Подготовка малых РНК-библиотек для секвенирования ранних эмбрионов мыши
В этой статье
Резюме
Мы описываем метод профилирования микроРНК в ранних эмбрионах мышей. Этот протокол преодолевает проблему низкого ввода клеток и небольшого обогащения РНК. Этот анализ может быть использован для анализа изменений экспрессии miRNA с течением времени в различных клеточных линиях раннего эмбриона мыши.
Аннотация
МикроРНК (миРНК) имеют важное значение для комплексного регулирования решений судьбы клеток и сроков развития. In vivo исследования вклада miRNAs во время раннего развития являются технически сложными из-за ограничения числа клеток. Кроме того, многие подходы требуют, чтобы в таких анализах, как северная blotting, microarray и qPCR, была определена мирная РНК, представляющих интерес. Таким образом, выражение многих miRNAs и их изоформы не были изучены в начале развития. Здесь мы демонстрируем протокол для небольшого РНК-секвенирования отсортированных клеток ранних эмбрионов мышей, чтобы обеспечить относительно объективное профилирование миРНК в ранних популяциях нервных клеток гребня. Мы преодолеваем трудности низкого ввода клеток и выбора размеров во время подготовки библиотеки с использованием усиления и очистки на основе геля. Мы определяем эмбриональный возраст как переменную, учитывая различия между репликациями и сценическими эмбрионами мыши, которые должны использоваться для точного профиля миРНК в биологических репликациях. Наши результаты показывают, что этот метод может быть широко применен для профиля выражения miRNAs из других линий клеток. Таким образом, этот протокол может быть использован для изучения того, как миРНК регулируют программы развития в различных клеточных линиях раннего эмбриона мыши.
Введение
Центральным вопросом биологии развития является то, как одна недифференцированная клетка может привести к развитию всего организма с многочисленными сложными типами клеток. Во время эмбриогенеза, потенциал развития клеток становится постепенно ограничен, как организм развивается. Одним из примеров является линия нервного гребня, которая постепенно отличается от многопотентной популяции клеток на различные производные терминала, такие как периферические нейроны, глиа, черепная кость и хрящ. Нейронные клетки гребня указаны от эктодерма во время гастрипуляции, а затем проходят эпителиальный мезенхимальный переход и мигрируют через эмбрион в дискретные места по всему телу, где они будут неизлечимодифференцировать 1. Десятилетия работы выявили транскрипционные гены нормативной сети, но гораздо меньше известно о механизмах пост-транскрипционные регулирования, которые контролируют сроки развития нервного гребня.
Предыдущая работа предполагает, что микроРНК (миРНК) подавляют экспрессию генов для правильного времени развитияи решения судьбы клеток 2,,3,,4,,5,,6. Исследования миРНК в развитии нервного гребня в значительной степени сосредоточены на более поздних стадиях черепно-мозгового развития. Например, miR-17-92 и miR-140 имеют решающее значение для небогенеза во время черепно-мозгового развития у мыши изебры, соответственно 7,8. Вклад миРНК в самые ранние решения судьбы нервного гребня эмбриона не был тщательно исследован. Исследования миРНК в ранних решениях судьбы были ограничены техническими проблемами, такими как низкое число клеток, присутствующих в ранних эмбрионах.
MiRNAs были профилированы в пробирке от клеточных линий с использованием эмбриональных тел на разных стадиях дифференциации для моделирования раннейразработки мыши 9. Исследование малых РНК in vivo во время раннего развития млекопитающих было относительно ограниченным. Предыдущие методы профиля miRNAs привели к предвзятости, как известная последовательность используется для анализа экспрессии конкретной миРНК в таких методах, как qPCR, microarrays, и северныепятна 10. Секвенирование следующего поколения и постоянно совершенствующиеся молекулярные инструменты теперь позволяют относительно объективному анализу экспрессии миРНК изучить их вклад в раннее развитие млекопитающих и решения судьбы клеток.
Здесь мы сообщаем о технике сбора и последовательности малых РНК, выраженных в нервных клетках гребня от ранних эмбрионов мыши, охватывающих гастрипуляцию (E7.5) до начала органогенеза (E9.5). Этот метод прост и сочетает в себе отслеживание линий, сортировку клеток и выбор размеров на основе геля для подготовки небольших библиотек секвенирования РНК из минимального количества ячеек для секвенирования следующего поколения. Мы подчеркиваем важность строгого сопоставления стадии сомитов эмбрионов для разрешения 6-часовых интервалов времени для получения всестороннего представления о миРНК во время быстрых изменений раннего развития. Этот метод может быть широко применен к генетическим исследованиям и исследованиям в области развития и позволяет избежать объединения эмбрионов. Мы описываем способ преодоления проблем, связанных с современными методами, такими как обогащение миРНК с помощью очистки на основе геля, библиотечной количественной оценки и минимизации предубеждений, связанных с ПЦР. Этот метод был использован для выявления моделей экспрессии miRNA с течением времени, чтобы изучить, как miRNAs контролировать время развития в нейронной линии гребня эмбрионов мыши.
протокол
Все исследования и процедуры по уходу за животными были одобрены Бейлор колледж медицины институционального ухода за животными и использования комитета и размещены в Ассоциации по оценке и аккредитации лабораторных животных уход утвержденных животных объекта в Бейлор медицинского колледжа. Все штаммы были сохранены на фоне C57BL6.
1. Рассечение эмбрионов (E7.5-E9.5)
- Удалить рога матки от беременной самки мыши, стерилизации живота с 70% этанола, где разрез должен быть сделан.
- Очистите матку путем полоскания фосфатом буферного солевого раствора (PBS). Поместите матку в стерильную пластиковую 10-сантиметровую тарелку.
- Используя ножницы микропересмешки, отделяйте каждый decidua, содержащий область друг от друга. Очистите маточные мышцы и разоблачить все deciduae. Один за другим, удалить decidua от каждого эмбриона.
- Удалите желточный мешок из каждого эмбриона и сохранить для генотипирования.
- Перемести все эмбрионы в новое блюдо из свежего PBS для визуализации.
- Смой весь помет. Изображение каждого эмбриона по отдельности и подсчитать количество somites каждого эмбриона. Держите увеличение и воздействие (для флуоресценции) то же самое между экспериментами.
ПРИМЕЧАНИЕ: Мы считаем, что 50-200 мс воздействия является адекватным для флуоресценции и что 20 мс является адекватным для яркой обстановке поля.
2. Диссоциация эмбрионов и сортировка клеток
- Для каждого эмбриона, чтобы быть отсортированы из, сделать следующее.
- Обезглавить чуть выше otic placode для эмбрионов старше E8.0 (если только помечены клетки черепной области желательно). Для эмбрионов E7.5 удалите экстраэмбриональные структуры (если только желаемый эмбрион).
- Переместите голову в минимальном объеме PBS к чистому колодец 48-хорошо пластины. Добавьте 250 МКЛ папаина (27 U/mL). Pipette вверх и вниз осторожно с помощью p200.
- Проверьте под микроскопом и искать сгустки и одиночные клетки.
- Повторите нежный пипетки вверх и вниз, пока одна подвеска ячейки достигается (как правило, три раунда трубопроводов вверх и вниз, которые должны приравниваться к между 30 с до 1 мин для E7.5-E9.5).
- Утолить 250 МКЛ сыворотки крупного рогатого скота плода (FBS).
- Повторите шаги 2.1.1-2.1.5 для сортировки каждого эмбриона.
- Фильтр 500 йл клеточной подвески через 35 мкм нейлоновой сетки фильтр крышка трубки для удаления сгустков.
- Возьмите фильтрат и перейдите на новую трубку 1,5 мл и спина на 200 х г в течение 5 мин. Удалите супернатант тщательно и перенесите в новую трубку (сохранить, пока живые клетки, как известно, в гранулы).
- Resuspend клеточных гранул в 300 йл PBS, содержащих 0,5-1% бычьей сыворотки альбумин и держать на льду до сортировки (свести к минимуму время до конца сортировки).
- При желании возьмите 10 МКЛ клеточной суспензии и в сочетании с 10 МКЛ трипан синий (0,4%) и рассчитывать с помощью гемоцитометра для определения приблизительной количественной оценки клеток и жизнеспособности, как Трипан синий только пятна мертвых клеток.
- Перед сортировкой, фильтровать каждый образец снова через трубку крышки фильтра и добавить DAPI пятно для живых клеток.
- Сортив каждый образец на 500 МКЛ раствора лиза извлечения РНК (см. таблицу материалов)на сортере клеток с соплом 70 мкм.
- Смешайте и храните при -80 градусов по Цельсию до тех пор, пока не будут собраны все образцы. Продолжить с этого момента только тогда, когда все образцы, необходимые для эксперимента собираются, чтобы уменьшить технические различия между раундами подготовки библиотеки.
3. Добыча РНК
ПРИМЕЧАНИЕ: Протокол адаптирован из комплекта изоляции РНК; см. Таблицу материалов.
- Добавьте 500 МКЛ раствора для извлечения РНК (см. таблицу материалов)к каждому образцу, чтобы сделать общий объем 1000 йЛ.
- Оттепель каждого образца при комнатной температуре.
- Vortex каждый образец в течение 1,5 мин, убедившись, что крышка надежно на каждой трубе перед началом гомогенизации. Инкубировать гомогенат при комнатной температуре (15-25 градусов по Цельсию) в течение 5 минут.
- Добавьте 140 МКЛ хлороформа, крышка трубки надежно и энергично встряхнуть в течение 15 с. Инкубировать при комнатной температуре в течение 3 мин.
- Центрифуга в течение 15 мин при 12 000 х г при 4 градусах Цельсия. Перенесите верхнюю aqueous фазу к новой трубке сбора на льду. Не переносить какую-либо межфазную или органическую фазу. При приближении к розовой органической фазе, наконечник трубки в сторону и удалить небольшие aliquots до тех пор, пока не ясно aqueous фазы могут быть собраны.
- Измерьте объем РНК, содержащий aqueous фазу, собранную из каждого образца для правильного расчета на следующем этапе.
- Добавьте 1,5 тома (обычно 525 л, но может быть немного больше или меньше) 100% этанола и тщательно перемешайте с помощью пипетки.
- Pipette до 700 йл образца, в том числе любой осадок, в колонке в 2 мл сбора трубки. Закройте крышку и центрифугу на ≥ 8000 х г на 15 с при комнатной температуре. Отбросьте поток через.
- Повторите шаг 3.8, используя оставшуюся часть образца.
- Вымойте колонку в соответствии с инструкциями производителя. Высушите столбец, вращаясь на полной скорости в течение 1 мин. Перенесите колонку на новую трубку для сбора 1,5 мл.
- Pipette 11 йл нуклеазы свободной воды на центр мембраны. Пусть сидят при комнатной температуре в течение 1 мин. Спин максимальная скорость в течение 1 мин, чтобы elute от столбца.
- Измерьте концентрацию РНК с помощью спектрофотометра и параллельного капиллярного электрофорезного инструмента(Таблица материалов).
4. Подготовка библиотеки
ПРИМЕЧАНИЕ: Протокол адаптирован из небольшого руководства по подготовке библиотечного комплекта РНК; см. Таблицу материалов.
- Завершите денатурацию и 3' перевязку адаптера, как указано в руководстве по подготовке небольшой рнк-библиотеки, используя 1/4 разбавления 3' адаптера.
- Продолжайте избыточное удаление адаптера 3' .
- Завершите истощение адаптера, как указано в небольшом справочнике по подготовке библиотеки РНК. Не забудьте использовать свежеприготовленный 80% этанола для очистки бисера и что все излишки этанола полностью удаляется непосредственно перед повторной ссадины в нуклеазной воде без чрезмерной сушки бисера (трещины гранулы бисера наблюдается при чрезмерной сушки).
- Перейти непосредственно к избыточной инактивации адаптера.
- Завершите инактивацию избыточного адаптера, как указано в руководстве по подготовке небольшой библиотеки РНК, собирающего все реагенты на льду.
- Продолжить 5' 4N адаптер перевязки.
- Полный 5' адаптер перевязки, как указано в небольшой РНК библиотека подготовки комплект справочника, несомненно, использовать 1 / 4 разбавления 5 ' адаптер и сборки всех реагентов на льду.
- Приступайте к обратной транскрипции.
- Полное обратное транскрипции первой нити синтеза, как указано в небольшой РНК библиотека подготовки комплект руководства и заботиться, чтобы собрать все реагенты на льду и не держать фермент из морозильника в течение длительных периодов времени.
ПРИМЕЧАНИЕ: На этом этапе протокол может быть остановлен, а образцы хранятся в течение ночи при 4 градусах Цельсия. Кроме того, продолжайте усиление ПЦР. - Полное усиление ПЦР путем сборки реагентов, как указано в руководстве по подготовке небольшой библиотеки РНК, и минимизации количества циклов ПЦР. Количество циклов ПЦР должно быть экспериментально определено для каждого приложения, и необходимо использовать минимальное количество циклов. Здесь мы использовали 16 циклов для успешного усиления наших небольших РНК-библиотек.
- Перейти непосредственно к выбору размера.
5. Выбор размера
- К каждому образцу добавьте 5 йл 6x красителя загрузки геля и пипетки для смешивания.
- Загрузите 10 йл лестницы к первому колодецу геля, оставив колодец сразу вправо пустым. Загрузите весь продукт от шага 5.1 на 6% Tris/borate/ethylenediaminetetraacetic кислота - полиакриламинидный гель (TBE-PAGE) и оставьте 1 полосу между каждым образцом.
ПРИМЕЧАНИЕ: Держите контейнер, что гель пришел в последующие шаги. - Вы запустите гель на 150 V примерно 30-40 мин в 0,5x TBE работает буфер (до нижней полосы красителя находится в нижней части геля, 0,5-1 см).
- Сделать 1 л окрашивания раствора в то время как гель работает: SYBR Золото разбавленной 1:10,000 в 0,5x TBE.
- Когда гель закончил работать (т.е. нижняя полоса красителя находится в нижней части геля), аккуратно снимите гель со стеклянных пластин, увечение геля.
- Поместите гель в лоток своей оригинальной упаковки. Удалите 0.5x TBE и замените раствором окрашивания с шага 5.5. Пятно гель в течение 15 мин. Время окрашивания, возможно, потребуется увеличить.
- Поместите гель на УФ-трансиллюминатор, заботясь о том, чтобы не рвать гель и поддерживая ориентацию, отмеченную выше (повторно пятно на дополнительное время, если полосы лестницы не могут быть четко видны).
- Изображение гель после окрашивания завершена на УФ-трансиллюминатор с камерой.
- Если требуется лучшее изображение, сначала используйте аппарат визуализации, кроме УФ-трансиллюминатора, чтобы захватить изображение геля, прежде чем вырезать полосы на ультрафиолетовом трансилюминаторе, так как изображение непосредственно на уф-трансилюминаторе вызывает переменную окраску фона, как показано на рисунке 3A-B. Не двигайтесь гель слишком много раз, как это деликатный и может разорвать.
- Определите и удалите полосу 150 bp с помощью чистого лезвия бритвы и поместите в чистую трубку 1,5 мл. Не вырежьте полосу 130 б/с (адаптерный димер).
- Изображение геля снова после удаления ломтиков, содержащих библиотечный продукт для целей документации.
- Спин микроцентрифуг трубки, содержащие гель ломтик на максимальной скорости в течение 30 с, чтобы собрать ломтики в нижней части каждой трубки.
- Используйте наконечник p200 для каждого образца, чтобы раздавить ломтик геля в самые маленькие биты возможно. Выброс каждого наконечника в каждую трубку.
- К каждой трубке добавьте 300 йл буфера элюции, заботясь о том, чтобы вымыть кусочки геля со стороны трубки и прикрепить кончик p200 и смыть кончик для каждого образца.
- Поместите eluting образцы в трясущимся инкубаторе установлен на 25 градусов по Цельсию. Инкубировать на ночь с 1000 об / мин встряхивания. Удалить трубки из инкубатора и спина на максимальной скорости в течение 10 минут при комнатной температуре.
- Перенесите супернатант, содержащий библиотечный продукт, на 2 мл RNase бесплатно 96 хорошо пластины. Позаботьтесь, чтобы не передавать гель.
- Добавьте 50 шариков очистки йЛ к каждому образцу и перемешайте с помощью пипетки. Немедленно добавьте 350 МКЛ изопропанола и перемешайте с помощью пипетки. Инкубировать при комнатной температуре в течение 10 минут с качания.
- Импульс спина пластины гранулы бисером, а затем намагничить в течение 2 минут. Аккуратно удалите и отбросьте супернатант.
- Добавьте 950 л 80% этанола. Инкубационный на 30 с. Удалите все супернатанты. Повторите в общей сложности два этанола моет.
- Высушите образец на 3 мин. На этом этапе позаботьтесь о том, чтобы удалить любой остаточный этанол, который собирается на дне каждой хорошо (не более одного раза) и не пересушить бисер (чрезмерное высыхание приведет к растрескиванию гранулы бисера).
- Удалите всю остаточную жидкость на дне колодец. Снимите пластину с магнитного стенда.
- Переусердуйте гранулы в 13 МКЛ буфера повторного незаменимия. Смешайте пипеткой до однородной массы. Инкубировать в течение 2 мин, а затем намагничить в течение 3 мин.
- Передача 12 МКЛ супернатанта в чистую трубку или колодец чистой пластины для последующего хранения. Храните все образцы при 4 градусах по Цельсию в течение ночи или -20 градусов по Цельсию в долгосрочной перспективе.
- Проверьте размер и концентрацию фрагментов, присутствующих в каждой библиотеке с помощью капиллярного электрофореза высокой чувствительности анализа ДНК. Подтвердите концентрацию более чем одним методом.
ПРИМЕЧАНИЕ: Мы время от времени использовали стандартный набор чувствительности, чтобы избежать перегрузки капиллярного электрофореза.
Результаты
Используя продемонстрировав здесь процедуру, мы собрали эмбрионы на E7.5, E8.5 и E9.5. Внеэмбрионические структуры были удалены из всех эмбрионов, а затем эмбрионы были somite поставил решить 6-часовойинтервал времени (рисунок 1A-1B). Используя принципиальный анализ компонентов для группирования образцов на основе сходства, мы находим, что образцы кластера по возрасту, подчеркивая изменения в результате эмбрионального возраста и необходимость тщательного сопоставления сомита для биологических репликаций (Рисунок 1C). Мы профилированного плюрипотентного эпибласта на E7.5, линии прослеживается премьермигратурных и мигрирующих нейронных клеток гребня с помощью Wnt1-Cre на E8.5 и мигрирующих нейронных клеток гребня с использованием Sox10-Cre на E9.5 (Рисунок 1D). Здесь мы специально собираем черепный нервный гребень, обезглавливая эмбрион чуть выше otic placode. Сравнение двух Cre-драйверов (Wnt1 и Sox10), которые часто используются для обозначения нейронных клеток гребня подтверждает, что они отмечают различные популяции в ранних эмбрионах мыши(рисунок 1E). Стратегии Гэтинга использовались для получения живых одиночных положительных клеток RFP, которые сортируются непосредственно в растворе лиза извлечения РНК (см. таблицу материалов)и хранятся при -80 градусах по Цельсию(рисунок 1F). Важно отслеживать, сколько клеток было собрано из каждого образца.
Изоляция РНК была выполнена с использованием модифицированной версии протокола комплекта РНК. В частности, мы используем мини-столбцы РНК, которые должны храниться при 4 градусах Цельсия. Эти столбцы полезны для eluting в небольшом томе (11 йл) для получения максимально возможной концентрации РНК из образцов, где ввод клеток ограничивает. По этой же причине, важно, чтобы получить все aqueous фазы после извлечения фенола хлороформа. Медленный трубопровод и наклон трубки в одну сторону при сборе имеют решающее значение для максимизации урожайности. В этой процедуре, мы количественно РНК с помощью как спектрофотометр, чтобы получить информацию о соли / белкового загрязнения, и капиллярный электрофорез для измерения концентрации(рисунок 2). След спектрофотометра показывает, что РНК была изолирована без загрязняющих белков, но имеет высокое содержание соли(рисунок 2A-2B). В идеале соотношение 260/280 должно быть 1,8 евро, а соотношение 260/230 должно быть 2,0 евро. Общий выход РНК, измеряемый спектрофотометром, не увеличивается с возрастом между E8.5-E9.5. Это связано с разрешением спектрофотометра недостаточно чувствительны для обнаружения изменений концентрации РНК от количества клеток, которые мы собираем, и мы рекомендуем использовать информацию о концентрации, полученную из капиллярного электрофореза(рисунок 2C). След капиллярного электрофореза может быть использован для оценки концентрации и размера фрагментов РНК. Пики нуклеотидов lt;1000 свидетельствуют о деградации. Репрезентативный след согласуется с РНК, которая не деградирует. Пики в 2000 нуклеотидов и 5100 нуклеотидов 18s и 28s rRNA, соответственно. Небольшая область РНК расположена на уровне 150 нуклеотидов(рисунок 2D).
Небольшие библиотеки секвенирования РНК были подготовлены с использованием небольшой аптечки библиотеки РНК, описанной в таблице материалов. Здесь мы используем чуть менее половины РНК, полученной из каждой выборки (4 МКЛ из 11 ЭЛ элюция, 80-120 нг), что позволяет РНК-секвенирования библиотек, которые будут синтезированы из оставшейся РНК из каждого образца. Здесь мы разбавляем 3' и 5' небольшие РНК адаптеры 1/4, чтобы снизить количество адаптера димеры настоящее время и предположить, что адаптер перевязки, очистки и обратной транскрипции шаги завершены как можно больше в непрерывном порядке. Мы использовали 16 циклов ПЦР для усиления библиотек и предлагаем эмпирически определить минимальное количество циклов ПЦР для любого эксперимента. Заполнив избыточные циклы ПЦР, можно искусственно надуть количество читаемых низко выраженную миРНК.
Выбор размеров необходим для обогащения библиотек miRNAs, а не адаптер димеров, которые, как правило, присутствуют. Размер библиотечного продукта (150 б.п.) и адаптерных димеров (130 б.п.) очень похожи по размеру. Извлечение геля используется для изоляции небольших библиотек секвенирования РНК от адаптерных димеров(рисунок 3). Изображение геля PAGE перед иссечением показывает, что в каждом образце присутствует множество размеров продукта(рисунок 3A). Важно оставить одну полосу открытой между любыми двумя образцами или лестницей, которая загружается на гель. Миграционный фронт в нижней части геля слегка изогнут, что указывает на то, что бег на более низкой скорости может быть необходим, если полосу 150 bp трудно различить для всех образцов. Это репрезентативное изображение также показывает обилие 150 bp продукт от более высокой концентрации положительного контроля РНК (общая РНК из мозга крысы), которые пошли в библиотеку подготовки по сравнению с тем, который вошел в каждый эмбриональный образец. Отрицательный контроль показывает, что реагенты были свободны от загрязнения нуклеиновой кислоты видов(рисунок 3A). Иссечение полосы 150 bp должно быть сделано с чистым лезвием бритвы и область собрана показана на рисунке 3B. Капиллярные следы электрофореза до и после выбора размера показывают резкое улучшение чистоты библиотечного продукта 150 bp с очисткойгеля (рисунок 3C-3D). Важно отметить, что следы на рисунке 3C-3D имеют пики выборки выше маркеров, что свидетельствует о перегрузке. В этих случаях размер фрагментов может быть точным, однако концентрация не может. Количественная оценка может быть получена путем разбавления библиотек в диапазон маркеров или с использованием альтернативных методов. Мы находим некоторые различия в альтернативных методах количественной оценки библиотек и рекомендуем эмпирически протестировать несколько методов количественной оценки. Точная количественная оценка концентрации имеет важное значение при максимальном количестве образцов, которые должны быть секвенированы за один раз. Библиотеки будут разбавлены до 1,3 рМ для секвенирования и, как правило, в любом месте от 15-25 образцов могут быть секвенированы в одно время на 150 цикл последовательности комплект, который обеспечивает 140 миллионов фунтов стерлингов читает. Это приводит к примерно 5 миллионам считых данных на выборку. Как правило, картографические ставки находятся между 60-80%.
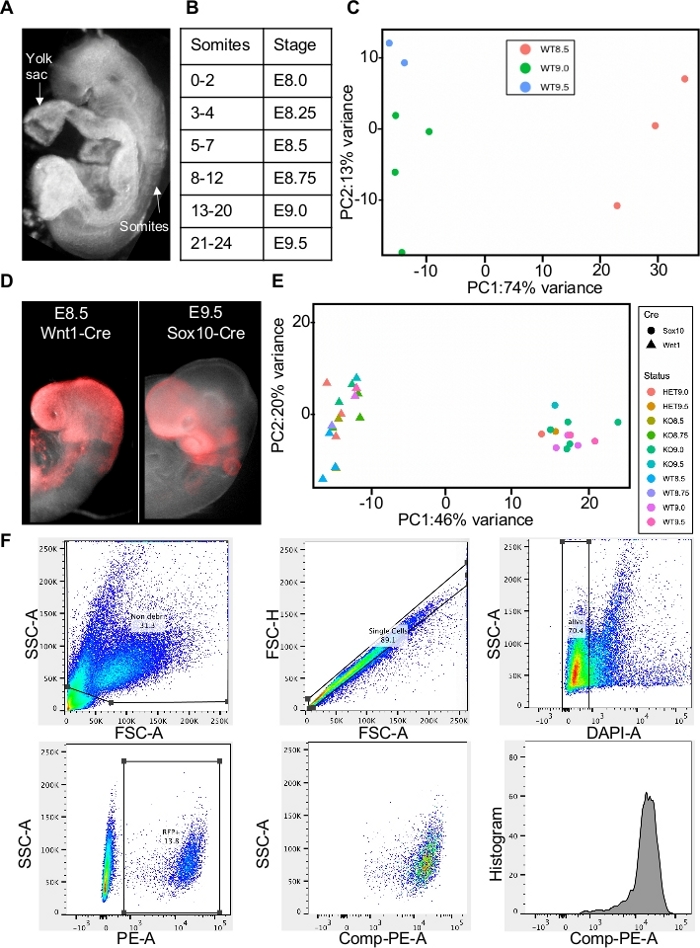
Рисунок 1: Сбор клеток из эмбрионов мыши для небольшого секвенирования РНК. (A) E8.5 эмбрион мыши, чтобы подчеркнуть удаление желточного мешка и сомитов, используемых для определения стадии эмбриона (B) Somite постановка эмбрионов мыши, чтобы захватить этапы развития нервного гребня (C) Принцип анализа компонентов библиотек, готовых от отсортированы клетки нервного гребня wildtype показывая, что образцы группы по возрасту ( D )Схемапоказывает, как образцы были собраны с помощью Wnt1-Cre на E8.5. для обозначения премьеры и мигрирующих нейронных клеток гребня и Sox10-Cre на E9.5 для обозначения только мигрирующих нейронных клеток гребня(E) Принцип анализа компонентов библиотек, готовых из отсортированных клеток нервного гребня дикого типа, показывающих образцы группы вместе Cre-driver независимо от возраста (F )Gatingстратегия, используемая для изоляции RFP' нейронных клеток гребня от E8.5 и E9.5 эмбрионов с использованием FACS сортировки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
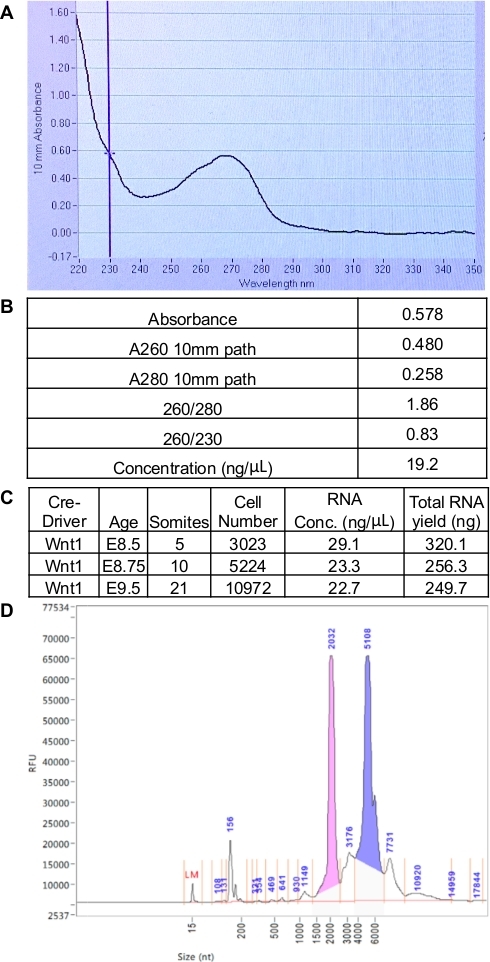
Рисунок 2: ИЗОЛЯЦИя РНК от эмбрионов мыши E7.5-E9.5. (A)Представитель спектрофотометр след изоляции РНК от самой молодой стадии эмбриона, что мы применили этот протокол. (B)Таблица, показывающая репрезентативные значения качества РНК, полученные из спектрофотометра. (C)Пример РНК, собранной из отсортированных нервных клеток гребня изэмбрионов каждого возраста (D) Капиллярный электрофорез след, показывающий хорошее качество РНК. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
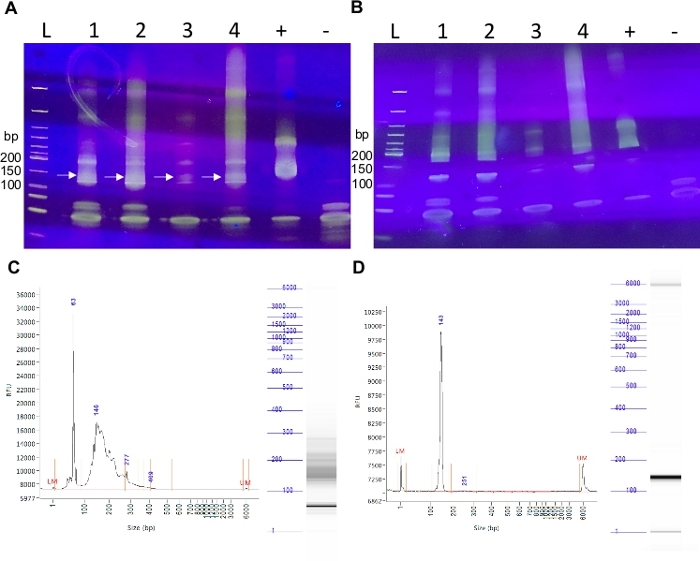
Рисунок 3: библиотеки miRNA до и после выбора размера. (A) TBE-PAGE гель, показывающий репрезентативные небольшие рнк библиотеки для четырех образцов и элементов управления до и (B) после 150 bp полосы иссечения. Стрелки представляют 150 bp полоса, которая будет вырезана ( C )Capillaryэлектрофорез след небольшой библиотеки РНК до и (D) после выбора размера. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Процессы развития могут происходить быстро, и клетки проходят много последовательных спецификаций, таких как, чтобы захватить всеобъемлющее представление о miRNAs способствует ранней судьбы решений, более конкретные постановки необходимо, чем широко используется полдня приращения. Недавнее исследование провело РНК секвенирования из Theiler этапе 12 эмбрионов, которые варьируются от 3 до 6 somites11. Мы находим, что в течение этого периода времени, нервные клетки гребня указаны (3 сомитов возраста), delaminate (4 сомитов возраста), и мигрировать (5-6 somites возраста). Мы также находим, что помимо Cre-драйвера, используемого для отслеживания популяций клеток, возраст является крупнейшим источником вариаций между биологическими образцами, и только сомитные эмбрионы должны рассматриваться как репликации. Это также следует принимать во внимание при сравнении трансгенных эмбрионов с контролем дикоготипа.
Предыдущие методы профиля miRNAs во время раннего развития использовали между 10-100 нг РНК ввода для небольшой РНК секвенирования библиотеки подготовки и объединили несколько эмбрионов водин образец 13,14. Мы демонстрируем изоляцию РНК и подготовку библиотеки от одного эмбриона E7.5 или от отсортированных нейронных клеток гребня на E8.5 и E9.5, используя приблизительно 100 нг общей РНК в качестве входного сигнала. При диссоциации эмбрионов для сортировки, следует позаботиться, чтобы наблюдать за диссоциацией под микроскопом и утолить реакцию наблюдать, когда одиночные клетки получены. Мы находим, что диссоциация черепной области эмбрионов E8.5-E9.5 почти мгновенно с нежным ручным пипетки, как описано в протоколе. Для больших тканей и все более старых эмбрионов время диссоциации может быть больше в зависимости от части диссоциации эмбриона. Для эмбрионов E7.5-E9.5 скопления клеток легко видны под микроскопом, и диссоциация должна продолжаться до тех пор, пока не будут видны больше сгустки. Одиночные ячейки видны в растворе, если вы отрегулируете фокус через раствор в вашем амо где угодно от 5-10x. Предыдущие методы сортировки ячеек непосредственно в буфер лиза для секвенирования РНК для подготовки объемных РНК из небольшого числа ячеек14. Здесь мы сортим непосредственно в растворе лиза извлечения РНК, так что РНК может быть изолирована до начала подготовки библиотеки. Использование мини-столбцов с объемом элюции 11 МКЛ позволило проработать достаточно высокую концентрацию РНК, так что одна РНК-подготовка могла быть разделена между небольшой РНК и секвенированием рнк навалом.
Одним из нынешних ограничений большинства малых методов секвенирования РНК является усиление ПЦР преобразованного кДНК. Наш метод не преодолевает это ограничение, но мы смогли свести к минимуму количество циклов ПЦР с 25-максимально рекомендованных до 16 циклов. Это сокращение усиления уменьшает искусственное усиление смещения, введенной ПЦР. Другим источником смещения является перевязка адаптеров, где известно, что конкретные последовательности, расположенные на концах адаптеров и miRNAs может ligate вместе с большей эффективностью, чем другие последовательности. Чтобы избежать этого, адаптеры, используемые в этом протоколе, имеют 4 случайные базы, включенные в конце каждого адаптера, чтобы предотвратить предвзятость в реакциях перевязки. Кроме того, другой распространенной проблемой является количество адаптерных димеров, которые образуются при низком входе РНК. Комплект подготовки библиотеки включает в себя шаги по сокращению образования адаптера димера, такие как инактивация адаптера и очистка бисера для удаления избыточных адаптеров после каждой перевязки. Мы также разбавили 3' и 5' 4N адаптеры на 1/4, чтобы уменьшить количество адаптера димер, который может образовываться. Мы обнаружили, что, когда не разбавленный, 130 bp интенсивность полосы увеличивается, что затрудняет отличить от 150 bp полоса, содержащая желаемые небольшие библиотеки РНК на гель.
Еще одной текущей проблемой подготовки библиотек секвенирования является точная количественная оценка продукта до секвенирования. Мы обнаружили, что различные методы дают различные результаты в одной библиотеке. Мы предлагаем исследователям использовать несколько методов количественной оценки, чтобы получить точную оценку концентрации.
Этот протокол может быть широко применен к генетическим исследованиям, исследованиям в области развития или другим приложениям, где РНК собирается из небольшого количества клеток. Этот подход упрощает височные исследования, избегая объединения эмбрионов и может быть легко применен как к не сортированы и отсортированы клетки.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Этот проект был поддержан Фондом Эндрю МакДоноу БЗ и NIH (R01-HD099252, R01-HD098131. R.J.P. является стипендиатом CPRIT в области исследований рака (RR150106) и V Scholar in Cancer Research (V Foundation). Авторы также хотели бы отметить цитометрию и ядро сортировки клеток в BCM за предоставление оборудования, необходимого для этого проекта.
Материалы
| Name | Company | Catalog Number | Comments |
| #5 Forceps Fine Science Tools | Fisher Scientific | NC9277114 | |
| 0.4% Trypan blue | ThermoFisher | 15250061 | |
| 10 cm Petri dishes | Fisher Scientific | 07-202-011 | |
| 2-Propanol | Miilapore Sigma | I9516-500ML | |
| 5 % Criterion TBE Polyacrylamide Gel, 12+2 well, 45 µL | Bio-Rad | 3450047 | |
| 5200 Fragment Analyzer | Agilent | M5310AA | |
| 96 well PCR plates high profile semi skirted clear/clear | Bio-Rad | HSS9601 | |
| BD FACSAria II | bdbiosciences | ||
| Bovine Serum Albumin, fraction V | Fisher Scientific | BP1600100 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Gendepot | CA008-300 | |
| Eppendorf tubes | Fisher Scientific | 05-408-129 | |
| Ethanol Pure, 200 proof anhydrous | Sigma Aldrich | E7023-500ml | |
| FC-404-2001 | Illumina | FC-404-2001 | |
| HS NGS Fragment kit | Agilent | DNF-474-0500 | |
| HS RNA Kit | Agilent | DNF-472-0500 | |
| miRNeasy Mini Kit (50) | Qiagen | 217004 | |
| NEXTflex Small RNA-Seq Kit v3 (48 barcodes) | Fisher Scientific | NC1289113 | |
| NextSeq 500/550 Mid Output Kit v2 (150 cycles) | Illumina | FC-404-2001 | |
| NGS Fragment kit | Agilent | DNF-473-1000 | |
| Papain | Worthington | LK003176 | resuspend in 5 mL of Ca/Mg free PBS for a final concentration of 27 U/mL |
| SYBR Gold nucleic acid gel stain | ThermoFisher | S11494 | |
| Trizol LS | ThermoFisher | 10296028 | |
| UVP Benchtop UV Transilluminators: Single UV | Fisher Scientific | UVP95044701 | |
| Vannas Scissors Straight Fine Science Tools #91500-09 | Fisher Scientific | NC9609583 |
Ссылки
- Sauka-Spengler, T., Bronner-Fraser, M. A gene regulatory network orchestrates neural crest formation. Nature Reviews Molecular Cell Biology. 9, 557-568 (2008).
- Abrahante, J. E., et al. The Caenorhabditis elegans hunchback-like gene lin-57/hbl-1 controls developmental time and is regulated by microRNAs. Developmental Cell. 4 (5), 625-637 (2003).
- Lin, S. Y., et al. The C elegans hunchback homolog, hbl-1, controls temporal patterning and is a probable microRNA target. Developmental Cell. 4 (5), 639-650 (2003).
- Reinhart, B. J., et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature. 403 (6772), 901 (2000).
- Slack, F. J., et al. The lin-41 RBCC gene acts in the C. elegans heterochronic pathway between the let-7 regulatory RNA and the LIN-29 transcription factor. Molecular Cell. 5 (4), 659-669 (2000).
- Vella, M. C., Choi, E. Y., Lin, S. Y., Reinert, K., Slack, F. J. The C. elegans microRNA let-7 binds to imperfect let-7 complementary sites from the lin-41 3'UTR. Genes & Development. 18 (2), 132-137 (2004).
- Ventura, A., et al. Targeted deletion reveals essential and overlapping functions of the miR-17 92 family of miRNA clusters. Cell. 132 (5), 875-886 (2008).
- Eberhart, J. K., et al. MicroRNA Mirn140 modulates Pdgf signaling during palatogenesis. Nature Genetics. 40 (3), 290 (2008).
- Li, Y., et al. Dynamic regulation of small RNAome during the early stage of cardiac differentiation from pluripotent embryonic stem cells. Genomics Data. 12, 136-145 (2017).
- Chugh, P., Dittmer, D. P. Potential pitfalls in microRNA profiling. Wiley Interdisciplinary Reviews: RNA. 3 (5), 601-616 (2012).
- Werber, M., Wittler, L., Timmermann, B., Grote, P., Herrmann, B. G. The tissue-specific transcriptomic landscape of the mid-gestational mouse embryo. Development. 141 (11), 2325-2330 (2014).
- Yang, Q., et al. Highly sensitive sequencing reveals dynamic modifications and activities of small RNAs in mouse oocytes and early embryos. Science Advances. 2, (2016).
- Ohnishi, Y., et al. Small RNA class transition from siRNA/piRNA to miRNA during pre-implantation mouse development. Nucleic Acids Research. 38 (15), 5141-5151 (2010).
- Loontiens, S., et al. Purification of high-quality RNA from a small number of fluorescence activated cell sorted zebrafish cells for RNA sequencing purposes. BMC Genomics. 20 (1), 228 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены