Modelagem de elementos finitos de um microambiente elétrico celular
Neste Artigo
Resumo
Este artigo apresenta uma estratégia para a construção de modelos de elementos finitos de materiais condutores fibrosos expostos a um campo elétrico (EF). Os modelos podem ser usados para estimar a entrada elétrica que as células semeadas nesses materiais recebem e avaliar o impacto da alteração das propriedades, estrutura ou orientação do material constituinte do andaime.
Resumo
Estudos clínicos mostram que a estimulação elétrica (ES) é uma terapia potencial para a cicatrização e regeneração de vários tecidos. Compreender os mecanismos de resposta celular quando expostos a campos elétricos pode, portanto, orientar a otimização das aplicações clínicas. Experimentos in vitro visam ajudar a descobri-los, oferecendo a vantagem de faixas de entrada e saída mais amplas que podem ser avaliadas de forma ética e eficaz. No entanto, os avanços em experimentos in vitro são difíceis de reproduzir diretamente em ambientes clínicos. Principalmente, isso porque os dispositivos ES utilizados in vitro diferem significativamente dos adequados para o uso do paciente, e o caminho dos eletrodos para as células-alvo é diferente. Traduzir os resultados in vitro em procedimentos in vivo, portanto, não é simples. Enfatizamos que a estrutura e as propriedades físicas do microambiente celular desempenham um papel determinante nas condições reais de teste experimental e sugerem que medidas de distribuição de carga podem ser usadas para preencher a lacuna entre in vitro e in vivo. Considerando isso, mostramos como a modelagem de elementos finitos silico (FEM) pode ser usada para descrever o microambiente celular e as mudanças geradas pela exposição do campo elétrico (EF). Destacamos como os casais EF com estrutura geométrica para determinar a distribuição de carga. Em seguida, mostramos o impacto das entradas dependentes do tempo no movimento da carga. Por fim, demonstramos a relevância da nossa nova metodologia do modelo silico utilizando dois estudos de caso: (i) in vitro fibroso Poly (3,4-etilenodioxithiophene) poli (estireno) (PEDOT-PSS) e (ii) em colágeno vivo em matriz extracelular (ECM).
Introdução
ES é o uso de EFs com o objetivo de controlar células e tecidos biológicos. Seu mecanismo é baseado no estímulo físico transduzido para a célula quando as biomoléculas dentro e ao seu redor são expostas a um gradiente de tensão gerado externamente. As partículas carregadas estão envolvidas em um movimento organizado regido pela lei de Coulomb, gerando forças de arrasto sobre as partículas não carregadas. O fluxo de fluidos resultante e a distribuição de carga alteram as atividades e funções celulares como adesão, contração, migração, orientação, diferenciação e proliferação1 à medida que a célula tenta se adaptar à mudança nas condições microambientais.
Como os EFs são controláveis, não invasivos, não farmacológicos e mostram ter um impacto efetivo no comportamento celular essencial, a ES é uma ferramenta valiosa para a engenharia de tecidos e medicina regenerativa. Foi usado com sucesso para orientar o desenvolvimento neural2, esquelético3, músculo cardíaco4, osso5 e desenvolvimento da pele6. Além disso, à medida que melhora a iontopforese7,é usado como um tratamento alternativo ou complementar aos farmacológicos convencionais. Sua eficiência no manejo da dor ainda é debatida, pois são aguardados ensaios clínicos de maior qualidade8,9,10. No entanto, não foram relatados efeitos adversos e tem potencial para melhorar o bem-estar do paciente11,12,13,14,15.
Embora apenas ensaios clínicos possam dar um veredicto definitivo para a eficácia de um procedimento, modelos in vitro e em silico são necessários para informar o design de um tratamento ES previsível, pois eles oferecem um controle mais forte sobre uma gama mais ampla de condições experimentais. Os usos clínicos investigados da ES são regeneração óssea16,17, recuperação de músculos denervados18,19, regeneração axonal após cirurgia20,21, alívio da dor22, cicatrização da ferida23,24,25 e entrega de medicamentos iontoforéticos26. Para que os dispositivos ES sejam amplamente introduzidos em todas as aplicações-alvo possíveis, os ensaios clínicos ainda não estabeleceram evidências mais fortes para um tratamento eficiente. Mesmo em domínios onde tanto os estudos in vivo animal quanto humano relatam consistentemente resultados positivos, o grande número de métodos relatados, juntamente com pouca orientação sobre como escolher entre eles e o alto preço de aquisição impede os médicos de investir em dispositivos ES27. Para superar isso, o tecido alvo não pode mais ser tratado como uma caixa preta (limite de experimentos in vivo), mas deve ser visto como uma sinergia complexa de múltiplos subsistemas(Figura 1).
Múltiplos experimentos ES foram realizados in vitro ao longo dos anos28,29,30,31,32,33,34. A maioria delas só caracteriza o ES através da queda de tensão entre os eletrodos divididos pela distância entre eles - uma aproximação aproximada da magnitude do campo elétrico. No entanto, o campo elétrico em si só influencia partículas carregadas, não células diretamente. Além disso, quando vários materiais são interpostos entre o dispositivo e as células, a aproximação áspera pode não aguentar.
Uma melhor caracterização do sinal de entrada requer uma visão clara de como o estímulo é transduzido para a célula. Os principais métodos de entrega do ES são o acoplamento direto, capacitivo e indutivo35,36. Os dispositivos para cada método diferem com o tipo de eletrodo (haste, planar ou enrolamento) e colocação em relação ao tecido alvo (em contato ou isolado)35. Dispositivos usados in vivo para tratamentos mais longos precisam ser vestíveis, assim os eletrodos e, na maioria das vezes, a fonte de energia são implantados ou anexados à pele como curativos ou manchas eletroativas. O gradiente de tensão gerado desloca partículas carregadas na área de tratamento.
Como impacta o fluxo de partículas carregadas resultante nas proximidades das células, a estrutura do andaime é de extrema importância no desenho dos protocolos ES. Diferentes configurações de transporte de carga surgem se o material da plataforma, técnica de síntese, estrutura ou orientação em relação à mudança de gradiente de tensão. In vivo, a disponibilidade e o movimento de partículas carregadas são impactados não apenas pelas células, mas também pela rede de colágeno e fluido intersticial que compõem o ECM de suporte. Andaimes projetados são cada vez mais usados para recriar melhor microambientes de células naturais in vitro1,35. Simultaneamente, o ECM é um andaime natural complexo.
Andaimes artificiais são baseados em metais, condução de polímeros e carbono, projetados com foco no equilíbrio da biocompatibilidade com desempenho eletroquímico e estabilidade a longo prazo36. Um tipo versátil de andaime é o tapete fibroso eletrospun que oferece uma topografia nanoescala controlável. Isso pode ser projetado para se assemelhar ao ECM, assim fornecer pistas mecânicas semelhantes que auxiliam na regeneração de uma ampla gama de tecidos37. Para impactar significativamente o ES, os tapetes precisam ser condutores até certo ponto. No entanto, os polímeros condutores são difíceis de eletropinar e a mistura com portadores isolantes limita a condutividade das fibrasresultantes 38. Uma solução é polimerizar um monômero condutor na superfície de uma fibra dielétrica, resultando em boa resistência mecânica e propriedades elétricas do produto final38. Um exemplo é o revestimento de fibras eletrospun de seda com o semi condutor PEDOT-PSS39. A combinação de sinais mecânicos e eletromagnéticos acelera significativamente o crescimento de neurite40,41,42. Os neurites seguem o alinhamento das fibras dos andaimes e alongam mais após a exposição a um EF paralelo às fibras do que a uma vertical43. Da mesma forma, o alinhamento dos andaimes fibrosos ao EF também promove a maturação miogênica33.
O ECM é composto principalmente de proteínas fibrosas44, daqueles colágenos tipo I sendo o principal constituinte em todos os tecidos animais, exceto a cartilagem (rica em colágeno tipo II)44. Tropocollagen (TC), conformação helicoidal tripla de fios de polipeptídeo, é o motivo estrutural das fibrilas de colágeno45. A microscopia eletrônica de transmissão e as imagens de microscopia de força atômica de fibrilas de colágeno mostram um padrão de banda46 periódico D explicado pelo modelo Hodge & Petruska47 como matrizes regulares de lacunas TC e sobreposições45. Os tendões são compostos de uma matriz fibrilar colagenosa alinhada blindada por uma matriz proteoglica não-colóide altamente hidrofílica48,49. Decorin é um pequeno proteoglycano rico em leucina (SLRP) capaz de ligar as regiões de lacuna de fibrilas de colágeno e conectar-se com outros SLRPs através de suas cadeias laterais glicosaminoglicanas (GAG)49. Estudos feitos sobre tendões mostram que suas propriedades elétricas mudam significativamente quando hidratadas50,51, mecanismo de transporte de carga mudando de protônico para iônico à medida que o nível de hidratação aumenta51. Isso sugere que a condução elétrica ao longo de uma fibrila tipo colágeno I poderia ser habilitada por um casaco de água decorina, com regiões de lacuna e sobreposição com diferentes condutividades elétricas e constantes dielétricas.
Como a recriação idêntica do ECM por andaimes artificiais é improvável, o conhecimento que produz sinergia entre in vivo e in vitro habilitado por resultados traduzíveis parece estar em um beco sem saída. Na modelagem do silico não só reestilização da tradução entre os dois, mas também agrega benefícios importantes na caracterização dos processos desconhecidos envolvidos no ES. Comparar as observações in vivo com o in vitro pode trazer informações sobre a força de acoplamento entre o tecido alvo e o resto do organismo, mas não revela os limites atuais de conhecimento. O desconhecido pode ser exposto observando a diferença entre o que se espera que aconteça com base no conhecimento atual e no que acontece. Em experimentos de silico baseados em modelagem matemática permitem dividir o processo em subprocessos conhecidos e desconhecidos. Dessa forma, fenômenos não contabilizados no modelo vêm à tona quando nas previsões de silico são comparados a experimentos in vitro e in vivo.
Formar e testar hipóteses quanto aos mecanismos subjacentes de como as células e tecidos são afetados pelos campos elétricos é dificultado pelo grande número de parâmetros52 que precisam ser testados separadamente. Para definir condições experimentais representativas, o processo ES deve ser dividido em subprocessos (Figura 1) e devem ser identificados sinais de entrada dominantes que afetam o comportamento celular. Modelos que representam efeitos físicos fundamentais do ES nas células descrevem o domínio que acotoda o EF com a célula - o das partículas carregadas53. O comportamento das partículas exteriores à célula depende do microambiente e pode ser investigado separadamente da célula. O sinal de entrada dominante para a célula é o subconjunto de saídas de dispositivos ES que causa o maior grau de variabilidade na resposta celular. O menor subconjunto dos parâmetros experimentais completos que podem gerar variações em todos os sinais de entrada celular dominantes pode ser usado para diminuir a dimensão do espaço do parâmetro e o número de casos de teste.
A entrada do modelo de destino ES biológico deve ser um subconjunto dos sinais de saída produzidos pelo dispositivo ES que são úteis na descrição dos efeitos físicos do ES nas células. Um simples bioreator com acoplamento direto tem a mesma estrutura que células eletroquímicas eletrolíticas. Os modelos deles mostram a distribuição de densidade atual primária (contabilizando a resistência à solução), secundária (também contabilizando reações farádicas) ou terciária (também contabilizando a difusão de íons). À medida que a complexidade se traduz em custo computacional, o modelo mais simples é mais adequado para explorações espaciais de parâmetros. Simulações de compósitos fibrosos motivados pelas propriedades materiais54 se concentram em propriedades de materiais a granel como resultado de uma microarquitetítada complexa, portanto não pode descrever os efeitos locais da exposição ao EF. Existentes em modelos de silico, motivados pelo ES, focalizar a amostra biológica, seja uma única célula imersa em um meio homogêneo55,56,57, ou tecidos complexos com espaço extracelular homogêneo58. A carga e a densidade atual (Figura 2) podem atuar como sinais de interface entre os modelos do dispositivo ES e da amostra biológica, ou entre diferentes componentes do dispositivo ES. O protocolo baseado em FEM proposto utiliza as equações descritas na Figura 2 e foi usado para estudar como parâmetros dependentes de andaimes podem ser usados para modular esses dois sinais, independente do EF gerado por uma configuração de acoplamento direto. Os resultados ressaltam que é necessário contabilizar propriedades elétricas de andaime ou ECM ao investigar como o ES impacta as células-alvo.
Protocolo
1. Construa o modelo em COMSOL
- Abra COMSOL e selecione Modelo em branco.
- Parâmetros: No Construtor deModelos , clique com o botão direito do mouse em Definições Globais,selecione Parâmetrose adicione parâmetros de acordo com a Tabela 1.
- Materiais: Adicionar materiais com propriedades de acordo com a Tabela 2.
- No Model Builder em Definições Globais,clique com o botão direito do mouse em Material e selecione Material em branco.
- Adicionar propriedades de material: Nas configurações do material recém-adicionado, expanda propriedades de material > propriedades básicas,selecione a Permissão Relativa e pressione o símbolo '+' para adicionar propriedade. Repita o passo para condutividade elétrica.
- No Conteúdo do Material,preencha as propriedades do material atual de acordo com a Tabela 2.
- Definição do componente: Na guia Home da fita superior, clique em Adicionar componente e selecione 3D. Um novo nó componente aparecerá no Model Builder.
- Geometria: No Construtor de Modelos, com o botão direito do mouse Geometry, inserçãodo clique esquerdo, clique duas vezes no Modelo Completo e selecione a sequência apropriada (SC/SNC/RC/RNC/RNCd).
- Alternativamente, construa a geometria do zero seguindo os passos subordinados.
- No Construtor de Modelos,clique à esquerda geometria sob o nó de componente atual. O mesmo nó geometria será encaminhado nas seguintes etapas subordinadas. Na janela Configurações, altere a unidade Comprimento para nm e certifique-se de que "Valores de escala ao mudar de unidades" seja deixado desmarcado.
- Geometria do andaime
- No Construtor de Modelos,clique com o botão direito do mouse em Geometria e selecione Bloco.
- Na guia Configurações, preencha o rótulo "Extensões de andaime".
- Expanda o tamanho e a forma e preencha "Ws", "Ls", "Hs" para Largura, Profundidade e Altura.
- Expanda a posição e mude a Base para o Centro.
- Expandir seleções de entidades resultantes,selecione Novo e adicione "Seleção de andaimes".
- Extensões da substância circundante: No Construtor de Modelos, sob Geometria,clique com o botão direito do mouse em extensões de andaime e selecione Duplicare editar a guia Configurações.
- Mude o rótulo para "Extensões de mídia".
- A cada caixa naseção Tamanho e Sh, adicione "med_ratio *" antes do parâmetro existente.
- Nas Seleções de Entidades Resultantes,adicione nova seleção como "Seleção de Mídia".
- Geometria de uma fibra (SC pular para 1.6.6)
- Núcleo (RC pular para 1.6.4.2)
- No Construtor de Modelos, clique com o botão direito do mouse geometria,selecione Cilindroe edite a guia Configurações da seguinte forma.
- Mude o rótulo para "Core".
- Expanda o tamanho e a forma e preencha "Rc" e "Lf" para Raio e Altura.
- Expanda a posição e preencha "-excesso*Ws/2" e "-Lf/2" para x e y.
- Expanda o eixo e mude o tipo axis para o eixo y.
- Expandir seleções de entidades resultantes e adicionar "Seleção de Núcleo".
- Casaco (salto SNC para 1,6,5)
- Laje (RC ou RNC pular para 1.6.4.2.2; RNCd pular para 1.6.4.2.3)
- No Modelo Construtor em Geometria,clique com o botão direito do mouse nas extensões do andaime e selecione Duplicata. Certifique-se de que a duplicata (extensões do andaime 1) venha logo após o Núcleo na sequência de geometria.
- Na guia Configurações, altere o rótulo para "Casaco".
- Na guia Configurações, expanda seleções de entidades resultantes e crie "Seleção de fibras".
- Pule para 1,6,5.
- Homogênea
- No Modelo Construtor com o botão direito do mouse Geometry, selecione Cilindro e edite sua guia Configurações da seguinte forma.
- Mude o rótulo para "Coat".
- Expanda o tamanho e a forma e preencha "Rf" e "Lf" para Raio e Altura.
- Expanda a posição e preencha "-excesso*Ws/2" e "-Lf/2" para x e y.
- Expandir o eixo e alterar o tipo de eixo para o eixo y (RC pular para 1.6.4.2.2.7).
- Expandir camadas,preencha "Rf-Rc" para espessura e deixe apenas "Camadas no lado" verificadas.
- Expandir seleções de entidades resultantes e adicionar "Seleção de casaco" ou, para RC, "Seleção de Fibra" (RC pular para 1.6.5).
- No Construtor de Modelos, clique com o botão direito do mouse em Geometria e selecione Excluir Entidades.
- Na guia Configurações, altere o nível de entrada geométrica para domínio e escolha Seleção de casaco para Seleção.
- Remova todos os domínios, mas domínio 3 da caixa de seleção (o núcleo do cilindro em camadas).
- Expandir seleções de entidades resultantes e selecionar seleção de casacos.
- Pule para 1,6,5.
- Matriz periódica de dois tipos
- No Construtor de Modelos,clique com o botão direito do mouse geometria e selecione Cilindro. Clique com o botão direito do mouse no elemento recém-criado e selecione Duplicar. Edite sua guia Configurações da seguinte forma.
- Definir rótulo para "Coat 1" / "Coat 2".
- Coloque o raio para Rf.
- Definir altura para "D*prop"/"D*(1-prop)".
- Expanda a posição e preencha "-excesso*Ws/2" para ambos em x e "-Lf/2"/"-Lf/2+D*prop" em y.
- Expanda o eixo e mude o tipo de eixo para o eixo y.
- Expandir camadas seção e preencher "Rf-Rc"; Certifique-se de que apenas a caixa "Camadas na lateral" seja verificada.
- Expandir seleções de entidades resultantes e criar "Seleção do Casaco 1"/ "Seleção do Casaco 2".
- No Construtor de Modelos, clique com o botão direito do mouse em Geometria e selecione Excluir Entidades.
- Na guia Configurações, altere o nível de entrada geométrica para domínio e selecione cilindro 2 (cyl2) e cilindro 3 (cyl3) da janela gráfica.
- Remova todos os domínios, mas domínio 3 da caixa de seleção (o núcleo dos cilindros em camadas).
- Expandir seleções de entidades resultantes e criar seleção de casacos.
- No Model Builder, com o botão direito do mouse geometria,expanda Transformações e selecione Array. Editar configurações da seguinte forma.
- Selecione "Seleção de revestimento" para objetos de entrada.
- Definir tipo matriz para Linear.
- Defina tamanho para "Lf/D".
- Defina deslocamento no eixo y para "D".
- No Construtor de Modelos,clique com o botão direito do mouse geometria e selecione Cilindro. Clique com o botão direito do mouse no elemento recém-criado e selecione Duplicar. Edite sua guia Configurações da seguinte forma.
- Laje (RC ou RNC pular para 1.6.4.2.2; RNCd pular para 1.6.4.2.3)
- Núcleo (RC pular para 1.6.4.2)
- Geometria de uma matriz de fibras orientada
- Core Array (RC pular para 1.6.5.2)
- No Construtor de Modelos, com o botão direito do mouse geometria, expanda transformações e selecione Girar.
- Na guia Configurações, ligue o Switch de objetos de entrada e selecione Seleção de núcleo na lista suspensa. Certifique-se de que a caixa de objetos de entrada não está verificada.
- Expanda o ângulo de rotação e preencha "theta" para rotação.
- Expandir seleções de entidades resultantes e criar "Seleção de Fibras".
- No Modelo Construtor clique com o botão direito do mouse geometria, expanda transformações e selecione Array.
- Mude o rótulo para "Core Array".
- Selecione Seleção do núcleo na lista suspensa para objetos de entrada.
- Expanda o tamanho,altere o tipo array para Linear e preencha "n_1*(theta<=45) +n_2*(theta>45)" para Tamanho.
- Expanda o deslocamento e preencha "2*tes*Rc*cos(theta)", "2*tes*Rc*sin(theta)" para x e y.
- Expandir seleções de entidades resultantes e selecionar "Seleção de Fibras".
- No Construtor de Modelos, com o botão direito do mouse geometria, expanda transformações e selecione Girar.
- Coat Array (salto SNC para 1.6.5.3)
- No Construtor de Modelos, com o botão direito do mouse geometria, expanda transformações e selecione Girar.
- Na guia Configurações, ligue os objetos de entrada Interruptor e selecione Seleção de casaco na lista suspensa. Certifique-se de que a caixa "Manter objetos de entrada" não esteja verificada.
- Expanda o ângulo de rotação e preencha "theta" para rotação.
- Expandir seleções de entidades resultantes e selecionar "Seleção de Fibras".
- No Construtor de Modelos, clique com o botão direito do mouse geometria, expanda transformações e selecione Array.
- Mude o rótulo para "Coat Array".
- Selecione Seleção de casaco na lista suspensa para objetos de entrada.
- Expanda o tamanho,altere o tipo array para Linear e preencha "n_1*(theta<=45) +n_2*(theta>45)" para Tamanho.
- Expanda o deslocamento e preencha "2*tes*Rc*cos(theta)", "2*tes*Rc*sin(theta)" para x e y.
- Expandir seleções de entidades resultantes e selecionar "Seleção de Fibras".
- No Construtor de Modelos, com o botão direito do mouse geometria, expanda transformações e selecione Girar.
- Andaime cortado
- Unir fibras: No modelo de construtor com o botão direito do mouse geometria, expanda booleans e partições e selecione União.
- Mude o rótulo para "Fibras".
- Ativar o interruptor de objetos de entrada e selecione Seleção de fibra na lista suspensa.
- Certifique-se de que a caixa "Manter objetos de entrada" não esteja verificada.
- Certifique-se de que "Mantenha os limites internos" seja verificado.
- Expandir seleções de entidades resultantes e selecionar seleção de andaimes na lista suspensa.
- Executar o corte: No modelo de construção com o botão direito do mouse Geometry, expanda booleans e partições e selecione Intersecção.
- Mude o rótulo para "Andaime".
- Ligue o interruptor Desapareçam e selecione Seleção de andaimes na lista suspensa.
- Certifique-se de que a caixa "Manter objetos de entrada" não esteja verificada.
- Certifique-se de que "Mantenha os limites internos" seja verificado.
- Unir fibras: No modelo de construtor com o botão direito do mouse geometria, expanda booleans e partições e selecione União.
- Core Array (RC pular para 1.6.5.2)
- Geometria do Conjunto
- Defina geometria da substância circundante.
- No Model Builder, com o botão direito do mouse geometria,expanda booleans e partições e selecione Diferença. Continue na guia Configurações.
- Na lista Objetos para adicionar dropdown, selecione Seleção de mídia.
- Nos Objetos para subtrair a lista suspensa, selecione Seleção de andaimes.
- Certifique-se de que as caixas "Mantenha objetos de entrada" e "Mantenha os limites internos" sejam verificadas.
- Excluir a caixa de extensões de mídia.
- No Construtor de Modelos, clique com o botão direito do mouse geometria e selecione Excluir entidades. Continue na guia Configurações.
- Selecione Domínio na lista de dropdown de nível de entrada geométrica.
- Selecione Seleção de mídia na lista suspensa De seleção.
- Remova "dif1" da caixa de seleção.
- Defina geometria da substância circundante.
- Construir geometria
- Sob o nó Geometria, certifique-se de que o último elemento antes do nó de Seleções Cumulativas seja a Form Union e não a Form Assembly. Se necessário, clique com o botão direito de apresentar o Formulário e altere a Ação para "Formar uma união" na guia Configurações.
- No Construtor de Modelos,clique no modo de geometria e selecione Build All.
- Materiais
- No Modelo Construtor sob o nó de componente Atual, clique com o botão direito do mouse materiais e selecione Link de material.
- Repita a seção cinco vezes para o maior número de materiais são considerados de acordo com o nível de complexidade.
- Materiais associados para cada componente na seguinte ordem: substância circundante, casacos, núcleos.
- Na guia Configurações, escolha Mídia/Andaime (para SC, SNC, RC)/Seleção de casacos/núcleos na lista suspensa De seleção.
- Expanda as configurações do Link e escolha o material apropriado da lista suspensa.
- Articulada
- No Construtor deModelos, clique no nó Malhar sob o componente atual.
- Na guia Configurações, selecione Normal na lista suspensa do tamanho do elemento e deixe clicar em Construir Tudo.
- Física: No Construtor de Modelos, componente atual do clique esquerdo, selecione Adicionar Física,expanda o módulo AC/DC na guia Adicionar Física, selecione o módulo Correntes Elétricas (ec) e clique em Adicionar ao Componente.
- Condições de limite: Na guia Gráficos, selecione a exibição xy.
- Chão: No Construtor de Modelos,clique com o botão direito do mouse no nó correntes elétricas e selecione Ground.
- Certifique-se de que o interruptor de seleção para a Seleção de Limites esteja ativo e clique à esquerda na face mais alta da substância circundante paralelamente ao plano xz para adicionar o limite 5 na Caixa de Seleção de Limites.
- Terminal: No Modelo Construtor,clique com o botão direito do mouse no nó correntes elétricas e selecione Terminal.
- Certifique-se de que o interruptor de seleção para a Seleção de Limite esteja ativo e clique à esquerda na face mais baixa da substância circundante paralelamente ao plano xz para adicionar o limite 2 na Caixa de Seleção de Limite.
- Expanda a seção Terminal e selecione Tensão na lista suspensa do tipo Terminal; preencher V0 para Tensão.
- Adicione complexidade se necessário: Salve o componente atual e volte ao Passo 1.4 para seguir outro caminho de complexidade (SC/SNC/RC/RNC/RNCd).
- Condições de limite: Na guia Gráficos, selecione a exibição xy.
2. Realizar simulação
- Refinamento de malha adaptável
- No Construtor deModelos, clique no nó raiz do modelo e selecione Adicionar estudo para abrir a guia Adicionar estudo, selecione Estudo Estacionário e clique com o botão adicionar estudo com o botão Adicionar.
- Crie uma etapa de estudo para cada componente criado: em Estudo nó com o botão direito do mouse Passo1: Estudo Estacionário e selecione Duplicata.
- Para cada etapa de estudo, modifique a guia de configurações com os detalhes do componente correspondente.
- Expandir a Seleção de Física e Variáveis; na coluna Resolver para a coluna deixe apenas o componente atual verificado.
- Expanda extensões de estudo e verifique a caixa de refinamento de malha adaptativa.
- Selecione a geometria do componente atual na lista suspensa ao lado da Adaptação em geometria.
- Em Model Builder clique com o botão direito do mouse Study 1 e selecione Compute. Isso gerará malhas adaptadas para todas as geometrias dos componentes com seu ângulo de orientação atual.
- Defina o ângulo de orientação e realize um estudo estacionário.
- Em Model Builder, em definições globais,deixou clique Parâmetros e altere o parâmetro teta para o ângulo de orientação de fibra desejado para simulação.
- Para cada componente, no Model Builder expanda o nó do componente, clique com o botão direito do mouse em Geometria e selecione Construir tudo.
- Em Model Builder, clique com o botão direito do mouse no estudo de refinamento de malha adaptativa e selecione computação.
- No Modelo Construtor à esquerda clique no nó raiz do modelo e selecione Adicionar estudo para abrir a guia Adicionar estudo, selecione Estudo Estacionário e clique com o botão adicionar estudo com o botão Adicionar.
- Em Model Builder, sob o estudo recém-adicionado, clique esquerdo passo 1, expanda a seleção de malha e, para cada componente, selecione as malhas geradas no estudo de refinamento de malha adaptativa.
- Clique com o botão Com base.
- Defina ângulo de orientação, sinal de entrada e realize estudo dependente do tempo.
- Em Model Builder, em definições globais,deixou clique Parâmetros e altere o parâmetro teta para o ângulo de orientação de fibra desejado para simulação.
- No Construtor demodelos, clique no nó raiz do modelo e selecione Adicionar estudo para abrir a guia Adicionar estudo. Selecione Estudo dependente do tempo,clique no botão Adicionar estudo e editar a guia Configurações da seguinte forma.
- Definir tempos para "intervalo(0, (2*pi/omega)/39,2*pi/omega)".
- Expandir a Seleção de Física e Variáveis; deixar apenas a caixa de seleção do componente de simulação "Resolver para" verificada.
- Expanda a seleção de malha e selecione uma malha para o componente de simulação. Altere as malhas dos outros componentes para Nenhuma malha.
- Expandir extensões de estudo e verificar a caixa de refinamento de malha adaptativa; selecione a geometria do componente de simulação a partir da lista suspensa.
- Defina a condição de limite dependente do tempo.
- Sob o nó do componente atual clique com o botão direito do mouse Definições e em Funções selecione Waveform.
- Na guia Configurações, altere o nome da função para "Entrada".
- Parâmetros deexpansão , definir Tipo para Sine, frequência angular para "ômega", Amplitude para V0.
- Para o componente de simulação, sob seu nó Correntes Elétricas, selecione Terminal e altere tensão para "Entrada(t[1/s)".
- Clique com o botão Com base.
3. Análise
- Densidade de carga
- No nó De formação com o botão direito do mouse noíde Resultados, selecione 3D Plot Group e edite Configurações.
- Alterar o rótulo para "Densidade de carga".
- Expanda dados e selecione o conjunto de dados do estudo paramétrico na lista suspensa do conjunto de dados.
- Expanda a Lenda das Cores e confira "Show legends" e "Mostrar valores máximos e mínimos".
- Clique com o botão direito da densidade de carga sob o nó Resultados no Construtor de Modelos e selecione Volume; proceder à guia Editar Configurações.
- Expanda dados e selecione "De pai" na lista suspensa do conjunto de dados.
- Expanda a expressão e preencha "ec.rhoq" na caixa Expressão.
- Expanda o alcance e verifique a caixa de faixa de cores manual.
- Definir mínima para "-0,03" e máxima para "0,03".
- Expanda a coloração e o estilo,defina colorir para a tabela Color, a tabela De cores para a onda, marque a caixa de legendas de cores, marque a faixa de cores Symmetrize.
- Clique com o botão direito do mouse em Criador de Modelos e selecione Filtro.
- Na guia Configurações preencha "abs(ec.rhoq)>0.012" na expressão Lógica para inclusão.
- Clique no botão Plot para visualizar resultados na janela gráfica.
- No nó De formação com o botão direito do mouse noíde Resultados, selecione 3D Plot Group e edite Configurações.
-
Densidade atual
- No Modelo Construtor com o botão direito do mouse no nó Resultados, selecione 3D Plot Group e edite a guia Configurações.
- Alterar o rótulo para "Densidade atual".
- Expanda dados e selecione o conjunto de dados do estudo paramétrico na lista suspensa do conjunto de dados.
- Expanda a Lenda das Cores,confira "Mostrar lendas" e "Mostrar valores máximos e mínimos".
- Clique com o botão direito da densidade atual sob o nó Resultados no Construtor de Modelos e selecione O Volume de Seta; proceder à guia Editar Configurações.
- Expanda dados e selecione "De pai" na lista suspensa do conjunto de dados.
- Expanda a Expressão e preencha "ec. Jx", "ec. Jy", "ec. Jz" nas caixas Expression para os componentes x, y e z, respectivamente.
- Expanda o posicionamento da Seta e preencha em 20 para todas as coordenadas número de pontos.
- Expanda a coloração e o estilo,defina o comprimento da seta para normalizado, a base de seta para o centro, verifique o fator Escala e defina-o para 85.
- Clique com o botão direito do mouse em Criador de Modelos e selecione Expressão de cor.
- Na guia Configurações preencha "ec.normJ" na caixa Expressão.
- Expandir coloração e estilo,definir tabela de cores para tráfego, verificar legenda de cores e tabela de cores reversa.
- Clique no botão Plot para visualizar resultados na janela gráfica.
- No Modelo Construtor com o botão direito do mouse no nó Resultados, selecione 3D Plot Group e edite a guia Configurações.
Resultados
O modelo proposto descreve características de um tapete composto com fibras paralelas, imerso em uma substância condutora e exposto a um gradiente potencial elétrico gerado externamente. Simulações mostram que a contabilização dos diferentes componentes de um andaime é importante em uma microescala e exploram como a mudança no ângulo de alinhamento (sinal de entrada) das fibras para o EF pode gerar variabilidade na corrente e densidade de carga (sinais de saída) nas proximidades das fibras.
São apresentados cinco estágios de complexidade geométrica diferentes, cada um tendo efeito sobre o resultado da simulação: laje condutiva suave (SC), laje lisa com fibras embarcadas não condutoras (SNC), composto condutivo áspero (RC), composto áspero com fibras embarcadas não condutoras (RNC), composto áspero com fibras embarcadas não condutoras e dois tipos de revestimento periódico (RNCd)(Figura 3). A seção 1.5 do protocolo apresenta as etapas para importar as geometrias em um projeto e a seção 1.6 mostra como construí-los passo a passo. Os dois primeiros modelos não explicam a morfologia superficial. SC e RC não contabilizam as propriedades dielétricas do núcleo de fibra. O RNC é o modelo proposto para andaimes artificiais nanofibrosas, enquanto o RNCd é o modelo proposto para um segmento de ECM.
A minimização do custo computacional foi realizada reduzindo a geometria do dispositivo ES a um volume de unidade modelo representando o microambiente. Embora um dispositivo ES e a largura e o comprimento do andaime possam facilmente estar na ordem de alguns centímetros, o diâmetro das fibras que contêm é geralmente menor do que um mícndo. Aqui, usamos um corte de andaime comparável ao diâmetro da fibra para reduzir o custo computacional induzido pela proporção e destacar o efeito da natureza fibrosa do andaime no microambiente elétrico. O resto do dispositivo ES é substituído por condições de limite potenciais elétricos escolhidas de modo que uma aproximação aproximada para a magnitude do campo elétrico é de 100 V/m, um parâmetro de estimulação frequentemente relatado. Além disso, acredita-se que um volume unitário com cinco fibras paralelas - como a utilizada em simulações, apresentada na Figura 3 - seja considerado representativo de todo um tapete fibroso planar. Três tipos de fibras podem ser distinguidas em uma matriz 1D: central interior (com o plano de simetria longitudinal do andaime dividindo-as ao meio), transitória interior (com superfície lateral cercada por outras fibras, mas com laterais assimétricas) e exterior (na borda do andaime). Cinco é o número mínimo de fibras necessárias para incluir todos os três tipos definidos.
O tamanho do elemento de malha do modelo requer atenção especial, pois pode impactar os resultados da simulação e, assim, não expor efeitos importantes (Figura 4). Esta é uma regra geral do método de elemento finito e uma implicação do teorema amostral de Nyquist-Shannon. Quanto mais rápido os sinais de simulação essenciais flutuam no espaço, menores os elementos de malha precisam ser para produzir uma representação leal do fenômeno. Por outro lado, quanto menor o elemento, maior o número total de blocos de construção do modelo e o custo computacional. O refinamento de malha adaptável configurado na seção 2.1 é um método bom e fácil para equilibrar esses objetivos opostos, diminuindo o tamanho do elemento apenas onde e enquanto esta operação produzir uma mudança significativa.
Um modelo muito simplista pode falhar apresentando efeitos importantes(Figura 5,6). Simulações mostram que a contabilização da morfologia superficial e propriedades elétricas de componentes de andaimes não é redundante na previsão de microambientes elétricos. Embora a morfologia superficial tenha um impacto direto no EF estacionário (compare SC e SNC com RC, RNC e RNCd), uma comparação entre as previsões de RC e RNC mostra que núcleos de fibra nãocondutivo amplificam esse efeito. Do ponto de vista da modelagem de microambientes elétricos celulares em andaimes nanofibrosas, os modelos SC, SNC e RC são, portanto, sub-ideais. No entanto, é uma boa prática adicionar complexidade incrementalmente, pois comparações entre os diferentes estágios ajudam a indicar quais características dão origem a efeitos específicos.
A complexidade do modelo impacta a mudança de corrente e da densidade de carga com o alinhamento de fibras ao EF. O protocolo proposto ajuda a destacar o efeito ( Figura5,6). Embora o modelo SC não mostre variação nas métricas propostas quando seu alinhamento ao gradiente potencial elétrico é alterado, as simulações do modelo RNC prevêem um contraste poderoso entre a unidade do tapete com fibras alinhadas ao EF e aquela com fibras perpendiculares(Figura 7). Quando os núcleos não condutores atrapalham o fluxo atual, formam barragens periódicas que levam a regiões alternadas de alta e baixa densidade de carga.
Regimes dinâmicos de ES podem ser simulados com estudos dependentes do tempo. Vídeos em arquivos suplementares mostram previsões feitas para uma tensão de entrada sinusoidal em um modelo de andaime artificial completo (RNC), com fibras paralelas ou perpendiculares ao gradiente potencial elétrico. Pequenas correntes ao longo das fibras perpendiculares ao EF aparecem quando a carga é liberada do andaime à medida que a magnitude do EF diminui. Isso mostra que a estimulação pode ocorrer não apenas enquanto o EF externo estiver presente, mas também logo após ser desconectado - Veja arquivos suplementares para vídeos.
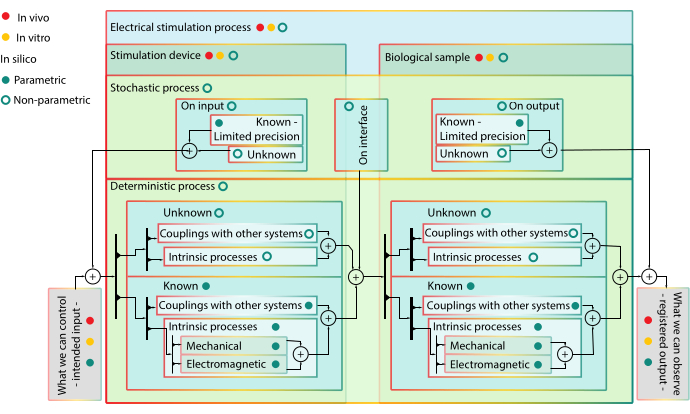
Figura 1: Diagrama hierárquico de blocos de modelagem - vantagens e limitações da modelagem com modelos in vivo e em silico. Bloqueie os blocos de marcas de cores no mesmo nível hierárquico. Blocos de classificação mais baixas estão incluídos em classificações mais altas. As marcas de cor do traçado do bloco podem incluir o bloco em um determinado tipo de modelo - o acoplamento com outros blocos de sistema não tem amarelo em seu curso, pois não são componentes para modelos in vitro. As balas agem como válvulas e significam controlabilidade do bloco. Quando uma válvula está acesa, o sinal pode passar por todos os caminhos de seta nos subsistemas subordinados que têm a cor da válvula em seu curso. Interpretação do diagrama: o processo ES é composto pelo dispositivo de estimulação e alvo biológico, cada um com vários subprocessos determinísticos ou estocásticos interconectados que não podem ser separados in vivo ou in vitro, portanto não possuem válvula vermelha ou amarela. Processos estocásticos também intervêm na interface entre o dispositivo de simulação e a amostra biológica quando ambos são estimulados. Um modelo in vitro desacopla o sistema de interesse (ou seja, segmento de pele) do resto do organismo. Assim, apenas processos intrínsecos do sistema de interesse coberto por processos estocásticos de natureza diferente podem ser observados. No entanto, os diferentes processos intrínsecos envolvidos não podem ser estimulados e identificados separadamente. Os modelos em silico são paramétricos para componentes conhecidos - espera-se que seu comportamento seja de uma determinada forma - e não paramétrico para o desconhecido - pois não há razão mecanicista para dar credibilidade a uma certa extrapolação. Todos os componentes em silico podem ser simulados separadamente ou em diferentes combinações, permitindo o retrato de diferentes hipóteses. Clique aqui para ver uma versão maior desta figura.
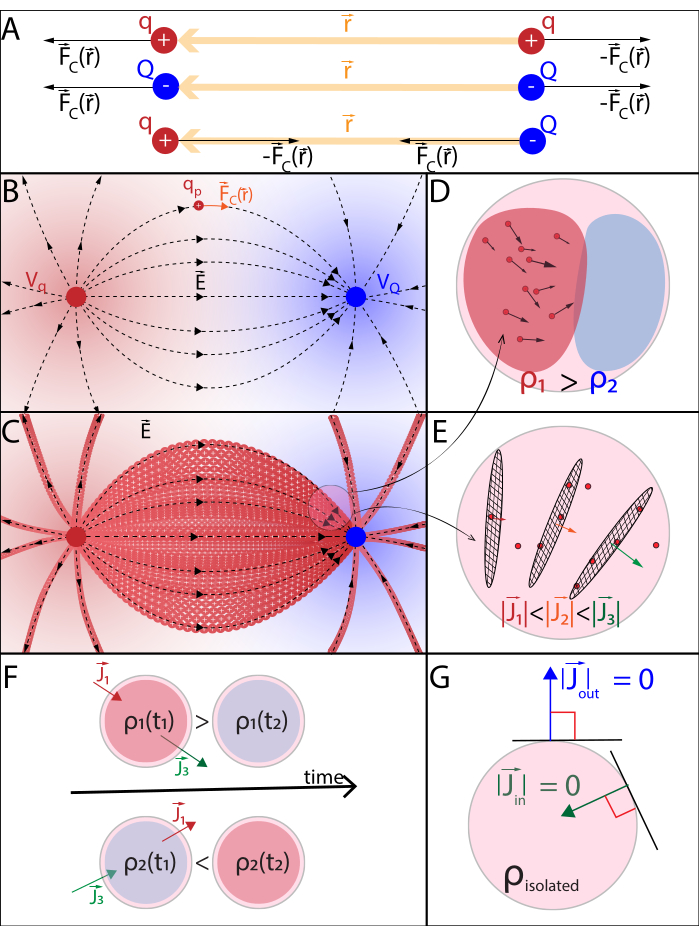
Figura 2: (A) Lei de Coulomb (B) Campo potencial elétrico e carga de sonda móvel (C) Corrente elétrica (D) Densidade de carga elétrica (E) Densidade atual (F) Equação de continuidade (G) Lei de conservação de carga. (A) Partículas estacionárias carregadas eletricamente q e Q interagem eletroessticamente através da força de Coulomb 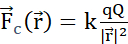 . (B1) Cada partícula carregada Q gera um campo escalar chamado potencial elétrico em todas as posições
. (B1) Cada partícula carregada Q gera um campo escalar chamado potencial elétrico em todas as posições  no espaço:
no espaço: 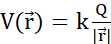 . O trabalho máximo necessário para mover outra partícula carregada q de sua posição
. O trabalho máximo necessário para mover outra partícula carregada q de sua posição 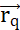 é o produto entre a carga q e o potencial elétrico gerado por Q na posição
é o produto entre a carga q e o potencial elétrico gerado por Q na posição 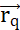 . O campo potencial elétrico gerado por múltiplas partículas é a soma dos campos gerados por cada partícula individual. (B2) Um campo estacionário com partículas geradoras fixas q e Q, age com
. O campo potencial elétrico gerado por múltiplas partículas é a soma dos campos gerados por cada partícula individual. (B2) Um campo estacionário com partículas geradoras fixas q e Q, age com 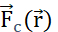 uma partícula sobre uma sonda com carga positiva qp. Em resposta, qp move-se para minimizar o potencial elétrico de sua posição. Para descrever o movimento de qp,pode-se derivar
uma partícula sobre uma sonda com carga positiva qp. Em resposta, qp move-se para minimizar o potencial elétrico de sua posição. Para descrever o movimento de qp,pode-se derivar 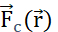 e o campo elétrico do campo potencial
e o campo elétrico do campo potencial 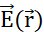 elétrico:
elétrico: 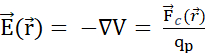 . (C) Várias partículas de sonda móvel carregadas positivamente liberadas uniformemente em um campo elétrico estacionário seguem um movimento organizado. Para rastrear a configuração de carga sem rastrear cada partícula, pode-se especificar a cada instante: (D) como o espaço é ocupado por partículas, atribuindo uma densidade de carga
. (C) Várias partículas de sonda móvel carregadas positivamente liberadas uniformemente em um campo elétrico estacionário seguem um movimento organizado. Para rastrear a configuração de carga sem rastrear cada partícula, pode-se especificar a cada instante: (D) como o espaço é ocupado por partículas, atribuindo uma densidade de carga 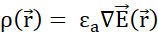 a cada volume infinitesimal, de acordo com a Lei de Gauss, e (E) como as partículas passam pelas superfícies de fronteira entre os volumes infinitesiários vizinhos, atribuindo uma densidade atual
a cada volume infinitesimal, de acordo com a Lei de Gauss, e (E) como as partículas passam pelas superfícies de fronteira entre os volumes infinitesiários vizinhos, atribuindo uma densidade atual 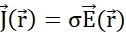 a cada limite de acordo com a Lei de Ohm. (F) A carga e a densidade atual evoluem co-dependentemente de acordo com a Equação de continuidade, pois o deslocamento de partículas não uniformes leva ao acúmulo ou perda de partículas em um determinado volume. (G) Dentro de um sistema isolado, prevalece a lei de conservação de Carga e não há entrada ou saída de partículas carregadas. Anotações utilizadas:- q,Q, qp carga e nome da partícula carregada;
a cada limite de acordo com a Lei de Ohm. (F) A carga e a densidade atual evoluem co-dependentemente de acordo com a Equação de continuidade, pois o deslocamento de partículas não uniformes leva ao acúmulo ou perda de partículas em um determinado volume. (G) Dentro de um sistema isolado, prevalece a lei de conservação de Carga e não há entrada ou saída de partículas carregadas. Anotações utilizadas:- q,Q, qp carga e nome da partícula carregada; 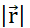 - Norma euclidiana do vetor de posição; k - Constante de Coulomb;
- Norma euclidiana do vetor de posição; k - Constante de Coulomb; 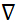 - operador de gradiente, εa - absoluta permissão do meio; σ - condutividade do meio. Clique aqui para ver uma versão maior desta figura.
- operador de gradiente, εa - absoluta permissão do meio; σ - condutividade do meio. Clique aqui para ver uma versão maior desta figura.
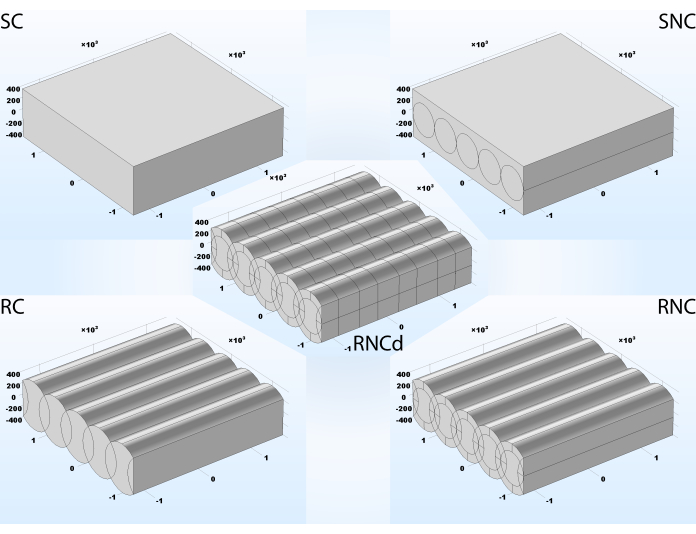
Figura 3: Cinco níveis diferentes de complexidade para um tapete fibroso. SC- suave com fibras embarcadas condutivas, o modelo mais simples, não contabilizando morfologia superficial ou propriedades diferentes dos componentes constituintes; SNC- suave com fibras embarcadas não condutoras; RC- áspero com fibras embarcadas condutivas, contabilizando a morfologia superficial, mas não para diferentes propriedades componentes; RNC- áspero com fibras embarcadas não condutoras, modelo completo proposto de andaimes artificiais nanofibrosas; RNCd- áspero com fibras embarcadas não condutoras revestidas com dois materiais diferentes, modelo completo proposto para uma folha de fibras de colágeno. Unidade de comprimento utilizada: nanômetros. Clique aqui para ver uma versão maior desta figura.
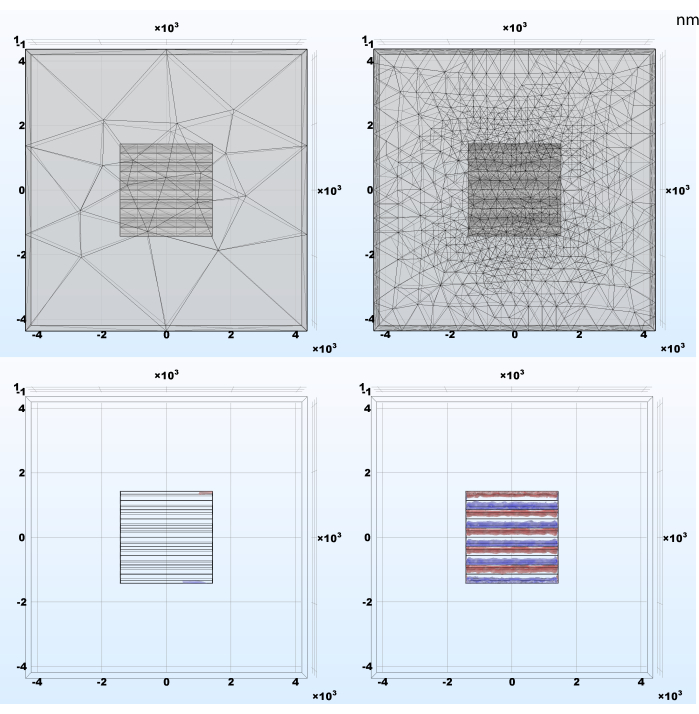
Figura 4: Exemplos de resultados do refinamento adaptativo da malha e da densidade de carga resultante após a simulação. (Esquerda) Rede gerada automaticamente com elementos tetraedra extra grosseiro; (À direita) Malha inicial adaptativamente refinada durante o estudo estacionário; elementos menores são necessários para um resultado preciso nas áreas onde sinais simulados têm mudanças espaciais abruptas. Clique aqui para ver uma versão maior desta figura.
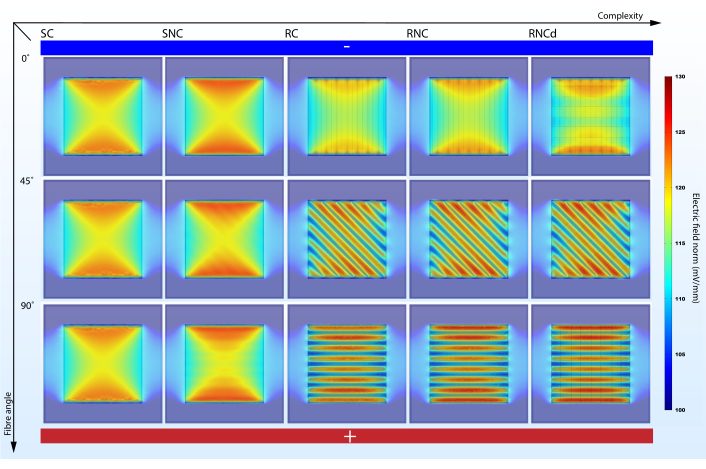
Figura 5: O ângulo de alinhamento da fibra para o gradiente potencial elétrico impacta a força do EF na mídia de cultura celular circundante quando a complexidade suficiente é contabilizada. SC, SNC, RC, RNC e RNCd são os diferentes níveis de complexidade para o modelo de tapete fibroso apresentado na Figura 3. O eixo vertical marca o ângulo de alinhamento das fibras ao gradiente potencial elétrico. Eletrodos abstratos em destaque - lado inferior com alto potencial elétrico e parte superior com baixo potencial elétrico. Clique aqui para ver uma versão maior desta figura.
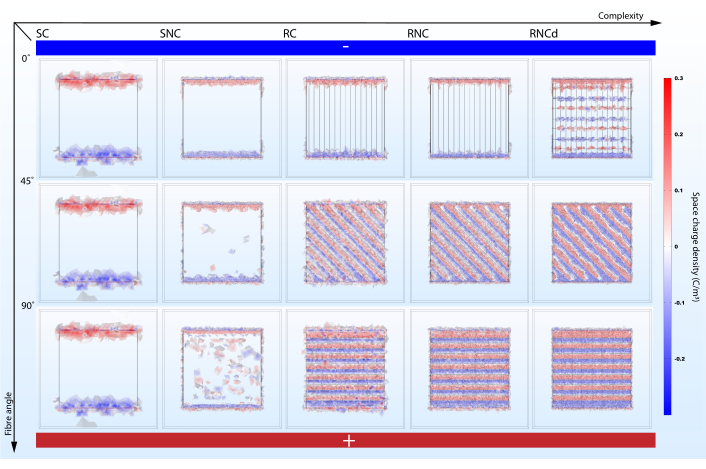
Figura 6: O ângulo de alinhamento da fibra para o gradiente potencial elétrico impacta a densidade de carga espacial nos meios de cultura celular circundantes quando a complexidade suficiente é contabilizada. SC, SNC, RC, RNC e RNCd são os diferentes níveis de complexidade para o modelo de tapete fibroso apresentado na Figura 3. O eixo vertical marca o ângulo de alinhamento das fibras ao gradiente potencial elétrico. Eletrodos abstratos em destaque-lado inferior com alto potencial elétrico e parte superior com baixo potencial elétrico. Clique aqui para ver uma versão maior desta figura.

Figura 7: O movimento da carga é influenciado pelo alinhamento da fibra do andaime em relação ao EF. Ambos os painéis ilustram previsões de modelos RNC de estado estável. No lado esquerdo as fibras são paralelas à EF, enquanto no lado direito são perpendiculares. O volume de cores de vermelho e azul claro marca a densidade de carga, enquanto o volume da seta marca a orientação de densidade atual. A cor das setas corresponde à norma de densidade atual. Por favor clique aqui para ver uma versão maior desta figura.
| Nome | Expressão | Descrição |
| Ws | 10*Rc*med_ratio | Largura do andaime |
| É | 10*Rc*med_ratio | Comprimento do andaime |
| Hs | 2*Rf | Altura do andaime |
| med_ratio | 1.5 | Proporção de mídia de cultura celular para andaime |
| Rc | 278,5[nm] | Raio do núcleo de fibra |
| r | 1.5 | Relação núcleo de fibra para revestimento |
| Rf | Rc*r | Fibra com raio de camada |
| theta | 90[deg] | Ângulo de orientação de fibras |
| Se | 1.3*(Ls*cos(theta)+Ws*sin(theta)) | Comprimento da fibra |
| tes | 1 | Relação de raio do núcleo de fibras à distância entre fibras |
| n_1 | 2*(correção((Ws/(2*cos(theta)-Rf)/(2*tes*Rc)+3)*(cos(theta)!=0)+1*(cos(theta)==0) | Número máximo de fibras se teta<=45 |
| n_2 | 2*(correção((Ls/(2*sin(theta)-Rf)/(2*tes*Rc)+3)*(pecado(theta)!=0)+1*(sin(theta)==0) | Número máximo de fibras se theta>45 |
| excesso | 1.2+0,3*abs(sin(2*theta)) | Primeira fibra relativa offset de andaime |
| D | Lf/5 | Periodicidade do casaco |
| escora | 0.46 | Comprimento do primeiro casaco em relação à periodicidade D |
| E | 100[mV/mm] | Magnitude do campo elétrico |
| V0 | E*Ls*med_ratio | Tensão terminal |
| ômega | 500[Hz] | Tempo dependente da frequência de tensão |
| p_sigma | 0.5 | Condutividade relativa do segundo revestimento |
| p_eps | 1.5 | Segunda constante dielétrica relativa de revestimento |
Tabela 1: Parâmetros utilizados para simulação
| Mídia de Cultura | PEDOT:PSS 1 | PEDOT:PSS 2 | Colágeno Hidratado 1 | Colágeno Hidratado 2 | Fibroin de Seda | Colágeno Seco | |
| Condutividade Elétrica (S/m) | 1.7014 | 1.00E-01 | p_sigma * 0.1 | 2.00E-05 | p_sigma * 2e-5 | 1.00E-08 | 2.50E-08 |
| Permissão Relativa | 80.1 | 2.2 | p_eps * 2.2 | 9.89 | p_eps * 9.89 | 7.81E+00 | 4.97 |
Tabela 2: Propriedades materiais utilizadas na simulação
Arquivos Suplementares. Clique aqui para baixar este Arquivo.
Discussão
O protocolo proposto sugere uma solução uniforme de modelagem para andaimes naturais e artificiais e destaca a necessidade de considerar a nanoestrutura de andaimes fibrosos ao inspecionar os efeitos do EF sobre células semeadas em tais materiais. Embora uma aproximação grosseira para a intensidade da EF (diferença potencial de eletrodo dividida pela distância entre os eletrodos) nos levaria a esperar uma força de campo de 100 mV/mm, simulações prevêem forças estacionárias de campo até 30% maiores em diferentes áreas do tapete(Figura 5). Esse resultado deve interessar-se ao desenho do experimento ES e à interpretação dos dados, uma vez que a morte celular pode ser causada por EFs muito fortes. Expor o microambiente elétrico permitiria uma correlação direta entre es e desenvolvimento celular. Enquanto vários estudos apresentam análises detalhadas de morfologia dos andaimes utilizados33,43,59, eles não investigam a interação entre a estrutura, as propriedades elétricas dos materiais e o EF. Este protocolo pode permitir este link, pois parâmetros como raio de fibra, espessura da camada de revestimento, distância entre fibras e propriedades elétricas dos materiais componentes podem ser modificados de acordo com cada experimento alterando as Definições Globais nas etapas 1.2 e 1.3. Assim, as previsões personalizadas de carga 3D e densidade atual podem ser feitas tanto para regimes estáticos quanto dinâmicos de ES.
A otimização do design de andaimes pode ser direcionada através dos modelos RNC e RNCd com amplas explorações de alcance de parâmetros, escalando as morfologias ou partes propostas. Alternativamente, outras configurações de andaimes podem ser investigadas com o protocolo proposto alterando os tipos de Array de Linear para Tridimensional na seção 1.6.5 e adaptando geometria do andaime na seção 1.6.2. No entanto, a otimização do andaime não pode ser feita sem um objetivo. Enquanto para fins de engenharia de tecidos o foco principal é o destino celular, uma imagem mais clara sobre quais estímulos são seus principais determinantes é essencial se seu controle confiável for desejado. Carga e densidade atual são bons descritores de microambientes elétricos celulares, pois mostram a interação entre o EF e as propriedades elétricas dos diferentes materiais componentes de andaimes complexos como o ECM. O protocolo mostra como calcular previsões para essas métricas dada uma geometria de andaime nanofibrosa e destaca a importância do ângulo de alinhamento das fibras com o EF. Previsões de carga e densidade atual poderiam então estar ligadas ao desenvolvimento celular e, portanto, os regimes de andaime e ES podem então ser otimizados para tarefas específicas.
Curiosamente, um estudo mostra que a exposição à EF gerou estresse mecânico mais do que o dobro em força em filmes compostos com nanofibras perpendiculares ao EF externo em comparação com filmes com alinhamento paralelo60. O estresse mecânico relatado pode ser resultado de forças de Coulomb agindo entre fibras carregadas, previstas pelas simulações de modelos ásperos (RC, RNC, RNCd) (Figura 6). Embora essas simulações possam ser úteis na investigação dessa hipótese, deve-se notar que os resultados experimentais relatados foram obtidos em um sistema com acoplamento capacitivo, e a simulação apresenta acoplamento direto.
Um fator limitante para futuros possíveis usos do protocolo para estimar um sinal de entrada celular é a incerteza dos parâmetros. Parâmetros geométricos incertos são a espessura da camada de revestimento e a distância entre núcleos de fibra. O primeiro pode ser inferido encontrando o valor que leva a uma impedância em massa que pode ser validada experimentalmente. O segundo pode ser extraído de material de alta resolução. Parâmetros que descrevem as propriedades físicas dos materiais também são afetados pela incerteza. No entanto, a condutividade elétrica e a constante dielétrica de materiais exemplificados diferem muito mais do que a precisão experimental de medição(Tabela 2). Portanto, os efeitos relatados seriam mantidos apesar de erros moderados de medição.
Os resultados mostram como a complexidade do modelo não suficiente pode esconder informações relevantes. É importante reconhecer que o protocolo simula uma versão simplificada do fenômeno físico que ocorre, pois não contabiliza a natureza diferente dos materiais envolvidos no processo - condutor (eletrodos), semicondutor (revestimento), dielétrico (núcleos de fibra) e eletrolítico (substância circundante) - que são capazes de influenciar o transporte de carga. Esse problema pode ser contabilizado em futuras expansões do modelo, adicionando atrasos na transferência de energia nas interfaces (ou seja, reações farádicas) e atrasos no transporte de íons dentro do eletrólito. A adição de complexidade deve, no entanto, ser guiada pela validação experimental, pois um modelo simples que reproduz a maior parte do que é observado é mais útil do que um notavelmente preciso que adiciona pouco mais informações, mas é profundamente sensível à incerteza de muitos parâmetros constituintes.
Como o objetivo final da engenharia de tecidos é criar bioreatores que não só imitam um ou dois aspectos de ambientes in vivo, mas que replicam e controlam todas as pistas de desenvolvimento celular61,eletromagnéticos e mecânicos em modelos de silico, bem como modelos de transferência de calor entre componentes bioreatores precisarão ser combinados. Em uma fase de modelagem subsequente, fenômenos de acoplamento entre essas interações como aquecimento ómico, fluxo de fluidos eletrolíticos, deformações de andaimes morfológicos em resposta à estimulação elétrica60 e piezoeletricidade62 também podem ser adicionados. No entanto, os modelos só devem ser mesclados após cada um ter sido validado experimentalmente. Dessa forma, podemos obter uma melhor compreensão da influência de cada componente no microambiente celular, e como os estímulos podem ser otimizados.
Se o modelo proposto for validado experimentalmente, pode ser combinado com modelos de células biológicas - Figura 1. Padrões de densidade de carga e modulações podem influenciar assimmetricamente a atividade das bombas de íons específicas, o apego ao impacto à fibra de proteínas que conduzem a adesão da membrana63 e, portanto, orientar a migração, os padrões de proliferação e a morfogênese64. Explorar essas hipóteses é o caminho a seguir na compreensão dos mecanismos que sustentam as respostas teciduais e celulares ao ES.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Programa de Doutorado da Wellcome Trust de 4 anos em Biologia Quantitativa & Biofísica
Materiais
| Name | Company | Catalog Number | Comments |
| Comsol multiphysics 5.2 AC/DC module | COMSOL | - | FEM modelling software |
Referências
- Zhao, S., Mehta, A. S., Zhao, M. Biomedical applications of electrical stimulation. Cellular and Molecular Life Sciences. 77 (14), 2681-2699 (2020).
- Gordon, T. Electrical Stimulation to Enhance Axon Regeneration After Peripheral Nerve Injuries in Animal Models and Humans. Neurotherapeutics. 13 (2), 295-310 (2016).
- Pedrotty, D. M., et al. Engineering skeletal myoblasts: Roles of three-dimensional culture and electrical stimulation. American Journal of Physiology - Heart and Circulatory Physiology. 288, 1620-1626 (2005).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Leppik, L., et al. Combining electrical stimulation and tissue engineering to treat large bone defects in a rat model. Scientific Reports. 8 (1), (2018).
- Du, S., et al. Bioinspired hybrid patches with self-adhesive hydrogel and piezoelectric nanogenerator for promoting skin wound healing. Nano Research. 13 (9), 2525-2533 (2020).
- Gratieri, T., Santer, V., Kalia, Y. N. Basic principles and current status of transcorneal and transscleral iontophoresis. Expert Opinion on Drug Delivery. 14 (9), 1091-1102 (2017).
- Kroeling, P., Gross, A., et al. Electrotherapy for neck pain. Cochrane Database of Systematic Reviews. 2013 (8), (2013).
- Hurlow, A., et al. Transcutaneous electric nerve stimulation (TENS) for cancer pain in adults. Cochrane Database of Systematic Reviews. 2012 (3), (2012).
- Claydon, L. S., Chesterton, L. S., Barlas, P., Sim, J. Dose-specific effects of transcutaneous electrical nerve stimulation (TENS) on experimental pain: A systematic review. Clinical Journal of Pain. 27 (7), 635-647 (2011).
- Sbruzzi, G., Silveira, S. A., Silva, D. V., Coronel, C. C., Plentz, R. D. M. Estimulação elétrica nervosa transcutânea no pós-operatório de cirurgia torácica: Revisão sistemática e metanálise de estudos randomizados. Brazilian Journal of Cardiovascular Surgery. 27 (1), 75-87 (2012).
- Jin, D. M., Xu, Y., Geng, D. F., Yan, T. b. Effect of transcutaneous electrical nerve stimulation on symptomatic diabetic peripheral neuropathy: A meta-analysis of randomized controlled trials. Diabetes Research and Clinical Practice. 89 (1), 10-15 (2010).
- Bjordal, J. M., et al. Short-term efficacy of physical interventions in osteoarthritic knee pain. A systematic review and meta-analysis of randomised placebo-controlled trials. BMC Musculoskeletal Disorders. 8 (1), 51 (2007).
- Johnson, M., Martinson, M. Efficacy of electrical nerve stimulation for chronic musculoskeletal pain: A meta-analysis of randomized controlled trials. Pain. 130 (1-2), 157-165 (2007).
- Johnson, M. I. Transcutaneous Electrical Nerve Stimulation (TENS). eLS. , 1-13 (2012).
- Griffin, M., Bayat, A. Electrical stimulation in bone healing: critical analysis by evaluating levels of evidence. Eplasty. 11, (2011).
- Mollon, B., Da Silva, V., Busse, J. W., Einhorn, T. A., Bhandari, M. Electrical stimulation for long-bone fracture-healing: A meta-analysis of randomized controlled trials. Journal of Bone and Joint Surgery - Series A. 90 (11), 2322-2330 (2008).
- Eberstein, A., Eberstein, S. Electrical stimulation of denervated muscle: Is it worthwhile. Medicine and Science in Sports and Exercise. 28 (12), 1463-1469 (1996).
- Mödlin, M., et al. Electrical stimulation of denervated muscles: First results of a clinical study. Artificial Organs. 29 (3), 203-206 (2005).
- Gordon, T., Amirjani, N., Edwards, D. C., Chan, K. M. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Chan, K. M., Curran, M. W. T., Gordon, T. The use of brief post-surgical low frequency electrical stimulation to enhance nerve regeneration in clinical practice. Journal of Physiology. 594 (13), 3553-3559 (2016).
- Vance, C. G. T., Dailey, D. L., Rakel, B. A., Sluka, K. A. Using TENS for pain control: the state of the evidence. Pain management. 4 (3), 197-209 (2014).
- Peters, E. J., Lavery, L. A., Armstrong, D. G., Fleischli, J. G. Electric stimulation as an adjunct to heal diabetic foot ulcers: A randomized clinical trial. Archives of Physical Medicine and Rehabilitation. 82 (6), 721-725 (2001).
- Lundeberg, T. C. M., Eriksson, S. V., Malm, M. Electrical nerve stimulation improves healing of diabetic ulcers. Annals of Plastic Surgery. 29 (4), 328-331 (1992).
- Houghton, P. E., et al. Electrical Stimulation Therapy Increases Rate of Healing of Pressure Ulcers in Community-Dwelling People With Spinal Cord Injury. Archives of Physical Medicine and Rehabilitation. 91 (5), 669-678 (2010).
- Bikbova, G., Bikbov, M. Standard corneal collagen crosslinking versus transepithelial iontophoresis-assisted corneal crosslinking, 24 months follow-up: randomized control trial. Acta Ophthalmologica. 94 (7), 600-606 (2016).
- Bhavsar, M. B., et al. Electrical stimulation-based bone fracture treatment, if it works so well why do not more surgeons use it. European Journal of Trauma and Emergency Surgery. 46 (2), 245-264 (2020).
- Erickson, C. A., Nuccitelli, R. Embryonic fibroblast motility and orientation can be influenced by physiological electric fields. Journal of Cell Biology. 98 (1), (1984).
- Hammerick, K. E., Longaker, M. T., Prinz, F. B. In vitro effects of direct current electric fields on adipose-derived stromal cells. Biochemical and Biophysical Research Communications. 397 (1), 12-17 (2010).
- Shao, S., et al. Osteoblast function on electrically conductive electrospun PLA/MWCNTs nanofibers. Biomaterials. 32 (11), 2821-2833 (2011).
- Forciniti, L., Ybarra Iii, J., Zaman, M. H., Schmidt, C. E. Schwann cell response on polypyrrole substrates upon electrical stimulation. Acta Biomaterialia. , (2014).
- Kumar, A., Nune, K. C., Misra, R. D. K. Electric field-mediated growth of osteoblasts-the significant impact of dynamic flow of medium. Biomaterials Science. 4 (1), 136-144 (2016).
- Hyun Ko, U., et al. Promotion of Myogenic Maturation by Timely Application of Electric Field Along the Topographical Alignment. Tissue Engineering Part A. 24 (10), 752-760 (2018).
- Lynch, K., Skalli, O., Sabri, F. Growing Neural PC-12 Cell on Crosslinked Silica Aerogels Increases Neurite Extension in the Presence of an Electric Field. Journal of Functional Biomaterials. 9 (2), 30 (2018).
- Balint, R., Cassidy, N. J., Cartmell, S. H. Electrical stimulation: A novel tool for tissue engineering. Tissue Engineering - Part B: Reviews. 19 (1), 48-57 (2013).
- Chen, C., Bai, X., Ding, Y., Lee, I. S. Electrical stimulation as a novel tool for regulating cell behavior in tissue engineering. Biomaterials Research. 23 (1), (2019).
- Purushothaman, A. E., Thakur, K., Kandasubramanian, B. Development of highly porous, Electrostatic force assisted nanofiber fabrication for biological applications. International Journal of Polymeric Materials and Polymeric Biomaterials. 69 (8), 477-504 (2020).
- Yanılmaz, M., Sarac, A. S. A review: Effect of conductive polymers on the conductivities of electrospun mats. Textile Research Journal. 84 (12), 1325-1342 (2014).
- Tsukada, S., Nakashima, H., Torimitsu, K. Conductive polymer combined silk fiber bundle for bioelectrical signal recording. PLoS ONE. 7 (4), 33689 (2012).
- Nguyen, H. T., et al. Electric field stimulation through a biodegradable polypyrrole-co- polycaprolactone substrate enhances neural cell growth. Journal of Biomedical Materials Research - Part A. 102 (8), 2554-2564 (2014).
- Song, J., et al. Polymerizing pyrrole coated poly (l-lactic acid-co-ε-caprolactone) (PLCL) conductive nanofibrous conduit combined with electric stimulation for long-range peripheral nerve regeneration. Frontiers in Molecular Neuroscience. 9, (2016).
- Lee, J. Y., Bashur, C. A., Goldstein, A. S., Schmidt, C. E. Polypyrrole-coated electrospun PLGA nanofibers for neural tissue applications. Biomaterials. 30 (26), 4325-4335 (2009).
- Du, L., et al. Combined effects of electrospun nanofibrous scaffold and electrical field on the neuronal outgrowth. Materials Letters. 256, (2019).
- Theocharis, A. D., Skandalis, S. S., Gialeli, C., Karamanos, N. K. Extracellular matrix structure. Advanced Drug Delivery Reviews. 97, 4-27 (2016).
- Shoulders, M. D., Raines, R. T. Collagen structure and stability. Annual Review of Biochemistry. 78, 929-958 (2009).
- Fang, M., et al. Type i collagen D-spacing in fibril bundles of dermis, tendon, and bone: Bridging between nano- and micro-level tissue hierarchy. ACS Nano. 6 (11), 9503-9514 (2012).
- PETRUSKA, J. A., HODGE, A. J. a Subunit Model for the Tropocollagen Macromolecule. Proceedings of the National Academy of Sciences of the United States ofAmerica. 51 (5), 871-876 (1964).
- Kastelic, J., Galeski, A., Baer, E. The multicomposite structure of tendon. Connective Tissue Research. 6 (1), 11-23 (1978).
- Thorpe, C. T., Birch, H. L., Clegg, P. D., Screen, H. R. C. The role of the non-collagenous matrix in tendon function. International Journal of Experimental Pathology. 94 (4), 248-259 (2013).
- Chapman, G. E., McLauchlan, K. A. The hydration structure of collagen. Proceedings of the Royal Society of London. Series B. Biological Sciences. 173 (31), 223-234 (1969).
- Bardelmeyer, G. H. Electrical conduction in hydrated collagen. I. Conductivity mechanisms. Biopolymers. 12 (10), 2289-2302 (1973).
- Budde, K., et al. Requirements for Documenting Electrical Cell Stimulation Experiments for Replicability and Numerical Modeling. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 1082-1088 (2019).
- Zhao, S., Mehta, A. S., Zhao, M. Biomedical applications of electrical stimulation. Cellular and Molecular Life Sciences. 77 (14), 2681-2699 (2020).
- Zhang, T., Yi, Y. B. Monte Carlo simulations of effective electrical conductivity in short-fiber composites. Journal of Applied Physics. 103 (1), 14910 (2008).
- Meny, I., Burais, N., Buret, F., Nicolas, L. Finite element modeling of cell exposed to harmonic and transient electric fields. 12th Biennial IEEE Conference on Electromagnetic Field Computation, CEFC 2006. 43 (4), 310 (2006).
- Schoenbach, K. H., et al. Ultrashort electrical pulses open a new gateway into biological cells. Proceedings of the IEEE. 92 (7), 1122-1136 (2004).
- Gowrishankar, T. R., Smith, K. C., Weaver, J. C. Transport-based biophysical system models of cells for quantitatively describing responses to electric fields. Proceedings of the IEEE. 101 (2), 505-517 (2013).
- Pietak, A., Levin, M. Exploring instructive physiological signaling with the bioelectric tissue simulation engine. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Babaie, A., et al. Synergistic effects of conductive PVA/PEDOT electrospun scaffolds and electrical stimulation for more effective neural tissue engineering. European Polymer Journal. 140, 110051 (2020).
- Zhou, J., Fukawa, T., Kimura, M. Directional electromechanical properties of PEDOT/PSS films containing aligned electrospun nanofibers. Polymer Journal. 43 (10), 849-854 (2011).
- Castro, N., et al. Physically Active Bioreactors for Tissue Engineering Applications. Advanced Biosystems. 4 (10), 1-29 (2020).
- Ribeiro, S., Gomes, A. C., Etxebarria, I., Lanceros-Méndez, S., Ribeiro, C. Electroactive biomaterial surface engineering effects on muscle cells differentiation. Materials Science and Engineering. , (2018).
- Marzocchi, M., et al. Physical and Electrochemical Properties of PEDOT:PSS as a Tool for Controlling Cell Growth. ACS Applied Materials and Interfaces. 7 (32), 17993-18003 (2015).
- Leronni, A., Bardella, L., Dorfmann, L., Pietak, A., Levin, M. On the coupling of mechanics with bioelectricity and its role in morphogenesis. Journal of the Royal Society Interface. 17 (167), 20200177 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados