Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Indsamling og identifikation af pollen fra honningbikolonier
Vi beskriver metoder til indsamling af korbikulære pollen fra honningbier samt protokoller til farvesortering, acetolyse og mikroskopdiasforberedelse af pollen til taksonomisk identifikation. Derudover præsenterer vi pelletfarve og taksonomisk mangfoldighed af korlikulær pollen indsamlet fra fem afgrødesystemer ved hjælp af pollenfælder.
Forskere indsamler og analyserer ofte korbicular pollen fra honningbier for at identificere de plantekilder, som de foder til pollen eller for at estimere pesticideksponering af bier via pollen. Beskrevet heri er en effektiv pollenfangstmetode til indsamling af korbikulære pollen fra honningbier, der vender tilbage til deres bistader. Denne indsamlingsmetode resulterer i store mængder korbikulært pollen, der kan bruges til forskningsformål. Honningbier indsamler pollen fra mange plantearter, men besøger typisk en art under hver indsamlingsrejse. Derfor repræsenterer hver korlikulær pollenpellet overvejende en planteart, og hver pollenpellet kan beskrives efter farve. Dette gør det muligt at sortere prøver af korbicular pollen efter farve for at adskille plantekilder. Forskere kan yderligere klassificere korlikulær pollen ved at analysere morfologien af acetolyzerede pollenkorn til taksonomisk identifikation. Disse metoder anvendes almindeligvis i undersøgelser relateret til bestøvere såsom bestøvningseffektivitet, bestøverfoderdynamik, diætkvalitet og mangfoldighed. Detaljerede metoder præsenteres for indsamling af korbicular pollen ved hjælp af pollenfælder, sortering af pollen efter farve og acetolyzing pollenkorn. Der præsenteres også resultater vedrørende hyppigheden af pillefarver og taxa af korbicular pollen indsamlet fra honningbier i fem forskellige afgrødesystemer.
Den vestlige honningbi (Apis mellifera L.) er en vigtig bestøver af mange landbrugsafgrøder, der er afhængige af bibestøvning1. I mere end et årti er der rapporteret om betydelige tab af honningbikolonier 2,3,4,5,6,7,8,9. Flere faktorer - herunder parasitter og sygdomme, dårlig ernæring og pesticider - har været impliceret i disse kolonifald10. Dårlig ernæring kan tilskrives landbrugsintensivering og tab af foderhabitat11. Det er bydende nødvendigt at forstå de blomsterressourcer, der anvendes af bier i forskellige landskaber for at forbedre biernes ernæring og hjælpe med at bevare bier. Pollen er den primære kilde til protein, lipider, vitaminer og mineraler til bier og er blevet brugt i mange landbrugs- og økologiske undersøgelser til at forstå honningbiers foderpræferencer på koloniniveau, evaluere virkningen af pollenfangst på honningbikolonier og bestemme pesticideksponering for bier 12,13,14.
Honningbier samler pollen fra blomster, pakker pollen i pellets på deres corbicula - en tibial pollenkurv på bagbenet - og vender tilbage til kolonien til opbevaring. Korlikulær pollen kan fjernes fra foragere ved at fange dem ved bikubeindgangen eller på blomster, afkøle dem kort for at immobilisere dem og derefter fjerne pollenpillerne fra deres bagben med tang. Den besværlige proces med håndopsamling af korbikulære pollen fra individuelt fangede foragere er langsom og ineffektiv, hvis man har brug for en betydelig mængde pollen. En enklere og mere effektiv metode til indsamling af store mængder pollen er ved at fange korbicular pollenpiller fra honningbier ved bikubeindgange. Pollenfælder er designet til at fjerne korbicular pollen fra benene på de tilbagevendende pollenforagere, når de kommer ind i bikuben15. Foragers skal presse gennem maskehuller, der er dimensioneret til snævert at tillade passage af en honningbi-arbejderkrop.
Når honningbien passerer gennem et af disse huller, skrabes de større pollenpiller af hendes ben og falder ned i en opsamlingsbakke16. Undersøgelser har vist, at pollenfangst stimulerer foragere til at indsamle mere pollen og dermed øge bestøvningseffektiviteten af de omkringliggende afgrøder og vegetation 17,18,19,20. Pollen indsamling metoder kan også bruges til at forstå foder anvendes af honningbier i landskabet som det første skridt til at bestemme mængden, kvaliteten og taxa af blomstrende plantearter. Effektive pollenfangstmetoder letter således både bestøvning og honningbi ernæringsforskning. En sammenligning af disse pollenopsamlingsmetoder er illustreret i tabel 1. Pollen fourageringsadfærd vil ændre sig baseret på koloniens behov for lagret pollen i forhold til dens æg- og larverpopulationsniveauer 21,22. Da disse ændringer omfatter varierende indsamlingsintensitet, forventes der ofte stor variation i pollenmængden blandt kolonier på samme sted og mellem forskellige steder af samme afgrødesystem eller landskabstype23,24. Forøgelse af antallet af kolonier og steder at fange pollen vil hjælpe med at imødekomme denne variation.
Pollenfælder varierer i effektivitet 25,26. Størrelsen af pollenpiller indsamlet af honningbier varierer mellem plantearter og kan ændre sig baseret på niveauet af pollenlagre i kolonien27,28. Dette giver mulighed for, at mindre pollenpiller bliver underrepræsenteret, og større pellets bliver overrepræsenteret i prøver indsamlet via pollenfælder. Voksne bier varierer i kropsstørrelse, hvilket også kan påvirke repræsentationen af pollen indsamlet i fælder. Der er også plantearter, der overvejende producerer nektar, der ikke vil blive opdaget, hvis kun vurderer indsamlet pollen i nogle landskaber. Fangsteffektiviteten påvirkes også af foragerdrift og desorientering, som påvirkes af pollenfældetypen og bikubeudstyrets tilstand. Dette problem kan afhjælpes ved at anvende teknikker, der er specificeret i dette papir. Efterforskere kan overveje yderligere forskningsteknikker, såsom at tælle blomsterbesøg af foragere, for at supplere resultaterne af foderpræferencer på koloniniveau. En nyttig metode til vurdering af pollendiversitet er sortering af korbikulære pollen efter farve. Selvom honningbier er generalistiske foragere, udviser de også blomstertroskab, hvor de samler pollen fra de samme plantearter på samme sted under en given indsamlingsrejse. Baseret på denne fourageringsadfærd antages det, at en given korlikulær pollenpellet overvejende er repræsenteret af en enkelt planteart 27,29,30,31. Derfor kan forskere beskrive pollendiversitet ved at sortere korbicular pollen efter pelletfarve og rapportere det samlede antal detekterede farver eller andelen af det samlede antal repræsenteret af hver farvegruppe 12,32,33,34. Dette kan opnås ved at måle masse- eller pellettællingen for hver farvegruppe. Måling af pellettællingen for hver farvegruppe foreslås, hvis der er kendte eller formodede systematiske forskelle i vægten af pellets fra forskellige taxa. Systematiske forskelle kan skyldes pelletstørrelse eller mængden af nektar, som foragere tilføjer pollen, når de danner en pellet.
Farvesortering er en tidseffektiv og enkel proces, men har muligvis ikke acceptabel nøjagtighed for nogle bestøvningsundersøgelser, fordi forskellige plantetaxa kan have lignende pollenpelletfarver35,36. Derudover er der en logistisk grænse for antallet af forskellige farvegrupper pollenpiller kan adskilles i. Således er adskillelsen af hver enkelt plante taxon pollen i sin egen særskilte pelletfarvegruppe ikke altid mulig i bestøvningsundersøgelser. Morfologisk karakterisering af pollenkorn via lysmikroskopi supplerer ofte farveseparation af pellets ved at skelne pollen fra to eller flere taxa i pellets af samme farvegruppe. Selvom det er almindeligt at finde pollenkorn af flere taxa i en given pollenpelletfarvegruppe, omfatter individuelle pollenpellets indsamlet af en honningbi generelt en dominerende taxon, muligvis med andre taxa i mindre mængder. Det er således almindeligt at antage taksonomisk troskab i korbulære pollenpiller af honningbier. Pollenpiller fra andre bestøvere, der ikke udviser blomstertroskabsadfærd, såsom humlebier, vil ofte indeholde mange plantearter og har muligvis ikke en dominerende taxon. I tilfælde, hvor kvantitative estimater af taxaproportioner i polyflorale pollenpellets ønskes, kræves der desuden mikroskopiske metoder, der inkluderer acetolyse, for korrekt analyse.
Vurdering af morfologiske egenskaber ved acetolyserede pollenkorn er den mest almindelige metode til taksonomisk identifikation16. Acetolyseproceduren fjerner pollenkornets protoplasma for at afsløre diagnostiske egenskaber, der kan observeres under lysmikroskopi37,38. Ved hjælp af denne metode kan forskere rapportere forskellige taxa, hyppighed af taxa fundet i specifikke afgrødesystemer og overvejende taxa af pelletfarver33,36. Acetolyse er den bedste analytiske teknik til at afsløre pollenmorfologi28. Imidlertid kan nogle acetolyserede pollenkorn, såsom mange Rosaceae-typer, ikke identificeres til slægts- eller artsniveau gennem acetolyse og lysmikroskopi alene. Forskere overvejer scanning elektronmikroskopi eller metabarkodning som alternative metoder til at opnå identifikation på slægts- eller artsniveau. Disse alternative metoder giver imidlertid kun kvalitativ taxonidentifikation og undlader at estimere andelen af forskellige pollenkorntaxa i polyflorale pollenpellets 36,39. Derudover er udgiften og den nødvendige ekspertise betydeligt højere for disse metoder. En sammenligning af disse identifikationsmetoder er illustreret i tabel 1.
| Metoder | Tidspunkt | Udgift | Opløsning | Ekspertise |
| Pollen indsamling | ||||
| Pollen fangst | Lav | Moderat | Variabel | Moderat |
| Pollen forager indsamling | Høj | Moderat | Høj | Lav |
| Pollen Identifikation | ||||
| Visuel (kun farvesortering) | Moderat | Lav | Lav | Lav |
| Acetolyse | Moderat | Moderat | Moderat | Moderat |
| Scanning elektronmikroskopi | Høj | Høj | Høj | Høj |
| Metabarkodning | Variabel | Høj | Høj | Høj |
Tabel 1: Sammenligning af forskellige metoder til pollenindsamling og identifikation baseret på tid, omkostninger, opløsning og ekspertise. Visuelle metoder (kun farvesortering) rapporterer det samlede antal registrerede farver eller andelen af det samlede antal repræsenteret af hver farvegruppe som en metrik til bestemmelse af pollenkilder, men giver ikke taxonidentifikation.
De tilgængelige oplysninger om fangst og sortering af pollen og acetolyzing pollenkorn er forskellige og spredes ofte over flere kilder, varierende for forskere på forskellige områder. Dette papir giver detaljeret indsigt i forskellige typer pollenfælder, der kan bruges af både forskere og biavlere til effektivt at indsamle store mængder korbikulært pollen. Der findes også protokoller til fremstilling af pollenprøver - ved acetolyse, farvning og diasmontering - til identifikation af plantetaxa. De metoder, der er beskrevet her, er omfattende og tjener som en unik ressource til identifikation af fremherskende plantearter, som honningbier fouragerer på i et givet landskab, især i afgrødesystemer. Resultater baseret på disse metoder fra en tidligere undersøgelse er blevet præsenteret og dokumenterer mangfoldigheden af pollenpelletfarver og plantetaxa fra korbicular pollen indsamlet af honningbier i fem afgrødesystemer14.
1. Indsamling af korbikulære pollen fra honningbikolonier ved hjælp af pollenfælder
- Bestem, hvornår du skal fange pollen fra den ønskede apiary placering.
BEMÆRK: Ideelle klimatiske forhold inkluderer fuld soleksponering, lave vindhastigheder, lav luftfugtighed og ingen forventet nedbør i den ønskede periode for pollenopsamling. - Vælg optimale honningbikolonier til fangst af pollen inden for apiary-placeringen.
- Vurder kolonistyrken ved at tælle foragere, der vender tilbage til koloniindgangen i 2 min. Vælg kolonier med det højeste samlede antal tilbagevendende foragere.
- Vælg bistader med trævarer, der er i god stand, helst uden ekstra indgange og skæve låg. Brug kolonier med færre alternative indgange, da de har øget sandsynligheden for at returnere foragere, der omorienterer sig til fældeindgangen.
- Vælg sydvendte bistadeindgange, når det er muligt. Hvis bistader palleteres, skal du installere pollenfælder på hver koloni, der vender i samme retning på en given palle for at undgå drift af foragere ind i nærliggende bikubeindgange.
- Vurder om ønsket koloniens yngel ved at inspicere rammer for tilstedeværelsen af larver. Vælg kolonier med relativt store mængder larver.
- Installer pollenfælder på de udvalgte honningbikolonier.
BEMÆRK: Installationen vil variere afhængigt af typen af pollenfælde. Typer inkluderer a) frontmonteret, b) bundmontering, c) topmontering eller d) indgangsbeslag til sneglehul. Se diskussionsafsnittet for at få flere oplysninger.- For frontmonterede fælder skal du fastgøre fælden foran indgangen med hæfteklammer, skruer og tape eller forbinde fælden til bungee-ledninger viklet rundt om bikuben. For bundmonterede fælder skal du placere fælden under den laveste bikubekasse og fastgøre fældeindgangen nær den oprindelige indgang. For sneglehulsmonteringsfælder skal du fastgøre fælden direkte foran et sneglehul i en bikubekasse ved hjælp af hæfteklammer, skruer og tape. For topmonterede fælder skal du placere fælden over den øverste bikubekasse og under låget.
- Forsegl alle andre mulige indgange til kolonien ved hjælp af ikke-klæbende og formbart materiale, såsom latex eller polyurethanskum, eller # 8 hardware klud (2,7 mm blænde) til sneglehuller. Brug tape til små revner.
- Hvis du bruger frontmonterede fælder, skal du placere en barriere, såsom en gummimåtte, mellem opsamlingskurven og græsset for at undgå fugtskader fra dug.
- Tænd pollenfældens fangstmekanisme 24 timer efter installationen, og før dagens fourageringsflyvning begynder (sen aften/tidlig morgen).
BEMÆRK: Dette trin er ideelt, men ikke nødvendigt. Engager pollenfælder hver anden uge, hvis du fanger pollen på de samme kolonier i en given periode. - Saml korlikulær pollen fra opsamlingsbakken, læg den i plastikposer eller centrifugerør, og opbevar i en køler med is.
- For at vurdere mangfoldigheden og overfloden af pollenarter, f.eks. ernæringsundersøgelser på landskabsniveau, skal du indsamle pollen i to eller tre 72 timers intervaller40.
- Til analyse af pesticidrester indsamles pollen i intervaller på 24 timer til 96 timer med mindst 3 g til behandling af41.
- Rengør pollen ved at fjerne bi-dele og andet bikubeaffald.
BEMÆRK: Brug engangshandsker ved håndtering af pollenprøver, og skift engangshandsker mellem prøverne. Brug separate værktøjer til at fjerne snavs fra pollen opsamlet i hver fælde. Skyl og tør, inden du bruger værktøjerne til endnu et parti fanget pollen. - Pollen opbevares ved -20 °C eller derunder for at bevare dets integritet i sammensætningen, hvis pollen er bestemt til identifikation af pollenkilder, mængdevurdering eller analyser af pesticidrester41,42.
- Når du har fjernet fælderne fra nældefeber, skal du sterilisere alt udstyr i en 5% blegemiddelopløsning, skylle og tørre udstyret inden næste brug.
2. Pollenpellet farvesortering til identifikation af nedstrøms pollenkilde og mængdevurdering
- Sørg for, at der er mindst 20 g pollenprøve at arbejde med. Bland pollenprøven grundigt i posen eller en anden beholder af passende størrelse for at opnå en homogen blanding af alle pellets indeholdt deri. For at undgå utilsigtet bias i det næste trin skal du skjule prøvens farvesammensætning fra visningen, før du fjerner en delprøve fra prøveposen.
- Brug en scooper eller stor ske, scoop ud 10 g pollen som en repræsentativ delprøve af det hele. Hæld langsomt pellets ud af scooperen på balancen, indtil displayet læser 10 g. Hvis den første scoop ikke var stor nok, skal du hente en anden scoop fra prøven på samme måde.
BEMÆRK: Disse specificerede vægtkrav (20 g og 10 g) tjener kun som eksempler. Forskere bør justere mængden af pollen, der anvendes i hvert trin efter behov. - Fjern alle bi-dele og andet affald fra 10 g-delstikprøven. Derefter tilsættes om nødvendigt lidt mere pollen fra den oprindelige prøve for at opnå en samlet vægt på 10 g af delprøven.
- Sorter hver pollenpellet fra 10 g delprøven i en farvegruppe. Brug både pollenfarve og tekstur til at skelne mellem farvegrupper.
BEMÆRK: Der forventes en vis variation inden for en gruppe, men brug af Pantone-farveguiden under sortering kan øge konsistensen. - For at sikre mindst 0,25 g af hver farvegruppe til nedstrøms trin skal du placere pellets, der ikke er rigelige nok til at danne en farvegruppe på mindst 0,25 g i en diverse gruppe. Navngiv hver enkelt farvegruppe ved hjælp af Pantone-farveguiden. Mærk diverse gruppe diverse.
- Vej hver farvegruppe på et separat vejepapir, og/eller tæl antallet af pellets i hver farvegruppe. Registrere farvegruppenavne og -vægte eller -tal på et dataark.
BEMÆRK: At vælge, om antallet af pellets i hver farvegruppe skal vejes eller tælles, afhænger af forskerens interesse og projektmål. - Opret en mikrocentrifugerøretiket for hver farvegruppe ved hjælp af en opløsningsmiddelbestandig pen og klæbende papirrøretiketter. Medtag dags dato, eksempel-id, prøveindsamlingsdato og farvegruppenummer i etiketten. Påfør etiketterne på rene, tørre 2 ml mikrocentrifugerør.
- Afveje 0,25 g (± 0,05 g) pollenpiller fra hver farvegruppe, og anbring denne mængde i det passende mærkede mikrocentrifugerør.
BEMÆRK: Hvis der er en lille variation i farve eller tekstur i pollen i en given farvegruppe, skal du sikre dig, at der er en repræsentativ prøve af pellets i hvert rør. Reagensvolumenerne og inkubations- og centrifugeringstiderne, der følger, er passende for 0,25 g pollen. Brug derfor denne mængde pollen i mikrocentrifugerørene, der skal bruges til acetolyse. Denne protokol skal give rigelig, farvet pollen til identifikation af nedstrøms plantekilde ved lysmikroskopi. Hvis der anvendes en anden mængde pollen i acetolyse, skal specifikationerne for reagensvolumen og behandlingstider justeres i overensstemmelse hermed. - Anbring de resterende pollen fra hver farvegruppe i individuelle plastposer (en pose pr. Farve) mærket med farvegruppenavnet. Disse poser opbevares sammen med de øvrige dele af den relevante originale prøve i et lager på -20 °C.
- Bland pollen grundigt i røret med et rent trætandstikker i 10 til 15 s.
3. Forberedelse til acetolyse
- Før du begynder nogen del af acetolyse for første gang, skal du kontakte den udpegede institutions afdeling for miljøsundhed og sikkerhed (EHS) for instruktioner om, hvordan acetolyserelaterede reagenser og affald skal håndteres.
- Få stamopløsninger af følgende reagenser, og læg dem i stinkhætten i overensstemmelse med EHS-retningslinjerne for kemisk opbevaring: 95% ethanol; destilleret vand; iseddike, vandfri; koncentreret svovlsyre; Glycerin; og klar neglelak.
- Forbered stamopløsninger af følgende reagenser, og læg dem i røghætten i overensstemmelse med EHS-retningslinjerne for kemisk opbevaring: mættet natriumbicarbonat (8% w / v opløsning i destilleret vand); og safranin O (1% w/v opløsning i 50% ethanol).
4. Acetolyse
- Udfør præ-acetolyseproceduren for iseddikevask. Udfør følgende trin i stinkhætten med kittel, øjenbeskyttelse og nitrilhandsker.
- Drej en varmeblok til 80 °C.
BEMÆRK: Sørg for, at en klemmeflaske mættet natriumbicarbonat er let tilgængelig. Dette kan bruges til at neutralisere syreudslip i røghætten, hvis de opstår. - Mærk et glasbægerglas til surt affald, et til ethanolaffald og et til acetolyseblanding.
- Ved hjælp af tidligere tilberedte stamopløsninger fremstilles arbejdsalkoter af følgende reagenser i mærkede glasbægre i passende størrelse: ~ 23,0 ml iseddike; ~ 33,0 ml destilleret vand; ~ 23,0 ml 95% ethanol; ~ 25,0 ml natriumbicarbonat (til syreforurenet fast affald).
BEMÆRK: Dette er de mængder, der kræves for at gennemføre følgende acetolyseprocedurer på i alt 10 farvegruppeprøver (10 mikrocentrifugerør). - Langsomt tilsættes 500 μL iseddike til hvert mikrocentrifugerør indeholdende 0,25 g farvegruppepollen. Mens du visuelt inspicerer røret, skal du røre pollen med et rent tandstikker i 10-15 s og sikre, at indholdet af røret blandes grundigt. Anbring det brugte tandstikker i natriumbicarbonataffaldsbægerglasset efter brug. gentag denne proces for hvert rør.
BEMÆRK: Brug en ren, ny tandstikker til hvert rør. Sørg for, at hvert rørs låg er tæt lukket. - Prøverne centrifugeres i 3 minutter ved 1.100 × g. Supernatanten dekanteres fra rørene og ind i det sure affaldsbægerglas. Rør derefter blidt og kort ved rørets åbne mund med et rent papirhåndklæde for at fjerne resterende iseddike omkring rørets kant.
BEMÆRK: Pas på ikke at miste pollenpillen, når du dekanterer supernatanter.
- Drej en varmeblok til 80 °C.
- Udfør acetolyseproceduren.
BEMÆRK: Udfør følgende trin i røghætten med kittel, øjenbeskyttelse og butylvinylhandsker.- Acetolyseblandingen (9:1 iseddike: svovlsyre) fremstilles ved først at tilsætte 10,8 ml iseddike (fra arbejdsalfitet) til bægerglasset mærket acetolyseblanding. Derefter tilsættes langsomt 1200 μL (1,2 ml) koncentreret svovlsyre fra stamopløsningen til acetolyseblandingens bægerglas indeholdende iseddike ved hjælp af en 1000 μL pipette forsynet med 1250 μL filtrerede pipettespidser. Hæld den brugte pipettespids i bægerglasset af natriumbicarbonat.
BEMÆRK: Acetolyseblandingsbægerglasset kan blive varmt at røre ved, og blandingen kan blive gul. Der er to muligheder, der får blandingen til at blive en mørk farve: (a) reagenserne kan være forbi deres udløbsdatoer, eller (b) for meget svovlsyre kan være tilsat. Under alle omstændigheder, hvis blandingen bliver mørk, kasseres den i det sure affaldsbægerglas og tilbered en frisk acetolyseblanding. - Rør forsigtigt acetolyseblandingen med en glasstang eller trærørepind for at sikre, at den er homogeniseret. Anbring den brugte stang/pind i bægerglasset af natriumbicarbonat.
- Ved hjælp af en 1000 μL pipette med 1250 μL filtrerede pipettespidser tilsættes langsomt 1000 μL acetolyseblanding fra bægerglasset til hvert rør. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt. Anbring det brugte tandstikker i natriumbicarbonataffaldsbægeret efter brug.
BEMÆRK: Brug en ren, ny tandstikker til hver prøve. - Prøverne anbringes på den forvarmede (80 °C) varmeblok. Inkuber rørene i 5 minutter, omrør hvert rør grundigt med et rent tandstikker halvvejs gennem inkubation. Anbring hvert brugt tandstikker i bægerglasset af natriumbicarbonat efter brug.
BEMÆRK: Efterlad ikke tandstikkere i prøverne; syren vil opløse dem.
- Acetolyseblandingen (9:1 iseddike: svovlsyre) fremstilles ved først at tilsætte 10,8 ml iseddike (fra arbejdsalfitet) til bægerglasset mærket acetolyseblanding. Derefter tilsættes langsomt 1200 μL (1,2 ml) koncentreret svovlsyre fra stamopløsningen til acetolyseblandingens bægerglas indeholdende iseddike ved hjælp af en 1000 μL pipette forsynet med 1250 μL filtrerede pipettespidser. Hæld den brugte pipettespids i bægerglasset af natriumbicarbonat.
- Udfør post-acetolyse iseddikevaskproceduren.
BEMÆRK: Udfør følgende trin i stinkhætten med kittel, øjenbeskyttelse og butylvinylhandsker.- Langsomt tilsættes 500 μL iseddike til hvert rør. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt. Anbring det brugte tandstikker i bægerglasset af natriumbicarbonat efter brug.
BEMÆRK: Brug en ren, ny tandstikker til hver prøve. Sørg for, at hvert rørs låg er tæt lukket. - Prøverne centrifugeres i 3 minutter ved 1.100 × g. Supernatanten fra hvert rør dekanteres i det sure affaldsbægerglas. Rør derefter blidt og kort ved rørets åbne mund med et rent papirhåndklæde for at fjerne resterende syre omkring rørets kant.
- Skyl butylvinylhandskerne grundigt under rindende vand i mindst 30 s, fjern dem, og sæt dem til tørre.
BEMÆRK: Følg producentens retningslinjer for genbrug af butylvinylhandsker.
- Langsomt tilsættes 500 μL iseddike til hvert rør. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt. Anbring det brugte tandstikker i bægerglasset af natriumbicarbonat efter brug.
- Udfør tre vandskylninger for hver prøve. Udfør følgende trin i stinkhætten med kittel, øjenbeskyttelse og nitrilhandsker.
- Der tilsættes 1000 μL destilleret vand fra det destillerede bægerglas til hvert rør. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt. Anbring tandstikkeren i natriumbicarbonataffaldsbægeret efter brug.
BEMÆRK: Brug en ren, ny tandstikker til hver prøve. Sørg for, at hvert rørs låg er tæt lukket. - Prøverne centrifugeres i 3 minutter ved 1.100 × g. Supernatanten fra rørene dekanteres i bægerglasset af natriumbicarbonat. Rør derefter forsigtigt ved rørets åbne mund med et rent papirhåndklæde for at fjerne resterende vand omkring rørets kant.
- Trin 4.4.1-4.4.2 gentages to gange for i alt tre vandskylninger.
- Der tilsættes 1000 μL destilleret vand fra det destillerede bægerglas til hvert rør. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt. Anbring tandstikkeren i natriumbicarbonataffaldsbægeret efter brug.
- Udfør ethanolskylningen for hver prøve.
BEMÆRK: Udfør følgende trin i stinkhætten med kittel, øjenbeskyttelse og nitrilhandsker.- Ved hjælp af en 1000 μL pipette med 1250 μL filtrerede pipettespidser tilsættes 1000 μL 95 % ethanol fra ethanolbægerglasset til hvert rør. Bortsmid pipettespidsen i ikke-farligt affald. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt.
BEMÆRK: Anbring tandstikkeren i natriumbicarbonataffaldsbægeret efter brug. Brug en ren, ny tandstikker til hver prøve. Sørg for, at hvert rørs låg er tæt lukket. - Prøverne centrifugeres i 3 minutter ved 1.100 × g. Supernatanten fra rørene dekanteres i ethanolaffaldsbægerglasset, og rør blidt ved rørets åbne mund med et rent papirhåndklæde for at fjerne resterende ethanol fra røret.
- Ved hjælp af en 1000 μL pipette med 1250 μL filtrerede pipettespidser tilsættes 1000 μL 95 % ethanol fra ethanolbægerglasset til hvert rør. Bortsmid pipettespidsen i ikke-farligt affald. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt.
- Brug kittel, øjenbeskyttelse og nitrilhandsker til at plette prøver. Bland Safranin O-pletopløsningen ved hjælp af skånsom inversion.
- Brug en engangsplastoverførselspipette til at tilsætte 5-10 dråber Safranin O-plet til hvert rør. Mens du visuelt inspicerer røret, omrøres med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt. Lad tandstikkeren stå i røret.
- Ved hjælp af en 1000 μL pipette med 1250 μL filtrerede pipettespidser tilsættes 1000 μL 95 % ethanol fra ethanolbægerglasset til hvert rør. Bortsmid pipettespidsen i ikke-farligt affald. Mens du visuelt inspicerer røret, skal du røre med tandstikkeren i 10-15 s og sikre, at indholdet af røret blandes grundigt. Anbring den brugte tandstikker i det ikke-farlige affald efter brug.
- Sørg for, at hvert rørs låg er tæt lukket. Centrifuger i 3 minutter ved 1.100 × g. Supernatanten dekanteres i ethanolbægerglasset.
BEMÆRK: Rør ikke ved rørets mund med et papirhåndklæde denne gang. - Tilsæt 10-15 dråber glycerin til hvert rør ved hjælp af en engangsoverførselspipette af plast. Mens du visuelt inspicerer røret, skal du røre rørets indhold med et rent tandstikker i 10-15 s og sikre, at indholdet af røret blandes grundigt.
BEMÆRK: Anbring den brugte tandstikker i det ikke-farlige affald efter brug. Brug en ren, ny tandstikker til hver prøve. Sørg for, at alle røretiketter er læselige.
- Lad rørene stå åbne i røghætten for at fordampe ethanolen i mindst 2 timer ved omgivelsesrumstemperatur. Kontroller prøverne for ethanollugt: Hvis det kan påvises, er prøverne ikke klar og skal lades tørre, indtil ethanollugten forsvinder.
- Rengør alle materialer, og bortskaf affald. Sluk for både centrifugen og varmeblokken. Bortskaf alt fast og flydende affald i overensstemmelse med den udpegede institutions miljømæssige sundheds- og sikkerhedsretningslinjer.
- Forbered mikroskop dias til pollen identifikation; mærk dem læseligt. Mærk et rent glasmikroskopglas passende for hver farvegruppe / prøve, der skal monteres. Mens du visuelt inspicerer røret, omrøres prøven med et rent tandstikker i 10-15 s, og sørg for, at indholdet af røret blandes grundigt.
BEMÆRK: Slide forberedelse kan udføres på laboratoriebænken. Kassér tandstikkeren i ikke-farligt affald. Brug en ren, ny tandstikker til hver prøve.- Brug en ren engangsplastoverførselspipette til at fjerne 1 dråbe pollenrester fra et rør og placere det i midten af det mærkede mikroskopglas. Lad dråben sprede sig lidt. Placer en ren dækslip over dråben på diaset.
- Når diaset er tørret, forsegles dækslippen til diaset med klar neglelak. Placer en lille dråbe polering på hvert hjørne af dækslippen, og mal en kant af polering omkring omkredsen af dækslippen, hvor den møder diaset. Lad neglelakken tørre helt, og mal et andet lag polering omkring dækslippens omkreds.
En tidligere undersøgelse rapporterede vurderingen af mangfoldigheden af pollen indsamlet af honningbier i følgende landbrugsafgrøder: mandel, kirsebær, highbush blåbær, hybrid gulerod og meadowfoam14. Ved hjælp af de beskrevne metoder blev korlikulær pollen indsamlet, sorteret efter farve, og plantekilderne til hver pelletfarvegruppe identificeret for at vurdere pollendiversiteten. Bundmonterede pollenfælder blev installeret på kolonier flere steder for hver afgrøde (figur 1A). Mængden af pollen indsamlet fra hvert sted var tilstrækkelig til at opfylde prøvevægtkravene til farvesorterings- og acetolyseanalysemetoderne. Hver pollenindsamlingsprøve havde flere skelnelige farvegrupper (figur 2 og figur 3). I nogle prøver indeholdt pollenfarvegrupper så få som 4-5 pellets; de fleste grupper havde dog betydeligt mere end det og fungerede således som deres egen mærkede farvegruppe for acetolyse (figur 4 og figur 5). Efter acetolyse (figur 6) blev lysfeltsmikroskopi brugt til effektivt at identificere hver farvegruppe til sin lavest mulige taksonomiske rang ved at bekræfte de morfologiske egenskaber med dem for kuponprøver indsamlet fra området omkring hvert undersøgelsessted (figur 7).

Figur 1: Pollenfælder installeret på en honningbikoloni for at opsamle korbikulært pollen. (A) Bundmonterede fælder placeret over bikubens bundplade og direkte over den laveste bikubekasse. Andre pollenfælder omfatter (B) frontmonterede og (C) indgangsbeslagfælder til sneglehul. Klik her for at se en større version af denne figur.

Figur 2: Fangstmekanisme og opsamlingsbakke med pollenfælde. Tilbagevendende pollenforagere skal presse gennem maskefangstmekanismen, inden de når deres bikube. Klik her for at se en større version af denne figur.

Figur 3: Opsamlingsbakke med pollenfælde. Korbicular pollen skrabes af benene på tilbagevendende pollenforagere ved pollenfælden og falder i opsamlingsbakken. Klik her for at se en større version af denne figur.

Figur 4: Sortering af en prøve af korbicular pollen i farvegrupper. Korbicular pollen kan tørres og vejes, efter at det er sorteret i farvegrupper for at rapportere proportioner af forskellige farve pellets indsamlet. Klik her for at se en større version af denne figur.

Figur 5: Fire grupper af pollenpiller sorteret efter farve ved hjælp af Pantone farveguiden. Farvegrupperne er mærket som (A) grå, Pantone 5855C, (B) brun, Pantone 7557C, (C) gul, Pantone 458C og (D) lysebrun, Pantone 3547C. Klik her for at se en større version af denne figur.
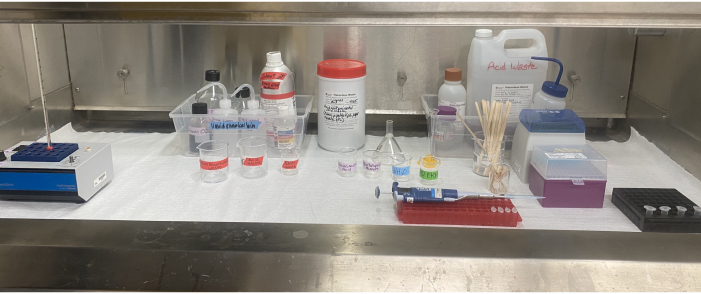
Figur 6: Opsætning af acetolyseudstyr inde i røghætten. Varmeblokken, reagenser, beholdere til affald af opløsningsmidler og syreaffald, mærkede bægerglas, pipette, pipettespidser, rørepinde og mikrocentrifugerør placeret inde i røghætten. Klik her for at se en større version af denne figur.
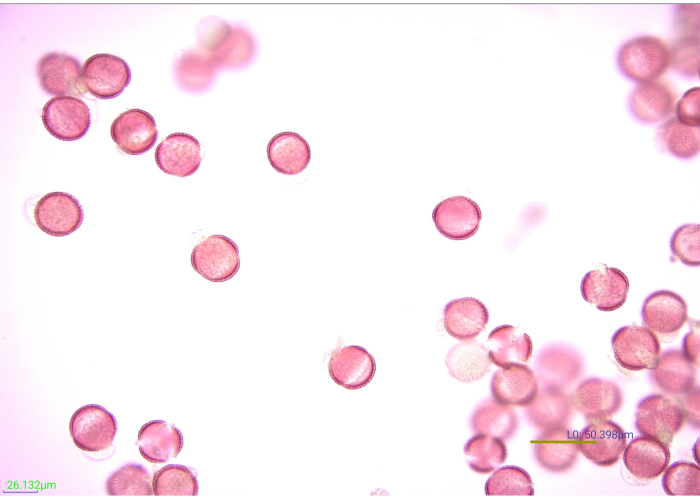
Figur 7: Mikrograf af farvede, acetolyserede pollenkorn. Mange facetter af acetolyzed sennep (Brassicaceae) pollenkorn ved 40x forstørrelse. Skalabjælke = 50.398 μm. Klik her for at se en større version af denne figur.
Pollen indsamlet fra mandelafgrøder havde relativt lavere pollendiversitet end pollen indsamlet fra andre afgrøder, med et gennemsnit på 3,0 ± 0,5 pelletfarver og 3,2 ± 1,2 plantetaxa pr. Sted (tabel 2)14. De resterende fire afgrødesystemer havde højere pollendiversitetsniveauer med et gennemsnit på 6,0 ± 2,0 pillefarver og 8,0 ± 1,5 plantetaxa pr. sted i kirsebær, 8,8 ± 1,4 pillefarver og 13,5 ± 2,0 plantetaxa pr. sted i højbusk blåbær, 7,0 ± 1,0 pillefarver og 11,0 ± 0,0 plantetaxa pr. sted i hybrid gulerod og 10,0 ± 0,0 pillefarver og 13,0 ± 1,5 plantetaxa pr. sted i engrød14.
| Afgrøde | Gennemsnitligt antal pollenpelletfarver/-sted (SE) | Gennemsnitligt antal plantetaxa/anlæg (SE) | Samlet antal konstaterede systematiske enheder | ||
| Familie | Slægt | Art | |||
| Mandel | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| Blåbær | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| Gulerod | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| Kirsebær | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| Enghøj | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
Tabel 2: Mangfoldighed af korbikulære pollen indsamlet fra honningbier i fem dyrkningssystemer. Mangfoldighedsmålinger inkluderer gennemsnitligt antal pelletfarver (± SE), gennemsnitligt antal plantetaxa (± SE) og samlet identificeret taxa. Denne tabel er blevet ændret fra14. Forkortelse: SE = standardfejl.
Forskellige pollenfælde stilarter har deres egne fordele og konsekvenser. Fordelene og begrænsningerne ved fire almindeligt anvendte fældestilarter, (1) frontmonterede, (2) bundmonterede, (3) sneglehul og (4) topmonterede pollenfælder diskuteres nedenfor. Frontmonterede fælder er den mest alsidige stil (figur 1B). Installationen er hurtig og nem; det kan gøres uden at løfte bikubekasser, og disse fælder kan passe på enhver Langstroth-stil af bikubeudstyr. Da opsamlingsbakken sidder foran kolonien, samler den minimalt affald fra kolonien. Opsamlingsbakken er dog også mere udsat for eksterne elementer - fugt fra markvanding, regnfuldt eller fugtigt vejr, eller dug kan komme i kontakt med pollen gennem opsamlingsbakken, hvilket potentielt gør pollen ubrugelig, hvis pellets bliver for mættede til at adskille. Risikoen for pollenmætning kan reduceres ved at undgå fangst under forventede regnhændelser eller høj luftfugtighed. Placering af en gummimåtte under fælden og ekstra dækmateriale (f.eks. Tagpap) oven på pollenfælden kan også beskytte opsamlingsbakken mod vejret.
Bundmonterede fælder blev brugt til at indsamle pollen til dataene i dette papir (figur 1A). De er ikke så bekvemme at installere, fordi de skal placeres under koloniens yngel. Installationen er tidskrævende og resulterer i, at en stor mængde affald falder i fælden fra kolonien, såsom bi-dele og små stykker voks. Gulvet i opsamlingsbakken til de fleste fremstillede bundmonterede fælder er lavet af fint mesh, hvilket muliggør korrekt ventilation for at beskytte den opsamlede pollen mod fugt. Sneglehul pollenfælder hjælper med at minimere desorientering af foragere, hvis de primært bruger sneglehuller som bikubeindgange i stedet for indgangen lavet af bikubens bundplade (figur 1C). Da opsamlingsbakken til sneglehul pollenfælder er meget lille, skal den tømmes ofte for at undgå overfyldning af opsamlingsbakken. I betragtning af sin øverste placering på en bikube er den topmonterede pollenfælde den nemmeste fældestil at installere og fjerne, og den indsamlede pollenprøve er fri for bikubeaffald. Denne fældestil er dog ekstra følsom over for beskadiget bikubeudstyr, da opsamlingsbakken vil blive udsat for fugt, hvis låget, det indre dæksel og den øverste bikubekasse ikke er ordentligt forseglet sammen.
De heri beskrevne protokoller opfordrer til udvælgelse af kolonier med store voksen- og larvepopulationer (trin 1.2). Denne udvælgelsesmetode er beregnet til at producere meget store mængder fanget pollen fra disse kolonier. Kolonier med betydelige fourageringspopulationer kan opleve stor overbelastning ved indgangen ved fældeinstallation. Valg af en stor bikubeindgang vil afhjælpe overbelastning. Store fourageringspopulationer kan også indsamle meget store mængder pollen, der kan overskride grænserne for opsamlingsbakken. Brug voluminøse opsamlingsbakker, som det ses med de fleste bund- eller topmonterede fældestilarter, og tomme bakker ofte for at rumme store mængder fanget pollen. Hvis det ønskede forskningsmål er at vurdere pollenmængder indsamlet af kolonier i en bigård, skal du vælge repræsentative kolonier i stedet for at optimere voksen- og larvepopulationerne til udvælgelse. Alle stilarter af pollenfælder blokerer bikubeindgangen og skaber en ny indgang, der adskiller sig rumligt fra den oprindelige indgang16. Pollenfælder undlader normalt at indsamle pollen, når foragere ikke er i stand til at omorientere sig til den nye indgang til pollenfælden ved installationen. Disse foragere driver let til nærliggende bistader, hvilket potentielt krydsforurener andre pollenopsamlingsprøver, hvis de kommer ind i en anden bikube med en pollenfælde. Derfor bør foragere have mindst 24 timer til at akklimatisere sig til den nye indgang ved at holde fangstmekanismen frakoblet efter installationen. Valg af kolonier med få eller ingen ekstra bistadeindgange reducerer også forvirring, når man orienterer sig mod den nye pollenfældeindgang.
Yderligere bistadeindgange (f.eks. Huller og skæve låg) bør forsegles, men risikoen for, at foragere driver til nabostader, vil stige med disse indgange til stede i starten af fældeinstallationen. Foragere vil også let drive ind i andre bikubeindgange, hvis en pollenfælde kun er installeret på en enkelt bikube i en klynge af palleterede bistader. Foragere er mindre tilbøjelige til at drive, hvis alle nældefeber, der vender i samme retning på pallen, har fælder installeret. Topmonterede pollenfælder kan udgøre en højere risiko for bidrift på grund af den betydelige afstand mellem pollenfældeindgangen og bikubens oprindelige indgang. Til denne undersøgelse blev pollenfælder installeret på flere honningbikolonier på hvert forsøgssted for at tage højde for variation i pollenmængde og taxasammensætning mellem hver honningbikoloni. Pollenfælder bør derfor installeres på flere kolonier for at opnå robuste pollensamlinger fra landskabet, fordi pollenindsamling kan variere meget mellem kolonier baseret på planteartstype og samlet indsamlet mængde12,13. Hver pollenprøve havde en 7-dages indsamlingsperiode. I fremtidige undersøgelser vil indsamling af pollen i to eller tre på hinanden følgende 72 timers intervaller øge nøjagtigheden af pollenfoderestimering40.
Da der er en høj grad af tidsmæssig udsving i pollenindsamling, kan pollenestimeringsnøjagtigheden øges ved at gentage pollenopsamlingsprocessen i tidlige, spidse og sene blomstringsperioder i de målrettede afgrødesystemer 24,27,39. Pollen bør indsamles fra flere steder, omend det samme afgrødesystem eller landskabstype, på grund af forventet variation i mængde og planteartstype mellem bigårdssteder 14,27,33,43. Langsigtet pollenfangst kan være skadelig for honningbikolonier. Potentielle virkninger omfatter reduceret opdræt af yngel, forkortelse af larvevækstperioden og kannibalisme af æg og unge larver i bistaderne 19,44,45,46. Længere perioder med pollenfangst, såsom hele vækstsæsonen, kan forværre de skadelige virkninger på opdræt af yngel i kolonier. Pollenfangst kan også medføre en reduktion i honningproduktionen og en stigning i fugtighedsniveauet for lagret honning13. Roterende pollenfælder mellem kolonier i en bigård, når man løbende overvåger et landskab eller afgrødesystem, kan afbøde skader på kolonier, der anvendes til pollenfangst. Engagerende pollenfælder hver anden uge vil reducere skadelige virkninger, især tab i honningproduktion, hvis man fanger pollen på de samme kolonier i en periode13.
Derudover placeres pollenfælderne fortrinsvis på stærke kolonier. Lejlighedsvis kan pollenfælderne engagere sig utilsigtet. Dette kan undgås ved at låse pollenfældemekanismen, når indsamling af pollenfælder ikke ønskes. Pollenfælder fjerner ikke alle korlikulære pollen fra honningbi-foragere. Fangsteffektivitet afhænger af fældetype, pollenpelletstørrelse, bi-kropsstørrelse, tidspunktet på dagen og vejrforholdene. Derfor er korbicular pollenindsamling ikke konsekvent, når man bruger pollenfælder til forskellige plantearter og indsamlingsperioder25,26. Mindre pollenpiller fra planter som Eucalyptus spp. og Tamarix spp. er mindre tilbøjelige til at blive fanget af pollenfælder27. Især blev der ikke fundet nogen highbush blåbær (Vaccinium corymbosum L.) pollen fra highbush blåbær indsamlingssteder i denne undersøgelse, som understøtter tidligere beviser for, at highbush blåbær pollen pellets er for små til pollenfælde indsamling47. I modsætning hertil blev pollen hentet fra mælkebøtte (Taraxacum officinale F.H. Wigg) fundet i hvert afgrødesystem i denne undersøgelse. Pollenpiller af nogle plantearter kan også være meget større end andre, såsom Taraxacum spp., og kan muligvis være overrepræsenteret i analysen af pollenopsamling fra pollenfælder27. Indfangning af individuelle pollenforagere og manuel fjernelse af deres korbicular pollen vil øge nøjagtigheden af en pollenkildevurdering, men det er meget tids- og ressourcekrævende sammenlignet med at bruge pollenfælder (tabel 1). Sortering af pollenpiller i farvegrupper er relativt ligetil, selvom det er tidskrævende. Medmindre der er et specifikt forskningsmål eller mål, bør mængden af pollenpiller begrænses til 10 g eller mindre (for en given prøve) til sortering i farvegrupper. Sortering af hele prøver, der indeholder større mængder end denne mængde, vil drastisk øge den tid, der kræves for at fuldføre analysen. Det er dog afgørende, at en pollenprøve er meget godt blandet, før der tages en delprøve til farvesortering fra den. Hvis den oprindelige prøve ikke blandes, kan det resultere i en delstikprøve, der ikke er repræsentativ for helheden, hvilket bør undgås.
Hvis den oprindelige prøvebeholder ikke indeholder tilstrækkelig ledig plads til at muliggøre en grundig blanding af pollenpiller, bør det være tilstrækkeligt at anbringe hele prøven i en stor plastpose eller en lille papirpose, selv for store prøver. Hård plast, lågbeholdere fungerer også. Blanding af prøven skal ske forsigtigt, så pollenpiller ikke klemmes eller på anden måde ødelægges. Utilsigtet bias kunne ubevidst overtale en til at øse "de smukke lilla pellets" ud, for eksempel når man fjerner en delprøve fra helheden. Derfor skal prøvens farvesammensætning skjules for visning, mens der øses en delprøve ud. På denne måde er det mere sandsynligt at få en delprøve, der virkelig er repræsentativ for helheden. Denne delprøvemetode kan imidlertid ikke vælge pollenpiller, der er i lav overflod i prøven. Derfor, hvis det er et forskningsmål at identificere hver enkelt plante taxon repræsenteret i prøven, vil det ikke være hensigtsmæssigt at indsamle en delprøve; hele prøven skal analyseres. Derfor skal pellets sorteres i en glas petriskål. Når sorteringen er afsluttet, kan passende sider i Pantone-farveguiden placeres under skålen for at gøre farvetilpasning mellem guiden og den sorterede pollen lettere. Et eksempel herpå er illustreret i figur 5.
Ved fangst af pollen fra honningbikolonier placeret i afgrøder til bestøvning bør der ikke anvendes mere end ti samlede farvegrupper: ni individuelle farver og en "diverse" farvegruppe sammensat af minoritetsfarverne i prøven. At sætte en rimelig grænse for det maksimale antal farvegrupper, som en prøve kan opdeles i, forhindrer forskeren i at gå i stå ved uendeligt at adskille pellets i et stadigt stigende antal ekstremt specifikke grupper, som, når sorteringen er afsluttet, måske ikke individuelt indeholder tilstrækkelige mængder til acetolyse. Hvis fangst fra kolonier, der sandsynligvis fouragerer fra et meget forskelligt udvalg af plantearter, kan det være nødvendigt med flere farvegrupper, og protokollerne bør optimeres for at afspejle dette krav. Den nuværende undersøgelse fokuserede på pollenprøver indsamlet fra honningbikolonier, der bestøvede afgrøder, og flere taxa blev almindeligvis fundet i en farvegruppe, svarende til tidligere undersøgelser 29,30,31.
Acetolyse opløser lipider, proteiner og organisk affald fra overfladen af pollenkorn og afslører exinens kendetegn, så kornene lettere kan farves og identificeres. Det er en gammel og almindelig metode, der anvendes i mange former for pollenforskning37. De generelle trin er standardiserede; de varierer lidt fra protokol til protokol. Imidlertid kan specifikationerne for centrifugeringshastigheder og -tider, inkubationstemperatur og varighed, pollenmængdedrevne reagensvolumener og endda supernatantfjernelsesmetode (dekantering vs pipettering) muligvis optimeres eksperimentelt i henhold til forskningsmål og til en vis grad de typer pollen, der sandsynligvis vil blive stødt på48. Faktisk kan acetolyse fjerne vigtige diagnostiske tegn af pollen fra nogle taxa som Malvaceae og Orchidaceae38. Derfor er ikke alle pollen modtagelige for standardmetoder til acetolyse. Som nævnt ovenfor blev disse metoder optimeret i denne undersøgelse med det formål at identificere dominerende plantetaxaonkilder til pollen indsamlet af afgrødebestøvende honningbier. Detaljer, der skal overvejes, hvis præcis kvantificering af pollenkorn er en del af undersøgelsen, er ikke blevet behandlet i dette papir.
Brug af opløsningsmidler og syrer kræver omhyggelig planlægning, korrekt personligt beskyttelsesudstyr (PPE) og bortskaffelse af ansvarligt affald (figur 6). Det er afgørende, at forskere bestemmer den korrekte måde at opbevare reagenser på og bortskaffe affald, inden de begynder nogen del af acetolyse. I dette laboratorium anvendes butylhandsker under enhver del af processen, der involverer svovlsyre og endda iseddike, da de har langt bedre nedbrydnings- og gennemtrængningsvurderinger for begge syrer end nitrilhandsker, mens de ikke kompromitterer fingerfærdighed49. Det ville være klogt at konsultere den respektive institutions sikkerhedsretningslinjer for anbefalinger om passende handsker og andre PV49. Tilsætning af iseddike før acetolysetrinnet hjælper med at fjerne eventuel resterende fugt i prøven og forbereder den til den vigtige acetolysereaktion. Iseddike-svovlsyreblandingen i acetolysetrinnet kan reagere voldsomt med vand, hvorfor det er vigtigt, at alt glas og forsyninger er helt tørt, og at al fugt fjernes fra prøven inden acetolyse. Post-acetolysetilsætningen af iseddike fortyndes og neutraliserer acetolyseblandingen.
Ethanol og iseddike kan især opløse blækket på mikrocentrifugerøretiketter, hvis disse reagenser drypper på ydersiden af røret, selv med opløsningsmiddelbestandige penne. Kontroller røretiketterne ofte under hele processen for at være sikker på, at de stadig er læselige. Hvis det er logistisk muligt, kan du overveje at bruge LaserJet-printede etiketter som en beskyttelse mod denne mulighed. Den måde, hvorpå supernatanter dekanteres, vil påvirke, om reagenser dribler ned på ydersiden af mikrocentrifugerørene. Det er vigtigt at dekantere supernatanten med en selvsikker, glat hånd, som følger med praksis. Der skal udvises forsigtighed for at undgå tab af pollenprøver fra centrifugerøret under dekantering. Dekantering for hurtigt risikerer at miste nogle eller alle pollenrester; dekantering for langsomt kan resultere i, at supernatanten løber ned i røret. Selv om en inkubationstemperatur på 100 °C almindeligvis anbefales, kan pollen let blive "overstegt" ved denne temperatur i de mængder, der anvendes i denne undersøgelse (0,25 g), især hvis det inkuberes i lidt længerevarigheder 29. Faktisk kan pollenkorn selv ved 80 °C briste eller på anden måde blive beskadiget, hvis de efterlades i acetolyseblandingen for længe. Inkubationstemperatur og -varighed skal bestemmes omhyggeligt for at undgå at ødelægge pollenkornene i prøven.
Farvning pollen øger definitionen og kontrasten af exine funktioner, hvilket gør det lettere at fotografere og identificere (figur 7). Fem dråber (fra en plastoverførselspipette) på 1% Safranin O farvede effektivt 0,25 g pollen. Imidlertid pletter forskellige pollen forskelligt. Hvis pollenkorn er farvet for let eller for stærkt, kan identifikation være vanskelig. Når det er muligt, bør mængden af pletopløsningen, der er nødvendig for at plette de pollenarter, der forventes at blive fundet i undersøgelsen, valideres, inden behandlingen af forsøgsprøverne påbegyndes. Ikke desto mindre, hvis en af de eksperimentelle prøver ikke er ordentligt farvet, kan den korrigeres. For at lette en pollenprøve, der er farvet for kraftigt, skylles prøven med vand og derefter ethanol. Hvis pollen ikke er farvet godt nok til at se kendetegn, kan der tilsættes et par ekstra dråber plet. Pletten af disse prøver skal kontrolleres, inden glycerin tilsættes. Ligeledes kan nogle forsøg og fejl være nødvendige for at bestemme den ideelle mængde glycerin til pollenresterne. Femten dråber glycerin beskyttede prøverne i denne undersøgelse passende mod udtørring, samtidig med at pollenresten fortyndes til en koncentration, der er ideel til downstream-identifikation via lysmikroskopi. Andre mængder pollenrester kan kræve mere eller mindre glycerin for at forhindre udtørring og lette montering.
Forfatterne har intet at afsløre.
Vi takker Dr. Gretchen Jones (USDA-ARS, APMRU, College Station, TX) for at hjælpe med farvesortering og acetolyseanalyse. Denne forskning blev støttet af forskningsmidler leveret til R.R.S. af Oregon State Beekeepers Association.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved