Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Verzameling en identificatie van stuifmeel van honingbijenkolonies
We beschrijven methoden voor het verzamelen van corbicular stuifmeel van honingbijen, evenals protocollen voor kleursortering, acetolyse en microscoopschuifvoorbereiding van stuifmeel voor taxonomische identificatie. Daarnaast presenteren we pelletkleur en taxonomische diversiteit van corbiculaire pollen verzameld uit vijf teeltsystemen met behulp van pollenvallen.
Onderzoekers verzamelen en analyseren vaak corbiculaire stuifmeel van honingbijen om de plantaardige bronnen te identificeren waarop ze foerageren voor stuifmeel of om de blootstelling aan pesticiden van bijen via stuifmeel te schatten. Hierin beschreven is een effectieve stuifmeelvangmethode voor het verzamelen van corbicular stuifmeel van honingbijen die terugkeren naar hun bijenkorven. Deze verzamelmethode resulteert in grote hoeveelheden corbiculaire pollen die kunnen worden gebruikt voor onderzoeksdoeleinden. Honingbijen verzamelen stuifmeel van vele plantensoorten, maar bezoeken meestal één soort tijdens elke verzamelreis. Daarom vertegenwoordigt elke corbicular stuifmeelpellet voornamelijk één plantensoort en kan elke stuifmeelpellet op kleur worden beschreven. Hierdoor kan het sorteren van monsters van corbiculaire stuifmeel op kleur plantenbronnen scheiden. Onderzoekers kunnen corbiculaire pollen verder classificeren door de morfologie van acetolyzed stuifmeelkorrels te analyseren voor taxonomische identificatie. Deze methoden worden vaak gebruikt in studies met betrekking tot bestuivers zoals bestuivingsefficiëntie, foerageerdynamiek van bestuivers, dieetkwaliteit en diversiteit. Gedetailleerde methodologieën worden gepresenteerd voor het verzamelen van corbicular pollen met behulp van pollenvallen, het sorteren van stuifmeel op kleur en acetolyserende stuifmeelkorrels. Ook gepresenteerd zijn resultaten met betrekking tot de frequentie van pelletkleuren en taxa van corbicular stuifmeel verzameld van honingbijen in vijf verschillende teeltsystemen.
De westelijke honingbij (Apis mellifera L.) is een belangrijke bestuiver van veel landbouwgewassen die afhankelijk zijn van bijenbestuiving1. Al meer dan een decennium worden aanzienlijke verliezen aan honingbijenkolonies gemeld 2,3,4,5,6,7,8,9. Verschillende factoren - waaronder parasieten en ziekten, slechte voeding en pesticiden - zijn betrokken bij deze kolonieafnames10. Slechte voeding kan worden toegeschreven aan intensivering van de landbouw en verlies van foerageerhabitat11. Het is absoluut noodzakelijk om de bloemenbronnen te begrijpen die door bijen in verschillende landschappen worden gebruikt om de bijenvoeding te verbeteren en te helpen bij het behoud van bijen. Stuifmeel is de primaire bron van eiwitten, lipiden, vitamines en mineralen voor bijen en is in veel landbouw- en ecologische studies gebruikt om de foerageervoorkeuren van honingbijen op kolonieniveau te begrijpen, de impact van stuifmeelvangst op honingbijenkolonies te evalueren en de blootstelling van pesticiden aan bijen te bepalen 12,13,14.
Honingbijen verzamelen stuifmeel van bloemen, verpakken stuifmeel in pellets op hun corbicula - een tibiale stuifmeelmand op hun achterpoot - en keren terug naar de kolonie voor opslag. Corbiculaire stuifmeel kan worden verwijderd van foerageerders door ze te vangen bij de ingang van de korf of op bloemen, ze kort te koelen om ze te immobiliseren en vervolgens de stuifmeelkorrels van hun achterpoten te verwijderen met een tang. Het moeizame proces van het met de hand verzamelen van corbicular stuifmeel van individueel gevangen foerageerders is traag en inefficiënt als men een aanzienlijke hoeveelheid stuifmeel nodig heeft. Een eenvoudigere en efficiëntere methode om grote hoeveelheden stuifmeel te verzamelen, is door corbicular stuifmeelkorrels van honingbijen bij bijenkorfingangen te vangen. Stuifmeelvallen zijn ontworpen om corbiculaire stuifmeel van de poten van de terugkerende stuifmeel foerageerders te verjagen wanneer ze de korf binnendringen15. De foerageerders moeten zich door mazen wurmen die zo groot zijn dat ze de doorgang van een honingbijenwerkerslichaam smal mogelijk maken.
Terwijl de honingbij door een van deze gaten gaat, worden de grotere stuifmeelkorrels van haar benen geschraapt en vallen ze in een verzamelbak16. Studies hebben aangetoond dat stuifmeelvangst foerageerders stimuleert om meer stuifmeel te verzamelen, waardoor de bestuivingsefficiëntie van de omliggende gewassen en vegetatie toeneemt 17,18,19,20. Stuifmeelverzamelingsmethoden kunnen ook worden gebruikt om het ruwvoer te begrijpen dat door honingbijen in het landschap wordt gebruikt als de eerste stap naar het bepalen van de kwantiteit, kwaliteit en taxa van bloeiende plantensoorten. Effectieve methoden voor het vangen van stuifmeel vergemakkelijken dus zowel bestuiving als onderzoek naar de voeding van honingbijen. Een vergelijking van deze methoden voor het verzamelen van pollen wordt geïllustreerd in tabel 1. Het foerageergedrag van stuifmeel zal veranderen op basis van de behoefte van de kolonie aan opgeslagen stuifmeel ten opzichte van de ei- en larvenpopulatieniveaus21,22. Aangezien deze veranderingen een variërende verzamelintensiteit omvatten, wordt vaak een grote variatie in pollenhoeveelheid verwacht tussen kolonies op dezelfde locatie en tussen verschillende locaties van hetzelfde teeltsysteem of landschapstype23,24. Het verhogen van het aantal kolonies en locaties om stuifmeel te vangen, zal helpen deze variatie op te vangen.
Pollenvallen variëren in efficiëntie25,26. De grootte van stuifmeelkorrels verzameld door honingbijen varieert per plantensoort en kan veranderen op basis van de niveaus van stuifmeelvoorraden in de kolonie27,28. Dit stelt de mogelijkheid voor kleinere stuifmeelpellets om ondervertegenwoordigd te zijn en grotere pellets om oververtegenwoordigd te zijn in monsters die zijn verzameld via pollenvallen. Volwassen bijen variëren in lichaamsgrootte, wat ook van invloed kan zijn op de representatie van stuifmeel verzameld in vallen. Er zijn ook plantensoorten die voornamelijk nectar produceren die onopgemerkt zal blijven als alleen het verzamelde stuifmeel in sommige landschappen wordt beoordeeld. De efficiëntie van de vang wordt ook beïnvloed door foerageerdrift en desoriëntatie, die wordt beïnvloed door het type pollenval en de toestand van de bijenkorfapparatuur. Dit probleem kan worden verholpen door gebruik te maken van technieken die in dit artikel worden gespecificeerd. Onderzoekers kunnen aanvullende onderzoekstechnieken overwegen, zoals het tellen van bloembezoek door foerageerders, om de resultaten van foerageervoorkeuren op kolonieniveau aan te vullen. Een nuttige methode voor het beoordelen van de pollendiversiteit is het sorteren van corbicular pollen op kleur. Hoewel honingbijen generalistische foerageerders zijn, vertonen ze ook bloemgetrouwheid, waarbij ze stuifmeel verzamelen van dezelfde plantensoort op dezelfde locatie tijdens een bepaalde verzamelreis. Op basis van dit foerageergedrag wordt aangenomen dat een bepaalde krablaasjes overwegend worden vertegenwoordigd door een enkele plantensoort 27,29,30,31. Daarom kunnen wetenschappers de diversiteit van stuifmeel beschrijven door corbiculaire pollen op pelletkleur te sorteren en het totale aantal gedetecteerde kleuren of het aandeel van het totaal vertegenwoordigd door elke kleurgroep 12,32,33,34 te rapporteren. Dit kan worden bereikt door het aantal massa's of pellets van elke kleurgroep te meten. Het meten van het aantal pellets van elke kleurgroep wordt voorgesteld als er bekende of vermoedelijke systematische verschillen zijn in het gewicht van pellets van verschillende taxa. Systematische verschillen kunnen worden veroorzaakt door de grootte van de pellet of de hoeveelheid nectar die foerageerders toevoegen aan stuifmeel bij het vormen van een pellet.
Kleursortering is een tijdsefficiënt en eenvoudig proces, maar heeft mogelijk geen acceptabele nauwkeurigheid voor sommige bestuivingsonderzoeken omdat verschillende plantentaxa vergelijkbare pollenpelletkleuren kunnen hebben35,36. Bovendien is er een logistieke limiet aan het aantal verschillende kleurgroepen waarin stuifmeelkorrels kunnen worden gescheiden. De scheiding van elk individueel planttaxonpollen in zijn eigen specifieke pelletkleurgroep is dus niet altijd mogelijk in bestuivingsstudies. Morfologische karakterisering van stuifmeelkorrels via lichtmicroscopie vult vaak de kleurscheiding van pellets aan door het stuifmeel van twee of meer taxa in pellets van dezelfde kleurgroep te onderscheiden. Hoewel het gebruikelijk is om stuifmeelkorrels van meerdere taxa te vinden in een bepaalde pollenpelletkleurgroep, vormen individuele stuifmeelkorrels verzameld door een honingbij over het algemeen één overheersend taxon, mogelijk met andere taxa in kleine hoeveelheden. Het is dus gebruikelijk om taxonomische betrouwbaarheid aan te nemen in kraciculaire stuifmeelkorrels van honingbijen. Stuifmeelkorrels van andere bestuivers die geen bloemgetrouw gedrag vertonen, zoals hommels, bevatten vaak veel plantensoorten en bezitten mogelijk geen overheersend taxon. In gevallen waarin kwantitatieve schattingen van taxa-verhoudingen in polyflorale stuifmeelpellets gewenst zijn, zijn microscopische methoden die acetolyse omvatten, bovendien vereist voor een goede analyse.
Het beoordelen van morfologische kenmerken van acetolysed pollenkorrels is de meest gebruikelijke methode voor taxonomische identificatie16. De acetolyseprocedure verwijdert het protoplasma van de stuifmeelkorrel om diagnostische kenmerken bloot te leggen die kunnen worden waargenomen onder lichtmicroscopie37,38. Met behulp van deze methode kunnen onderzoekers verschillende taxa, frequentie van taxa in specifieke teeltsystemen en overheersende taxa van pelletkleuren33,36 rapporteren. Acetolyse is de beste analysetechniek voor het onthullen van pollenmorfologie28. Sommige acetolysed stuifmeelkorrels, zoals veel Rosaceae-typen, kunnen echter niet worden geïdentificeerd op geslachts- of soortniveau door acetolyse en lichtmicroscopie alleen. Onderzoekers beschouwen scanning elektronenmicroscopie of metabarcoding als alternatieve methoden om identificatie op geslachts- of soortniveau te bereiken. Deze alternatieve methoden bieden echter alleen kwalitatieve taxonidentificatie en schatten de verhoudingen van verschillende stuifmeelkorreltaxa in polyflorale stuifmeelkorrelsniet 36,39. Bovendien zijn de kosten en benodigde expertise aanzienlijk hoger voor deze methoden. Een vergelijking van deze identificatiemethoden wordt geïllustreerd in tabel 1.
| Methoden | Tijd | Kosten | Resolutie | Deskundigheid |
| Pollen collectie | ||||
| Stuifmeelvangst | Laag | Gematigd | Veranderlijk | Gematigd |
| Pollen foerageerder collectie | Hoog | Gematigd | Hoog | Laag |
| Pollen Identificatie | ||||
| Visueel (alleen kleursortering) | Gematigd | Laag | Laag | Laag |
| Acetolyse | Gematigd | Gematigd | Gematigd | Gematigd |
| Scanning elektronenmicroscopie | Hoog | Hoog | Hoog | Hoog |
| Metabarcoding | Veranderlijk | Hoog | Hoog | Hoog |
Tabel 1: Vergelijking van verschillende methoden voor het verzamelen en identificeren van pollen op basis van tijd, kosten, resolutie en expertise. Visuele methoden (alleen kleursortering) rapporteren het totale aantal gedetecteerde kleuren of het aandeel van het totaal dat door elke kleurgroep wordt vertegenwoordigd als een metriek voor het bepalen van pollenbronnen, maar bieden geen taxonidentificatie.
De beschikbare informatie over het vangen en sorteren van stuifmeel en acetolyserende stuifmeelkorrels is divers en vaak verspreid over meerdere bronnen, variërend voor onderzoekers op verschillende gebieden. Dit artikel biedt gedetailleerde inzichten in verschillende soorten stuifmeelvallen die door zowel onderzoekers als imkers kunnen worden gebruikt om grote hoeveelheden corbiculaire stuifmeel effectief te verzamelen. Ook worden protocollen verstrekt voor het voorbereiden van pollenmonsters - door acetolyse, kleuring en schuifmontage - voor de identificatie van plantentaxa. De hier beschreven methodologieën zijn uitgebreid en dienen als een unieke bron voor het identificeren van overheersende plantensoorten waarop honingbijen foerageren in een bepaald landschap, met name in teeltsystemen. Bevindingen op basis van deze methoden uit een eerdere studie zijn gepresenteerd en documenteren de diversiteit van stuifmeelkorrelkleuren en plantentaxa van corbicular stuifmeel verzameld door honingbijen in vijf teeltsystemen14.
1. Het verzamelen van corbiculaire stuifmeel uit honingbijenkolonies met behulp van stuifmeelvallen
- Bepaal wanneer stuifmeel van de gewenste bijenstallocatie moet worden gevangen.
OPMERKING: Ideale klimatologische omstandigheden omvatten blootstelling aan de volle zon, lage windsnelheden, lage luchtvochtigheid en geen voorspelde neerslag tijdens de gewenste periode voor het verzamelen van pollen. - Selecteer optimale honingbijenkolonies voor het vangen van stuifmeel in de bijenstallocatie.
- Beoordeel de sterkte van de kolonie door foerageerders te tellen die gedurende 2 minuten terugkeren naar de ingang van de kolonie. Selecteer kolonies met het hoogste totale aantal terugkerende foerageerders.
- Kies bijenkorven met houten materiaal dat in goede staat is, bij voorkeur zonder extra ingangen en kromgetrokken deksels. Gebruik kolonies met minder alternatieve ingangen, omdat ze de kans vergroten dat foerageerders zich heroriënteren naar de ingang van de val.
- Selecteer waar mogelijk bijenkorfingangen op het zuiden. Als bijenkorven worden gepalletiseerd, installeer dan stuifmeelvallen op elke kolonie in dezelfde richting op een bepaald pallet om de drift van foerageerders naar naburige bijenkorfingangen te voorkomen.
- Beoordeel indien gewenst het broednest van de kolonie door frames te inspecteren op de aanwezigheid van larven. Selecteer kolonies met relatief grote hoeveelheden larven.
- Installeer stuifmeelvallen op de geselecteerde honingbijenkolonies.
OPMERKING: De installatie zal verschillen op basis van het type pollenval. Typen omvatten a) front-mount, b) bottom-mount, c) top-mount, of d) auger-hole entrance mount. Zie het discussiegedeelte voor meer informatie.- Voor voorvallen aan de voorzijde bevestigt u de val voor de ingang met nietjes, schroeven en tape, of sluit u de val aan op bungee-koorden die rond de korf zijn gewikkeld. Voor vallen op de bodem plaatst u de val onder de laagste korfdoos en bevestigt u de ingang van de val bij de oorspronkelijke ingang. Voor vijzelgatmontagevallen bevestigt u de val direct voor een vijzelgat van een korfdoos met behulp van nietjes, schroeven en tape. Voor vallen op de bovenste montage plaatst u de val boven de bovenste korfdoos en onder het deksel.
- Sluit alle andere mogelijke ingangen in de kolonie af met behulp van niet-klevend en vormbaar materiaal, zoals latex of polyurethaanschuim, of # 8 hardwaredoek (diafragma van 2,7 mm) voor vijzelgaten. Gebruik plakband voor kleine scheurtjes.
- Als u voorste bevestigingsvallen gebruikt, plaatst u een barrière, zoals een rubberen mat, tussen de opvangmand en het gras om vochtschade door dauw te voorkomen.
- Schakel het vangmechanisme van de pollenval 24 uur na installatie in en voordat de foerageervlucht van de dag begint (late avond / vroege ochtend).
LET OP: Deze stap is ideaal, maar niet noodzakelijk. Betrek om de week stuifmeelvallen als je stuifmeel op dezelfde kolonies gedurende een bepaalde periode vangt. - Verzamel corbicular stuifmeel uit de opvangbak, plaats het in plastic zakken of centrifugebuizen en bewaar het in een koeler met ijs.
- Om de diversiteit en abundantie van stuifmeelsoorten te beoordelen, bijvoorbeeld voedingsstudies op landschapsniveau, verzamelt u stuifmeel in twee of drie intervallen van 72 uur40.
- Verzamel voor de analyse van bestrijdingsmiddelenresiduen stuifmeel in intervallen van 24 uur tot 96 uur met een minimum van 3 g voor verwerking41.
- Reinig het stuifmeel door bijendelen en ander korfafval te verwijderen.
OPMERKING: Gebruik wegwerphandschoenen bij het hanteren van pollenmonsters en vervang de wegwerphandschoenen tussen monsters. Gebruik afzonderlijke hulpmiddelen om puin te verwijderen van het stuifmeel dat in elke val is verzameld. Spoel en droog voordat u de gereedschappen gebruikt voor een andere partij gevangen stuifmeel. - Bewaar stuifmeel bij -20 °C of lager om de samenstellingsintegriteit te behouden als stuifmeel bestemd is voor de identificatie van stuifmeelbronnen, de beoordeling van de hoeveelheid of de analyse van bestrijdingsmiddelenresiduen41,42.
- Nadat u de vallen uit de kasten hebt verwijderd, steriliseert u alle apparatuur in een 5% bleekoplossing, spoelt u de apparatuur af en droogt u deze voor het volgende gebruik.
2. Kleursortering van stuifmeelkorrels voor downstream pollenbronidentificatie en hoeveelheidsbeoordeling
- Zorg ervoor dat er minstens 20 g stuifmeelmonster is om mee te werken. Meng het stuifmeelmonster grondig in de zak of een andere container van voldoende grootte om een homogene mix van alle pellets daarin te verkrijgen. Om onbedoelde vertekening in de volgende stap te voorkomen, moet u de kleursamenstelling van het monster uit het zicht onttrekken voordat u een substeekproef uit de monsterzak verwijdert.
- Schep met een schep of grote lepel 10 g stuifmeel eruit als een representatieve substeekproef van het geheel. Giet langzaam pellets uit de scooper op de balans totdat het display 10 g aangeeft. Als de eerste schep niet groot genoeg was, haal dan op dezelfde manier een andere schep uit het monster.
OPMERKING: Deze gespecificeerde gewichtseisen (20 g en 10 g) dienen slechts als voorbeeld. Onderzoekers moeten de hoeveelheid stuifmeel die in elke stap wordt gebruikt, aanpassen aan specifieke behoeften. - Verwijder alle bijendelen en ander vuil uit de substeekproef van 10 g. Voeg vervolgens, indien nodig, iets meer stuifmeel van het oorspronkelijke monster toe om een totaal gewicht van 10 g van de substeekproef te bereiken.
- Sorteer elke stuifmeelkorrel uit de substeekproef van 10 g in een kleurgroep. Gebruik zowel stuifmeelkleur als textuur om onderscheid te maken tussen kleurgroepen.
OPMERKING: Er wordt enige variatie binnen een groep verwacht, maar het gebruik van de Pantone-kleurengids tijdens het sorteren kan de consistentie verhogen. - Om ervoor te zorgen dat ten minste 0,25 g van elke kleurgroep voor stroomafwaartse stappen wordt uitgevoerd, plaatst u pellets die niet overvloedig genoeg zijn om een kleurgroep van ten minste 0,25 g te vormen in een diverse groep. Geef elke afzonderlijke kleurgroep een naam met behulp van de Pantone-kleurgids. Label de diverse groep misc.
- Weeg elke kleurgroep op een apart weegpapier en/of tel het aantal pellets in elke kleurgroep. Noteer de namen en gewichten of tellingen van de kleurgroepen in een gegevensblad.
OPMERKING: De keuze of het aantal pellets in elke kleurgroep moet worden gewogen of geteld, hangt af van de interesse- en projectdoelen van de onderzoeker. - Maak een microcentrifugebuislabel voor elke kleurgroep met behulp van een oplosmiddelbestendige pen en zelfklevende papieren buisetiketten. Neem de huidige datum, monster-id, datum voor het verzamelen van monsters en het kleurgroepnummer op in het label. Breng de etiketten aan op schone, droge 2 ml microcentrifugebuizen.
- Weeg 0,25 g (± 0,05 g) stuifmeelkorrels uit elke kleurgroep af en plaats deze hoeveelheid in de correct gelabelde microcentrifugebuis.
OPMERKING: Als er een kleine variatie in kleur of textuur is in het stuifmeel van een bepaalde kleurgroep, zorg er dan voor dat er een representatief monster van pellets in elke buis zit. De reagensvolumes en incubatie- en centrifugatietijden die volgen zijn geschikt voor 0,25 g stuifmeel. Gebruik daarom deze hoeveelheid stuifmeel in de microcentrifugebuizen om te worden gebruikt bij acetolyse. Dit protocol moet voldoende, gekleurd stuifmeel bieden voor downstream plantbronidentificatie door middel van lichtmicroscopie. Bij gebruik van een andere hoeveelheid stuifmeel bij acetolyse moeten de specifieke kenmerken van het reagensvolume en de verwerkingstijden dienovereenkomstig worden aangepast. - Plaats het resterende stuifmeel van elke kleurgroep in afzonderlijke plastic zakken (één zak per kleur) met de naam van de kleurgroep. Bewaar deze zakken met de andere delen van het juiste originele monster in -20 °C opslag.
- Meng het stuifmeel in de tube grondig met een schone houten tandenstoker gedurende 10 tot 15 s.
3. Voorbereiding op acetolyse
- Voordat u voor de eerste keer met een deel van acetolyse begint, neemt u contact op met de afdeling milieugezondheid en -veiligheid (EHS) van de aangewezen instelling voor instructies over hoe acetolyse-gerelateerde reagentia en afval moeten worden behandeld.
- Verkrijg voorraadoplossingen van de volgende reagentia en plaats ze in de zuurkast in overeenstemming met EHS-richtlijnen voor chemische opslag: 95% ethanol; gedestilleerd water; ijsazijn, watervrij; geconcentreerd zwavelzuur; Glycerine; en heldere nagellak.
- Bereid stamoplossingen van de volgende reagentia en plaats ze in de zuurkast in overeenstemming met ehs-richtlijnen voor chemische opslag: verzadigd natriumbicarbonaat (8% w/v-oplossing in gedestilleerd water); en safranine O (1% w/v oplossing in 50% ethanol).
4. Acettolyse
- Voer de pre-acetolyseprocedure van ijsazijnzuurwas uit. Voer de volgende stappen uit in de zuurkast met laboratoriumjas, oogbescherming en nitrilhandschoenen.
- Zet een warmteblok aan op 80 °C.
OPMERKING: Zorg ervoor dat een knijpfles verzadigd natriumbicarbonaat gemakkelijk toegankelijk is. Dit kan worden gebruikt om zure morsen in de zuurkast te neutraliseren als ze zich voordoen. - Label één glazen bekerglas voor zuur afval, één voor ethanolafval en één voor acetolysemengsel.
- Maak met behulp van eerder bereide stamoplossingen werkende aliquots van de volgende reagentia in geëtiketteerde glazen bekers van de juiste grootte: ~ 23,0 ml ijsazijn; ~ 33,0 ml gedestilleerd water; ~ 23,0 ml 95% ethanol; ~ 25,0 ml natriumbicarbonaat (voor met zuur verontreinigd vast afval).
OPMERKING: Dit zijn de volumes die nodig zijn om de volgende acetolyseprocedures te voltooien op in totaal 10 kleurgroepmonsters (10 microcentrifugebuizen). - Voeg langzaam 500 μL ijsazijn toe aan elke microcentrifugebuis met 0,25 g kleurgroeppollen. Roer tijdens het visueel inspecteren van de buis het stuifmeel met een schone tandenstoker gedurende 10-15 s en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Plaats de gebruikte tandenstoker na gebruik in het natriumbicarbonaat afvalbeker; herhaal dit proces voor elke buis.
OPMERKING: Gebruik een schone, nieuwe tandenstoker voor elke tube. Zorg ervoor dat het deksel van elke buis goed gesloten is. - Centrifugeer de monsters gedurende 3 minuten bij 1.100 × g. Decanteer het supernatant uit de buizen in het zure afvalbeker. Raak vervolgens zacht en kort de open mond van de buis aan met een schone papieren handdoek om achtergebleven ijsazijn rond de rand van de buis te verwijderen.
OPMERKING: Pas op dat u de stuifmeelkorrel niet verliest bij het decanteren van supernatanten.
- Zet een warmteblok aan op 80 °C.
- Voer de acetolyseprocedure uit.
OPMERKING: Voer de volgende stappen uit in de zuurkast met laboratoriumjas, oogbescherming en butylvinylhandschoenen.- Bereid het acetolysemengsel (9:1 ijsazijn:zwavelzuur) door eerst 10,8 ml ijsazijn (uit het werkende aliquot) toe te voegen aan het met het bekerglas gelabelde acettolysemengsel. Voeg vervolgens met een 1000 μL-pipet uitgerust met 1250 μL gefilterde pipetpunten langzaam 1200 μL (1,2 ml) geconcentreerd zwavelzuur uit de stamoplossing toe aan het acetolysismengselbeker dat ijsazijn bevat. Gooi de gebruikte pipetpunt weg in het bekerglas van natriumbicarbonaat.
OPMERKING: Het bekerglas van het acetolysismengsel kan warm aanvoelen en het mengsel kan geel worden. Er zijn twee mogelijkheden die ervoor zorgen dat het mengsel een donkere kleur krijgt: (a) de reagentia kunnen over hun houdbaarheidsdatum zijn, of (b) er kan te veel zwavelzuur zijn toegevoegd. In ieder geval, als het mengsel donker wordt, gooi het dan weg in het zure afvalbeker en bereid een vers acetolysismengsel. - Roer het acetolysemengsel voorzichtig met een glazen staaf of houten roerstaaf om ervoor te zorgen dat het gehomogeniseerd is. Plaats de gebruikte staaf/stok in het bekerglas natriumbicarbonaat.
- Gebruik een pipet van 1000 μL met 1250 μL gefilterde pipetpunten en voeg langzaam 1000 μL acetolysemengsel uit het bekerglas toe aan elke buis. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Plaats de gebruikte tandenstoker na gebruik in het natriumbicarbonaat afvalbekertje.
OPMERKING: Gebruik een schone, nieuwe tandenstoker voor elk monster. - Plaats de monsters op het voorverwarmde (80 °C) warmteblok. Incubeer de tubes gedurende 5 minuten en roer elke tube grondig met een schone tandenstoker halverwege de incubatie. Plaats elke gebruikte tandenstoker na gebruik in het bekerglas natriumbicarbonaat.
OPMERKING: Laat geen tandenstokers achter in de monsters; het zuur zal ze oplossen.
- Bereid het acetolysemengsel (9:1 ijsazijn:zwavelzuur) door eerst 10,8 ml ijsazijn (uit het werkende aliquot) toe te voegen aan het met het bekerglas gelabelde acettolysemengsel. Voeg vervolgens met een 1000 μL-pipet uitgerust met 1250 μL gefilterde pipetpunten langzaam 1200 μL (1,2 ml) geconcentreerd zwavelzuur uit de stamoplossing toe aan het acetolysismengselbeker dat ijsazijn bevat. Gooi de gebruikte pipetpunt weg in het bekerglas van natriumbicarbonaat.
- Voer de post-acetolysis glaciale azijnzuur wasprocedure uit.
OPMERKING: Voer de volgende stappen uit in de zuurkast met laboratoriumjas, oogbescherming en butylvinylhandschoenen.- Voeg langzaam 500 μL ijsazijn toe aan elke buis. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Plaats de gebruikte tandenstoker na gebruik in het bekerglas natriumbicarbonaat.
OPMERKING: Gebruik een schone, nieuwe tandenstoker voor elk monster. Zorg ervoor dat het deksel van elke buis goed gesloten is. - Centrifugeer de monsters gedurende 3 minuten bij 1.100 × g. Decanteer het supernatant uit elke buis in het zure afvalbeker. Raak vervolgens zachtjes en kort de open mond van de buis aan met een schone papieren handdoek om restzuur rond de rand van de buis te verwijderen.
- Spoel de butyl vinyl handschoenen grondig af onder stromend water gedurende ten minste 30 s, verwijder ze en zet ze te drogen.
OPMERKING: Volg de richtlijnen van de fabrikant voor hergebruik van butylvinylhandschoenen.
- Voeg langzaam 500 μL ijsazijn toe aan elke buis. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Plaats de gebruikte tandenstoker na gebruik in het bekerglas natriumbicarbonaat.
- Voer drie waterspoelingen uit voor elk monster. Voer de volgende stappen uit in de zuurkast met laboratoriumjas, oogbescherming en nitrilhandschoenen.
- Voeg 1000 μL gedestilleerd water uit het gedestilleerde waterbeker toe aan elke buis. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Plaats de tandenstoker na gebruik in het natriumbicarbonaat afvalbekertje.
OPMERKING: Gebruik een schone, nieuwe tandenstoker voor elk monster. Zorg ervoor dat het deksel van elke buis goed gesloten is. - Centrifugeer de monsters gedurende 3 minuten bij 1.100 × g. Decanteer het supernatant uit de buizen in het bekerglas van natriumbicarbonaat. Raak vervolgens zachtjes de open mond van de buis aan met een schoon papieren handdoekje om restwater rond de rand van de buis te verwijderen.
- Herhaal stap 4.4.1-4.4.2 nog twee keer voor in totaal drie waterspoelingen.
- Voeg 1000 μL gedestilleerd water uit het gedestilleerde waterbeker toe aan elke buis. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Plaats de tandenstoker na gebruik in het natriumbicarbonaat afvalbekertje.
- Voer de ethanolspoeling uit voor elk monster.
OPMERKING: Voer de volgende stappen uit in de zuurkast met laboratoriumjas, oogbescherming en nitrilhandschoenen.- Gebruik een 1000 μL pipet met 1250 μL gefilterde pipetpunten en voeg 1000 μL 95% ethanol uit het ethanolbeker toe aan elke buis. Gooi de pipetpunt weg in ongevaarlijk afval. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd.
LET OP: Plaats de tandenstoker na gebruik in het natriumbicarbonaat afvalbekertje. Gebruik een schone, nieuwe tandenstoker voor elk monster. Zorg ervoor dat het deksel van elke buis goed gesloten is. - Centrifugeer de monsters gedurende 3 minuten bij 1.100 × g. Decanteer het supernatant uit de buizen in het ethanolafvalbeker en raak zachtjes de open mond van de buis aan met een schoon papieren handdoekje om resterende ethanol uit de buis te verwijderen.
- Gebruik een 1000 μL pipet met 1250 μL gefilterde pipetpunten en voeg 1000 μL 95% ethanol uit het ethanolbeker toe aan elke buis. Gooi de pipetpunt weg in ongevaarlijk afval. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd.
- Draag laboratoriumjas, oogbescherming en nitrilhandschoenen om monsters te beitsen. Meng de Safranin O-vlekvoorraadoplossing met zachte inversie.
- Gebruik een wegwerp, plastic transferpipet en voeg 5-10 druppels Safranin O-vlek toe aan elke buis. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met een schone tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Laat de tandenstoker in de tube.
- Gebruik een 1000 μL pipet met 1250 μL gefilterde pipetpunten en voeg 1000 μL 95% ethanol uit het ethanolbeker toe aan elke buis. Gooi de pipetpunt weg in ongevaarlijk afval. Roer tijdens het visueel inspecteren van de buis gedurende 10-15 s met de tandenstoker en zorg ervoor dat de inhoud van de buis grondig wordt gemengd. Plaats de gebruikte tandenstoker na gebruik in het ongevaarlijke afval.
- Zorg ervoor dat het deksel van elke buis goed gesloten is. Centrifugeer gedurende 3 minuten bij 1.100 × g. Decanteer het supernatant in het ethanol afvalbeker.
OPMERKING: Raak de mond van de buis deze keer niet aan met een papieren handdoek. - Voeg 10-15 druppels glycerine toe aan elke buis met behulp van een plastic wegwerptransferpipet. Roer tijdens het visueel inspecteren van de buis de inhoud van de buis met een schone tandenstoker gedurende 10-15 s en zorg ervoor dat de inhoud van de buis grondig wordt gemengd.
LET OP: Plaats de gebruikte tandenstoker na gebruik in het ongevaarlijke afval. Gebruik een schone, nieuwe tandenstoker voor elk monster. Zorg ervoor dat alle buisetiketten leesbaar zijn.
- Laat de buizen open in de zuurkast om de ethanol gedurende ten minste 2 uur bij kamertemperatuur te verdampen. Controleer de monsters op ethanolgeur: als deze detecteerbaar is, zijn de monsters niet klaar en moeten ze worden gedroogd totdat de ethanolgeur verdwijnt.
- Reinig alle materialen en gooi afval weg. Schakel zowel de centrifuge als het warmteblok uit. Verwijder al het vaste en vloeibare afval in overeenstemming met de milieugezondheids- en veiligheidsrichtlijnen van de aangewezen instelling.
- Bereid microscoopglaasjes voor op pollenidentificatie; label ze leesbaar. Label een schone glazen microscoopglaasje op de juiste manier voor elke kleurgroep / monster dat wordt gemonteerd. Roer tijdens het visueel inspecteren van de buis het monster met een schone tandenstoker gedurende 10-15 s en zorg ervoor dat de inhoud van de buis grondig wordt gemengd.
OPMERKING: Diavoorbereiding kan worden gedaan op de laboratoriumbank. Gooi de tandenstoker weg in niet-gevaarlijk afval. Gebruik een schone, nieuwe tandenstoker voor elk monster.- Gebruik een schone plastic wegwerppipet, verwijder 1 druppel stuifmeelresten uit een buis en plaats deze in het midden van de gelabelde microscoopglaas. Laat de druppel iets verspreiden. Plaats een schone coverslip over de druppel op de glijbaan.
- Nadat de glijbaan is opgedroogd, sluit u de afdeklip af op de glijbaan met heldere nagellak. Plaats een kleine druppel polish op elke hoek van de coverslip en schilder een rand van polish rond de omtrek van de coverslip waar deze de dia ontmoet. Laat de nagellak volledig drogen en schilder een tweede laagje lak rond de omtrek van de deklip.
Een eerdere studie rapporteerde de beoordeling van de diversiteit van stuifmeel verzameld door honingbijen in de volgende landbouwgewassen: amandel, kers, highbush bosbes, hybride wortel en weideschuim14. Met behulp van de beschreven methoden werd corbiculaire stuifmeel verzameld, gesorteerd op kleur, en de plantenbronnen van elke pelletkleurgroep geïdentificeerd om de stuifmeeldiversiteit te beoordelen. Op kolonies werden voor elk gewas op meerdere locaties stuifmeelvallen op de bodem geïnstalleerd (figuur 1A). De hoeveelheid stuifmeel die op elke locatie werd verzameld, was voldoende om te voldoen aan de vereisten voor het gewicht van de kleursortering en acetolyse-analysemethoden. Elk stuifmeelverzamelingsmonster had meerdere te onderscheiden kleurgroepen (figuur 2 en figuur 3). In sommige monsters bevatten stuifmeelkleurgroepen slechts 4-5 pellets; de meeste groepen hadden echter significant meer dan dat en dienden dus als hun eigen gelabelde kleurgroep voor acetolyse (figuur 4 en figuur 5). Na acetolyse (figuur 6) werd bright-field light microscopie gebruikt om elke kleurgroep effectief te identificeren tot de laagst mogelijke taxonomische rang door de morfologische kenmerken te bevestigen met die van voucherspecimens verzameld uit het gebied rond elke onderzoekslocatie (figuur 7).

Figuur 1: Stuifmeelvallen geïnstalleerd op een honingbijenkolonie om corbicular stuifmeel te verzamelen. (A) Bottom-mount vallen geplaatst boven de korfbodem en direct boven de laagste korfdoos. Andere pollenvalstijlen zijn (B) front-mount en (C) auger-hole entrance mount traps. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 2: Vangmechanisme en opvangbak van stuifmeelval. Terugkerende stuifmeelverzorgers moeten zich door het mesh-vangmechanisme wurmen voordat ze hun korf bereiken. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 3: Verzamelbak met pollenval. Corbiculaire stuifmeel wordt door de pollenval van de poten van terugkerende stuifmeelverzorgers geschraapt en valt in de opvangbak. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 4: Sorteren van een monster van corbiculaire pollen in kleurgroepen. Corbiculaire pollen kunnen worden gedroogd en gewogen nadat het in kleurgroepen is gesorteerd om verhoudingen van verschillende kleurkorrels te rapporteren die zijn verzameld. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 5: Vier groepen stuifmeelkorrels gesorteerd op kleur met behulp van de Pantone-kleurengids. De kleurgroepen zijn gelabeld als (A) grijs, Pantone 5855C, (B) bruin, Pantone 7557C, (C) geel, Pantone 458C en (D) lichtbruin, Pantone 3547C. Klik hier om een grotere versie van deze afbeelding te bekijken.
Figuur 6: Opstelling van acetolyseapparatuur in de zuurkast. Het warmteblok, reagentia, oplosmiddelafval en zuurafvalcontainers, gelabelde bekers, pipet, pipetpunten, roerstaafjes en microcentrifugebuizen in de zuurkast. Klik hier om een grotere versie van deze figuur te bekijken.
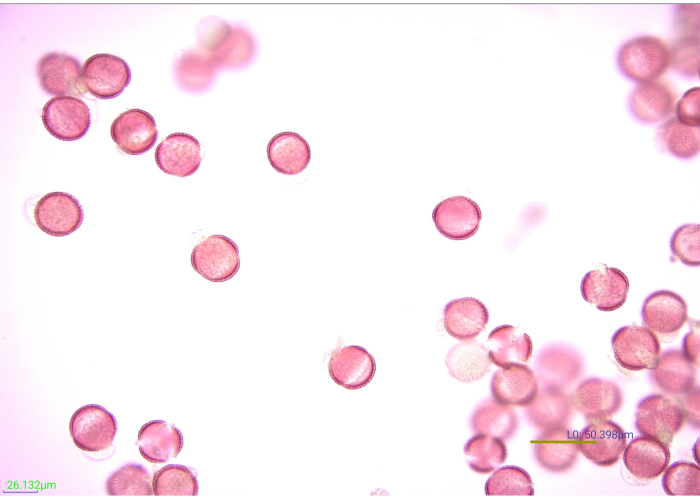
Figuur 7: Micrografie van gekleurde, acetolysaatkorrels. Vele facetten van acetolyzed mosterd (Brassicaceae) stuifmeelkorrels bij 40x vergroting. Schaalbalk = 50,398 μm. Klik hier om een grotere versie van dit cijfer te bekijken.
Het stuifmeel verzameld van amandelgewaslocaties had een relatief lagere stuifmeeldiversiteit dan stuifmeel verzameld van andere gewassen, met een gemiddelde van 3,0 ± 0,5 pelletkleuren en 3,2 ± 1,2 plantentaxa per locatie (tabel 2) 14. De overige vier teeltsystemen hadden een hogere stuifmeeldiversiteitsniveaus met een gemiddelde van 6,0 ± 2,0 pelletkleuren en 8,0 ± 1,5 plantentaxa per locatie in kersen, 8,8 ± 1,4 pelletkleuren en 13,5 ± 2,0 plantentaxa per locatie in highbush blauwe bessen, 7,0 ± 1,0 pelletkleuren en 11,0 ± 0,0 plantenbelasting per site in hybride wortel, en 10,0 ± 0,0 pelletkleuren en 13,0 ± 1,5 plantenbelasting per site in weideschuim14.
| Gewas | Gemiddeld aantal pollen pellet kleuren/plaats (SE) | Gemiddeld aantal planttaxa/locatie (SE) | Totaal geïdentificeerde taxa | ||
| Familie | Geslacht | Soort | |||
| Amandel | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| Bosbes | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| Wortel | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| Kers | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| Weideschuim | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
Tabel 2: Diversiteit van kraciculaire stuifmeel verzameld van honingbijen in vijf teeltsystemen. Diversiteitsstatistieken omvatten het gemiddelde aantal pelletkleuren (± SE), het gemiddelde aantal plantentaxa (± SE) en de totale geïdentificeerde taxa. Deze tabel is gewijzigd van14. Afkorting: SE = standaardfout.
Verschillende pollenvalstijlen hebben hun eigen voordelen en gevolgen. De voordelen en beperkingen van vier veelgebruikte valstijlen, (1) front-mount, (2) bottom-mount, (3) auger-hole en (4) top-mount pollenvallen worden hieronder besproken. Front-mount traps zijn de meest veelzijdige stijl (figuur 1B). Installatie is snel en eenvoudig; het kan worden gedaan zonder bijenkorfkasten op te tillen, en deze vallen passen op elke Langstroth-stijl van bijenkorfapparatuur. Omdat de verzamelbak voor de kolonie zit, verzamelt deze minimaal puin van de kolonie. De opvangbak wordt echter ook meer blootgesteld aan externe elementen - vocht van veldirrigatie, regenachtig of vochtig weer, of dauw kan via de opvangbak in contact komen met het stuifmeel, waardoor het stuifmeel mogelijk onbruikbaar wordt als de pellets te verzadigd raken om te scheiden. Het risico op pollenverzadiging kan worden verminderd door het vangen te vermijden tijdens voorspelde gebeurtenissen van regen of hoge luchtvochtigheid. Het plaatsen van een rubberen mat onder de val en extra afdekmateriaal (bijv. dakleer) bovenop de pollenval kan de opvangbak ook beschermen tegen weersinvloeden.
Bottom-mount vallen werden gebruikt om stuifmeel te verzamelen voor de gegevens in dit artikel (figuur 1A). Ze zijn niet zo handig om te installeren omdat ze onder het broednest van de kolonie moeten worden geplaatst. De installatie is tijdrovend en resulteert in een groot volume puin dat in de val van de kolonie valt, zoals bijendelen en kleine stukjes was. De vloer van de opvangbak voor de meeste gefabriceerde bodemklemmen is gemaakt van fijn gaas, wat een goede ventilatie mogelijk maakt om het verzamelde stuifmeel te beschermen tegen vocht. Vijzelgatpollenvallen helpen de desoriëntatie van foerageerders te minimaliseren als ze voornamelijk vijzelgaten gebruiken als bijenkorfingangen in plaats van de ingang gemaakt door de onderste plank van de korf (figuur 1C). Omdat de opvangbak voor vijzelgatpollenvallen erg klein is, moet deze regelmatig worden geleegd om te voorkomen dat de opvangbak overloopt. Gezien de bovenste plaatsing op een korf, is de bovenste stuifmeelval de gemakkelijkste valstijl om te installeren en te verwijderen, en het verzamelde stuifmeelmonster is vrij van korfafval. Deze valstijl is echter extra gevoelig voor beschadigde bijenkorfapparatuur, omdat de opvangbak zou worden blootgesteld aan vocht als het deksel, de binnenklep en de bovenste korfdoos niet goed aan elkaar zijn verzegeld.
De hierin beschreven protocollen vragen om het selecteren van kolonies met grote volwassen en larvale populaties (stap 1.2). Deze selectiemethode is bedoeld om zeer grote hoeveelheden gevangen stuifmeel uit deze kolonies te produceren. Kolonies met aanzienlijke foeragerende populaties kunnen zware congestie ervaren bij de ingang bij de installatie van de val. Het selecteren van een grote bijenkorfingang zal de congestie verlichten. Grote foeragerende populaties kunnen ook zeer grote hoeveelheden stuifmeel verzamelen die de grenzen van de verzamelbak kunnen overschrijden. Gebruik volumineuze verzamelbakken, zoals te zien is bij de meeste trapstijlen aan de onderkant of bovenkant, en lege trays vaak om grote hoeveelheden gevangen stuifmeel op te vangen. Als het gewenste onderzoeksdoel is om stuifmeelhoeveelheden te beoordelen die door kolonies in een bijenstal zijn verzameld, selecteer dan representatieve kolonies in plaats van de volwassen en larvale populaties te optimaliseren voor selectie. Alle stijlen van stuifmeelvallen blokkeren de bijenkorfingang en creëren een nieuwe ingang die ruimtelijk verschilt van de oorspronkelijke ingang16. Stuifmeelvallen slagen er vaak niet in om stuifmeel te verzamelen wanneer foerageerders zich bij installatie niet kunnen heroriënteren op de nieuwe ingang van de pollenval. Deze foerageerders drijven gemakkelijk naar naburige bijenkorven en vervuilen mogelijk andere stuifmeelverzamelingsmonsters als ze een andere korf binnengaan met een stuifmeelval. Daarom moeten foerageerders ten minste 24 uur de tijd krijgen om aan de nieuwe ingang te acclimatiseren door het vangmechanisme na installatie los te houden. Het selecteren van kolonies met weinig of geen extra bijenkorfingangen vermindert ook verwarring bij het oriënteren op de nieuwe pollenvalingang.
Extra bijenkorfingangen (bijv. Gaten en kromgetrokken deksels) moeten worden afgedicht, maar het risico dat foerageerders naar naburige bijenkorven drijven, zal toenemen met deze ingangen aanwezig aan het begin van de valinstallatie. Foerageerders zullen ook gemakkelijk afdrijven naar andere bijenkorfingangen als een pollenval alleen op een enkele korf in een cluster van gepalletiseerde bijenkorven wordt geïnstalleerd. Foerageerders zullen minder snel drijven als alle bijenkorven die in dezelfde richting op de pallet staan, vallen hebben geïnstalleerd. Stuifmeelvallen van de bovenste montage kunnen een hoger risico op bijendrift vormen vanwege de aanzienlijke afstand tussen de ingang van de pollenval en de oorspronkelijke ingang van de korf. Voor deze studie werden stuifmeelvallen geïnstalleerd op meerdere honingbijenkolonies op elke experimentele locatie om rekening te houden met variatie in de hoeveelheid stuifmeel en taxa-samenstelling tussen elke honingbijenkolonie. Daarom moeten pollenvallen op meerdere kolonies worden geïnstalleerd om robuuste stuifmeelcollecties uit het landschap te bereiken, omdat de stuifmeelverzameling sterk kan variëren tussen kolonies op basis van het type plantensoort en de totale verzamelde hoeveelheid12,13. Elk stuifmeelmonster had een verzamelperiode van 7 dagen. In toekomstige studies zal het verzamelen van stuifmeel in twee of drie opeenvolgende intervallen van 72 uur de nauwkeurigheid van de schatting van stuifmeelvoer verhogen40.
Aangezien er een hoge mate van temporele fluctuatie is in de pollenverzameling, kan de nauwkeurigheid van de pollenschatting worden verhoogd door het stuifmeelverzamelingsproces te herhalen in vroege, piek- en late bloeiperioden van de beoogde teeltsystemen 24,27,39. Stuifmeel moet op meerdere locaties worden verzameld, zij het hetzelfde teeltsysteem of landschapstype, vanwege de verwachte variatie in hoeveelheid en type plantensoort tussen bijenstallocaties 14,27,33,43. Langdurige stuifmeelvangst kan schadelijk zijn voor honingbijenkolonies. Mogelijke effecten zijn onder meer verminderde broedopfok, verkorting van de groeiperiode van larven en kannibalisme van eieren en jonge larven in de bijenkorven 19,44,45,46. Langere perioden van stuifmeelvangst, zoals het hele groeiseizoen, kunnen de schadelijke effecten op de broedopfok in kolonies verergeren. Stuifmeelvangst kan ook een vermindering van de honingproductie en een toename van het vochtgehalte van opgeslagen honing veroorzaken13. Roterende stuifmeelvallen tussen kolonies in een bijenstal bij het continu monitoren van een landschap of teeltsysteem kan schade aan kolonies die worden gebruikt voor het vangen van stuifmeel verminderen. Het om de week gebruiken van stuifmeelvallen zal schadelijke effecten verminderen, met name verlies in honingproductie, als stuifmeel op dezelfde kolonies gedurende een bepaalde periode wordt gevangen13.
Daarnaast worden de stuifmeelvallen bij voorkeur op sterke kolonies geplaatst. Af en toe kunnen de pollenvallen onbedoeld in actie komen. Dit kan worden voorkomen door het pollenvalmechanisme te vergrendelen wanneer het verzamelen van stuifmeelvallen niet gewenst is. Stuifmeelvallen verwijderen niet alle corbicular stuifmeel van honingbijen foerageerders. De efficiëntie van de vang is afhankelijk van het valtype, de grootte van de stuifmeelkorrels, de lichaamsgrootte van de bijen, het tijdstip van de dag en de weersomstandigheden. Vandaar dat de verzameling van kraalpollen niet consistent is bij het gebruik van stuifmeelvallen voor verschillende plantensoorten en verzamelperioden25,26. Kleinere stuifmeelkorrels van planten zoals Eucalyptus spp. en Tamarix spp. worden minder snel gevangen door stuifmeelvallen27. Met name werd er in deze studie geen highbush blueberry (Vaccinium corymbosum L.) stuifmeel gevonden van de highbush blueberry collection sites, wat eerder bewijs ondersteunt dat highbush blueberry pollen pellets te klein zijn voor stuifmeelval collectie47. Daarentegen werd stuifmeel afkomstig van paardenbloem (Taraxacum officinale F.H. Wigg) gevonden in elk teeltsysteem in deze studie. Stuifmeelkorrels van sommige plantensoorten kunnen ook veel groter zijn dan andere, zoals Taraxacum spp., en kunnen mogelijk oververtegenwoordigd zijn in de analyse van stuifmeelverzamelingen van stuifmeelvallen27. Het vangen van individuele stuifmeel foerageerders en het handmatig verwijderen van hun corbicular pollen zal de nauwkeurigheid van een pollenbronbeoordeling verhogen, maar het is zeer tijd- en resource-intensief in vergelijking met het gebruik van pollenvallen (tabel 1). Het sorteren van stuifmeelkorrels in kleurgroepen is relatief eenvoudig, hoewel het tijdrovend is. Tenzij er een specifiek onderzoeksdoel of -doel is, moet de hoeveelheid stuifmeelkorrels worden beperkt tot 10 g of minder (voor een bepaald monster) voor het sorteren in kleurgroepen. Het sorteren van volledige monsters die grotere hoeveelheden bevatten dan deze hoeveelheid zal de tijd die nodig is om de analyse te voltooien drastisch verlengen. Het is echter van cruciaal belang dat een stuifmeelmonster zeer goed wordt gemengd voordat er een substeekproef voor kleursortering uit wordt gehaald. Het niet mengen van het oorspronkelijke monster kan resulteren in een substeekproef die niet representatief is voor het geheel, wat moet worden vermeden.
Als de oorspronkelijke monstercontainer niet genoeg vrije ruimte bevat om stuifmeelkorrels grondig te mengen, zou het voldoende moeten zijn om het hele monster in een grote plastic zak of een kleine papieren zak te plaatsen, zelfs voor grote monsters. Harde plastic, dekselcontainers zullen ook werken. Het mengen van het monster moet voorzichtig gebeuren, zodat stuifmeelkorrels niet worden geplet of anderszins worden vernietigd. Onbedoelde vooringenomenheid kan iemand onbewust overtuigen om "de mooie paarse pellets" eruit te scheppen, bijvoorbeeld bij het verwijderen van een substeekproef uit het geheel. Daarom moet de kleursamenstelling van het monster aan het zicht worden onttrokken terwijl een substeekproef wordt uitgeschept. Op deze manier is het waarschijnlijker om een substeekproef te krijgen die echt representatief is voor het geheel. Deze subsamplingmethode kan er echter niet in slagen om stuifmeelkorrels te selecteren die in lage abundantie in het monster voorkomen. Daarom, als het identificeren van elk individueel planttaxon dat in het monster wordt vertegenwoordigd een onderzoeksdoel is, is het verzamelen van een substeekproef niet geschikt; het hele monster moet worden geanalyseerd. Daarom moeten pellets worden gesorteerd in een glazen petrischaal. Zodra het sorteren is voltooid, kunnen de juiste pagina's van de Pantone-kleurengids onder het gerecht worden geplaatst om kleurafstemming tussen de gids en het gesorteerde stuifmeel gemakkelijker te maken. Een voorbeeld hiervan is geïllustreerd in figuur 5.
Bij het vangen van stuifmeel van honingbijenkolonies die in gewassen zijn geplaatst voor bestuiving, mogen niet meer dan tien totale kleurgroepen worden gebruikt: negen individuele kleuren en één "diverse" kleurgroep samengesteld uit de minderheidskleuren in het monster. Het plaatsen van een redelijke limiet op het maximale aantal kleurgroepen waarin een monster kan worden verdeeld, voorkomt dat de onderzoeker verzandt in het eindeloos scheiden van pellets in steeds grotere aantallen extreem specifieke groepen, die, wanneer het sorteren is voltooid, mogelijk niet individueel voldoende hoeveelheden bevatten voor acetolyse. Als het vangen van kolonies die waarschijnlijk foerageren uit een zeer divers assortiment plantensoorten, kunnen meer kleurgroepen nodig zijn en de protocollen moeten worden geoptimaliseerd om die vereiste te weerspiegelen. De huidige studie richtte zich op de stuifmeelmonsters verzameld van honingbijenkolonies die gewassen bestuiven, en meerdere taxa werden vaak gevonden in een kleurgroep, vergelijkbaar met eerdere studies 29,30,31.
Acetolyse lost de lipiden, eiwitten en organisch afval op van het oppervlak van stuifmeelkorrels en onthult de onderscheidende kenmerken van de exine, zodat de korrels gemakkelijker kunnen worden gekleurd en geïdentificeerd. Het is een oude en veel voorkomende methodologie die wordt gebruikt in vele soorten pollenonderzoek37. De algemene stappen zijn gestandaardiseerd; ze variëren weinig van protocol tot protocol. De specifieke kenmerken van centrifugatiesnelheden en -tijden, incubatietemperatuur en -duur, pollenhoeveelheidsgedreven reagensvolumes en zelfs supernatantverwijderingsmethode (decanteren versus pipetteren) moeten mogelijk experimenteel worden geoptimaliseerd volgens onderzoeksdoelen en, tot op zekere hoogte, de soorten pollen die waarschijnlijk zullen worden aangetroffen48. Acetolyse kan inderdaad belangrijke diagnostische kenmerken van het stuifmeel verwijderen uit sommige taxa zoals Malvaceae en Orchidaceae38. Daarom is niet alle stuifmeel vatbaar voor standaardmethoden voor acetolyse. Zoals hierboven vermeld, werden deze methoden in deze studie geoptimaliseerd met als doel het identificeren van dominante plantaardige taxonbronnen van stuifmeel verzameld door gewasbestuivende honingbijen. Details die in overweging moeten worden genomen als nauwkeurige kwantificering van stuifmeelkorrels deel uitmaakt van de studie, zijn in dit artikel niet behandeld.
Het gebruik van oplosmiddelen en zuren vereist een zorgvuldige planning, goede persoonlijke beschermingsmiddelen (PBM' s) en verantwoorde afvalverwijdering (figuur 6). Het is van cruciaal belang dat onderzoekers de juiste manier bepalen om reagentia op te slaan en afval te verwijderen voordat ze beginnen met een deel van acetolyse. In dit laboratorium worden butylhandschoenen gebruikt tijdens elk deel van het proces waarbij zwavelzuur en zelfs ijsazijn betrokken zijn, omdat ze veel betere afbraak- en permeatiewaarden hebben voor beide zuren dan nitrilhandschoenen, zonder afbreuk te doen aan de behendigheid49. Het zou verstandig zijn de veiligheidsrichtsnoeren van de betreffende instelling te raadplegen voor aanbevelingen over geschikte handschoenen en andere PBM's49. Toevoeging van ijsazijn vóór de acetolysestap helpt bij het verwijderen van achtergebleven vocht in het monster en bereidt het voor op de belangrijke acetolysereactie. Het glaciale azijnzuur-zwavelzuurmengsel in de acetolysestap kan heftig reageren met water, daarom is het belangrijk dat al het glaswerk en alle benodigdheden volledig droog zijn en dat al het vocht vóór acetolyse uit het monster wordt verwijderd. De post-acetolyse toevoeging van ijsazijn verdunt en neutraliseert het acetolysemengsel.
Met name ethanol en ijsazijn kunnen de inkt van microcentrifugebuisetiketten oplossen, als deze reagentia aan de buitenkant van de buis druppelen, zelfs met oplosmiddelbestendige pennen. Controleer de buisetiketten regelmatig tijdens het proces om er zeker van te zijn dat ze nog leesbaar zijn. Als het logistiek haalbaar is, overweeg dan om LaserJet-bedrukte etiketten te gebruiken als een bescherming tegen deze mogelijkheid. De manier waarop supernatanten worden gedecanteerd, zal van invloed zijn op de vraag of reagentia langs de buitenkant van de microcentrifugebuizen druppelen. Het is belangrijk om het supernatant te decanteren met een zelfverzekerde, soepele hand, die gepaard gaat met oefening. Er moet voor worden gezorgd dat tijdens het decanteren geen stuifmeelmonsters uit de centrifugebuis verloren gaan. Te snel decanteren riskeert een deel of alle pollenresten te verliezen; te langzaam decanteren kan ertoe leiden dat het supernatant door de buis loopt. Hoewel een incubatietemperatuur van 100 °C algemeen wordt aanbevolen, kan stuifmeel bij die temperatuur gemakkelijk "overgekookt" worden in de hoeveelheden die in dit onderzoek worden gebruikt (0,25 g), vooral als het gedurende iets langere duur wordt geïncubeerd29. Zelfs bij 80 °C kunnen stuifmeelkorrels barsten of anderszins beschadigd raken als ze te lang in het acetolysemengsel blijven zitten. De incubatietemperatuur en -duur moeten zorgvuldig worden bepaald om te voorkomen dat de stuifmeelkorrels in het monster worden vernietigd.
Het kleuren van stuifmeel verhoogt de definitie en het contrast van de exine kenmerken, waardoor het gemakkelijker wordt om te fotograferen en te identificeren (figuur 7). Vijf druppels (uit een plastic transferpipet) van 1% Safranin O kleurden effectief 0,25 g stuifmeel. Verschillende pollen kleuren echter anders. Als stuifmeelkorrels te licht of te zwaar gekleurd zijn, kan identificatie moeilijk zijn. Indien mogelijk moet het volume van de vlekoplossing dat nodig is om de pollensoorten die naar verwachting in het onderzoek zullen worden aangetroffen, op passende wijze te kleuren, worden gevalideerd voordat met de verwerking van de experimentele monsters wordt begonnen. Als een van de experimentele monsters echter niet goed gekleurd is, kan deze worden gecorrigeerd. Om een stuifmeelmonster dat te zwaar gekleurd is lichter te maken, spoelt u het monster af met water en vervolgens met ethanol. Als het stuifmeel niet goed genoeg gekleurd is om onderscheidende kenmerken te zien, kunnen een paar extra vlekken worden toegevoegd. De vlek van deze monsters moet worden gecontroleerd voordat glycerine wordt toegevoegd. Evenzo kan wat vallen en opstaan nodig zijn om het ideale volume glycerine voor de pollenresiduen te bepalen. Vijftien druppels glycerine beschermden de monsters in deze studie op passende wijze tegen uitdroging, terwijl ook het pollenresidu werd verdund tot een concentratie die ideaal is voor downstream-identificatie via lichtmicroscopie. Andere hoeveelheden pollenresidu kunnen meer of minder glycerine vereisen om uitdroging te voorkomen en montage te vergemakkelijken.
De auteurs hebben niets te onthullen.
We bedanken Dr. Gretchen Jones (USDA-ARS, APMRU, College Station, TX) voor het helpen bij het sorteren van kleuren en acetolyse-analyse. Dit onderzoek werd ondersteund door onderzoeksfondsen die aan R.R.S. werden verstrekt door de Oregon State Beekeepers Association.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved