Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Collecte et identification du pollen des colonies d’abeilles mellifères
Nous décrivons des méthodes de collecte du pollen corbiculaire des abeilles mellifères ainsi que des protocoles de tri des couleurs, d’acétolyse et de préparation du pollen sur lame de microscope pour l’identification taxonomique. En outre, nous présentons la couleur des granulés et la diversité taxonomique du pollen corbiculaire collecté à partir de cinq systèmes de culture utilisant des pièges à pollen.
Les chercheurs recueillent et analysent souvent le pollen corbiculaire des abeilles mellifères pour identifier les sources végétales sur lesquelles elles se nourrissent de pollen ou pour estimer l’exposition des abeilles aux pesticides via le pollen. La présente est décrite comme une méthode efficace de piégeage du pollen pour recueillir le pollen corbiculaire des abeilles mellifères qui retournent dans leurs ruches. Cette méthode de collecte permet d’obtenir de grandes quantités de pollen corbiculaire qui peuvent être utilisées à des fins de recherche. Les abeilles recueillent le pollen de nombreuses espèces végétales, mais visitent généralement une espèce lors de chaque voyage de collecte. Par conséquent, chaque pastille de pollen corbiculaire représente principalement une espèce végétale, et chaque pastille de pollen peut être décrite par couleur. Cela permet de trier les échantillons de pollen corbiculaire par couleur pour séparer les sources végétales. Les chercheurs peuvent classer davantage le pollen corbiculaire en analysant la morphologie des grains de pollen acétolysés pour l’identification taxonomique. Ces méthodes sont couramment utilisées dans les études liées aux pollinisateurs telles que l’efficacité de la pollinisation, la dynamique de recherche de nourriture des pollinisateurs, la qualité de l’alimentation et la diversité. Des méthodologies détaillées sont présentées pour la collecte du pollen corbiculaire à l’aide de pièges à pollen, le tri du pollen par couleur et l’acétolyse des grains de pollen. Les résultats relatifs à la fréquence des couleurs des granulés et des taxons de pollen corbiculaire prélevés sur les abeilles mellifères dans cinq systèmes de culture différents sont également présentés.
L’abeille mellifère de l’Ouest (Apis mellifera L.) est un pollinisateur important de nombreuses cultures agricoles qui dépendent de la pollinisation des abeilles1. Depuis plus d’une décennie, d’importantes pertes de colonies d’abeilles mellifères ont été signalées 2,3,4,5,6,7,8,9. Plusieurs facteurs, dont les parasites et les maladies, la mauvaise alimentation et les pesticides, ont été impliqués dans le déclin de ces colonies10. La mauvaise nutrition peut être attribuée à l’intensification de l’agriculture et à la perte d’habitat d’alimentation11. Il est impératif de comprendre les ressources florales utilisées par les abeilles dans différents paysages pour améliorer la nutrition des abeilles et contribuer aux efforts de conservation des abeilles. Le pollen est la principale source de protéines, de lipides, de vitamines et de minéraux pour les abeilles et a été utilisé dans de nombreuses études agricoles et écologiques pour comprendre les préférences des abeilles mellifères en matière de recherche de nourriture au niveau des colonies, évaluer l’impact du piégeage du pollen sur les colonies d’abeilles mellifères et déterminer l’exposition des abeilles aux pesticides12,13,14.
Les abeilles mellifères recueillent le pollen des fleurs, emballent le pollen en granulés sur leur corbicula - un panier de pollen tibial sur leur patte arrière - et retournent à la colonie pour le stockage. Le pollen corbiculaire peut être retiré des butineuses en les capturant à l’entrée de la ruche ou sur les fleurs, en les refroidissant brièvement pour les immobiliser, puis en retirant les pastilles de pollen de leurs pattes arrière avec des pinces. Le processus laborieux de collecte manuelle du pollen corbiculaire des butineuses capturées individuellement est lent et inefficace si l’on a besoin d’une quantité considérable de pollen. Une méthode plus simple et plus efficace pour collecter de grands volumes de pollen consiste à piéger les granulés de pollen corbiculaire des abeilles mellifères à l’entrée des ruches. Les pièges à pollen sont conçus pour déloger le pollen corbiculaire des pattes des butineuses de pollen qui reviennent lorsqu’elles entrent dans la ruche15. Les butineuses doivent se faufiler à travers des trous de maille dimensionnés pour permettre étroitement le passage d’un corps d’abeille mellifère.
Lorsque l’abeille passe à travers l’un de ces trous, les plus grosses pastilles de pollen sont grattées de ses pattes et tombent dans un bac de collecte16. Des études ont montré que le piégeage du pollen stimule les butineuses à collecter plus de pollen, augmentant ainsi l’efficacité de la pollinisation des cultures et de la végétation environnantes17,18,19,20. Les méthodologies de collecte de pollen peuvent également être utilisées pour comprendre le fourrage utilisé par les abeilles mellifères dans le paysage comme première étape pour déterminer la quantité, la qualité et les taxons des espèces de plantes à fleurs. Des méthodologies efficaces de piégeage du pollen facilitent ainsi à la fois la pollinisation et la recherche sur la nutrition des abeilles mellifères. Une comparaison de ces méthodes de collecte du pollen est illustrée dans le tableau 1. Le comportement de recherche de nourriture du pollen changera en fonction des besoins de la colonie en pollen stocké par rapport aux niveaux de population d’œufs et de larves21,22. Comme ces changements comprennent une intensité de collecte variable, on s’attend souvent à une forte variation de la quantité de pollen entre les colonies du même endroit et entre différents endroits du même système de culture ou du même type de paysage23,24. L’augmentation du nombre de colonies et d’emplacements pour piéger le pollen aidera à tenir compte de cette variation.
L’efficacité des pièges à pollen varie de25,26. La taille des granulés de pollen recueillis par les abeilles mellifères varie selon les espèces végétales et peut changer en fonction des niveaux de pollen stockés dans la colonie27,28. Il est donc possible que les granulés de pollen plus petits soient sous-représentés et que les granulés plus gros soient surreprésentés dans les échantillons prélevés au moyen de pièges à pollen. La taille des abeilles adultes varie, ce qui peut également affecter la représentation du pollen recueilli dans les pièges. Il existe également des espèces végétales qui produisent principalement du nectar qui ne sera pas détecté si seulement on évalue le pollen collecté dans certains paysages. L’efficacité du piégeage est également influencée par la dérive et la désorientation de la butineuse, qui sont influencées par le type de piège à pollen et l’état de l’équipement de la ruche. Ce problème peut être atténué en utilisant les techniques spécifiées dans le présent document. Les chercheurs peuvent envisager d’autres techniques de recherche, comme le comptage des visites de fleurs par les butineuses, pour compléter les résultats des préférences de recherche de nourriture au niveau de la colonie. Une méthode utile pour évaluer la diversité du pollen est le tri du pollen corbiculaire par couleur. Bien que les abeilles mellifères soient des butineuses généralistes, elles présentent également une fidélité aux fleurs, où elles recueillent le pollen des mêmes espèces végétales au même endroit au cours d’un voyage de collecte donné. Sur la base de ce comportement de recherche de nourriture, on suppose que toute pastille de pollen corbiculaire donnée est principalement représentée par une seule espèce végétale 27,29,30,31. Par conséquent, les scientifiques peuvent décrire la diversité du pollen en triant le pollen corbiculaire par couleur de pastille et en indiquant le nombre total de couleurs détectées ou la proportion du total représentée par chaque groupe de couleurs 12,32,33,34. Cela peut être accompli en mesurant la masse ou le nombre de granulés de chaque groupe de couleurs. Il est suggéré de mesurer le nombre de granulés de chaque groupe de couleurs s’il existe des différences systématiques connues ou soupçonnées dans le poids des granulés de différents taxons. Les différences systématiques pourraient être causées par la taille des granulés ou la quantité de nectar que les butineuses ajoutent au pollen lors de la formation d’une pastille.
Le tri des couleurs est un processus simple et rapide, mais peut ne pas avoir une précision acceptable pour certaines études de recherche sur la pollinisation parce que différents taxons végétaux peuvent avoir des couleurs de granulés de pollen similaires35,36. De plus, il existe une limite logistique au nombre de groupes de couleurs distincts dans lesquels les granulés de pollen peuvent être séparés. Ainsi, la séparation du pollen de chaque taxon végétal en son propre groupe de couleur de granulés distinct n’est pas toujours possible dans les études de pollinisation. La caractérisation morphologique des grains de pollen par microscopie optique complète souvent la séparation des couleurs des granulés en distinguant le pollen de deux taxons ou plus dans des granulés du même groupe de couleurs. Bien qu’il soit courant de trouver des grains de pollen de plusieurs taxons dans un groupe de couleur de pastilles de pollen donné, les granulés de pollen individuels collectés par une abeille mellifère comprennent généralement un taxon prédominant, éventuellement avec d’autres taxons en petites quantités. Ainsi, il est courant de supposer la fidélité taxonomique dans les granulés de pollen corbiculaire des abeilles mellifères. Les granulés de pollen d’autres pollinisateurs qui ne présentent pas de comportement de fidélité des fleurs, tels que les bourdons, contiennent souvent de nombreuses espèces végétales et peuvent ne pas posséder de taxon prédominant. Dans les cas où des estimations quantitatives des proportions de taxons dans les granulés de pollen polyfloral sont souhaitées, des méthodes microscopiques qui incluent l’acétolyse sont en outre nécessaires pour une analyse appropriée.
L’évaluation des caractéristiques morphologiques des grains de pollen acétolysés est la méthode la plus courante d’identification taxonomique16. La procédure d’acétolyse élimine le protoplasme du grain de pollen pour exposer les caractéristiques diagnostiques qui peuvent être observées en microscopie optique37,38. En utilisant cette méthode, les chercheurs peuvent rapporter différents taxons, la fréquence des taxons trouvés dans des systèmes de culture spécifiques et les taxons prédominants de couleurs de granulés33,36. L’acétolyse est la meilleure technique analytique pour révéler la morphologie du pollen28. Cependant, certains grains de pollen acétolysés, tels que de nombreux types de rosacées, ne peuvent pas être identifiés au niveau du genre ou de l’espèce par l’acétolyse et la microscopie optique seules. Les chercheurs considèrent la microscopie électronique à balayage ou le métacodage à barres comme des méthodes alternatives pour obtenir une identification au niveau du genre ou de l’espèce. Ces méthodes alternatives, cependant, ne fournissent qu’une identification qualitative des taxons et ne parviennent pas à estimer les proportions de différents taxons de grains de pollen dans les granulés de pollen polyfloraux36,39. De plus, le coût et l’expertise nécessaire sont considérablement plus élevés pour ces méthodes. Une comparaison de ces méthodes d’identification est illustrée au tableau 1.
| Méthode | Heure | Dépense | Résolution | Expertise |
| Collecte de pollen | ||||
| Piégeage du pollen | Bas | Modéré | Variable | Modéré |
| Collecte de pollen butineuse | Haut | Modéré | Haut | Bas |
| Pollen Identification | ||||
| Visuel (tri des couleurs uniquement) | Modéré | Bas | Bas | Bas |
| Acétolyse | Modéré | Modéré | Modéré | Modéré |
| Microscopie électronique à balayage | Haut | Haut | Haut | Haut |
| Métacode-barres | Variable | Haut | Haut | Haut |
Tableau 1 : Comparaison des différentes méthodes de collecte et d’identification du pollen en fonction du temps, des dépenses, de la résolution et de l’expertise. Les méthodes visuelles (tri des couleurs uniquement) indiquent le nombre total de couleurs détectées ou la proportion du total représentée par chaque groupe de couleurs comme mesure pour déterminer les sources de pollen, mais ne fournissent pas d’identification du taxon.
L’information disponible sur le piégeage et le tri du pollen et l’acétolyse des grains de pollen est diversifiée et souvent répartie sur de multiples sources, ce qui varie pour les chercheurs dans différents domaines. Cet article offre des informations détaillées sur les différents types de pièges à pollen qui peuvent être utilisés par les chercheurs et les apiculteurs pour collecter efficacement de grands volumes de pollen corbiculaire. Des protocoles sont également fournis pour la préparation des échantillons de pollen - par acétolyse, coloration et montage sur lame - pour l’identification des taxons végétaux. Les méthodologies détaillées ici sont complètes et constituent une ressource unique pour identifier les espèces végétales prédominantes sur lesquelles les abeilles se nourrissent dans un paysage donné, en particulier dans les systèmes de culture. Les résultats basés sur ces méthodes d’une étude précédente ont été présentés et documentent la diversité des couleurs des pastilles de pollen et des taxons végétaux du pollen corbiculaire collecté par les abeilles mellifères dans cinq systèmes de culture14.
1. Collecte du pollen corbiculaire des colonies d’abeilles mellifères à l’aide de pièges à pollen
- Déterminez quand piéger le pollen à partir de l’emplacement de rucher souhaité.
REMARQUE: Les conditions climatiques idéales comprennent une exposition au plein soleil, de faibles vitesses de vent, une faible humidité et aucune précipitation prévue pendant la période souhaitée pour la collecte du pollen. - Sélectionnez les colonies d’abeilles mellifères optimales pour piéger le pollen dans l’emplacement du rucher.
- Évaluez la force de la colonie en comptant les butineuses qui retournent à l’entrée de la colonie pendant 2 minutes. Sélectionnez les colonies ayant le plus grand nombre total de butineuses de retour.
- Choisissez des ruches en bois en bon état, de préférence sans entrées supplémentaires ni couvercles déformés. Utilisez des colonies avec moins d’entrées alternatives, car elles ont une probabilité accrue de retour des butineuses en se réorientant vers l’entrée du piège.
- Choisissez des entrées de ruche orientées au sud dans la mesure du possible. Si les ruches sont palettisées, installez des pièges à pollen sur chaque colonie orientée dans la même direction sur une palette donnée pour éviter la dérive des butineuses dans les entrées de ruches voisines.
- Si vous le souhaitez, évaluez le nid de couvain de la colonie en inspectant les cadres pour détecter la présence de larves. Sélectionnez des colonies avec des quantités relativement importantes de larves.
- Installez des pièges à pollen sur les colonies d’abeilles sélectionnées.
REMARQUE: L’installation diffère en fonction du type de piège à pollen. Les types comprennent a) montage frontal, b) montage inférieur, c) montage supérieur ou d) montage d’entrée à trou de tarière. Voir la section discussion pour plus de détails.- Pour les pièges montés à l’avant, fixez le piège devant l’entrée avec des agrafes, des vis et du ruban adhésif, ou connectez le piège à des cordons élastiques enroulés autour de la ruche. Pour les pièges montés sur le fond, placez le piège sous la boîte de ruche la plus basse et fixez l’entrée du piège près de l’entrée d’origine. Pour les pièges à vis sans fin, fixez le piège directement devant un trou de vis sans fin d’une boîte à ruche à l’aide d’agrafes, de vis et de ruban adhésif. Pour les pièges montés sur le dessus, placez le piège au-dessus de la boîte de ruche supérieure et sous le couvercle.
- Scellez toutes les autres entrées possibles dans la colonie en utilisant un matériau non adhésif et moulable, tel que du latex ou de la mousse de polyuréthane, ou un tissu de quincaillerie #8 (ouverture de 2,7 mm) pour les trous de tarière. Utilisez du ruban adhésif pour les petites fissures.
- Si vous utilisez des pièges montés à l’avant, placez une barrière, comme un tapis de caoutchouc, entre le panier de collecte et l’herbe pour éviter les dommages causés par l’humidité causée par la rosée.
- Enclenchez le mécanisme de piégeage du piège à pollen 24 h après l’installation et avant le début du vol de recherche de nourriture de la journée (tard le soir ou tôt le matin).
REMARQUE: Cette étape est idéale, mais pas nécessaire. Engagez des pièges à pollen toutes les deux semaines si vous piégez du pollen sur les mêmes colonies pendant une période donnée. - Recueillez le pollen corbiculaire du plateau de collecte, placez-le dans des sacs en plastique ou des tubes à centrifuger et conservez-le dans une glacière avec de la glace.
- Pour évaluer la diversité et l’abondance des espèces de pollen, par exemple par des études nutritionnelles à l’échelle du paysage, recueillir le pollen à deux ou trois intervalles de 72 heures40.
- Pour l’analyse des résidus de pesticides, prélever le pollen à intervalles de 24 h à 96 h avec un minimum de 3 g pour le traitement41.
- Nettoyez le pollen en enlevant les parties d’abeilles et autres débris de ruche.
REMARQUE: Utilisez des gants jetables lorsque vous manipulez des échantillons de pollen et changez les gants jetables entre les échantillons. Utilisez des outils distincts pour enlever les débris du pollen recueilli dans chaque piège. Rincer et sécher avant d’utiliser les outils pour un autre lot de pollen piégé. - Entreposer le pollen à -20 °C ou moins pour maintenir son intégrité de composition si le pollen est destiné à l’identification des sources de pollen, à l’évaluation des quantités ou à l’analyse des résidus de pesticides41,42.
- Après avoir retiré les pièges des ruches, stérilisez tout l’équipement dans une solution d’eau de Javel à 5%, rincez et séchez l’équipement avant la prochaine utilisation.
2. Tri des couleurs des pastilles de pollen pour l’identification des sources de pollen en aval et l’évaluation de la quantité
- Assurez-vous qu’il y a au moins 20 g d’échantillon de pollen avec lequel travailler. Bien mélanger l’échantillon de pollen dans son sac ou dans un autre récipient de taille appropriée pour obtenir un mélange homogène de toutes les granulés qu’il contient. Pour éviter tout biais involontaire à l’étape suivante, masquez la composition de couleur de l’échantillon avant de retirer un sous-échantillon du sac d’échantillon.
- À l’aide d’une cuillère ou d’une grande cuillère, prélever 10 g de pollen comme sous-échantillon représentatif de l’ensemble. Versez lentement les granulés de la pelle sur la balance jusqu’à ce que l’écran indique 10 g. Si la première cuillère n’était pas assez grande, récupérez une autre cuillère de l’échantillon de la même manière.
REMARQUE : Ces exigences de poids spécifiées (20 g et 10 g) ne servent qu’à titre d’exemple. Les chercheurs devraient ajuster la quantité de pollen utilisée à chaque étape en fonction de besoins spécifiques. - Retirez toutes les parties d’abeilles et autres débris du sous-échantillon de 10 g. Ensuite, si nécessaire, ajoutez un peu plus de pollen de l’échantillon original pour obtenir un poids total de 10 g du sous-échantillon.
- Triez chaque pastille de pollen du sous-échantillon de 10 g dans un groupe de couleur. Utilisez à la fois la couleur et la texture du pollen pour différencier les groupes de couleurs.
REMARQUE: Certaines variations au sein d’un groupe sont attendues, mais l’utilisation du guide de couleur Pantone pendant le tri peut augmenter la cohérence. - Pour assurer au moins 0,25 g de chaque groupe de couleurs pour les étapes en aval, placez les granulés qui ne sont pas assez abondants pour former un groupe de couleur d’au moins 0,25 g dans un groupe divers. Nommez chaque groupe de couleurs à l’aide du guide de couleurs Pantone. Étiquetez le groupe divers divers.
- Pesez chaque groupe de couleurs sur un papier de pesage séparé et/ou comptez le nombre de granulés dans chaque groupe de couleurs. Enregistrez les noms et les poids ou les nombres des groupes de couleurs sur une feuille de données.
REMARQUE: Le choix de peser ou de compter le nombre de granulés dans chaque groupe de couleurs dépend de la mesure d’intérêt du chercheur et des objectifs du projet. - Créez une étiquette de tube microcentrifuge pour chaque groupe de couleurs à l’aide d’un stylo résistant aux solvants et d’étiquettes de tubes en papier adhésif. Indiquez la date actuelle, l’identificateur de l’échantillon, la date de prélèvement de l’échantillon et le numéro du groupe de couleurs sur l’étiquette. Appliquez les étiquettes sur des tubes microcentrifugeuses propres et secs de 2 mL.
- Peser 0,25 g (± 0,05 g) de pastilles de pollen de chaque groupe de couleur et placer cette quantité dans le tube microcentrifuge correctement étiqueté.
REMARQUE: S’il y a une légère variation de couleur ou de texture dans le pollen d’un groupe de couleurs donné, assurez-vous qu’il y a un échantillon représentatif de granulés dans chaque tube. Les volumes de réactifs et les temps d’incubation et de centrifugation qui suivent sont appropriés pour 0,25 g de pollen. Par conséquent, utilisez cette quantité de pollen dans les tubes de microcentrifugation à utiliser dans l’acétolyse. Ce protocole devrait fournir suffisamment de pollen coloré pour l’identification des sources végétales en aval par microscopie optique. Si vous utilisez une quantité différente de pollen dans l’acétolyse, les spécificités du volume de réactif et des temps de traitement doivent être ajustées en conséquence. - Placez le pollen restant de chaque groupe de couleurs dans des sacs en plastique individuels (un sac par couleur) étiquetés avec le nom du groupe de couleurs. Conserver ces sacs avec les autres parties de l’échantillon original approprié dans un stockage à -20 °C.
- Bien mélanger le pollen dans le tube avec un cure-dent en bois propre pendant 10 à 15 s.
3. Préparation à l’acétolyse
- Avant de commencer une partie de l’acétolyse pour la première fois, communiquez avec le service de santé et de sécurité environnementales (ESS) de l’établissement désigné pour obtenir des instructions sur la façon dont les réactifs et les déchets liés à l’acétolyse doivent être manipulés.
- Obtenir des solutions mères des réactifs suivants et les placer dans la hotte conformément aux directives EHS pour le stockage des produits chimiques: éthanol à 95%; eau distillée; acide acétique glacial, anhydre; acide sulfurique concentré; Glycérine; et vernis à ongles transparent.
- Préparer des solutions mères des réactifs suivants et les placer dans la hotte conformément aux directives EHS pour le stockage des produits chimiques: bicarbonate de sodium saturé (solution à 8% p/v dans de l’eau distillée); et safranine O (solution à 1 % p/v dans de l’éthanol à 50 %).
4. Acétolyse
- Effectuer la procédure de pré-acétolyse de lavage à l’acide acétique glacial. Effectuez les étapes suivantes dans la hotte avec une blouse de laboratoire, une protection oculaire et des gants en nitrile.
- Allumez un bloc de chaleur à 80 °C.
REMARQUE: Assurez-vous qu’un flacon pressé de bicarbonate de sodium saturé est facilement accessible. Cela peut être utilisé pour neutraliser les déversements d’acide dans la hotte s’ils se produisent. - Étiquetez un bécher en verre pour les déchets acides, un pour les déchets d’éthanol et un pour le mélange d’acétolyse.
- À l’aide de solutions mères préparées antérieurement, créer des aliquotes fonctionnelles des réactifs suivants dans des béchers en verre étiquetés de taille appropriée : ~23,0 mL d’acide acétique glacial; ~33,0 mL d’eau distillée; ~23,0 mL d’éthanol à 95 %; ~25,0 mL de bicarbonate de sodium (pour les déchets solides contaminés par l’acide).
NOTE: Ce sont les volumes requis pour compléter les procédures d’acétolyse suivantes sur un total de 10 échantillons de groupe de couleur (10 tubes microcentrifuges). - Ajouter lentement 500 μL d’acide acétique glacial à chaque tube de microcentrifugation contenant 0,25 g de pollen de groupe de couleur. Lors de l’inspection visuelle du tube, remuez le pollen avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé. Placer le cure-dent usagé dans le bécher à déchets de bicarbonate de sodium après utilisation; Répétez ce processus pour chaque tube.
REMARQUE: Utilisez un cure-dent propre et neuf pour chaque tube. Assurez-vous que le couvercle de chaque tube est bien fermé. - Centrifuger les échantillons pendant 3 min à 1 100 × g. Décanter le surnageant des tubes dans le bécher de déchets acides. Ensuite, touchez doucement et brièvement l’embouchure ouverte du tube avec une serviette en papier propre pour éliminer l’acide acétique glacial résiduel autour du bord du tube.
REMARQUE : Veillez à ne pas perdre la pastille de pollen lors de la décantation des surnageants.
- Allumez un bloc de chaleur à 80 °C.
- Effectuer la procédure d’acétolyse.
REMARQUE: Effectuez les étapes suivantes dans la hotte avec une blouse de laboratoire, une protection oculaire et des gants en vinyle butyle.- Préparer le mélange d’acétolyse (acide acétique glacial 9:1:acide sulfurique) en ajoutant d’abord 10,8 mL d’acide acétique glacial (à partir de l’aliquote de travail) au mélange d’acétolyse étiqueté du bécher. Ensuite, à l’aide d’une pipette de 1000 μL munie d’embouts de pipette filtrés de 1250 μL, ajouter lentement 1200 μL (1,2 mL) d’acide sulfurique concentré de la solution mère au bécher à mélange d’acétolyse contenant de l’acide acétique glacial. Jeter l’embout de la pipette usagée dans le bécher en bicarbonate de sodium.
REMARQUE: Le bécher à mélange d’acétolyse peut devenir chaud au toucher et le mélange peut jaunir. Il y a deux possibilités qui font que le mélange prend une couleur foncée: (a) les réactifs peuvent avoir dépassé leur date de péremption, ou (b) trop d’acide sulfurique peut avoir été ajouté. Dans tous les cas, si le mélange devient sombre, jetez-le dans le bécher de déchets acides et préparez un mélange d’acétolyse frais. - Remuez doucement le mélange d’acétolyse avec une tige de verre ou un bâtonnet en bois pour vous assurer qu’il est homogénéisé. Placez la tige ou le bâton usagé dans le bécher en bicarbonate de sodium.
- À l’aide d’une pipette de 1000 μL avec des pointes de pipette filtrées de 1250 μL, ajouter lentement 1000 μL de mélange d’acétolyse du bécher à chaque tube. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé. Placez le cure-dent usagé dans le bécher à déchets de bicarbonate de sodium après utilisation.
REMARQUE: Utilisez un cure-dent neuf propre pour chaque échantillon. - Placer les échantillons sur le bloc thermique préchauffé (80 °C). Incuber les tubes pendant 5 min, en remuant soigneusement chaque tube avec un cure-dent propre à mi-chemin de l’incubation. Placez chaque cure-dent utilisé dans le bécher de bicarbonate de sodium après utilisation.
REMARQUE: Ne laissez pas de cure-dents dans les échantillons; L’acide va les dissoudre.
- Préparer le mélange d’acétolyse (acide acétique glacial 9:1:acide sulfurique) en ajoutant d’abord 10,8 mL d’acide acétique glacial (à partir de l’aliquote de travail) au mélange d’acétolyse étiqueté du bécher. Ensuite, à l’aide d’une pipette de 1000 μL munie d’embouts de pipette filtrés de 1250 μL, ajouter lentement 1200 μL (1,2 mL) d’acide sulfurique concentré de la solution mère au bécher à mélange d’acétolyse contenant de l’acide acétique glacial. Jeter l’embout de la pipette usagée dans le bécher en bicarbonate de sodium.
- Effectuer la procédure de lavage à l’acide acétique glacial post-acétolyse.
REMARQUE: Effectuez les étapes suivantes dans la hotte avec une blouse de laboratoire, une protection oculaire et des gants en vinyle butyle.- Ajouter lentement 500 μL d’acide acétique glacial à chaque tube. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé. Placez le cure-dent usagé dans le bécher de bicarbonate de sodium après utilisation.
REMARQUE: Utilisez un cure-dent neuf propre pour chaque échantillon. Assurez-vous que le couvercle de chaque tube est bien fermé. - Centrifuger les échantillons pendant 3 min à 1 100 × g. Décanter le surnageant de chaque tube dans le bécher de déchets acides. Ensuite, touchez doucement et brièvement l’embouchure ouverte du tube avec une serviette en papier propre pour éliminer l’acide résiduel autour du bord du tube.
- Rincez soigneusement les gants en vinyle butyle sous l’eau courante pendant au moins 30 s, retirez-les et mettez-les à sécher.
REMARQUE: Suivez les directives du fabricant sur la réutilisation des gants en vinyle butyle.
- Ajouter lentement 500 μL d’acide acétique glacial à chaque tube. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé. Placez le cure-dent usagé dans le bécher de bicarbonate de sodium après utilisation.
- Effectuer trois rinçages à l’eau pour chaque échantillon. Effectuez les étapes suivantes dans la hotte avec une blouse de laboratoire, une protection oculaire et des gants en nitrile.
- Ajouter 1000 μL d’eau distillée du bécher d’eau distillée à chaque tube. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé. Placez le cure-dent dans le bécher en bicarbonate de sodium après utilisation.
REMARQUE: Utilisez un cure-dent neuf propre pour chaque échantillon. Assurez-vous que le couvercle de chaque tube est bien fermé. - Centrifuger les échantillons pendant 3 min à 1 100 × g. Décanter le surnageant des tubes dans le bécher de bicarbonate de sodium. Ensuite, touchez doucement l’embouchure ouverte du tube avec une serviette en papier propre pour éliminer l’eau résiduelle autour du bord du tube.
- Répétez les étapes 4.4.1 à 4.4.2 deux fois de plus pour un total de trois rinçages à l’eau.
- Ajouter 1000 μL d’eau distillée du bécher d’eau distillée à chaque tube. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé. Placez le cure-dent dans le bécher en bicarbonate de sodium après utilisation.
- Effectuer le rinçage à l’éthanol pour chaque échantillon.
REMARQUE: Effectuez les étapes suivantes dans la hotte avec une blouse de laboratoire, une protection oculaire et des gants en nitrile.- À l’aide d’une pipette de 1000 μL avec des pointes de pipette filtrées de 1250 μL, ajoutez 1000 μL d’éthanol à 95% du bécher d’éthanol à chaque tube. Jeter l’embout de la pipette dans les déchets non dangereux. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé.
REMARQUE: Placez le cure-dent dans le bécher à déchets de bicarbonate de sodium après utilisation. Utilisez un cure-dent propre et neuf pour chaque échantillon. Assurez-vous que le couvercle de chaque tube est bien fermé. - Centrifuger les échantillons pendant 3 min à 1 100 × g. Décanter le surnageant des tubes dans le bécher de déchets d’éthanol et toucher doucement l’embouchure ouverte du tube avec une serviette en papier propre pour éliminer l’éthanol résiduel du tube.
- À l’aide d’une pipette de 1000 μL avec des pointes de pipette filtrées de 1250 μL, ajoutez 1000 μL d’éthanol à 95% du bécher d’éthanol à chaque tube. Jeter l’embout de la pipette dans les déchets non dangereux. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé.
- Portez une blouse de laboratoire, une protection oculaire et des gants en nitrile pour tacher les échantillons. Mélanger la solution de teinture Safranin O en utilisant une légère inversion.
- À l’aide d’une pipette de transfert en plastique jetable, ajouter 5 à 10 gouttes de colorant Safranin O dans chaque tube. Lors de l’inspection visuelle du tube, remuez avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé. Laissez le cure-dent dans le tube.
- À l’aide d’une pipette de 1000 μL avec des pointes de pipette filtrées de 1250 μL, ajoutez 1000 μL d’éthanol à 95% du bécher d’éthanol à chaque tube. Jeter l’embout de la pipette dans les déchets non dangereux. Tout en inspectant visuellement le tube, remuer avec le cure-dent pendant 10-15 s et s’assurer que le contenu du tube est bien mélangé. Placez le cure-dent usagé dans les déchets non dangereux après utilisation.
- Assurez-vous que le couvercle de chaque tube est bien fermé. Centrifuger pendant 3 min à 1 100 × g. Décanter le surnageant dans le bécher à déchets d’éthanol.
REMARQUE: Ne touchez pas l’embouchure du tube avec une serviette en papier cette fois. - Ajouter 10-15 gouttes de glycérine à chaque tube à l’aide d’une pipette de transfert jetable en plastique. Lors de l’inspection visuelle du tube, remuez le contenu du tube avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé.
REMARQUE: Placez le cure-dent usagé dans les déchets non dangereux après utilisation. Utilisez un cure-dent propre et neuf pour chaque échantillon. Assurez-vous que toutes les étiquettes des tubes sont lisibles.
- Laissez les tubes ouverts dans la hotte pour évaporer l’éthanol pendant au moins 2 h à température ambiante. Vérifiez les échantillons pour l’odeur d’éthanol: si elle est détectable, les échantillons ne sont pas prêts et doivent être laissés à sécher jusqu’à ce que l’odeur d’éthanol se dissipe.
- Nettoyez tous les matériaux et éliminez les déchets. Éteignez la centrifugeuse et le bloc thermique. Éliminer tous les déchets solides et liquides conformément aux lignes directrices de l’établissement désigné, en matière de santé et de sécurité environnementales.
- Préparer des lames de microscope pour l’identification du pollen; étiquetez-les lisiblement. Étiquetez une lame de microscope en verre propre de manière appropriée pour chaque groupe de couleurs / échantillon qui sera monté. Tout en inspectant visuellement le tube, remuez l’échantillon avec un cure-dent propre pendant 10-15 s et assurez-vous que le contenu du tube est bien mélangé.
REMARQUE: La préparation des lames peut être effectuée au laboratoire. Jetez le cure-dent dans les déchets non dangereux. Utilisez un cure-dent propre et neuf pour chaque échantillon.- À l’aide d’une pipette de transfert en plastique propre et jetable, retirez 1 goutte de résidu de pollen d’un tube et placez-la au centre de sa lame de microscope étiquetée. Laissez la goutte s’étaler légèrement. Placez un bordereau de couverture propre sur la goutte sur la glissière.
- Une fois la lame sèche, scellez le couvercle sur la lame avec du vernis à ongles transparent. Placez une petite goutte de vernis sur chaque coin du couvercle et peignez une bordure de vernis autour du périmètre du couvercle où il rencontre la glissière. Laissez le vernis à ongles sécher complètement et peignez une deuxième couche de vernis autour du périmètre de la lame.
Une étude antérieure a rapporté l’évaluation de la diversité du pollen recueilli par les abeilles mellifères dans les cultures agricoles suivantes: amande, cerise, bleuets en corymbe, carotte hybride et limnanthe14. À l’aide des méthodes décrites, le pollen corbiculaire a été recueilli, trié par couleur, et les sources végétales de chaque groupe de couleur de granulés ont été identifiées pour évaluer la diversité pollinique. Des pièges à pollen montés sur le fond ont été installés sur des colonies dans plusieurs sites pour chaque culture (figure 1A). La quantité de pollen recueillie sur chaque site était suffisante pour répondre aux exigences de poids de l’échantillon des méthodes de tri des couleurs et d’analyse de l’acétolyse. Chaque échantillon de pollen de collecte avait plusieurs groupes de couleurs distincts (Figure 2 et Figure 3). Dans certains échantillons, les groupes de couleur pollinique contenaient aussi peu que 4-5 pastilles; cependant, la plupart des groupes avaient beaucoup plus que cela et ont donc servi de leur propre groupe de couleur étiqueté pour l’acétolyse (Figure 4 et Figure 5). Après l’acétolyse (figure 6), la microscopie optique à fond clair a été utilisée pour identifier efficacement chaque groupe de couleurs à son rang taxonomique le plus bas possible en confirmant les caractéristiques morphologiques avec celles des spécimens de référence prélevés dans la zone entourant chaque site d’étude (figure 7).

Figure 1 : Pièges à pollen installés sur une colonie d’abeilles mellifères pour recueillir le pollen corbiculaire. (A) Pièges montés sur le fond placés au-dessus du panneau inférieur de la ruche et directement au-dessus de la boîte de ruche la plus basse. D’autres styles de pièges à pollen comprennent (B) des pièges à montage frontal et (C) des pièges à montage d’entrée de trou de tarière. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Mécanisme de piégeage et plateau de collecte du piège à pollen. Les butineuses de pollen qui reviennent doivent se faufiler à travers le mécanisme de piégeage des mailles avant d’atteindre leur ruche. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Plateau de collecte du piège à pollen. Le pollen corbiculaire est gratté des pattes des butineuses de pollen de retour par le piège à pollen et tombe dans le bac de collecte. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Tri d’un échantillon de pollen corbiculaire en groupes de couleurs. Le pollen corbiculaire peut être séché et pesé après avoir été trié en groupes de couleurs pour signaler les proportions de granulés de différentes couleurs collectés. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5: Quatre groupes de pastilles de pollen triées par couleur à l’aide du guide des couleurs Pantone. Les groupes de couleurs sont étiquetés comme (A) gris, Pantone 5855C, (B) marron, Pantone 7557C, (C) jaune, Pantone 458C et (D) brun clair, Pantone 3547C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
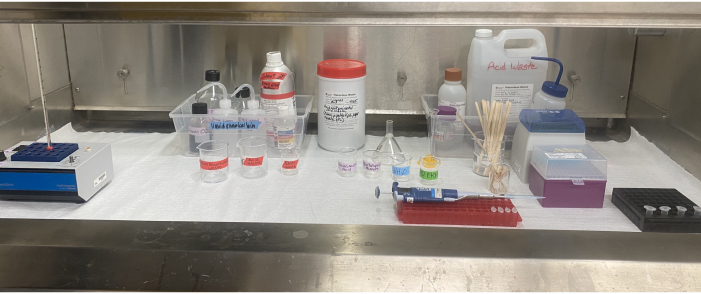
Figure 6 : Configuration de l’équipement d’acétolyse à l’intérieur de la hotte. Le bloc thermique, les réactifs, les déchets de solvants et les conteneurs de déchets acides, les béchers étiquetés, les pipettes, les embouts de pipettes, les bâtonnets d’agitation et les tubes de microcentrifugation situés à l’intérieur de la hotte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
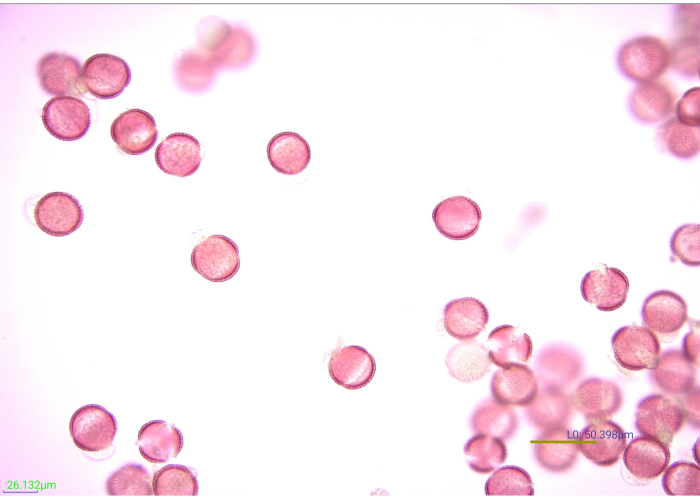
Figure 7 : Micrographie des grains de pollen colorés et acétolysés. De nombreuses facettes de grains de pollen de moutarde acétolysée (Brassicaceae) à un grossissement de 40x. Barre d’échelle = 50,398 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le pollen prélevé dans les sites de culture d’amandes présentait une diversité pollinique relativement plus faible que le pollen prélevé sur d’autres cultures, avec une moyenne de 3,0 ± 0,5 couleur de granulés et de 3,2 ± 1,2 taxon de plantes par site (tableau 2)14. Les quatre autres systèmes de culture présentaient des niveaux de diversité pollinique plus élevés avec une moyenne de 6,0 ± 2,0 couleurs de granulés et 8,0 ± 1,5 taxons de plantes par site chez les cerises, 8,8 ± 1,4 couleurs de granulés et 13,5 ± 2,0 taxons végétaux par site chez le bleuet en corymbe, 7,0 ± 1,0 colorants de granulés et 11,0 ± 0,0 taxons végétaux par site chez la carotte hybride, et 10,0 ± 0,0 colorants de granulés et 13,0 ± 1,5 taxons végétaux par site chez la limnanthe14.
| Jabot | Nombre moyen de couleurs/site de pastilles de pollen (SE) | Nombre moyen de taxons/sites végétaux (SE) | Total des taxons identifiés | ||
| Famille | Genre | Espèce | |||
| Amande | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| Myrtille | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| Carotte | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| Cerise | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| Limnanthe | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
Tableau 2 : Diversité du pollen corbiculaire prélevé sur les abeilles mellifères dans cinq systèmes de culture. Les mesures de diversité comprennent le nombre moyen de couleurs de granulés (± SE), le nombre moyen de taxons végétaux (± SE) et le nombre total de taxons identifiés. Ce tableau a été modifié à partir de14. Abréviation : SE = erreur-type.
Différents styles de pièges à pollen ont leurs propres avantages et conséquences. Les avantages et les limites de quatre styles de pièges couramment utilisés, (1) les pièges à pollen à montage frontal, (2) les pièges à pollen à montage inférieur, (3) les pièges à pollen à montage supérieur et (4) les pièges à pollen montés sur le dessus sont discutés ci-dessous. Les pièges à montage frontal sont le style le plus polyvalent (Figure 1B). L’installation est rapide et facile; cela peut être fait sans soulever de boîtes de ruche, et ces pièges peuvent s’adapter à n’importe quel style d’équipement de ruche Langstroth. Comme le plateau de collecte se trouve devant la colonie, il recueille un minimum de débris de la colonie. Cependant, le plateau de collecte est également plus exposé aux éléments externes - l’humidité provenant de l’irrigation des champs, du temps pluvieux ou humide, ou de la rosée peut entrer en contact avec le pollen à travers le plateau de collecte, rendant potentiellement le pollen inutilisable si les granulés deviennent trop saturés pour se séparer. Le risque de saturation pollinique peut être réduit en évitant le piégeage lors d’événements prévus de pluie ou d’humidité élevée. Le fait de placer un tapis de caoutchouc sous le piège et un matériau de revêtement supplémentaire (p. ex., feutre de toiture) sur le dessus du piège à pollen peut également protéger le plateau de collecte des intempéries.
Des pièges montés sur le fond ont été utilisés pour recueillir le pollen pour les données du présent document (figure 1A). Ils ne sont pas aussi pratiques à installer car ils doivent être placés sous le nid de couvain de la colonie. L’installation prend beaucoup de temps et entraîne la chute d’un volume élevé de débris dans le piège de la colonie, tels que des parties d’abeilles et de petits morceaux de cire. Le plancher du plateau de collecte pour la plupart des pièges à montage inférieur fabriqués est fait de mailles fines, ce qui permet une ventilation adéquate pour protéger le pollen recueilli de l’humidité. Les pièges à pollen à trous de tarière aident à minimiser la désorientation des butineuses si elles utilisent principalement des trous de tarière comme entrées de ruche au lieu de l’entrée faite par le panneau inférieur de la ruche (figure 1C). Comme le bac de collecte des pièges à pollen à trous de tarière est très petit, il doit être vidé fréquemment pour éviter de déborder du bac de collecte. Compte tenu de son emplacement supérieur sur une ruche, le piège à pollen monté sur le dessus est le type de piège le plus facile à installer et à enlever, et l’échantillon de pollen collecté est exempt de débris de ruche. Cependant, ce type de piège est extrêmement sensible à l’équipement de ruche endommagé, car le plateau de collecte serait exposé à l’humidité si le couvercle, le couvercle intérieur et la boîte supérieure de la ruche ne sont pas correctement scellés ensemble.
Les protocoles décrits ici prévoient la sélection de colonies ayant de grandes populations d’adultes et de larves (étape 1.2). Cette méthode de sélection est destinée à produire de très grandes quantités de pollen piégé à partir de ces colonies. Les colonies ayant d’importantes populations d’aliments peuvent connaître une forte congestion à l’entrée lors de l’installation des pièges. Le choix d’une grande entrée de ruche réduira la congestion. Les grandes populations butineuses peuvent également recueillir de très grandes quantités de pollen qui peuvent dépasser les limites du plateau de collecte. Utilisez des plateaux de collecte volumineux, comme on le voit avec la plupart des styles de pièges montés en bas ou en haut, et des plateaux vides fréquemment pour accueillir de grandes quantités de pollen piégé. Si l’objectif de recherche souhaité est d’évaluer les quantités de pollen recueillies par les colonies dans un rucher, sélectionner des colonies représentatives au lieu d’optimiser les populations adultes et larvaires pour la sélection. Tous les styles de pièges à pollen bloquent l’entrée de la ruche et créent une nouvelle entrée qui diffère spatialement de l’entrée originale16. Les pièges à pollen ne parviennent généralement pas à recueillir le pollen lorsque les butineuses sont incapables de se réorienter vers la nouvelle entrée du piège à pollen lors de l’installation. Ces butineuses dérivent facilement vers les ruches voisines, contaminant potentiellement d’autres échantillons de pollen s’ils pénètrent dans une autre ruche avec un piège à pollen. Par conséquent, les butineuses doivent avoir au moins 24 heures pour s’acclimater à la nouvelle entrée en gardant le mécanisme de piégeage désengagé après l’installation. La sélection de colonies avec peu ou pas d’entrées de ruche supplémentaires réduit également la confusion lors de l’orientation vers la nouvelle entrée du piège à pollen.
Les entrées de ruches supplémentaires (p. ex. trous et couvercles déformés) doivent être scellées, mais le risque que les butineuses dérivent vers les ruches voisines augmentera avec ces entrées présentes au début de l’installation des pièges. Les butineuses dériveront également facilement dans d’autres entrées de ruches si un piège à pollen n’est installé que sur une seule ruche dans un groupe de ruches palettisées. Les butineuses sont moins susceptibles de dériver si toutes les ruches qui font face à la même direction sur la palette ont des pièges installés. Les pièges à pollen montés sur le dessus peuvent présenter un risque plus élevé de dérive des abeilles en raison de la distance importante entre l’entrée du piège à pollen et l’entrée d’origine de la ruche. Pour cette étude, des pièges à pollen ont été installés sur plusieurs colonies d’abeilles mellifères dans chaque site expérimental pour tenir compte de la variation de la quantité de pollen et de la composition des taxons entre chaque colonie d’abeilles mellifères. Ainsi, des pièges à pollen devraient être installés sur plusieurs colonies pour obtenir des collections de pollen robustes dans le paysage, car la collecte de pollen peut varier considérablement d’une colonie à l’autre en fonction du type d’espèce végétale et de la quantité totale collectée12,13. Chaque échantillon de pollen avait une période de collecte de 7 jours. Dans les études futures, la collecte du pollen à deux ou trois intervalles consécutifs de 72 heures augmentera la précision de l’estimation du fourrage pollinique40.
Comme il existe un degré élevé de fluctuation temporelle dans la collecte du pollen, la précision de l’estimation du pollen pourrait être augmentée en répétant le processus de collecte du pollen pendant les périodes de floraison précoce, maximale et tardive des systèmes de culture ciblés24,27,39. Le pollen devrait être prélevé à plusieurs endroits, bien qu’il s’agisse du même système de culture ou du même type de paysage, en raison de la variation prévue de la quantité et du type d’espèces végétales entre les sites ruchers 14,27,33,43. Le piégeage du pollen à long terme peut nuire aux colonies d’abeilles mellifères. Les impacts potentiels comprennent la réduction de l’élevage des couvées, le raccourcissement de la période de croissance larvaire et le cannibalisme des œufs et des jeunes larves dans les ruches 19,44,45,46. Des périodes plus longues de piégeage du pollen, comme toute la saison de croissance, peuvent aggraver les effets néfastes sur l’élevage des couvées en colonies. Le piégeage du pollen peut également entraîner une réduction de la production de miel et une augmentation du niveau d’humidité du miel stocké13. La rotation des pièges à pollen entre les colonies d’un rucher lors de la surveillance continue d’un paysage ou d’un système de culture pourrait atténuer les dommages causés aux colonies utilisées pour le piégeage du pollen. L’engagement de pièges à pollen toutes les deux semaines réduira les effets néfastes, en particulier la perte de production de miel, si le piégeage du pollen sur les mêmes colonies pendant une période de temps13.
De plus, les pièges à pollen sont de préférence placés sur des colonies fortes. Parfois, les pièges à pollen peuvent s’engager involontairement. Cela pourrait être évité en verrouillant le mécanisme de piège à pollen lorsque la collecte du piège à pollen n’est pas souhaitée. Les pièges à pollen n’éliminent pas tout le pollen corbiculaire des butineuses d’abeilles mellifères. L’efficacité du piégeage dépend du type de piège, de la taille des pastilles de pollen, de la taille du corps de l’abeille, de l’heure de la journée et des conditions météorologiques. Par conséquent, la collecte de pollen corbiculaire n’est pas uniforme lors de l’utilisation de pièges à pollen pour différentes espèces végétales et périodesde collecte 25,26. Les granulés de pollen plus petits provenant de plantes telles que Eucalyptus spp. et Tamarix spp. sont moins susceptibles d’être capturés par les pièges à pollen27. Notamment, aucun pollen de bleuets en corymbe (Vaccinium corymbosum L.) n’a été trouvé dans les sites de collecte de bleuets en corymbe dans cette étude, ce qui confirme les preuves antérieures que les granulés de pollen de bleuets en corymbe sont trop petits pour la collecte de pièges à pollen47. En revanche, du pollen provenant de pissenlit (Taraxacum officinale F.H. Wigg) a été trouvé dans tous les systèmes de culture de cette étude. Les granulés de pollen de certaines espèces végétales peuvent également être beaucoup plus gros que d’autres, comme Taraxacum spp., et pourraient éventuellement être surreprésentés dans l’analyse des collections de pollen des pièges à pollen27. La capture de butineuses de pollen individuelles et l’élimination manuelle de leur pollen corbiculaire augmenteront la précision d’une évaluation des sources de pollen, mais cela demande beaucoup de temps et de ressources par rapport à l’utilisation de pièges à pollen (tableau 1). Le tri des granulés de pollen en groupes de couleurs est relativement simple, bien que cela prenne du temps. À moins qu’il n’y ait un but ou un objectif de recherche spécifique, la quantité de granulés de pollen devrait être limitée à 10 g ou moins (pour un échantillon donné) pour le tri en groupes de couleurs. Le tri d’échantillons entiers qui contiennent des quantités supérieures à cette quantité augmentera considérablement le temps nécessaire pour effectuer l’analyse. Il est cependant crucial qu’un échantillon de pollen soit très bien mélangé avant qu’un sous-échantillon pour le tri des couleurs ne soit prélevé à partir de celui-ci. Le fait de ne pas mélanger l’échantillon original peut entraîner un sous-échantillon qui n’est pas représentatif de l’ensemble, ce qui devrait être évité.
Si le récipient d’échantillon d’origine ne contient pas suffisamment d’espace libre pour permettre un mélange complet des granulés de pollen, placer l’échantillon entier dans un grand sac en plastique ou un petit sac en papier devrait suffire, même pour les gros échantillons. Les contenants en plastique dur et à couvercle fonctionneront également. Le mélange de l’échantillon doit être fait doucement, afin que les pastilles de pollen ne soient pas écrasées ou détruites d’une autre manière. Un biais involontaire pourrait inconsciemment persuader une personne de retirer « les jolies pastilles violettes », par exemple, lors du retrait d’un sous-échantillon de l’ensemble. Par conséquent, la composition de couleur de l’échantillon doit être masquée lors de l’extraction d’un sous-échantillon. De cette façon, il est plus probable d’obtenir un sous-échantillon vraiment représentatif de l’ensemble. Cependant, cette méthode de sous-échantillonnage pourrait ne pas permettre de sélectionner les pastilles de pollen qui sont en faible abondance dans l’échantillon. Par conséquent, si l’identification de chaque taxon végétal individuel représenté dans l’échantillon est un objectif de recherche, le prélèvement d’un sous-échantillon ne sera pas approprié; L’échantillon entier doit être analysé. Par conséquent, les granulés doivent être triés dans une boîte de Petri en verre. Une fois le tri terminé, les pages appropriées du guide des couleurs Pantone peuvent être placées sous le plat pour faciliter la correspondance des couleurs entre le guide et le pollen trié. La figure 5 en est un exemple.
Lors du piégeage du pollen des colonies d’abeilles mellifères placées dans les cultures pour la pollinisation, pas plus de dix groupes de couleurs au total doivent être utilisés: neuf couleurs individuelles et un groupe de couleurs « diverses » composé des couleurs minoritaires de l’échantillon. Imposer une limite raisonnable au nombre maximal de groupes de couleurs dans lesquels un échantillon peut être divisé empêche le chercheur de s’enliser en séparant sans cesse les granulés en un nombre toujours croissant de groupes extrêmement spécifiques qui, une fois le tri terminé, peuvent ne pas contenir individuellement des quantités suffisantes pour l’acétolyse. En cas de piégeage à partir de colonies susceptibles de se nourrir d’un assortiment très diversifié d’espèces végétales, d’autres groupes de couleurs peuvent être nécessaires, et les protocoles devraient être optimisés pour refléter cette exigence. La présente étude s’est concentrée sur les échantillons de pollen prélevés dans les colonies d’abeilles mellifères pollinisant les cultures, et plusieurs taxons ont été couramment trouvés dans un groupe de couleur, similaire aux études précédentes 29,30,31.
L’acétolyse dissout les lipides, les protéines et les débris organiques de la surface des grains de pollen, révélant les caractères distinctifs de l’exine, de sorte que les grains peuvent être colorés et identifiés plus facilement. C’est une méthodologie ancienne et courante utilisée dans de nombreux types de recherche sur le pollen37. Les étapes générales sont normalisées; Ils varient peu d’un protocole à l’autre. Cependant, les spécificités des vitesses et des temps de centrifugation, de la température et de la durée d’incubation, des volumes de réactifs induits par la quantité de pollen et même de la méthode d’élimination du surnageant (décantation vs pipetage) peuvent devoir être optimisées expérimentalement en fonction des objectifs de recherche et, dans une certaine mesure, des types de pollen susceptibles d’être rencontrés48. En effet, l’acétolyse peut supprimer des caractères diagnostiques importants du pollen de certains taxons tels que Malvaceae et Orchidaceae38. Par conséquent, tous les pollens ne se prêtent pas aux méthodes standard d’acétolyse. Comme indiqué ci-dessus, ces méthodes ont été optimisées dans cette étude dans le but d’identifier les principales sources de pollen des taxons végétaux recueillis par les abeilles mellifères pollinisatrices des cultures. Les détails à prendre en considération si la quantification précise des grains de pollen fait partie de l’étude n’ont pas été abordés dans le présent document.
L’utilisation de solvants et d’acides nécessite une planification minutieuse, un équipement de protection individuelle (EPI) approprié et une élimination responsable des déchets (Figure 6). Il est essentiel que les chercheurs déterminent la bonne façon de stocker les réactifs et d’éliminer les déchets avant de commencer toute partie de l’acétolyse. Dans ce laboratoire, les gants en butyle sont utilisés pendant toute partie du processus impliquant de l’acide sulfurique et même de l’acide acétique glacial, car ils ont de bien meilleurs taux de dégradation et de perméation pour les deux acides que les gants en nitrile, tout en ne compromettant pas la dextérité49. Il serait prudent de consulter les directives de sécurité de l’institution concernée pour obtenir des recommandations sur les gants appropriés et autres EPI49. L’ajout d’acide acétique glacial avant l’étape d’acétolyse aide à éliminer toute humidité résiduelle dans l’échantillon et le prépare à la réaction d’acétolyse importante. Le mélange acide acétique glacial-acide sulfurique à l’étape de l’acétolyse peut réagir violemment avec l’eau, c’est pourquoi il est important que toute la verrerie et les fournitures soient complètement sèches et que toute l’humidité soit éliminée de l’échantillon avant l’acétolyse. L’addition post-acétolyse d’acide acétique glacial dilue et neutralise le mélange d’acétolyse.
L’éthanol et l’acide acétique glacial, en particulier, peuvent dissoudre l’encre des étiquettes des tubes microcentrifugés, si ces réactifs s’égoutter à l’extérieur du tube, même avec des stylos résistants aux solvants. Vérifiez fréquemment les étiquettes des tubes tout au long du processus pour vous assurer qu’elles sont toujours lisibles. Si cela est possible sur le plan logistique, envisagez d’utiliser des étiquettes imprimées par LaserJet comme protection contre cette possibilité. La façon dont les surnageants sont décantés influencera si les réactifs coulent à l’extérieur des tubes de microcentrifugation. Il est important de décanter le surnageant avec une main confiante et lisse, qui vient avec la pratique. Des précautions doivent être prises pour éviter la perte d’échantillons de pollen du tube de centrifugation pendant la décantation. La décantation trop rapide risque de perdre une partie ou la totalité des résidus de pollen; Une décantation trop lente peut entraîner l’écoulement du surnageant dans le tube. Bien qu’une température d’incubation de 100 °C soit couramment recommandée, le pollen pourrait facilement devenir « trop cuit » à cette température dans les quantités utilisées dans cette étude (0,25 g), en particulier s’il est incubé pendant des durées un peu plus longues29. En fait, même à 80 °C, les grains de pollen peuvent éclater ou être endommagés s’ils sont laissés trop longtemps dans le mélange d’acétolyse. La température et la durée d’incubation doivent être soigneusement déterminées pour éviter de détruire les grains de pollen dans l’échantillon.
La coloration du pollen augmente la définition et le contraste des caractéristiques exiniennes, ce qui facilite la photographie et l’identification (Figure 7). Cinq gouttes (provenant d’une pipette de transfert en plastique) de 1% de safranine O ont effectivement coloré 0,25 g de pollen. Cependant, différents pollens se colorent différemment. Si les grains de pollen sont tachés trop légèrement ou trop fortement, l’identification peut être difficile. Dans la mesure du possible, le volume de la solution colorante nécessaire pour colorer de manière appropriée les espèces polliniques attendues dans l’étude doit être validé avant de commencer le traitement des échantillons expérimentaux. Néanmoins, si l’un des échantillons expérimentaux n’est pas correctement coloré, il peut être corrigé. Pour éclaircir un échantillon de pollen trop coloré, rincez l’échantillon avec de l’eau puis de l’éthanol. Si le pollen n’est pas assez bien coloré pour voir les caractéristiques distinctives, quelques gouttes supplémentaires de tache peuvent être ajoutées. La coloration de ces échantillons doit être vérifiée avant d’ajouter de la glycérine. De même, quelques essais et erreurs peuvent être nécessaires pour déterminer le volume idéal de glycérine pour les résidus de pollen. Quinze gouttes de glycérine ont protégé de manière appropriée les échantillons de cette étude contre le dessèchement, tout en diluant le résidu de pollen à une concentration idéale pour l’identification en aval par microscopie optique. D’autres quantités de résidus de pollen peuvent nécessiter plus ou moins de glycérine pour empêcher la dessiccation et faciliter le montage.
Les auteurs n’ont rien à divulguer.
Nous remercions le Dr Gretchen Jones (USDA-ARS, APMRU, College Station, TX) pour son aide au tri des couleurs et à l’analyse de l’acétolyse. Cette recherche a été financée par des fonds de recherche fournis à R.R.S. par l’Oregon State Beekeepers Association.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved