Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
איסוף וזיהוי אבקה ממושבות דבורי דבש
אנו מתארים שיטות לאיסוף אבקה קורביקולרית מדבורי דבש וכן פרוטוקולים למיון צבעים, אצטוליזה והכנת שקופיות מיקרוסקופ של אבקה לצורך זיהוי טקסונומי. בנוסף, אנו מציגים צבע גלולה ומגוון טקסונומי של אבקה קורביקולרית שנאספה מחמש מערכות חיתוך באמצעות מלכודות אבקה.
חוקרים אוספים ומנתחים לעתים קרובות אבקה קורביקולרית מדבורי דבש כדי לזהות את המקורות הצמחיים שעליהם הן מחפשות אבקה או כדי להעריך את החשיפה לחומרי הדברה של דבורים באמצעות אבקה. מתוארת כאן שיטה יעילה ללכידת אבקה לאיסוף אבקה קורביקולרית מדבורי דבש החוזרות לכוורות שלהן. שיטת איסוף זו גורמת לכמויות גדולות של אבקה קורביקולרית שיכולה לשמש למטרות מחקר. דבורי דבש אוספות אבקה ממיני צמחים רבים, אך בדרך כלל מבקרות מין אחד במהלך כל מסע איסוף. לכן, כל כדור אבקה קורביקולרי מייצג בעיקר מין צמח אחד, וכל כדור אבקה יכול להיות מתואר על ידי צבע. זה מאפשר מיון של דגימות של אבקה קורביקולרית לפי צבע כדי להפריד מקורות צמחיים. חוקרים יכולים לסווג עוד יותר אבקה קורביקולרית על ידי ניתוח המורפולוגיה של גרגרי אבקה אצטוליזים לזיהוי טקסונומי. שיטות אלה משמשות בדרך כלל במחקרים הקשורים למאביקים כגון יעילות האבקה, דינמיקה של מאביקים, איכות התזונה וגיוון. מתודולוגיות מפורטות מוצגות לאיסוף אבקה קורביקולרית באמצעות מלכודות אבקה, מיון אבקה לפי צבע, ואצטוליזה של גרגרי אבקה. כמו כן מוצגות תוצאות הנוגעות לתדירות צבעי הכדורים והטקסה של אבקה קורביקולרית שנאספה מדבורי דבש בחמש מערכות גידול שונות.
דבורת הדבש המערבית (Apis mellifera L.) היא מאביקה חשובה של גידולים חקלאיים רבים התלויים בהאבקת דבורים1. במשך יותר מעשור דווח על הפסדים משמעותיים של מושבת דבורי הדבש 2,3,4,5,6,7,8,9. מספר גורמים - כולל טפילים ומחלות, תזונה לקויה וחומרי הדברה - היו מעורבים בירידה במושבות אלה10. ניתן לייחס תזונה לקויה להתעצמות החקלאות ולאובדן בית הגידול11. חובה להבין את משאבי הפרחים המשמשים את הדבורים בנופים שונים כדי לשפר את תזונת הדבורים ולסייע במאמצי שימור הדבורים. אבקה היא המקור העיקרי לחלבון, שומנים, ויטמינים ומינרלים לדבורים, והיא שימשה במחקרים חקלאיים ואקולוגיים רבים כדי להבין את העדפות ההזדקנות של דבורי הדבש ברמת המושבה, להעריך את ההשפעה של לכידת אבקה על מושבות דבורי הדבש ולקבוע חשיפה לחומרי הדברה לדבורים12,13,14.
דבורי הדבש אוספות אבקה מפרחים, אורזות אבקה לכדורים על הקורביקולה שלהן - סלסלת אבקה טיביאלית על אחוריהן - וחוזרות למושבה לאחסון. ניתן להסיר את האבקה הקורביקולרית מהזחלים על ידי לכידתם בכניסה לכוורת או על פרחים, צינון קצר כדי לשתק אותם, ולאחר מכן הסרת כדורי האבקה מאחוריהם באמצעות מלקחיים. התהליך המייגע של איסוף ידני של אבקה קורביקולרית ממספוא שנלכד בנפרד הוא איטי ולא יעיל אם דורשים כמות ניכרת של אבקה. שיטה פשוטה ויעילה יותר לאיסוף כמויות גדולות של אבקה היא על ידי לכידת כדורי אבקה קורביקולריים מדבורי דבש בכניסות לכוורת. מלכודות אבקה נועדו לעקור אבקה קורביקולרית מרגליהם של מלכודות האבקה החוזרות כשהם נכנסים לכוורת15. על הפורגרים להידחק דרך חורי רשת שגודלם צר כדי לאפשר מעבר של גוף עובד דבורת דבש.
כאשר דבורת הדבש עוברת דרך אחד החורים האלה, כדורי האבקה הגדולים יותר נשרטים מרגליה ונופלים למגש איסוף16. מחקרים הראו כי לכידת אבקה מעוררת את הפורענים לאסוף יותר אבקה, ובכך מגדילה את יעילות ההאבקה של היבולים והצמחייה שמסביב17,18,19,20. מתודולוגיות איסוף אבקה יכולות לשמש גם כדי להבין את המספוא המשמש את דבורי הדבש בנוף כצעד ראשון לקביעת הכמות, האיכות והמסה של מיני צמחים פורחים. מתודולוגיות יעילות ללכידת אבקה מקלות אפוא הן על האבקה והן על מחקר תזונת דבורי הדבש. השוואה בין שיטות איסוף אבקה אלה מתוארת בטבלה 1. התנהגות האבקה תשתנה בהתאם לצורך של המושבה באבקה מאוחסנת ביחס לאוכלוסיית הביצים והזחלים שלה המדורגת21,22. מכיוון ששינויים אלה כוללים עוצמת איסוף משתנה, לעתים קרובות צפויה שונות גבוהה בכמות האבקה בין מושבות באותו מיקום ובין מיקומים שונים של אותה מערכת גידול או סוג נוף23,24. הגדלת מספר המושבות והמיקומים ללכידת אבקה תסייע להכיל את השונות הזו.
יעילות מלכודות האבקה משתנהב-25,26. גודל כדורי האבקה שנאספו על ידי דבורי הדבש משתנה בין מיני הצמחים ויכול להשתנות בהתאם לרמות מאגרי האבקה במושבה27,28. זה מציב את הפוטנציאל של כדוריות אבקה קטנות יותר להיות מיוצגות פחות וכדורים גדולים יותר להיות מיוצגים יתר על המידה בדגימות שנאספו באמצעות מלכודות אבקה. דבורים בוגרות משתנות בגודל הגוף, מה שיכול להשפיע גם על ייצוג האבקה שנאספת במלכודות. ישנם גם מיני צמחים המייצרים בעיקר צוף שלא יבחינו בו אם רק יעריכו אבקה שנאספה בנופים מסוימים. יעילות הלכידה מושפעת גם מסחף ודיסאוריינטציה של הכוורת, אשר מושפעים מסוג מלכודת האבקה וממצב ציוד הכוורת. ניתן לפתור בעיה זו על ידי שימוש בטכניקות המפורטות במאמר זה. חוקרים עשויים לשקול טכניקות מחקר נוספות, כגון ספירת ביקורי פרחים על ידי פורגרים, כדי להשלים את התוצאות של העדפות זיוף ברמת המושבה. שיטה שימושית להערכת מגוון האבקה היא מיון אבקה קורביקולרית לפי צבע. אף על פי שדבורי הדבש הן כלליות, הן גם מפגינות נאמנות פרחים, שבה הן אוספות אבקה מאותו מין צמח באותו מקום במהלך כל מסע איסוף נתון. בהתבסס על התנהגות זו, ההנחה היא שכל כדור אבקה קורביקולרי נתון מיוצג בעיקר על ידי מין צמח יחיד 27,29,30,31. לפיכך, מדענים יכולים לתאר את מגוון האבקה על ידי מיון אבקה קורביקולרית לפי צבע גלולות ודיווח על המספר הכולל של הצבעים שזוהו או על חלקו הכולל המיוצג על ידי כל קבוצת צבעים 12,32,33,34. ניתן להשיג זאת על ידי מדידת המסה או ספירת הכדורים של כל קבוצת צבעים. מדידת ספירת הכדורים של כל קבוצת צבעים מוצעת אם יש הבדלים שיטתיים ידועים או חשודים במשקל של כדורים מטקסונים שונים. הבדלים שיטתיים יכולים להיגרם על ידי גודל גלולה או כמות הצוף כי foragers להוסיף אבקה בעת יצירת גלולה.
מיון צבעים הוא תהליך יעיל בזמן ופשוט, אך ייתכן שאין לו דיוק מקובל עבור מחקרי האבקה מסוימים מכיוון שלטקסה צמחית שונה עשויים להיות צבעי כדורי אבקה דומים35,36. בנוסף, קיימת מגבלה לוגיסטית למספר קבוצות הצבעים הנפרדות שניתן להפריד אליהן כדורי אבקה. לפיכך, ההפרדה של כל אבקת טקסון צמחית בודדת לקבוצת צבע גלולה נפרדת משלה לא תמיד אפשרית במחקרי האבקה. אפיון מורפולוגי של גרגרי אבקה באמצעות מיקרוסקופיית אור משלים לעתים קרובות את הפרדת הצבעים של כדוריות על ידי הבחנה בין אבקה של שני טקסונים או יותר בכופתיות מאותה קבוצת צבעים. אמנם, מקובל למצוא גרגרי אבקה של טקסונים מרובים בקבוצת צבעים של כדורי אבקה נתונה, אך כדורי אבקה בודדים שנאספו על ידי דבורת דבש מהווים בדרך כלל טקסון דומיננטי אחד, אולי עם טקסונים אחרים בכמויות קלות. לכן, מקובל להניח נאמנות טקסונומית בכדורי אבקה קורביקולרית של דבורי דבש. כדורי אבקה של מאביקים אחרים שאינם מפגינים התנהגות נאמנות של פרחים, כגון דבורי בומבוס, יכילו לעתים קרובות מיני צמחים רבים וייתכן שאינם בעלי טקסון דומיננטי. במקרים בהם יש צורך באומדנים כמותיים של פרופורציות טקסה בכדורי אבקה פוליפלורליים, נדרשות גם שיטות מיקרוסקופיות הכוללות אצטוליזה, לצורך ניתוח נכון.
הערכת מאפיינים מורפולוגיים של גרגרי אבקה אצטוליזים היא השיטה הנפוצה ביותר לזיהוי טקסונומי16. הליך האצטוליזה מסיר את הפרוטופלסמה של גרגר האבקה כדי לחשוף מאפיינים אבחנתיים שניתן לראות תחת מיקרוסקופיית אור37,38. באמצעות שיטה זו, חוקרים יכולים לדווח על טקסונים שונים, תדירות הטקסה שנמצאה במערכות חיתוך ספציפיות, וטקסה דומיננטית של צבעי גלולה33,36. אצטוליזה היא הטכניקה האנליטית הטובה ביותר לחשיפת מורפולוגיה של אבקה28. עם זאת, חלק מגרגרי האבקה האצטוליזית, כגון סוגים רבים של רוזציאה, אינם ניתנים לזיהוי לפי סוג או מין באמצעות אצטוליזה ומיקרוסקופיית אור בלבד. חוקרים רואים בסריקת מיקרוסקופ אלקטרונים או מטא-ברקוד כשיטות חלופיות להשגת זיהוי ברמת הסוג או המין. שיטות חלופיות אלה, עם זאת, מספקות רק זיהוי טקסון איכותי ואינן מעריכות את הפרופורציות של טקסה של גרגרי אבקה שונים בכדורי אבקה פוליפלורליים36,39. בנוסף, ההוצאות והמומחיות הנדרשת גבוהות בהרבה עבור שיטות אלה. השוואה בין שיטות זיהוי אלה מודגמת בטבלה 1.
| שיטות | זמן | הוצאות | רזולוציה | מומחיות |
| אוסף אבקה | ||||
| לכידת אבקה | נמוך | מתון | משתנה | מתון |
| אוסף אבקה | גבוה | מתון | גבוה | נמוך |
| זיהוי אבקה | ||||
| חזותי (מיון צבעים בלבד) | מתון | נמוך | נמוך | נמוך |
| אצטוליזה | מתון | מתון | מתון | מתון |
| מיקרוסקופיית אלקטרונים סורקת | גבוה | גבוה | גבוה | גבוה |
| מטאברקוד | משתנה | גבוה | גבוה | גבוה |
טבלה 1: השוואה בין שיטות שונות לאיסוף וזיהוי אבקה בהתבסס על זמן, הוצאה, רזולוציה ומומחיות. שיטות חזותיות (מיון צבעים בלבד) מדווחות על המספר הכולל של הצבעים שזוהו או על החלק הכולל המיוצג על-ידי כל קבוצת צבעים כמדד לקביעת מקורות אבקה, אך אינן מספקות זיהוי טקסון.
המידע הזמין על לכידה ומיון של אבקנים ועל גרגרי אבקה הוא מגוון ולעתים קרובות מפוזר על פני מקורות רבים, משתנה עבור חוקרים בתחומים שונים. מאמר זה מציע תובנות מפורטות על סוגים שונים של מלכודות אבקה שיכולות לשמש הן חוקרים והן כוורנים כדי לאסוף ביעילות כמויות גדולות של אבקה קורביקולרית. כמו כן מסופקים פרוטוקולים להכנת דגימות אבקה - על ידי אצטוליזה, צביעה והרכבה בהחלקה - לזיהוי טקסה צמחית. המתודולוגיות המפורטות כאן הן מקיפות ומשמשות משאב ייחודי לזיהוי מיני צמחים דומיננטיים שעליהם דבורי הדבש מספוא בנוף נתון, במיוחד במערכות גידול. ממצאים המבוססים על שיטות אלה ממחקר קודם הוצגו ומתעדים את מגוון צבעי כדורי האבקה והטקסה הצמחית מאבקה קורביקולרית שנאספו על ידי דבורי דבש בחמש מערכות גידול14.
1. איסוף אבקה קורביקולרית ממושבות דבורי דבש באמצעות מלכודות אבקה
- קבעו מתי ללכוד אבקה ממיקום המכוורת הרצוי.
הערה: תנאי אקלים אידיאליים כוללים חשיפה מלאה לשמש, מהירויות רוח נמוכות, לחות נמוכה וללא משקעים חזויים בתקופה הרצויה לאיסוף אבקנים. - בחרו מושבות דבורי דבש אופטימליות ללכידת אבקה בתוך מיקום המכוורת.
- העריכו את חוזק המושבה על ידי ספירת הפורגרים החוזרים לכניסה למושבה למשך 2 דקות. בחר מושבות עם המספר הכולל הגבוה ביותר של פורגרים חוזרים.
- בחר כוורות עם כלי עץ במצב טוב, רצוי ללא כניסות נוספות ומכסים מעוותים. השתמש במושבות עם פחות כניסות חלופיות מכיוון שיש להן סיכוי מוגבר להחזיר את הפורגרים לכיוון הכניסה למלכודת.
- בחרו כניסות לכוורת הפונות דרומה במידת האפשר. אם הכוורות הן משטחים, התקינו מלכודות אבקה על כל מושבה הפונה לאותו כיוון על משטח נתון כדי למנוע סחיפה של כוורות לתוך כניסות כוורת שכנות.
- אם תרצה, להעריך את קן brood של המושבה על ידי בדיקת מסגרות עבור נוכחות של זחלים. מושבות נבחרות עם כמויות גדולות יחסית של זחלים.
- התקינו מלכודות אבקה במושבות דבורי הדבש שנבחרו.
הערה: ההתקנה תשתנה בהתאם לסוג מלכודת האבקה. הסוגים כוללים א) הרכבה קדמית, ב) הרכבה תחתונה, ג) הרכבה עליונה, או ד) תושבת כניסה עם חור אוגר. עיין בסעיף הדיון לקבלת פרטים.- למלכודות להרכבה קדמית, חברו את המלכודת שלפני הכניסה באמצעות סיכות, ברגים וסרט הדבקה, או חברו את המלכודת לכבלי באנג'י העטופים סביב הכוורת. להשמנות להרכבה תחתונה, הניחו את ההשמנה מתחת לתיבת הכוורת הנמוכה ביותר, וקנו את פתח ההשמנה ליד הכניסה המקורית. עבור מלכודות להרכבה עם חור אוגר, חבר את המלכודת ישירות מול חור אוגר של תיבת כוורת באמצעות סיכות, ברגים וסרט הדבקה. להשמנות להרכבה עליונה, הניחו את ההשמנה מעל תיבת הכוורת העליונה ומתחת למכסה.
- אטמו את כל הכניסות האפשריות האחרות למושבה על ידי שימוש בחומר שאינו דבק וניתן ליהוק, כגון לטקס או קצף פוליאוריתן, או בד חומרה #8 (צמצם של 2.7 מ"מ) עבור חורי אוגר. השתמש בסרט דבק עבור סדקים קטנים.
- אם אתם משתמשים במלכודות להרכבה קדמית, הניחו מחסום, כגון שטיחון גומי, בין סל האיסוף לדשא כדי למנוע נזקי לחות מטל.
- הפעילו את מנגנון הלכידה של מלכודת האבקה 24 שעות לאחר ההתקנה ולפני תחילת טיסת הזיוף של היום (שעות הערב המאוחרות/שעות הבוקר המוקדמות).
הערה: שלב זה הוא אידיאלי, אך אינו הכרחי. הפעילו מלכודות אבקה אחת לשבועיים אם אתם לוכדים אבקה באותן מושבות לאורך תקופה נתונה. - אספו אבקה קורביקולרית ממגש האיסוף, הכניסו אותה לשקיות ניילון או צינורות צנטריפוגה, ואחסנו בצידנית עם קרח.
- כדי להעריך את המגוון והשפע של מיני אבקה, למשל, מחקרי תזונה ברמת הנוף, אספו אבקה בשניים או שלושה מרווחים של 72 שעות40.
- לניתוח שאריות חומרי הדברה, אספו אבקה במרווחים של 24 שעות עד 96 שעות עם מינימום של 3 גרם לעיבוד41.
- נקו את האבקה על ידי הסרת חלקי דבורים ופסולת כוורת אחרת.
הערה: השתמש בכפפות חד פעמיות בעת טיפול בדגימות אבקה, והחלף את הכפפות החד פעמיות בין הדגימות. השתמשו בכלים נפרדים כדי להסיר פסולת מהאבקה שנאספה בכל מלכודת. יש לשטוף ולייבש לפני השימוש בכלים לאצווה נוספת של אבקה לכודה. - יש לאחסן אבקה בטמפרטורה של -20 מעלות צלזיוס ומטה כדי לשמור על שלמות הרכבה, אם האבקה מיועדת לזיהוי מקור האבקה, הערכת כמות או ניתוח שאריות חומרי הדברה41,42.
- לאחר הסרת המלכודות מהכוורות, יש לעקר את כל הציוד בתמיסת אקונומיקה של 5%, לשטוף ולייבש את הציוד לפני השימוש הבא.
2. מיון צבע כדורי אבקה לזיהוי מקור אבקה במורד הזרם והערכת כמות
- ודא שיש לפחות 20 גרם של דגימת אבקה לעבוד איתה. ערבבו היטב את דגימת האבקה בשקית שלה או במיכל אחר בגודל מתאים כדי לקבל תערובת הומוגנית של כל הכדורים הכלולים בה. כדי למנוע הטיה לא מכוונת בשלב הבא, הסתר את הרכב הצבעים של הדגימה מהעין לפני הסרת תת-דגימה מתיק הדגימה.
- באמצעות כף מדידה או כף גדולה, הוציאו 10 גרם אבקה כתת-דגימה מייצגת של השלם. יש לשפוך באיטיות את הכדורים מהסקופר על האיזון עד שהתצוגה קוראת 10 גרם. אם הכף הראשונה לא הייתה גדולה מספיק, שלוף כף מדידה נוספת מהדגימה באותו אופן.
הערה: דרישות המשקל שצוינו (20 גרם ו-10 גרם) משמשות כדוגמאות בלבד. על החוקרים להתאים את כמות האבקה המשמשת בכל שלב בהתאם לצרכים ספציפיים. - הסר את כל חלקי הדבורים ופסולת אחרת מתת-הדגימה של 10 גרם. לאחר מכן, במידת הצורך, הוסיפו עוד קצת אבקה מהמדגם המקורי כדי להשיג משקל כולל של 10 גרם מתת-הדגימה.
- ממיינים כל כדור אבקה מתת-הדגימה של 10 גרם לקבוצת צבעים. השתמשו גם בצבע האבקה וגם במרקם כדי להבדיל בין קבוצות צבעים.
הערה: צפויה שונות מסוימת בתוך קבוצה, אך שימוש במדריך הצבעים של Pantone במהלך המיון יכול להגביר את העקביות. - כדי להבטיח לפחות 0.25 גרם מכל קבוצת צבעים לצעדים במורד הזרם, מקם את כל הכדורים שאינם בשפע מספיק כדי ליצור קבוצת צבעים של לפחות 0.25 גרם לקבוצה שונה. תן שם לכל קבוצת צבעים בנפרד בעזרת מדריך הצבעים Pantone. תייג את הקבוצה השונות כשונות.
- שקלו כל קבוצת צבעים על נייר שקילה נפרד, ו/או ספרו את מספר הכדורים בכל קבוצת צבעים. תעד את השמות והמשקלים או הספירות של קבוצות הצבעים בגליון נתונים.
הערה: הבחירה אם לשקול או לספור את מספר הכדורים בכל קבוצת צבעים תלויה במדד העניין של החוקר ובמטרות הפרויקט. - צור תווית שפופרת microcentrifuge עבור כל קבוצת צבעים באמצעות עט עמיד בפני ממסים ותוויות צינור נייר דבק. כלול את התאריך הנוכחי, מזהה הדגימה, תאריך איסוף הדגימה ומספר קבוצת הצבעים בתווית. החל את התוויות על צינורות מיקרוצנטריפוגה נקיים ויבשים של 2 מ"ל.
- שקלו 0.25 גרם (± 0.05 גרם) של כדורי אבקה מכל קבוצת צבעים, והניחו כמות זו בצינור המיקרוצנטריפוגה המסומן כראוי.
הערה: אם יש שינוי קל בצבע או במרקם באבקה של קבוצת צבעים נתונה, ודא שיש מדגם מייצג של כדוריות בתוך כל צינור. נפחי הריאגנטים וזמני הדגירה והצנטריפוגה הבאים מתאימים ל-0.25 גרם אבקה. לכן, השתמש בכמות זו של אבקה בצינורות microcentrifuge לשמש אצטוליזה. פרוטוקול זה אמור לספק אבקה בשפע ומוכתמת לזיהוי מקורות צמחים במורד הזרם על ידי מיקרוסקופיית אור. אם משתמשים בכמות שונה של אבקה באצטוליזה, יש להתאים את הפרטים של נפח הריאגנט וזמני העיבוד בהתאם. - הכניסו את האבקה הנותרת מכל קבוצת צבעים לשקיות פלסטיק נפרדות (שקית אחת לכל צבע) המסומנות בשם קבוצת הצבעים. אחסן שקיות אלה עם החלקים האחרים של הדגימה המקורית המתאימה באחסון של -20 מעלות צלזיוס.
- מערבבים היטב את האבקה בצינור עם קיסם עץ נקי במשך 10 עד 15 שניות.
3. הכנה לאצטוליזה
- לפני תחילת כל חלק של אצטוליזה בפעם הראשונה, פנה למחלקת בריאות ובטיחות סביבתית (EHS) של המוסד הייעודי לקבלת הוראות כיצד יש לטפל בריאגנטים ופסולת הקשורים לאצטוליזה.
- להשיג פתרונות מלאי של הריאגנטים הבאים, ולהניח אותם במכסה האדים בהתאם להנחיות EHS לאחסון כימיקלים: 95% אתנול; מים מזוקקים; חומצה אצטית קרחונית, נטולת מים; חומצה גופרתית מרוכזת; גליצרין; ולק ציפורניים שקוף.
- הכינו תמיסות מלאי של הריאגנטים הבאים, והניחו אותם במכסה האדים בהתאם להנחיות EHS לאחסון כימיקלים: סודיום ביקרבונט רווי (תמיסת 8% w/v במים מזוקקים); וספרנין O (תמיסת 1% w/v ב-50% אתנול).
4. אצטוליזה
- בצע את הליך טרום אצטוליזה של שטיפת חומצה אצטית קרחונית. בצעו את השלבים הבאים בתוך מכסה המנוע בעזרת ציפוי מעבדה, הגנה על העיניים וכפפות ניטריל.
- הפעל בלוק חום ל 80 מעלות צלזיוס.
הערה: ודא שבקבוק לחיץ של סודיום ביקרבונט רווי נגיש בקלות. זה יכול לשמש כדי לנטרל שפיכת חומצה במכסה האדים אם הם מתרחשים. - תייג אחת לפסולת חומצית, אחת לפסולת אתנול ואחת לתערובת אצטוליזה.
- באמצעות פתרונות מלאי שהוכנו מראש, ליצור aliquots עובד של הריאגנטים הבאים בכוסות זכוכית מסומנות, בגודל מתאים: ~ 23.0 מ"ל של חומצה אצטית קרחונית; ~ 33.0 מ"ל של מים מזוקקים; ~ 23.0 מ"ל של 95% אתנול; ~ 25.0 מ"ל של סודיום ביקרבונט (עבור פסולת מוצקה מזוהמת בחומצה).
הערה: אלה הם הנפחים הדרושים להשלמת הליכי האצטוליזה הבאים על סך של 10 דגימות קבוצת צבע (10 צינורות microcentrifuge). - הוסיפו באיטיות 500 μL של חומצה אצטית קרחונית לכל צינור מיקרוצנטריפוגה המכיל 0.25 גרם של אבקה מקבוצת הצבעים. תוך כדי בדיקה ויזואלית של הצינור, מערבבים את האבקה עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. מניחים את הקיסם המשומש בכוס הפסולת סודיום ביקרבונט לאחר השימוש; חזור על תהליך זה עבור כל צינור.
הערה: השתמש בקיסם חדש ונקי עבור כל צינור. ודא שהמכסה של כל שפופרת סגור היטב. - צנטריפוגה את הדגימות במשך 3 דקות ב 1,100 × גרם. מדקיעים את הסופר-נאטנט מהצינורות לתוך הפסולת החומצית. לאחר מכן, גע ברכות ובקצרה בפה הפתוח של הצינור במגבת נייר נקייה כדי להסיר שאריות של חומצה אצטית קרחונית סביב שפת הצינור.
הערה: יש להיזהר שלא לאבד את כדור האבקה בעת נטרול סופרנטנטים.
- הפעל בלוק חום ל 80 מעלות צלזיוס.
- בצע את הליך אצטוליזה.
הערה: בצע את השלבים הבאים בתוך מכסה האדים עם ציפוי מעבדה, הגנה על העיניים וכפפות ויניל בוטיל.- הכינו את תערובת האצטוליזה (חומצה אצטית קרחונית ביחס של 9:1: חומצה גופרתית) על ידי הוספת 10.8 מ"ל של חומצה אצטית קרחונית (מהאליקוט העובד) לתערובת הכוס שכותרתה אצטוליזה. לאחר מכן, באמצעות פיפטה של 1000 μL המצוידת בקצות פיפטה מסוננים של 1250 μL, הוסיפו באיטיות 1200 μL (1.2 מ"ל) של חומצה גופרתית מרוכזת מתמיסת המלאי לתערובת האצטוליזה המכילה חומצה אצטית קרחונית. השליכו את קצה הפיפטה המשומש לתוך הכוס של סודיום ביקרבונט.
הערה: תערובת האצטוליזה עשויה להתחמם למגע, והתערובת עשויה להפוך לצהובה. ישנן שתי אפשרויות שגורמות לתערובת להפוך לצבע כהה: (א) ייתכן שהריאגנטים עברו את תאריכי התפוגה שלהם, או (ב) הוסיפו יותר מדי חומצה גופרתית. בכל מקרה, אם התערובת מחשיכה, השליכו אותה לכוס הפסולת החומצית, והכינו תערובת אצטוליזה טרייה. - ערבבו בעדינות את תערובת האצטוליזה עם מוט זכוכית או מקל ערבוב מעץ כדי להבטיח שהיא הומוגנית. מניחים את המוט/מקל המשומש בכוס של סודיום ביקרבונט.
- באמצעות פיפטה של 1000 μL עם 1250 μL קצוות פיפטה מסוננים, הוסיפו באיטיות 1000 μL של תערובת אצטוליזה מהכוס לכל צינור. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. הניחו את הקיסם המשומש בכוס הפסולת של סודיום ביקרבונט לאחר השימוש.
הערה: השתמש בקיסם חדש ונקי עבור כל דגימה. - מניחים את הדגימות על בלוק החום שחומם מראש (80 מעלות צלזיוס). לדגור את הצינורות במשך 5 דקות, תוך ערבוב כל צינור ביסודיות עם קיסם נקי באמצע הדגירה. מניחים כל קיסם משומש בכוס של סודיום ביקרבונט לאחר השימוש.
הערה: אין להשאיר קיסמים בדגימות; החומצה תמיס אותם.
- הכינו את תערובת האצטוליזה (חומצה אצטית קרחונית ביחס של 9:1: חומצה גופרתית) על ידי הוספת 10.8 מ"ל של חומצה אצטית קרחונית (מהאליקוט העובד) לתערובת הכוס שכותרתה אצטוליזה. לאחר מכן, באמצעות פיפטה של 1000 μL המצוידת בקצות פיפטה מסוננים של 1250 μL, הוסיפו באיטיות 1200 μL (1.2 מ"ל) של חומצה גופרתית מרוכזת מתמיסת המלאי לתערובת האצטוליזה המכילה חומצה אצטית קרחונית. השליכו את קצה הפיפטה המשומש לתוך הכוס של סודיום ביקרבונט.
- בצע את הליך שטיפת החומצה האצטית הקרחונית לאחר אצטוליזה.
הערה: בצע את השלבים הבאים במכסה האדים עם ציפוי מעבדה, הגנה על העיניים וכפפות ויניל בוטיל.- הוסיפו באיטיות 500 μL של חומצה אצטית קרחונית לכל צינור. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. מניחים את הקיסם המשומש בכוס של סודיום ביקרבונט לאחר השימוש.
הערה: השתמש בקיסם חדש ונקי עבור כל דגימה. ודא שהמכסה של כל שפופרת סגור היטב. - צנטריפוגה את הדגימות במשך 3 דקות ב 1,100 × גרם. השקיעו את הסופר-נטנט מכל צינור לתוך הפסולת החומצית. לאחר מכן, ברכות ובקצרה לגעת בפה הפתוח של הצינור עם מגבת נייר נקייה כדי להסיר חומצה שיורית סביב שפת הצינור.
- שטפו היטב את כפפות הוויניל בוטיל מתחת למים זורמים למשך 30 שניות לפחות, הסירו אותן והניחו להן להתייבש.
הערה: עקוב אחר הנחיות היצרן לשימוש חוזר בכפפות ויניל בוטיל.
- הוסיפו באיטיות 500 μL של חומצה אצטית קרחונית לכל צינור. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. מניחים את הקיסם המשומש בכוס של סודיום ביקרבונט לאחר השימוש.
- בצעו שלוש שטיפות מים לכל דגימה. בצעו את השלבים הבאים בתוך מכסה המנוע בעזרת ציפוי מעבדה, הגנה על העיניים וכפפות ניטריל.
- הוסף 1000 μL של מים מזוקקים מכוס המים המזוקקים לכל צינור. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. מניחים את הקיסם בכוס הפסולת של סודיום ביקרבונט לאחר השימוש.
הערה: השתמש בקיסם חדש ונקי עבור כל דגימה. ודא שהמכסה של כל שפופרת סגור היטב. - צנטריפוגה את הדגימות במשך 3 דקות ב 1,100 × גרם. דקנט את הסופרנטנט מהצינורות לתוך הכוס של סודיום ביקרבונט. לאחר מכן, גע ברכות בפה הפתוח של הצינור במגבת נייר נקייה כדי להסיר שאריות מים סביב שפת הצינור.
- חזור על שלבים 4.4.1-4.4.2 פעמיים נוספות לסך של שלוש שטיפות מים.
- הוסף 1000 μL של מים מזוקקים מכוס המים המזוקקים לכל צינור. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. מניחים את הקיסם בכוס הפסולת של סודיום ביקרבונט לאחר השימוש.
- בצע את שטיפת האתנול עבור כל דגימה.
הערה: בצעו את השלבים הבאים בתוך מכסה האדים עם ציפוי מעבדה, הגנה על העיניים וכפפות ניטריל.- באמצעות פיפטה של 1000 μL עם קצות פיפטה מסוננים של 1250 μL, הוסף 1000 μL של 95% אתנול מכוס האתנול לכל צינור. השליכו את קצה הפיפטה לפסולת לא מסוכנת. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב.
הערה: יש להניח את הקיסם בכוס הפסולת של סודיום ביקרבונט לאחר השימוש. השתמשו בקיסם חדש ונקי לכל דגימה. ודא שהמכסה של כל שפופרת סגור היטב. - צנטריפוגה את הדגימות במשך 3 דקות ב 1,100 × גרם. הדק את הסופרנטנט מהצינורות לתוך פסולת האתנול, וגע ברכות בפה הפתוח של הצינור במגבת נייר נקייה כדי להסיר אתנול שיורי מהצינור.
- באמצעות פיפטה של 1000 μL עם קצות פיפטה מסוננים של 1250 μL, הוסף 1000 μL של 95% אתנול מכוס האתנול לכל צינור. השליכו את קצה הפיפטה לפסולת לא מסוכנת. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב.
- יש ללבוש מעיל מעבדה, הגנה על העיניים וכפפות ניטריל כדי להכתים דגימות. ערבבו את תמיסת הכתמים Safranin O באמצעות היפוך עדין.
- באמצעות פיפטה חד פעמית להעברת פלסטיק, מוסיפים 5-10 טיפות של כתם ספרנין O לכל צינור. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. השאירו את הקיסם בצינור.
- באמצעות פיפטה של 1000 μL עם קצות פיפטה מסוננים של 1250 μL, הוסף 1000 μL של 95% אתנול מכוס האתנול לכל צינור. השליכו את קצה הפיפטה לפסולת לא מסוכנת. תוך כדי בדיקה ויזואלית של הצינור, מערבבים עם הקיסם במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב. יש להניח את הקיסם המשומש בפסולת הלא מסוכנת לאחר השימוש.
- ודא שהמכסה של כל שפופרת סגור היטב. צנטריפוגה למשך 3 דקות ב 1,100 × גרם. השקיעו את הסופרנטנט בכוס פסולת האתנול.
הערה: אין לגעת הפעם בפה השפופרת במגבת נייר. - הוסיפו 10-15 טיפות גליצרין לכל צינור באמצעות פיפטה חד פעמית מפלסטיק. תוך כדי בדיקה חזותית של הצינור, ערבבו את תוכן הצינור עם קיסם נקי במשך 10-15 שניות, וודאו כי תוכן הצינור מעורבב היטב.
הערה: יש להניח את קיסם השיניים המשומש בפסולת שאינה מסוכנת לאחר השימוש. השתמשו בקיסם חדש ונקי לכל דגימה. ודא שכל תוויות הצינורות קריאות.
- השאירו את הצינורות פתוחים במכסה האדים כדי לאדות את האתנול למשך שעתיים לפחות בטמפרטורת החדר. בדוק את הדגימות עבור ריח אתנול: אם הוא ניתן לזיהוי, הדגימות אינן מוכנות ויש להשאיר אותן להתייבש עד שריח האתנול יתפוגג.
- נקו את כל החומרים, והשליכו פסולת. כבה גם את הצנטריפוגה וגם את בלוק החום. יש להשליך את כל הפסולת המוצקה והנוזלית בהתאם להנחיות הבריאות והבטיחות הסביבתית של המוסד הייעודי.
- להכין שקופיות מיקרוסקופ לזיהוי אבקה; לתייג אותם באופן קריא. תייג שקופית מיקרוסקופ זכוכית נקייה כראוי לכל קבוצת צבעים / דגימה שתותקן. תוך כדי בדיקה חזותית של הצינור, מערבבים את הדגימה עם קיסם נקי במשך 10-15 שניות, ומוודאים שתכולת הצינור מעורבבת היטב.
הערה: ניתן להכין שקופיות בספסל המעבדה. יש להשליך את הקיסם בפסולת שאינה מתכלה. השתמשו בקיסם חדש ונקי לכל דגימה.- באמצעות פיפטה חד פעמית נקייה מפלסטיק, הסר טיפה אחת של שאריות אבקה מצינור, והנח אותה במרכז שקופית המיקרוסקופ המסומנת שלה. אפשרו לטיפה להתפשט מעט. הניחו כיסוי נקי מעל הטיפה שעל המגלשה.
- לאחר שהמגלשה התייבשה, אטמו את הכיסוי לשקופית עם לק שקוף. הניחו טיפת לק קטנה על כל פינה של הכיסוי, וצבעו גבול של לק סביב היקף הכיסוי במקום שבו הוא פוגש את המגלשה. תנו ללק להתייבש לחלוטין, וצבעו שכבת לק שנייה סביב היקף הכיסוי.
מחקר קודם דיווח על הערכת מגוון האבקה שאספו דבורי הדבש בגידולים החקלאיים הבאים: שקדים, דובדבנים, אוכמניות גבוהות, גזר היברידי ואחופום14. באמצעות השיטות המתוארות, אבקה קורביקולרית נאספה, מוינה לפי צבע, ומקורות הצמחים של כל קבוצת צבע גלולה זוהו כדי להעריך את מגוון האבקה. מלכודות אבקה בהרכבה תחתונה הותקנו על מושבות במספר אתרים עבור כל גידול (איור 1A). כמות האבקה שנאספה מכל אתר הספיקה כדי למלא את דרישות משקל המדגם של שיטות מיון הצבעים וניתוח האצטוליזה. לכל דגימת איסוף אבקה היו מספר קבוצות צבעים שניתן להבחין ביניהן (איור 2 ואיור 3). בחלק מהדגימות, קבוצות הצבעים של האבקה הכילו עד 4-5 כדורים; עם זאת, לרוב הקבוצות היה הרבה יותר מזה, ולכן הן שימשו כקבוצת צבע מסומנת משלהן עבור אצטוליזה (איור 4 ואיור 5). לאחר אצטוליזה (איור 6), נעשה שימוש במיקרוסקופיית אור בשדה בהיר כדי לזהות ביעילות כל קבוצת צבעים בדרגה הטקסונומית הנמוכה ביותר האפשרית שלה על-ידי אישור המאפיינים המורפולוגיים עם אלה של דגימות שוברים שנאספו מהאזור המקיף כל אתר מחקר (איור 7).

איור 1: מלכודות אבקה המותקנות על מושבת דבורי דבש כדי לאסוף אבקה קורביקולרית. (A) מלכודות להרכבה תחתונה הממוקמות מעל הלוח התחתון של הכוורת וישירות מעל תיבת הכוורת הנמוכה ביותר. סגנונות אחרים של לכידת אבקה כוללים (B) מלכודות הרכבה קדמית ו-(C) מלכודות כניסה עם חור אוגר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: מנגנון לכידה ומגש איסוף של מלכודת אבקה. מפיצי אבקה חוזרים חייבים להידחק דרך מנגנון לכידת הרשת לפני שהם מגיעים לכוורת שלהם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: מגש איסוף של מלכודת אבקה. אבקה קורביקולרית נשרטת מרגליהם של מפיצי אבקה חוזרים על ידי מלכודת האבקה ונופלת למגש האיסוף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: מיון דגימה של אבקה קורביקולרית לקבוצות צבעים. ניתן לייבש ולשקול אבקה קורביקולרית לאחר מיון לקבוצות צבעים כדי לדווח על פרופורציות של כדורי צבע שונים שנאספו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: ארבע קבוצות של כדורי אבקה ממוינות לפי צבע באמצעות מדריך הצבעים Pantone. קבוצות הצבעים מסומנות כ-(A) אפור, פנטון 5855C, (B) חום, פנטון 7557C, (C) צהוב, פנטון 458C ו-(D) חום בהיר, Pantone 3547C. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
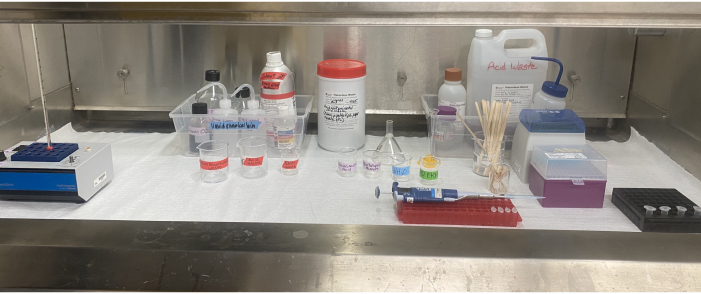
איור 6: התקנת ציוד אצטוליזה בתוך מכסה האדים. בלוק החום, ריאגנטים, פסולת ממסים ומיכלי פסולת חומצה, כוסות מסומנות, פיפטה, קצות פיפטה, מקלות ערבוב וצינורות מיקרוצנטריפוגה הממוקמים בתוך מכסה האדים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
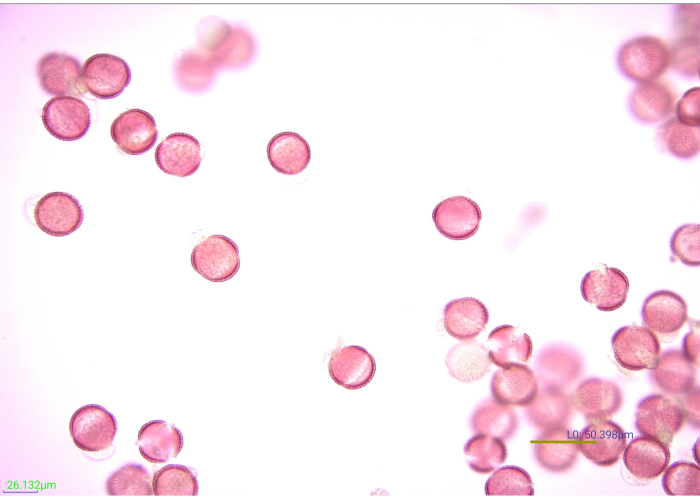
איור 7: מיקרוגרף של גרגרי אבקה מוכתמים ואצטוליזה. היבטים רבים של גרגרי אבקה של חרדל אצטוליזי (Brassicaceae) בהגדלה של פי 40. סרגל קנה מידה = 50.398 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
האבקה שנאספה ממקומות גידול השקד הייתה בעלת מגוון אבקה נמוך יחסית לאבקה שנאספה מגידולים אחרים, עם ממוצע של 3.0 ± 0.5 צבעי גלולה ו-3.2 ± 1.2 טקסה צמחית לכל אתר (טבלה 2)14. בארבע מערכות הגידול הנותרות היו רמות גבוהות יותר של מגוון אבקה עם ממוצע של 6.0 ± 2.0 צבעי גלולה ו-8.0 ± 1.5 טקסה צמחית לכל אתר בדובדבן, 8.8 ± 1.4 צבעי גלולה ו-13.5 ± 2.0 טקסה צמחית לאתר באוכמניות גבוהות, 7.0 ± 1.0 צבעי גלולה ו-11.0 ± 0.0 טקסה צמחית לאתר בגזר היברידי, ו-10.0 ± 0.0 צבעי גלולה ו-13.0 ± 1.5 טקסה צמחית לכל אתר ב-meadowfoam14.
| יבול | מספר ממוצע של צבעי כדורי אבקה /אתר (SE) | מספר ממוצע של טקסה/אתר צמח (SE) | סה"כ טקסה מזוהה | ||
| משפחה | סוג | מינים | |||
| שקד | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| אוכמניות | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| גזר | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| דובדבן | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| מדופום | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
טבלה 2: מגוון אבקני קורביקום שנאספו מדבורי דבש בחמש מערכות גידול. מדדי הגיוון כוללים מספר ממוצע של צבעי גלולות (± SE), מספר ממוצע של טקסה צמחית (± SE) וסך כל הטקסות שזוהו. טבלה זו שונתה מ-14. קיצור: SE = שגיאת תקן.
לסגנונות שונים של מלכודת אבקה יש יתרונות והשלכות משלהם. היתרונות והמגבלות של ארבעה סגנונות השמנה נפוצים, (1) הרכבה קדמית, (2) הרכבה תחתונה, (3) חור אוגר ו-(4) מלכודות אבקה להרכבה עליונה נדונים להלן. השמנות להרכבה קדמית הן הסגנון הרב-תכליתי ביותר (איור 1B). ההתקנה מהירה וקלה; זה יכול להיעשות ללא הרמת תיבות כוורת, ומלכודות אלה יכולות להתאים לכל סגנון Langstroth של ציוד כוורת. כאשר מגש האיסוף יושב מול המושבה, הוא אוסף פסולת מינימלית מהמושבה. עם זאת, מגש האיסוף גם חשוף יותר לאלמנטים חיצוניים - לחות מהשקיית שדה, מזג אוויר גשום או לח, או טל יכול לבוא במגע עם האבקה דרך מגש האיסוף, מה שעלול להפוך את האבקה לבלתי שמישה אם הכדוריות הופכות רוויות מכדי להיפרד. ניתן להפחית את הסיכון לרוויית אבקה על ידי הימנעות מלכידה במהלך אירועים חזויים של גשם או לחות גבוהה. הנחת שטיחון גומי מתחת למלכודת וחומר כיסוי נוסף (למשל, לבד קירוי) על גבי מלכודת האבקה יכולה גם היא להגן על מגש האיסוף מפני מזג האוויר.
מלכודות תחתונות שימשו לאיסוף אבקה עבור הנתונים במאמר זה (איור 1A). הם פחות נוחים להתקנה מכיוון שהם חייבים להיות ממוקמים מתחת לקן הרבייה של המושבה. ההתקנה גוזלת זמן רב וגורמת לכמות גדולה של פסולת ליפול למלכודת מהמושבה, כגון חלקי דבורים ופיסות שעווה קטנות. רצפת מגש האיסוף של רוב המלכודות המיוצרות בתחתית עשויה מרשת עדינה, המאפשרת אוורור נאות כדי להגן על האבקה שנאספה מפני לחות. מלכודות אבקה עם חורי אוגר עוזרות למזער את הדיסאוריינטציה של הכוורת אם הן משתמשות בעיקר בחורי אוגר ככניסות לכוורת במקום בכניסה שנוצרת על ידי הלוח התחתון של הכוורת (איור 1C). מכיוון שמגש האיסוף למלכודות אבקה עם חורי אוגר הוא קטן מאוד, יש לרוקן אותו לעתים קרובות כדי למנוע הצפה של מגש האיסוף. בהתחשב במיקומה העליון בכוורת, מלכודת האבקה העליונה היא סגנון המלכודת הקל ביותר להתקנה ולהסרה, ודגימת האבקה שנאספה נקייה מפסולת כוורת. עם זאת, סגנון מלכודת זה רגיש במיוחד לציוד כוורת פגום מכיוון שמגש האיסוף יהיה חשוף ללחות אם המכסה, המכסה הפנימי ותיבת הכוורת העליונה אינם אטומים כראוי זה לזה.
הפרוטוקולים המתוארים כאן קוראים לבחירת מושבות עם אוכלוסיות גדולות של בוגרים וזחלים (שלב 1.2). שיטת בחירה זו נועדה לייצר כמויות גדולות מאוד של אבקה לכודה ממושבות אלה. מושבות עם אוכלוסיות גידול משמעותיות עלולות לחוות עומס כבד בכניסה עם התקנת המלכודת. בחירה בכניסה גדולה לכוורת תקל על העומס. אוכלוסיות גדולות עשויות גם לאסוף כמויות גדולות מאוד של אבקה שיכולה לחרוג מגבולות מגש האיסוף. השתמש במגשי איסוף גדולים, כפי שניתן לראות ברוב סגנונות ההשמנה התחתונה או העליונה, ובמגשים ריקים לעתים קרובות כדי להכיל כמויות גדולות של אבקה לכודה. אם מטרת המחקר הרצויה היא להעריך את כמויות האבקה שנאספו על ידי מושבות במכוורת, בחר מושבות מייצגות במקום לייעל את אוכלוסיות הבוגרים והזחלים לבחירה. כל סגנונות מלכודות האבקה חוסמים את הכניסה לכוורת ויוצרים כניסה חדשה השונה מרחבית מהכניסה המקורית16. מלכודות אבקה בדרך כלל אינן מצליחות לאסוף אבקה כאשר האבקה אינה מסוגלת להתכוונן מחדש לכניסה החדשה של מלכודת האבקה בעת ההתקנה. הפורגרים האלה נסחפים בקלות לכוורות שכנות, מה שעלול לגרום לזיהום צולב של דגימות איסוף אבקה אחרות אם הם נכנסים לכוורת אחרת עם מלכודת אבקה. לפיכך, יש לתת לפורגרים לפחות 24 שעות כדי להתאקלם לכניסה החדשה על ידי שמירה על מנגנון הלכידה מנותק לאחר ההתקנה. בחירת מושבות עם כניסות מעטות או ללא כניסות נוספות לכוורת גם מפחיתה את הבלבול כאשר מכוונים לכניסה החדשה של מלכודת האבקה.
כניסות נוספות לכוורת (למשל, חורים ומכסים מעוותים) צריכות להיות אטומות, אך הסיכון של כוורות להיסחף לכוורות שכנות יגדל כאשר כניסות אלה יהיו קיימות בתחילת התקנת המלכודת. מחסנים ייסחפו בקלות גם לכניסות אחרות לכוורת אם מלכודת אבקה תותקן רק על כוורת בודדת באשכול של כוורות משטחים. מחילות נוטים פחות להיסחף אם כל הכוורות הפונות לאותו כיוון על המשטח מותקנות מלכודות. מלכודות אבקה בהרכבה העליונה עשויות להוות סיכון גבוה יותר להיסחפות דבורים בשל המרחק הרב בין הכניסה למלכודת האבקה לבין הכניסה המקורית של הכוורת. לצורך מחקר זה, מלכודות אבקה הותקנו על מושבות מרובות של דבורי דבש בכל מיקום ניסיוני כדי להסביר את השונות בכמות האבקה ובהרכב הטקסה בין כל מושבת דבורי דבש. לפיכך, יש להתקין מלכודות אבקה על מושבות מרובות כדי להשיג אוספי אבקה חזקים מהנוף מכיוון שאיסוף אבקה יכול להשתנות במידה רבה בין מושבות בהתבסס על סוג מיני הצמחים והכמות הכוללת שנאספה12,13. לכל מדגם אבקה הייתה תקופת איסוף של 7 ימים. במחקרים עתידיים, איסוף אבקה במרווחים של שתיים או שלוש רצופות של 72 שעות יגדיל את הדיוק של אומדן מספוא אבקה40.
מכיוון שיש רמה גבוהה של תנודתיות טמפורלית באיסוף אבקה, ניתן להגדיל את דיוק אומדן האבקה על ידי חזרה על תהליך איסוף האבקה בתקופות פריחה מוקדמות, שיא ומאוחרות של מערכות הגידול הממוקדות24,27,39. יש לאסוף את האבקה ממספר מקומות, אם כי מאותה מערכת גידול או סוג נוף, בגלל השונות הצפויה בכמות ובסוג מיני הצמחים בין מיקומי המכוורת 14,27,33,43. לכידת אבקה ארוכת טווח עלולה להזיק למושבות דבורי הדבש. ההשפעות הפוטנציאליות כוללות צמצום גידול הזחלים, קיצור תקופת גידול הזחלים וקניבליזם של ביצים וזחלים צעירים בכוורות 19,44,45,46. תקופות ארוכות יותר של לכידת אבקנים, כמו כל עונת הגידול, עלולות להחמיר את ההשפעות המזיקות על גידול הגזעים במושבות. לכידת אבקה יכולה גם לגרום לירידה בייצור הדבש ולעלייה ברמת הלחות של הדבש המאוחסן13. סיבוב מלכודות אבקה בין מושבות בכוורת בעת ניטור רציף של נוף או מערכת חיתוך יכול למתן את הפגיעה במושבות המשמשות ללכידת אבקנים. עיסוק במלכודות אבקה אחת לשבועיים יפחית את ההשפעות המזיקות, במיוחד את האובדן בייצור הדבש, אם לוכדים אבקה על אותן מושבות לאורך פרק זמןשל 13.
בנוסף, עדיף להניח את מלכודות האבקה על מושבות חזקות. לעיתים, מלכודות האבקה עשויות לפעול שלא במתכוון. ניתן להימנע מכך על ידי נעילת מנגנון מלכודת האבקה כאשר אין צורך באיסוף מלכודת אבקה. מלכודות אבקה אינן מסירות את כל האבקה הקורביקולרית מדבורי הדבש. יעילות ההשמנה תלויה בסוג המלכודת, גודל כדור האבקה, גודל גוף הדבורה, השעה ביום ותנאי מזג האוויר. לפיכך, איסוף אבקה קורביקולרית אינו עקבי בעת שימוש במלכודות אבקה עבור מיני צמחים שונים ותקופות איסוף25,26. כדורי אבקה קטנים יותר מצמחים כמו אקליפטוס spp. ותמרים spp. נוטים פחות להילכד על ידי מלכודות אבקה27. יש לציין כי במחקר זה לא נמצאה אבקה של אוכמניות Highbush (Vaccinium corymbosum L.) מאתרי איסוף האוכמניות של highbush, מה שתומך בראיות קודמות לכך שכדורי אבקה של אוכמניות Highbush קטנים מדי עבור איסוף מלכודות אבקה47. לעומת זאת, אבקה שמקורה בשן הארי (Taraxacum officinale F.H. Wigg) נמצאה בכל מערכות הגידול במחקר זה. כדורי אבקה של מיני צמחים מסוימים יכולים גם להיות גדולים בהרבה מאחרים, כגון Taraxacum spp., וייתכן שהם מיוצגים יתר על המידה בניתוח של אוספי אבקה ממלכודות אבקה27. לכידת מלכודות אבקה בודדות והסרה ידנית של אבקה קורביקולרית יגבירו את הדיוק של הערכת מקור האבקה, אך היא דורשת זמן רב ומשאבים בהשוואה לשימוש במלכודות אבקה (טבלה 1). מיון כדורי אבקה לקבוצות צבעים הוא יחסית ישר קדימה, אם כי הוא גוזל זמן. אלא אם כן יש מטרת מחקר או יעד מחקר ספציפיים, כמות כדורי האבקה צריכה להיות מוגבלת ל -10 גרם או פחות (עבור כל מדגם נתון) למיון לקבוצות צבע. מיון דגימות שלמות המכילות כמויות גדולות יותר מכמות זו יגדיל באופן דרסטי את הזמן הדרוש להשלמת הניתוח. עם זאת, חיוני שדגימת אבקה תהיה מעורבת היטב לפני שתילקח ממנה תת-דגימה למיון צבעים. אי ערבוב המדגם המקורי עלול לגרום לתת-מדגם שאינו מייצג את השלם, שיש להימנע ממנו.
אם מיכל הדגימה המקורי אינו מכיל מספיק מקום פנוי כדי לאפשר ערבוב יסודי של כדורי אבקה, הנחת כל הדגימה בשקית ניילון גדולה או בשקית נייר קטנה אמורה להספיק, אפילו לדגימות גדולות. פלסטיק קשיח, מיכלים מכסים יעבוד גם. ערבוב הדגימה צריך להיעשות בעדינות, כך כדורי אבקה לא מעוכים או נהרסים בדרך אחרת. הטיה לא מכוונת עלולה לשכנע באופן לא מודע את האדם להוציא את "הכדורים הסגולים היפים", למשל, בעת הסרת תת-דגימה מהשלם. לכן, יש לטשטש את קומפוזיציית הצבעים של הדגימה מהעין בעת הוצאת תת-דגימה. בדרך זו, קבלת תת מדגם כי הוא באמת מייצג את השלם סביר יותר. עם זאת, שיטת תת-דגימה זו עלולה להיכשל בבחירת כדורי אבקה הנמצאים בשפע נמוך בדגימה. לכן, אם זיהוי כל טקסון צמח בודד המיוצג במדגם הוא מטרת מחקר, איסוף תת-דגימה לא יהיה מתאים; יש לנתח את כל המדגם. לפיכך, גלולות צריך להיות ממוין בצלחת פטרי זכוכית. לאחר השלמת המיון, ניתן למקם עמודים מתאימים במדריך הצבעים של Pantone מתחת לצלחת כדי להקל על התאמת הצבעים בין המדריך לאבקה הממוינת. דוגמה לכך מודגמת באיור 5.
כאשר לוכדים אבקה ממושבות דבורי דבש המונחות בגידולים להאבקה, יש להשתמש בלא יותר מעשר קבוצות צבע כוללות: תשעה צבעים בודדים וקבוצת צבעים "שונה" אחת המורכבת מצבעי המיעוט בדגימה. הצבת מגבלה סבירה על המספר המרבי של קבוצות צבע שניתן לחלק לדגימה מונעת מהחוקר להיתקע על ידי הפרדה אינסופית של גלולות למספר הולך וגדל של קבוצות ספציפיות ביותר, אשר, כאשר המיון הושלם, לא יכול להכיל בנפרד כמויות מספיקות עבור acetolysis. אם לכודים ממושבות שככל הנראה מזדקנות ממגוון רחב מאוד של מיני צמחים, ייתכן שיהיה צורך בקבוצות צבעים נוספות, ויש לייעל את הפרוטוקולים כך שישקפו דרישה זו. המחקר הנוכחי התמקד בדגימות אבקה שנאספו ממושבות דבורי דבש המאביקות יבולים, וטקסונים מרובים נמצאו בדרך כלל בקבוצת צבעים, בדומה למחקרים קודמים 29,30,31.
אצטוליזה ממיסה את השומנים, החלבונים והפסולת האורגנית מפני השטח של גרגרי האבקה, וחושפת את המאפיינים המבדילים של האקסין, כך שניתן יהיה להכתים ולזהות את הגרגרים ביתר קלות. זוהי מתודולוגיה ישנה ונפוצה המשמשת בסוגים רבים של מחקר אבקה37. השלבים הכלליים מתוקננים; הם משתנים מעט מפרוטוקול לפרוטוקול. עם זאת, הפרטים של מהירויות וזמני צנטריפוגה, טמפרטורת הדגירה ומשך הזמן, נפחי ריאגנטים מונעי אבקה ואפילו שיטת הסרת סופר-נאטנט (decanting לעומת pipetting) עשויים להיות מותאמים באופן ניסיוני בהתאם למטרות המחקר, ובמידה מסוימת, סוגי האבקה שסביר שייתקלובהם 48. ואכן, אצטוליזה יכולה להסיר תווים אבחנתיים חשובים של האבקה מכמה טקסונים כגון Malvaceae ו Orchidaceae38. לכן, לא כל אבקה מקובלת על שיטות סטנדרטיות של אצטוליזה. כאמור, שיטות אלה הותאמו במחקר זה לצורך זיהוי מקורות טקסון צמחיים דומיננטיים של אבקה שנאספו על ידי דבורי דבש המאביקות יבולים. פרטים שיש לשקול אם כימות מדויק של גרגרי אבקה הוא חלק מהמחקר, לא טופלו במאמר זה.
השימוש בממסים ובחומצות דורש תכנון קפדני, ציוד מגן אישי מתאים (PPE) ופינוי פסולת אחראי (איור 6). זה קריטי כי החוקרים לקבוע את הדרך הנכונה לאחסן ריאגנטים ולהשליך פסולת לפני תחילת כל חלק של אצטוליזה. במעבדה זו, כפפות בוטיל משמשות במהלך כל חלק של התהליך הכולל חומצה גופרתית ואפילו חומצה אצטית קרחונית מכיוון שיש להן דירוגי השפלה וחדירה טובים בהרבה עבור שתי החומצות מאשר כפפות ניטריל, מבלי להתפשר על מיומנות49. יהיה זה נבון להתייעץ עם הנחיות הבטיחות של המוסד המתאים לקבלת המלצות על כפפות מתאימות ו- PPE49 אחרים. תוספת חומצה אצטית קרחונית לפני שלב האצטוליזה מסייעת בהסרת שאריות הלחות בדגימה ומכינה אותה לתגובת האצטוליזה החשובה. תערובת החומצה האצטית הקרחונית והחומצה הגופרתית בשלב האצטוליזה עלולה להגיב באלימות עם מים, ולכן חשוב שכל כלי הזכוכית והאספקה יהיו יבשים לחלוטין, ושכל הלחות תוסר מהדגימה לפני אצטוליזה. התוספת שלאחר אצטוליזה של חומצה אצטית קרחונית מדללת ומנטרלת את תערובת האצטוליזה.
אתנול וחומצה אצטית קרחונית, בפרט, יכולים להמיס את הדיו של תוויות צינור microcentrifuge, אם ריאגנטים אלה מטפטפים על החלק החיצוני של הצינור, אפילו עם עטים עמידים לממסים. בדוק את תוויות הצינורות לעתים קרובות לאורך כל התהליך כדי לוודא שהן עדיין קריאות. אם הדבר אפשרי מבחינה לוגיסטית, שקול להשתמש במדבקות מודפסות ב- LaserJet כהגנה מפני אפשרות זו. האופן שבו נטרפים סופר-נאטנטים ישפיע על השאלה אם ריאגנטים יטפטפו במורד החלק החיצוני של צינורות המיקרו-צנטריפוגה. חשוב לנטרל את הסופר-נטנט ביד בטוחה וחלקה, שמגיעה עם תרגול. יש להקפיד על אובדן דגימות אבקה מצינור הצנטריפוגה במהלך ההדחה. התרוקנות מהירה מדי עלולה לאבד חלק משאריות האבקה או את כולן; התפוגגות איטית מדי עלולה לגרום לסופרנאטנט לזרום במורד הצינור. למרות שטמפרטורת דגירה של 100 מעלות צלזיוס מומלצת בדרך כלל, אבקה יכולה בקלות להיות "מבושלת יתר על המידה" בטמפרטורה זו בכמויות ששימשו במחקר זה (0.25 גרם), במיוחד אם דגירה במשך משכי זמן מעט ארוכים יותר29. למעשה, אפילו ב 80 מעלות צלזיוס, גרגרי אבקה יכולים להתפוצץ או להינזק בדרך אחרת אם נשארים בתערובת אצטוליזה זמן רב מדי. טמפרטורת הדגירה ומשך הזמן חייבים להיקבע בקפידה כדי להימנע מהשמדת גרגרי האבקה בדגימה.
צביעת אבקה מגבירה את ההגדרה והניגודיות של תכונות האקסין, ומקלה על הצילום והזיהוי (איור 7). חמש טיפות (מפיפטה העברת פלסטיק) של 1% ספרנין O הכתימו למעשה 0.25 גרם אבקה. עם זאת, אבקנים שונים מכתימים אחרת. אם גרגרי האבקה מוכתמים קלות מדי או כבדים מדי, הזיהוי עשוי להיות קשה. במידת האפשר, יש לאמת את נפח תמיסת הכתמים הדרושה כדי להכתים כראוי את מיני האבקה הצפויים להימצא במחקר לפני תחילת עיבוד דגימות הניסוי. עם זאת, אם אחת מדגימות הניסוי אינה מוכתמת כראוי, ניתן לתקן אותה. כדי להבהיר דגימת אבקה המוכתמת בכבדות רבה מדי, שטפו את הדגימה במים ולאחר מכן באתנול. אם האבקה אינה מוכתמת מספיק טוב כדי לראות תכונות מבדילות, ניתן להוסיף עוד כמה טיפות של כתם. יש לבדוק את הכתם של דגימות אלה לפני הוספת גליצרין. כמו כן, ייתכן שיהיה צורך בניסוי וטעייה מסוימים כדי לקבוע את הנפח האידיאלי של גליצרין עבור שאריות האבקה. 15 טיפות של גליצרין הגנו כראוי על הדגימות במחקר זה מפני התייבשות, תוך דילול שאריות האבקה לריכוז אידיאלי לזיהוי במורד הזרם באמצעות מיקרוסקופיית אור. כמויות אחרות של שאריות אבקה עשויות לדרוש פחות או יותר גליצרין כדי למנוע דסיקציה ולהקל על ההרכבה.
למחברים אין מה לחשוף.
אנו מודים לד"ר גרטשן ג'ונס (USDA-ARS, APMRU, College Station, TX) על הסיוע במיון צבעים וניתוח אצטוליזה. מחקר זה נתמך על ידי קרנות מחקר שסופקו ל- R.R.S. על ידי איגוד הדבוראים של מדינת אורגון.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved