Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
शहद मधुमक्खी कॉलोनियों से पराग का संग्रह और पहचान
हम शहद मधुमक्खियों से कॉर्बिकुलर पराग एकत्र करने के तरीकों के साथ-साथ टैक्सोनोमिक पहचान के लिए पराग के रंग छँटाई, एसिटोलिसिस और माइक्रोस्कोप स्लाइड तैयारी के लिए प्रोटोकॉल का वर्णन करते हैं। इसके अलावा, हम पराग जाल का उपयोग करके पांच फसल प्रणालियों से एकत्र किए गए कॉर्बिकुलर पराग की गोली रंग और वर्गीकरण विविधता प्रस्तुत करते हैं।
शोधकर्ता अक्सर पौधे के स्रोतों की पहचान करने के लिए मधुमक्खियों से कॉर्बिकुलर पराग एकत्र और विश्लेषण करते हैं, जिस पर वे पराग के लिए चारा करते हैं या पराग के माध्यम से मधुमक्खियों के कीटनाशक जोखिम का अनुमान लगाते हैं। यहां वर्णित शहद मधुमक्खियों से अपने पित्ती पर लौटने वाले कॉर्बिकुलर पराग को इकट्ठा करने के लिए एक प्रभावी पराग-फँसाने की विधि है। इस संग्रह विधि के परिणामस्वरूप बड़ी मात्रा में कॉर्बिकुलर पराग होता है जिसका उपयोग अनुसंधान उद्देश्यों के लिए किया जा सकता है। मधुमक्खियां कई पौधों की प्रजातियों से पराग एकत्र करती हैं, लेकिन आमतौर पर प्रत्येक संग्रह यात्रा के दौरान एक प्रजाति का दौरा करती हैं। इसलिए, प्रत्येक कॉर्बिकुलर पराग गोली मुख्य रूप से एक पौधे की प्रजातियों का प्रतिनिधित्व करती है, और प्रत्येक पराग गोली को रंग द्वारा वर्णित किया जा सकता है। यह पौधे के स्रोतों को अलग करने के लिए रंग द्वारा कॉर्बिकुलर पराग के नमूनों की छंटाई की अनुमति देता है। शोधकर्ता टैक्सोनोमिक पहचान के लिए एसिटोलाइज्ड पराग कणों की आकृति विज्ञान का विश्लेषण करके कॉर्बिकुलर पराग को और वर्गीकृत कर सकते हैं। इन विधियों का उपयोग आमतौर पर परागणकों से संबंधित अध्ययनों में किया जाता है जैसे परागण दक्षता, परागणक फोर्जिंग गतिशीलता, आहार की गुणवत्ता और विविधता। पराग जाल का उपयोग करके कॉर्बिकुलर पराग एकत्र करने, रंग द्वारा पराग को छांटने और पराग कणों को एसिटोलाइज करने के लिए विस्तृत तरीके प्रस्तुत किए जाते हैं। इसके अलावा पांच अलग-अलग फसल प्रणालियों में शहद मधुमक्खियों से एकत्र किए गए गोली रंगों की आवृत्ति और कॉर्बिकुलर पराग के कर से संबंधित परिणाम भी प्रस्तुत किए गए हैं।
पश्चिमी शहद मधुमक्खी (एपिस मेलिफेरा एल) कई कृषि फसलों का एक महत्वपूर्ण परागणक है जो मधुमक्खी परागण1 पर निर्भर करता है। एक दशक से अधिक समय से, महत्वपूर्ण शहद मधुमक्खी कॉलोनी नुकसान 2,3,4,5,6,7,8,9 की सूचना दी गई है। परजीवी और बीमारियों, खराब पोषण और कीटनाशकों सहित कई कारकों को इन कॉलोनी में फंसाया गया है10. खराब पोषण को कृषि गहनता और फोर्जिंग निवास स्थान के नुकसान के लिए जिम्मेदार ठहराया जा सकताहै 11. मधुमक्खी पोषण में सुधार और मधुमक्खी संरक्षण प्रयासों में सहायता के लिए विभिन्न परिदृश्यों में मधुमक्खियों द्वारा उपयोग किए जाने वाले पुष्प संसाधनों को समझना आवश्यक है। पराग मधुमक्खियों के लिए प्रोटीन, लिपिड, विटामिन और खनिजों का प्राथमिक स्रोत है और इसका उपयोग कई कृषि और पारिस्थितिक अध्ययनों में शहद मधुमक्खियों की कॉलोनी-स्तर फोर्जिंग वरीयताओं को समझने, शहद मधुमक्खी कॉलोनियों पर पराग फंसाने के प्रभाव का मूल्यांकन करने और मधुमक्खियों12,13,14 के कीटनाशक जोखिम को निर्धारित करने के लिए किया गया है।
शहद मधुमक्खियां फूलों से पराग इकट्ठा करती हैं, पराग को अपने कॉर्बिकुला पर छर्रों में पैक करती हैं - उनके हिंडलेग पर एक टिबियल पराग टोकरी - और भंडारण के लिए कॉलोनी में लौटती हैं। कॉर्बिकुलर पराग को छत्ते के प्रवेश द्वार पर या फूलों पर कब्जा करके फोर्जर्स से हटाया जा सकता है, उन्हें स्थिर करने के लिए संक्षेप में ठंडा किया जा सकता है, और फिर संदंश के साथ अपने हिंडलेग से पराग छर्रों को हटा दिया जा सकता है। व्यक्तिगत रूप से पकड़े गए फोर्जर्स से हाथ से कॉर्बिकुलर पराग इकट्ठा करने की श्रमसाध्य प्रक्रिया धीमी और अक्षम है यदि किसी को काफी मात्रा में पराग की आवश्यकता होती है। पराग की बड़ी मात्रा को इकट्ठा करने का एक सरल और अधिक कुशल तरीका छत्ते के प्रवेश द्वार पर शहद मधुमक्खियों से कॉर्बिकुलर पराग छर्रों को फंसाकर है। पराग जाल को लौटने वाले पराग फोर्जर्स के पैरों से कॉर्बिकुलर पराग को हटाने के लिए डिज़ाइन किया गया है क्योंकि वे छत्ते15 में प्रवेश करते हैं। फोर्जर्स को मेष छेद के माध्यम से निचोड़ना चाहिए जो शहद मधुमक्खी कार्यकर्ता शरीर के पारित होने की संकीर्ण रूप से अनुमति देने के लिए आकार के होते हैं।
जैसा कि शहद मधुमक्खी इन छेदों में से एक से गुजरती है, बड़े पराग छर्रों को उसके पैरों से स्क्रैप किया जाता है और एक संग्रह ट्रे16 में गिर जाता है। अध्ययनों से पता चला है कि पराग फँसाने से फोर्जर्स को अधिक पराग इकट्ठा करने के लिए उत्तेजित किया जाता है, इस प्रकार आसपास की फसलों और वनस्पतियों की परागण दक्षता 17,18,19,20 बढ़ जाती है। फूलों की पौधों की प्रजातियों की मात्रा, गुणवत्ता और कर का निर्धारण करने के पहले चरण के रूप में परिदृश्य में शहद मधुमक्खियों द्वारा उपयोग किए जाने वाले चारा को समझने के लिए पराग संग्रह पद्धतियों का भी उपयोग किया जा सकता है। प्रभावी पराग-फँसाने के तरीके इस प्रकार परागण और शहद मधुमक्खी पोषण अनुसंधान दोनों की सुविधा प्रदान करते हैं। इन पराग संग्रह विधियों की तुलना तालिका 1 में सचित्र है। पराग फोर्जिंग व्यवहार अपने अंडे और लार्वा जनसंख्या स्तर21,22 के सापेक्ष संग्रहीत पराग की कॉलोनी की आवश्यकता के आधार पर बदल जाएगा। चूंकि इन परिवर्तनों में अलग-अलग संग्रह तीव्रता शामिल है, पराग मात्रा में उच्च भिन्नता अक्सर एक ही स्थान पर कॉलोनियों के बीच और एक ही फसल प्रणाली या परिदृश्य प्रकार23,24 के विभिन्न स्थानों के बीच अपेक्षित होती है। पराग को फंसाने के लिए कॉलोनियों और स्थानों की संख्या बढ़ाने से इस भिन्नता को समायोजित करने में मदद मिलेगी।
पराग जाल दक्षता25,26 में भिन्न होते हैं। शहद मधुमक्खियों द्वारा एकत्र किए गए पराग छर्रों का आकार पौधों की प्रजातियों के बीच भिन्न होता है और कॉलोनी27,28 में पराग भंडार के स्तर के आधार पर बदल सकता है। यह छोटे पराग छर्रों को कम करने और पराग जाल के माध्यम से एकत्र किए गए नमूनों में बड़े छर्रों को अतिरंजित करने की क्षमता पैदा करता है। वयस्क मधुमक्खियां शरीर के आकार में भिन्न होती हैं, जो जाल में एकत्र पराग के प्रतिनिधित्व को भी प्रभावित कर सकती हैं। पौधों की प्रजातियां भी हैं जो मुख्य रूप से अमृत का उत्पादन करती हैं जो केवल कुछ परिदृश्यों में एकत्रित पराग का आकलन करने पर पता नहीं चलेगी। फँसाने की दक्षता फोर्जर बहाव और भटकाव से भी प्रभावित होती है, जो पराग जाल प्रकार और छत्ते के उपकरण की स्थिति से प्रभावित होती है। इस पेपर में निर्दिष्ट तकनीकों को नियोजित करके इस समस्या को कम किया जा सकता है। जांचकर्ता कॉलोनी-स्तर फोर्जिंग वरीयताओं के परिणामों के पूरक के लिए फोर्जर्स द्वारा फूलों की यात्रा की गिनती जैसे अतिरिक्त शोध तकनीकों पर विचार कर सकते हैं। पराग विविधता का आकलन करने के लिए एक उपयोगी तरीका रंग द्वारा कॉर्बिकुलर पराग को सॉर्ट करना है। यद्यपि शहद मधुमक्खियां सामान्यवादी फोर्जर हैं, वे फूलों की निष्ठा भी प्रदर्शित करती हैं, जहां वे किसी भी संग्रह यात्रा के दौरान एक ही स्थान पर एक ही पौधे की प्रजातियों से पराग एकत्र करती हैं। इस फोर्जिंग व्यवहार के आधार पर, यह माना जाता है कि किसी भी दिए गए कॉर्बिकुलर पराग गोली को मुख्य रूप से एक पौधे की प्रजाति 27,29,30,31 द्वारा दर्शाया जाता है। इसलिए, वैज्ञानिक गोली के रंग द्वारा कॉर्बिकुलर पराग को सॉर्ट करके पराग विविधता का वर्णन कर सकते हैं और पता लगाए गए रंगों की कुल संख्या या प्रत्येक रंग समूह 12,32,33,34 द्वारा दर्शाए गए कुल अनुपात की रिपोर्ट कर सकते हैं। यह प्रत्येक रंग समूह के द्रव्यमान या गोली गिनती को मापकर पूरा किया जा सकता है। प्रत्येक रंग समूह की गोली गिनती को मापने का सुझाव दिया जाता है यदि विभिन्न करों से छर्रों के वजन में ज्ञात या संदिग्ध व्यवस्थित अंतर हैं। व्यवस्थित अंतर गोली के आकार या अमृत की मात्रा के कारण हो सकता है जो फोर्जर गोली बनाते समय पराग में जोड़ते हैं।
रंग छँटाई एक समय-कुशल और सरल प्रक्रिया है, लेकिन कुछ परागण अनुसंधान अध्ययनों के लिए स्वीकार्य सटीकता नहीं हो सकती है क्योंकि विभिन्न पौधे कर में समान पराग गोली रंग35,36 हो सकते हैं। इसके अतिरिक्त, अलग-अलग रंग समूहों की संख्या के लिए एक तार्किक सीमा है पराग छर्रों को अलग किया जा सकता है। इस प्रकार, प्रत्येक व्यक्तिगत पौधे टैक्सन पराग को अपने स्वयं के विशिष्ट गोली रंग समूह में अलग करना परागण अध्ययन में हमेशा संभव नहीं हो सकता है। प्रकाश माइक्रोस्कोपी के माध्यम से पराग कणों का रूपात्मक लक्षण वर्णन अक्सर एक ही रंग समूह के छर्रों में दो या दो से अधिक कर के पराग को अलग करके छर्रों के रंग पृथक्करण का पूरक होता है। यद्यपि, किसी दिए गए पराग गोली रंग समूह में कई करों के पराग कणों को ढूंढना आम है, शहद मधुमक्खी द्वारा एकत्र किए गए व्यक्तिगत पराग छर्रों में आम तौर पर एक प्रमुख टैक्सन होता है, संभवतः मामूली मात्रा में अन्य कर के साथ। इस प्रकार, शहद मधुमक्खियों के कॉर्बिकुलर पराग छर्रों में टैक्सोनोमिक निष्ठा को मानना आम है। अन्य परागणकों से पराग छर्रों जो फूलों की निष्ठा व्यवहार का प्रदर्शन नहीं करते हैं, जैसे कि भौंरा मधुमक्खियों, में अक्सर कई पौधों की प्रजातियां होती हैं और एक प्रमुख टैक्सोन नहीं हो सकता है। ऐसे उदाहरणों में जहां पॉलीफ्लोरल पराग छर्रों में कर अनुपात के मात्रात्मक अनुमान वांछित हैं, सूक्ष्म तरीके जिनमें एसिटोलिसिस शामिल है, उचित विश्लेषण के लिए अतिरिक्त रूप से आवश्यक हैं।
एसिटोलाइज्ड पराग कणों की रूपात्मक विशेषताओं का आकलन टैक्सोनोमिक पहचान के लिए सबसे आम तरीका है16. एसिटोलिसिस प्रक्रिया नैदानिक विशेषताओं को उजागर करने के लिए पराग अनाज के प्रोटोप्लाज्म को हटा देती है जिसे प्रकाश माइक्रोस्कोपी37,38 के तहत देखा जा सकता है। इस पद्धति का उपयोग करके, शोधकर्ता विभिन्न कर, विशिष्ट फसल प्रणालियों में पाए जाने वाले कर की आवृत्ति और गोलीरंग33,36 के प्रमुख कर की रिपोर्ट कर सकते हैं। एसिटोलिसिस पराग आकृति विज्ञान28 को प्रकट करने के लिए सबसे अच्छी विश्लेषणात्मक तकनीक है। हालांकि, कुछ एसिटोलाइज्ड पराग कण, जैसे कि कई रोसैसी प्रकार, अकेले एसिटोलिसिस और प्रकाश माइक्रोस्कोपी के माध्यम से जीनस या प्रजातियों के स्तर की पहचान नहीं की जा सकती है। शोधकर्ता जीनस- या प्रजाति-स्तर की पहचान प्राप्त करने के लिए वैकल्पिक तरीकों के रूप में इलेक्ट्रॉन माइक्रोस्कोपी या मेटाबारकोडिंग को स्कैन करने पर विचार करते हैं। हालांकि, ये वैकल्पिक तरीके केवल गुणात्मक टैक्सोन पहचान प्रदान करते हैं और पॉलीफ्लोरल पराग छर्रों36,39 में विभिन्न पराग अनाज कर के अनुपात का अनुमान लगाने में विफल रहते हैं। इसके अलावा, इन तरीकों के लिए व्यय और आवश्यक विशेषज्ञता काफी अधिक है। इन पहचान विधियों की तुलना तालिका 1 में सचित्र है।
| विधियाँ | समय | लागत | प्रस्ताव | विशेषज्ञता |
| पराग संग्रह | ||||
| पराग फँसाने | नीचा | मध्यम | परिवर्तनशील | मध्यम |
| पराग फोर्जर संग्रह | उच्च | मध्यम | उच्च | नीचा |
| पराग की पहचान | ||||
| दृश्य (केवल रंग सॉर्टिंग) | मध्यम | नीचा | नीचा | नीचा |
| एसिटोलिसिस | मध्यम | मध्यम | मध्यम | मध्यम |
| स्कैनिंग इलेक्ट्रॉन माइक्रोस्कोपी | उच्च | उच्च | उच्च | उच्च |
| मेटाबारकोडिंग | परिवर्तनशील | उच्च | उच्च | उच्च |
तालिका 1: समय, व्यय, संकल्प और विशेषज्ञता के आधार पर पराग संग्रह और पहचान के विभिन्न तरीकों की तुलना। दृश्य विधियाँ (केवल रंग सॉर्टिंग) पता लगाए गए रंगों की कुल संख्या या पराग स्रोतों को निर्धारित करने के लिए मीट्रिक के रूप में प्रत्येक रंग समूह द्वारा दर्शाए गए कुल के अनुपात की रिपोर्ट करती हैं, लेकिन टैक्सोन पहचान प्रदान नहीं करती हैं।
पराग कणों को फँसाने और छँटाई करने और पराग कणों को एसिटोलाइज़ करने पर उपलब्ध जानकारी विविध है और अक्सर कई स्रोतों में फैली हुई है, जो विभिन्न क्षेत्रों में शोधकर्ताओं के लिए अलग-अलग हैं। यह पत्र विभिन्न प्रकार के पराग जाल में विस्तृत अंतर्दृष्टि प्रदान करता है जिसका उपयोग शोधकर्ताओं और मधुमक्खी पालकों दोनों द्वारा बड़ी मात्रा में कॉर्बिकुलर पराग को प्रभावी ढंग से इकट्ठा करने के लिए किया जा सकता है। इसके अलावा पराग नमूने तैयार करने के लिए प्रोटोकॉल प्रदान किए जाते हैं - एसिटोलिसिस, धुंधला, और स्लाइड बढ़ते द्वारा - पौधे कर पहचान के लिए। यहां विस्तृत पद्धतियां व्यापक हैं और प्रमुख पौधों की प्रजातियों की पहचान करने के लिए एक अनूठे संसाधन के रूप में काम करती हैं, जिस पर किसी दिए गए परिदृश्य में शहद मधुमक्खियां चारा डालती हैं, खासकर फसल प्रणालियों में। पिछले अध्ययन से इन विधियों के आधार पर निष्कर्ष प्रस्तुत किए गए हैं और पांच फसल प्रणालियों में शहद मधुमक्खियों द्वारा एकत्र किए गए कॉर्बिकुलर पराग से पराग गोली रंगों और पौधे करकी विविधता का दस्तावेजीकरण किया गया है।
1. पराग जाल का उपयोग कर शहद मधुमक्खी कालोनियों से कॉर्बिकुलर पराग एकत्र करना
- निर्धारित करें कि वांछित मधुमक्खी स्थान से पराग को कब फंसाना है।
नोट: आदर्श जलवायु परिस्थितियों में पूर्ण सूर्य जोखिम, कम हवा की गति, कम आर्द्रता, और पराग संग्रह के लिए वांछित अवधि के दौरान कोई पूर्वानुमानित वर्षा शामिल नहीं है। - मधुमक्खी स्थान के भीतर पराग फँसाने के लिए इष्टतम शहद मधुमक्खी कालोनियों का चयन करें।
- 2 मिनट के लिए कॉलोनी प्रवेश द्वार पर लौटने वाले फोर्जरों की गिनती करके कॉलोनी की ताकत का आकलन करें। लौटने वाले फोर्जर्स की उच्चतम कुल संख्या वाली कॉलोनियों का चयन करें।
- लकड़ी के बर्तन के साथ पित्ती का चयन करें जो अच्छी स्थिति में है, अधिमानतः अतिरिक्त प्रवेश द्वार और विकृत ढक्कन के बिना। कम वैकल्पिक प्रवेश द्वार के साथ कॉलोनियों का उपयोग करें क्योंकि उनके पास जाल प्रवेश द्वार पर लौटने वाले फोर्जर्स लौटने की संभावना बढ़ गई है।
- जब भी संभव हो दक्षिण-मुखी छत्ते प्रवेश द्वार का चयन करें। यदि पित्ती को पैलेटाइज किया जाता है, तो पड़ोसी छत्ते के प्रवेश द्वार में फोर्जर्स के बहाव से बचने के लिए किसी दिए गए फूस पर एक ही दिशा का सामना करने वाली प्रत्येक कॉलोनी पर पराग जाल स्थापित करें।
- यदि वांछित है, तो लार्वा की उपस्थिति के लिए फ्रेम का निरीक्षण करके कॉलोनी के ब्रूड घोंसले का आकलन करें। लार्वा की अपेक्षाकृत बड़ी मात्रा के साथ कालोनियों का चयन करें।
- चयनित मधुमक्खी कॉलोनियों पर पराग जाल स्थापित करें।
नोट: स्थापना पराग जाल के प्रकार के आधार पर भिन्न होगी। प्रकारों में ए) फ्रंट-माउंट, बी) बॉटम-माउंट, सी) टॉप-माउंट, या डी) ऑगर-होल एंट्रेंस माउंट शामिल हैं। विवरण के लिए चर्चा अनुभाग देखें।- फ्रंट-माउंट ट्रैप के लिए, स्टेपल, शिकंजा और टेप के साथ प्रवेश द्वार के सामने जाल संलग्न करें, या जाल को छत्ते के चारों ओर लिपटे बंजी डोरियों से कनेक्ट करें। नीचे-माउंट जाल के लिए, सबसे कम छत्ते बॉक्स के नीचे जाल रखें, और मूल प्रवेश द्वार के पास जाल प्रवेश द्वार को ठीक करें। बरमा-छेद माउंट जाल के लिए, स्टेपल, शिकंजा और टेप का उपयोग करके हाइव बॉक्स के बरमा छेद के सामने सीधे जाल संलग्न करें। टॉप-माउंट ट्रैप के लिए, जाल को सबसे ऊपरी छत्ते बॉक्स के ऊपर और ढक्कन के नीचे रखें।
- बरमा छेद के लिए लेटेक्स या पॉलीयूरेथेन फोम, या # 8 हार्डवेयर कपड़ा (2.7 मिमी एपर्चर) जैसे गैर-चिपकने वाला और मोल्ड करने योग्य सामग्री का उपयोग करके कॉलोनी में अन्य सभी संभावित प्रवेश द्वारों को सील करें। छोटी दरारों के लिए चिपकने वाला टेप का उपयोग करें।
- यदि फ्रंट-माउंट जाल का उपयोग कर रहे हैं, तो ओस से नमी के नुकसान से बचने के लिए संग्रह टोकरी और घास के बीच एक बाधा, जैसे रबर की चटाई रखें।
- स्थापना के 24 घंटे बाद और दिन की फोर्जिंग उड़ान शुरू होने से पहले पराग जाल के फंसाने के तंत्र को संलग्न करें (देर शाम /
नोट: यह कदम आदर्श है, लेकिन आवश्यक नहीं है। एक निश्चित अवधि के दौरान एक ही उपनिवेशों पर पराग फंसाने पर हर दूसरे सप्ताह पराग जाल संलग्न करें। - संग्रह ट्रे से कॉर्बिकुलर पराग इकट्ठा करें, इसे प्लास्टिक की थैलियों या अपकेंद्रित्र ट्यूबों में रखें, और बर्फ के साथ कूलर में स्टोर करें।
- पराग प्रजातियों की विविधता और बहुतायत का आकलन करने के लिए, उदाहरण के लिए, परिदृश्य-स्तरीय पोषण अध्ययन, दो या तीन 72 घंटे के अंतराल में पराग एकत्र करें40.
- कीटनाशक अवशेष विश्लेषण के लिए, प्रसंस्करण41 के लिए न्यूनतम 3 ग्राम के साथ 24 घंटे से 96 घंटे के अंतराल में पराग एकत्र करें।
- मधुमक्खी भागों और अन्य छत्ते मलबे को हटाकर पराग को साफ करें।
नोट: पराग नमूने को संभालते समय डिस्पोजेबल दस्ताने का उपयोग करें, और नमूनों के बीच डिस्पोजेबल दस्ताने बदलें। प्रत्येक जाल में एकत्र पराग से मलबे को हटाने के लिए अलग-अलग उपकरणों का उपयोग करें। फंसे पराग के एक और बैच के लिए उपकरण का उपयोग करने से पहले कुल्ला और सूखा। - पराग को अपनी रचनात्मक अखंडता बनाए रखने के लिए -20 डिग्री सेल्सियस या उससे नीचे स्टोर करें यदि पराग पराग स्रोत पहचान, मात्रा मूल्यांकन, या कीटनाशक अवशेषविश्लेषण 41,42 के लिए अभिप्रेत है।
- पित्ती से जाल को हटाने के बाद, 5% ब्लीच समाधान में सभी उपकरणों को निष्फल करें, कुल्ला करें, और अगले उपयोग से पहले उपकरण को सूखा दें।
2. डाउनस्ट्रीम पराग स्रोत पहचान और मात्रा मूल्यांकन के लिए पराग गोली रंग छँटाई
- सुनिश्चित करें कि काम करने के लिए कम से कम 20 ग्राम पराग नमूना है। इसमें निहित सभी छर्रों का सजातीय मिश्रण प्राप्त करने के लिए पराग नमूने को अपने बैग या किसी अन्य उपयुक्त आकार के कंटेनर में अच्छी तरह से मिलाएं। अगले चरण में अनजाने पूर्वाग्रह से बचने के लिए, नमूना बैग से एक उप-नमूना हटाने से पहले नमूने की रंग संरचना को दृश्य से अस्पष्ट करें।
- एक स्कूपर या बड़े चम्मच का उपयोग करके, पूरे के प्रतिनिधि उप-नमूने के रूप में 10 ग्राम पराग को स्कूप करें। धीरे-धीरे संतुलन पर स्कूपर से छर्रों को डालें जब तक कि डिस्प्ले 10 ग्राम न पढ़े। यदि पहला स्कूप काफी बड़ा नहीं था, तो उसी तरह नमूने से एक और स्कूप पुनर्प्राप्त करें।
नोट: ये निर्दिष्ट वजन आवश्यकताएं (20 ग्राम और 10 ग्राम) केवल उदाहरण के रूप में काम करती हैं। शोधकर्ताओं को विशिष्ट आवश्यकताओं के लिए उपयुक्त के रूप में प्रत्येक चरण में उपयोग किए जाने वाले पराग की मात्रा को समायोजित करना चाहिए। - 10 ग्राम उप-नमूने से सभी मधुमक्खी भागों और अन्य मलबे को हटा दें। फिर, यदि आवश्यक हो, तो उप-नमूने के 10 ग्राम के कुल वजन को प्राप्त करने के लिए मूल नमूने से थोड़ा और पराग जोड़ें।
- 10 ग्राम उप-नमूने से प्रत्येक पराग गोली को एक रंग समूह में सॉर्ट करें। रंग समूहों के बीच अंतर करने के लिए पराग रंग और बनावट दोनों का उपयोग करें।
नोट: एक समूह के भीतर कुछ भिन्नता की उम्मीद है, लेकिन छँटाई के दौरान पैनटोन रंग गाइड का उपयोग करने से स्थिरता बढ़ सकती है। - डाउनस्ट्रीम चरणों के लिए प्रत्येक रंग समूह के कम से कम 0.25 ग्राम सुनिश्चित करने के लिए, किसी भी छर्रों को रखें जो विविध समूह में कम से कम 0.25 ग्राम का रंग समूह बनाने के लिए पर्याप्त नहीं हैं। पैनटोन रंग गाइड का उपयोग करके प्रत्येक व्यक्तिगत रंग समूह का नाम दें। विविध समूह विविध लेबल करें।
- प्रत्येक रंग समूह को एक अलग वजन कागज पर तौलें, और / या प्रत्येक रंग समूह में छर्रों की संख्या की गणना करें। किसी डेटा पत्रक पर रंग समूह नाम और भार या गणना रिकॉर्ड करें.
नोट: प्रत्येक रंग समूह में छर्रों की संख्या का वजन या गिनती करना चुनना शोधकर्ता की रुचि और परियोजना लक्ष्यों के मीट्रिक पर निर्भर करता है। - एक विलायक प्रतिरोधी कलम और चिपकने वाला पेपर ट्यूब लेबल का उपयोग करके प्रत्येक रंग समूह के लिए एक माइक्रोसेंट्रिफ्यूज ट्यूब लेबल बनाएं। लेबल में वर्तमान दिनांक, नमूना पहचानकर्ता, नमूना संग्रह दिनांक और रंग समूह संख्या शामिल करें. 2 एमएल माइक्रोसेंट्रिफ्यूज ट्यूबों को साफ, सूखी करने के लिए लेबल लागू करें।
- प्रत्येक रंग समूह से पराग छर्रों के 0.25 ग्राम (± 0.05 ग्राम) वजन करें, और इस राशि को उचित रूप से लेबल किए गए माइक्रोसेंट्रिफ्यूज ट्यूब में रखें।
नोट: यदि किसी दिए गए रंग समूह के पराग में रंग या बनावट में मामूली भिन्नता है, तो सुनिश्चित करें कि प्रत्येक ट्यूब के भीतर छर्रों का प्रतिनिधि नमूना है। अभिकर्मक मात्रा और इनक्यूबेशन और सेंट्रीफ्यूजेशन समय जो अनुसरण करते हैं, 0.25 ग्राम पराग के लिए उपयुक्त हैं। इसलिए, एसीटोलिसिस में उपयोग किए जाने वाले माइक्रोसेंट्रिफुग ट्यूबों में पराग की इस मात्रा का उपयोग करें। इस प्रोटोकॉल प्रकाश माइक्रोस्कोपी द्वारा डाउनस्ट्रीम संयंत्र स्रोत पहचान के लिए पर्याप्त, दाग पराग प्रदान करना चाहिए। यदि एसिटोलिसिस में पराग की एक अलग मात्रा का उपयोग करते हैं, तो अभिकर्मक मात्रा और प्रसंस्करण समय की बारीकियों को तदनुसार समायोजित किया जाना चाहिए। - प्रत्येक रंग समूह से शेष पराग को रंग समूह के नाम के साथ लेबल किए गए व्यक्तिगत प्लास्टिक बैग (रंग प्रति एक बैग) में रखें। -20 डिग्री सेल्सियस भंडारण में उपयुक्त मूल नमूने के अन्य भागों के साथ इन बैग स्टोर।
- 10 से 15 एस के लिए एक साफ लकड़ी के टूथपिक के साथ ट्यूब में पराग को अच्छी तरह से मिलाएं।
3. एसिटोलिसिस की तैयारी
- पहली बार एसिटोलिसिस के किसी भी हिस्से को शुरू करने से पहले, निर्दिष्ट संस्थान के पर्यावरणीय स्वास्थ्य और सुरक्षा (ईएचएस) विभाग से संपर्क करें कि एसिटोलिसिस से संबंधित अभिकर्मकों और अपशिष्ट को कैसे संभाला जाना चाहिए।
- निम्नलिखित अभिकर्मकों के स्टॉक समाधान प्राप्त करें, और रासायनिक भंडारण के लिए ईएचएस दिशानिर्देशों के अनुसार उन्हें धूआं हुड में रखें: 95% इथेनॉल; आसुत जल; ग्लेशियल एसिटिक एसिड, निर्जल; केंद्रित सल्फ्यूरिक एसिड; ग्लिसरीन; और स्पष्ट नेल पॉलिश।
- निम्नलिखित अभिकर्मकों के स्टॉक समाधान तैयार करें, और रासायनिक भंडारण के लिए ईएचएस दिशानिर्देशों के अनुसार उन्हें धूआं हुड में रखें: संतृप्त सोडियम बाइकार्बोनेट (आसुत जल में 8% डब्ल्यू / और सैफ्रानिन ओ (50% इथेनॉल में 1% डब्ल्यू /
4. एसिटोलिसिस
- ग्लेशियल एसिटिक एसिड धोने की पूर्व-एसिटोलिसिस प्रक्रिया करें। लैब कोट, आंखों की सुरक्षा और नाइट्राइल दस्ताने के साथ धूआं हुड के भीतर निम्नलिखित चरणों को पूरा करें।
- 80 डिग्री सेल्सियस पर एक गर्मी ब्लॉक बारी।
नोट: सुनिश्चित करें कि संतृप्त सोडियम बाइकार्बोनेट की एक निचोड़ बोतल आसानी से सुलभ है। इसका उपयोग धुएं के हुड में एसिड स्पिल को बेअसर करने के लिए किया जा सकता है यदि वे होते हैं। - एसिड अपशिष्ट के लिए एक ग्लास बीकर लेबल करें, इथेनॉल अपशिष्ट के लिए एक, और एसिटोलिसिस मिश्रण के लिए एक।
- पहले से तैयार स्टॉक समाधानों का उपयोग करके, लेबल, उचित आकार के ग्लास बीकर में निम्नलिखित अभिकर्मकों के कामकाजी विभाज्य बनाएं: ~ 23.0 एमएल ग्लेशियल एसिटिक एसिड; ~ 33.0 एमएल आसुत जल; ~ 95% इथेनॉल के 23.0 एमएल; ~ 25.0 एमएल सोडियम बाइकार्बोनेट (एसिड-दूषित ठोस अपशिष्ट के लिए)।
नोट: ये कुल 10 रंग समूह नमूनों (10 माइक्रोसेंट्रिफ्यूज ट्यूब) पर निम्नलिखित एसिटोलिसिस प्रक्रियाओं को पूरा करने के लिए आवश्यक वॉल्यूम हैं। - धीरे-धीरे 0.25 ग्राम रंग समूह पराग युक्त प्रत्येक माइक्रोसेंट्रिफ्यूज ट्यूब में ग्लेशियल एसिटिक एसिड के 500 μL जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, पराग को 10-15 एस के लिए एक साफ टूथपिक के साथ हिलाएं, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। उपयोग के बाद सोडियम बाइकार्बोनेट अपशिष्ट बीकर में उपयोग किए गए टूथपिक को रखें; प्रत्येक ट्यूब के लिए इस प्रक्रिया को दोहराएं।
नोट: प्रत्येक ट्यूब के लिए एक साफ, नई टूथपिक का उपयोग करें। सुनिश्चित करें कि प्रत्येक ट्यूब का ढक्कन कसकर बंद है। - 1,100 × ग्राम पर 3 मिनट के लिए नमूने अपकेंद्रित्र। एसिड अपशिष्ट बीकर में ट्यूबों से सतह पर तैरनेवाला डिकेंट करें। फिर, ट्यूब के रिम के चारों ओर अवशिष्ट ग्लेशियल एसिटिक एसिड को हटाने के लिए एक साफ पेपर तौलिया के साथ ट्यूब के खुले मुंह को धीरे-धीरे और संक्षेप में स्पर्श करें।
नोट: सतह पर तैरनेवालों को कम करते समय पराग गोली को खोने के लिए सावधान रहें।
- 80 डिग्री सेल्सियस पर एक गर्मी ब्लॉक बारी।
- एसिटोलिसिस प्रक्रिया करें।
नोट: प्रयोगशाला कोट, आंखों की सुरक्षा और ब्यूटाइल विनाइल दस्ताने के साथ धूआं हुड के भीतर निम्नलिखित चरणों को पूरा करें।- एसिटोलिसिस मिश्रण (9: 1 ग्लेशियल एसिटिक एसिड: सल्फ्यूरिक एसिड) को पहले 10.8 एमएल ग्लेशियल एसिटिक एसिड (कामकाजी विभाज्य से) को बीकर लेबल वाले एसीटोलिसिस मिश्रण में जोड़कर तैयार करें। फिर, 1250 μL फ़िल्टर्ड पिपेट युक्तियों के साथ लगे 1000 μL पिपेट का उपयोग करके, धीरे-धीरे ग्लेशियल एसिटिक एसिड युक्त एसीटोलिसिस मिश्रण बीकर में स्टॉक समाधान से केंद्रित सल्फ्यूरिक एसिड के 1200 μL (1.2 एमएल) जोड़ें। सोडियम बाइकार्बोनेट के बीकर में इस्तेमाल किया पिपेट टिप त्यागें।
नोट: एसिटोलिसिस मिश्रण बीकर स्पर्श करने के लिए गर्म हो सकता है, और मिश्रण पीला हो सकता है। दो संभावनाएं हैं जो मिश्रण को गहरे रंग में बदलने का कारण बनती हैं: (ए) अभिकर्मक अपनी समाप्ति तिथियों से पहले हो सकते हैं, या (बी) बहुत अधिक सल्फ्यूरिक एसिड जोड़ा जा सकता है। किसी भी मामले में, यदि मिश्रण अंधेरा हो जाता है, तो इसे एसिड अपशिष्ट बीकर में फेंक दें, और एक ताजा एसिटोलिसिस मिश्रण तैयार करें। - धीरे-धीरे एक ग्लास रॉड या लकड़ी की हलचल छड़ी के साथ एसीटोलिसिस मिश्रण को हिलाएं ताकि यह सुनिश्चित हो सके कि यह समरूप है। सोडियम बाइकार्बोनेट के बीकर में इस्तेमाल की गई रॉड /
- 1250 μL फ़िल्टर्ड पिपेट युक्तियों के साथ एक 1000 μL विंदुक का उपयोग करके, धीरे-धीरे प्रत्येक ट्यूब के लिए बीकर से एसिटोलिसिस मिश्रण के 1000 μL जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। उपयोग के बाद सोडियम बाइकार्बोनेट अपशिष्ट बीकर में इस्तेमाल किए गए टूथपिक को रखें।
नोट: प्रत्येक नमूने के लिए एक साफ, नई टूथपिक का उपयोग करें। - पहले से गरम (80 डिग्री सेल्सियस) गर्मी ब्लॉक पर नमूने रखें। 5 मिनट के लिए ट्यूबों सेते हैं, इनक्यूबेशन के माध्यम से आधे रास्ते में एक साफ टूथपिक के साथ अच्छी तरह से सरगर्मी। उपयोग के बाद सोडियम बाइकार्बोनेट के बीकर में प्रत्येक प्रयुक्त टूथपिक रखें।
नोट: नमूनों में टूथपिक्स न छोड़ें; एसिड उन्हें भंग कर देगा।
- एसिटोलिसिस मिश्रण (9: 1 ग्लेशियल एसिटिक एसिड: सल्फ्यूरिक एसिड) को पहले 10.8 एमएल ग्लेशियल एसिटिक एसिड (कामकाजी विभाज्य से) को बीकर लेबल वाले एसीटोलिसिस मिश्रण में जोड़कर तैयार करें। फिर, 1250 μL फ़िल्टर्ड पिपेट युक्तियों के साथ लगे 1000 μL पिपेट का उपयोग करके, धीरे-धीरे ग्लेशियल एसिटिक एसिड युक्त एसीटोलिसिस मिश्रण बीकर में स्टॉक समाधान से केंद्रित सल्फ्यूरिक एसिड के 1200 μL (1.2 एमएल) जोड़ें। सोडियम बाइकार्बोनेट के बीकर में इस्तेमाल किया पिपेट टिप त्यागें।
- पोस्ट-एसिटोलिसिस ग्लेशियल एसिटिक एसिड धोने की प्रक्रिया करें।
नोट: प्रयोगशाला कोट, आंखों की सुरक्षा और ब्यूटाइल विनाइल दस्ताने के साथ धूआं हुड में निम्नलिखित चरणों को पूरा करें।- धीरे-धीरे प्रत्येक ट्यूब में ग्लेशियल एसिटिक एसिड के 500 μL जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। उपयोग के बाद सोडियम बाइकार्बोनेट के बीकर में इस्तेमाल किए गए टूथपिक को रखें।
नोट: प्रत्येक नमूने के लिए एक साफ, नई टूथपिक का उपयोग करें। सुनिश्चित करें कि प्रत्येक ट्यूब का ढक्कन कसकर बंद है। - 1,100 × ग्राम पर 3 मिनट के लिए नमूने अपकेंद्रित्र। एसिड अपशिष्ट बीकर में प्रत्येक ट्यूब से सतह पर तैरनेवाला डिकेंट करें। फिर, ट्यूब के रिम के चारों ओर अवशिष्ट एसिड को हटाने के लिए एक साफ पेपर तौलिया के साथ ट्यूब के खुले मुंह को धीरे-धीरे और संक्षेप में स्पर्श करें।
- कम से कम 30 एस के लिए बहते पानी के नीचे ब्यूटाइल विनाइल दस्ताने को अच्छी तरह से कुल्लाएं, उन्हें हटा दें, और उन्हें सूखने के लिए सेट करें।
नोट: ब्यूटाइल विनाइल दस्ताने के पुन: उपयोग पर निर्माता के दिशानिर्देशों का पालन करें।
- धीरे-धीरे प्रत्येक ट्यूब में ग्लेशियल एसिटिक एसिड के 500 μL जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। उपयोग के बाद सोडियम बाइकार्बोनेट के बीकर में इस्तेमाल किए गए टूथपिक को रखें।
- प्रत्येक नमूने के लिए तीन पानी कुल्ला प्रदर्शन करें। लैब कोट, आंखों की सुरक्षा और नाइट्राइल दस्ताने के साथ धूआं हुड के भीतर निम्नलिखित चरणों को पूरा करें।
- प्रत्येक ट्यूब में आसुत जल बीकर से आसुत जल के 1000 μL जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। उपयोग के बाद सोडियम बाइकार्बोनेट अपशिष्ट बीकर में टूथपिक रखें।
नोट: प्रत्येक नमूने के लिए एक साफ, नई टूथपिक का उपयोग करें। सुनिश्चित करें कि प्रत्येक ट्यूब का ढक्कन कसकर बंद है। - 1,100 × ग्राम पर 3 मिनट के लिए नमूने अपकेंद्रित्र। ट्यूबों से सतह पर तैरनेवाला को सोडियम बाइकार्बोनेट के बीकर में डिकेंट करें। फिर, ट्यूब के रिम के चारों ओर अवशिष्ट पानी को हटाने के लिए एक साफ पेपर तौलिया के साथ ट्यूब के खुले मुंह को धीरे-धीरे स्पर्श करें।
- कुल तीन पानी के कुल्ला के लिए दो अतिरिक्त बार चरण 4.4.1-4.4.2 दोहराएं।
- प्रत्येक ट्यूब में आसुत जल बीकर से आसुत जल के 1000 μL जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। उपयोग के बाद सोडियम बाइकार्बोनेट अपशिष्ट बीकर में टूथपिक रखें।
- प्रत्येक नमूने के लिए इथेनॉल कुल्ला प्रदर्शन करें।
नोट: प्रयोगशाला कोट, आंखों की सुरक्षा और नाइट्राइल दस्ताने के साथ धूआं हुड के भीतर निम्नलिखित चरणों को पूरा करें।- 1250 μL फ़िल्टर्ड विंदुक युक्तियाँ के साथ एक 1000 μL विंदुक का उपयोग कर, प्रत्येक ट्यूब के लिए इथेनॉल बीकर से 95% इथेनॉल के 1000 μL जोड़ें। गैर खतरनाक कचरे में विंदुक टिप त्यागें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो।
नोट: उपयोग के बाद सोडियम बाइकार्बोनेट अपशिष्ट बीकर में टूथपिक रखें। प्रत्येक नमूने के लिए एक साफ, नई टूथपिक का उपयोग करें। सुनिश्चित करें कि प्रत्येक ट्यूब का ढक्कन कसकर बंद है। - 1,100 × ग्राम पर 3 मिनट के लिए नमूने अपकेंद्रित्र। इथेनॉल अपशिष्ट बीकर में ट्यूबों से सतह पर तैरनेवाला डिकेंट करें, और ट्यूब से अवशिष्ट इथेनॉल को हटाने के लिए एक साफ पेपर तौलिया के साथ ट्यूब के खुले मुंह को धीरे-धीरे स्पर्श करें।
- 1250 μL फ़िल्टर्ड विंदुक युक्तियाँ के साथ एक 1000 μL विंदुक का उपयोग कर, प्रत्येक ट्यूब के लिए इथेनॉल बीकर से 95% इथेनॉल के 1000 μL जोड़ें। गैर खतरनाक कचरे में विंदुक टिप त्यागें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो।
- नमूनों को दागने के लिए प्रयोगशाला कोट, आंखों की सुरक्षा और नाइट्राइल दस्ताने पहनें। कोमल उलटा का उपयोग करके सैफ्रानिन ओ दाग स्टॉक समाधान मिलाएं।
- एक डिस्पोजेबल, प्लास्टिक हस्तांतरण पिपेट का उपयोग करके, प्रत्येक ट्यूब में सैफ्रानिन ओ दाग की 5-10 बूंदें जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। टूथपिक को ट्यूब में छोड़ दें।
- 1250 μL फ़िल्टर्ड विंदुक युक्तियाँ के साथ एक 1000 μL विंदुक का उपयोग कर, प्रत्येक ट्यूब के लिए इथेनॉल बीकर से 95% इथेनॉल के 1000 μL जोड़ें। गैर खतरनाक कचरे में विंदुक टिप त्यागें। नेत्रहीन ट्यूब का निरीक्षण करते समय, 10-15 एस के लिए टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो। उपयोग के बाद गैर-खतरनाक कचरे में इस्तेमाल किए गए टूथपिक को रखें।
- सुनिश्चित करें कि प्रत्येक ट्यूब का ढक्कन कसकर बंद है। 1,100 × ग्राम पर 3 मिनट के लिए अपकेंद्रित्र। इथेनॉल अपशिष्ट बीकर में सतह पर तैरनेवाला डिकेंट करें।
नोट: इस बार पेपर तौलिया के साथ ट्यूब के मुंह को न छुएं। - एक प्लास्टिक डिस्पोजेबल हस्तांतरण विंदुक का उपयोग कर प्रत्येक ट्यूब के लिए ग्लिसरीन की 10-15 बूंदें जोड़ें। नेत्रहीन ट्यूब का निरीक्षण करते समय, ट्यूब की सामग्री को 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो।
नोट: उपयोग के बाद गैर-खतरनाक कचरे में इस्तेमाल किए गए टूथपिक को रखें। प्रत्येक नमूने के लिए एक साफ, नई टूथपिक का उपयोग करें। सुनिश्चित करें कि सभी ट्यूब लेबल सुपाठ्य हैं।
- परिवेश के कमरे के तापमान पर कम से कम 2 घंटे के लिए इथेनॉल को वाष्पित करने के लिए धूआं हुड में ट्यूबों को खुला छोड़ दें। इथेनॉल गंध के लिए नमूनों की जांच करें: यदि यह पता लगाने योग्य है, तो नमूने तैयार नहीं हैं और इथेनॉल गंध फैलने तक सूखने के लिए छोड़ दिया जाना चाहिए।
- सभी सामग्रियों को साफ करें, और कचरे का निपटान करें। अपकेंद्रित्र और गर्मी ब्लॉक दोनों को बंद करें। निर्दिष्ट संस्था के पर्यावरणीय स्वास्थ्य और सुरक्षा दिशानिर्देशों के अनुसार सभी ठोस और तरल कचरे का निपटान करें।
- पराग पहचान के लिए माइक्रोस्कोप स्लाइड तैयार करें; उन्हें स्पष्ट रूप से लेबल करें। प्रत्येक रंग समूह/नमूना है कि घुड़सवार किया जाएगा के लिए उचित रूप से एक साफ ग्लास माइक्रोस्कोप स्लाइड लेबल। नेत्रहीन ट्यूब का निरीक्षण करते समय, नमूने को 10-15 एस के लिए एक साफ टूथपिक के साथ हलचल करें, और सुनिश्चित करें कि ट्यूब की सामग्री अच्छी तरह से मिश्रित हो।
नोट: स्लाइड की तैयारी प्रयोगशाला बेंच पर की जा सकती है। गैर-खतरनाक कचरे में टूथपिक को त्यागें। प्रत्येक नमूने के लिए एक साफ, नई टूथपिक का उपयोग करें।- एक साफ डिस्पोजेबल प्लास्टिक हस्तांतरण पिपेट का उपयोग करके, एक ट्यूब से पराग अवशेषों की 1 बूंद निकालें, और इसे अपने लेबल माइक्रोस्कोप स्लाइड के केंद्र में रखें। बूंद को थोड़ा फैलने दें। स्लाइड पर ड्रॉप पर एक साफ कवरस्लिप रखें।
- स्लाइड सूखने के बाद, कवरस्लिप को स्पष्ट नेल पॉलिश के साथ स्लाइड पर सील करें। कवरस्लिप के प्रत्येक कोने पर पॉलिश की एक छोटी बूंद रखें, और कवरस्लिप की परिधि के चारों ओर पॉलिश की एक सीमा पेंट करें जहां यह स्लाइड से मिलता है। नेल पॉलिश को पूरी तरह से सूखने दें, और कवरस्लिप की परिधि के चारों ओर पॉलिश का दूसरा कोट पेंट करें।
पिछले एक अध्ययन ने निम्नलिखित कृषि फसलों में शहद मधुमक्खियों द्वारा एकत्र पराग की विविधता के आकलन की सूचना दी: बादाम, चेरी, हाईबश ब्लूबेरी, हाइब्रिड गाजर और घास का मैदान14। वर्णित विधियों का उपयोग करते हुए, कॉर्बिकुलर पराग एकत्र किया गया था, रंग द्वारा क्रमबद्ध किया गया था, और पराग विविधता का आकलन करने के लिए पहचाने गए प्रत्येक गोली रंग समूह के पौधे स्रोत। नीचे माउंट पराग जाल प्रत्येक फसल (चित्रा 1 ए) के लिए कई साइटों में कालोनियों पर स्थापित किए गए थे। प्रत्येक साइट से एकत्र पराग की मात्रा रंग छँटाई और एसिटोलिसिस विश्लेषण विधियों की नमूना वजन आवश्यकताओं को पूरा करने के लिए पर्याप्त थी। प्रत्येक पराग संग्रह नमूने में कई अलग-अलग रंग समूह (चित्रा 2 और चित्रा 3) थे। कुछ नमूनों में, पराग रंग समूहों में 4-5 छर्रों के रूप में कुछ होते हैं; हालाँकि, अधिकांश समूहों में उससे काफी अधिक था और इस प्रकार एसिटोलिसिस (चित्रा 4 और चित्रा 5) के लिए अपने स्वयं के लेबल वाले रंग समूह के रूप में कार्य किया। एसिटोलिसिस (चित्रा 6) के बाद, उज्ज्वल क्षेत्र प्रकाश माइक्रोस्कोपी प्रभावी ढंग से प्रत्येक अध्ययन स्थल (चित्रा 7) के आसपास के क्षेत्र से एकत्र वाउचर नमूनों के साथ रूपात्मक विशेषताओं की पुष्टि करके अपने सबसे कम संभव वर्गीकरण रैंक करने के लिए प्रत्येक रंग समूह की पहचान करने के लिए इस्तेमाल किया गया था।

चित्रा 1: कॉर्बिकुलर पराग इकट्ठा करने के लिए एक शहद मधुमक्खी कॉलोनी पर स्थापित पराग जाल। (ए) नीचे-माउंट जाल छत्ते के नीचे बोर्ड के ऊपर और सीधे सबसे कम छत्ते बॉक्स के ऊपर रखा गया है। अन्य पराग जाल शैलियों में (बी) फ्रंट-माउंट और (सी) बरमा-छेद प्रवेश माउंट जाल शामिल हैं। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 2: फँसाने तंत्र और पराग जाल के संग्रह ट्रे। लौटने वाले पराग फोर्जर्स को अपने छत्ते तक पहुंचने से पहले जाल फंसाने वाले तंत्र के माध्यम से निचोड़ना चाहिए। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 3: पराग जाल का संग्रह ट्रे। कॉर्बिकुलर पराग को पराग जाल द्वारा लौटने वाले पराग फोर्जर्स के पैरों से स्क्रैप किया जाता है और संग्रह ट्रे में गिर जाता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 4: रंग समूहों में कॉर्बिकुलर पराग के एक नमूने को सॉर्ट करना। कॉर्बिकुलर पराग को एकत्र किए गए विभिन्न रंग छर्रों के अनुपात की रिपोर्ट करने के लिए रंग समूहों में क्रमबद्ध करने के बाद सुखाया और तौला जा सकता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 5: पैनटोन रंग गाइड का उपयोग करके रंग द्वारा क्रमबद्ध पराग छर्रों के चार समूह। रंग समूहों को (ए) ग्रे, पैनटोन 5855 सी, (बी) ब्राउन, पैनटोन 7557 सी, (सी) पीला, पैनटोन 458 सी, और (डी) हल्के भूरे रंग, पैनटोन 3547 सी के रूप में लेबल किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
चित्रा 6: धूआं हुड के अंदर एसिटोलिसिस उपकरण सेटअप। गर्मी ब्लॉक, अभिकर्मकों, विलायक अपशिष्ट और एसिड अपशिष्ट कंटेनर, लेबल बीकर, पिपेट, पिपेट युक्तियाँ, हलचल छड़ें, और धुआं हुड के अंदर स्थित माइक्रोसेंट्रिफ्यूज ट्यूब। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
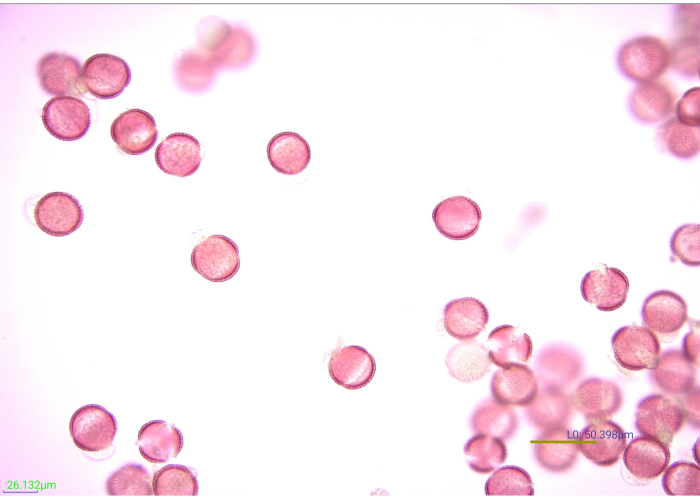
चित्रा 7: दाग, एसिटोलाइज्ड पराग कणों का माइक्रोग्राफ। 40x आवर्धन पर एसिटोलाइज्ड सरसों (ब्रैसिकेसी) पराग कणों के कई पहलू। स्केल बार = 50.398 μm कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
बादाम फसल स्थानों से एकत्र पराग में अन्य फसलों से एकत्र पराग की तुलना में अपेक्षाकृत कम पराग विविधता थी, जिसमें औसतन 3.0 ± 0.5 गोली रंग और 3.2 ± 1.2 पौधे कर प्रति साइट (तालिका 2)14 था। शेष चार फसल प्रणालियों में चेरी में प्रति साइट 6.0 ± 1.5 पौधे कर के औसत के साथ उच्च पराग विविधता स्तर ± उच्च पराग विविधता स्तर था, 1.4 गोली रंगों ± ± 8.8 ± 1.4 गोली रंग और हाईबश ब्लूबेरी में प्रति साइट 13.0 पौधे कर ±, 7.0 ± 1.0 गोली रंग और 11.0 ± ± 0.0 पौधा कर प्रति साइट
| पैदावार | पराग गोली रंग/साइट (एसई) की औसत संख्या | संयंत्र कर/साइट (एसई) की औसत संख्या | कुल कर की पहचान की गई | ||
| परिवार | वंश | प्रजातियां | |||
| बादाम | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| ब्लूबेरी | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| गाजर | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| चेरी | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| घास का मैदान | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
तालिका 2: पांच फसल प्रणालियों में शहद मधुमक्खियों से एकत्र किए गए कॉर्बिकुलर पराग की विविधता। विविधता मैट्रिक्स में गोली रंगों की औसत संख्या (± एसई), पौधे कर की औसत संख्या (± एसई), और पहचाने गए कुल कर शामिल हैं। इस तालिका को14 से संशोधित किया गया है। संक्षिप्त नाम: एसई = मानक त्रुटि।
विभिन्न पराग जाल शैलियों के अपने फायदे और परिणाम हैं। चार आमतौर पर इस्तेमाल किए जाने वाले जाल शैलियों के लाभ और सीमाएं, (1) फ्रंट-माउंट, (2) बॉटम-माउंट, (3) बरमा-छेद, और (4) टॉप-माउंट पराग जाल नीचे चर्चा की गई हैं। फ्रंट-माउंट जाल सबसे बहुमुखी शैली (चित्रा 1 बी) हैं। स्थापना तेज और आसान है; यह छत्ते के बक्से को उठाने के बिना किया जा सकता है, और ये जाल छत्ते के उपकरण की किसी भी लैंगस्ट्रोथ शैली पर फिट हो सकते हैं। जैसे ही संग्रह ट्रे कॉलोनी के सामने बैठती है, यह कॉलोनी से न्यूनतम मलबा एकत्र करती है। हालांकि, संग्रह ट्रे बाहरी तत्वों के संपर्क में भी अधिक है- क्षेत्र सिंचाई, बरसात या आर्द्र मौसम से नमी, या ओस संग्रह ट्रे के माध्यम से पराग के संपर्क में आ सकती है, संभावित रूप से पराग को अनुपयोगी बना ती है यदि छर्रों को अलग करने के लिए बहुत संतृप्त हो जाते हैं। बारिश या उच्च आर्द्रता की पूर्वानुमानित घटनाओं के दौरान फंसाने से बचकर पराग संतृप्ति के जोखिम को कम किया जा सकता है। जाल के नीचे एक रबर चटाई रखना और पराग जाल के शीर्ष पर अतिरिक्त कवरिंग सामग्री (जैसे, छत महसूस किया गया) भी मौसम से संग्रह ट्रे को ढाल सकता है।
इस पेपर (चित्रा 1 ए) में डेटा के लिए पराग एकत्र करने के लिए नीचे-माउंट जाल का उपयोग किया गया था। वे स्थापित करने के लिए सुविधाजनक नहीं हैं क्योंकि उन्हें कॉलोनी के ब्रूड घोंसले के नीचे रखा जाना चाहिए। स्थापना समय लेने वाली है और इसके परिणामस्वरूप कॉलोनी से जाल में गिरने वाले मलबे की एक उच्च मात्रा होती है, जैसे मधुमक्खी भागों और मोम के छोटे टुकड़े। अधिकांश निर्मित बॉटम-माउंट जाल के लिए संग्रह ट्रे का फर्श ठीक जाल से बना है, जो एकत्र पराग को नमी से बचाने के लिए उचित वेंटिलेशन की अनुमति देता है। बरमा-छेद पराग जाल फोर्जर्स के भटकाव को कम करने में मदद करते हैं यदि वे मुख्य रूप से छत्ते के निचले बोर्ड (चित्रा 1 सी) द्वारा किए गए प्रवेश द्वार के बजाय छत्ते के प्रवेश द्वार के रूप में बरमा छेद का उपयोग करते हैं। चूंकि बरमा-छेद पराग जाल के लिए संग्रह ट्रे बहुत छोटा है, इसलिए संग्रह ट्रे के अतिप्रवाह से बचने के लिए इसे अक्सर खाली किया जाना चाहिए। एक छत्ते पर इसके ऊपरी प्लेसमेंट को देखते हुए, शीर्ष-माउंट पराग जाल स्थापित करने और हटाने के लिए सबसे आसान जाल शैली है, और एकत्र पराग नमूना छत्ते के मलबे से मुक्त है। हालांकि, यह जाल शैली क्षतिग्रस्त छत्ते उपकरणों के प्रति अतिरिक्त संवेदनशील है क्योंकि संग्रह ट्रे नमी के संपर्क में आ जाएगी यदि ढक्कन, आंतरिक कवर और ऊपरी छत्ते बॉक्स को ठीक से एक साथ सील नहीं किया जाता है।
यहां वर्णित प्रोटोकॉल बड़े वयस्क और लार्वा आबादी (चरण 1.2) के साथ उपनिवेशों का चयन करने के लिए कहते हैं। इस चयन विधि का उद्देश्य इन उपनिवेशों से बहुत बड़ी मात्रा में फंसे पराग का उत्पादन करना है। पर्याप्त फोर्जिंग आबादी वाली कॉलोनियों को जाल स्थापना पर प्रवेश द्वार पर भारी भीड़ का अनुभव हो सकता है। एक बड़े छत्ते के प्रवेश द्वार का चयन भीड़ को कम करेगा। बड़ी फोर्जिंग आबादी भी बहुत बड़ी मात्रा में पराग एकत्र कर सकती है जो संग्रह ट्रे की सीमा से अधिक हो सकती है। विशाल संग्रह ट्रे का उपयोग करें, जैसा कि अधिकांश नीचे या शीर्ष-माउंट जाल शैलियों के साथ देखा जाता है, और बड़ी मात्रा में फंसे पराग को समायोजित करने के लिए अक्सर खाली ट्रे। यदि वांछित शोध उद्देश्य एक मधुमक्खी पालन में उपनिवेशों द्वारा एकत्र पराग मात्रा का आकलन करना है, तो चयन के लिए वयस्क और लार्वा आबादी को अनुकूलित करने के बजाय प्रतिनिधि कॉलोनियों का चयन करें। पराग जाल की सभी शैलियाँ छत्ते के प्रवेश द्वार को अवरुद्ध करती हैं और एक नया प्रवेश द्वार बनाती हैं जो मूल प्रवेश द्वार16 से स्थानिक रूप से भिन्न होती है। पराग जाल आमतौर पर पराग को इकट्ठा करने में विफल होते हैं जब फोर्जर स्थापना पर पराग जाल के नए प्रवेश द्वार पर फिर से उन्मुख करने में असमर्थ होते हैं। ये फोर्जर्स आसानी से पड़ोसी पित्ती में बहाव करते हैं, संभावित रूप से अन्य पराग संग्रह नमूनों को क्रॉस-दूषित करते हैं यदि वे पराग जाल के साथ एक और छत्ते में प्रवेश करते हैं। इसलिए, फोर्जर्स को स्थापना के बाद ट्रैपिंग तंत्र को अलग रखकर नए प्रवेश द्वार के अनुकूल होने के लिए कम से कम 24 घंटे दिए जाने चाहिए। कुछ या कोई अतिरिक्त छत्ता प्रवेश द्वार के साथ कॉलोनियों का चयन भी नए पराग जाल प्रवेश द्वार के लिए उन्मुख करते समय भ्रम को कम करता है।
अतिरिक्त छत्ता प्रवेश द्वार (जैसे, छेद और विकृत ढक्कन) को सील कर दिया जाना चाहिए, लेकिन जाल स्थापना की शुरुआत में मौजूद इन प्रवेश द्वारों के साथ पड़ोसी पित्ती में बहने वाले फोर्जर का खतरा बढ़ जाएगा। फोर्जर्स आसानी से अन्य छत्ते के प्रवेश द्वारों में भी बह जाएंगे यदि एक पराग जाल केवल पैलेटाइज्ड पित्ती के क्लस्टर में एक छत्ते पर स्थापित किया जाता है। फोर्जर्स के बहाव की संभावना कम होती है यदि फूस पर एक ही दिशा का सामना करने वाले सभी पित्ती में जाल स्थापित होते हैं। पराग जाल प्रवेश द्वार और छत्ते के मूल प्रवेश द्वार के बीच पर्याप्त दूरी के कारण टॉप-माउंट पराग जाल मधुमक्खी बहाव का अधिक जोखिम पैदा कर सकते हैं। इस अध्ययन के लिए, प्रत्येक मधुमक्खी कॉलोनी के बीच पराग मात्रा और कर संरचना में भिन्नता के लिए प्रत्येक प्रयोगात्मक स्थान में कई शहद मधुमक्खी कॉलोनियों पर पराग जाल स्थापित किए गए थे। इस प्रकार, परिदृश्य से मजबूत पराग संग्रह प्राप्त करने के लिए कई कॉलोनियों पर पराग जाल स्थापित किया जाना चाहिए क्योंकि पराग संग्रह पौधों की प्रजातियों के प्रकार और कुल एकत्रित मात्रा12,13 के आधार पर कॉलोनियों के बीच व्यापक रूप से भिन्न हो सकता है। प्रत्येक पराग नमूने में 7-दिवसीय संग्रह अवधि थी। भविष्य के अध्ययनों में, लगातार दो या तीन 72 घंटे के अंतराल में पराग एकत्र करने से पराग चारा अनुमान40 की सटीकता में वृद्धि होगी।
चूंकि पराग संग्रह में अस्थायी उतार-चढ़ाव की एक उच्च डिग्री है, इसलिए पराग अनुमान सटीकता को लक्षित फसल प्रणालियों 24,27,39 की प्रारंभिक, शिखर और देर से खिलने की अवधि में पराग संग्रह प्रक्रिया को दोहराकर बढ़ाया जा सकता है। मधुमक्खी स्थानों14,27,33,43 के बीच मात्रा और पौधों की प्रजातियों के प्रकार में प्रत्याशित भिन्नता के कारण पराग को कई स्थानों से एकत्र किया जाना चाहिए, यद्यपि एक ही फसल प्रणाली या परिदृश्य प्रकार। लंबे समय तक पराग फँसाने शहद मधुमक्खी कालोनियों के लिए हानिकारक हो सकता है। संभावित प्रभावों में ब्रूड पालन में कमी, लार्वा विकास अवधि को छोटा करना, और पित्ती 19,44,45,46 में अंडे और युवा लार्वा का नरभक्षण शामिल है। पराग फँसाने की लंबी अवधि, जैसे कि पूरे बढ़ते मौसम, कॉलोनियों में ब्रूड पालन पर हानिकारक प्रभावों को खराब कर सकते हैं। पराग फँसाने से शहद उत्पादन में कमी और संग्रहीत शहद के नमी स्तर में वृद्धि भी हो सकतीहै 13. एक मधुमक्खी पालन में कॉलोनियों के बीच घूर्णन पराग जाल जब लगातार एक परिदृश्य या फसल प्रणाली की निगरानी पराग फंसाने के लिए उपयोग की जाने वाली कॉलोनियों को नुकसान को कम कर सकता है। हर दूसरे सप्ताह पराग जाल को उलझाने से हानिकारक प्रभाव कम हो जाएंगे, विशेष रूप से शहद उत्पादन में नुकसान, अगर समय की अवधि में एक ही कॉलोनियों पर पराग फंसाना13.
इसके अलावा, पराग जाल अधिमानतः मजबूत कॉलोनियों पर रखा जाता है। कभी-कभी, पराग जाल अनजाने में संलग्न हो सकते हैं। पराग जाल संग्रह वांछित नहीं होने पर पराग जाल तंत्र को लॉक करके इससे बचा जा सकता है। पराग जाल शहद मधुमक्खी फोर्जर से सभी कॉर्बिकुलर पराग को नहीं हटाते हैं। ट्रैपिंग दक्षता जाल प्रकार, पराग गोली आकार, मधुमक्खी शरीर के आकार, दिन के समय और मौसम की स्थिति पर निर्भर करती है। इसलिए, विभिन्न पौधों की प्रजातियों और संग्रह अवधि25,26 के लिए पराग जाल का उपयोग करते समय कॉर्बिकुलर पराग संग्रह सुसंगत नहीं है। नीलगिरी एसपीपी और टैमरिक्स एसपीपी जैसे पौधों से छोटे पराग छर्रों को पराग जाल27 द्वारा कब्जा करने की संभावना कम है। विशेष रूप से, इस अध्ययन में हाईबश ब्लूबेरी संग्रह साइटों से कोई हाईबश ब्लूबेरी (वैक्सीनियम कोरिम्बोसोम एल) पराग नहीं पाया गया था, जो पिछले सबूतों का समर्थन करता है कि पराग जाल संग्रह47 के लिए हाईबश ब्लूबेरी पराग छर्रों बहुत छोटे हैं। इसके विपरीत, इस अध्ययन में हर फसल प्रणाली में सिंहपर्णी (तारक्सैकम ऑफिसिनेल एफएच विग) से प्राप्त पराग पाया गया था। कुछ पौधों की प्रजातियों के पराग छर्रों को दूसरों की तुलना में बहुत बड़ा भी हो सकता है, जैसे कि तारक्सैकम एसपीपी, और संभवतः पराग जाल27 से पराग संग्रह के विश्लेषण में अधिक प्रतिनिधित्व किया जा सकता है। व्यक्तिगत पराग फोर्जर्स को कैप्चर करना और मैन्युअल रूप से उनके कॉर्बिकुलर पराग को हटाने से पराग स्रोत मूल्यांकन की सटीकता में वृद्धि होगी, लेकिन पराग जाल (तालिका 1) का उपयोग करने की तुलना में यह बहुत समय और संसाधन-गहन है। पराग छर्रों को रंग समूहों में सॉर्ट करना अपेक्षाकृत सीधा आगे है, हालांकि यह समय लेने वाला है। जब तक कोई विशिष्ट शोध लक्ष्य या उद्देश्य नहीं होता है, पराग छर्रों की मात्रा रंग समूहों में छँटाई के लिए 10 ग्राम या उससे कम (किसी भी दिए गए नमूने के लिए) तक सीमित होनी चाहिए। इस राशि से अधिक मात्रा वाले पूरे नमूनों को सॉर्ट करने से विश्लेषण पूरा करने के लिए आवश्यक समय में काफी वृद्धि होगी। हालांकि, यह महत्वपूर्ण है कि रंग छँटाई के लिए एक उप-नमूना लेने से पहले एक पराग नमूना बहुत अच्छी तरह से मिश्रित हो। मूल नमूने को मिलाने में विफल रहने के परिणामस्वरूप एक उप-नमूना हो सकता है जो पूरे का प्रतिनिधि नहीं है, जिससे बचा जाना चाहिए।
यदि मूल नमूना कंटेनर में पराग छर्रों के पूरी तरह से मिश्रण की अनुमति देने के लिए पर्याप्त खाली जगह नहीं है, तो पूरे नमूने को एक बड़े प्लास्टिक बैग या एक छोटे पेपर बैग में रखना पर्याप्त होना चाहिए, यहां तक कि बड़े नमूनों के लिए भी। हार्ड प्लास्टिक, ढक्कन वाले कंटेनर भी काम करेंगे। नमूने को मिलाकर धीरे-धीरे किया जाना चाहिए, ताकि पराग छर्रों को स्क्वैश या अन्यथा नष्ट न किया जाए। अनजाने पूर्वाग्रह अवचेतन रूप से "सुंदर बैंगनी छर्रों" को स्कूप करने के लिए राजी कर सकते हैं, उदाहरण के लिए, पूरे से एक उप-नमूने को हटाते समय। इसलिए, नमूने की रंग संरचना को एक उप-नमूने को स्कूप करते समय दृश्य से अस्पष्ट किया जाना चाहिए। इस तरह, एक उप-नमूना प्राप्त करना जो वास्तव में पूरे का प्रतिनिधि है, अधिक संभावना है। हालांकि, यह सबसैंपलिंग विधि पराग छर्रों का चयन करने में विफल हो सकती है जो नमूने में कम बहुतायत में हैं। इसलिए, यदि नमूने में प्रतिनिधित्व किए गए प्रत्येक व्यक्तिगत पौधे टैक्सोन की पहचान करना एक शोध लक्ष्य है, तो एक उप-नमूना एकत्र करना उचित नहीं होगा; पूरे नमूने का विश्लेषण किया जाना चाहिए। इसलिए, छर्रों को एक गिलास पेट्री डिश में क्रमबद्ध किया जाना चाहिए। एक बार छंटाई पूरी हो जाने के बाद, पैनटोन रंग गाइड के उपयुक्त पृष्ठों को गाइड और सॉर्ट किए गए पराग के बीच रंग-मिलान को आसान बनाने के लिए डिश के नीचे रखा जा सकता है। इसका एक उदाहरण चित्र 5 में दर्शाया गया है।
परागण के लिए फसलों में रखी गई शहद मधुमक्खी कालोनियों से पराग को फँसाते समय, दस से अधिक कुल रंग समूहों का उपयोग नहीं किया जाना चाहिए: नौ व्यक्तिगत रंग और नमूने में अल्पसंख्यक रंगों से बना एक "विविध" रंग समूह। रंग समूहों की अधिकतम संख्या पर एक उचित सीमा रखना जो एक नमूने में विभाजित किया जा सकता है, शोधकर्ता को छर्रों को अत्यंत विशिष्ट समूहों की बढ़ती संख्या में अंतहीन रूप से अलग करके फंसने से रोकता है, जो सॉर्टिंग पूरा होने पर, व्यक्तिगत रूप से एसिटोलिसिस के लिए पर्याप्त मात्रा में नहीं हो सकता है। यदि पौधों की प्रजातियों के एक बहुत ही विविध वर्गीकरण से फोर्जिंग की संभावना वाले उपनिवेशों से फंसना है, तो अधिक रंग समूह आवश्यक हो सकते हैं, और प्रोटोकॉल को उस आवश्यकता को प्रतिबिंबित करने के लिए अनुकूलित किया जाना चाहिए। वर्तमान अध्ययन शहद मधुमक्खी कॉलोनियों परागण फसलों से एकत्र किए गए पराग नमूनों पर केंद्रित था, और कई कर आमतौर पर एक रंग समूह में पाए गए थे, पिछले अध्ययनों 29,30,31 के समान।
एसिटोलिसिस पराग कणों की सतह से लिपिड, प्रोटीन और कार्बनिक मलबे को भंग कर देता है, जिससे एक्सीन के विशिष्ट पात्रों का पता चलता है, ताकि अनाज को दाग दिया जा सके और अधिक आसानी से पहचाना जा सके। यह एक पुरानी और सामान्य पद्धति है जिसका उपयोग कई प्रकार के पराग अनुसंधान में किया जाताहै। सामान्य कदम मानकीकृत हैं; वे प्रोटोकॉल से प्रोटोकॉल में थोड़ा भिन्न होते हैं। हालांकि, सेंट्रीफ्यूजेशन गति और समय की बारीकियों, इनक्यूबेशन तापमान और अवधि, पराग-मात्रा-चालित अभिकर्मक मात्रा और यहां तक कि सतह पर तैरनेवाला हटाने की विधि (डिकैंटिंग बनाम पाइपिंग) को अनुसंधान लक्ष्यों के अनुसार प्रयोगात्मक रूप से अनुकूलित करने की आवश्यकता हो सकती है और, कुछ हद तक, पराग के प्रकार ों का सामना करना पड़ सकता है48. दरअसल, एसिटोलिसिस पराग के महत्वपूर्ण नैदानिक पात्रों को कुछ टैक्सा से हटा सकता है जैसे कि मालवासी और ऑर्किडेसी38। इसलिए, सभी पराग एसिटोलिसिस के मानक तरीकों के लिए उत्तरदायी नहीं हैं। जैसा कि ऊपर कहा गया है, फसल-परागण शहद मधुमक्खियों द्वारा एकत्र पराग के प्रमुख पौधे टैक्सोन स्रोतों की पहचान करने के उद्देश्य से इस अध्ययन में इन विधियों को अनुकूलित किया गया था। यदि पराग कणों का सटीक परिमाणीकरण अध्ययन का हिस्सा है, तो विचार किए जाने वाले विवरणों को इस पत्र में संबोधित नहीं किया गया है।
सॉल्वैंट्स और एसिड के उपयोग के लिए सावधानीपूर्वक योजना, उचित व्यक्तिगत सुरक्षा उपकरण (पीपीई), और जिम्मेदार अपशिष्ट निपटान (चित्रा 6) की आवश्यकता होती है। यह महत्वपूर्ण है कि शोधकर्ता एसिटोलिसिस के किसी भी हिस्से को शुरू करने से पहले अभिकर्मकों को संग्रहीत करने और कचरे का निपटान करने का सही तरीका निर्धारित करें। इस प्रयोगशाला में, ब्यूटाइल दस्ताने का उपयोग प्रक्रिया के किसी भी हिस्से के दौरान किया जाता है जिसमें सल्फ्यूरिक एसिड और यहां तक कि ग्लेशियल एसिटिक एसिड भी शामिल होता है क्योंकि उनके पास नाइट्राइल दस्ताने की तुलना में दोनों एसिड के लिए बेहतर गिरावट और पारगम्यता रेटिंग होती है, जबकि निपुणता49 से समझौता नहीं किया जाता है। उपयुक्त दस्ताने और अन्य पीपीई49 पर सिफारिशों के लिए संबंधित संस्थान के सुरक्षा दिशानिर्देशों से परामर्श करना विवेकपूर्ण होगा। एसिटोलिसिस चरण से पहले ग्लेशियल एसिटिक एसिड जोड़ नमूने में किसी भी अवशिष्ट नमी को हटाने में मदद करता है और इसे महत्वपूर्ण एसिटोलिसिस प्रतिक्रिया के लिए तैयार करता है। एसिटोलिसिस चरण में ग्लेशियल एसिटिक एसिड-सल्फ्यूरिक एसिड मिश्रण पानी के साथ हिंसक प्रतिक्रिया कर सकता है, यही कारण है कि यह महत्वपूर्ण है कि सभी कांच के बने पदार्थ और आपूर्ति पूरी तरह से सूखी हो, और यह कि सभी नमी को एसिटोलिसिस से पहले नमूने से हटा दिया जाता है। ग्लेशियल एसिटिक एसिड के पोस्ट-एसिटोलिसिस जोड़ एसिटोलिसिस मिश्रण को पतला और बेअसर करता है।
इथेनॉल और ग्लेशियल एसिटिक एसिड, विशेष रूप से, माइक्रोसेंट्रिफ्यूज ट्यूब लेबल की स्याही को भंग कर सकते हैं, अगर ये अभिकर्मक ट्यूब के बाहर ड्रिप करते हैं, यहां तक कि विलायक प्रतिरोधी पेन के साथ भी। यह सुनिश्चित करने के लिए कि वे अभी भी सुपाठ्य हैं, पूरी प्रक्रिया में ट्यूब लेबल की जांच करें। यदि तार्किक रूप से संभव हो, तो इस संभावना के खिलाफ सुरक्षा के रूप में लेजरजेट-मुद्रित लेबल का उपयोग करने पर विचार करें। जिस तरह से सतह पर तैरनेवालों को हटाया जाता है, वह प्रभावित करेगा कि अभिकर्मक माइक्रोसेंट्रिफ्यूज ट्यूबों के बाहर ड्रिबल करते हैं या नहीं। एक आत्मविश्वास, चिकनी हाथ के साथ सतह पर तैरनेवाला को कम करना महत्वपूर्ण है, जो अभ्यास के साथ आता है। विघटन के दौरान अपकेंद्रित्र ट्यूब से पराग के नमूनों के नुकसान से बचने के लिए देखभाल की जानी चाहिए। बहुत तेजी से कम करने से कुछ या सभी पराग अवशेषों को खोने का जोखिम होता है; बहुत धीरे-धीरे डिकैंटिंग के परिणामस्वरूप सतह पर तैरनेवाला ट्यूब के नीचे चल सकता है। यद्यपि आमतौर पर 100 डिग्री सेल्सियस के इनक्यूबेशन तापमान की सिफारिश की जाती है, पराग आसानी से इस अध्ययन (0.25 ग्राम) में उपयोग की जाने वाली मात्रा में उस तापमान पर "अतिरंजित" हो सकता है, खासकर अगर थोड़ी लंबी अवधि के लिए ऊष्मायन किया जाता है29. वास्तव में, यहां तक कि 80 डिग्री सेल्सियस पर, पराग कण फट सकते हैं या अन्यथा क्षतिग्रस्त हो सकते हैं यदि एसीटोलिसिस मिश्रण में बहुत लंबा छोड़ दिया जाता है। इनक्यूबेशन तापमान और अवधि को नमूने में पराग कणों को नष्ट करने से बचने के लिए सावधानीपूर्वक निर्धारित किया जाना चाहिए।
धुंधला पराग एक्साइन सुविधाओं की परिभाषा और विपरीत को बढ़ाता है, जिससे फोटोग्राफ और पहचानना आसान हो जाता है (चित्रा 7)। 1% सैफ्रानिन ओ की पांच बूंदें (प्लास्टिक ट्रांसफर पिपेट से) प्रभावी रूप से 0.25 ग्राम पराग दाग। हालांकि, अलग-अलग पराग अलग-अलग दागते हैं। यदि पराग कणों को बहुत हल्के या बहुत भारी दाग दिया जाता है, तो पहचान मुश्किल हो सकती है। जब संभव हो, अध्ययन में पाए जाने वाले पराग प्रजातियों को उचित रूप से दागने के लिए आवश्यक दाग समाधान की मात्रा को प्रयोगात्मक नमूनों के प्रसंस्करण की शुरुआत से पहले मान्य किया जाना चाहिए। बहरहाल, यदि प्रयोगात्मक नमूनों में से एक ठीक से दाग नहीं है, तो इसे ठीक किया जा सकता है। एक पराग नमूने को हल्का करने के लिए जो बहुत भारी दाग है, नमूने को पानी और फिर इथेनॉल से कुल्लाएं। यदि पराग को विशिष्ट विशेषताओं को देखने के लिए पर्याप्त रूप से दाग नहीं दिया जाता है, तो दाग की कुछ अतिरिक्त बूंदें जोड़ी जा सकती हैं। ग्लिसरीन जोड़ने से पहले इन नमूनों के दाग की जांच की जानी चाहिए। इसी तरह, पराग अवशेषों के लिए ग्लिसरीन की आदर्श मात्रा निर्धारित करने के लिए कुछ परीक्षण और त्रुटि की आवश्यकता हो सकती है। ग्लिसरीन की पंद्रह बूंदों ने इस अध्ययन में नमूनों को सूखने से उचित रूप से संरक्षित किया, जबकि पराग अवशेषों को प्रकाश माइक्रोस्कोपी के माध्यम से डाउनस्ट्रीम पहचान के लिए आदर्श एकाग्रता में भी पतला किया। पराग अवशेषों की अन्य मात्रा में निर्जलीकरण को रोकने और बढ़ते की सुविधा के लिए कम या ज्यादा ग्लिसरीन की आवश्यकता हो सकती है।
लेखकों के पास खुलासा करने के लिए कुछ भी नहीं है।
ग्रेचेन जोन्स (यूएसडीए-एआरएस, एपीएमआरयू, कॉलेज स्टेशन, टीएक्स) को रंग छँटाई और एसिटोलिसिस विश्लेषण के साथ सहायता के लिए धन्यवाद देते हैं। इस शोध को ओरेगन स्टेट मधुमक्खीपालन द्वारा आरआरएस को प्रदान किए गए अनुसंधान धन द्वारा समर्थित किया गया था।
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved