Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
꿀벌 식민지에서 꽃가루의 수집 및 식별
우리는 꿀벌로부터 코르비큘러 꽃가루를 수집하는 방법뿐만 아니라 분류 식별을위한 꽃가루의 색상 분류, 비원 분해 및 현미경 슬라이드 준비를위한 프로토콜을 설명합니다. 또한, 우리는 꽃가루 트랩을 사용하여 다섯 가지 자르기 시스템에서 수집 한 코르비큘러 꽃가루의 펠렛 색상과 분류 학적 다양성을 제시합니다.
연구자들은 종종 꿀벌로부터 코르비큘러 꽃가루를 수집하고 분석하여 꽃가루를 먹이는 식물 공급원을 확인하거나 꽃가루를 통해 꿀벌의 살충제 노출을 추정합니다. 본원에 기재된 것은 그들의 두드러기로 돌아가는 꿀벌로부터 코르비큘러 꽃가루를 수집하기 위한 효과적인 꽃가루-포획 방법이다. 이 수집 방법은 연구 목적으로 사용될 수있는 많은 양의 코르비큘러 꽃가루를 생성합니다. 꿀벌은 많은 식물 종에서 꽃가루를 수집하지만 일반적으로 각 수집 여행 중에 한 종을 방문합니다. 따라서 각 피질의 꽃가루 펠렛은 주로 하나의 식물 종을 나타내며 각 꽃가루 펠렛은 색상으로 설명 할 수 있습니다. 이를 통해 코르비큘러 꽃가루 샘플을 색상별로 분류하여 식물 공급원을 분리 할 수 있습니다. 연구자들은 분류 학적 식별을 위해 아세토 분해 된 꽃가루 곡물의 형태를 분석함으로써 부식질 꽃가루를 더 분류 할 수 있습니다. 이러한 방법은 수분 효율, 수분자 먹이 역학, 식단 품질 및 다양성과 같은 수분제와 관련된 연구에 일반적으로 사용됩니다. 꽃가루 트랩을 사용하여 코르비큘러 꽃가루를 수집하고, 꽃가루를 색으로 분류하고, 꽃가루 알갱이를 비옥 분해하기위한 상세한 방법론이 제시됩니다. 또한 다섯 가지 작물 시스템에서 꿀벌로부터 수집 된 코르비큘라 꽃가루의 펠렛 색상과 택시의 빈도에 관한 결과가 제시됩니다.
서양 꿀벌 (Apis mellifera L.)은 꿀벌 수분에 의존하는 많은 농작물의 중요한 수분제입니다1. 10 년 이상 동안 상당한 꿀벌 식민지 손실은 2,3,4,5,6,7,8,9보고되었습니다. 기생충과 질병, 영양 부족 및 살충제를 포함한 몇 가지 요인이 이러한 식민지 감소에 연루되어 있습니다10. 영양 부족은 농업 강화와 먹이 서식지11의 손실로 인한 것일 수 있습니다. 꿀벌 영양을 개선하고 꿀벌 보존 노력을 돕기 위해 다른 풍경에서 꿀벌이 사용하는 꽃 자원을 이해하는 것이 필수적입니다. 꽃가루는 꿀벌을위한 단백질, 지질, 비타민 및 미네랄의 주요 원천이며 꿀벌의 식민지 수준의 먹이 선호도를 이해하고, 꿀벌 식민지에 대한 꽃가루 포획의 영향을 평가하고, 꿀벌에 대한 살충제 노출을 결정하기 위해 많은 농업 및 생태 연구에 사용되었습니다12,13,14.
꿀벌은 꽃가루에서 꽃가루를 모으고 꽃가루를 뒷다리에 경골 꽃가루 바구니 인 코르비큘라의 알갱이로 포장하고 저장을 위해 식민지로 돌아갑니다. Corbicular 꽃가루는 벌집 입구 나 꽃에서 그들을 잡아서 잠깐 식히고 고정시킨 다음 집게로 뒷다리에서 꽃가루 알갱이를 제거하여 마초에서 제거 할 수 있습니다. 개별적으로 포획 된 마초에서 코르비큘러 꽃가루를 손으로 수집하는 힘든 과정은 상당한 양의 꽃가루가 필요한 경우 느리고 비효율적입니다. 많은 양의 꽃가루를 수집하는 더 간단하고 효율적인 방법은 벌집 입구에서 꿀벌의 코르비큘러 꽃가루 알갱이를 포획하는 것입니다. 꽃가루 함정은 하이브15에 들어갈 때 돌아 오는 꽃가루 마초의 다리에서 코르비큘러 꽃가루를 제거하도록 설계되었습니다. 마초는 꿀벌 노동자 시체의 통과를 좁게 허용하기 위해 크기가 큰 메쉬 구멍을 통해 짜내야합니다.
꿀벌이 이들 구멍들 중 하나를 통과할 때, 더 큰 꽃가루 펠릿은 그녀의 다리로부터 긁어내어 수집 트레이(16)에 떨어진다. 연구에 따르면 꽃가루 포획은 마초가 더 많은 꽃가루를 수집하도록 자극하여 주변 작물과 식물의 수분 효율을 증가시킵니다17,18,19,20. 꽃가루 수집 방법론은 또한 꽃이 피는 식물 종의 양, 품질 및 택시를 결정하는 첫 번째 단계로 풍경에서 꿀벌이 사용하는 사료를 이해하는 데 사용할 수 있습니다. 따라서 효과적인 꽃가루 포획 방법론은 수분과 꿀벌 영양 연구를 촉진합니다. 이러한 꽃가루 수집 방법의 비교가 표 1에 예시되어 있다. 꽃가루 먹이 행동은 계란 및 애벌레 개체군 수준21,22에 비해 저장된 꽃가루에 대한 식민지의 필요성에 따라 바뀔 것입니다. 이러한 변화에는 다양한 수집 강도가 포함되기 때문에 꽃가루 양의 높은 변화는 종종 동일한 위치에있는 식민지와 동일한 자르기 시스템 또는 조경 유형23,24의 다른 위치 사이에서 예상됩니다. 꽃가루를 포획 할 식민지와 위치의 수를 늘리면 이러한 변화를 수용하는 데 도움이됩니다.
꽃가루 함정은 효율성25,26에서 다양합니다. 꿀벌에 의해 수집 된 꽃가루 알갱이의 크기는 식물 종에 따라 다르며 식민지27,28의 꽃가루 저장 수준에 따라 변경 될 수 있습니다. 이것은 더 작은 꽃가루 펠릿이 과소 대표되고 더 큰 펠릿이 꽃가루 트랩을 통해 수집 된 샘플에서 과대 대표 될 가능성을 제기합니다. 성인 꿀벌은 신체 크기가 다양하며 함정에서 수집 된 꽃가루의 표현에도 영향을 줄 수 있습니다. 또한 일부 경관에서 수집 된 꽃가루를 평가하면 발견되지 않는 과즙을 주로 생산하는 식물 종도 있습니다. 포획 효율은 또한 꽃가루 트랩 유형 및 하이브 장비의 상태에 의해 영향을받는 마초 드리프트 및 방향 감각 상실의 영향을받습니다. 이 문제는 이 백서에 지정된 기술을 사용하여 완화할 수 있습니다. 조사관은 식민지 수준의 먹이 선호도의 결과를 보완하기 위해 마초의 꽃 방문을 세는 것과 같은 추가 연구 기술을 고려할 수 있습니다. 꽃가루 다양성을 평가하는 데 유용한 방법은 코르비큘러 꽃가루를 색상별로 분류하는 것입니다. 꿀벌은 일반 마초이지만, 그들은 또한 주어진 수집 여행 중에 동일한 위치에있는 동일한 식물 종에서 꽃가루를 수집하는 꽃꽁 충실도를 나타냅니다. 이러한 먹이 재배 거동에 기초하여, 임의의 주어진 코르비큘러 꽃가루 펠릿이 주로 단일 식물 종 27,29,30,31에 의해 표현된다고 가정된다. 따라서 과학자들은 코르비큘러 꽃가루를 펠렛 색상으로 분류하고 검출 된 총 색상 수 또는 각 색상 그룹으로 표현 된 총 비율12,32,33,34를보고함으로써 꽃가루 다양성을 설명 할 수 있습니다. 이것은 각 색상 그룹의 질량 또는 펠릿 수를 측정함으로써 달성될 수 있다. 각 색상 그룹의 펠릿 수를 측정하는 것은 다른 택시에서 펠릿의 무게에 알려진 또는 의심되는 체계적인 차이가 있는 경우에 제안된다. 체계적인 차이는 펠릿 크기 또는 마초가 펠렛을 형성 할 때 꽃가루에 첨가하는 과즙의 양에 의해 발생할 수 있습니다.
색상 분류는 시간 효율적이고 간단한 공정이지만 다른 식물 탁사가 유사한 꽃가루 펠릿 색상35,36을 가질 수 있기 때문에 일부 수분 연구 연구에는 허용 가능한 정확도가 없을 수 있습니다. 추가적으로, 꽃가루 펠릿이 분리될 수 있는 별개의 색군의 수에 대한 물류 한계가 있다. 따라서, 각각의 개별 식물 탁손 꽃가루를 그 자신의 별개의 펠릿 색 그룹으로 분리하는 것은 수분 연구에서 항상 가능하지 않을 수 있다. 광 현미경을 통한 꽃가루 입자의 형태 학적 특성화는 종종 동일한 색상 그룹의 펠렛에서 둘 이상의 탁사의 꽃가루를 구별함으로써 펠렛의 색상 분리를 보완합니다. 주어진 꽃가루 펠릿 색상 그룹에서 여러 탁사의 꽃가루 알갱이를 발견하는 것이 일반적이지만, 꿀벌에 의해 수집 된 개별 꽃가루 알갱이는 일반적으로 하나의 우세한 분류를 포함하며 아마도 소량으로 다른 택시와 함께 구성됩니다. 따라서, 꿀벌의 부식성 꽃가루 알갱이에서 분류학적 충실도를 가정하는 것이 일반적이다. 꿀벌과 같이 꽃 충실도 행동을 나타내지 않는 다른 수분제의 꽃가루 알갱이는 종종 많은 식물 종을 포함하고 우세한 분류를 소유하지 않을 수 있습니다. 폴리플로랄 꽃가루 펠릿에서 탁사 비율의 정량적 추정이 필요한 경우, 적절한 분석을 위해 비소 분해를 포함하는 현미경 방법이 추가로 필요합니다.
아세톨 분해 꽃가루 곡물의 형태 학적 특성을 평가하는 것은 분류 학적 식별을위한 가장 일반적인 방법16입니다. 비구 분해 절차는 꽃가루 알갱이의 원형질을 제거하여 광 현미경37,38에서 관찰 할 수있는 진단 특성을 노출시킵니다. 이 방법을 사용하여 연구자들은 다른 택시, 특정 자르기 시스템에서 발견되는 택시의 빈도 및 펠렛 색상33,36의 우세한 택시를보고 할 수 있습니다. 비구 분해는 꽃가루 형태학28을 드러내는 가장 좋은 분석 기술입니다. 그러나 많은 장미과 유형과 같은 일부 아세토 분해 꽃가루 곡물은 acetolysis 및 가벼운 현미경만으로는 속 또는 종 수준으로 식별 할 수 없습니다. 연구자들은 주사 전자 현미경 또는 메타 바코딩을 속 또는 종 수준의 식별을 달성하기위한 대체 방법으로 간주합니다. 그러나 이러한 대안적인 방법은 질적 분류 식별만을 제공하고 폴리플로랄 꽃가루 펠릿36,39에서 다른 꽃가루 곡물 탁사의 비율을 추정하지 못한다. 또한 이러한 방법에 대한 비용 및 필요한 전문 지식이 상당히 높습니다. 이들 식별 방법의 비교가 표 1에 예시되어 있다.
| 방법 | 시간 | 비용 | 해상도 | 전문성 |
| 꽃가루 컬렉션 | ||||
| 꽃가루 포획 | 낮다 | 온화한 | 변수 | 온화한 |
| 꽃가루 마초 수집 | 높다 | 온화한 | 높다 | 낮다 |
| 꽃가루 식별 | ||||
| 시각적 개체(색상 정렬만 해당) | 온화한 | 낮다 | 낮다 | 낮다 |
| 비구분해 | 온화한 | 온화한 | 온화한 | 온화한 |
| 주사 전자 현미경 검사 | 높다 | 높다 | 높다 | 높다 |
| 메타바코딩 | 변수 | 높다 | 높다 | 높다 |
표 1 : 시간, 비용, 해결 방법 및 전문 지식을 기반으로 꽃가루 수집 및 식별의 다양한 방법의 비교. 시각적 방법(색상 정렬에만 해당)은 감지된 총 색상 수 또는 각 색상 그룹으로 표시되는 총 색상 비율을 꽃가루 소스를 결정하기 위한 메트릭으로 보고하지만 taxon 식별은 제공하지 않습니다.
꽃가루 포획 및 분류 및 꽃가루 곡물 비옥 분해에 대한 정보는 다양하며 종종 여러 출처에 걸쳐 퍼져 있으며 다른 분야의 연구자마다 다릅니다. 이 논문은 연구자와 양봉가 모두 대량의 코르비큘러 꽃가루를 효과적으로 수집하는 데 사용할 수있는 다양한 유형의 꽃가루 트랩에 대한 자세한 통찰력을 제공합니다. 또한 식물 탁사 식별을 위해 비소 분해, 염색 및 슬라이드 장착에 의해 꽃가루 샘플을 준비하기위한 프로토콜이 제공됩니다. 여기에 자세히 설명 된 방법론은 포괄적이며 꿀벌이 주어진 풍경, 특히 자르기 시스템에서 먹이를 먹는 우세한 식물 종을 식별하기위한 고유 한 자원으로 사용됩니다. 이전 연구로부터의 이러한 방법에 기초한 발견이 제시되었고, 다섯 가지 작물 시스템(14)에서 꿀벌에 의해 수집된 코르비큘라 꽃가루로부터의 꽃가루 펠릿 색상과 식물 탁사의 다양성을 문서화하였다.
1. 꽃가루 덫을 사용하여 꿀벌 식민지에서 코르비큘러 꽃가루 수집
- 원하는 양봉장 위치에서 꽃가루를 언제 가둘 지 결정하십시오.
참고: 이상적인 기후 조건에는 완전한 태양 노출, 낮은 풍속, 낮은 습도 및 꽃가루 수집을 위해 원하는 기간 동안 예측 된 강수량이 포함되지 않습니다. - 양봉장 위치 내에서 꽃가루를 포획하기위한 최적의 꿀벌 식민지를 선택하십시오.
- 2 분 동안 식민지 입구로 돌아 오는 마초를 세어 식민지 강도를 평가하십시오. 돌아 오는 마초의 총 수가 가장 많은 식민지를 선택하십시오.
- 양호한 상태의 목공으로 두드러기를 선택하고, 추가 출입구와 뒤틀린 뚜껑이없는 것이 좋습니다. 대체 출입구가 적은 식민지를 사용하면 함정 입구로 방향을 바꾸는 마초를 되돌릴 가능성이 높아집니다.
- 가능하면 남쪽을 향한 하이브 입구를 선택하십시오. 두드러기가 팔레트화 된 경우 주어진 팔레트에서 동일한 방향을 향하는 모든 식민지에 꽃가루 트랩을 설치하여 마초가 이웃 하이브 입구로 표류하지 않도록하십시오.
- 원하는 경우 유충의 존재에 대한 프레임을 검사하여 식민지의 새끼 둥지를 평가하십시오. 상대적으로 많은 양의 애벌레가있는 식민지를 선택하십시오.
- 선택한 꿀벌 식민지에 꽃가루 함정을 설치하십시오.
참고: 설치는 꽃가루 트랩의 유형에 따라 다릅니다. 유형에는 a) 전면 마운트, b) 하단 마운트, c) 탑 마운트 또는 d) 오거 홀 입구 마운트가 포함됩니다. 자세한 내용은 토론 섹션을 참조하십시오.- 전면 마운트 트랩의 경우 입구 앞에 스테이플, 나사 및 테이프로 트랩을 부착하거나 트랩을 하이브를 감싸는 번지 코드에 연결하십시오. 하단 마운트 트랩의 경우 트랩을 가장 낮은 하이브 박스 아래에 놓고 트랩 입구를 원래 입구 근처에 고정하십시오. 오거 홀 마운트 트랩의 경우 스테이플, 나사 및 테이프를 사용하여 하이브 박스의 오거 구멍 바로 앞에 트랩을 부착하십시오. 상단 마운트 트랩의 경우 트랩을 맨 위 하이브 박스 위와 뚜껑 아래에 놓습니다.
- 라텍스 또는 폴리 우레탄 폼과 같은 비 접착 및 성형 가능한 재료 또는 오거 구멍 용 # 8 하드웨어 천 (2.7mm 조리개)을 사용하여 식민지로 가능한 모든 입구를 밀봉하십시오. 작은 균열에 접착 테이프를 사용하십시오.
- 전면 마운트 트랩을 사용하는 경우 이슬로 인한 수분 손상을 방지하기 위해 수집 바구니와 잔디 사이에 고무 매트와 같은 장벽을 배치하십시오.
- 설치 후 24 시간 및 하루의 먹이 비행이 시작되기 전에 꽃가루 트랩의 트랩핑 메커니즘에 참여하십시오 (늦은 저녁 / 이른 아침).
참고: 이 단계는 이상적이지만 반드시 필요한 것은 아닙니다. 주어진 기간 동안 같은 식민지에 꽃가루를 잡는 경우 격주로 꽃가루 함정에 참여하십시오. - 수집 트레이에서 코르비큘러 꽃가루를 모아 비닐 봉지 또는 원심 분리기 튜브에 넣고 얼음이있는 냉각기에 보관하십시오.
- 꽃가루 종의 다양성과 풍부함을 평가하기 위해, 예를 들어, 풍경 수준의 영양 연구, 두세 개의 72 h 간격(40)에서 꽃가루를 수집하십시오.
- 살충제 잔류 물 분석을 위해, 24 시간 내지 96 시간 간격으로 꽃가루를 수집하고,처리 41을 위해 최소 3g을 섭취한다.
- 꿀벌 부분과 다른 벌집 파편을 제거하여 꽃가루를 청소하십시오.
참고: 꽃가루 샘플을 취급할 때는 일회용 장갑을 사용하고 샘플 사이에 일회용 장갑을 교체하십시오. 별도의 도구를 사용하여 각 트랩에 수집 된 꽃가루에서 파편을 제거하십시오. 갇힌 꽃가루의 다른 배치를위한 도구를 사용하기 전에 헹구고 말리십시오. - 꽃가루가 꽃가루 공급원 식별, 수량 평가 또는 살충제 잔류 물 분석41,42를 위해 의도 된 경우 꽃가루의 구성 무결성을 유지하기 위해 -20 °C 이하에 꽃가루를 보관하십시오.
- 두드러기에서 함정을 제거한 후 5 % 표백제로 모든 장비를 살균하고 다음 사용 전에 장비를 헹구고 건조하십시오.
2. 다운스트림 꽃가루 공급원 식별 및 수량 평가를 위한 꽃가루 펠릿 색상 분류
- 작업 할 꽃가루 샘플이 20g 이상인지 확인하십시오. 꽃가루 샘플을 가방 또는 다른 적절한 크기의 용기에 완전히 혼합하여 그 안에 들어있는 모든 펠렛의 균질한 혼합물을 얻는다. 다음 단계에서 의도하지 않은 편향을 방지하려면 샘플 백에서 하위 샘플을 제거하기 전에 샘플의 색상 구성을 보기에서 흐리게 합니다.
- 스쿠퍼 또는 큰 숟가락을 사용하여 꽃가루 10g을 전체의 대표적인 하위 샘플로 추출하십시오. 디스플레이가 10g을 읽을 때까지 스쿠퍼에서 펠렛을 저울에 천천히 붓습니다. 첫 번째 스쿱이 충분히 크지 않은 경우 동일한 방식으로 샘플에서 다른 스쿱을 검색하십시오.
참고: 이러한 지정된 중량 요구 사항(20g 및 10g)은 예시로만 사용됩니다. 연구원은 특정 요구에 맞게 각 단계에서 사용되는 꽃가루의 양을 조정해야합니다. - 10g 서브샘플에서 모든 벌 부분과 다른 파편을 제거하십시오. 그런 다음 필요한 경우 원래 샘플에서 꽃가루를 조금 더 첨가하여 하위 샘플의 총 중량 10g을 달성하십시오.
- 각 꽃가루 펠렛을 10g 서브샘플로부터 컬러 그룹으로 분류한다. 꽃가루 색상과 질감을 모두 사용하여 색상 그룹을 구분합니다.
참고: 그룹 내에서 일부 변형이 예상되지만 정렬 중에 Pantone 색상 가이드를 사용하면 일관성이 높아질 수 있습니다. - 하류 단계를 위해 각 색상 그룹의 최소 0.25g을 확보하려면 적어도 0.25g의 색상 그룹을 형성하기에 충분하지 않은 펠렛을 기타 그룹에 넣으십시오. Pantone 색상 가이드를 사용하여 각 개별 색상 그룹의 이름을 지정합니다. 기타 그룹 misc에 레이블을 지정합니다.
- 각 색상 그룹을 별도의 계량 용지에 계량하거나 각 색상 그룹의 펠렛 수를 계산합니다. 색상 그룹 이름과 가중치 또는 카운트를 데이터시트에 기록합니다.
참고: 각 색상 그룹의 펠릿 수를 계량할지 또는 계산할지 여부를 선택하는 것은 연구자의 관심 지표 및 프로젝트 목표에 따라 다릅니다. - 용제 내성 펜 및 접착성 종이 튜브 라벨을 사용하여 각 색상 그룹에 대한 마이크로 원심분리 튜브 라벨을 만듭니다. 레이블에 현재 날짜, 샘플 식별자, 샘플 컬렉션 날짜 및 색상 그룹 번호를 포함합니다. 라벨을 깨끗하고 건조한 2mL 마이크로 원심분리 튜브에 바릅니다.
- 각 색상 그룹으로부터 0.25 g (± 0.05 g)의 꽃가루 펠렛을 칭량하고, 이 양을 적절하게 표지된 마이크로원심분리 튜브에 넣는다.
참고: 주어진 색상 그룹의 꽃가루에 색상이나 질감이 약간 차이가 있는 경우 각 튜브 내에 펠릿의 대표적인 샘플이 있는지 확인하십시오. 시약 부피 및 인큐베이션 및 원심분리 시간은 0.25 g의 꽃가루에 적합하다. 따라서 이 양의 꽃가루를 마이크로 원심분리 튜브에 사용하여 비원 분해에 사용하십시오. 이 프로토콜은 광 현미경에 의한 하류 식물 공급원 식별을 위해 충분하고 염색 된 꽃가루를 제공해야합니다. acetolysis에서 다른 양의 꽃가루를 사용하는 경우, 시약 부피 및 처리 시간의 특성은 그에 따라 조정되어야합니다. - 각 색상 그룹의 나머지 꽃가루를 색상 그룹 이름으로 표시된 개별 비닐 봉지 (색상 당 하나의 봉지)에 넣으십시오. 이들 백을 적절한 원래 샘플의 다른 부분과 함께 -20°C 저장소에 보관하십시오.
- 튜브의 꽃가루를 깨끗한 나무 이쑤시개와 10 ~ 15 초 동안 철저히 섞으십시오.
3. 비구분해를 위한 준비
- 처음으로 비구 분해의 일부를 시작하기 전에 지정된 기관의 환경 보건 및 안전 (EHS) 부서에 연락하여 비구 분해 관련 시약 및 폐기물을 처리하는 방법에 대한 지침을 얻으십시오.
- 다음 시약의 스톡 용액을 구하고 화학 저장을위한 EHS 지침에 따라 흄 후드에 넣으십시오 : 95 % 에탄올; 증류수; 빙초산, 무수; 농축 황산; 글리세린; 그리고 명확한 매니큐어.
- 다음 시약의 스톡 용액을 준비하고 화학 저장을위한 EHS 지침에 따라 흄 후드에 넣으십시오 : 포화 중탄산 나트륨 (증류수에서 8 % w / v 용액); 및 사프라닌 O (50 % 에탄올 중 1 % w / v 용액).
4. 비소 분해
- 빙초산 세척의 사전 비분해 절차를 수행하십시오. 실험실 코트, 눈 보호 및 니트릴 장갑으로 흄 후드 내에서 다음 단계를 수행하십시오.
- 열 블록을 80°C로 돌립니다.
참고 : 포화 중탄산 나트륨의 스퀴즈 병에 쉽게 접근 할 수 있는지 확인하십시오. 이것은 흄 후드에서 산성 유출이 발생할 경우 중화시키는 데 사용할 수 있습니다. - 유리 비커 한 개를 산성 폐기물, 다른 하나는 에탄올 폐기물, 다른 하나는 비토 분해 혼합물에 라벨을 붙입니다.
- 이전에 준비된 스톡 솔루션을 사용하여 라벨이 붙은 적절한 크기의 유리 비커에 다음 시약의 작업 분취량을 만듭니다 : ~ 23.0 mL의 빙초산; ~33.0 mL의 증류수; ∼23.0 mL의 95% 에탄올; ~ 25.0 mL의 중탄산 나트륨 (산으로 오염 된 고체 폐기물의 경우).
참고: 이들은 총 10개의 컬러 그룹 샘플(10개의 마이크로원심분리 튜브)에서 다음의 비구분해 절차를 완료하는 데 필요한 부피입니다. - 0.25g의 색그룹 꽃가루가 들어있는 각 마이크로 원심분리 튜브에 빙초산 500μL를 천천히 첨가한다. 튜브를 육안으로 검사하는 동안 꽃가루를 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 사용 후 사용된 이쑤시개를 중탄산나트륨 폐기물 비이커에 넣고; 각 튜브에 대해이 과정을 반복하십시오.
참고 : 각 튜브에 대해 깨끗하고 새로운 이쑤시개를 사용하십시오. 각 튜브의 뚜껑이 단단히 닫혀 있는지 확인하십시오. - 샘플을 1,100 × g에서 3분 동안 원심분리한다. 튜브에서 상층액을 산성 폐기물 비이커로 데칸트하십시오. 그런 다음 깨끗한 종이 타월로 튜브의 열린 입을 부드럽고 간략하게 만져서 튜브 테두리 주변의 잔류 빙초산을 제거합니다.
참고 : 상청액을 디캔팅 할 때 꽃가루 펠렛을 잃지 않도록주의하십시오.
- 열 블록을 80°C로 돌립니다.
- 비소 분해 절차를 수행하십시오.
참고: 실험실 코트, 눈 보호 및 부틸 비닐 장갑을 사용하여 흄 후드 내에서 다음 단계를 수행하십시오.- 비이커 라벨이 붙은 비커에 빙초산 (9:1 빙초산:황산) 10.8 mL를 첨가하여 비오스분해 혼합물 (9:1 빙초산:황산)을 준비한다. 이어서, 1250 μL 여과된 피펫 팁이 장착된 1000 μL 피펫을 사용하여, 빙초산을 함유하는 비이커에 원액으로부터 진한 황산 1200 μL(1.2 mL)를 천천히 첨가한다. 사용 된 피펫 팁을 중탄산 나트륨의 비이커에 버리십시오.
참고 : 비구 분해 혼합물 비커는 만지면 따뜻해질 수 있으며 혼합물이 노란색으로 바뀔 수 있습니다. 혼합물이 어두운 색으로 변하는 두 가지 가능성이 있습니다 : (a) 시약이 만료 날짜를 지났거나 (b) 너무 많은 황산이 첨가되었을 수 있습니다. 어쨌든, 혼합물이 어두워지면 산성 폐기물 비이커에 버리고, 신선한 acetolysis 혼합물을 준비하십시오. - 비석 용해 혼합물을 유리 막대 또는 나무 교반 스틱으로 부드럽게 저어 균질화되도록하십시오. 사용 된 막대 / 스틱을 중탄산 나트륨의 비이커에 넣으십시오.
- 1250 μL 여과된 피펫 팁이 있는 1000 μL 피펫을 사용하여, 비이커로부터 1000 μL의 acetolysis 혼합물을 각 튜브에 천천히 첨가한다. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 사용 후 사용 된 이쑤시개를 중탄산 나트륨 폐기물 비이커에 넣으십시오.
참고: 각 샘플에 대해 깨끗하고 새로운 이쑤시개를 사용하십시오. - 샘플을 예열된(80°C) 열 블록 위에 놓는다. 튜브를 5분 동안 인큐베이션하고, 인큐베이션을 통해 중간에 깨끗한 이쑤시개로 각 튜브를 완전히 저어준다. 사용 후 사용 된 각 이쑤시개를 중탄산 나트륨의 비이커에 넣으십시오.
참고 : 샘플에 이쑤시개를 두지 마십시오. 산이 그들을 녹일 것입니다.
- 비이커 라벨이 붙은 비커에 빙초산 (9:1 빙초산:황산) 10.8 mL를 첨가하여 비오스분해 혼합물 (9:1 빙초산:황산)을 준비한다. 이어서, 1250 μL 여과된 피펫 팁이 장착된 1000 μL 피펫을 사용하여, 빙초산을 함유하는 비이커에 원액으로부터 진한 황산 1200 μL(1.2 mL)를 천천히 첨가한다. 사용 된 피펫 팁을 중탄산 나트륨의 비이커에 버리십시오.
- 비소 분해 후 빙초산 세척 절차를 수행하십시오.
참고: 실험실 코트, 눈 보호 및 부틸 비닐 장갑을 사용하여 흄 후드에서 다음 단계를 수행하십시오.- 각 튜브에 빙초산 500μL를 천천히 첨가한다. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 사용 후 사용 된 이쑤시개를 중탄산 나트륨의 비이커에 넣으십시오.
참고: 각 샘플에 대해 깨끗하고 새로운 이쑤시개를 사용하십시오. 각 튜브의 뚜껑이 단단히 닫혀 있는지 확인하십시오. - 샘플을 1,100 × g에서 3분 동안 원심분리한다. 각 튜브에서 상층액을 산성 폐기물 비이커로 데칸트하십시오. 그런 다음 깨끗한 종이 타월로 튜브의 열린 입을 부드럽고 간략하게 만져서 튜브 테두리 주변의 잔류 산을 제거합니다.
- 부틸 비닐 장갑을 흐르는 물에서 30 초 이상 철저히 헹구고 제거한 다음 말리십시오.
참고: 부틸 비닐 장갑의 재사용에 대한 제조업체의 지침을 따르십시오.
- 각 튜브에 빙초산 500μL를 천천히 첨가한다. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 사용 후 사용 된 이쑤시개를 중탄산 나트륨의 비이커에 넣으십시오.
- 각 샘플에 대해 세 번의 물 헹굼을 수행하십시오. 실험실 코트, 눈 보호 및 니트릴 장갑으로 흄 후드 내에서 다음 단계를 수행하십시오.
- 증류수 비이커에서 증류수 1000 μL를 각 튜브에 첨가한다. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 사용 후 이쑤시개를 중탄산 나트륨 폐기물 비이커에 넣으십시오.
참고: 각 샘플에 대해 깨끗하고 새로운 이쑤시개를 사용하십시오. 각 튜브의 뚜껑이 단단히 닫혀 있는지 확인하십시오. - 샘플을 1,100 × g에서 3분 동안 원심분리한다. 튜브에서 상청액을 중탄산 나트륨의 비이커로 데칸트하십시오. 그런 다음 깨끗한 종이 타월로 튜브의 열린 입을 부드럽게 만져서 튜브 테두리 주변의 잔류 물을 제거하십시오.
- 4.4.1-4.4.2 단계를 두 번 더 반복하여 총 세 번의 물 헹굼을 반복합니다.
- 증류수 비이커에서 증류수 1000 μL를 각 튜브에 첨가한다. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 사용 후 이쑤시개를 중탄산 나트륨 폐기물 비이커에 넣으십시오.
- 각 샘플에 대해 에탄올 헹굼을 수행하십시오.
참고: 실험실 코트, 눈 보호 및 니트릴 장갑을 사용하여 흄 후드 내에서 다음 단계를 수행하십시오.- 1250 μL 여과된 피펫 팁이 있는 1000 μL 피펫을 사용하여, 에탄올 비이커로부터 95% 에탄올 1000 μL를 각 튜브에 첨가한다. 피펫 팁을 위험하지 않은 폐기물로 버리십시오. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오.
참고: 사용 후 이쑤시개를 중탄산나트륨 폐기물 비이커에 넣으십시오. 각 샘플에 대해 깨끗하고 새로운 이쑤시개를 사용하십시오. 각 튜브의 뚜껑이 단단히 닫혀 있는지 확인하십시오. - 샘플을 1,100 × g에서 3분 동안 원심분리한다. 튜브에서 상층액을 에탄올 폐기물 비이커로 데칸트하고, 깨끗한 종이 타월로 튜브의 열린 입을 부드럽게 만져서 튜브에서 잔류 에탄올을 제거합니다.
- 1250 μL 여과된 피펫 팁이 있는 1000 μL 피펫을 사용하여, 에탄올 비이커로부터 95% 에탄올 1000 μL를 각 튜브에 첨가한다. 피펫 팁을 위험하지 않은 폐기물로 버리십시오. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오.
- 실험실 코트, 눈 보호 및 니트릴 장갑을 착용하여 샘플을 얼룩지게하십시오. 부드러운 반전을 사용하여 Safranin O 얼룩 원액을 혼합하십시오.
- 일회용 플라스틱 이송 피펫을 사용하여 각 튜브에 Safranin O 얼룩 5-10 방울을 넣으십시오. 튜브를 육안으로 검사하는 동안 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 이쑤시개를 튜브에 두십시오.
- 1250 μL 여과된 피펫 팁이 있는 1000 μL 피펫을 사용하여, 에탄올 비이커로부터 95% 에탄올 1000 μL를 각 튜브에 첨가한다. 피펫 팁을 위험하지 않은 폐기물로 버리십시오. 튜브를 육안으로 검사하는 동안 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오. 사용 후 사용 된 이쑤시개를 위험하지 않은 폐기물에 넣으십시오.
- 각 튜브의 뚜껑이 단단히 닫혀 있는지 확인하십시오. 1,100 × g에서 3분 동안 원심분리한다. 상층액을 에탄올 폐기물 비이커에 넣는다.
참고 : 이번에는 종이 타월로 튜브의 입을 만지지 마십시오. - 플라스틱 일회용 이송 피펫을 사용하여 각 튜브에 글리세린 10-15 방울을 넣으십시오. 튜브를 시각적으로 검사하는 동안 튜브의 내용물을 깨끗한 이쑤시개로 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오.
참고: 사용한 이쑤시개를 사용 후 위험하지 않은 폐기물에 넣으십시오. 각 샘플에 대해 깨끗하고 새로운 이쑤시개를 사용하십시오. 모든 튜브 라벨이 읽을 수 있는지 확인하십시오.
- 튜브를 흄 후드에 열어 두어 주변 실온에서 적어도 2 시간 동안 에탄올을 증발시킵니다. 샘플에 에탄올 냄새가 있는지 확인하십시오 : 감지 할 수있는 경우 샘플이 준비되지 않았으며 에탄올 냄새가 사라질 때까지 건조시켜야합니다.
- 모든 재료를 청소하고 폐기물을 처리하십시오. 원심 분리기와 열 블록을 모두 끕니다. 모든 고체 및 액체 폐기물은 지정된 기관의 환경 보건 및 안전 지침에 따라 폐기하십시오.
- 꽃가루 식별을위한 현미경 슬라이드를 준비하십시오. 그들에게 읽기 쉬운 라벨을 붙입니다. 깨끗한 유리 현미경 슬라이드에 장착할 각 색상 그룹/샘플에 대해 적절하게 라벨을 붙입니다. 튜브를 시각적으로 검사하는 동안 깨끗한 이쑤시개로 샘플을 10-15 초 동안 저어주고 튜브의 내용물이 완전히 혼합되어 있는지 확인하십시오.
참고: 슬라이드 준비는 실험실 벤치에서 수행할 수 있습니다. 이쑤시개를 위험하지 않은 폐기물에 버리십시오. 각 샘플에 대해 깨끗하고 새로운 이쑤시개를 사용하십시오.- 깨끗한 일회용 플라스틱 이송 피펫을 사용하여 튜브에서 꽃가루 잔여물 1 방울을 제거하고 라벨이 붙은 현미경 슬라이드의 중앙에 놓습니다. 방울이 약간 퍼지도록 허용하십시오. 슬라이드의 드롭 위에 깨끗한 커버 슬립을 놓습니다.
- 슬라이드가 건조된 후 커버슬립을 투명한 매니큐어로 슬라이드에 밀봉합니다. 커버 슬립의 각 모서리에 작은 광택 방울을 놓고 슬라이드와 만나는 커버 슬립의 둘레 주위에 광택 테두리를 칠하십시오. 매니큐어가 완전히 건조되도록 하고 커버슬립 둘레에 두 번째 광택 코트를 칠합니다.
이전 연구는 아몬드, 체리, 하이 부시 블루 베리, 하이브리드 당근 및 초원 폼14와 같은 농작물에서 꿀벌이 수집 한 꽃가루의 다양성에 대한 평가를보고했습니다. 기술된 방법을 사용하여, 코르비큘러 꽃가루를 수집하고, 색별로 분류하고, 꽃가루 다양성을 평가하기 위해 확인된 각 펠릿 색상 그룹의 식물 공급원을 확인하였다. 하단 마운트 꽃가루 트랩은 각 작물에 대해 여러 사이트의 콜로니에 설치되었습니다 (그림 1A). 각 부위에서 채취한 꽃가루의 양은 색 분류 및 비소 분해 분석 방법의 샘플 중량 요구 사항을 충족하기에 충분했습니다. 모든 꽃가루 수집 샘플에는 여러 개의 구별 가능한 색상 그룹이 있습니다(그림 2 및 그림 3). 일부 샘플에서, 꽃가루 색 그룹은 4-5 펠릿만큼 적게; 그러나 대부분의 그룹은 그보다 훨씬 더 많은 것을 가지고 있었기 때문에 비구 분해를위한 자체 라벨링 된 색상 그룹으로 사용되었습니다 (그림 4 및 그림 5). 비어세분해 후(도 6), 밝은 전계 광 현미경을 사용하여 각 연구 부위 주변 지역에서 수집한 바우처 표본의 형태학적 특성을 확인함으로써 가능한 가장 낮은 분류학 순위로 각 색상 그룹을 효과적으로 식별하였다(도 7).

그림 1: 꿀벌 식민지에 설치된 꽃가루 트랩은 코르비큘러 꽃가루를 수집합니다 . (A) 하이브 바닥 보드 위와 가장 낮은 하이브 박스 바로 위에 놓인 하단 마운트 트랩. 다른 꽃가루 트랩 스타일에는 (B) 전면 마운트 및 (C) 오거 홀 입구 마운트 트랩이 포함됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 꽃가루 트랩의 트랩핑 메커니즘 및 수집 트레이. 돌아 오는 꽃가루 마초는 하이브에 도달하기 전에 메쉬 트래핑 메커니즘을 통해 짜내야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 꽃가루 트랩의 수집 트레이. Corbicular 꽃가루는 꽃가루 함정에 의해 돌아 오는 꽃가루 마초의 다리에서 긁히고 수집 쟁반에 떨어집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 코르비큘러 꽃가루 샘플을 색상 그룹으로 정렬합니다. Corbicular 꽃가루는 수집 된 다른 색상 펠릿의 비율을보고하기 위해 색상 그룹으로 분류 된 후 건조되고 칭량 될 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: Pantone 색상 가이드를 사용하여 색상별로 정렬된 꽃가루 펠릿의 네 그룹. 색상 그룹은 (A) 회색, Pantone 5855C, (B) 갈색, Pantone 7557C, (C) 노란색, Pantone 458C 및 (D) 밝은 갈색, Pantone 3547C로 표시되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
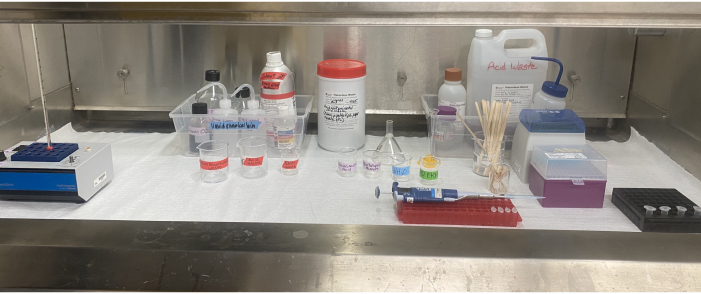
그림 6: 흄 후드 내부의 비구분해 장비 설정. 열 블록, 시약, 용매 폐기물 및 산성 폐기물 용기, 라벨이 붙은 비커, 피펫, 피펫 팁, 교반 스틱 및 흄 후드 내부에 위치한 마이크로 원심분리 튜브. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
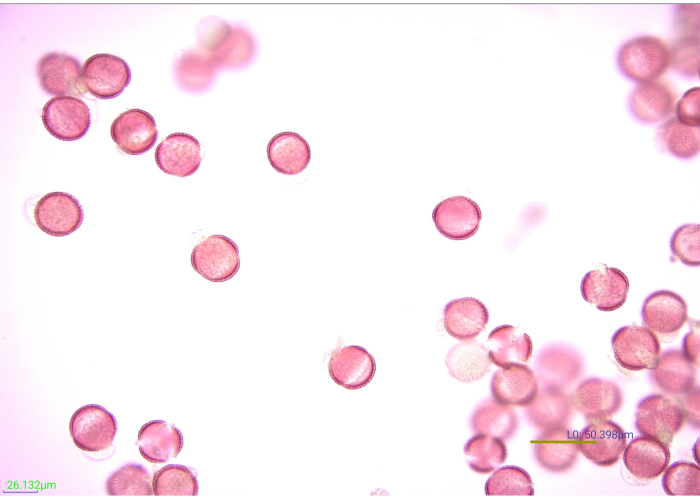
그림 7 : 염색 된, 아세톨 분해 된 꽃가루 곡물의 현미경 사진. 40x 배율로 아세토 분해 겨자 (Brassicaceae) 꽃가루 곡물의 많은면. 배율 막대 = 50.398 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
아몬드 작물 위치에서 수집 된 꽃가루는 다른 작물에서 수집 한 꽃가루보다 꽃가루 다양성이 상대적으로 낮았으며 평균 3.0 ± 0.5 펠렛 색상과 3.2 ± 사이트 당 1.2 식물 택시 (표 2)14. 나머지 4 가지 작물 시스템은 높은 꽃가루 다양성 수준을 보였으며 체리에서 사이트 당 평균 6.0 ± 2.0 펠릿 색상과 8.0 ± 1.5 식물 탁사, 8.8 ± 1.4 펠릿 색상, 13.5 ± 하이 부시 블루 베리의 사이트 당 식물 택시, 7.0 ± 1.0 펠렛 색상 및 하이브리드 당근의 사이트 당 11.0 ± 0.0 식물 택시, 초원폼14의 사이트 당 13.0 ± 0.0 펠렛 색상 및 13.0 ± 1.5 식물 택시.
| 멀떠구니 | 꽃가루 펠릿 색상/사이트의 평균 수(SE) | 식물 택시 / 사이트의 평균 수 (SE) | 식별된 총 택시 | ||
| 가족 | 속 | 종 | |||
| 편도 | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| 블루베리 | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| 당근 | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| 버찌 | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| 메도우폼 | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
표 2 : 다섯 가지 작물 시스템에서 꿀벌로부터 수집 된 코르비큘러 꽃가루의 다양성. 다양성 메트릭에는 평균 펠릿 색상 수(± SE), 평균 식물 탁사 수(± SE) 및 식별된 총 택시가 포함됩니다. 이 테이블은14에서 수정되었습니다. 약어: SE = 표준 오류입니다.
다른 꽃가루 함정 스타일은 자신의 장점과 결과를 가지고 있습니다. 일반적으로 사용되는 4가지 트랩 스타일, (1) 전면 장착, (2) 하단 마운트, (3) 오거 홀 및 (4) 탑 마운트 꽃가루 트랩의 이점과 한계는 아래에서 설명합니다. 전면 장착 트랩은 가장 다양한 스타일입니다(그림 1B). 설치가 빠르고 쉽습니다. 하이브 박스를 들어 올리지 않고도 수행 할 수 있으며,이 함정은 모든 Langstroth 스타일의 하이브 장비에 적합 할 수 있습니다. 수집 트레이가 식민지 앞에 앉으면 식민지에서 최소한의 파편을 수집합니다. 그러나, 수집 트레이는 또한 외부 요소에 더 많이 노출된다 - 현장 관개, 비오는 날씨 또는 습한 날씨, 또는 이슬이 수집 트레이를 통해 꽃가루와 접촉할 수 있고, 펠릿이 분리하기에 너무 포화될 경우 꽃가루를 사용할 수 없게 될 수 있다. 꽃가루 포화의 위험은 비 또는 높은 습도의 예측 된 사건 동안 포획을 피함으로써 줄일 수 있습니다. 고무 매트를 트랩 아래에 배치하고 꽃가루 트랩 위에 여분의 덮개 재료 (예 : 루핑 펠트)를 배치하면 수집 트레이를 날씨로부터 보호 할 수 있습니다.
하단 마운트 트랩은 이 백서의 데이터에 대한 꽃가루를 수집하는 데 사용되었습니다(그림 1A). 그들은 식민지의 무리 둥지 아래에 배치해야하기 때문에 설치하기가 편리하지 않습니다. 설치는 시간이 많이 걸리고 꿀벌 부분과 작은 왁스 조각과 같은 식민지에서 함정으로 떨어지는 많은 양의 파편을 초래합니다. 대부분의 제조 된 바닥 마운트 트랩을위한 수집 트레이의 바닥은 미세한 메쉬로 만들어져 수집 된 꽃가루를 습기로부터 보호하기 위해 적절한 환기가 가능합니다. 오거 홀 꽃가루 트랩은 하이브의 하단 보드가 만든 입구 대신 오거 구멍을 하이브 입구로 주로 사용하는 경우 마초의 방향 감각을 최소화하는 데 도움이 됩니다(그림 1C). 오거 홀 꽃가루 트랩의 수집 트레이는 매우 작기 때문에 수집 트레이가 넘치지 않도록 자주 비워야합니다. 하이브에 상부 배치를 감안할 때, 상단 마운트 꽃가루 트랩은 설치 및 제거가 가장 쉬운 트랩 스타일이며 수집 된 꽃가루 샘플에는 하이브 파편이 없습니다. 그러나 이 트랩 스타일은 뚜껑, 내부 덮개 및 위쪽 하이브 박스가 함께 제대로 밀봉되지 않은 경우 수집 트레이가 습기에 노출되기 때문에 손상된 하이브 장비에 매우 민감합니다.
여기에 설명 된 프로토콜은 성인 및 애벌레 개체군이 많은 식민지를 선택할 것을 요구합니다 (1.2 단계). 이 선택 방법은 이러한 식민지에서 매우 많은 양의 갇힌 꽃가루를 생산하기위한 것입니다. 상당한 먹이 개체군을 가진 식민지는 함정 설치시 입구에서 심한 혼잡을 경험할 수 있습니다. 큰 하이브 입구를 선택하면 혼잡이 완화됩니다. 대규모 사료 개체군은 수집 트레이의 경계를 초과 할 수있는 매우 많은 양의 꽃가루를 수집 할 수도 있습니다. 대부분의 하단 또는 상단 마운트 트랩 스타일에서 볼 수 있듯이 방대한 수집 트레이와 많은 양의 갇힌 꽃가루를 수용하기 위해 빈 트레이를 자주 사용하십시오. 원하는 연구 목표가 양봉장에서 식민지에 의해 수집 된 꽃가루 양을 평가하는 것이라면, 선택을 위해 성인과 애벌레 개체군을 최적화하는 대신 대표적인 식민지를 선택하십시오. 모든 스타일의 꽃가루 함정은 하이브 입구를 막고 원래 입구16과 공간적으로 다른 새로운 입구를 만듭니다. 꽃가루 함정은 일반적으로 마초가 설치시 꽃가루 함정의 새로운 입구로 방향을 바꿀 수 없을 때 꽃가루를 수집하지 못합니다. 이 마초는 이웃 두드러기로 쉽게 표류하며, 꽃가루 함정이있는 다른 하이브에 들어갈 경우 다른 꽃가루 수집 샘플을 교차 오염시킬 수 있습니다. 따라서 마초는 설치 후 트랩핑 메커니즘을 분리하여 새 입구에 적응하기 위해 최소 24 시간을 주어야합니다. 추가 하이브 입구가 거의 없거나 전혀없는 식민지를 선택하면 새로운 꽃가루 함정 입구로 향할 때 혼란을 줄일 수 있습니다.
추가 하이브 입구 (예 : 구멍 및 뒤틀린 뚜껑)는 봉인되어야하지만 트랩 설치가 시작될 때 이러한 입구가 존재함에 따라 이웃 두드러기로 표류하는 마초의 위험이 증가합니다. 또한 꽃가루 트랩이 팔레트 모양의 두드러기 클러스터의 단일 하이브에만 설치되면 Foragers는 다른 하이브 입구로 쉽게 표류합니다. 마초는 팔레트에서 같은 방향을 향하고있는 모든 두드러기에 트랩이 설치되어있는 경우 표류 할 가능성이 적습니다. 상단 마운트 꽃가루 함정은 꽃가루 트랩 입구와 하이브의 원래 입구 사이의 상당한 거리로 인해 꿀벌 표류의 위험이 더 높을 수 있습니다. 이 연구를 위해, 꽃가루 트랩을 각 실험 위치의 여러 꿀벌 콜로니에 설치하여 각 꿀벌 식민지 사이의 꽃가루 양과 택시 조성의 변화를 설명했습니다. 따라서 꽃가루 수집은 식물 종 유형과 총 수집 수량12,13에 따라 식민지간에 크게 다를 수 있기 때문에 풍경에서 강력한 꽃가루 수집을 달성하기 위해 여러 식민지에 꽃가루 트랩을 설치해야합니다. 각각의 꽃가루 샘플은 7일간의 수집 기간을 가졌다. 앞으로의 연구에서, 두세 번의 연속된 72시간 간격으로 꽃가루를 수집하는 것은 꽃가루 사료 추정(40)의 정확도를 증가시킬 것이다.
꽃가루 수집에 높은 수준의 시간적 변동이 있기 때문에, 꽃가루 추정 정확도는 표적 작물 시스템(24,27,39)의 초기, 피크 및 늦은 개화 기간에 꽃가루 수집 과정을 반복함으로써 증가될 수 있다. 꽃 가루는 양봉장 위치14,27,33,43 사이의 수량 및 식물 종 유형의 예상 변화로 인해 동일한 자르기 시스템 또는 조경 유형에도 불구하고 여러 위치에서 수집해야합니다. 장기간 꽃가루 포획은 꿀벌 식민지에 해로울 수 있습니다. 잠재적 인 영향에는 새끼 사육 감소, 애벌레 성장 기간 단축, 두드러기 19,44,45,46의 알과 어린 애벌레의 식인 풍습이 포함됩니다. 전체 성장기와 같은 꽃가루 포획의 더 긴 기간은 식민지에서 새끼 사육에 대한 해로운 영향을 악화시킬 수 있습니다. 꽃가루 포획은 또한 꿀 생산의 감소 및 저장된 꿀(13)의 수분 수준의 증가를 야기할 수 있다. 풍경이나 자르기 시스템을 지속적으로 모니터링 할 때 양봉장의 식민지 사이에서 꽃가루 트랩을 회전하면 꽃가루 포획에 사용되는 식민지에 대한 피해를 완화 할 수 있습니다. 격주로 꽃가루 덫을 잡으면 일정 기간 동안 동일한 식민지에 꽃가루를 가두면 해로운 영향, 특히 꿀 생산 손실을 줄일 수 있습니다13.
또한, 꽃가루 함정은 강한 식민지에 배치되는 것이 바람직하다. 때로는 꽃가루 함정이 의도하지 않게 관여 할 수 있습니다. 이것은 꽃가루 트랩 수집이 필요하지 않을 때 꽃가루 트랩 메커니즘을 잠그면 피할 수 있습니다. 꽃가루 함정은 꿀벌 마초에서 모든 부식성 꽃가루를 제거하지 않습니다. 트랩 효율은 트랩 유형, 꽃가루 펠릿 크기, 꿀벌 몸 크기, 하루 중 시간 및 기상 조건에 따라 다릅니다. 따라서 코르비큘러 꽃가루 수집은 다른 식물 종과 수집 기간25,26에 꽃가루 트랩을 사용할 때 일관성이 없습니다. Eucalyptus spp. 및 Tamarix spp.와 같은 식물에서 나온 더 작은 꽃가루 알갱이는 꽃가루 함정27에 의해 포획 될 가능성이 적습니다. 특히, 하이부시 블루베리(Vaccinium corymbosum L.) 꽃가루는 본 연구에서 하이부시 블루베리 수집지에서 발견되지 않았으며, 이는 하이부시 블루베리 꽃가루 펠릿이 꽃가루 트랩 수집(47)에 비해 너무 작다는 이전의 증거를 뒷받침한다. 대조적으로, 민들레 (Taraxacum officinale F.H. Wigg)에서 공급 된 꽃가루는이 연구의 모든 작물 시스템에서 발견되었습니다. 일부 식물 종의 꽃가루 펠릿은 Taraxacum spp.와 같은 다른 종보다 훨씬 클 수 있으며, 꽃가루 트랩(27)으로부터의 꽃가루 수집의 분석에서 과대 대표 될 수 있습니다. 개별 꽃가루 사료를 포획하고 코르비큘러 꽃가루를 수동으로 제거하면 꽃가루 공급원 평가의 정확도가 높아지지만 꽃가루 트랩을 사용하는 것에 비해 시간과 자원이 매우 많이 소요됩니다 (표 1). 꽃가루 펠릿을 색상 그룹으로 분류하는 것은 시간이 많이 걸리지 만 비교적 간단합니다. 특정 연구 목표 또는 목표가없는 한, 꽃가루 펠렛의 양은 색상 그룹으로 분류하기 위해 10g 이하 (주어진 샘플의 경우)로 제한되어야합니다. 이 양보다 많은 양을 포함하는 전체 샘플을 정렬하면 분석을 완료하는 데 필요한 시간이 크게 늘어납니다. 그러나 색상 정렬을위한 하위 샘플을 가져 오기 전에 꽃가루 샘플을 매우 잘 혼합하는 것이 중요합니다. 원래 샘플을 혼합하지 않으면 전체를 대표하지 않는 하위 샘플이 발생할 수 있으므로 피해야합니다.
원래 샘플 용기에 꽃가루 펠렛을 철저히 혼합 할 수있는 충분한 여유 공간이 없으면 큰 비닐 봉지 또는 작은 종이 봉지에 전체 샘플을 넣으면 큰 샘플의 경우에도 충분합니다. 단단한 플라스틱, 뚜껑이 달린 용기도 작동합니다. 시료를 혼합하는 것은 부드럽게 이루어져야하므로 꽃가루 알갱이가 찌그러 지거나 파괴되지 않아야합니다. 의도하지 않은 편향은 무의식적으로 "예쁜 보라색 펠릿"을 훔쳐서 예를 들어 전체에서 하위 샘플을 제거 할 때 설득 할 수 있습니다. 따라서 샘플의 색상 구성은 하위 샘플을 스쿠핑하는 동안 시야에서 가려야합니다. 이런 식으로 전체를 진정으로 대표하는 하위 샘플을 얻는 것이 더 가능성이 큽니다. 그러나 이 서브샘플링 방법은 샘플에서 낮은 풍부도의 꽃가루 펠릿을 선택하지 못할 수 있습니다. 따라서 샘플에 표시된 모든 개별 식물 분류를 식별하는 것이 연구 목표라면 하위 샘플을 수집하는 것은 적절하지 않습니다. 전체 샘플을 분석해야합니다. 따라서 펠렛은 유리 페트리 접시에 분류되어야합니다. 정렬이 완료되면 Pantone 색상 가이드의 적절한 페이지를 접시 아래에 배치하여 가이드와 정렬 된 꽃가루 간의 색상 일치를 쉽게 할 수 있습니다. 이에 대한 예가 그림 5에 나와 있습니다.
수분을 위해 작물에 배치 된 꿀벌 식민지에서 꽃가루를 포획 할 때 총 색상 그룹을 열 개 이상 사용해서는 안됩니다 : 아홉 개의 개별 색상과 샘플의 소수 색상으로 구성된 하나의 "기타"색상 그룹. 샘플을 나눌 수있는 최대 색상 그룹 수에 합리적인 제한을 두면 펠릿을 극도로 특정 그룹의 수가 계속 증가하여 연구원이 수렁에 빠지는 것을 방지하며, 분류가 완료되면 개별적으로 acetolysis를위한 충분한 양을 포함하지 않을 수 있습니다. 매우 다양한 식물 종에서 먹이를 먹을 가능성이있는 식민지에서 포획하는 경우 더 많은 색상 그룹이 필요할 수 있으며 프로토콜은 해당 요구 사항을 반영하도록 최적화되어야합니다. 본 연구는 꿀벌 식민지에서 수집 된 꽃가루 샘플에 초점을 맞추었고 이전 연구 29,30,31과 유사한 색상 그룹에서 여러 택시가 일반적으로 발견되었습니다.
Acetolysis는 꽃가루 곡물의 표면에서 지질, 단백질 및 유기 파편을 용해시켜 엑신의 구별되는 특성을 밝혀 곡물을 염색하고 더 쉽게 식별 할 수 있도록합니다. 그것은 많은 종류의 꽃가루 연구37에서 사용되는 오래되고 일반적인 방법론입니다. 일반적인 단계는 표준화되어 있습니다. 프로토콜마다 거의 차이가 없습니다. 그러나, 원심분리 속도 및 시간, 인큐베이션 온도 및 기간, 꽃가루-양-구동 시약 부피 및 심지어 상등액 제거 방법(디캔팅 대 피펫팅)의 특성은 연구 목표 및 어느 정도까지는 발생할 가능성이 있는 꽃가루의 유형에 따라 실험적으로 최적화될 필요가 있을 수 있다48. 실제로, acetolysis는 Malvaceae 및 Orchidaceae38과 같은 일부 택시에서 꽃가루의 중요한 진단 특성을 제거 할 수 있습니다. 따라서 모든 꽃가루가 표준 acetolysis 방법을 적용 할 수있는 것은 아닙니다. 위에서 언급 한 바와 같이, 이러한 방법은 작물 수분 꿀벌에 의해 수집 된 꽃가루의 지배적 인 식물 분류 소스를 확인하기 위해이 연구에서 최적화되었습니다. 꽃가루 곡물의 정확한 정량화가 연구의 일부인 경우 고려해야 할 세부 사항은이 논문에서 다루지 않았습니다.
용매와 산을 사용하려면 신중한 계획, 적절한 개인 보호 장비(PPE) 및 책임있는 폐기물 처리가 필요합니다(그림 6). 연구원이 비뇨기 분해의 일부를 시작하기 전에 시약을 저장하고 폐기물을 처리하는 올바른 방법을 결정하는 것이 중요합니다. 이 실험실에서 부틸 장갑은 황산과 심지어 빙초산과 관련된 공정의 모든 부분에서 사용되는데, 이는 니트릴 장갑보다 두 산에 대한 분해 및 투과 등급이 훨씬 우수하고 손재주를 손상시키지 않기 때문입니다49. 적절한 장갑 및 기타 PPE49에 대한 권장 사항에 대해 각 기관의 안전 지침을 참조하는 것이 현명합니다. acetolysis 단계 전에 빙하 아세트산 첨가는 샘플의 잔류 수분을 제거하고 중요한 acetolysis 반응을 위해 그것을 준비하는 데 도움이됩니다. 비소 분해 단계에서 빙초산-황산 혼합물은 물과 격렬하게 반응 할 수 있으므로 모든 유리 제품 및 공급품이 완전히 건조되고 acetolysis 전에 모든 수분이 샘플에서 제거되는 것이 중요합니다. 빙초산의 비구분해 후 첨가는 비구분해 혼합물을 희석하고 중화시킨다.
에탄올 및 빙초산, 특히 미세원심분리 튜브 라벨의 잉크를 용해시킬 수 있으며, 이러한 시약이 용매 내성 펜으로도 튜브 외부에 떨어지면 용해 될 수 있습니다. 공정 전반에 걸쳐 튜브 라벨을 자주 확인하여 여전히 읽을 수 있는지 확인하십시오. 논리적으로 실현 가능한 경우 LaserJet 인쇄 라벨을 이러한 가능성에 대한 보호 장치로 사용하는 것이 좋습니다. 상청액이 디캔팅되는 방식은 시약이 마이크로 원심분리 튜브의 외부로 드리블되는지 여부에 영향을 미칩니다. 연습과 함께 제공되는 자신감 있고 부드러운 손으로 상등액을 속이는 것이 중요합니다. 데칸테이션 중에 원심 분리기 튜브에서 꽃가루 샘플이 손실되지 않도록주의해야합니다. 너무 빨리 디캔팅하면 꽃가루 잔류 물의 일부 또는 전부를 잃을 위험이 있습니다. 너무 천천히 디캔팅하면 상청액이 튜브 아래로 흘러 내려갈 수 있습니다. 100 °C의 배양 온도가 일반적으로 권장되지만, 꽃가루는이 연구에 사용 된 양 (0.25g)의 온도에서 쉽게 "과식"될 수 있으며, 특히 약간 더 긴 기간 동안 배양하는 경우29. 실제로, 80°C에서조차도, 비구분해 혼합물에 너무 오래 방치하면 꽃가루 알갱이가 파열되거나 그렇지 않으면 손상될 수 있다. 인큐베이션 온도 및 지속 시간은 샘플에서 꽃가루 입자가 파괴되지 않도록 신중하게 결정되어야합니다.
꽃가루를 염색하면 엑신 특징의 정의와 대비가 증가하여 사진을 찍고 식별하기가 더 쉬워집니다(그림 7). 1 % Safranin O의 5 방울 (플라스틱 전달 피펫에서)은 꽃가루 0.25g을 효과적으로 염색했습니다. 그러나 다른 폴렌은 다르게 얼룩집니다. 꽃가루 알갱이가 너무 가볍게 또는 너무 심하게 얼룩지면 식별이 어려울 수 있습니다. 가능한 경우, 연구에서 발견될 것으로 예상되는 꽃가루 종을 적절하게 염색하는 데 필요한 얼룩 용액의 부피는 실험 샘플의 처리를 시작하기 전에 검증되어야 한다. 그럼에도 불구하고, 실험 샘플 중 하나가 적절하게 염색되지 않으면, 그것은 교정될 수 있다. 너무 심하게 얼룩진 꽃가루 샘플을 밝게하려면 샘플을 물로 헹구고 에탄올로 헹구십시오. 꽃가루가 뚜렷한 특징을 볼 수있을만큼 잘 염색되지 않으면 몇 방울의 얼룩을 추가 할 수 있습니다. 이 샘플의 얼룩은 글리세린을 첨가하기 전에 확인해야합니다. 마찬가지로, 꽃가루 잔기에 대한 글리세린의 이상적인 부피를 결정하기 위해 시행착오가 필요할 수 있다. 글리세린 열다섯 방울은 이 연구에서 샘플이 건조되지 않도록 적절하게 보호했으며, 꽃가루 잔여물을 광 현미경을 통한 하류 식별에 이상적인 농도로 희석했습니다. 다른 양의 꽃가루 잔류 물은 건조를 방지하고 장착을 용이하게하기 위해 더 많거나 적은 글리세린을 요구할 수 있습니다.
저자는 공개 할 것이 없습니다.
색상 분류 및 비석 분석을 도와 주신 그레첸 존스 박사(USDA-ARS, APMRU, College Station, TX)에게 감사드립니다. 이 연구는 오레곤 주 양봉가 협회 (Oregon State Beekeepers Association)가 R.R.S.에 제공 한 연구 자금으로 지원되었습니다.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved