Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Innsamling og identifisering av pollen fra honningbiekolonier
Vi beskriver metoder for innsamling av korbikulær pollen fra honningbier samt protokoller for fargesortering, acetolyse og mikroskop lysbildefremstilling av pollen for taksonomisk identifikasjon. I tillegg presenterer vi pelletsfarge og taksonomisk mangfold av korbikulær pollen samlet inn fra fem beskjæringssystemer ved hjelp av pollenfeller.
Forskere samler ofte og analyserer korbikulær pollen fra honningbier for å identifisere plantekildene som de fôrer for pollen eller for å estimere eksponering av bier av plantevernmidler via pollen. Beskrevet her er en effektiv pollenfangstmetode for å samle korbikulær pollen fra honningbier som kommer tilbake til elveblestene sine. Denne innsamlingsmetoden resulterer i store mengder korbikulær pollen som kan brukes til forskningsformål. Honningbier samler pollen fra mange plantearter, men besøker vanligvis en art i løpet av hver innsamlingstur. Derfor representerer hver korbikulær pollenpellet overveiende en planteart, og hver pollenpellet kan beskrives etter farge. Dette gjør det mulig å sortere prøver av korbikulær pollen etter farge for å segregere plantekilder. Forskere kan videre klassifisere korbikulær pollen ved å analysere morfologien til acetolyserte pollenkorn for taksonomisk identifikasjon. Disse metodene brukes ofte i studier relatert til pollinatorer som pollineringseffektivitet, pollinatorforagingdynamikk, diettkvalitet og mangfold. Detaljerte metoder presenteres for å samle korbikulær pollen ved hjelp av pollenfeller, sortere pollen etter farge og acetolyserende pollenkorn. Også presentert er resultater knyttet til hyppigheten av pelletsfarger og taxa av korbikulær pollen samlet fra honningbier i fem forskjellige beskjæringssystemer.
Den vestlige honningbien (Apis mellifera L.) er en viktig pollinator av mange landbruksavlinger som er avhengige av biebestøvning1. I mer enn et tiår har betydelige tap av honningbiekolonier blitt rapportert 2,3,4,5,6,7,8,9. Flere faktorer - inkludert parasitter og sykdommer, dårlig ernæring og plantevernmidler - har vært involvert i disse koloninedgangene10. Dårlig ernæring kan tilskrives intensivering av landbruket og tap av beitehabitat11. Det er viktig å forstå blomsterressursene som brukes av bier i forskjellige landskap for å forbedre bieernæring og hjelpemiddel i bievernarbeid. Pollen er den primære kilden til protein, lipider, vitaminer og mineraler for bier og har blitt brukt i mange landbruks- og økologiske studier for å forstå koloninivåforaging preferanser av honningbier, evaluere virkningen av pollenfangst på honningbiekolonier, og bestemme eksponering for plantevernmidler for bier12,13,14.
Honningbier samler pollen fra blomster, pakker pollen i pellets på corbicula - en tibial pollenkurv på bakbenet - og går tilbake til kolonien for lagring. Corbicular pollen kan fjernes fra foragers ved å fange dem ved bikubeinngangen eller på blomster, chilling dem kort for å immobilisere dem, og deretter fjerne pollenpellets fra bakbenene med tang. Den møysommelige prosessen med håndinnsamling av korbikulær pollen fra individuelt fangede foragere er langsom og ineffektiv hvis man krever en betydelig mengde pollen. En enklere og mer effektiv metode for å samle store mengder pollen er ved å fange korbikulære pollenpellets fra honningbier ved bikubeinnganger. Pollenfeller er designet for å løsne korbikulær pollen fra beina til de returnerende pollenforagerne når de kommer inn i bikuben15. Foragerne må klemme gjennom nettinghull som er dimensjonert for å tillate passasje av en honningbiearbeiderkropp.
Når honningbien passerer gjennom et av disse hullene, skrapes de større pollenpellets av bena og faller ned i et oppsamlingsbrett16. Studier har vist at pollenfangst stimulerer foragere til å samle mer pollen, og dermed øke pollineringseffektiviteten til de omkringliggende avlingene og vegetasjonen17,18,19,20. Polleninnsamlingsmetoder kan også brukes til å forstå fôret som brukes av honningbier i landskapet som det første skrittet for å bestemme kvantitet, kvalitet og taxa av blomstrende plantearter. Effektive pollenfangstmetoder letter dermed både pollinering og honningbienæringsforskning. En sammenligning av disse pollensamlingsmetodene er illustrert i tabell 1. Pollenforagingadferd vil endres basert på koloniens behov for lagret pollen i forhold til egg- og larvepopulasjonsnivåene21,22. Siden disse endringene inkluderer varierende innsamlingsintensitet, forventes det ofte høy variasjon i pollenmengde mellom kolonier på samme sted og mellom forskjellige steder av samme beskjæringssystem eller landskapstype23,24. Å øke antall kolonier og lokaliteter for å fange pollen vil bidra til å imøtekomme denne variasjonen.
Pollenfeller varierer i effektivitet25,26. Størrelsen på pollenpellets samlet av honningbier varierer mellom plantearter og kan endres basert på nivåene av pollenbutikker i kolonien27,28. Dette gir mulighet for at mindre pollenpellets blir underrepresentert og større pellets kan overrepresenteres i prøver samlet inn via pollenfeller. Voksenbier varierer i kroppsstørrelse, noe som også kan påvirke representasjonen av pollen samlet i feller. Det finnes også plantearter som hovedsakelig produserer nektar som vil være uoppdaget hvis man bare vurderer innsamlet pollen i enkelte landskap. Fangsteffektiviteten påvirkes også av foragerdrift og desorientering, som påvirkes av pollenfelletype og tilstanden til bikubeutstyret. Dette problemet kan reduseres ved å bruke teknikker som er angitt i denne artikkelen. Etterforskere kan vurdere ytterligere forskningsteknikker, for eksempel å telle blomsterbesøk av foragere, for å supplere resultatene av foraging preferanser på koloninivå. En nyttig metode for å vurdere pollendiversitet er å sortere korbikulær pollen etter farge. Selv om honningbier er generalistforagere, viser de også blomstertroskap, hvor de samler pollen fra samme planteart på samme sted under en gitt samlingstur. Basert på denne foragingadferden antas det at en gitt korbikulær pollenpellet hovedsakelig er representert av en enkelt planteart 27,29,30,31. Derfor kan forskere beskrive pollendiversitet ved å sortere korbikulær pollen etter pelletsfarge og rapportere totalt antall farger oppdaget eller andelen av totalen representert av hver fargegruppe 12,32,33,34. Dette kan oppnås ved å måle masse- eller pelletstallet for hver fargegruppe. Måling av pelletstallet for hver fargegruppe foreslås hvis det er kjente eller mistenkte systematiske forskjeller i vekten av pellets fra forskjellige taxa. Systematiske forskjeller kan skyldes pelletsstørrelse eller mengden nektar som foragere legger til pollen når de danner en pellet.
Fargesortering er en tidseffektiv og enkel prosess, men kan ikke ha akseptabel nøyaktighet for noen pollineringsforskningsstudier fordi forskjellige planteskatter kan ha lignende pollenpelletsfarger35,36. I tillegg er det en logistisk grense for antall forskjellige fargegrupper pollenpellets kan deles inn i. Dermed kan separasjonen av hver enkelt plantetaksonpollen i sin egen distinkte pelletsfargegruppe ikke alltid være mulig i pollineringsstudier. Morfologisk karakterisering av pollenkorn via lysmikroskopi komplementerer ofte fargeseparasjon av pellets ved å skille pollen av to eller flere taxa i pellets av samme fargegruppe. Selv om det er vanlig å finne pollenkorn av flere taxa i en gitt pollenpelletsfargegruppe, består individuelle pollenpellets samlet av en honningbie vanligvis en dominerende takson, muligens med andre taxa i mindre mengder. Det er således vanlig å anta taksonomisk troskap i korbikulære pollenpellets av honningbier. Pollenpellets fra andre pollinatorer som ikke utviser blomstertroskapsadferd, for eksempel humlebier, vil ofte inneholde mange plantearter og har kanskje ikke et dominerende takson. I tilfeller der kvantitative estimater av taxa-proporsjoner i polyflorale pollenpellets er ønsket, er det i tillegg nødvendig med mikroskopiske metoder som inkluderer acetolyse, for riktig analyse.
Vurdering av morfologiske egenskaper ved acetolyserte pollenkorn er den vanligste metoden for taksonomisk identifikasjon16. Acetolyseprosedyren fjerner pollenkornets protoplasma for å eksponere diagnostiske egenskaper som kan observeres under lysmikroskopi37,38. Ved hjelp av denne metoden kan forskere rapportere forskjellige taxa, hyppighet av taxa funnet i spesifikke beskjæringssystemer, og dominerende taxa av pelletsfarger33,36. Acetolyse er den beste analytiske teknikken for å avsløre pollenmorfologi28. Imidlertid kan noen acetolyzed pollenkorn, som mange Rosaceae-typer, ikke identifiseres til slekts- eller artsnivå gjennom acetolyse og lysmikroskopi alene. Forskere vurderer skanning elektronmikroskopi eller metabarkoding som alternative metoder for å oppnå slekts- eller artsnivåidentifikasjon. Disse alternative metodene gir imidlertid bare kvalitativ taksonidentifikasjon og unnlater å estimere proporsjonene av forskjellige pollenkornskatter i polyflorale pollenpellets36,39. I tillegg er utgiftene og nødvendig kompetanse betydelig høyere for disse metodene. En sammenligning av disse identifikasjonsmetodene er illustrert i tabell 1.
| Metoder | Tid | Utgift | Resolusjon | Ekspertise |
| Pollen Collection | ||||
| Pollenfangst | Lav | Moderat | Variabel | Moderat |
| Pollen forager samling | Høy | Moderat | Høy | Lav |
| Pollen Identifikasjon | ||||
| Visuelt (bare fargesortering) | Moderat | Lav | Lav | Lav |
| Acetolyse | Moderat | Moderat | Moderat | Moderat |
| Skanning elektronmikroskopi | Høy | Høy | Høy | Høy |
| Metabarkoding | Variabel | Høy | Høy | Høy |
Tabell 1: Sammenligning av ulike metoder for pollensamling og identifisering basert på tid, kostnader, oppløsning og kompetanse. Visuelle metoder (bare fargesortering) rapporterer totalt antall farger som oppdages, eller andelen av totalen som representeres av hver fargegruppe, som en beregning for å bestemme pollenkilder, men gir ikke taksonidentifikasjon.
Informasjonen som er tilgjengelig om fangst og sortering av pollen og acetolyserende pollenkorn er mangfoldig og ofte spredt over flere kilder, varierende for forskere på forskjellige felt. Dette papiret gir detaljert innsikt i ulike typer pollenfeller som kan brukes av både forskere og biavlere for effektivt å samle store mengder korbikulær pollen. Også gitt er protokoller for fremstilling av pollenprøver - ved acetolyse, farging og glidemontering - for identifikasjon av planteskatt. Metodene som er beskrevet her er omfattende og fungerer som en unik ressurs for å identifisere dominerende plantearter som honningbier fôrer i et gitt landskap, spesielt i beskjæringssystemer. Funn basert på disse metodene fra en tidligere studie har blitt presentert og dokumenterer mangfoldet av pollenpelletsfarger og plantetaksa fra korbikulær pollen samlet inn av honningbier i fem beskjæringssystemer14.
1. Samle korbikulær pollen fra honningbiekolonier ved hjelp av pollenfeller
- Bestem når du skal fange pollen fra ønsket apiary-plassering.
MERK: Ideelle klimatiske forhold inkluderer full soleksponering, lave vindhastigheter, lav luftfuktighet og ingen forventet nedbør i ønsket periode for pollenoppsamling. - Velg optimale honningbiekolonier for å fange pollen innenfor apiary-stedet.
- Vurder kolonistyrken ved å telle foragere som kommer tilbake til koloniinngangen i 2 minutter. Velg kolonier med høyest totalt antall returnerende foragere.
- Velg elveblest med tretøy som er i god stand, helst uten ekstra innganger og vridde lokk. Bruk kolonier med færre alternative innganger, da de har økt sannsynlighet for å returnere foragere som omorienterer seg til felleinngangen.
- Velg sørvendte bikubeinnganger når det er mulig. Hvis elveblest er palletert, installer pollenfeller på hver koloni som vender i samme retning på en gitt pall for å unngå drift av foragere inn i nærliggende bikubeinnganger.
- Hvis ønskelig, vurder koloniens brødrede ved å inspisere rammer for tilstedeværelse av larver. Velg kolonier med relativt store mengder larver.
- Installer pollenfeller på de valgte honningbikoloniene.
MERK: Installasjonen vil variere basert på typen pollenfelle. Typer inkluderer a) frontmontert, b) bunnmontering, c) toppmontering eller d) inngangsmontert snøskruehull. Se diskusjonsdelen for detaljer.- For frontmonterte feller, fest fellen foran inngangen med stifter, skruer og tape, eller koble fellen til strikkledninger viklet rundt bikuben. For bunnmonterte feller, plasser fellen under den laveste bikubeboksen, og fest felleinngangen nær den opprinnelige inngangen. For skruehullfestefeller, fest fellen rett foran et skruehull i en bikubeboks ved hjelp av stifter, skruer og tape. For toppmonterte feller, plasser fellen over den øverste bikubeboksen og under lokket.
- Forsegl alle andre mulige innganger til kolonien ved å bruke ikke-klebende og formbart materiale, for eksempel latex- eller polyuretanskum, eller # 8 maskinvareduk (2,7 mm blenderåpning) for skruehull. Bruk tape for små sprekker.
- Hvis du bruker frontmonterte feller, plasser en barriere, for eksempel en gummimatte, mellom oppsamlingskurven og gresset for å unngå fuktskader fra dugg.
- Koble til fangstmekanismen til pollenfellen 24 timer etter installasjon og før dagens fôringsflyvning starter (sen kveld / tidlig morgen).
MERK: Dette trinnet er ideelt, men ikke nødvendig. Engasjer pollenfeller annenhver uke hvis du fanger pollen på de samme koloniene gjennom en gitt periode. - Samle korbikulær pollen fra oppsamlingsbrettet, legg det i plastposer eller sentrifugerør, og oppbevar i en kjøler med is.
- For å vurdere mangfoldet og overfloden av pollenarter, for eksempel ernæringsstudier på landskapsnivå, samle pollen i to eller tre 72-timers intervaller40.
- For analyse av rester av plantevernmidler, samle pollen i intervaller på 24 timer til 96 timer med minimum 3 g for behandling av41.
- Rengjør pollen ved å fjerne biedeler og annet bikubeavfall.
MERK: Bruk engangshansker ved håndtering av pollenprøver, og bytt engangshansker mellom prøvene. Bruk separate verktøy for å fjerne rusk fra pollen samlet i hver felle. Skyll og tørk før du bruker verktøyene til en annen gruppe fanget pollen. - Oppbevar pollen ved -20 °C eller lavere for å opprettholde dens sammensetningsintegritet dersom pollen er beregnet på pollenkildeidentifikasjon, mengdevurdering eller restanalyser av plantevernmidler41,42.
- Etter å ha fjernet fellene fra elveblestene, steriliser alt utstyr i en 5% blekemiddelløsning, skyll og tørk utstyret før neste bruk.
2. Pollenpelletsfargesortering for nedstrøms pollenkildeidentifikasjon og mengdevurdering
- Sørg for at det er minst 20 g pollenprøve å jobbe med. Bland pollenprøven grundig i posen eller en annen beholder av passende størrelse for å oppnå en homogen blanding av alle pellets inneholdt deri. Hvis du vil unngå utilsiktet skjevhet i neste trinn, skjuler du utvalgets fargesammensetning før du fjerner en delprøve fra prøveposen.
- Bruk en scooper eller stor skje, øs ut 10 g pollen som en representativ subsample av hele. Hell sakte pellets ut av scooperen på balansen til displayet leser 10 g. Hvis den første scoop ikke var stor nok, hente en annen scoop fra prøven på samme måte.
MERK: Disse spesifiserte vektkravene (20 g og 10 g) fungerer kun som eksempler. Forskeren bør justere mengden pollen som brukes i hvert trinn etter behov for spesifikke behov. - Fjern alle biedeler og annet rusk fra 10 g subsample. Deretter legger du om nødvendig til litt mer pollen fra den opprinnelige prøven for å oppnå en totalvekt på 10 g av delprøven.
- Sorter hver pollenpellet fra 10 g subsample i en fargegruppe. Bruk både pollenfarge og tekstur til å skille mellom fargegrupper.
MERK: Det forventes noe variasjon innenfor en gruppe, men bruk av Pantone-fargeveiledningen under sortering kan øke konsistensen. - For å sikre minst 0,25 g av hver fargegruppe for nedstrøms trinn, plasser eventuelle pellets som ikke er rikelig nok til å danne en fargegruppe på minst 0,25 g i en annen gruppe. Gi hver enkelt fargegruppe et navn ved hjelp av Pantone-fargeveiledningen. Merk diverse gruppe diverse.
- Vei hver fargegruppe på et eget veiepapir, og/eller tell antall pellets i hver fargegruppe. Registrer fargegruppenavn og tykkelser eller antall i et dataark.
MERK: Å velge om du vil veie eller telle antall pellets i hver fargegruppe, avhenger av forskerens beregning av interesse og prosjektmål. - Lag en mikrosentrifugerøretikett for hver fargegruppe ved hjelp av en løsemiddelbestandig penn og selvklebende papirrøretiketter. Inkluder gjeldende dato, eksempelidentifikator, prøvesamlingsdato og fargegruppenummer i etiketten. Påfør etikettene på rene, tørre 2 ml mikrosentrifugerør.
- Vei ut 0,25 g (± 0,05 g) pollenpellets fra hver fargegruppe, og plasser denne mengden i riktig merket mikrosentrifugerør.
MERK: Hvis det er liten variasjon i farge eller tekstur i pollen av en gitt fargegruppe, må du sørge for at det er et representativt utvalg av pellets i hvert rør. Reagensvolumene og inkubasjons- og sentrifugeringstidene som følger er egnet for 0,25 g pollen. Bruk derfor denne mengden pollen i mikrosentrifugerørene som skal brukes i acetolyse. Denne protokollen skal gi rikelig, farget pollen for nedstrøms plantekildeidentifikasjon ved lysmikroskopi. Hvis du bruker en annen mengde pollen i acetolyse, bør spesifikasjonene av reagensvolum og behandlingstider justeres tilsvarende. - Plasser de resterende pollen fra hver fargegruppe i individuelle plastposer (en pose per farge) merket med fargegruppenavnet. Oppbevar disse posene sammen med de andre delene av den aktuelle originalprøven i -20 °C oppbevaring.
- Bland pollen i røret grundig med en ren tretannpirker i 10 til 15 s.
3. Forberedelse til acetolyse
- Før du begynner noen del av acetolyse for første gang, kontakt den utpekte institusjonens avdeling for miljørettet helsevern og sikkerhet (HMS) for instruksjoner om hvordan acetolyserelaterte reagenser og avfall skal håndteres.
- Skaff lagerløsninger av følgende reagenser, og plasser dem i avtrekkshetten i samsvar med EHS-retningslinjer for kjemisk lagring: 95% etanol; destillert vann; iseddik, vannfrisyre; konsentrert svovelsyre; Glyserin; og klar neglelakk.
- Klargjør stamløsninger av følgende reagenser, og plasser dem i avtrekksviften i samsvar med HMS-retningslinjer for kjemisk lagring: mettet natriumbikarbonat (8 % w/v-oppløsning i destillert vann); og safranin O (1 % w/v-løsning i 50 % etanol).
4. Acetolyse
- Utfør pre-acetolyseprosedyren for iseddikvask. Utfør følgende trinn i avtrekkshetten med laboratoriefrakk, øyevern og nitrilhansker.
- Slå på en varmeblokk til 80 °C.
MERK: Sørg for at en klemmeflaske mettet natriumbikarbonat er lett tilgjengelig. Dette kan brukes til å nøytralisere syresøl i avtrekkshetten hvis de oppstår. - Merk ett glassbeger for syreavfall, ett for etanolavfall og ett for acetolyseblanding.
- Bruk tidligere tilberedte stamløsninger, opprett arbeidsaliquoter av følgende reagenser i merkede glassbeger av passende størrelse: ~ 23,0 ml iseddik; ~33,0 ml destillert vann; ~23,0 ml 95 % etanol; ~25,0 ml natriumbikarbonat (for syreforurenset fast avfall).
MERK: Dette er volumene som kreves for å fullføre følgende acetolyseprosedyrer på totalt 10 fargegruppeprøver (10 mikrosentrifugerør). - Tilsett sakte 500 μL iseddik til hvert mikrosentrifugerør som inneholder 0,25 g fargegruppepollen. Mens du visuelt inspiserer røret, rør pollen med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig. Plasser den brukte tannpirkeren i natriumbikarbonatavfallsbegeret etter bruk; Gjenta denne prosessen for hvert rør.
MERK: Bruk en ren, ny tannpirker for hvert rør. Forsikre deg om at lokket på hvert rør er tett lukket. - Sentrifuge prøvene i 3 minutter ved 1,100 × g. Dekanter supernatanten fra rørene inn i syreavfallsbegeret. Deretter berører du den åpne munnen på røret mykt og kort med et rent papirhåndkle for å fjerne gjenværende iseddik rundt kanten av røret.
MERK: Vær forsiktig så du ikke mister pollenpelleten når du dekanterer supernatanter.
- Slå på en varmeblokk til 80 °C.
- Utfør acetolyseprosedyren.
MERK: Utfør følgende trinn i avtrekkshetten med laboratoriefrakk, øyevern og butylvinylhansker.- Forbered acetolyseblandingen (9: 1 iseddik: svovelsyre) ved først å tilsette 10,8 ml iseddik (fra arbeidsaliquot) til begeret merket acetolyseblanding. Deretter, ved hjelp av en 1000 μL pipette utstyrt med 1250 μL filtrerte pipettespisser, tilsett sakte 1200 μL (1,2 ml) konsentrert svovelsyre fra stamløsningen til acetolyseblandingsbegeret som inneholder iseddik. Kast den brukte pipettespissen i begeret av natriumbikarbonat.
MERK: Acetolyseblandingsbegeret kan bli varmt å ta på, og blandingen kan bli gul. Det er to muligheter som får blandingen til å bli en mørk farge: (a) reagensene kan være forbi utløpsdatoene, eller (b) for mye svovelsyre kan ha blitt tilsatt. I alle fall, hvis blandingen blir mørk, kast den i syreavfallsbegeret og lag en frisk acetolyseblanding. - Rør forsiktig acetolyseblandingen med en glassstang eller trerørepinne for å sikre at den homogeniseres. Plasser den brukte stangen / pinnen i begeret av natriumbikarbonat.
- Ved hjelp av en 1000 μL pipette med 1250 μL filtrerte pipettespisser, tilsett sakte 1000 μL acetolyseblanding fra begeret til hvert rør. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig. Plasser den brukte tannpirkeren i natriumbikarbonatavfallsbegeret etter bruk.
MERK: Bruk en ren, ny tannpirker for hver prøve. - Plasser prøvene på den forvarmede (80 °C) varmeblokken. Inkuber rørene i 5 minutter, rør hvert rør grundig med en ren tannpirker halvveis gjennom inkubasjon. Plasser hver brukt tannpirker i begeret av natriumbikarbonat etter bruk.
MERK: Ikke la tannpirkere være i prøvene; syren vil oppløse dem.
- Forbered acetolyseblandingen (9: 1 iseddik: svovelsyre) ved først å tilsette 10,8 ml iseddik (fra arbeidsaliquot) til begeret merket acetolyseblanding. Deretter, ved hjelp av en 1000 μL pipette utstyrt med 1250 μL filtrerte pipettespisser, tilsett sakte 1200 μL (1,2 ml) konsentrert svovelsyre fra stamløsningen til acetolyseblandingsbegeret som inneholder iseddik. Kast den brukte pipettespissen i begeret av natriumbikarbonat.
- Utfør prosedyren for post-acetolyse iseddikvask.
MERK: Utfør følgende trinn i avtrekkshetten med laboratoriefrakk, øyevern og butylvinylhansker.- Tilsett sakte 500 μL iseddik til hvert rør. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig. Plasser den brukte tannpirkeren i begeret av natriumbikarbonat etter bruk.
MERK: Bruk en ren, ny tannpirker for hver prøve. Forsikre deg om at lokket på hvert rør er tett lukket. - Sentrifuge prøvene i 3 minutter ved 1,100 × g. Dekanter supernatanten fra hvert rør inn i syreavfallsbegeret. Deretter berører du den åpne munnen på røret mykt og kort med et rent papirhåndkle for å fjerne gjenværende syre rundt kanten av røret.
- Skyll butylvinylhanskene grundig under rennende vann i minst 30 s, fjern dem og sett dem til å tørke.
MERK: Følg produsentens retningslinjer for gjenbruk av butylvinylhansker.
- Tilsett sakte 500 μL iseddik til hvert rør. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig. Plasser den brukte tannpirkeren i begeret av natriumbikarbonat etter bruk.
- Utfør tre vannskyllinger for hver prøve. Utfør følgende trinn i avtrekkshetten med laboratoriefrakk, øyevern og nitrilhansker.
- Tilsett 1000 μL destillert vann fra det destillerte vannbegeret til hvert rør. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig. Plasser tannpirkeren i natriumbikarbonatavfallsbegeret etter bruk.
MERK: Bruk en ren, ny tannpirker for hver prøve. Forsikre deg om at lokket på hvert rør er tett lukket. - Sentrifuge prøvene i 3 minutter ved 1,100 × g. Dekanter supernatanten fra rørene inn i begeret av natriumbikarbonat. Deretter berører du den åpne munnen på røret mykt med et rent papirhåndkle for å fjerne gjenværende vann rundt kanten av røret.
- Gjenta trinn 4.4.1-4.4.2 to ganger til sammen tre vannskyllinger.
- Tilsett 1000 μL destillert vann fra det destillerte vannbegeret til hvert rør. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig. Plasser tannpirkeren i natriumbikarbonatavfallsbegeret etter bruk.
- Utfør etanolskylling for hver prøve.
MERK: Utfør følgende trinn i avtrekkshetten med laboratoriefrakk, øyevern og nitrilhansker.- Ved hjelp av en 1000 μL pipette med 1250 μL filtrerte pipettespisser, tilsett 1000 μL 95% etanol fra etanolbegeret til hvert rør. Kast pipettespissen i ufarlig avfall. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig.
MERK: Plasser tannpirkeren i natriumbikarbonatavfallsbegeret etter bruk. Bruk en ren, ny tannpirker for hver prøve. Forsikre deg om at lokket på hvert rør er tett lukket. - Sentrifuge prøvene i 3 minutter ved 1,100 × g. Dekanter supernatanten fra rørene inn i etanolavfallsbegeret, og berør den åpne munnen på røret mykt med et rent papirhåndkle for å fjerne gjenværende etanol fra røret.
- Ved hjelp av en 1000 μL pipette med 1250 μL filtrerte pipettespisser, tilsett 1000 μL 95% etanol fra etanolbegeret til hvert rør. Kast pipettespissen i ufarlig avfall. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig.
- Bruk laboratoriefrakk, øyevern og nitrilhansker for å flekke prøver. Bland Safranin O flekkmasseløsning med mild inversjon.
- Bruk en engangspipette av plastoverføring, tilsett 5-10 dråper Safranin O-flekk til hvert rør. Mens du inspiserer røret visuelt, rør med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig. La tannpirkeren ligge i røret.
- Ved hjelp av en 1000 μL pipette med 1250 μL filtrerte pipettespisser, tilsett 1000 μL 95% etanol fra etanolbegeret til hvert rør. Kast pipettespissen i ufarlig avfall. Mens du inspiserer røret visuelt, rør med tannpirkeren i 10-15 s, og sørg for at innholdet i røret blandes grundig. Plasser den brukte tannpirkeren i det ikke-farlige avfallet etter bruk.
- Forsikre deg om at lokket på hvert rør er tett lukket. Sentrifuge i 3 min ved 1,100 × g. Dekantere supernatanten i etanolavfallsbegeret.
NOTAT: Ikke berør munnen på tuben med et papirhåndkle denne gangen. - Tilsett 10-15 dråper glyserin til hvert rør ved hjelp av en engangsoverføringspipette av plast. Mens du inspiserer røret visuelt, rør innholdet i røret med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig.
MERK: Plasser den brukte tannpirkeren i det ikke-farlige avfallet etter bruk. Bruk en ren, ny tannpirker for hver prøve. Forsikre deg om at alle røretiketter er leselige.
- La rørene stå åpne i avtrekkshetten for å fordampe etanolen i minst 2 timer ved romtemperatur. Kontroller prøvene for etanollukt: Hvis det er detekterbart, er prøvene ikke klare og bør få tørke til etanollukten forsvinner.
- Rengjør alle materialer, og kast avfall. Slå av både sentrifugen og varmeblokken. Kast alt fast og flytende avfall i samsvar med den utpekte institusjonens retningslinjer for miljørettet helsevern og sikkerhet.
- Forbered mikroskop lysbilder for pollen identifikasjon; Merk dem leselig. Merk et rent glassmikroskop lysbilde på riktig måte for hver fargegruppe / prøve som skal monteres. Mens du inspiserer røret visuelt, rør prøven med en ren tannpirker i 10-15 s, og sørg for at innholdet i røret blandes grundig.
MERK: Lysbildeforberedelse kan gjøres på laboratoriebenken. Kast tannpirkeren i ikke-farlig avfall. Bruk en ren, ny tannpirker for hver prøve.- Bruk en ren engangsplastoverføringspipette, fjern 1 dråpe pollenrester fra et rør og legg det i midten av det merkede mikroskoplysbildet. La dråpen spre seg litt. Plasser en ren deksel over dråpen på lysbildet.
- Etter at lysbildet har tørket, forsegler du dekselet til lysbildet med klar neglelakk. Legg en liten dråpe polering på hvert hjørne av dekselet, og mal en kant av polering rundt omkretsen av dekselet der den møter lysbildet. La neglelakken tørke helt, og mal et nytt lag med polering rundt omkretsen av dekselet.
En tidligere studie rapporterte vurderingen av mangfoldet av pollen samlet av honningbier i følgende landbruksavlinger: mandel, kirsebær, highbush blåbær, hybrid gulrot og meadowfoam14. Ved hjelp av de beskrevne metodene ble korbikulær pollen samlet, sortert etter farge, og plantekildene til hver pelletsfargegruppe identifisert for å vurdere pollendiversitet. Bunnmonterte pollenfeller ble installert på kolonier på flere steder for hver avling (figur 1A). Mengden pollen samlet fra hvert sted var nok til å oppfylle prøvevektkravene til fargesortering og acetolyseanalysemetoder. Hver pollensamlingsprøve hadde flere distinkte fargegrupper (figur 2 og figur 3). I noen prøver inneholdt pollenfargegrupper så få som 4-5 pellets; Imidlertid hadde de fleste gruppene betydelig mer enn det og fungerte dermed som sin egen merkede fargegruppe for acetolyse (figur 4 og figur 5). Etter acetolyse (figur 6) ble lysfeltsmikroskopi brukt for effektivt å identifisere hver fargegruppe til lavest mulig taksonomisk rangering ved å bekrefte de morfologiske egenskapene med bilagsprøver samlet inn fra området rundt hvert studiested (figur 7).

Figur 1: Pollenfeller installert på en honningbiekoloni for å samle korbikulær pollen . (A) Bunnmonterte feller plassert over bikubebunnbrettet og rett over den laveste bikubeboksen. Andre pollenfelle stiler inkluderer (B) front-mount og (C) auger-hole inngangsfeste feller. Klikk her for å se en større versjon av dette tallet.

Figur 2: Fangstmekanisme og oppsamlingsbrett for pollenfelle. Returnerende pollenforagere må klemme seg gjennom maskefangstmekanismen før de når bikuben. Klikk her for å se en større versjon av dette tallet.

Figur 3: Oppsamlingsbrett med pollenfelle. Corbicular pollen skrapes av beina til returnerende pollenforagere av pollenfellen og faller inn i oppsamlingsbrettet. Klikk her for å se en større versjon av dette tallet.

Figur 4: Sortere en prøve av korbikulær pollen i fargegrupper. Corbicular pollen kan tørkes og veies etter at den er sortert i fargegrupper for å rapportere proporsjoner av forskjellige fargepellets samlet. Klikk her for å se en større versjon av dette tallet.

Figur 5: Fire grupper pollenpellets sortert etter farge ved hjelp av Pantone-fargeguiden. Fargegruppene er merket som (A) grå, Pantone 5855C, (B) brun, Pantone 7557C, (C) gul, Pantone 458C og (D) lysebrun, Pantone 3547C. Klikk her for å se en større versjon av denne figuren.
Figur 6: Oppsett av acetolyseutstyr inne i avtrekksviften. Varmeblokken, reagenser, løsemiddelavfall og syreavfallsbeholdere, merkede beger, pipette, pipettespisser, rørepinner og mikrosentrifugerør som ligger inne i avtrekkshetten. Klikk her for å se en større versjon av dette tallet.
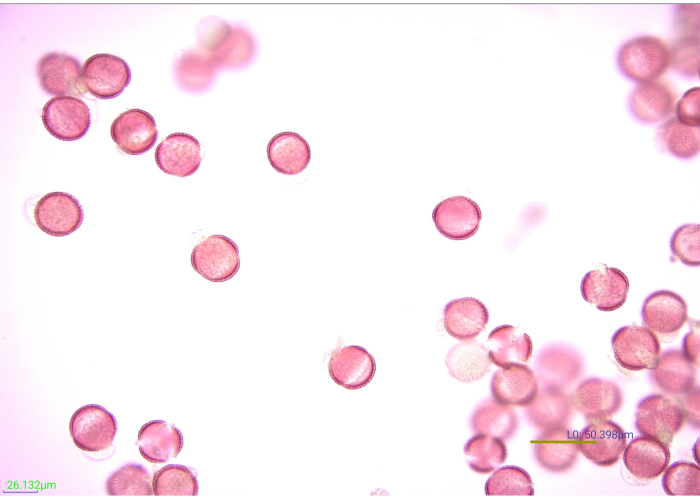
Figur 7: Mikrografi av fargede, acetolyserte pollenkorn. Mange fasetter av acetolysert sennep (Brassicaceae) pollenkorn ved 40x forstørrelse. Skala bar = 50.398 μm. Vennligst klikk her for å se en større versjon av denne figuren.
Pollen samlet fra mandelavlingssteder hadde relativt lavere pollendiversitet enn pollen samlet inn fra andre avlinger, med et gjennomsnitt på 3,0 ± 0,5 pelletsfarger og 3,2 ± 1,2 plantetaxa per sted (tabell 2) 14. De resterende fire beskjæringssystemene hadde høyere pollendiversitetsnivåer med et gjennomsnitt på 6,0 ± 2,0 pelletsfarger og 8,0 ± 1,5 plante taxa per sted i kirsebær, 8,8 ± 1,4 pelletsfarger og 13,5 ± 2,0 plante taxa per sted i highbush blåbær, 7,0 ± 1,0 pelletsfarger og 11,0 ± 0,0 plante taxa per sted i hybrid gulrot, og 10,0 ± 0,0 pelletsfarger og 13,0 ± 1,5 plante taxa per sted i meadowfoam14.
| Avling | Gjennomsnittlig antall pollenpelletsfarger/sted (SE) | Gjennomsnittlig antall plantetaksa/lokalitet (SE) | Sum taksa identifisert | ||
| Familie | Slekt | Art | |||
| Mandel | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| Blåbær | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| Gulrot | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| Kirsebær | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| Engfoam | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
Tabell 2: Mangfold av korbikulær pollen samlet fra honningbier i fem beskjæringssystemer. Mangfoldsmålinger inkluderer gjennomsnittlig antall pelletsfarger (± SE), gjennomsnittlig antall plantetaxa (± SE) og total taksa identifisert. Denne tabellen er endret fra14. Forkortelse: SE = standardfeil.
Ulike pollenfellestiler har sine egne fordeler og konsekvenser. Fordelene og begrensningene til fire vanlige fellestiler, (1) frontmontering, (2) bunnmontering, (3) skruehull og (4) toppmonterte pollenfeller diskuteres nedenfor. Frontmonterte feller er den mest allsidige stilen (figur 1B). Installasjonen er rask og enkel; det kan gjøres uten å løfte bikubebokser, og disse fellene kan passe på hvilken som helst Langstroth-stil med bikubeutstyr. Når oppsamlingsbrettet sitter foran kolonien, samler det minimalt med rusk fra kolonien. Oppsamlingsbrettet er imidlertid også mer utsatt for eksterne elementer - fuktighet fra feltvanning, regnfullt eller fuktig vær, eller dugg kan komme i kontakt med pollen gjennom oppsamlingsbrettet, noe som potensielt gjør pollen ubrukelig hvis pellets blir for mettet til å skille seg. Risikoen for pollenmetning kan reduseres ved å unngå fangst under forventede hendelser med regn eller høy luftfuktighet. Hvis du plasserer en gummimatte under fellen og ekstra dekkmateriale (f.eks. takfilt) på toppen av pollenfellen, kan du også beskytte oppsamlingsbrettet mot vær og vind.
Bunnmonterte feller ble brukt til å samle pollen til dataene i denne artikkelen (figur 1A). De er ikke like praktiske å installere fordi de må plasseres under koloniens brødrede. Installasjon er tidkrevende og resulterer i et høyt volum av rusk som faller inn i fellen fra kolonien, for eksempel biedeler og små biter av voks. Gulvet i oppsamlingsbrettet for de fleste produserte bunnmonterte feller er laget av fint nett, noe som gir riktig ventilasjon for å beskytte den oppsamlede pollen mot fuktighet. Auger-hull pollen feller bidra til å minimere desorientering av foragere hvis de primært bruker skruehull som bikube innganger i stedet for inngangen laget av bunnen av bikube (figur 1C). Siden oppsamlingsbrettet for pollenfeller med skruehull er svært lite, må det tømmes ofte for å unngå at oppsamlingsbrettet renner over. Gitt sin øvre plassering på en bikube, er den toppmonterte pollenfellen den enkleste fellestilen å installere og fjerne, og den innsamlede pollenprøven er fri for bikuberester. Imidlertid er denne fellestilen ekstra følsom for skadet bikubeutstyr, da oppsamlingsbrettet vil bli utsatt for fuktighet hvis lokket, innerdekselet og den øvre bikubeboksen ikke er ordentlig forseglet sammen.
Protokollene beskrevet her krever utvelgelse av kolonier med store voksen- og larvepopulasjoner (trinn 1.2). Denne seleksjonsmetoden er ment å produsere svært store mengder fanget pollen fra disse koloniene. Kolonier med betydelige beitebestander kan oppleve stor trengsel ved inngangen ved felleinstallasjon. Å velge en stor bikubeinngang vil lindre overbelastning. Store beitepopulasjoner kan også samle svært store mengder pollen som kan overstige grensene for oppsamlingsbrettet. Bruk voluminøse oppsamlingsbrett, som vist med de fleste bunn- eller toppmonterte fellestiler, og tomme skuffer ofte for å få plass til store mengder fanget pollen. Hvis ønsket forskningsmål er å vurdere pollenmengder samlet inn av kolonier i en bigård, velger du representative kolonier i stedet for å optimalisere voksen- og larvepopulasjonene for seleksjon. Alle stiler av pollenfeller blokkerer bikubeinngangen og skaper en ny inngang som skiller seg romlig fra den opprinnelige inngangen16. Pollenfeller klarer ofte ikke å samle pollen når foragere ikke klarer å reorientere seg til den nye inngangen til pollenfellen ved installasjon. Disse foragerne driver lett til nærliggende elveblest, potensielt kryssforurensende andre polleninnsamlingsprøver hvis de går inn i en annen bikube med en pollenfelle. Derfor bør sankere gis minst 24 timer for å akklimatisere seg til den nye inngangen ved å holde fangstmekanismen frakoblet etter installasjon. Valg av kolonier med få eller ingen ekstra bikubeinnganger reduserer også forvirring når man orienterer seg mot den nye pollenfelleinngangen.
Ytterligere bikubeinnganger (f.eks. hull og vridde lokk) bør forsegles, men risikoen for at foragere driver til nærliggende elveblest vil øke med disse inngangene til stede ved starten av felleinstallasjonen. Foragere vil også lett drive inn i andre bikubeinnganger hvis en pollenfelle bare er installert på en enkelt bikube i en klynge av palleterte elveblest. Foragere er mindre sannsynlig å drive hvis alle elveblestene som vender mot samme retning på pallen, har feller installert. Toppmonterte pollenfeller kan utgjøre en høyere risiko for biedrift på grunn av den store avstanden mellom pollenfelleinngangen og bikubens opprinnelige inngang. For denne studien ble pollenfeller installert på flere honningbiekolonier i hvert eksperimentelt sted for å ta hensyn til variasjon i pollenmengde og taxa-sammensetning mellom hver honningbiekoloni. Pollenfeller bør derfor installeres på flere kolonier for å oppnå robuste pollensamlinger fra landskapet fordi pollensamlingen kan variere mye mellom kolonier basert på planteartstype og total samlet mengde12,13. Hver pollenprøve hadde en innsamlingsperiode på 7 dager. I fremtidige studier vil innsamling av pollen i to eller tre påfølgende 72-timers intervaller øke nøyaktigheten av pollenfôrestimering40.
Siden det er en høy grad av tidsmessig svingning i pollensamlingen, kan pollenestimeringsnøyaktigheten økes ved å gjenta polleninnsamlingsprosessen i tidlige, topp- og sene blomstringsperioder av de målrettede beskjæringssystemene24,27,39. Pollen bør samles inn fra flere steder, om enn samme beskjæringssystem eller landskapstype, på grunn av forventet variasjon i mengde og planteartstype mellom apiary-steder 14,27,33,43. Langvarig pollenfangst kan være skadelig for honningbiekolonier. Potensielle effekter inkluderer redusert oppdrett av brød, forkortelse av larvevekstperioden og kannibalisme av egg og unge larver i elveblestene 19,44,45,46. Lengre perioder med pollenfangst, som hele vekstsesongen, kan forverre skadevirkningene på oppdrett i kolonier. Pollenfangst kan også føre til en reduksjon i honningproduksjonen og en økning i fuktighetsnivået til lagret honning13. Roterende pollenfeller mellom kolonier i en bigård når man kontinuerlig overvåker et landskap eller beskjæringssystem, kan redusere skade på kolonier som brukes til pollenfangst. Å engasjere pollenfeller annenhver uke vil redusere skadelige virkninger, spesielt tap i honningproduksjon, hvis du fanger pollen på de samme koloniene gjennom en periode13.
I tillegg er pollenfellene fortrinnsvis plassert på sterke kolonier. Av og til kan pollenfellene engasjere seg utilsiktet. Dette kan unngås ved å låse pollenfellemekanismen når pollenfelleoppsamling ikke er ønsket. Pollenfeller fjerner ikke all korbikulær pollen fra honningbi-foragere. Fangsteffektiviteten avhenger av felletype, pollenpelletsstørrelse, biekroppsstørrelse, tid på dagen og værforhold. Korbikulær pollensamling er derfor ikke konsistent ved bruk av pollenfeller for ulike plantearter og innsamlingsperioder25,26. Mindre pollenpellets fra planter som Eucalyptus spp. og Tamarix spp. er mindre sannsynlig å bli fanget av pollenfeller27. Spesielt ble det ikke funnet noen highbush blåbær (Vaccinium corymbosum L.) pollen fra highbush blåbærsamlingsstedene i denne studien, noe som støtter tidligere bevis på at highbush blåbærpollenpellets er for små for pollenfellesamling47. I motsetning til dette ble pollen hentet fra løvetann (Taraxacum officinale F.H. Wigg) funnet i alle beskjæringssystemer i denne studien. Pollenpellets av noen plantearter kan også være mye større enn andre, for eksempel Taraxacum spp., og kan muligens være overrepresentert i analysen av pollensamlinger fra pollenfeller27. Fangst av individuelle pollenforagere og manuell fjerning av deres korbikulære pollen vil øke nøyaktigheten av en pollenkildevurdering, men det er svært tids- og ressurskrevende sammenlignet med bruk av pollenfeller (tabell 1). Sortering av pollenpellets i fargegrupper er relativt rett frem, selv om det er tidkrevende. Med mindre det er et bestemt forskningsmål eller mål, bør mengden pollenpellets begrenses til 10 g eller mindre (for en gitt prøve) for sortering i fargegrupper. Sortering av hele prøver som inneholder større mengder enn dette beløpet, vil drastisk øke tiden som kreves for å fullføre analysen. Det er imidlertid avgjørende at en pollenprøve er svært godt blandet før en delprøve for fargesortering tas fra den. Hvis den opprinnelige prøven ikke blandes, kan det føre til en delprøve som ikke er representativ for helheten, noe som bør unngås.
Hvis den originale prøvebeholderen ikke inneholder nok ledig plass til å tillate grundig blanding av pollenpellets, bør det være tilstrekkelig å plassere hele prøven i en stor plastpose eller en liten papirpose, selv for store prøver. Hard plast, lokkede beholdere vil også fungere. Blanding av prøven skal gjøres forsiktig, slik at pollenpellets ikke blir klemt eller på annen måte ødelagt. Utilsiktet skjevhet kan ubevisst overtale en til å øse ut "de vakre lilla pellets", for eksempel når man fjerner en subsample fra det hele. Derfor bør prøvens fargesammensetning skjules mens du øser ut en delprøve. På denne måten er det mer sannsynlig å få en subsample som virkelig er representativ for helheten. Denne subsamplingsmetoden kan imidlertid mislykkes i å velge pollenpellets som har lav overflod i prøven. Derfor, hvis det er et forskningsmål å identifisere hvert enkelt plantetakson som er representert i prøven, vil det ikke være hensiktsmessig å samle inn en delprøve; hele prøven må analyseres. Derfor bør pellets sorteres i en glass petriskål. Når sorteringen er fullført, kan passende sider i Pantone-fargeguiden plasseres under parabolen for å gjøre fargetilpasning mellom guiden og den sorterte pollenen enklere. Et eksempel på dette er illustrert i figur 5.
Ved fangst av pollen fra honningbiekolonier plassert i avlinger for pollinering, bør ikke mer enn ti totale fargegrupper brukes: ni individuelle farger og en "diverse" fargegruppe sammensatt av minoritetsfargene i prøven. Å sette en rimelig grense for maksimalt antall fargegrupper som en prøve kan deles inn i, forhindrer forskeren i å bli sittende fast ved uendelig å skille pellets i stadig økende antall ekstremt spesifikke grupper, som, når sorteringen er fullført, kanskje ikke individuelt inneholder tilstrekkelige mengder for acetolyse. Hvis fangst fra kolonier som sannsynligvis foraging fra et svært variert utvalg av plantearter, kan det være nødvendig med flere fargegrupper, og protokollene bør optimaliseres for å gjenspeile dette kravet. Den nåværende studien fokuserte på pollenprøver samlet fra honningbiekolonier som pollinerte avlinger, og flere taxa ble ofte funnet i en fargegruppe, lik tidligere studier 29,30,31.
Acetolyse løser lipider, proteiner og organisk rusk fra overflaten av pollenkorn, og avslører de karakteristiske tegnene til eksinen, slik at kornene lettere kan farges og identifiseres. Det er en gammel og vanlig metodikk som brukes i mange typer pollenforskning37. De generelle trinnene er standardiserte; de varierer lite fra protokoll til protokoll. Imidlertid kan spesifikasjonene av sentrifugeringshastigheter og -tider, inkubasjonstemperatur og varighet, pollenmengdedrevne reagensvolumer og til og med supernatant fjerningsmetode (dekantering vs pipettering) måtte optimaliseres eksperimentelt i henhold til forskningsmål og til en viss grad hvilke typer pollen som sannsynligvis vil oppstå48. Faktisk kan acetolyse fjerne viktige diagnostiske tegn på pollen fra noen taxa som Malvaceae og Orchidaceae38. Derfor er ikke alt pollen mottagelig for standardmetoder for acetolyse. Som nevnt ovenfor ble disse metodene optimalisert i denne studien med det formål å identifisere dominerende plantetaksonkilder til pollen samlet inn av avlingsbestøvende honningbier. Detaljer som skal vurderes hvis presis kvantifisering av pollenkorn er en del av studien, har ikke blitt adressert i denne artikkelen.
Bruk av løsemidler og syrer krever nøye planlegging, riktig personlig verneutstyr (PPE) og ansvarlig avfallshåndtering (figur 6). Det er viktig at forskere bestemmer den riktige måten å lagre reagenser og avhende avfall før de begynner noen del av acetolyse. I dette laboratoriet brukes butylhansker under alle deler av prosessen som involverer svovelsyre og til og med iseddik, da de har langt bedre nedbrytnings- og permeasjonsverdier for begge syrer enn nitrilhansker, mens de ikke kompromitterer fingerferdighet49. Det vil være klokt å konsultere den respektive institusjonens sikkerhetsretningslinjer for anbefalinger om passende hansker og annet PPE49. Glacial eddiksyretilsetning før acetolysetrinnet bidrar til å fjerne restfuktighet i prøven og forbereder den på den viktige acetolysereaksjonen. Iseddik-svovelsyreblandingen i acetolysetrinnet kan reagere voldsomt med vann, og derfor er det viktig at alt glass og forsyninger er helt tørt, og at all fuktighet fjernes fra prøven før acetolyse. Post-acetolysetilsetningen av iseddik fortynner og nøytraliserer acetolyseblandingen.
Spesielt etanol og iseddik kan oppløse blekket på mikrosentrifugerøretiketter hvis disse reagensene drypper på utsiden av røret, selv med løsemiddelresistente penner. Sjekk røretikettene ofte gjennom hele prosessen for å være sikker på at de fortsatt er leselige. Hvis det er logistisk mulig, bør du vurdere å bruke LaserJet-trykte etiketter som en beskyttelse mot denne muligheten. Måten supernatanter dekanteres på, vil påvirke om reagenser drypper ned på utsiden av mikrosentrifugerørene. Det er viktig å dekantere supernatanten med en trygg, glatt hånd, som følger med praksis. Det må utvises forsiktighet for å unngå tap av pollenprøver fra sentrifugerøret under dekantering. Dekantering for fort risikerer å miste noen eller alle pollenrester; dekantering for sakte kan føre til at supernatanten renner ned i røret. Selv om en inkubasjonstemperatur på 100 ° C vanligvis anbefales, kan pollen lett bli "overkokt" ved den temperaturen i mengdene som brukes i denne studien (0,25 g), spesielt hvis det inkuberes i litt lengre varighet29. Faktisk, selv ved 80 ° C, kan pollenkorn sprekke eller på annen måte bli skadet hvis de blir igjen i acetolyseblandingen for lenge. Inkubasjonstemperatur og varighet må bestemmes nøye for å unngå å ødelegge pollenkornene i prøven.
Farging av pollen øker definisjonen og kontrasten til eksinefunksjonene, noe som gjør det enklere å fotografere og identifisere (figur 7). Fem dråper (fra en plastoverføringspipette) på 1% Safranin O farget effektivt 0,25 g pollen. Imidlertid flekker forskjellige pollen annerledes. Hvis pollenkorn er farget for lett eller for tungt, kan identifisering være vanskelig. Når det er mulig, bør volumet av flekkløsningen som er nødvendig for å fargelegge pollenarten som forventes å bli funnet i studien, valideres før behandlingen av de eksperimentelle prøvene påbegynnes. Likevel, hvis en av de eksperimentelle prøvene ikke er riktig farget, kan den korrigeres. For å lette en pollenprøve som er farget for tungt, skyll prøven med vann og deretter etanol. Hvis pollen ikke er farget godt nok til å se kjennetegn, kan noen ekstra dråper flekk tilsettes. Flekken av disse prøvene bør kontrolleres før tilsetning av glyserin. På samme måte kan det være nødvendig med litt prøving og feiling for å bestemme det ideelle volumet av glyserin for pollenrester. Femten dråper glyserin beskyttet prøvene i denne studien på en passende måte mot uttørking, samtidig som pollenrestene fortynnes til en konsentrasjon som er ideell for nedstrøms identifikasjon via lysmikroskopi. Andre mengder pollenrester kan kreve mer eller mindre glyserin for å forhindre uttørking og lette montering.
Forfatterne har ingenting å avsløre.
Vi takker Dr. Gretchen Jones (USDA-ARS, APMRU, College Station, TX) for å bistå med fargesortering og acetolyseanalyse. Denne forskningen ble støttet av forskningsmidler gitt til RRS av Oregon State Beekeepers Association.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved