Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Сбор и идентификация пыльцы из пчелиных семей
Описаны методы сбора корбикулярной пыльцы у медоносных пчел, а также протоколы сортировки цветов, ацетолиза и микроскопической подготовки пыльцы для таксономической идентификации. Кроме того, мы представляем цвет гранул и таксономическое разнообразие корбикулярной пыльцы, собранной из пяти систем земледелия с использованием пыльцевых ловушек.
Исследователи часто собирают и анализируют корбикулярную пыльцу от медоносных пчел, чтобы определить растительные источники, на которых они питают пыльцу, или оценить воздействие пестицидов на пчел с помощью пыльцы. Здесь описан эффективный метод улавливания пыльцы для сбора корбикулярной пыльцы у медоносных пчел, возвращающихся в свои ульи. Этот метод сбора приводит к большому количеству корбикулярной пыльцы, которая может быть использована в исследовательских целях. Медоносные пчелы собирают пыльцу со многих видов растений, но обычно посещают один вид во время каждой поездки по сбору. Поэтому каждая корбикулярная пыльцевая гранула преимущественно представляет один вид растений, и каждая пыльцевая гранула может быть описана по цвету. Это позволяет сортировать образцы корбикулярной пыльцы по цвету для разделения растительных источников. Исследователи могут дополнительно классифицировать корбикулярную пыльцу, анализируя морфологию ацетолизованных пыльцевых зерен для таксономической идентификации. Эти методы обычно используются в исследованиях, связанных с опылителями, таких как эффективность опыления, динамика кормления опылителей, качество диеты и разнообразие. Представлены подробные методики сбора корбикулярной пыльцы с помощью пыльцевых ловушек, сортировки пыльцы по цвету, ацетолизации пыльцевых зерен. Также представлены результаты, относящиеся к частоте цветов гранул и таксонов корбикулярной пыльцы, собранной у медоносных пчел в пяти различных системах земледелия.
Западная медоносная пчела (Apis mellifera L.) является важным опылителем многих сельскохозяйственных культур, которые зависят от опыленияпчелами 1. За более чем десятилетие сообщалось о значительных потерях колоний медоносных пчел 2,3,4,5,6,7,8,9. Несколько факторов, включая паразитов и болезни, плохое питание и пестициды, были вовлечены в снижение этих колоний10. Плохое питание можно объяснить интенсификацией сельского хозяйства и потерей кормовой средыобитания 11. Крайне важно понимать цветочные ресурсы, используемые пчелами в различных ландшафтах, чтобы улучшить питание пчел и помочь в усилиях по сохранению пчел. Пыльца является основным источником белка, липидов, витаминов и минералов для пчел и использовалась во многих сельскохозяйственных и экологических исследованиях для понимания предпочтений медоносных пчел в кормлении на уровне колоний, оценки влияния улавливания пыльцы на колонии медоносных пчел и определения воздействия пестицидов на пчел 12,13,14.
Медоносные пчелы собирают пыльцу с цветов, упаковывают пыльцу в гранулы на своей корбикуле — большеберцовой пыльцевой корзине на заднем дне — и возвращаются в колонию для хранения. Корбикулярную пыльцу можно удалить у фуражиров, захватив их у входа в улей или на цветы, ненадолго охладив их, чтобы обездвижить их, а затем удалив пыльцевые гранулы с задних ног щипцами. Трудоемкий процесс ручного сбора корбикулярной пыльцы от индивидуально захваченных фуражиров медленный и неэффективный, если требуется большое количество пыльцы. Более простым и эффективным методом сбора больших объемов пыльцы является улавливание корбикулярных пыльцевых гранул у медоносных пчел у входов в ульи. Пыльцевые ловушки предназначены для вытеснения корбикулярной пыльцы с ног возвращающихся пыльцевых собирателей, когда они попадают в улей15. Фуражиры должны протискиваться через сетчатые отверстия, которые имеют размер, чтобы узко пропускать тело работника медоносной пчелы.
Когда медоносная пчела проходит через одно из этих отверстий, более крупные гранулы пыльцы соскребаются с ее ног и попадают в лоток для сбора16. Исследования показали, что улавливание пыльцы стимулирует фуражиров собирать больше пыльцы, тем самым повышая эффективность опыления окружающих культур и растительности 17,18,19,20. Методологии сбора пыльцы также могут быть использованы для понимания корма, используемого медоносными пчелами в ландшафте, в качестве первого шага к определению количества, качества и таксонов видов цветковых растений. Таким образом, эффективные методологии улавливания пыльцы облегчают как опыление, так и исследования в области питания медоносных пчел. Сравнение этих методов сбора пыльцы проиллюстрировано в таблице 1. Поведение пыльцы при кормлении будет меняться в зависимости от потребности колонии в хранимой пыльце относительно уровня популяции яиц и личинок21,22. Поскольку эти изменения включают в себя различную интенсивность сбора, часто ожидается большое изменение количества пыльцы среди колоний в одном и том же месте и между различными местами одной и той же системы земледелия или ландшафтного типа23,24. Увеличение количества колоний и мест для улавливания пыльцы поможет приспособиться к этой вариации.
Пыльцевые ловушки различаются по эффективности25,26. Размер гранул пыльцы, собранных медоносными пчелами, варьируется в зависимости от вида растений и может меняться в зависимости от уровня запасов пыльцы в колонии27,28. Это создает вероятность того, что меньшие гранулы пыльцы будут недопредставлены, а более крупные гранулы будут перепредставлены в образцах, собранных с помощью пыльцевых ловушек. Взрослые пчелы различаются по размеру тела, что также может повлиять на представление пыльцы, собранной в ловушках. Существуют также виды растений, которые преимущественно производят нектар, который не будет обнаружен, если только оценить собранную пыльцу в некоторых ландшафтах. На эффективность улавливания также влияет дрейф и дезориентация фуражиров, на которую влияет тип пыльцевой ловушки и состояние оборудования улья. Эту проблему можно смягчить, используя методы, указанные в настоящем документе. Исследователи могут рассмотреть дополнительные методы исследования, такие как подсчет посещений цветков фуражирами, чтобы дополнить результаты предпочтений кормления на уровне колоний. Полезным методом оценки разнообразия пыльцы является сортировка корбикулярной пыльцы по цвету. Хотя медоносные пчелы являются универсальными фуражирами, они также демонстрируют цветочную верность, когда они собирают пыльцу с одних и тех же видов растений в одном и том же месте во время любой данной поездки по сбору. Исходя из такого пищевого поведения, предполагается, что любая данная корбикулярная пыльцевая гранула преимущественно представлена одним видом растений 27,29,30,31. Следовательно, ученые могут описать разнообразие пыльцы, отсортировав корбикулярную пыльцу по цвету гранул и сообщив общее количество обнаруженных цветов или долю от общего числа, представленного каждой цветовой группой 12,32,33,34. Это может быть достигнуто путем измерения массы или количества гранул каждой цветовой группы. Измерение количества гранул каждой цветовой группы предлагается, если есть известные или предполагаемые систематические различия в весе гранул из разных таксонов. Систематические различия могут быть вызваны размером гранул или количеством нектара, который фуражиры добавляют в пыльцу при формировании гранулы.
Сортировка цветов является эффективным по времени и простым процессом, но может не иметь приемлемой точности для некоторых исследований опыления, потому что разные таксоны растений могут иметь одинаковые цвета пыльцевых гранул35,36. Кроме того, существует логистическое ограничение на количество различных цветовых групп, на которые могут быть разделены гранулы пыльцы. Таким образом, разделение пыльцы каждого отдельного таксона растения на отдельную цветовую группу гранул не всегда возможно в исследованиях опыления. Морфологическая характеристика пыльцевых зерен с помощью световой микроскопии часто дополняет цветовое разделение гранул, различая пыльцу двух и более таксонов в гранулах одной цветовой группы. Хотя обычно можно найти пыльцевые зерна нескольких таксонов в данной цветовой группе пыльцевых гранул, отдельные гранулы пыльцы, собранные медоносной пчелой, обычно составляют один преобладающий таксон, возможно, с другими таксонами в незначительных количествах. Таким образом, принято считать таксономическую точность в корбикулярных пыльцевых гранулах медоносных пчел. Гранулы пыльцы от других опылителей, которые не проявляют поведения цветочной верности, таких как шмели, часто содержат много видов растений и могут не обладать преобладающим таксоном. В тех случаях, когда желательны количественные оценки пропорций таксонов в гранулах полифлорной пыльцы, для правильного анализа дополнительно требуются микроскопические методы, включающие ацетолиз.
Оценка морфологических характеристик ацетолизованных пыльцевых зерен является наиболее распространенным методом таксономической идентификации16. Процедура ацетолиза удаляет протоплазму пыльцевого зерна для выявления диагностических характеристик, которые можно наблюдать при световой микроскопии37,38. Используя этот метод, исследователи могут сообщать о различных таксонах, частоте таксонов, обнаруженных в конкретных системах земледелия, и преобладающих таксонах цветов гранул33,36. Ацетолиз является лучшим аналитическим методом выявления морфологии пыльцы28. Однако некоторые ацетолизированные пыльцевые зерна, такие как многие типы Rosaceae, не могут быть идентифицированы на уровне рода или вида только с помощью ацетолиза и световой микроскопии. Исследователи рассматривают сканирующую электронную микроскопию или метабаркодирование в качестве альтернативных методов для достижения идентификации на уровне рода или вида. Эти альтернативные методы, однако, обеспечивают только качественную идентификацию таксонов и не позволяют оценить пропорции различных таксонов пыльцевого зерна в полифлорных пыльцевых гранулах36,39. Кроме того, расходы и необходимые знания значительно выше для этих методов. Сравнение этих методов идентификации проиллюстрировано в таблице 1.
| Методика | Время | Расход | Резолюция | Экспертиза |
| Сбор пыльцы | ||||
| Улавливание пыльцы | Низкий | Умеренный | Переменная | Умеренный |
| Сбор пыльцы фуражиров | Высокий | Умеренный | Высокий | Низкий |
| Идентификация пыльцы | ||||
| Визуальный (только цветовая сортировка) | Умеренный | Низкий | Низкий | Низкий |
| Ацетолиз | Умеренный | Умеренный | Умеренный | Умеренный |
| Сканирующая электронная микроскопия | Высокий | Высокий | Высокий | Высокий |
| Метабаркодирование | Переменная | Высокий | Высокий | Высокий |
Таблица 1: Сравнение различных методов сбора и идентификации пыльцы на основе времени, затрат, разрешения и опыта. Визуальные методы (только сортировка цветов) сообщают общее количество обнаруженных цветов или долю от общего числа, представленного каждой цветовой группой, в качестве метрики для определения источников пыльцы, но не предоставляют идентификацию таксона.
Доступная информация о улавливании и сортировке пыльцы и ацетолизирующих пыльцевых зерен разнообразна и часто распространяется по нескольким источникам, различным для исследователей в разных областях. Эта статья предлагает подробное представление о различных типах пыльцевых ловушек, которые могут быть использованы как исследователями, так и пчеловодами для эффективного сбора больших объемов корбикулярной пыльцы. Также предусмотрены протоколы подготовки образцов пыльцы - путем ацетолиза, окрашивания и монтажа слайдов - для идентификации таксонов растений. Методологии, подробно описанные здесь, являются всеобъемлющими и служат уникальным ресурсом для выявления преобладающих видов растений, на которых кормятся медоносные пчелы в данном ландшафте, особенно в системах земледелия. Результаты, основанные на этих методах из предыдущего исследования, были представлены и документируют разнообразие цветов пыльцевых гранул и таксонов растений из корбикулярной пыльцы, собранной медоносными пчелами в пяти системахземледелия 14.
1. Сбор корбикулярной пыльцы из пчелиных семей с помощью пыльцевых ловушек
- Определите, когда улавливать пыльцу с нужного места пасеки.
ПРИМЕЧАНИЕ: Идеальные климатические условия включают полное пребывание на солнце, низкие скорости ветра, низкую влажность и отсутствие прогнозируемых осадков в течение желаемого периода сбора пыльцы. - Подберите оптимальные пчелиные семьи для улавливания пыльцы в пределах пасеки.
- Оцените силу колонии, подсчитав фуражиров, возвращающихся ко входу в колонию в течение 2 минут. Выберите колонии с наибольшим общим числом возвращающихся фуражиров.
- Выбирайте ульи с деревянной посудой, которая находится в хорошем состоянии, желательно без лишних входов и искривленных крышек. Используйте колонии с меньшим количеством альтернативных входов, так как они имеют повышенную вероятность возвращения фуражиров, переориентирующихся на вход в ловушку.
- По возможности выбирайте входы в улей, выходящие на юг. Если ульи упакованы на паллеты, установите пыльцевые ловушки на каждой колонии, обращенной в одном и том же направлении на данном поддоне, чтобы избежать дрейфа фуражиров в соседние входы ульев.
- При желании оцените расплодное гнездо колонии, осмотрев рамки на наличие личинок. Выбирайте колонии с относительно большим количеством личинок.
- Установите пыльцевые ловушки на выбранные пчелиные семьи.
ПРИМЕЧАНИЕ: Установка будет отличаться в зависимости от типа пыльцевой ловушки. Типы включают в себя а) переднее крепление, б) нижнее крепление, в) верхнее крепление или г) входное крепление со шнековым отверстием. Подробности см. в разделе обсуждения.- Для ловушек с передним креплением прикрепите ловушку перед входом с помощью скоб, винтов и ленты или подключите ловушку к шнурам тарзанки, обернутым вокруг улья. Для ловушек с нижним креплением поместите ловушку под самым низким ящиком улья и закрепите вход в ловушку рядом с оригинальным входом. Для ловушек с шнековым отверстием прикрепите ловушку непосредственно перед шнековым отверстием ульевого ящика с помощью скоб, винтов и ленты. Для ловушек верхнего крепления поместите ловушку над самым верхним ящиком улья и ниже крышки.
- Запечатайте все другие возможные входы в колонию с помощью неадгезивного и формуемого материала, такого как латекс или полиуретан, или аппаратную ткань No 8 (отверстие 2,7 мм) для отверстий шнека. Используйте клейкую ленту для небольших трещин.
- При использовании ловушек с передним креплением установите барьер, такой как резиновый коврик, между корзиной для сбора и травой, чтобы избежать повреждения влагой от росы.
- Включите механизм улавливания пыльцевой ловушки через 24 часа после установки и до начала дневного кормового полета (поздним вечером / ранним утром).
ПРИМЕЧАНИЕ: Этот шаг идеален, но не обязателен. Задействуйте пыльцевые ловушки каждые две недели, если вы захватываете пыльцу на одних и тех же колониях в течение определенного периода. - Соберите корбикулярную пыльцу из лотка для сбора, поместите ее в полиэтиленовые пакеты или трубки центрифуги и храните в холодильнике со льдом.
- Чтобы оценить разнообразие и численность видов пыльцы, например, исследования питания на уровне ландшафта, соберите пыльцу за два или три 72-часовых интервала40.
- Для анализа остатков пестицидов собирают пыльцу с интервалом от 24 ч до 96 ч с минимум 3 г для обработки41.
- Очистите пыльцу, удалив части пчел и другой мусор улья.
ПРИМЕЧАНИЕ: Используйте одноразовые перчатки при обработке образцов пыльцы и меняйте одноразовые перчатки между образцами. Используйте отдельные инструменты для удаления мусора из пыльцы, собранной в каждой ловушке. Промыть и высушить перед использованием инструментов для другой партии захваченной пыльцы. - Хранить пыльцу при -20 °C или ниже для поддержания ее композиционной целостности, если пыльца предназначена для идентификации источника пыльцы, количественной оценки или анализа остатков пестицидов41,42.
- После удаления ловушек из ульев стерилизуйте все оборудование в 5% растворе отбеливателя, промойте и высушите оборудование перед следующим использованием.
2. Сортировка цвета пыльцевых гранул для идентификации источника пыльцы и оценки количества
- Убедитесь, что для работы имеется не менее 20 г образца пыльцы. Тщательно перемешайте образец пыльцы в его пакете или другом контейнере подходящего размера, чтобы получить однородную смесь всех содержащихся в нем гранул. Чтобы избежать непреднамеренного смещения на следующем шаге, затемните цветовую композицию образца из поля зрения, прежде чем удалять подвыборку из пакета с образцом.
- Используя совок или большую ложку, вычерпните 10 г пыльцы в качестве репрезентативного подвыборки целого. Медленно вылейте гранулы из скупера на весы, пока дисплей не покажет 10 г. Если первая мерная ложка была недостаточно большой, извлеките другую мерную ложку из образца таким же образом.
ПРИМЕЧАНИЕ: Эти конкретные требования к весу (20 г и 10 г) служат только примерами. Исследователи должны корректировать количество пыльцы, используемой на каждом этапе, в соответствии с конкретными потребностями. - Удалите все части пчелы и другой мусор из подвыборки весом 10 г. Затем, при необходимости, добавляют немного больше пыльцы из исходного образца для достижения общей массы 10 г подвыборки.
- Отсортируйте каждую пыльцевую гранулу из подвыборки весом 10 г в цветовую группу. Используйте как цвет пыльцы, так и текстуру, чтобы различать цветовые группы.
ПРИМЕЧАНИЕ: Ожидаются некоторые изменения внутри группы, но использование руководства по цвету Pantone во время сортировки может повысить согласованность. - Чтобы обеспечить по меньшей мере 0,25 г каждой цветовой группы для последующих этапов, поместите любые гранулы, которые недостаточно многочисленны, чтобы сформировать цветовую группу не менее 0,25 г, в другую группу. Назовите каждую отдельную цветовую группу с помощью руководства по цветам Pantone. Пометьте группу разное.
- Взвесьте каждую цветовую группу на отдельной весовой бумаге и/или подсчитайте количество гранул в каждой цветовой группе. Запишите имена и веса цветовых групп или счетчики в таблице.
ПРИМЕЧАНИЕ: Выбор того, взвешивать или подсчитывать количество гранул в каждой цветовой группе, зависит от метрики интереса исследователя и целей проекта. - Создайте этикетку микроцентрифуги для каждой цветовой группы, используя устойчивые к растворителям ручки и клейкие бумажные трубки. Включите в метку текущую дату, идентификатор образца, дату сбора образца и номер цветовой группы. Нанесите этикетки на чистые, сухие микроцентрифужные трубки 2 мл.
- Взвесьте 0,25 г (± 0,05 г) пыльцевых гранул из каждой цветовой группы и поместите это количество в соответствующим образом маркированную микроцентрифужную трубку.
ПРИМЕЧАНИЕ: Если есть небольшие изменения в цвете или текстуре пыльцы данной цветовой группы, убедитесь, что в каждой пробирке имеется репрезентативный образец гранул. Последующие объемы реагентов и время инкубации и центрифугирования соответствуют 0,25 г пыльцы. Поэтому используйте это количество пыльцы в микроцентрифужных трубках для использования при ацетолизе. Этот протокол должен обеспечивать достаточное количество окрашенной пыльцы для идентификации источника растений с помощью световой микроскопии. При использовании другого количества пыльцы в ацетолизе следует соответствующим образом корректировать специфику объема реагента и времени обработки. - Поместите оставшуюся пыльцу из каждой цветовой группы в отдельные пластиковые пакеты (по одному пакету на цвет), помеченные названием цветовой группы. Храните эти пакеты вместе с другими частями соответствующего оригинального образца при температуре -20 °C.
- Тщательно перемешайте пыльцу в тюбике с чистой деревянной зубочисткой в течение 10-15 с.
3. Подготовка к ацетолизу
- Прежде чем начать какую-либо часть ацетолиза в первый раз, свяжитесь с отделом гигиены и безопасности окружающей среды (EHS) назначенного учреждения для получения инструкций о том, как следует обращаться с реагентами и отходами, связанными с ацетолизом.
- Получить исходные растворы следующих реагентов и поместить их в вытяжной шкаф в соответствии с руководящими принципами EHS для химического хранения: 95% этанола; дистиллированная вода; ледниковая уксусная кислота, безводная; концентрированная серная кислота; глицерин; и прозрачный лак для ногтей.
- Подготовьте запасы растворов следующих реагентов, и поместите их в вытяжную вытяжку в соответствии с рекомендациями EHS по химическому хранению: насыщенный бикарбонат натрия (8% мас./об раствор в дистиллированной воде); и сафранин О (1% мас./об.раствор в 50% этаноле).
4. Ацетолиз
- Выполните процедуру предварительного ацетолиза промывания ледниковой уксусной кислотой. Выполните следующие шаги в вытяжном капюшоне с лабораторным покрытием, защитой глаз и нитриловыми перчатками.
- Включите тепловой блок при температуре до 80 °C.
ПРИМЕЧАНИЕ: Убедитесь, что бутылка с насыщенным бикарбонатом натрия легко доступна. Это может быть использовано для нейтрализации разливов кислоты в вытяжном шкафу, если они происходят. - Маркировка одного стеклянного стакана для кислотных отходов, одного для отходов этанола и одного для ацетолизной смеси.
- Используя предварительно подготовленные стоковые растворы, создают рабочие аликвоты следующих реагентов в маркированных стеклянных стаканах соответствующего размера: ~23,0 мл ледниковой уксусной кислоты; ~33,0 мл дистиллированной воды; ~23,0 мл 95% этанола; ~25,0 мл бикарбоната натрия (для твердых отходов, загрязненных кислотой).
ПРИМЕЧАНИЕ: Это объемы, необходимые для выполнения следующих процедур ацетолиза на 10 образцах цветовых групп (10 микроцентрифужных пробирок). - Медленно добавляйте 500 мкл ледниковой уксусной кислоты в каждую микроцентрифужную трубку, содержащую 0,25 г пыльцы цветовой группы. При визуальном осмотре трубки перемешайте пыльцу чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано. Поместите использованную зубочистку в стакан для отходов бикарбоната натрия после использования; повторите этот процесс для каждой трубки.
ПРИМЕЧАНИЕ: Используйте чистую, новую зубочистку для каждого тюбика. Убедитесь, что крышка каждой трубки плотно закрыта. - Центрифугируйте образцы в течение 3 мин при 1 100 × г. Декантируйте супернатант из трубок в стакан кислотных отходов. Затем мягко и ненадолго коснитесь открытого рта трубки чистым бумажным полотенцем, чтобы удалить остаточную ледниковую уксусную кислоту вокруг края трубки.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не потерять пыльцевую гранулу при декантировании супернатантов.
- Включите тепловой блок при температуре до 80 °C.
- Выполните процедуру ацетолиза.
ПРИМЕЧАНИЕ: Выполните следующие шаги в вытяжном капюшоне с лабораторным покрытием, защитой глаз и бутиловыми виниловыми перчатками.- Приготовьте смесь ацетолиза (9:1 ледниковая уксусная кислота: серная кислота), сначала добавив 10,8 мл ледниковой уксусной кислоты (из рабочей аликвоты) в смесь ацетолиза, меченую стаканом. Затем, используя пипетку объемом 1000 мкл, снабженную фильтрованными наконечниками пипетки объемом 1250 мкл, медленно добавляют 1200 мкл (1,2 мл) концентрированной серной кислоты из исходного раствора в стакан ацетолизной смеси, содержащий ледниковую уксусную кислоту. Выбросьте использованный наконечник пипетки в стакан бикарбоната натрия.
ПРИМЕЧАНИЕ: Стакан для ацетолизной смеси может стать теплым на ощупь, и смесь может пожелтеть. Существует две возможности, которые приводят к тому, что смесь приобретает темный цвет: (а) реагенты могут иметь срок годности или (б) может быть добавлено слишком много серной кислоты. В любом случае, если смесь потемнеет, выбросьте ее в стакан кислотных отходов, и приготовьте свежую ацетолизную смесь. - Осторожно перемешайте ацетолизную смесь со стеклянным стержнем или деревянной палочкой для перемешивания, чтобы убедиться, что она гомогенизирована. Поместите использованный стержень/палочку в стакан бикарбоната натрия.
- Используя пипетку 1000 мкл с 1250 мкл отфильтрованными наконечниками пипетки, медленно добавляйте 1000 мкл ацетолизной смеси из стакана в каждую трубку. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано. Поместите использованную зубочистку в стакан для отходов бикарбоната натрия после использования.
ПРИМЕЧАНИЕ: Используйте чистую, новую зубочистку для каждого образца. - Поместите образцы на предварительно нагретый (80 °C) тепловой блок. Инкубируйте трубки в течение 5 минут, тщательно перемешивая каждый тюбик чистой зубочисткой на полпути через инкубацию. Поместите каждую использованную зубочистку в стакан бикарбоната натрия после использования.
ПРИМЕЧАНИЕ: Не оставляйте зубочистки в образцах; кислота растворит их.
- Приготовьте смесь ацетолиза (9:1 ледниковая уксусная кислота: серная кислота), сначала добавив 10,8 мл ледниковой уксусной кислоты (из рабочей аликвоты) в смесь ацетолиза, меченую стаканом. Затем, используя пипетку объемом 1000 мкл, снабженную фильтрованными наконечниками пипетки объемом 1250 мкл, медленно добавляют 1200 мкл (1,2 мл) концентрированной серной кислоты из исходного раствора в стакан ацетолизной смеси, содержащий ледниковую уксусную кислоту. Выбросьте использованный наконечник пипетки в стакан бикарбоната натрия.
- Выполните процедуру промывания ледниковой уксусной кислотой после ацетолиса.
ПРИМЕЧАНИЕ: Выполните следующие шаги в вытяжном капюшоне с лабораторным покрытием, защитой глаз и бутиловыми виниловыми перчатками.- Медленно добавляйте 500 мкл ледниковой уксусной кислоты в каждую трубку. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано. Поместите использованную зубочистку в стакан бикарбоната натрия после использования.
ПРИМЕЧАНИЕ: Используйте чистую, новую зубочистку для каждого образца. Убедитесь, что крышка каждой трубки плотно закрыта. - Центрифугируйте образцы в течение 3 мин при 1 100 × г. Декантируйте супернатант из каждой трубки в стакан кислотных отходов. Затем мягко и ненадолго коснитесь открытого рта трубки чистым бумажным полотенцем, чтобы удалить остаточную кислоту вокруг края трубки.
- Тщательно промойте бутиловые виниловые перчатки под проточной водой не менее 30 с, снимите их и высушите.
ПРИМЕЧАНИЕ: Следуйте рекомендациям производителя по повторному использованию бутилвиниловых перчаток.
- Медленно добавляйте 500 мкл ледниковой уксусной кислоты в каждую трубку. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано. Поместите использованную зубочистку в стакан бикарбоната натрия после использования.
- Выполните три промывки водой для каждого образца. Выполните следующие шаги в вытяжном капюшоне с лабораторным покрытием, защитой глаз и нитриловыми перчатками.
- Добавьте 1000 мкл дистиллированной воды из стакана дистиллированной воды в каждую трубку. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано. Поместите зубочистку в стакан для отходов бикарбоната натрия после использования.
ПРИМЕЧАНИЕ: Используйте чистую, новую зубочистку для каждого образца. Убедитесь, что крышка каждой трубки плотно закрыта. - Центрифугируйте образцы в течение 3 мин при 1 100 × г. Декантируйте супернатант из трубок в стакан бикарбоната натрия. Затем мягко коснитесь открытого рта трубки чистым бумажным полотенцем, чтобы удалить остаточную воду вокруг края трубки.
- Повторите шаги 4.4.1-4.4.2 еще два раза, в общей сложности три промывки водой.
- Добавьте 1000 мкл дистиллированной воды из стакана дистиллированной воды в каждую трубку. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано. Поместите зубочистку в стакан для отходов бикарбоната натрия после использования.
- Выполните промывку этанолом для каждого образца.
ПРИМЕЧАНИЕ: Выполните следующие шаги в вытяжном капюшоне с лабораторным покрытием, защитой глаз и нитриловыми перчатками.- Используя пипетку объемом 1000 мкл с фильтрованными наконечниками пипетки объемом 1250 мкл, добавьте 1000 мкл 95% этанола из этанолового стакана в каждую трубку. Выбросьте наконечник пипетки в неопасные отходы. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано.
ПРИМЕЧАНИЕ: Поместите зубочистку в стакан для отходов бикарбоната натрия после использования. Используйте чистую, новую зубочистку для каждого образца. Убедитесь, что крышка каждой трубки плотно закрыта. - Центрифугируйте образцы в течение 3 мин при 1 100 × г. Декантируйте супернатант из трубок в стакан для отходов этанола и мягко коснитесь открытого рта трубки чистым бумажным полотенцем, чтобы удалить остаточный этанол из трубки.
- Используя пипетку объемом 1000 мкл с фильтрованными наконечниками пипетки объемом 1250 мкл, добавьте 1000 мкл 95% этанола из этанолового стакана в каждую трубку. Выбросьте наконечник пипетки в неопасные отходы. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано.
- Носите лабораторное покрытие, защиту глаз и нитриловые перчатки для окрашивания образцов. Смешайте раствор красителей Safranin O, используя мягкую инверсию.
- Используя одноразовую пластиковую переносную пипетку, добавьте 5-10 капель пятна Сафранин О в каждый тюбик. При визуальном осмотре тюбика перемешивайте чистой зубочисткой в течение 10-15 с, и убедитесь, что содержимое трубки тщательно перемешано. Оставьте зубочистку в тюбике.
- Используя пипетку объемом 1000 мкл с фильтрованными наконечниками пипетки объемом 1250 мкл, добавьте 1000 мкл 95% этанола из этанолового стакана в каждую трубку. Выбросьте наконечник пипетки в неопасные отходы. При визуальном осмотре тюбика перемешайте зубочисткой в течение 10-15 с и убедитесь, что содержимое трубки тщательно перемешано. Поместите использованную зубочистку в неопасные отходы после использования.
- Убедитесь, что крышка каждой трубки плотно закрыта. Центрифуга в течение 3 мин при 1 100 × г. Декантируйте супернатант в стакан для отходов этанола.
ПРИМЕЧАНИЕ: На этот раз не прикасайтесь к горлышку тюбика бумажным полотенцем. - Добавьте 10-15 капель глицерина в каждый тюбик с помощью пластиковой одноразовой переносной пипетки. При визуальном осмотре трубки перемешайте содержимое трубки чистой зубочисткой в течение 10-15 с и убедитесь, что содержимое трубки тщательно перемешано.
ПРИМЕЧАНИЕ: Поместите использованную зубочистку в неопасные отходы после использования. Используйте чистую, новую зубочистку для каждого образца. Убедитесь, что все этикетки на тубах разборчивы.
- Оставьте трубки открытыми в вытяжном шкафу, чтобы испарить этанол в течение не менее 2 ч при комнатной температуре окружающей среды. Проверьте образцы на запах этанола: если он обнаруживается, образцы не готовы и должны быть оставлены для высыхания до тех пор, пока запах этанола не рассеется.
- Очистите все материалы и утилизируйте отходы. Выключите центрифугу и тепловой блок. Утилизируйте все твердые и жидкие отходы в соответствии с руководящими принципами гигиены и безопасности окружающей среды назначенного учреждения.
- Подготовить слайды микроскопа для идентификации пыльцы; пометить их разборчиво. Нанесите метку на прозрачный стеклянный микроскоп соответствующим образом для каждой цветовой группы/образца, который будет установлен. При визуальном осмотре пробирки перемешайте образец чистой зубочисткой в течение 10-15 с и убедитесь, что содержимое трубки тщательно перемешано.
ПРИМЕЧАНИЕ: Подготовка слайдов может быть выполнена на лабораторном стенде. Выбросьте зубочистку в неопасные отходы. Используйте чистую, новую зубочистку для каждого образца.- Используя чистую одноразовую пластиковую переносную пипетку, удалите 1 каплю остатка пыльцы из трубки и поместите ее в центр помеченного слайда микроскопа. Дайте капле немного распространиться. Поместите чистую крышку поверх капли на слайде.
- После того, как горка высохнет, запечатайте крышку к слайду прозрачным лаком для ногтей. Поместите небольшую каплю лака на каждый угол крышки и нарисуйте границу лака по периметру крышки, где она встречается с слайдом. Дайте лаку для ногтей полностью высохнуть и нанесите второй слой лака по периметру обшивки.
В предыдущем исследовании сообщалось об оценке разнообразия пыльцы, собранной медоносными пчелами в следующих сельскохозяйственных культурах: миндаль, вишня, голубика высокого роста, гибридная морковь и луговая пена14. Используя описанные способы, корбикулярную пыльцу собирали, сортировали по цвету, а растительные источники каждой цветовой группы гранул идентифицировали для оценки разнообразия пыльцы. Пыльцевые ловушки с нижним креплением были установлены на колониях в нескольких местах для каждой культуры (рисунок 1А). Количество пыльцы, собранной с каждого участка, было достаточным для выполнения требований к весу образца методов цветовой сортировки и анализа ацетолиза. Каждый образец сбора пыльцы имел несколько различимых цветовых групп (рисунок 2 и рисунок 3). В некоторых образцах цветовые группы пыльцы содержали всего 4-5 гранул; однако большинство групп имели значительно больше этого и, таким образом, служили своей собственной меченой цветовой группой для ацетолиза (рисунок 4 и рисунок 5). После ацетолиза (рисунок 6) для эффективной идентификации каждой цветовой группы до минимально возможного таксономического ранга использовалась микроскопия яркого поля, подтверждающая морфологические характеристики ваучерных образцов, собранных из области, окружающей каждый участок исследования (рисунок 7).

Рисунок 1: Пыльцевые ловушки, установленные на колонии медоносных пчел для сбора корбикулярной пыльцы. (А) Ловушки для нижнего крепления, размещенные над нижней доской улья и непосредственно над самым нижним ящиком улья. Другие стили пыльцевых ловушек включают (B) передние крепления и (C) шнековые входные ловушки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Улавливающий механизм и лоток для сбора пыльцевой ловушки. Возвращающиеся пыльцевые фуражиры должны протиснуться через механизм улавливания сетки, прежде чем достичь своего улья. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Лоток для сбора пыльцевой ловушки. Корбикулярная пыльца соскребается с ног возвращающихся пыльцевых фуражиров пыльцевой ловушкой и попадает в лоток для сбора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Сортировка образца корбикулярной пыльцы по цветовым группам. Пыльца корбикулярных частиц может быть высушена и взвешена после того, как она будет отсортирована по цветовым группам, чтобы сообщить пропорции собранных гранул различного цвета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Четыре группы гранул пыльцы, отсортированные по цвету с использованием руководства по цвету Pantone. Цветовые группы обозначены как (A) серый, Pantone 5855C, (B) коричневый, Pantone 7557C, (C) желтый, Pantone 458C и (D) светло-коричневый, Pantone 3547C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
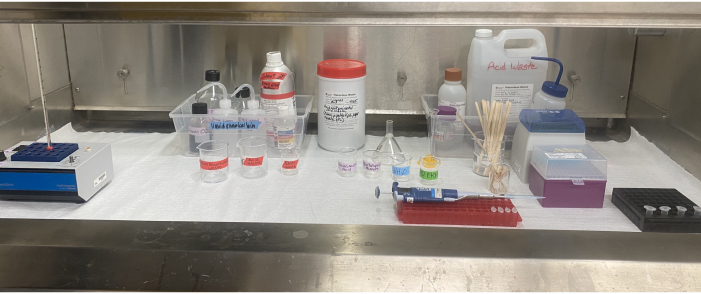
Рисунок 6: Установка оборудования для ацетолиза внутри вытяжного шкафа. Тепловой блок, реагенты, контейнеры для отходов растворителей и кислотных отходов, маркированные стаканы, пипетки, наконечники пипеток, палочки для перемешивания и микроцентрифужные трубки, расположенные внутри вытяжного шкафа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
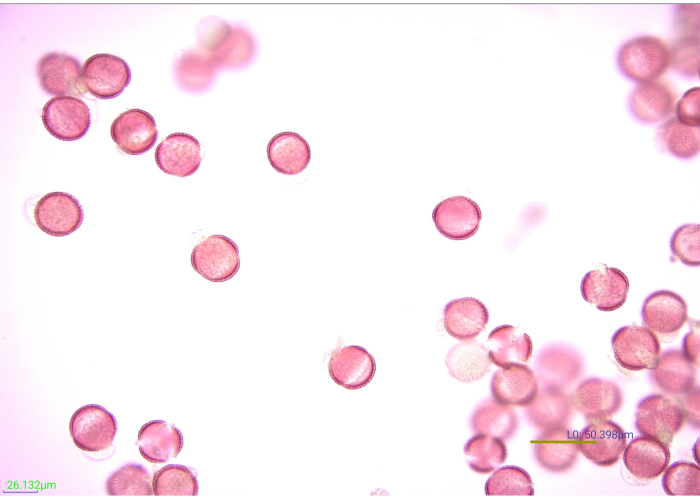
Рисунок 7: Микрофотография окрашенных, ацетолизированных пыльцевых зерен. Многие грани ацетолизированной горчицы (Brassicaceae) пыльцевыми зернами при 40-кратном увеличении. Шкала = 50.398 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Пыльца, собранная из мест выращивания миндаля, имела относительно более низкое разнообразие пыльцы, чем пыльца, собранная с других культур, в среднем 3,0 ± 0,5 цвета гранул и 3,2 ± 1,2 таксонов растений на участок (таблица 2)14. Остальные четыре системы земледелия имели более высокие уровни разнообразия пыльцы в среднем 6,0 ± 2,0 цвета гранул и 8,0 ± 1,5 таксонов растений на участок в вишне, 8,8 ± 1,4 цвета гранул и 13,5 ± 2,0 таксонов растений на участок в голубике высокого роста, 7,0 ± 1,0 цветов гранул и 11,0 ± 0,0 таксонов растений на участок гибридной моркови и 10,0 ± 0,0 цветов гранул и 13,0 ± 1,5 таксонов растений на участок в луговой пене14.
| Урожай | Среднее количество цветов пыльцевых гранул/участок (SE) | Среднее число таксонов/участка растений (SE) | Всего идентифицированных таксонов | ||
| Семья | Род | Вид | |||
| Миндаль | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| Черника | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| Морковь | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| Вишня | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| Луговая пена | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
Таблица 2: Разнообразие корбикулярной пыльцы, собранной у медоносных пчел в пяти системах земледелия. Метрики разнообразия включают среднее количество цветов гранул (± SE), среднее число таксонов растений (± SE) и общее количество идентифицированных таксонов. Эта таблица была изменена с14. Аббревиатура: SE = стандартная ошибка.
Различные стили пыльцевых ловушек имеют свои преимущества и последствия. Преимущества и ограничения четырех часто используемых стилей ловушек: (1) переднее крепление, (2) нижнее крепление, (3) шнековое отверстие и (4) пыльцевые ловушки верхнего крепления обсуждаются ниже. Ловушки переднего крепления являются наиболее универсальным стилем (рисунок 1B). Установка быстрая и простая; это можно сделать без подъема ульевых ящиков, и эти ловушки могут поместиться на любом ульевом оборудовании типа Langstroth. Поскольку лоток для сбора находится перед колонией, он собирает минимальный мусор из колонии. Тем не менее, лоток для сбора также более подвержен воздействию внешних элементов - влага от полевого орошения, дождливой или влажной погоды или роса может вступать в контакт с пыльцой через лоток для сбора, что потенциально делает пыльцу непригодной для использования, если гранулы становятся слишком насыщенными, чтобы отделиться. Риск насыщения пыльцой можно снизить, избегая ловушки во время прогнозируемых событий дождя или высокой влажности. Размещение резинового коврика под ловушкой и дополнительного укрывного материала (например, кровельного войлока) поверх пыльцевой ловушки также может защитить лоток для сбора от непогоды.
Для сбора пыльцы для данных в этой статье использовались ловушки с нижним креплением (рисунок 1А). Их не так удобно устанавливать, потому что они должны быть размещены под выводковым гнездом колонии. Установка занимает много времени и приводит к большому количеству мусора, попадающего в ловушку из колонии, таких как пчелиные части и небольшие кусочки воска. Пол лотка для сбора для большинства производимых донных ловушек выполнен из мелкой сетки, что позволяет правильно проветривать собранную пыльцу от влаги. Пыльцевые ловушки с шнековыми отверстиями помогают свести к минимуму дезориентацию фуражиров, если они в основном используют шнековые отверстия в качестве входов в улей вместо входа, сделанного нижней доской улья (рисунок 1С). Поскольку лоток для сбора пыльцевых ловушек с шнековым отверстием очень мал, его необходимо часто опорожнять, чтобы избежать переполнения лотка для сбора. Учитывая его верхнее расположение на улье, пыльцевая ловушка с верхним креплением является самым простым стилем ловушки для установки и удаления, а собранный образец пыльцы не содержит обломков улья. Тем не менее, этот стиль ловушки очень чувствителен к поврежденному оборудованию улья, так как лоток для сбора будет подвергаться воздействию влаги, если крышка, внутренняя крышка и верхний ящик улья не будут должным образом запечатаны вместе.
Протоколы, описанные в настоящем описании, предусматривают отбор колоний с большими популяциями взрослых особей и личинок (этап 1.2). Этот метод отбора предназначен для получения очень большого количества захваченной пыльцы из этих колоний. Колонии со значительными популяциями кормов могут испытывать сильные заторы на входе при установке ловушки. Выбор большого входа в улей облегчит заторы. Большие популяции кормов могут также собирать очень большое количество пыльцы, которая может превышать границы сбора лотка. Используйте объемные лотки для сбора, как это видно из большинства стилей ловушек с нижним или верхним креплением, и пустые лотки часто для размещения большого количества захваченной пыльцы. Если желаемой целью исследования является оценка количества пыльцы, собранной колониями на пасеке, выберите репрезентативные колонии вместо оптимизации взрослых и личиночных популяций для отбора. Все стили пыльцевых ловушек блокируют вход в улей и создают новый вход, который пространственно отличается от первоначального входа16. Пыльцевые ловушки обычно не собирают пыльцу, когда фуражиры не могут переориентироваться на новый вход пыльцевой ловушки при установке. Эти фуражиры легко дрейфуют в соседние ульи, потенциально перекрестно загрязняя другие образцы сбора пыльцы, если они попадают в другой улей с пыльцевой ловушкой. Следовательно, собирателям должно быть дано не менее 24 часов, чтобы акклиматизироваться к новому входу, сохраняя механизм захвата отключенным после установки. Выбор колоний с небольшим количеством или без дополнительных входов в улей также уменьшает путаницу при ориентации на новый вход пыльцевой ловушки.
Дополнительные входы в ульи (например, отверстия и деформированные крышки) должны быть герметизированы, но риск дрейфа фуражиров в соседние ульи увеличится с этими входами, присутствующими в начале установки ловушки. Фуражиры также будут легко дрейфовать в другие входы в ульи, если пыльцевая ловушка установлена только на одном улье в кластере паллетизированных ульев. Фуражиры с меньшей вероятностью дрейфуют, если во всех ульях, которые обращены в одном направлении на поддоне, установлены ловушки. Пыльцевые ловушки с верхним креплением могут представлять более высокий риск дрейфа пчел из-за значительного расстояния между входом в пыльцевую ловушку и первоначальным входом в улей. Для этого исследования пыльцевые ловушки были установлены на нескольких колониях медоносных пчел в каждом экспериментальном месте, чтобы учесть изменения в количестве пыльцы и составе таксонов между каждой колонией медоносных пчел. Таким образом, пыльцевые ловушки должны быть установлены на нескольких колониях для достижения надежных коллекций пыльцы из ландшафта, поскольку коллекция пыльцы может широко варьироваться между колониями в зависимости от типа вида растений и общего собранного количества12,13. Каждый образец пыльцы имел 7-дневный период сбора. В будущих исследованиях сбор пыльцы в два или три последовательных интервала 72 часа повысит точность оценки пыльцы корма40.
Поскольку существует высокая степень временных колебаний в сборе пыльцы, точность оценки пыльцы может быть увеличена путем повторения процесса сбора пыльцы в ранние, пиковые и поздние периоды цветения целевых систем земледелия 24,27,39. Пыльца должна собираться из нескольких мест, хотя и с одной и той же системой земледелия или типом ландшафта, из-за ожидаемых различий в количестве и типе видов растений между пасеками 14,27,33,43. Долгосрочная ловушка пыльцы может быть вредной для пчелиных семей. Потенциальные последствия включают сокращение выращивания расплода, сокращение периода роста личинок и каннибализм яиц и молодых личинок в ульях 19,44,45,46. Более длительные периоды отлова пыльцы, такие как весь вегетационный период, могут ухудшить вредное воздействие на выращивание расплода в колониях. Улавливание пыльцы также может привести к снижению производства меда и повышению уровня влажности хранимого меда13. Вращающиеся пыльцевые ловушки между колониями на пасеке при постоянном мониторинге ландшафта или системы земледелия могут смягчить вред для колоний, используемых для отлова пыльцы. Использование пыльцевых ловушек каждые две недели уменьшит пагубные последствия, особенно потери в производстве меда, если улавливать пыльцу на одних и тех же колониях в течение периода времени13.
Кроме того, пыльцевые ловушки предпочтительно размещать на сильных колониях. Иногда пыльцевые ловушки могут вовлекаться непреднамеренно. Этого можно избежать, заблокировав механизм пыльцевой ловушки, когда сбор пыльцевой ловушки не желателен. Пыльцевые ловушки не удаляют всю корбикулярную пыльцу с собирателей медоносных пчел. Эффективность улавливания зависит от типа ловушки, размера гранул пыльцы, размера тела пчелы, времени суток и погодных условий. Следовательно, сбор корбикулярной пыльцы не является последовательным при использовании пыльцевых ловушек для различных видов растений и периодов сбора25,26. Меньшие гранулы пыльцы из таких растений, как Eucalyptus spp. и Tamarix spp., с меньшей вероятностью будут захвачены пыльцевыми ловушками27. Примечательно, что в этом исследовании не было обнаружено пыльцы черники с высоким кустом (Vaccinium corymbosum L.) из мест сбора черники с высоким кустом, что подтверждает предыдущие доказательства того, что гранулы пыльцы черники слишком малы для сбора пыльцы47. Напротив, пыльца, полученная из одуванчика (Taraxacum officinale F.H. Wigg), была обнаружена в каждой системе земледелия в этом исследовании. Гранулы пыльцы некоторых видов растений также могут быть намного крупнее других, таких как Taraxacum spp., и, возможно, могут быть чрезмерно представлены при анализе коллекций пыльцы из пыльцевых ловушек27. Захват отдельных собирателей пыльцы и ручное удаление их корбикулярной пыльцы повысит точность оценки источника пыльцы, но это очень трудоемко по сравнению с использованием пыльцевых ловушек (таблица 1). Сортировка пыльцевых гранул по цветовым группам относительно проста, хотя и занимает много времени. Если нет конкретной цели или задачи исследования, количество гранул пыльцы должно быть ограничено 10 г или менее (для любого данного образца) для сортировки по цветовым группам. Сортировка целых образцов, которые содержат большее количество, чем это количество, резко увеличит время, необходимое для завершения анализа. Однако крайне важно, чтобы образец пыльцы был очень хорошо перемешан, прежде чем из него будет взята подвыборка для сортировки цветов. Неспособность смешать исходный образец может привести к подвыборке, которая не является репрезентативной для целого, чего следует избегать.
Если оригинальный контейнер для образцов не содержит достаточного свободного пространства для тщательного смешивания гранул пыльцы, помещение всего образца в большой пластиковый пакет или небольшой бумажный пакет должно быть достаточно, даже для больших образцов. Жесткие пластиковые контейнеры с крышкой также будут работать. Перемешивание образца следует производить осторожно, чтобы пыльцевые гранулы не были раздавлены или иным образом уничтожены. Непреднамеренная предвзятость может подсознательно убедить человека зачерпнуть «красивые фиолетовые гранулы», например, при удалении подвыборки из целого. Поэтому цветовая композиция образца должна быть скрыта от глаз при вычерпывании подвыборки. Таким образом, получение подвыборки, которая действительно репрезентативна для целого, более вероятно. Однако этот метод субдискретизации может не позволить выбрать гранулы пыльцы, которые находятся в небольшом количестве в образце. Поэтому, если идентификация каждого отдельного таксона растений, представленного в образце, является целью исследования, сбор подвыборки будет неуместным; весь образец должен быть проанализирован. Следовательно, гранулы должны быть отсортированы в стеклянной чашке Петри. После завершения сортировки соответствующие страницы руководства по цвету Pantone могут быть помещены под блюдом, чтобы облегчить сопоставление цветов между направляющей и отсортированной пыльцой. Пример этого проиллюстрирован на рисунке 5.
При улавливании пыльцы из пчелиных семей, помещенных в посевы для опыления, следует использовать не более десяти общих цветовых групп: девять отдельных цветов и одну «разную» цветовую группу, состоящую из миноритарных цветов в образце. Установление разумного ограничения на максимальное количество цветовых групп, на которые может быть разделен образец, не позволяет исследователю увязнуть в бесконечном разделении гранул на постоянно растущее число чрезвычайно специфических групп, которые при завершении сортировки могут не содержать по отдельности достаточных количеств для ацетолиза. При отлове из колоний, которые, вероятно, кормятся из очень разнообразного ассортимента видов растений, может потребоваться больше цветовых групп, и протоколы должны быть оптимизированы, чтобы отразить это требование. Настоящее исследование было сосредоточено на образцах пыльцы, собранных из колоний медоносных пчел, опыляющих сельскохозяйственные культуры, и несколько таксонов обычно находились в цветовой группе, аналогично предыдущим исследованиям 29,30,31.
Ацетолиз растворяет липиды, белки и органический мусор с поверхности пыльцевых зерен, выявляя отличительные признаки эксина, так что зерна могут быть окрашены и идентифицированы легче. Это старая и распространенная методология, используемая во многих видах исследований пыльцы37. Общие шаги стандартизированы; они мало варьируются от протокола к протоколу. Однако специфика скоростей и времени центрифугирования, температуры и продолжительности инкубации, объемов реагентов, обусловленных количеством пыльцы, и даже метода удаления супернатанта (декантирование против пипетирования), возможно, потребуется экспериментально оптимизировать в соответствии с целями исследований и, в некоторой степени, типами пыльцы, с которыми можно столкнуться48. Действительно, ацетолиз может удалить важные диагностические признаки пыльцы из некоторых таксонов, таких как Malvaceae и Orchidaceae38. Поэтому не вся пыльца поддается стандартным методам ацетолиза. Как указано выше, эти методы были оптимизированы в данном исследовании с целью выявления источников пыльцы, опыляющей сельскохозяйственные культуры, с целью выявления доминирующих таксонов растений. Детали, которые следует рассмотреть, если точная количественная оценка пыльцевых зерен является частью исследования, не были рассмотрены в настоящем документе.
Использование растворителей и кислот требует тщательного планирования, надлежащих средств индивидуальной защиты (СИЗ) и ответственного удаления отходов (рисунок 6). Очень важно, чтобы исследователи определили правильный способ хранения реагентов и утилизации отходов перед началом любой части ацетолиза. В этой лаборатории бутильные перчатки используются во время любой части процесса, которая включает серную кислоту и даже ледниковую уксусную кислоту, поскольку они имеют гораздо лучшие показатели деградации и проникновения для обеих кислот, чем нитриловые перчатки, не ставя под угрозу ловкость49. Было бы разумно ознакомиться с руководящими принципами безопасности соответствующего учреждения для получения рекомендаций по соответствующим перчаткам и другим СИЗ49. Добавление ледниковой уксусной кислоты перед этапом ацетолиза помогает удалить любую остаточную влагу в образце и подготавливает его к важной реакции ацетолиза. Смесь ледниковой уксусной кислоты и серной кислоты на стадии ацетолиза может бурно реагировать с водой, поэтому важно, чтобы вся стеклянная посуда и материалы были полностью сухими, и чтобы вся влага удалялась из образца перед ацетолизом. Постацетолизное добавление ледниковой уксусной кислоты разбавляет и нейтрализует смесь ацетолиза.
Этанол и ледниковая уксусная кислота, в частности, могут растворять чернила этикеток микроцентрифуг, если эти реагенты капают на внешнюю сторону трубки, даже с помощью устойчивых к растворителям ручек. Часто проверяйте этикетки на этикетках на протяжении всего процесса, чтобы убедиться, что они все еще разборчивы. Если логистически возможно, рассмотрите возможность использования этикеток, напечатанных LaserJet, в качестве защиты от такой возможности. Способ, которым супернатанты декантируются, будет влиять на то, будут ли реагенты стекать по внешней стороне трубок микроцентрифуги. Важно декантировать супернатант уверенной, гладкой рукой, что приходит с практикой. Следует соблюдать осторожность, чтобы избежать потери образцов пыльцы из трубки центрифуги во время декантации. Слишком быстрое декантирование рискует потерять часть или весь остаток пыльцы; Слишком медленное декантирование может привести к тому, что супернатант стекает по трубке. Хотя обычно рекомендуется температура инкубации 100 °C, пыльца может легко «пережариться» при этой температуре в количествах, используемых в этом исследовании (0,25 г), особенно при инкубации в течение несколько более длительных периодов29. Фактически, даже при 80 ° C пыльцевые зерна могут лопнуть или иным образом быть повреждены, если их оставить в смеси ацетолиза слишком долго. Температура и продолжительность инкубации должны быть тщательно определены, чтобы избежать разрушения пыльцевых зерен в образце.
Окрашивание пыльцы увеличивает четкость и контрастность внешних признаков, облегчая фотографирование и идентификацию (рисунок 7). Пять капель (из пластиковой переносной пипетки) 1% Сафранина О эффективно окрашивают 0,25 г пыльцы. Однако разные пыльцы окрашиваются по-разному. Если пыльцевые зерна окрашены слишком легко или слишком сильно, идентификация может быть затруднена. Когда это возможно, объем пятнистого раствора, необходимый для надлежащего окрашивания видов пыльцы, которые, как ожидается, будут обнаружены в исследовании, должен быть проверен до начала обработки экспериментальных образцов. Тем не менее, если один из экспериментальных образцов не окрашен должным образом, его можно исправить. Чтобы осветлить образец пыльцы, который окрашен слишком сильно, промойте образец водой, а затем этанолом. Если пыльца не окрашена достаточно хорошо, чтобы увидеть отличительные черты, можно добавить несколько дополнительных капель пятна. Пятно этих образцов должно быть проверено перед добавлением глицерина. Аналогичным образом, некоторые пробы и ошибки могут потребоваться для определения идеального объема глицерина для остатков пыльцы. Пятнадцать капель глицерина надлежащим образом защищали образцы в этом исследовании от высыхания, а также разбавляли остатки пыльцы до концентрации, идеально подходящей для последующей идентификации с помощью световой микроскопии. Другие количества остатков пыльцы могут потребовать больше или меньше глицерина для предотвращения высыхания и облегчения монтажа.
Авторам нечего раскрывать.
Мы благодарим доктора Гретхен Джонс (USDA-ARS, APMRU, College Station, TX) за помощь в сортировке цветов и анализе ацетолиза. Это исследование было поддержано исследовательскими фондами, предоставленными R.R.S. Ассоциацией пчеловодов штата Орегон.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved