Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Bal Arısı Kolonilerinden Polenlerin Toplanması ve Tanımlanması
Bal arılarından korbiküler polen toplama yöntemlerinin yanı sıra renk sıralama, asetoliz ve taksonomik tanımlama için polenlerin mikroskop slayt hazırlama protokollerini açıklıyoruz. Ek olarak, polen tuzakları kullanılarak beş kırpma sisteminden toplanan korbiküler polenlerin pelet rengi ve taksonomik çeşitliliğini sunuyoruz.
Araştırmacılar genellikle polen için beslendikleri bitki kaynaklarını tanımlamak veya arıların polen yoluyla pestisit maruziyetini tahmin etmek için bal arılarından korbiküler polen toplar ve analiz ederler. Burada anlatılan, kovanlarına geri dönen bal arılarından korbiküler polen toplamak için etkili bir polen yakalama yöntemidir. Bu toplama yöntemi, araştırma amacıyla kullanılabilecek büyük miktarlarda korbiküler polen ile sonuçlanır. Bal arıları birçok bitki türünden polen toplar, ancak genellikle her toplama gezisi sırasında bir türü ziyaret eder. Bu nedenle, her bir korbiküler polen peleti ağırlıklı olarak bir bitki türünü temsil eder ve her polen peleti renkle tanımlanabilir. Bu, bitki kaynaklarını ayırmak için korbiküler polen örneklerinin renge göre sıralanmasını sağlar. Araştırmacılar, taksonomik tanımlama için asetolize polen tanelerinin morfolojisini analiz ederek korbiküler poleni daha da sınıflandırabilirler. Bu yöntemler, tozlaşma verimliliği, tozlayıcı yiyecek arama dinamikleri, diyet kalitesi ve çeşitlilik gibi tozlayıcılarla ilgili çalışmalarda yaygın olarak kullanılmaktadır. Polen tuzakları kullanılarak korbiküler polenlerin toplanması, polenlerin renge göre sıralanması ve polen tanelerinin asetolize edilmesi için ayrıntılı metodolojiler sunulmuştur. Ayrıca, beş farklı kırpma sisteminde bal arılarından toplanan pelet renklerinin ve korbiküler polenlerin taksonlarının sıklığına ilişkin sonuçlar da sunulmaktadır.
Batı bal arısı (Apis mellifera L.), arı tozlaşmasına bağlı birçok tarımsal ürünün önemli bir tozlaştırıcısıdır1. On yıldan fazla bir süredir, önemli bal arısı kolonisi kayıpları 2,3,4,5,6,7,8,9 olarak bildirilmiştir. Parazitler ve hastalıklar, yetersiz beslenme ve pestisitler de dahil olmak üzere çeşitli faktörler bu koloni düşüşlerinde rol oynamıştır10. Kötü beslenme, tarımsal yoğunlaşmaya ve yiyecek arama habitatının kaybına bağlanabilir11. Arı beslenmesini iyileştirmek ve arı koruma çabalarına yardımcı olmak için farklı manzaralarda arılar tarafından kullanılan çiçek kaynaklarını anlamak zorunludur. Polen, arılar için birincil protein, lipit, vitamin ve mineral kaynağıdır ve bal arılarının koloni düzeyinde yiyecek arama tercihlerini anlamak, polen yakalamanın bal arısı kolonileri üzerindeki etkisini değerlendirmek ve arılara pestisit maruziyetini belirlemek için birçok tarımsal ve ekolojik çalışmada kullanılmıştır12,13,14.
Bal arıları çiçeklerden polen toplar, polenleri corbicula'larındaki peletlere paketler - arka ayaklarında tibial bir polen sepeti - ve depolama için koloniye geri dönerler. Corbicular polen, kovan girişinde veya çiçekler üzerinde yakalanarak, onları hareketsiz hale getirmek için kısa bir süre soğutularak ve daha sonra polen topaklarını forseps ile arka ayaklarından çıkararak toplayıcılardan çıkarılabilir. Bireysel olarak yakalanan toplayıcılardan korbiküler polenlerin elle toplanmasının zahmetli süreci, önemli miktarda polen gerektiriyorsa yavaş ve verimsizdir. Büyük miktarlarda polen toplamanın daha basit ve daha verimli bir yöntemi, kovan girişlerinde bal arılarından korbiküler polen peletlerini yakalamaktır. Polen tuzakları, korbiküler poleni, kovan15'e girerken geri dönen polen toplayıcılarının bacaklarından çıkarmak için tasarlanmıştır. Toplayıcılar, bir bal arısı işçi gövdesinin geçişine dar bir şekilde izin verecek şekilde boyutlandırılmış ağ deliklerinden sıkılmalıdır.
Bal arısı bu deliklerden birinden geçerken, daha büyük polen topakları bacaklarından kazınır ve bir toplama tepsisine düşer16. Çalışmalar, polen yakalamanın toplayıcıları daha fazla polen toplamaya teşvik ettiğini, böylece çevredeki mahsullerin ve bitki örtüsünün tozlaşma verimliliğini arttırdığını göstermiştir17,18,19,20. Polen toplama metodolojileri, çiçekli bitki türlerinin miktarını, kalitesini ve taksonlarını belirlemenin ilk adımı olarak bal arıları tarafından peyzajda kullanılan yemleri anlamak için de kullanılabilir. Etkili polen yakalama metodolojileri böylece hem tozlaşmayı hem de bal arısı beslenme araştırmalarını kolaylaştırır. Bu polen toplama yöntemlerinin bir karşılaştırması Tablo 1'de gösterilmiştir. Polen toplama davranışı, koloninin yumurta ve larva popülasyon seviyelerine göre depolanmış polen ihtiyacına bağlı olarak değişecektir21,22. Bu değişiklikler değişen toplama yoğunluğunu içerdiğinden, aynı yerdeki koloniler arasında ve aynı kırpma sisteminin veya peyzaj tipi23,24'ün farklı yerleri arasında polen miktarında yüksek varyasyon beklenir. Polenleri yakalamak için kolonilerin ve yerlerin sayısının arttırılması, bu varyasyonun karşılanmasına yardımcı olacaktır.
Polen tuzakları verimlilikaçısından değişir 25,26. Bal arıları tarafından toplanan polen peletlerinin büyüklüğü bitki türleri arasında değişir ve kolonideki polen depolarının seviyelerine göre değişebilir27,28. Bu, daha küçük polen peletlerinin az temsil edilme ve daha büyük peletlerin polen tuzakları yoluyla toplanan örneklerde aşırı temsil edilme potansiyelini ortaya koymaktadır. Yetişkin arılar vücut büyüklüğüne göre değişir, bu da tuzaklarda toplanan polenlerin temsilini de etkileyebilir. Ağırlıklı olarak nektar üreten bitki türleri de vardır, bu da sadece bazı manzaralarda toplanan polenlerin değerlendirilmesi durumunda tespit edilemeyecek. Tuzak verimliliği, polen tuzağı tipinden ve kovan ekipmanının durumundan etkilenen toplayıcı sürüklenmesi ve oryantasyon bozukluğundan da etkilenir. Bu sorun, bu makalede belirtilen teknikler kullanılarak hafifletilebilir. Araştırmacılar, koloni düzeyinde yiyecek arama tercihlerinin sonuçlarını desteklemek için toplayıcılar tarafından çiçek ziyaretini saymak gibi ek araştırma tekniklerini düşünebilirler. Polen çeşitliliğini değerlendirmek için yararlı bir yöntem, korbiküler polenleri renge göre sıralamaktır. Bal arıları genelci toplayıcılar olmalarına rağmen, herhangi bir toplama gezisi sırasında aynı bitki türünden polenleri aynı yerde topladıkları çiçek sadakatini de sergilerler. Bu yiyecek arama davranışına dayanarak, herhangi bir korbiküler polen peletinin ağırlıklı olarak tek bir bitki türü 27,29,30,31 tarafından temsil edildiği varsayılmaktadır. Bu nedenle, bilim adamları polen çeşitliliğini, korbiküler poleni pelet rengine göre sıralayarak ve tespit edilen toplam renk sayısını veya her renk grubu tarafından temsil edilen toplamın oranını 12,32,33,34 bildirerek tanımlayabilirler. Bu, her renk grubunun kütlesini veya pelet sayısını ölçerek gerçekleştirilebilir. Her renk grubunun pelet sayısının ölçülmesi, farklı taksonlardan peletlerin ağırlığında bilinen veya şüphelenilen sistematik farklılıklar varsa önerilir. Sistematik farklılıklar, pelet boyutundan veya toplayıcıların bir pelet oluştururken polenlere eklediği nektar miktarından kaynaklanabilir.
Renk sıralama zaman açısından verimli ve basit bir işlemdir, ancak bazı tozlaşma araştırma çalışmaları için kabul edilebilir bir doğruluğa sahip olmayabilir, çünkü farklı bitki taksonları benzer polen pelet renklerine sahip olabilir35,36. Ek olarak, polen peletlerinin ayrılabileceği farklı renk gruplarının sayısı için lojistik bir sınır vardır. Bu nedenle, her bir bitki takson poleninin kendi ayrı pelet renk grubuna ayrılması, tozlaşma çalışmalarında her zaman mümkün olmayabilir. Polen tanelerinin ışık mikroskobu yoluyla morfolojik karakterizasyonu genellikle aynı renk grubundaki peletlerde iki veya daha fazla taksonun polenini ayırt ederek peletlerin renk ayrımını tamamlar. Belirli bir polen pelet renk grubunda çoklu taksonların polen tanelerini bulmak yaygın olsa da, bir bal arısı tarafından toplanan bireysel polen peletleri genellikle küçük miktarlarda diğer taksonlarla birlikte bir baskın takson içerir. Bu nedenle, bal arılarının korbiküler polen peletlerinde taksonomik sadakati varsaymak yaygındır. Bombus arıları gibi çiçek sadakat davranışı sergilemeyen diğer tozlayıcılardan gelen polen peletleri, genellikle birçok bitki türünü içerecek ve baskın bir taksona sahip olmayabilir. Polifloral polen peletlerindeki takson oranlarının nicel tahminlerinin istendiği durumlarda, uygun analiz için asetoliz içeren mikroskobik yöntemler de gereklidir.
Asetolize polen tanelerinin morfolojik özelliklerinin değerlendirilmesi taksonomik tanımlama için en yaygın yöntemdir16. Asetoliz prosedürü, ışık mikroskobu37,38 altında gözlemlenebilen tanısal özellikleri ortaya çıkarmak için polen tanesinin protoplazmasını çıkarır. Bu yöntemi kullanarak, araştırmacılar farklı taksonları, belirli kırpma sistemlerinde bulunan taksonların sıklığını ve pelet renklerinin baskın taksonlarını33,36 olarak bildirebilirler. Asetoliz, polen morfolojisini ortaya çıkarmak için en iyi analitik tekniktir28. Bununla birlikte, birçok Rosaceae tipi gibi bazı asetolize polen taneleri, yalnızca asetoliz ve ışık mikroskobu yoluyla cins veya tür seviyesine tanımlanamaz. Araştırmacılar, elektron mikroskobu veya metabarkodlamayı taramayı, cins veya tür düzeyinde tanımlama elde etmek için alternatif yöntemler olarak görüyorlar. Bununla birlikte, bu alternatif yöntemler yalnızca nitel takson tanımlaması sağlar ve polifloral polen peletlerindeki farklı polen tanesi taksonlarının oranlarını tahmin edemez36,39. Ek olarak, bu yöntemler için masraf ve gerekli uzmanlık oldukça yüksektir. Bu tanımlama yöntemlerinin bir karşılaştırması Tablo 1'de gösterilmiştir.
| Yöntemler | Saat | Gider | Çözünürlük | Uzmanlık |
| Polen Koleksiyonu | ||||
| Polen yakalama | Alçak | Ilımlı | Değişken | Ilımlı |
| Polen toplayıcı koleksiyonu | Yüksek | Ilımlı | Yüksek | Alçak |
| Polen Tanımlama | ||||
| Görsel (yalnızca renk sıralama) | Ilımlı | Alçak | Alçak | Alçak |
| Asetoliz | Ilımlı | Ilımlı | Ilımlı | Ilımlı |
| Taramalı elektron mikroskobu | Yüksek | Yüksek | Yüksek | Yüksek |
| Metabarkodlama | Değişken | Yüksek | Yüksek | Yüksek |
Tablo 1: Farklı polen toplama ve tanımlama yöntemlerinin zaman, masraf, çözüm ve uzmanlığa göre karşılaştırılması. Görsel yöntemler (yalnızca renk sıralama), polen kaynaklarını belirlemek için bir metrik olarak algılanan toplam renk sayısını veya her renk grubu tarafından temsil edilen toplamın oranını bildirir, ancak takson tanımlaması sağlamaz.
Polenlerin yakalanması ve sıralanması ve polen tanelerinin asetolize edilmesi hakkında mevcut bilgiler çeşitlidir ve genellikle farklı alanlardaki araştırmacılar için değişen birden fazla kaynağa yayılmıştır. Bu makale, hem araştırmacılar hem de arıcılar tarafından büyük miktarlarda korbiküler polenleri etkili bir şekilde toplamak için kullanılabilecek farklı polen tuzakları hakkında ayrıntılı bilgiler sunmaktadır. Ayrıca, bitki taksonlarının tanımlanması için polen numunelerinin hazırlanması için - asetoliz, boyama ve slayt montajı ile - protokoller de sağlanmaktadır. Burada ayrıntılı olarak açıklanan metodolojiler kapsamlıdır ve bal arılarının belirli bir manzarada, özellikle de kırpma sistemlerinde beslendiği baskın bitki türlerini tanımlamak için eşsiz bir kaynak görevi görür. Önceki bir çalışmadan bu yöntemlere dayanan bulgular sunulmuş ve beş kırpma sisteminde bal arıları tarafından toplanan korbiküler polenlerden polen pelet renklerinin ve bitki taksonlarının çeşitliliğini belgelemiştir14.
1. Polen tuzakları kullanarak bal arısı kolonilerinden korbiküler polen toplanması
- Polenlerin istenen arı kovanı konumundan ne zaman yakalanacağını belirleyin.
NOT: İdeal iklim koşulları arasında tam güneşe maruz kalma, düşük rüzgar hızları, düşük nem ve polen toplama için istenen süre boyunca tahmin edilen yağış yoktur. - Arı kovanı bölgesinde polenleri yakalamak için en uygun bal arısı kolonilerini seçin.
- 2 dakika boyunca koloni girişine dönen toplayıcıları sayarak koloni gücünü değerlendirin. Geri dönen avcı toplayıcıların toplam sayısının en yüksek olduğu kolonileri seçin.
- İyi durumda olan, tercihen ekstra girişler ve çarpık kapaklar olmadan ahşap eşyalı kovanları seçin. Daha az alternatif girişe sahip koloniler kullanın, çünkü avcı toplayıcıların tuzak girişine yeniden yönlendirilme olasılığını artırmışlardır.
- Mümkün olduğunca güneye bakan kovan girişlerini seçin. Kovanlar paletlenirse, toplayıcıların komşu kovan girişlerine sürüklenmesini önlemek için belirli bir palette aynı yöne bakan her koloniye polen tuzakları takın.
- İstenirse, larvaların varlığı için çerçeveleri inceleyerek koloninin yavru yuvasını değerlendirin. Nispeten büyük miktarda larva içeren kolonileri seçin.
- Seçilen bal arısı kolonilerine polen tuzakları kurun.
NOT: Kurulum, polen tuzağının türüne göre farklılık gösterecektir. Türleri arasında a) ön montaj, b) alttan montaj, c) üstten montaj veya d) burgu deliği giriş montajı bulunur. Ayrıntılar için tartışma bölümüne bakın.- Öne monte tuzaklar için, tuzağı girişin önüne zımbalar, vidalar ve bantla takın veya tuzağı kovanın etrafına sarılmış bungee kablolarına bağlayın. Alttan montajlı tuzaklar için, tuzağı en düşük kovan kutusunun altına yerleştirin ve tuzak girişini orijinal girişin yanına sabitleyin. Burgu deliği montaj tuzakları için, zımbalar, vidalar ve bant kullanarak tuzağı doğrudan bir kovan kutusunun burgu deliğinin önüne takın. Üste monte tuzaklar için, tuzağı en üstteki kovan kutusunun üstüne ve kapağın altına yerleştirin.
- Lateks veya poliüretan köpük gibi yapışkan olmayan ve kalıplanabilir malzemeler veya burgu delikleri için #8 donanım bezi (2,7 mm açıklık) kullanarak koloniye diğer tüm olası girişleri kapatın. Küçük çatlaklar için yapışkan bant kullanın.
- Öne monte tuzaklar kullanıyorsanız, çiyden kaynaklanan nem hasarını önlemek için toplama sepeti ile çim arasına kauçuk paspas gibi bir bariyer yerleştirin.
- Polen tuzağının yakalama mekanizmasını kurulumdan 24 saat sonra ve günün yiyecek arama uçuşu başlamadan önce (akşamın geç saatlerinde / sabahın erken saatlerinde) devreye sokun.
NOT: Bu adım idealdir, ancak gerekli değildir. Belirli bir süre boyunca aynı kolonilerde polen hapsediyorsanız, her iki haftada bir polen tuzaklarını kullanın. - Toplama tepsisinden korbiküler polenleri toplayın, plastik torbalara veya santrifüj tüplerine yerleştirin ve buzlu bir soğutucuda saklayın.
- Polen türlerinin çeşitliliğini ve bolluğunu değerlendirmek için, örneğin peyzaj düzeyinde beslenme çalışmaları, polenleri iki veya üç 72 saatlik aralıklarla toplayın40.
- Pestisit kalıntı analizi için, 41 işleme için en az 3 g ile24 saat ila 96 saat aralıklarla polen toplayın.
- Arı parçalarını ve diğer kovan kalıntılarını temizleyerek poleni temizleyin.
NOT: Polen numunelerini tutarken tek kullanımlık eldivenler kullanın ve numuneler arasında tek kullanımlık eldivenleri değiştirin. Her tuzakta toplanan polenlerden kalıntıları çıkarmak için ayrı araçlar kullanın. Aletleri başka bir sıkışmış polen partisi için kullanmadan önce durulayın ve kurutun. - Polen, polen kaynağı tanımlama, miktar değerlendirmesi veya pestisit kalıntı analizleri için tasarlanmışsa, bileşimsel bütünlüğünü korumak için poleni -20 ° C veya altında saklayın41,42.
- Tuzakları kovanlardan çıkardıktan sonra, tüm ekipmanı% 5'lik bir ağartıcı çözeltisinde sterilize edin, bir sonraki kullanımdan önce ekipmanı durulayın ve kurutun.
2. Aşağı akış polen kaynağı tanımlama ve miktar değerlendirmesi için polen pelet rengi sıralama
- Çalışmak için en az 20 g polen örneği olduğundan emin olun. Polen numunesini torbasında veya uygun büyüklükte başka bir kapta iyice karıştırarak, içinde bulunan tüm peletlerin homojen bir karışımını elde edin. Bir sonraki adımda kasıtsız önyargıyı önlemek için, numune torbasından bir alt numuneyi çıkarmadan önce numunenin renk kompozisyonunu görünümden gizleyin.
- Bir kepçe veya büyük bir kaşık kullanarak, bütünün temsili bir alt örneği olarak 10 g polen alın. Ekran 10 g okuyana kadar kepçeden topakları yavaşça teraziye dökün. İlk kepçe yeterince büyük değilse, numuneden aynı şekilde başka bir kepçe alın.
NOT: Bu belirtilen ağırlık gereksinimleri (20 g ve 10 g) yalnızca örnek teşkil eder. Araştırmacılar, her adımda kullanılan polen miktarını belirli ihtiyaçlara uygun olarak ayarlamalıdır. - Tüm arı parçalarını ve diğer kalıntıları 10 g alt numuneden çıkarın. Daha sonra, gerekirse, alt numunenin toplam 10 g ağırlığını elde etmek için orijinal numuneden biraz daha polen ekleyin.
- Her polen peletini 10 g alt örneklemden bir renk grubuna ayırın. Renk grupları arasında ayrım yapmak için hem polen rengini hem de dokuyu kullanın.
NOT: Bir grup içinde bazı farklılıklar beklenir, ancak sıralama sırasında Pantone renk kılavuzunun kullanılması tutarlılığı artırabilir. - Aşağı akış adımları için her renk grubunun en az 0,25 g'ını sağlamak için, en az 0,25 g'lık bir renk grubu oluşturacak kadar bol olmayan peletleri çeşitli bir gruba yerleştirin. Pantone renk kılavuzunu kullanarak her bir renk grubunu ayrı ayrı adlandırın. Çeşitli grup çeşitliliğini etiketleyin.
- Her renk grubunu ayrı bir tartım kağıdında tartın ve/veya her renk grubundaki pelet sayısını sayın. Renk grubu adlarını ve ağırlıklarını veya sayımlarını veri sayfasına kaydedin.
NOT: Her renk grubundaki pelet sayısının tartılıp sayılmayacağını seçmek, araştırmacının ilgi metriğine ve proje hedeflerine bağlıdır. - Solvente dayanıklı kalem ve yapışkan kağıt tüp etiketleri kullanarak her renk grubu için bir mikrosantrifüj tüp etiketi oluşturun. Geçerli tarihi, örnek tanımlayıcısını, örnek toplama tarihini ve renk grubu numarasını etikete ekleyin. Etiketleri temiz, kuru 2 mL mikrosantrifüj tüplerine uygulayın.
- Her renk grubundan 0,25 g (± 0,05 g) polen peleti tartın ve bu miktarı uygun şekilde etiketlenmiş mikrosantrifüj tüpüne yerleştirin.
NOT: Belirli bir renk grubunun poleninde renk veya dokuda hafif bir değişiklik varsa, her tüpün içinde temsili bir pelet örneği olduğundan emin olun. Takip eden reaktif hacimleri ve inkübasyon ve santrifüjleme süreleri 0.25 g polen için uygundur. Bu nedenle, asetolizde kullanılacak mikrosantrifüj tüplerinde bu miktarda polen kullanın. Bu protokol, ışık mikroskobu ile aşağı akış bitki kaynağı tanımlaması için geniş, lekeli polen sağlamalıdır. Asetolizde farklı miktarda polen kullanılıyorsa, reaktif hacminin özellikleri ve işleme süreleri buna göre ayarlanmalıdır. - Her renk grubundan kalan polenleri, renk grubu adıyla etiketlenmiş ayrı plastik torbalara (renk başına bir torba) yerleştirin. Bu torbaları uygun orijinal numunenin diğer kısımlarıyla birlikte -20 °C depoda saklayın.
- Tüpteki poleni 10 ila 15 s boyunca temiz bir ahşap kürdan ile iyice karıştırın.
3. Asetoliz için hazırlık
- Asetolizin herhangi bir bölümüne ilk kez başlamadan önce, asetolizle ilişkili reaktiflerin ve atıkların nasıl ele alınması gerektiğine dair talimatlar için belirlenen kurumun çevre sağlığı ve güvenliği (EHS) departmanına başvurun.
- Aşağıdaki reaktiflerin stok çözeltilerini elde edin ve bunları kimyasal depolama için EHS kurallarına uygun olarak duman davlumbazına yerleştirin:% 95 etanol; damıtılmış su; buzul asetik asit, susuz; konsantre sülfürik asit; Gliserin; ve şeffaf oje.
- Aşağıdaki reaktiflerin stok çözeltilerini hazırlayın ve bunları kimyasal depolama için EHS kılavuzlarına uygun olarak duman davlumbazına yerleştirin: doymuş sodyum bikarbonat (damıtılmış suda% 8 w / v çözeltisi); ve safranin O (% 50 etanolde% 1 w / v çözeltisi).
4. Asetoliz
- Buzul asetik asit yıkamanın ön asetoliz prosedürünü uygulayın. Laboratuvar önlüğü, göz koruması ve nitril eldivenlerle duman davlumbazının içinde aşağıdaki adımları uygulayın.
- Bir ısı bloğunu 80 ° C'ye getirin.
NOT: Bir sıkma şişesi doymuş sodyum bikarbonata kolayca erişilebildiğinden emin olun. Bu, meydana gelirse duman davlumbazındaki asit dökülmelerini nötralize etmek için kullanılabilir. - Asit atıkları, etanol atıkları için bir cam kabı ve asetoliz karışımı için bir cam kabı etiketleyin.
- Önceden hazırlanmış stok çözeltilerini kullanarak, etiketli, uygun boyutta cam beherlerde aşağıdaki reaktiflerin çalışan alikotlarını oluşturun: ~ 23.0 mL buzul asetik asit; ~ 33.0 mL damıtılmış su; ~23.0 mL% 95 etanol; ~ 25.0 mL sodyum bikarbonat (asitle kirlenmiş katı atıklar için).
NOT: Bunlar, toplam 10 renk grubu numunesinde (10 mikrosantrifüj tüpü) aşağıdaki asetoliz prosedürlerini tamamlamak için gereken hacimlerdir. - 0.25 g renk grubu polen içeren her mikrosantrifüj tüpüne yavaşça 500 μL buzul asetik asit ekleyin. Tüpü görsel olarak incelerken, poleni 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kullanılmış kürdanı kullanımdan sonra sodyum bikarbonat atık kabına yerleştirin; Bu işlemi her tüp için tekrarlayın.
NOT: Her tüp için temiz, yeni bir kürdan kullanın. Her tüpün kapağının sıkıca kapatıldığından emin olun. - Numuneleri 1.100 × g'da 3 dakika boyunca santrifüj yapın. Süpernatantı tüplerden asit atık kabına boşaltın. Daha sonra, tüpün kenarı etrafındaki artık buzul asetik asidi çıkarmak için tüpün açık ağzına temiz bir kağıt havluyla yumuşak ve kısa bir süre dokunun.
NOT: Süpernatantları boşaltırken polen peletini kaybetmemeye dikkat edin.
- Bir ısı bloğunu 80 ° C'ye getirin.
- Asetoliz prosedürünü uygulayın.
NOT: Laboratuvar önlüğü, göz koruması ve bütil vinil eldivenlerle davlumbaz içinde aşağıdaki adımları uygulayın.- Asetoliz karışımını (9: 1 buzul asetik asit: sülfürik asit) önce beher etiketli asetoliz karışımına 10.8 mL buzul asetik asit (çalışan alikottan) ekleyerek hazırlayın. Daha sonra, 1250 μL filtrelenmiş pipet uçlarıyla donatılmış 1000 μL'lik bir pipet kullanarak, stok çözeltisinden buzul asetik asit içeren asetoliz karışımı kabına yavaşça 1200 μL (1,2 mL) konsantre sülfürik asit ekleyin. Kullanılmış pipet ucunu sodyum bikarbonat kabına atın.
NOT: Asetoliz karışımı kabı dokunulduğunda ısınabilir ve karışım sararabilir. Karışımın koyu bir renge dönüşmesine neden olan iki olasılık vardır: (a) reaktifler son kullanma tarihlerini geçmiş olabilir veya (b) çok fazla sülfürik asit eklenmiş olabilir. Her durumda, karışım kararırsa, asit atık kabına atın ve taze bir asetoliz karışımı hazırlayın. - Asetoliz karışımını homojenize edildiğinden emin olmak için bir cam çubuk veya ahşap karıştırma çubuğu ile yavaşça karıştırın. Kullanılmış çubuğu / çubuğu sodyum bikarbonat kabına yerleştirin.
- 1250 μL filtrelenmiş pipet uçlarına sahip 1000 μL'lik bir pipet kullanarak, her bir tüpe beherden yavaşça 1000 μL asetoliz karışımı ekleyin. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kullanılmış kürdanı kullanımdan sonra sodyum bikarbonat atık kabına yerleştirin.
NOT: Her numune için temiz, yeni bir kürdan kullanın. - Numuneleri önceden ısıtılmış (80 °C) ısı bloğuna yerleştirin. Tüpleri 5 dakika boyunca inkübe edin, her tüpü inkübasyonun yarısına kadar temiz bir kürdan ile iyice karıştırın. Kullanılan her kürdanı kullanımdan sonra sodyum bikarbonat kabına yerleştirin.
NOT: Kürdan numunelerde bırakmayın; asit onları çözecektir.
- Asetoliz karışımını (9: 1 buzul asetik asit: sülfürik asit) önce beher etiketli asetoliz karışımına 10.8 mL buzul asetik asit (çalışan alikottan) ekleyerek hazırlayın. Daha sonra, 1250 μL filtrelenmiş pipet uçlarıyla donatılmış 1000 μL'lik bir pipet kullanarak, stok çözeltisinden buzul asetik asit içeren asetoliz karışımı kabına yavaşça 1200 μL (1,2 mL) konsantre sülfürik asit ekleyin. Kullanılmış pipet ucunu sodyum bikarbonat kabına atın.
- Asetoliz sonrası buzul asetik asit yıkama prosedürünü uygulayın.
NOT: Laboratuvar önlüğü, göz koruması ve bütil vinil eldivenlerle duman başlığında aşağıdaki adımları uygulayın.- Her tüpe yavaşça 500 μL buzul asetik asit ekleyin. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kullanılmış kürdanı kullanımdan sonra sodyum bikarbonat kabına yerleştirin.
NOT: Her numune için temiz, yeni bir kürdan kullanın. Her tüpün kapağının sıkıca kapatıldığından emin olun. - Numuneleri 1.100 × g'da 3 dakika boyunca santrifüj yapın. Süpernatantı her tüpten asit atık kabına boşaltın. Daha sonra, tüpün kenarının etrafındaki artık asidi çıkarmak için tüpün açık ağzına temiz bir kağıt havluyla yumuşak ve kısa bir süre dokunun.
- Bütil vinil eldivenleri akan su altında en az 30 saniye boyunca iyice durulayın, çıkarın ve kurumaya bırakın.
NOT: Bütil vinil eldivenlerin yeniden kullanımıyla ilgili üreticinin yönergelerine uyun.
- Her tüpe yavaşça 500 μL buzul asetik asit ekleyin. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kullanılmış kürdanı kullanımdan sonra sodyum bikarbonat kabına yerleştirin.
- Her numune için üç suyla durulama gerçekleştirin. Laboratuvar önlüğü, göz koruması ve nitril eldivenlerle duman davlumbazının içinde aşağıdaki adımları uygulayın.
- Her tüpe damıtılmış su kabından 1000 μL damıtılmış su ekleyin. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kürdanı kullandıktan sonra sodyum bikarbonat atık kabına yerleştirin.
NOT: Her numune için temiz, yeni bir kürdan kullanın. Her tüpün kapağının sıkıca kapatıldığından emin olun. - Numuneleri 1.100 × g'da 3 dakika boyunca santrifüj yapın. Süpernatantı tüplerden sodyum bikarbonat kabına boşaltın. Ardından, tüpün kenarının etrafındaki artık suyu çıkarmak için tüpün açık ağzına temiz bir kağıt havluyla yumuşak bir şekilde dokunun.
- Toplam üç su durulaması için 4.4.1-4.4.2 arasındaki adımları iki kez daha tekrarlayın.
- Her tüpe damıtılmış su kabından 1000 μL damıtılmış su ekleyin. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kürdanı kullandıktan sonra sodyum bikarbonat atık kabına yerleştirin.
- Her numune için etanol durulama işlemini gerçekleştirin.
NOT: Laboratuvar önlüğü, göz koruması ve nitril eldivenlerle davlumbaz içinde aşağıdaki adımları uygulayın.- 1250 μL filtrelenmiş pipet uçlarına sahip 1000 μL'lik bir pipet kullanarak, her tüpe etanol kabından 1000 μL %95 etanol ekleyin. Pipet ucunu tehlikeli olmayan atıklara atın. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun.
NOT: Kürdanı kullandıktan sonra sodyum bikarbonat atık kabına yerleştirin. Her örnek için temiz, yeni bir kürdan kullanın. Her tüpün kapağının sıkıca kapatıldığından emin olun. - Numuneleri 1.100 × g'da 3 dakika boyunca santrifüj yapın. Süpernatantı tüplerden etanol atık kabına boşaltın ve tüpten kalan etanolün çıkarılması için tüpün açık ağzına temiz bir kağıt havluyla yumuşak bir şekilde dokunun.
- 1250 μL filtrelenmiş pipet uçlarına sahip 1000 μL'lik bir pipet kullanarak, her tüpe etanol kabından 1000 μL %95 etanol ekleyin. Pipet ucunu tehlikeli olmayan atıklara atın. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun.
- Numuneleri lekelemek için laboratuvar önlüğü, göz koruması ve nitril eldivenler giyin. Safranin O leke suyu çözeltisini nazik ters çevirme kullanarak karıştırın.
- Tek kullanımlık, plastik bir transfer pipeti kullanarak, her tüpe 5-10 damla Safranin O lekesi ekleyin. Tüpü görsel olarak incelerken, 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kürdanı tüpün içinde bırakın.
- 1250 μL filtrelenmiş pipet uçlarına sahip 1000 μL'lik bir pipet kullanarak, her tüpe etanol kabından 1000 μL %95 etanol ekleyin. Pipet ucunu tehlikeli olmayan atıklara atın. Tüpü görsel olarak incelerken, kürdan ile 10-15 s karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun. Kullanılmış kürdanı kullandıktan sonra tehlikeli olmayan atıklara yerleştirin.
- Her tüpün kapağının sıkıca kapatıldığından emin olun. 1.100 × g'da 3 dakika santrifüj. Süpernatantı etanol atık kabına boşaltın.
NOT: Bu kez tüpün ağzına kağıt havlu ile dokunmayın. - Plastik tek kullanımlık transfer pipeti kullanarak her tüpe 10-15 damla gliserin ekleyin. Tüpü görsel olarak incelerken, tüpün içeriğini 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun.
NOT: Kullanılmış kürdanı kullandıktan sonra tehlikesiz atıklara yerleştirin. Her örnek için temiz, yeni bir kürdan kullanın. Tüm tüp etiketlerinin okunaklı olduğundan emin olun.
- Etanolün ortam oda sıcaklığında en az 2 saat buharlaştırılması için tüpleri davlumbazda açık bırakın. Numunelerde etanol kokusu olup olmadığını kontrol edin: tespit edilebilirse, numuneler hazır değildir ve etanol kokusu dağılana kadar kurumaya bırakılmalıdır.
- Tüm malzemeleri temizleyin ve atıkları atın. Hem santrifüjü hem de ısı bloğunu kapatın. Tüm katı ve sıvı atıkları, belirlenen kurumun çevre sağlığı ve güvenliği yönergelerine uygun olarak bertaraf etmek.
- Polen tanımlaması için mikroskop slaytları hazırlayın; onları okunaklı bir şekilde etiketleyin. Temiz bir cam mikroskop slaytını, monte edilecek her renk grubu / numune için uygun şekilde etiketleyin. Tüpü görsel olarak incelerken, numuneyi 10-15 s temiz bir kürdan ile karıştırın ve tüpün içeriğinin iyice karıştırıldığından emin olun.
NOT: Slayt hazırlığı laboratuvar tezgahında yapılabilir. Kürdanı tehlikesiz atıklara atın. Her örnek için temiz, yeni bir kürdan kullanın.- Temiz bir tek kullanımlık plastik transfer pipeti kullanarak, bir tüpten 1 damla polen kalıntısını çıkarın ve etiketli mikroskop slaytının ortasına yerleştirin. Damlanın hafifçe yayılmasına izin verin. Slayttaki damlanın üzerine temiz bir kapak kayması yerleştirin.
- Slayt kuruduktan sonra, kapak kapağını slayda şeffaf oje ile kapatın. Kapak kaymasının her köşesine küçük bir damla cila yerleştirin ve kapak kaymasının slaytla buluştuğu çevresine bir cila kenarlığı boyayın. Ojelerin tamamen kurumasına izin verin ve kapak kaymasının çevresine ikinci bir kat cila boyayın.
Önceki bir çalışma, aşağıdaki tarımsal ürünlerde bal arıları tarafından toplanan polen çeşitliliğinin değerlendirilmesini bildirmiştir: badem, kiraz, highbush yaban mersini, hibrit havuç ve çayır köpüğü14. Tarif edilen yöntemler kullanılarak, korbiküler polenler toplandı, renge göre sıralandı ve polen çeşitliliğini değerlendirmek için her pelet renk grubunun bitki kaynakları belirlendi. Alttan montajlı polen tuzakları, her ürün için birden fazla bölgedeki kolonilere kuruldu (Şekil 1A). Her bir sahadan toplanan polen miktarı, renk sıralama ve asetoliz analiz yöntemlerinin numune ağırlığı gereksinimlerini karşılamak için yeterliydi. Her polen toplama örneğinin birden fazla ayırt edilebilir renk grubu vardı (Şekil 2 ve Şekil 3). Bazı örneklerde, polen renk grupları 4-5 pelet kadar az içeriyordu; Bununla birlikte, çoğu grup bundan önemli ölçüde daha fazlasına sahipti ve bu nedenle asetoliz için kendi etiketli renk grubu olarak hizmet etti (Şekil 4 ve Şekil 5). Asetolizden sonra (Şekil 6), morfolojik özellikleri her çalışma alanını çevreleyen alandan toplanan kupon örneklerininkilerle doğrulayarak her renk grubunu mümkün olan en düşük taksonomik rütbesine etkili bir şekilde tanımlamak için parlak alan ışık mikroskobu kullanılmıştır (Şekil 7).

Şekil 1: Bağcıksal polen toplamak için bir bal arısı kolonisine monte edilen polen tuzakları. (A) Kovan alt tahtasının üzerine ve doğrudan en düşük kovan kutusunun üzerine yerleştirilen tabana monte tuzaklar. Diğer polen tuzağı stilleri arasında (B) ön montaj ve (C) burgu deliği giriş montaj tuzakları bulunur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 2: Polen tuzağının yakalama mekanizması ve toplama tepsisi. Geri dönen polen toplayıcıları, kovanlarına ulaşmadan önce ağ yakalama mekanizmasından sıkılmalıdır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 3: Polen tuzağının toplama tepsisi. Corbicular polen, polen tuzağı tarafından geri dönen polen toplayıcılarının bacaklarından kazınır ve toplama tepsisine düşer. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Bir korbiküler polen örneğini renk gruplarına ayırma. Corbicular polen, toplanan farklı renk peletlerinin oranlarını bildirmek için renk gruplarına ayrıldıktan sonra kurutulabilir ve tartılabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Pantone renk kılavuzu kullanılarak renge göre sıralanmış dört grup polen peleti. Renk grupları (A) gri, Pantone 5855C, (B) kahverengi, Pantone 7557C, (C) sarı, Pantone 458C ve (D) açık kahverengi, Pantone 3547C olarak etiketlenmiştir .
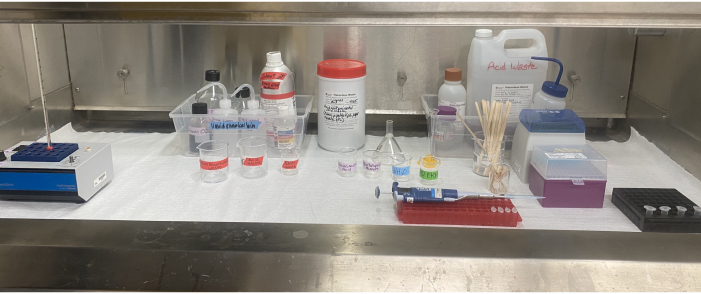
Resim 6: Duman davlumbazının içindeki asetoliz ekipmanı kurulumu. Davlumbazın içinde bulunan ısı bloğu, reaktifler, solvent atık ve asit atık kapları, etiketli beherler, pipet, pipet uçları, karıştırma çubukları ve mikrosantrifüj tüpleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
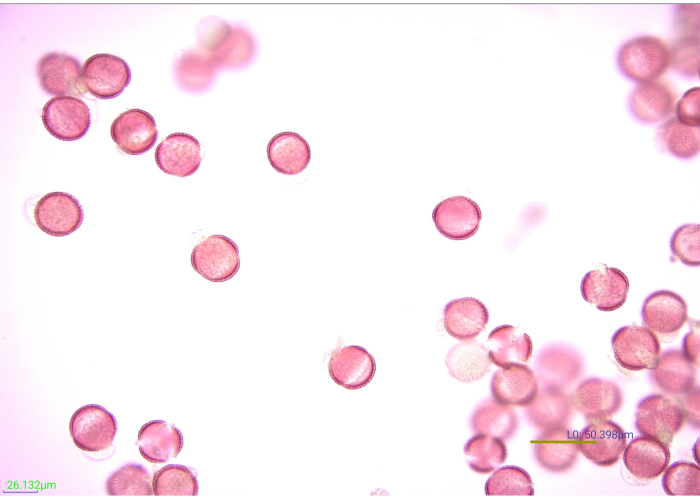
Şekil 7: Lekeli, asetolize polen tanelerinin mikrografisi. Asetolize hardal (Brassicaceae) polen tanelerinin birçok yönü 40x büyütmede. Ölçek çubuğu = 50.398 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Badem mahsulü bölgelerinden toplanan polenler, diğer mahsullerden toplanan polenlerden nispeten daha düşük polen çeşitliliğine sahipti; ortalama 3.0 ± 0.5 pelet rengi ve alan başına 3.2 ± 1.2 bitki taksonu (Tablo 2)14. Kalan dört kırpma sistemi, kirazda alan başına ortalama 6.0 ± 2.0 pelet rengi ve 8.0 ± 1.5 bitki taksonu, 8.8 ± 1.4 pelet rengi ve highbush yaban mersini alan başına 13.5 ± 2.0 bitki taksonu, 7.0 ± 1.0 pelet rengi ve melez havuçta alan başına 11.0 ± 0.0 bitki taksonu ve çayır köpüğü14'te alan başına 10.0 ± 0.0 pelet rengi ve 13.0 ± 1.5 bitki taksonu ile daha yüksek polen çeşitliliği seviyelerine sahipti.
| Ekin | Polen pelet renklerinin/alanlarının ortalama sayısı (SE) | Ortalama bitki taksonu/saha sayısı (SE) | Tanımlanan toplam taksonlar | ||
| Aile | Cins | Tür | |||
| Badem | 3.0 (0.5) | 3.2 (1.2) | 4 | 3 | 4 |
| Yaban mersini | 8.8 (1.4) | 13.5 (2.0) | 5 | 10 | 13 |
| Havuç | 7.0 (1.0) | 11.0 (0.0) | 3 | 5 | 6 |
| Kiraz | 6.0 (2.0) | 8.0 (1.5) | 4 | 7 | 5 |
| Çayır köpüğü | 10.0 (0.0) | 13.0 (1.5) | 5 | 4 | 14 |
Tablo 2: Beş kırpma sisteminde bal arılarından toplanan korbiküler polenlerin çeşitliliği. Çeşitlilik metrikleri, ortalama pelet rengi sayısını (± SE), ortalama bitki taksonu sayısını (± SE) ve tanımlanan toplam taksonu içerir. Bu tablo14'ten değiştirilmiştir. Kısaltma: SE = standart hata.
Farklı polen tuzağı stillerinin kendi avantajları ve sonuçları vardır. Yaygın olarak kullanılan dört tuzak stilinin, (1) ön montaj, (2) alta montaj, (3) burgu deliği ve (4) üste monte polen tuzaklarının yararları ve sınırlamaları aşağıda tartışılmıştır. Öne monte tuzaklar en çok yönlü stildir (Şekil 1B). Kurulum hızlı ve kolaydır; kovan kutularını kaldırmadan yapılabilir ve bu tuzaklar herhangi bir Langstroth tarzı kovan ekipmanına sığabilir. Toplama tepsisi koloninin önünde otururken, koloniden minimum enkaz toplar. Bununla birlikte, toplama tepsisi ayrıca dış elementlere daha fazla maruz kalır - tarla sulamasından, yağmurlu veya nemli havalardan kaynaklanan nem, veya çiğ, toplama tepsisinden polenle temas edebilir ve peletler ayrılmak için çok doygun hale gelirse potansiyel olarak poleni kullanılamaz hale getirebilir. Polen doygunluğu riski, öngörülen yağmur veya yüksek nem olayları sırasında sıkışmadan kaçınılarak azaltılabilir. Tuzağın altına bir kauçuk paspas ve polen tutucunun üstüne ekstra kaplama malzemesi (örneğin, çatı keçesi) yerleştirmek de toplama tepsisini hava koşullarından koruyabilir.
Bu makaledeki veriler için polen toplamak amacıyla alta monte tuzaklar kullanılmıştır (Şekil 1A). Kurulumu uygun değildir, çünkü koloninin yavru yuvasının altına yerleştirilmeleri gerekir. Kurulum zaman alıcıdır ve arı parçaları ve küçük balmumu parçaları gibi koloniden tuzağa düşen yüksek miktarda enkazla sonuçlanır. Çoğu üretilen tabana monte tuzaklar için toplama tepsisinin zemini, toplanan poleni nemden korumak için uygun havalandırmaya izin veren ince ağdan yapılmıştır. Burgu delikli polen tuzakları, kovanın alt tahtası tarafından yapılan giriş yerine kovan girişleri olarak burgu delikleri kullanıyorlarsa, toplayıcıların oryantasyon bozulmasını en aza indirmeye yardımcı olur (Şekil 1C). Burgu delikli polen tuzakları için toplama tepsisi çok küçük olduğundan, toplama tepsisinin taşmasını önlemek için sık sık boşaltılmalıdır. Bir kovan üzerindeki üst yerleşimi göz önüne alındığında, üste monte polen tuzağı, takılması ve çıkarılması en kolay tuzak stilidir ve toplanan polen numunesi kovan kalıntılarından arındırılmıştır. Bununla birlikte, bu tuzak stili, kapak, iç kapak ve üst kovan kutusu birlikte düzgün bir şekilde kapatılmazsa toplama tepsisi neme maruz kalacağından, hasarlı kovan ekipmanına karşı ekstra hassastır.
Burada açıklanan protokoller, büyük yetişkin ve larva popülasyonlarına sahip kolonilerin seçilmesini gerektirmektedir (adım 1.2). Bu seçim yöntemi, bu kolonilerden çok büyük miktarlarda sıkışmış polen üretmeyi amaçlamaktadır. Önemli yiyecek arama popülasyonlarına sahip koloniler, tuzak kurulumundan sonra girişte ağır tıkanıklık yaşayabilir. Büyük bir kovan girişi seçmek tıkanıklığı hafifletecektir. Büyük yiyecek arama popülasyonları, toplama tepsisinin sınırlarını aşabilecek çok büyük miktarlarda polen de toplayabilir. Çoğu alta veya üste monte tuzak stilinde görüldüğü gibi hacimli toplama tepsileri ve büyük miktarlarda sıkışmış polenleri barındırmak için sık sık boş tepsiler kullanın. İstenilen araştırma amacı, bir arı kovanındaki koloniler tarafından toplanan polen miktarlarını değerlendirmekse, yetişkin ve larva popülasyonlarını seçim için optimize etmek yerine temsili kolonileri seçin. Tüm polen tuzakları stilleri kovan girişini bloke eder ve orijinal giriş16'dan mekansal olarak farklı yeni bir giriş oluşturur. Polen tuzakları, toplayıcılar kurulumdan sonra polen tuzağının yeni girişine yeniden yönlendiremediklerinde genellikle polen toplamakta başarısız olurlar. Bu toplayıcılar kolayca komşu kovanlara sürüklenir ve polen tuzağı olan başka bir kovana girerlerse potansiyel olarak diğer polen toplama örneklerini çapraz kirletirler. Bu nedenle, toplayıcılara, kurulumdan sonra yakalama mekanizmasını devre dışı bırakarak yeni girişe alışmaları için en az 24 saat verilmelidir. Ek kovan girişleri az olan veya hiç olmayan kolonilerin seçilmesi, yeni polen tuzağı girişine yönlendirilirken karışıklığı da azaltır.
Ek kovan girişleri (örneğin, delikler ve çarpık kapaklar) kapatılmalıdır, ancak avcı toplayıcıların komşu kovanlara sürüklenme riski, tuzak kurulumunun başlangıcında mevcut olan bu girişlerle artacaktır. Toplayıcılar ayrıca, paletli kovan kümesinde yalnızca tek bir kovana bir polen tuzağı kurulursa, diğer kovan girişlerine kolayca sürüklenecektir. Palet üzerinde aynı yöne bakan tüm kovanların tuzakları takılıysa, toplayıcıların sürüklenme olasılığı daha düşüktür. Üste monte polen tuzakları, polen tuzağı girişi ile kovanın orijinal girişi arasındaki önemli mesafe nedeniyle arı sürüklenmesi riski daha yüksek olabilir. Bu çalışma için, her bal arısı kolonisi arasındaki polen miktarındaki ve takson bileşimindeki değişimi hesaba katmak için her deneysel konumdaki birden fazla bal arısı kolonisine polen tuzakları yerleştirilmiştir. Bu nedenle, polen tuzakları, peyzajdan sağlam polen koleksiyonları elde etmek için birden fazla koloniye kurulmalıdır, çünkü polen toplama, bitki türlerinin türüne ve toplam toplanan miktara bağlı olarak koloniler arasında büyük ölçüde değişebilir12,13. Her polen örneğinin 7 günlük bir toplama süresi vardı. Gelecekteki çalışmalarda, polenlerin iki veya üç ardışık 72 saat aralıklarla toplanması, polen yem tahmini40'ın doğruluğunu artıracaktır.
Polen toplamada yüksek derecede zamansal dalgalanma olduğu için, polen toplama işleminin hedeflenen kırpma sistemlerinin erken, pik ve geç çiçeklenme dönemlerinde tekrarlanmasıyla polen tahmin doğruluğu arttırılabilir24,27,39. Polenler, aynı kırpma sistemi veya peyzaj tipi de olsa, arı kovanı yerleri14,27,33,43 arasındaki miktar ve bitki türü türünde beklenen değişiklik nedeniyle birden fazla yerden toplanmalıdır. Uzun süreli polen yakalama, bal arısı kolonileri için zararlı olabilir. Potansiyel etkiler arasında yavru yetiştiriciliğinin azalması, larva büyüme süresinin kısalması ve kovanlardaki yumurta ve genç larvaların yamyamlığı 19,44,45,46 sayılabilir. Tüm büyüme mevsimi gibi daha uzun polen yakalama süreleri, kolonilerde yavru yetiştiriciliği üzerindeki zararlı etkileri kötüleştirebilir. Polen sıkışması ayrıca bal üretiminde bir azalmaya ve depolanan balın nem seviyesinde bir artışa neden olabilir13. Bir arı kovanındaki koloniler arasında dönen polen tuzakları, bir manzarayı veya kırpma sistemini sürekli izlerken, polen yakalama için kullanılan kolonilere verilen zararı azaltabilir. Polen tuzaklarını her iki haftada bir kullanmak, polenleri aynı kolonilerde bir süre boyunca hapsederse, zararlı etkileri, özellikle bal üretimindeki kaybı azaltacaktır13.
Ek olarak, polen tuzakları tercihen güçlü kolonilere yerleştirilir. Bazen, polen tuzakları istemeden devreye girebilir. Polen tuzağı toplanması istenmediğinde polen tuzağı mekanizmasının kilitlenmesiyle bu önlenebilir. Polen tuzakları, bal arısı toplayıcılarından tüm korbiküler polenleri çıkarmaz. Tuzak verimliliği, tuzak tipine, polen pelet boyutuna, arı gövdesi büyüklüğüne, günün saatine ve hava koşullarına bağlıdır. Bu nedenle, farklı bitki türleri ve toplama dönemleri için polen tuzakları kullanıldığında korbiküler polen toplama tutarlılığı yoktur25,26. Okaliptüs spp. ve Tamarix spp. gibi bitkilerden elde edilen daha küçük polen topaklarının polen tuzakları tarafından yakalanma olasılığı daha düşüktür27. Özellikle, bu çalışmada highbush yaban mersini toplama bölgelerinden hiçbir highbush yaban mersini (Vaccinium corymbosum L.) poleni bulunmamıştır, bu da highbush yaban mersini polen peletlerinin polen tuzağı toplama için çok küçük olduğuna dair önceki kanıtları desteklemektedir47. Buna karşılık, karahindiba kaynaklı polen (Taraxacum officinale F.H. Wigg) bu çalışmada her kırpma sisteminde bulunmuştur. Bazı bitki türlerinin polen topakları, Taraxacum spp. gibi diğerlerinden çok daha büyük olabilir ve polen tuzaklarından polen koleksiyonlarının analizinde muhtemelen aşırı temsil edilebilir27. Bireysel polen toplayıcılarını yakalamak ve korbiküler polenlerini manuel olarak çıkarmak, polen kaynağı değerlendirmesinin doğruluğunu artıracaktır, ancak polen tuzaklarını kullanmaya kıyasla çok zaman ve kaynak yoğundur (Tablo 1). Polen peletlerini renk gruplarına ayırmak, zaman alıcı olmasına rağmen, nispeten basittir. Belirli bir araştırma amacı veya hedefi olmadığı sürece, polen peletlerinin miktarı, renk gruplarına ayırmak için 10 g veya daha az (herhangi bir örnek için) ile sınırlandırılmalıdır. Bu miktardan daha fazla miktarda içeren numunelerin tamamını sıralamak, analizi tamamlamak için gereken süreyi önemli ölçüde artıracaktır. Bununla birlikte, renk sıralaması için bir alt örnek alınmadan önce bir polen örneğinin çok iyi karıştırılması çok önemlidir. Orijinal numunenin karıştırılmaması, bütünü temsil etmeyen bir alt numuneye neden olabilir ve bundan kaçınılmalıdır.
Orijinal numune kabı, polen peletlerinin iyice karıştırılmasına izin verecek kadar boş alan içermiyorsa, tüm numuneyi büyük bir plastik torbaya veya küçük bir kağıt torbaya koymak, büyük numuneler için bile yeterli olacaktır. Sert plastik, kapaklı kaplar da çalışacaktır. Numunenin karıştırılması nazikçe yapılmalıdır, böylece polen peletleri ezilmez veya başka bir şekilde tahrip edilmez. İstemsiz önyargı, bilinçaltında, örneğin bir alt örneği bütünden çıkarırken, "güzel mor peletleri" çıkarmaya ikna edebilir. Bu nedenle, bir alt numune çıkarılırken numunenin renk bileşimi görünümden gizlenmelidir. Bu şekilde, bütünü gerçekten temsil eden bir alt örnek elde etmek daha olasıdır. Bununla birlikte, bu alt örnekleme yöntemi, numunede düşük miktarda bulunan polen peletlerini seçemeyebilir. Bu nedenle, numunede temsil edilen her bir bitki taksonunun tanımlanması bir araştırma hedefi ise, bir alt numune toplamak uygun olmayacaktır; numunenin tamamı analiz edilmelidir. Bu nedenle, peletler bir cam Petri kabında sıralanmalıdır. Sıralama tamamlandıktan sonra, kılavuz ve sıralanmış polen arasındaki renk eşleşmesini kolaylaştırmak için Pantone renk kılavuzunun uygun sayfaları kabın altına yerleştirilebilir. Bunun bir örneği Şekil 5'te gösterilmiştir.
Tozlaşma için mahsullere yerleştirilen bal arısı kolonilerinden polen yakalanırken, ondan fazla toplam renk grubu kullanılmamalıdır: dokuz ayrı renk ve numunedeki azınlık renklerinden oluşan bir "çeşitli" renk grubu. Bir numunenin bölünebileceği maksimum renk grubu sayısına makul bir sınır koymak, araştırmacının, peletleri sürekli artan sayıda son derece spesifik gruplara ayırarak tıkanmasını önler; bu, sıralama tamamlandığında, ayrı ayrı asetoliz için yeterli miktarda içermeyebilir. Çok çeşitli bitki türlerinin çeşitliliğinden yiyecek arayan kolonilerden yakalanıyorsa, daha fazla renk grubu gerekli olabilir ve protokoller bu gereksinimi yansıtacak şekilde optimize edilmelidir. Bu çalışma, bitkileri tozlaştıran bal arısı kolonilerinden toplanan polen örneklerine odaklanmıştır ve önceki çalışmalara benzer şekilde bir renk grubunda yaygın olarak çoklu taksonlar bulunmuştur 29,30,31.
Asetoliz, lipitleri, proteinleri ve organik kalıntıları polen tanelerinin yüzeyinden çözerek eksinin ayırt edici karakterlerini ortaya çıkarır, böylece taneler lekelenebilir ve daha kolay tanımlanabilir. Birçok polen araştırmasında kullanılan eski ve yaygın bir metodolojidir37. Genel adımlar standartlaştırılmıştır; protokolden protokole çok az değişirler. Bununla birlikte, santrifüjleme hızlarının ve sürelerinin, inkübasyon sıcaklığının ve süresinin, polen miktarına bağlı reaktif hacimlerinin ve hatta süpernatant giderme yönteminin (dekantasyon vs pipetleme) özelliklerinin, araştırma hedeflerine ve bir dereceye kadar karşılaşılması muhtemel polen türlerine göre deneysel olarak optimize edilmesi gerekebilir48. Gerçekten de, asetoliz, polenlerin önemli tanısal karakterlerini Malvaceae ve Orchidaceae38 gibi bazı taksonlardan çıkarabilir. Bu nedenle, tüm polenler standart asetoliz yöntemlerine uygun değildir. Yukarıda belirtildiği gibi, bu yöntemler bu çalışmada, mahsul-tozlaşan bal arıları tarafından toplanan polenlerin baskın bitki takson kaynaklarını belirlemek amacıyla optimize edilmiştir. Polen tanelerinin kesin niceliğinin çalışmanın bir parçası olması durumunda göz önünde bulundurulması gereken detaylar bu makalede ele alınmamıştır.
Solventlerin ve asitlerin kullanımı dikkatli planlama, uygun kişisel koruyucu ekipman (KKD) ve sorumlu atık bertarafı gerektirir (Şekil 6). Araştırmacıların, asetolizin herhangi bir bölümüne başlamadan önce reaktifleri depolamanın ve atıkları bertaraf etmenin doğru yolunu belirlemeleri çok önemlidir. Bu laboratuvarda, bütil eldivenler, sülfürik asit ve hatta buzul asetik asit içeren işlemin herhangi bir bölümünde kullanılır, çünkü her iki asit için nitril eldivenlerden çok daha iyi bozulma ve geçirgenlik derecelerine sahiptirler, ancak el becerisinden ödün vermezler49. Uygun eldivenler ve diğer KKD49 ile ilgili öneriler için ilgili kurumun güvenlik yönergelerine başvurmak akıllıca olacaktır. Asetoliz adımından önce buzul asetik asit ilavesi, numunedeki artık nemin giderilmesine yardımcı olur ve bunu önemli asetoliz reaksiyonu için hazırlar. Asetoliz adımındaki buzul asetik asit-sülfürik asit karışımı su ile şiddetli reaksiyona girebilir, bu nedenle tüm cam eşyaların ve malzemelerin tamamen kuru olması ve tüm nemin asetolizden önce numuneden uzaklaştırılması önemlidir. Buzul asetik asidin asetoliz sonrası ilavesi, asetoliz karışımını seyreltir ve nötralize eder.
Özellikle etanol ve buzul asetik asit, mikrosantrifüj tüp etiketlerinin mürekkebini çözebilir, eğer bu reaktifler tüpün dışına damlarsa, çözücüye dayanıklı kalemlerle bile. Hala okunaklı olduklarından emin olmak için tüp etiketlerini işlem boyunca sık sık kontrol edin. Lojistik olarak mümkünse, bu olasılığa karşı bir koruma olarak LaserJet baskılı etiketler kullanmayı düşünün. Süpernatantların boşaltılma şekli, reaktiflerin mikrosantrifüj tüplerinin dışından aşağı damlayıp damlamadığını etkileyecektir. Süpernatantı pratikle birlikte gelen kendinden emin, pürüzsüz bir el ile temizlemek önemlidir. Dekantasyon sırasında santrifüj tüpünden polen örneklerinin kaybını önlemek için özen gösterilmelidir. Çok hızlı dekantasyon, polen kalıntısının bir kısmını veya tamamını kaybetme riski taşır; Çok yavaş dekant, süpernatantın tüpten aşağı akmasına neden olabilir. Her ne kadar 100 ° C'lik bir inkübasyon sıcaklığı yaygın olarak önerilse de, polen bu çalışmada kullanılan miktarlarda (0.25 g), özellikle biraz daha uzun süreler için inkübe edilirse, bu sıcaklıkta kolayca "aşırı pişmiş" hale gelebilir29. Aslında, 80 ° C'de bile, polen taneleri asetoliz karışımında çok uzun süre bırakılırsa patlayabilir veya başka bir şekilde zarar görebilir. Numunedeki polen tanelerinin tahrip olmasını önlemek için inkübasyon sıcaklığı ve süresi dikkatlice belirlenmelidir.
Polenlerin boyanması, eksin özelliklerinin tanımını ve kontrastını artırarak fotoğraflamayı ve tanımlamayı kolaylaştırır (Şekil 7). % 1 Safranin O'nun beş damlası (plastik transfer pipetinden) 0.25 g poleni etkili bir şekilde lekeledi. Bununla birlikte, farklı polenler farklı şekilde boyanır. Polen taneleri çok hafif veya çok ağır lekelenirse, tanımlama zor olabilir. Mümkün olduğunda, çalışmada bulunması beklenen polen türlerini uygun şekilde boyamak için gereken leke çözeltisinin hacmi, deneysel örneklerin işlenmesine başlamadan önce doğrulanmalıdır. Bununla birlikte, deneysel örneklerden biri uygun şekilde boyanmazsa, düzeltilebilir. Çok ağır lekelenmiş bir polen örneğini hafifletmek için, numuneyi suyla ve ardından etanolle durulayın. Polen, ayırt edici özellikleri görecek kadar iyi boyanmamışsa, birkaç damla daha leke eklenebilir. Gliserin eklenmeden önce bu örneklerin lekesi kontrol edilmelidir. Benzer şekilde, polen kalıntıları için ideal gliserin hacmini belirlemek için bazı deneme yanılma gerekebilir. On beş damla gliserin, bu çalışmadaki numuneleri kurumaya karşı uygun şekilde korurken, polen kalıntısını ışık mikroskobu yoluyla aşağı akış tanımlaması için ideal bir konsantrasyona seyreltti. Diğer polen kalıntısı miktarları, kurumayı önlemek ve montajı kolaylaştırmak için az ya da çok gliserin gerektirebilir.
Yazarların açıklayacak hiçbir şeyleri yoktur.
Dr. Gretchen Jones'a (USDA-ARS, APMRU, College Station, TX) renk sıralama ve asetoliz analizine yardımcı olduğu için teşekkür ederiz. Bu araştırma, Oregon Eyaleti Arıcılar Birliği tarafından RSS'ye sağlanan araştırma fonları ile desteklenmiştir.
| Name | Company | Catalog Number | Comments |
| #8 hardware cloth | 2.7 mm aperture | ||
| 10 mL graduated cylinder | |||
| 1000 uL micropipette tips | |||
| 1250 mL filter micropipette tips | |||
| 15 x 75 mm glass slides | Thickness: 0.93 mm - 1.05 mm | ||
| 2 mL microcentrifuge tubes | |||
| 250 mL graduated Borosilicate glass beakers (x3) | VWR | 10754-952 | |
| 50 mL graduated Borosilicate glass beakers (x6) | VWR | 10754-946 | |
| 95% EtOH | Pharmco AAPER | 111000200DM55 | ACS/USP/Kosher grade |
| Butyl vinyl gloves | |||
| Centrifuge | 1060 x g maximum speed; horizontal swing preferred | ||
| Chemical safety goggles | |||
| Color guide | Pantone | SKU: GP1601A | Solid coated |
| Coverslip of 1 or 1.5 | Thickness: 0.13 mm - 0.19 mm | ||
| Distilled water | |||
| Forceps | |||
| Fume hood | |||
| Glacial acetic acid | BDH Chemicals | BDH3092 | ACS grade |
| Glass funnel | |||
| Glycerin | Humco | 103196001_1 | USP grade, 99.5%, anhydrous |
| Hazardous waste containers | |||
| Hive tool | |||
| Hot block | Must reach 80 degree C | ||
| Lab coat with long sleeves | |||
| Latex or polyurethane foam | |||
| Microscope | |||
| Nailpolish, clear | |||
| Nitrile gloves | |||
| P1000 pipette | VWR | ||
| Petri dish | |||
| Plastic spoon | |||
| Safranin | Ward's Science | 470302-322 | Lab grade |
| Smoker | For pollen trap installation | ||
| Sodium bicarbonate | EMD Millipore | SX0320 | ACS grade, powder |
| Squirt bottles (x2) | |||
| Sulfuric acid | EMD Millipore | SX1244 | ACS grade |
| Sundance Bottom Mount Pollen Trap | Betterbee Beekeeping Supply | PTRAPB | |
| Tape | |||
| Wooden stir sticks | |||
| Wooden tooth picks |
- Klein, A. M., Vaissière, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C., Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences. 274 (1608), 303-313 (2007).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Pettis, J. S. A survey of honey bee colony losses in the United States, fall 2008 to spring 2009. Journal of Apicultural Research. 49 (1), 7-14 (2010).
- vanEngelsdorp, D., Hayes, J., Underwood, R. M., Caron, D., Pettis, J. S. A survey of managed honey bee colony losses in the USA, fall 2009 to winter 2010. Journal of Apicultural Research. 50 (1), 1-10 (2011).
- vanEngelsdorp, D., et al. A national survey of managed honey bee 2010-11 winter colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 51 (1), 115-124 (2012).
- Spleen, A. M., et al. A national survey of managed honey bee 2011-12 winter colony losses in the United States: results from the Bee Informed Partnership. Journal of Apicultural Research. 52 (2), 44-53 (2013).
- Steinhauer, N. A., et al. A national survey of managed honey bees 2012-2013 annual colony losses in the USA: results from the Bee Informed Partnership. Journal of Apicultural Research. 53 (1), 1-18 (2014).
- Lee, K. V., et al. A national survey of managed honey bee 2013-2014 annual colony losses in the USA. Apidologie. 46 (3), 292-305 (2015).
- Seitz, N., et al. A national survey of managed honey bee 2014-2015 annual colony losses in the USA. Journal of Apicultural Research. 54 (4), 1-12 (2016).
- Kulhanek, K., et al. A national survey of managed honey bee 2015-2016 annual colony losses in the USA. Journal of Apicultural Research. 56 (4), 328-340 (2017).
- Steinhauer, N., et al. Drivers of colony losses. Current Opinion in Insect Science. 26, 142-148 (2018).
- Smart, M. D., Pettis, J. S., Euliss, N., Spivak, M. S. Land use in the Northern Great Plains region of the U.S. influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 230, 139-149 (2016).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS One. 8 (7), 70182 (2013).
- Hoover, S. E., Ovinge, L. P. Pollen collection, honey production, and pollination services: managing honey bees in an agricultural setting. Journal of Economic Entomology. 111 (4), 1509-1516 (2018).
- Topitzhofer, E., Lucas, H., Chakrabarti, P., Breece, C., Bryant, V., Sagili, R. R. Assessment of pollen diversity available to honey bees (Hymenoptera: Apidae) in major cropping systems during pollination in the western United States. Journal of Economic Entomology. 112 (5), 2040-2048 (2019).
- Judd, H. J., Huntzinger, C., Ramirez, R., Strange, J. P. A 3D printed pollen trap for bumble bee (Bombus) hive entrances. Journal of Visualized Experiments. (161), e61500 (2020).
- Delaplane, K. S., Dag, A., Danka, R. G., Freitas, B. M., Garibaldi, L. A., Goodwin, R. M., Hormaza, J. I. Standard methods for pollination research with Apis mellifera. Journal of Apicultural Research. 52 (4), 1-28 (2013).
- Barker, R. J. The influence of food inside the hive on pollen collection by a honeybee colony. Journal of Apicultural Research. 10 (1), 23-26 (1971).
- Levin, M. D., Loper, G. M. Factors affecting pollen trap efficiency. American Bee Journal. 124 (10), 721-723 (1984).
- Webster, T. C., Thorp, R. W., Briggs, D., Skinner, J., Parisian, T. Effects of pollen traps on honey bee (Hymenoptera: Apidae) foraging and brood rearing during almond and prune pollination. Environmental Entomology. 14 (6), 683-686 (1985).
- Gemeda, T. K., Li, J., Luo, S., Yang, H., Jin, T., Huang, J., Wu, J., Nascimento, F. S. Pollen trapping and sugar syrup feeding of honey bee (Hymenoptera: Apidae) enhance pollen collection of less preferred flowers. PLoS One. 13 (9), 0203648 (2018).
- Hellmich, R. L., Rothenbuhler, W. C. Relationship between different amounts of brood and the collection and use of pollen by the honey bee (Apis mellifera). Apidologie. 17 (1), 13-20 (1986).
- Weidenmüller, A., Tautz, J. In-hive behavior of pollen foragers (Apis mellifera) in honey bee colonies under conditions of high and low pollen need. Ethology. 108 (3), 205-221 (2002).
- Pernal, S. F., Currie, R. W. The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.). Behavioral Ecology and Sociobiology. 51 (1), 53-68 (2001).
- Couvillon, M. J., et al. Honey bee foraging distance depends on month and forage type. Apidologie. 46, 61-70 (2015).
- Percival, M. Pollen collection by Apis mellifera. New Phytologist. 46, 142-165 (1947).
- Synge, A. D. Pollen collection by honey bees (Apis mellifera). Journal of Animal Ecology. 16, 122-138 (1947).
- O'Neal, R. J., Waller, G. D. On the pollen harvest by the honey bee (Apis mellifera L.) near Tucson, Arizona (1976-1981). Desert Plants. 6, 81-109 (1984).
- Eckert, C. D., Winston, M. L., Ydenberg, R. C. The relationship between population size, amount of brood, and individual foraging behaviour in the honey bee, Apis mellifera. Oecologia. 97 (2), 248-255 (1994).
- Free, J. B. The flower constancy of honey bees. Journal of Animal Ecology. 32 (1), 119-132 (1963).
- van der Moezel, P. G., Delfs, J. C., Pate, J. S., Loneragan, W. A., Bell, D. T. Pollen selection by honeybees in shrublands of the Northern Sandplains of Western Australia. Journal of Apicultural Research. 26 (4), 224-232 (1987).
- Hill, P. S., Wells, P. H., Wells, H. Spontaneous flower constancy and learning in honey bees as a function of color. Animal Behaviour. 54 (3), 615-627 (1997).
- Barth, O., Munhoz, M., Luz, C. Botanical origin of Apis pollen loads using colour, weight and pollen morphology data. Acta Alimentaria. 38, 133-139 (2009).
- Colwell, M. J., Williams, G. R., Evans, R. C., Shutler, D. Honey bee-collected pollen in agro-ecosystems reveals diet diversity, diet quality, and pesticide exposure. Ecology and Evolution. 7 (18), 7243-7253 (2017).
- Stoner, K. A., Cowles, R. S., Nurse, A., Eitzer, B. D. Tracking pesticide residues to a plant genus using palynology in pollen trapped from honey bees (Hymenoptera: Apidae) at ornamental plant nurseries. Environmental Entomology. 48 (2), 351-362 (2019).
- Almeida-Muradian, L., Pamplona, L. C., Coimbra, S. I., Barth, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis. 18 (1), 105-111 (2005).
- Lau, P., Bryant, V., Rangel, J. Determining the minimum number of pollen grains needed for accurate honey bee (Apis mellifera) colony pollen pellet analysis. Palynology. 42 (1), 36-42 (2018).
- Erdtman, G. . Handbook of palynology: morphology, taxonomy, ecology: an introduction to the study of pollen grains and spores. , (1969).
- Jones, G. D. Pollen analyses for pollination research, acetolysis. Journal of Pollination Ecology. 13 (21), 203-217 (2014).
- Richardson, R. T., Lin, C. H., Sponsler, D. B., Quijia, J. O., Goodell, K., Johnson, R. M. Application of ITS2 metabarcoding to determine the provenance of pollen collected by honey bees in an agroecosystem. Applied Plant Science. 3 (1), 1-6 (2015).
- Dimou, M., Thrasyvoulou, A., Tsirakoglou, V. Efficient use of pollen traps to determine the pollen flora used by honey bees. Journal of Apicultural Research. 45 (1), 42-46 (2005).
- Szczesna, T., Rybak-Chmielewska, H., Chmielewski, W. Effect of infestation of pollen loads with acarid mites on amino acid content and organoleptic characteristics of the product. Pszczelnicze Zeszyty Naukowe. 43 (1), 235-245 (1999).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS One. 8 (10), 77550 (2013).
- Garbuzov, M., Couvillon, M. J., Schürch, R., Ratnieks, F. L. Honey bee dance decoding and pollen-load analysis show limited foraging on spring-flowering oilseed rape, a potential source of neonicotinoid contamination. Agriculture, Ecosystems & Environment. 203, 62-68 (2015).
- Moeller, F. E. Managing colonies for pollen production. Proceedings of 26th International Agricultural Congress. , 232-239 (1977).
- Dustmann, J. H., Ohe, W. V. D. Einfluss von Kälteeinbrüchen auf die Frühjahresentwicklung von Bienenvölkern (Apis mellifera L). Apidologie. 19 (3), 245-254 (1988).
- Schmickl, T., Crailsheim, K. J. Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages. Journal of Comparative Physiology A. 187 (7), 541-547 (2001).
- Hodges, D. . The pollen loads of the honeybee: a guide to their identification by colour and form. , (1974).
- Jones, G. D. Pollen extraction from insects. Palynology. 36 (1), 86-109 (2012).
- . Chemical resistance guide. Permeation and degradation data. 8th Ed Available from: https://ehs.unc.edu/files/2015/09/Ansell_8thEditionChemicalResistanceGuide.pdf (2020)
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved