Monitoramento de Elastase e Cathepsin G Atividade em Amostras de Espiuma Humana
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os protocolos aqui descritos fornecem um guia para visualizar e quantificar a atividade de proteases neutrófilos na escarro humana. As aplicações dessa análise abrangem desde a avaliação de tratamentos anti-inflamatórios, até validação de biomarcadores, triagem de medicamentos e grandes estudos clínicos de coorte.
Resumo
As proteases são reguladores de inúmeros processos fisiológicos e a investigação precisa de suas atividades continua sendo um desafio biomédico intrigante. Entre as ~600 proteases codificadas pelo genoma humano, as proteases de soroitina neutrófila (NSPs) são investigadas minuciosamente por seu envolvimento no surgimento e progressão de condições inflamatórias, incluindo doenças respiratórias. Exclusivamente, NSPs secretados não só difusos dentro de fluidos extracelulares, mas também localizam-se em membranas plasmáticas. Durante a formação de armadilha extracelular de neutrófilos (NETs), os NSPs tornam-se parte integrante da cromatina secreta. Tal comportamento complexo torna a compreensão da fisiopatologia nSPs uma tarefa desafiadora. Aqui, protocolos detalhados são mostrados para visualizar, quantificar e discriminar atividades de elastrófilo livre e ligado à membrana (NE) e cathepsin G (CG) em amostras de escarro. NE e CG são NSPs cujas atividades têm papéis pleiotrópicos na patogênese da fibrose cística (CF) e doença pulmonar obstrutiva crônica (DPOC): promovem a remodelação tecidual, regulam as respostas imunes a jusante e se correlacionam com a gravidade da doença pulmonar. Os protocolos mostram como separar a fração fluida e celular, bem como o isolamento de neutrófilos da escória humana para quantificação de atividade enzimática através de repórteres baseados em transferência de energia de ressonância Förster de pequena molécula (FRET). Para reunir insights específicos sobre o papel relativo das atividades de NE e CG, uma leitura de FRET pode ser medida por diferentes tecnologias: i) medições in vitro do leitor de placas permitem alta taxa e detecção em massa da atividade protease; ii) microscopia confocal resolvetempormente a atividade ligada à membrana na superfície celular; iii) a citometria de fluxo de fret de pequenas moléculas permite a rápida avaliação de tratamentos anti-inflamatórios através da quantificação da atividade protease unicelular e fenotipagem. A implementação desses métodos abre as portas para explorar a patobiologia dos NSPs e seu potencial como biomarcadores da gravidade da doença para CF e DPOC. Dado o seu potencial de padronização, sua leitura robusta e a simplicidade da transferência, as técnicas descritas são imediatamente compartilháveis para implementação em laboratórios de pesquisa e diagnóstico.
Introdução
Neutrófilo desaróo (NE), cathepsina G (CG), proteinase 3 (PR3) e neutrophil serine protease 4 (NSP4) são os quatro proteases de soroitina neutrófila (NSPs)1. Eles são armazenados, juntamente com mieloperoxidase, dentro de grânulos primários ou azurofílicos. Devido ao seu alto teor proteolítico, a secreção dos grânulos primários é fortemente regulada e os neutrófilos devem ser sequencialmente desafiados com priming e ativação de estímulos2.
Dentro do fagolysosome, os NSPs funcionam como agentes bactericidas intracelulares3. Quando secretados, os NSPs tornam-se fortes mediadores da inflamação: eles cortam citocinas e receptores de superfície, ativando vias pró-inflamatórias paralelas3. É importante ressaltar que as condições inflamatórias apresentam uma secreção deSPs descontrolada. Por exemplo, dentro das vias aéreas inflamadas, a atividade excessiva de NE causa hipersecreção de muco, metaplasia de células de cálice, inativação de CFTR e remodelação da matriz extracelular4,5. Cathepsin G também participa da inflamação: ela se acovarda especificamente e ativa dois componentes da família IL-1, IL-36α e IL-36β6. Em conjunto com o NE, cg cleaves receptores ativados protease no epitélio das vias aéreas e também ativa TNF-α e IL-1β.
Anti-proteases endógenos como alfa-1-antitripsina, alfa-1-antiquimotripsina e o inibidor secreto leucócito protease regulam a atividade de neutrófilo e catepsina G5. No entanto, ao longo da progressão da doença pulmonar, a secreção contínua das proteases excede estequiometricamente o escudo anti-protease, levando à não resolução de neutrófilia nas vias aéreas, piora da inflamação e dano tecidual5,7. Embora a concentração e a atividade do NE em frações solúveis das vias aéreas do paciente tenham se mostrado um biomarcador promissor da gravidade da doença8,NE e CG também associam-se à membrana plasmática neutrófila e ao DNA extracelular através de interações eletrostáticas9,10 onde se tornam menos acessíveis aos anti-proteases. É importante ressaltar que estudos pré-clínicos definiram um cenário em que a atividade de protease associada à superfície celular aparece mais cedo e/ou independentemente de sua contraparte solúvel4,11. Na verdade, para se tornar detectável, a atividade protease livre primeiro precisa sobrecarregar o escudo anti-protease. Em vez disso, na superfície celular, a atividade de protease ligada à membrana permanece pelo menos parcialmente intacta devido à inacessibilidade de grandes inibidores da membrana plasmáticacelular 12. Esse comportamento complexo de protease tem consequências importantes no início e propagação da inflamação mediada por neutrófilos e, portanto, precisa ser investigado com ferramentas precisas e informativas.
Ao longo dos anos, as sondas baseadas em transferência de energia de ressonância de Förster (FRET) encontraram inúmeras aplicações biomédicas como ferramentas que avaliam eficiente e rapidamente uma atividade específica de protease em amostras humanas13. Para funcionar, os repórteres protease são compostos por um motivo de reconhecimento (ou seja, um peptídeo), que é reconhecido pela enzima alvo e conta com o FRET, um processo físico onde, após a excitação, um fluoróforo doador transfere energia para uma molécula aceitadora. O processamento operado pela enzima sobre o repórter, ou seja, o decote da parte de reconhecimento, resulta no aceitador para difundir longe do doador: a atividade enzimática é, portanto, medida como uma mudança dependente do tempo no doador sobre a fluorescência aceitadora. Essa leitura é auto-normalizadora e racionmétrica, portanto apenas marginalmente afetada por condições ambientais como pH e concentração de sonda local. NEmo-114 e sSAM15 são sondas FRET que relatam especificamente sobre a atividade NE e CG, respectivamente. No entanto, tais repórteres não localizam especificamente qualquer compartimento celular, portanto, são empregados para monitorar a atividade de protease presente nos fluidos humanos. Para monitorar a atividade de protease de forma espacialmente localizada, nós e outros desenvolvemos sondas FRET que se associam a componentes subcelulares através de etiquetas moleculares14,15,16,17,18,19. Tal estratégia sintética permitiu o desenvolvimento de NEmo-2 e mSAM, duas sondas FRET equipadas com âncoras lipídicas que se localizam na membrana plasmática. Esses repórteres alimentaram uma compreensão mais profunda das proteases ne e CG em fibrose cística e doenças pulmonares obstrutivas crônicas14,15.
Aqui, protocolos detalhados são fornecidos para a visualização e quantificação de atividades de NE e CG solúveis e ligadas à membrana em escarro humano por meio da série NEmo e SAM de sondas FRET. Para abordar diversos aspectos da fisiopatologia nSPs e fornecer uma série de métodos que podem ser empregados de acordo com a necessidade específica do usuário, a análise via espectroscopia de fluorescência, microscopia de fluorescência e citometria de fluxo são mostradas.
Protocolo
Os seguintes protocolos descrevem a análise realizada em escarro humano. O manuseio de amostras humanas foi aprovado pelo comitê de ética da Universidade de Heidelberg e o consentimento por escrito informado foi obtido de todos os pacientes ou de seus pais/responsáveis legais (S-370/2011) e controles saudáveis (S-046/2009).
NOTA: Os seguintes protocolos descrevem a preparação da amostra e a quantificação da atividade de proteases de serina de neutrófilos (NSPs). Os procedimentos experimentais aqui apresentados focam na medição da atividade de escarro e neutrófilo14,20,21 (NE) ou catepsina G15 (CG). No entanto, pequenas adaptações no protocolo de preparação da amostra tornam possível a análise de células derivadas do sangue e homogeneiza tumorais. Além disso, as atividades de metaloproteinase 12 e cathepsin S podem ser investigadas da mesma forma por meio de sondas FRET dedicadas22,23,24,25,26.
1. Preparação da amostra: isolamento celular e separação supernacante
NOTA: Se possível, o tratamento da escarro deve ser realizado dentro de 120 minutos após a expectativa e a escarro deve ser armazenada no gelo até um processamento posterior.
- Se a expectativa espontânea de escarro não for possível, induza a escarro como descrito anteriormente19. Brevemente, inspire 200 μg do salbutamol β-2-receptor-antagonista antes de iniciar o procedimento de indução de escarro. Posteriormente, inale uma solução salina hipertônica (6%) por 15 min usando um nebulizador. Colete a escarro esperançosa em uma placa de Petri.
- Separe os mochilão do muco da saliva em uma placa de Petri com a ajuda de uma ponta de pipeta.
- Pesar o muco.
NOTA: O peso médio de uma amostra de muco é de 0,8 g (variando entre 0,1 g e 5 g); 0,1 g são geralmente suficientes para realizar os procedimentos mencionados. - Adicione 4 partes (v/w) de 10% de sputolysin (em PBS) à escarro (por exemplo: 4 mL de 10% de sputolysina para cada grama de escarro).
ATENÇÃO: A sputolysina é composta de dithiothreitol concentrado no tampão fosfato, portanto, manuseie-o com cuidado. - Incubar a mistura à temperatura ambiente (RT) em um agitador de balanço por 15 minutos para dissolver o muco. Por razões de segurança, coloque o agitador em um capô de fumaça.
- Sacie a reação adicionando o mesmo volume de PBS frio (por exemplo: 1 mL de PBS frio para cada mL de 10% de Sputolysin).
- Misture por pipetação para obter uma solução homogênea.
- Filtre a mistura através de um coador de célula de nylon de 100 μm em um tubo de 50 mL.
- Repita a etapa de filtragem através de um coador de célula de nylon de 40 μm.
- Centrifugar a solução por 10 min a 300 x g a 4 °C.
- Transfira a fração supernasal cuidadosamente para um tubo fresco e armazene-a no gelo.
NOTA: As frações supernasas podem ser armazenadas a -20 °C ou -80 °C até uma análise mais aprofundada. - Levemente resuspenque a pelota de célula em 500 μL de PBS frio e coloque-a no gelo.
NOTA: A fração celular deve ser processada imediatamente.
2. Medida de atividade de protease de serina de neutrófilo
NOTA: Aqui, diferentes métodos são introduzidos para quantificar a atividade de NSPs por meio de repórteres FRET. A escolha da tecnologia é ditada pela questão biomédica específica e pelo propósito do experimento. As sondas apresentadas foram extensivamente testadas para sua especificidade contra um conjunto de enzimas relevantes pulmonares14,15. Embora as sondas sejam específicas para sua enzima alvo, verifique sempre a especificidade da sonda na amostra clínica de interesse. Isso pode ser conseguido incubando a amostra com um inibidor específico de protease antes da adição da sonda, o que deve abolir qualquer aumento na razão D/A.
- Quantificação de atividade de NSPs solúveis via ensaio fluorímetro ou leitor de placas
NOTA: A atividade protease em frações solúveis da amostra pode ser detectada com qualquer instrumento capaz de detecção de fluorescência.- Descongelar enzimas no gelo.
- Até usar, mantenha NE e CG em tampão de armazenamento ácido (acetato de sódio de 50 mM, 200 mM NaCl, pH 5.5) para evitar auto-decote.
- Para configurar uma curva padrão enzimácica, prepare uma diluição serial de 1:2 da enzima (33,9 - 0,271 nM para NE; 42,6 - 0,333 nM para CG) no buffer de ativação (10 mM Tris-HCl, 500 mM NaCl no pH 7.5). O buffer de ativação tem um pH neutro e, portanto, permite que a catálise enzimática ocorra de forma eficiente.
- Para preparar a maior concentração padrão (concentração de NE: 33,9 nM), diluir 1 μL de NE (33,9 μM) em 999 μL de buffer de ativação.
- Para preparar o segundo padrão (concentração ne: 16,95 nM), misture 200 μL da primeira diluição com 200 μL de tampão de ativação.
- Prossiga em conformidade para preparar as diluições restantes de 1:2.
- O último padrão, que é o em branco, é composto de tampão de ativação pura. Recomenda-se a medição de duplicatas técnicas ou triplicados. Durante a preparação padrão e amostra, tente manter frascos no gelo.
- Paralelamente à preparação padrão, diluem amostras de escarro no buffer de ativação. Diluir as amostras humanas antes de avaliar sua atividade de protease para permanecer na faixa linear de aumento do sinal de repórter (razão doador/aceitador). Se as amostras dos pacientes fossem deixadas sem diluido, o decote aconteceria muito rapidamente para um ajuste confiável. Uma vez que a escarro saudável do doador contém menos proteases ativas em comparação com amostras de pacientes com CF e DPOC, diferentes diluições são geralmente realizadas (1:10 para supernanato de escarro saudável, 1:20-500 para supernanato de escarro de dpoc ou cf).
NOTA: Para medir quantitativamente a atividade da protease em amostras onde sua concentração é desconhecida, uma curva padrão com concentrações enzimáticas conhecidas precisa ser medida em paralelo, idealmente na mesma placa. A concentração de enzima ativa na escarro humana é calculada através da interpolação das encostas medidas em amostras de escarro humanas com as medidas com as curvas padrão. - Antes de preparar as amostras para medição, configure o instrumento. Defina o comprimento de onda de excitação para a sonda NE FRET (NEmo-114) para 354 nm, e defina o comprimento de onda de detecção para 400 nm para o doador e 490 nm para o aceitador. Defina o comprimento de onda de excitação para a sonda CG FRET (sSAM15) para 405 nm, e defina a emissão para 485 (doador) e 580 nm (aceitador).
- Adicione 40 μL de amostras, padrão ou em branco nos poços de uma placa preta de 96 poços de meia área.
- Para preparar o mix mestre contendo os repórteres (concentração do repórter no mix mestre: 10 μM), diluir o estoque da sonda (1 mM em DMSO) 1:100 no buffer de ativação. Prepare o volume de mixagem mestre necessário multiplicando 10 μL x o número de poços de placa necessários. Para alcançar a concentração final ideal (2 μM) para medição de fluorescência dos repórteres NEmo-1 e sSAM, adicione 10 μL da mistura mestre a cada poço (contendo 40 μL de cada amostra, padrão ou em branco) e inicie a leitura. Os repórteres NEmo-1 e sSAM monitorarão, portanto, a atividade solúvel de elastrófilo e cathepsina G, respectivamente.
NOTA: Se um injetor de reagente não estiver disponível, certifique-se de iniciar a leitura o mais rápido possível após a adição do repórter às amostras. - Inicie a medição do leitor de placas e regise o aumento da relação doador/aceitador a cada 60-90 segundos por pelo menos 20 minutos ou até que o aumento do sinal atinja um patamar.
- Uma vez exportados os dados, calcule a razão doador/aceitador (razão D/A) dividindo as unidades de fluorescência relativa do doador (RFU) com a RFU aceitadora para cada ponto de tempo e amostra.
- Calcule a média da razão D/A e o desvio padrão de cada amostra.
- Determine a inclinação dentro do crescimento linear da variação da relação D/A. A inclinação é um indicador da taxa de decote enzimádulo para uma sonda FRET. Calcule a concentração de enzima ativa na escarro, encaixando as encostas de regressão linear derivadas das amostras humanas com as calculadas a partir do padrão enzimático.
- Quantificação de atividade de NSPs ligada à membrana através de ensaio fluorímetro ou leitor de placas
- Isole células de escarro como descrito acima. Resuspend 3 x 104 células em um volume de 40 μL de PBS. Adicione bem as células ao leitor de placas.
- Coloque o instrumento. Defina o comprimento de onda de excitação para a sonda NE FRET ligada à membrana (NEmo-214) para 405 nm, e defina o comprimento de onda de detecção para 485 nm para o doador e 580 nm para o aceitor. Defina o comprimento de onda de excitação para a sonda CG FRET ligada à membrana (mSAM15) para 405 nm, e defina a emissão para 485 (doador) e 580 nm (aceitador).
- Para preparar a mistura mestre contendo os repórteres, diluir o estoque da sonda no buffer de ativação para uma concentração de 10 μM. Prepare o volume de mix mestre necessário multiplicando 10 μL X o número de poços de placa necessários. Para alcançar a concentração final ideal (2 μM) para medição de fluorescência dos repórteres NEmo-2 e mSAM, adicione 10 μL da mistura mestre a cada poço (contendo 40 μL de cada amostra, padrão ou em branco) e inicie a leitura. Os repórteres NEmo-2 e mSAM monitorarão, portanto, a atividade de elastrófilo neutrófilo ligado à membrana e a atividade G de cathepsina, respectivamente.
NOTA: Um controle negativo celular pode ser usado, por exemplo, em células que não secretam ativamente NSPs. Por exemplo, a incubação dos repórteres com progenitores 3 x 104 leucócitos HL-60 progenitoras HL-60 proyelocíticas representa um controle negativo de decote válido. - Mudança recorde na relação doador/aceitador por pelo menos 20 minutos ou até que o aumento do sinal atinja um patamar. Analise os dados conforme descrito acima.
- Medição de atividade de NSPs ligada à membrana por microscopia de fluorescência
- Determine o número de condições que precisam ser analisadas.
NOTA: Para cada medição da amostra de escarro, recomenda-se a preparação e análise de controle positivo adicional (PC) e negativo (NC). - Para cada medição, resuspende 3 x 104 células de escarro em um volume de 50 μL PBS em um tubo de 1,5 mL.
- Como controle negativo, incubar células de escarro com um inibidor específico (Sivelestat, inibidor específico de NE, ou inibidor de cathepsina G I, inibidor de CG específico, a uma concentração final de 100 μM). Incubar por 10 min na RT.
- Como controle positivo, incubar células de escarro com a enzima apropriada (NE ou CG a 340 nM ou 200 nM, respectivamente) por 10 min na RT.
- Adicione 50 μL de PBS contendo o repórter FRET e uma mancha nuclear (em uma diluição final de 1:1000) a cada tubo (células tratadas com controle positivo, células tratadas com controle negativo e células não tratadas) a fim de alcançar uma concentração final da sonda de 2 μM. Incubar por 10-20 min na RT.
IMPORTANTE: A adição de uma mancha nuclear facilita a imagem de microscopia de fluorescência, pois permite procurar células de escarro de interesse sem usar os canais da sonda FRET e, portanto, evitar o branqueamento de repórteres. Além disso, a mancha de DNA permite segmentar células de escarro de acordo com a forma de seu núcleo. Por exemplo, os neutrófilos podem ser facilmente identificados por seus núcleos multilobulares. Além disso, informações adicionais sobre a viabilidade das células podem ser recuperadas (neutrófilos com um núcleo mais segmentado são mais propensos a estar vivos).
NOTA: Além do ligado à membrana, a atividade de NE ou CG ligados ao DNA na escarro humana pode ser medida da mesma forma por meio de H-NE e H-CG, sondas FRET extracelulares associando DNA27. Ao preparar a mistura mestre, H-NE e H-CG podem ser adicionados na concentração de 10 μM e incubados com escarro antes da preparação de citospin e slides. A quantificação da razão D/A no DNA extracelular prossegue de forma idêntica ao NEmo-2 e mSAM, com a única diferença de que os agregados extracelulares de DNA são segmentados em vez de células únicas27. - Sacie a reação adicionando 100 μL de PBS gelado, e transfira amostras no gelo.
- Citospine a mistura em lâminas de microscopia, ar seco, fixe com metanol gelado 10% por 10 minutos, ar seco e montar com um meio de montagem adequado.
NOTA: Os slides de microscopia podem ser armazenados a 4 °C no escuro por até um mês até uma análise mais aprofundada. - Adquira imagens de microscopia usando um microscópio confocal com um objetivo de óleo PL APO 40x ou 63x. Para aumentar a qualidade da imagem e reduzir o tempo de aquisição, recomenda-se um modo de aquisição de imagem sequencial.
- Imagem a mancha nuclear primeiro através de excitação de 633 nm com a linha hélio-neon-laser e registrar sua emissão entre 650 e 715 nm.
- Registo o doador (coumarin 343) do repórter FRET entre 470 e 510 nm após excitação a 458 nm com um laser de argônio. Adquirir a emissão sensibilizada (5,6-TAMRA) entre 570 e 610 nm após excitação única do doador.
- Registo a emissão direta de aceitadores em um canal separado entre 470 e 510 nm após a excitação ideal aceitadora em 561 nm usando o laser de estado sólido bombeado diodo (DPSS).
- Coloque o orifício no início do experimento e mantenha durante a sessão de imagem.
NOTA: Devido ao seu pequeno tamanho, recomenda-se o uso de um objetivo de microscópio de 40x ou 63x para visualizar os neutrófilos corretamente. Geralmente, as imagens são adquiridas em vários canais consecutivos, começando com o comprimento de onda de excitação mais longo para evitar o fotobleaching do repórter durante a aquisição.
- Imagem de pelo menos 100 células por condição para estatísticas conclusivas. Para análise de imagens de microscopia, use um software apropriado: segmente as células e calcule a razão D/A em uma base pixel por pixel, depois calcule a média ou mediana de uma determinada região de interesse que é selecionada manualmente pelo usuário. Para resultados representativos, consulte Figura 1.
- Determine o número de condições que precisam ser analisadas.
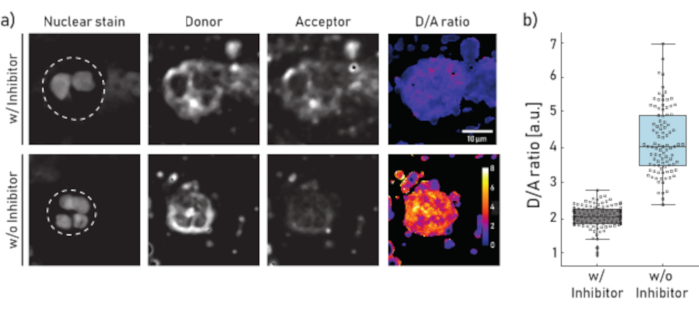
Figura 1: Imagens representativas e quantificação da atividade ne ligada à membrana em neutrófilos isolados da escarro do paciente CF. a) Imagens de microscopia confocal representativa de neutrófilos pré-incubados (painel superior) por 10 min com 100 μM de Sivelestat (w/) ou não tratadas (w/o) (painel inferior) antes do repórter NEmo-2 (2 μM) adição. A primeira coluna da esquerda mostra a mancha nuclear, o segundo o canal do doador, o terceiro canal de aceitação e o último a razão de D/A calculada obtida dividindo canais doadores e aceitantes em uma base pixel a pixel. As fronteiras da região de interesse (neutrófilo único) são retratadas como linha tracejada. São indicadas barras de escala (10 μm) e de calibração (razão D/A). b) Parcelas de caixa e ponto mostrando a razão D/A de neutrófilos escarro de um paciente cf representativo. Células incubadas com inibidor e células não tratadas são mostradas em cinza e azul, respectivamente. Cada ponto representa uma célula (N: c/ inibidor = 113 e inibidor w/o = 96). Clique aqui para ver uma versão maior desta figura.
- Medição de atividade de NSPs ligada à membrana por citometria de fluxo
- Resuspend 1 x 106 células em 100 μL de PBS em um tubo de fundo redondo de poliestireno FACS de 5 mL e coloque o tubo no gelo.
- Para portão de neutrófilos de escarro, utilize os seguintes anticorpos: CD14 (1:50), CD16 (1:50), CD45 (1:33) e CD66b (1:50). Prepare mistura mestre suficiente para todas as amostras. Coloque a mistura mestre no gelo no escuro.
- Configure a estratégia de gating conforme descrito na Figura 2. Os neutrófilos são fechados como 7AAD-CD45+CD14-CD16+CD66b+ eventos. Os eventos fechados serão então analisados para sua atividade de protease ligada à membrana para seu doador (λexc = 405 nm, λem = 450/50 nm) e acceptor (λexc = 405 nm, λem = 585/42 nm) intensidades fluorescentes médias (MFIs).
- Adicione 2 μL de FcBlock a cada amostra e incubar por 5 min no RT.
- Adicione os anticorpos escolhidos a cada tubo, e incubar por 30 minutos no gelo no escuro.
- Lave as células adicionando 2 mL de PBS frio, e centrífuga por 5 min a 300 x g e 4 °C. Descarte células supernascidas e resuspendas em 200 μL de PBS frio.
- Divida os 200 μL em dois tubos com 100 μL cada e adicione 5 μL de solução de coloração de viabilidade celular em cada tubo. Coloque tubos no gelo.
- Adicione um inibidor NSP específico apropriado (para ne use Sivelestat a 225 μM de concentração final, para o uso de CG o inibidor G A 100 μM) ao tubo de ensaio de controle negativo (NC). Incubar as amostras em RT por 10 minutos no escuro.
- Adicione 100 μL de PBS frio à amostra, filtre-o através de um filtro de 40 μm em um tubo FACS limpo para evitar entupimento do instrumento.
- Adicione o repórter (para NE, NEmo-2 em uma concentração final de 4 μM, para CG, mSAM em uma concentração final de 2 μM) à amostra NC, suavemente vórtice do tubo.
- Comece a adquirir células incubadas com o inibidor específico para ajustar ligeiramente, se necessário, os portões, bem como as tensões dos PMTs do repórter.
- Regisso pelo menos 1000 neutrófilos. Mantenha a amostra em temperatura ambiente.
NOTA: Embora mais eventos possam ser registrados, 1000 células garantem um bom compromisso entre estatísticas adequadas e tempo de gravação. - Proceda com os seguintes tubos (amostras de escarro não tratadas) em conformidade.
- Para registrar alterações na razão D/A devido à atividade de protease ligada à membrana, registo 1000 neutrófilos de cada tubo a cada 5 a 10 minutos.
NOTA: Após o sucesso do decote do repórter fret, a intensidade do canal de doadores MFIs aumentará com o tempo. A intensidade do canal de aceitação MFIs deve diminuir ou permanecer constante ao longo do tempo. - Calcule a razão FRET dividindo o doador pelos valores do canal aceitador para as amostras medidas nos neutrófilos únicos viáveis fechados.
- Normalize as medições amostrais dividindo-as com o ponto de tempo correspondente de 0 min (para resultados representativos e análises ver Figura 2).
NOTA: A gravação de pelo menos dois pontos de tempo (ou seja, 0 e 10 min) é necessária para uma medição dinâmica da variação da relação D/A. Para normalizar a medição de atividade para cada amostra, a razão D/A medida em pontos de tempo posteriores (por exemplo, 10 min) é dividida pela razão calculada imediatamente após a adição da sonda (0 min).
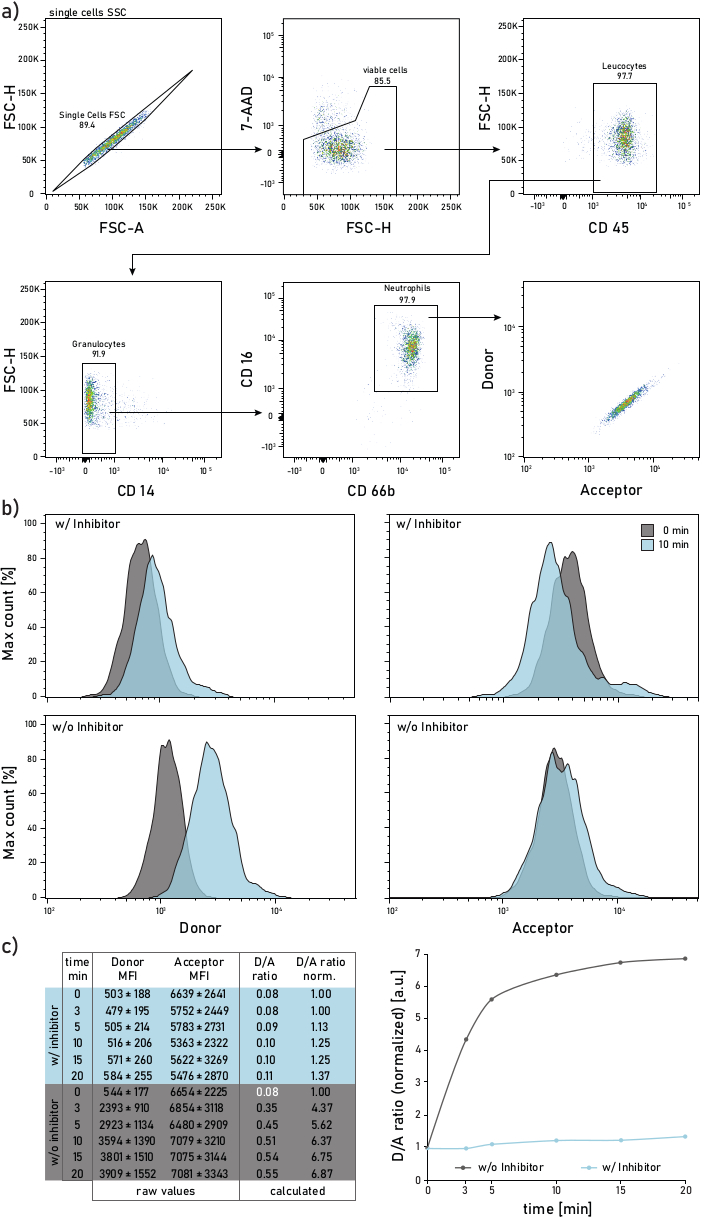
Figura 2: Estratégia de gating e parcelas representativas da atividade ne ligada à membrana medida em neutrófilos isolados da escarro do paciente CF. a) Para os neutrófilos de escarro são utilizados os seguintes anticorpos: CD14 (1:50), CD16 (1:50), CD45 (1:33) e CD66b (1:50). Os neutrófilos são fechados como 7-AAD-CD45+CD14-CD16+CD66b+ eventos. Os eventos fechados são analisados para seu doador (λexc= 405 nm, λem= 450/50 nm) e acceptor (λexc= 405 nm, λem= 585/42 nm) intensidades médias de fluorescência (IM). b) Histogramas representativos de neutrófilos de escarro cf analisados para sua atividade ne ligada à membrana. A coluna esquerda mostra o sinal do doador, a coluna direita mostra o sinal de aceitador. A linha superior mostra intensidades médias de fluorescência de células tratadas com Sivelestat (c/) por 10 minutos antes da adição do repórter. A linha inferior mostra células não tratadas (w/o) cuja fluorescência repórter é medida imediatamente (0 min, cinza) e 10 minutos (azul) após a adição de repórter. Neutrófilos são fechados de acordo com a estratégia mostrada no painel a. c) A tabela de dados mostra um conjunto de dados representativo consistindo de MFIs brutos para o doador e sinal de aceitador em neutrófilos medidos ao longo de vários pontos de tempo (0-3-5-10-15-20 min) bem como a razão de D/A calculada. A razão D/A pode ser normalizada, ou seja, para o ponto de tempo de 0 min (fonte branca). 0 min indica uma gravação feita o mais rápido possível após a adição do repórter ao tubo de fluxo com células de escarro manchadas. Os dados de MFIs são mostrados como ± desvio padrão para 1000 neutrófilos. Clique aqui para ver uma versão maior desta figura.
Resultados
Os resultados apresentados na Figura 1a ilustram um conjunto de dados representativo de microscopia. O sinal nuclear é usado para identificar neutrófilos por seus núcleos segmentados característicos. A região de interesse (ROI) é selecionada manualmente (linha tracejada na Figura 1a). A imagem da razão D/A é calculada dividindo as intensidades do canal doador pelas intensidades do canal aceitador em uma base pixel por pixel. Na última etapa, é calculada a relação média de D/A por célula (ROI). Na Figura 1b cada ponto representa a média de um ROI (neutrófilo). Recomenda-se a imagem e avaliar cerca de 100 células por condição.
Uma estratégia representativa de citometria de fluxo é mostrada na Figura 2a. Tal gating permite discriminar e estudar neutrófilos de escarro. Para evitar derramamento de fluorescência ou artefatos de compensação, recomenda-se dedicar uma linha laser (por exemplo, laser azul) à detecção de fluorescência da sonda FRET. A compensação da fluorescência de citometria de fluxo deve ser realizada para anticorpos e não para a sonda FRET. A Figura 2b retrata a distribuição do MFI em 0 e 10 minutos após a adição do repórter. Cada linha na Figura 2c indica os valores médios de doador e aceitação de MFIs para 1000 neutrófilos de escarro. A razão D/A é calculada dividindo os MFIs doadores e aceitos. O curso de tempo na Figura 2c do lado direito mostra a progressão da medida: após um rápido aumento inicial, a razão D/A atinge um platô, de acordo com a atividade da enzima ligada à membrana.
Discussão
Os protocolos relatados explicam diferentes abordagens para quantificar a atividade de elastase neutrófila e cathepsina G em amostras de escarro humana. Pontos críticos para uma medição bem sucedida da atividade enzimária são o i) tempo preciso e padronização do procedimento operacional e ii) o uso de controles negativos e positivos confiáveis. Se essas condições forem atendidas, os métodos descritos não se limitam à escarro, mas também podem ser facilmente adaptados à análise da atividade protease no sangue, fluidos de lavage broncoalveolar e seções de tecido ou homogeneizadores.
Cada uma das três técnicas tem seus pontos fortes e limitações, que muitas vezes se complementam. Por exemplo, a citometria de fluxo permite a análise rápida de populações de células raras, bem como fenotipagem celular, mas não tem informações de resolução espacial, que podem ser obtidas por microscopia. Em vez disso, as medidas do leitor de placas permitem a avaliação paralela de várias amostras ou condições de forma de alto rendimento. Uma vez que as células de escarro frescas não podem ser congeladas e armazenadas, os três métodos exigem que as amostras sejam processadas rapidamente após a expectativa. Isso limita a flexibilidade ou o throughput das medidas de atividade ligadas à membrana. O desenvolvimento de um protocolo de citometria de fluxo que permite fixar células após a adição da sonda e decote enzimático se abriria para a medição paralela de um maior número de tubos. Além disso, deve-se prestar especial atenção ao manuseio e armazenamento das sondas FRET. Na verdade, alguns aminoácidos presentes no substrato peptídeo, como a metionina, sofrem oxidação que leva à diminuição da sensibilidade dos repórteres. Para aumentar a vida útil do repórter (estimado em cerca de três meses a 20 °C), eles podem ser armazenados em alíquotas de pequeno volume (1-2 μL) sob gás inerte como nitrogênio ou argônio.
Na CF e em outras doenças inflamatórias pulmonares crônicas é importante detectar a inflamação o mais cedo possível, e biomarcadores confiáveis têm o potencial de alcançar tal objetivo. A possibilidade de detectar a atividade de NSPs ligada à superfície, que tem se mostrado prejudicial para o tecido circundante, também em condições em que não há ou pouca atividade livre de NE, adiciona outro nível de informações valiosas, que dificilmente podem ser alcançadas por meio de outros métodos existentes4,11.
Os repórteres podem ser usados para estudar a ligação da atividade NSP associada à membrana com a gravidade e progressão da doença pulmonar, especialmente no seu início precoce. Os métodos podem ser utilizados para monitorar a eficácia do tratamento (por exemplo, tratamentos anti-inflamatórios ou moduladores e potencializadores cftr altamente eficazes28) e investigar o amortecedor resultante da inflamação orientada por neutrófilos. Além disso, os protocolos são baseados em procedimentos amostrais não invasivos que carregam um risco muito baixo para o paciente e, portanto, podem ser usados em uma escala muito ampla e abrir as portas para inúmeras aplicações emocionantes.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Este projeto foi apoiado por subsídios do Ministério alemão da Educação e Pesquisa (FKZ 82DZL004A1 a M.A.M) e da Fundação Alemã de Pesquisa (SFB-TR84TP B08 a M.A.M). O trabalho descrito neste manuscrito foi apoiado pelo Centro Alemão de Pesquisa pulmonar (DZL) e pela EMBL Heidelberg através de uma bolsa de doutorado para M.G. Agradecemos a J. Schatterny, S. Butz e H. Scheuermann pela assistência técnica especializada.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 µm Nylon cell strainer | Corning Inc. | 431752 | |
| 2300 EnSpire (Multilabel Plate Reader) | PerkinElmer | ||
| 35x10mm Dish, Nunclon Delta | Thermo Fisher Scientific | 150318 | |
| 40 µm Nylon cell strainer | Corning Inc. | 431750 | |
| 50 mL tubes | Sarstedt | 10535253 | |
| 7-AAD, viability dye | Bio Legend | 420404 | 5 µL/100 µL |
| Balance | OHAUS Instruments (Shanghai) Co., Ltd. | PR124 | |
| BD Falcon Round-Bottom Tubes 5 mL | BD Bioscience | 352054 | |
| BD LSRFortessa cell analyzer | BD Bioscience | ||
| black flat bottom 96 well half area plate | Corning Life Science | 3694 | |
| Cathepsin G | Elastin Products Company | SG623 | |
| Cathepsin G Inhibitor I | Merck KGaA | 219372 | |
| Centrifuge 5418R | Eppendorf AG | EP5401000137 | |
| Combitips advanced 1.0 mL | Eppendorf AG | 0030 089 430 | |
| cOmplete proteinase inhibitor | Roche | 11697498001 | |
| Countig chambers improved Neubauer | Glaswarenfabrik Karl Hecht GmbH & Co KG | 40442 | |
| coverslips Ø 25mm | Thermo Fisher Scientific | MENZCB00250RA003 | |
| Cytospin 4 | Thermo Fisher Scientific | ||
| DRAQ5 (nuclear stain) | BioStatus Limited | DR50050 | 1:10000 |
| FACSDiva software, v8.0.1 | BD Bioscience | ||
| FcBlock | BD Bioscience | 564219 | |
| Fiji (Fiji Is Just ImageJ) | fiji.sc | ||
| Flow Jo software, v10 | TreeStar | ||
| FluoQ Plugin, v3-97 | |||
| Heraeus Megafuge 16R | Thermo Fisher Scientific | ||
| Human Sputum Leucocyte Elastase | Elastin Products Company | SE563 | |
| Leica SP8 confocal microscope | Leica Microsystems | ||
| Mini Rock-Shaker | PEQLAB Biotechnologie GmbH | MR-1 | |
| mouse anti-human CD14, Pe-Cy7, clone M5E2 | BD Bioscience | 557742 Lot:8221983 | 1:50 |
| mouse anti-human CD16, AF700, clone 3G8 | BD Bioscience | 557820 Lot:8208791 | 1:50 |
| mouse anti-human CD45, APC-Cy7, clone 2D1 | BD Bioscience | 557833 Lot:8059688 | 1:33 |
| mouse anti-human CD66b, PE/Dazzel 594, clone G10F5 | BioLegend | 305122 Lot:B241921 | 1:50 |
| mSAM | in house | 2 mM | |
| Multipette plus | Eppendorf AG | ||
| NEmo-1 | SiChem | SC-0200 | 1 mM |
| NEmo-2E | SiChem | SC-0201 | 2 mM |
| Pari Boy SX with an LC Sprint jet nebulizer | Pari | 085G3001 | |
| phosphate buffered saline | Gibco | 10010-015 | |
| ROTI Histokitt (mounting medium) | Carl Roth GmbH + Co.KG | 6638.1 | |
| Salbutamol | Teva GmbH | ||
| Sivelestat | Cayman Chemicals | 17779 | |
| Sputolysin | Calbiochem | 560000-1SET | |
| sSAM | in house | 2 mM | |
| SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | 10149870 | |
| Trypan Blue solution | Sigma-Aldrich | T8154 |
Referências
- Korkmaz, B., Moreau, T., Gauthier, F. Neutrophil elastase, proteinase 3 and cathepsin G: Physicochemical properties, activity and physiopathological functions. Biochimie. 90 (2), 227-242 (2008).
- Sheshachalam, A., Srivastava, N., Mitchell, T., Lacy, P., Eitzen, G. Granule Protein Processing and Regulated Secretion in Neutrophils. Frontiers in Immunology. 5, 448 (2014).
- Pham, C. T. N. Neutrophil serine proteases: Specific regulators of inflammation. Nature Reviews Immunology. 6 (7), 541-550 (2006).
- Gehrig, S., et al. Lack of neutrophil elastase reduces inflammation, mucus hypersecretion, and emphysema, but not mucus obstruction, in mice with cystic fibrosislike lung disease. American Journal of Respiratory and Critical Care Medicine. 189 (9), 1082-1092 (2014).
- McKelvey, M. C., Weldon, S., McAuley, D. F., Mall, M. A., Taggart, C. C. Targeting proteases in cystic fibrosis lung disease paradigms, progress, and potential. American Journal of Respiratory and Critical Care Medicine. 201 (2), 141-147 (2020).
- Clancy, D. M., et al. Extracellular Neutrophil Proteases Are Efficient Regulators of IL-1, IL-33, and IL-36 Cytokine Activity but Poor Effectors of Microbial Killing. Cell Reports. 22 (11), 2937-2950 (2018).
- Giacalone, V. D., Margaroli, C., Mall, M. A., Tirouvanziam, R. Neutrophil adaptations upon recruitment to the lung: New concepts and implications for homeostasis and disease. International Journal of Molecular Sciences. 21 (3), 1-21 (2020).
- Sly, P. D., et al. Risk Factors for Bronchiectasis in Children with Cystic Fibrosis. New England Journal of Medicine. 368 (21), 1963-1970 (2013).
- Owen, C. A., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Campbell, E. J. Cell surface-bound elastase and cathepsin G on human neutrophils: A novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. Journal of Cell Biology. 131 (3), 775-789 (1995).
- Brinkmann, V., et al. Neutrophil Extracellular Traps Kill Bacteria. Science. 303 (5663), 1532-1535 (2004).
- Margaroli, C., et al. Elastase Exocytosis by Airway Neutrophils Associates with Early Lung Damage in Cystic Fibrosis Children. American Journal of Respiratory and Critical Care Medicine. , (2018).
- Owen, C., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Carolina, N. Cell surface-bound elastase and cathepsin G on human neutrophils: a novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. The Journal of cell biology. 131 (3), 775-789 (1995).
- Garland, M., Yim, J. J., Bogyo, M. A Bright Future for Precision Medicine: Advances in Fluorescent Chemical Probe Design and Their Clinical Application. Cell chemical biology. 23 (1), 122-136 (2016).
- Gehrig, S., Mall, M. A., Schultz, C. Spatially resolved monitoring of neutrophil elastase activity with ratiometric fluorescent reporters. Angewandte Chemie - International Edition. 51 (25), 6258-6261 (2012).
- Guerra, M., et al. Cathepsin G Activity as a New Marker for Detecting Airway Inflammation by Microscopy and Flow Cytometry. ACS Central Science. 5 (3), 539-548 (2019).
- Hu, H. Y., et al. In vivo imaging of mouse tumors by a lipidated cathepsin S substrate. Angewandte Chemie - International Edition. 53 (29), 7669-7673 (2014).
- Korkmaz, B., et al. Measuring elastase, proteinase 3 and cathepsin G activities at the surface of human neutrophils with fluorescence resonance energy transfer substrates. Nature Protocols. 3 (6), 991-1000 (2008).
- Craven, T. H., et al. Super-silent FRET Sensor Enables Live Cell Imaging and Flow Cytometric Stratification of Intracellular Serine Protease Activity in Neutrophils. Scientific Reports. 8 (1), 13490 (2018).
- Mu, J., et al. A small-molecule fret reporter for the real-time visualization of cell-surface proteolytic enzyme functions. Angewandte Chemie - International Edition. 53 (52), 14357-14362 (2014).
- Hagner, M., et al. New method for rapid and dynamic quantification of elastase activity on sputum neutrophils from patients with cystic fibrosis using flow cytometry. European Respiratory Journal. 55 (4), 1902355 (2020).
- Dittrich, A. S., et al. Elastase activity on sputum neutrophils correlates with severity of lung disease in cystic fibrosis. European Respiratory Journal. , 1701910 (2018).
- Cobos-Correa, A., Trojanek, J. B., Diemer, S., Mall, M. A., Schultz, C. Membrane-bound FRET probe visualizes MMP12 activity in pulmonary inflammation. Nature Chemical Biology. 5 (9), 628-630 (2009).
- Hu, H. -. Y., et al. FRET-based and other fluorescent proteinase probes. Biotechnology Journal. 9 (2), 266-281 (2014).
- Trojanek, J. B., et al. Airway mucus obstruction triggers macrophage activation and matrix metalloproteinase 12-dependent emphysema. American Journal of Respiratory Cell and Molecular Biology. 51 (5), 709-720 (2014).
- Wagner, C. J., Schultz, C., Mall, M. A. Neutrophil elastase and matrix metalloproteinase 12 in cystic fibrosis lung disease. Molecular and Cellular Pediatrics. 3 (1), 25 (2016).
- Gaggar, A., et al. The role of matrix metalloproteinases in cystic fibrosis lung disease. The European respiratory journal. 38 (3), 721-727 (2011).
- Guerra, M., et al. Protease FRET Reporters Targeting Neutrophil Extracellular Traps. Journal of the American Chemical Society. 142 (48), 20299-20305 (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele. New England Journal of Medicine. 381 (19), 1809-1819 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados