Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Assemblierung von zellimitierenden unterstützten und suspendierten Lipiddoppelschichtmodellen zur Untersuchung molekularer Wechselwirkungen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Bildung von Zell-imitierenden Uni-Lipid- und Multi-Lipid-Vesikeln, unterstützten Lipiddoppelschichten und suspendierten Lipiddoppelschichten. Diese In-vitro-Modelle können angepasst werden, um eine Vielzahl von Lipidtypen zu integrieren und können verwendet werden, um verschiedene Molekül- und Makromolekül-Interaktionen zu untersuchen.
Zusammenfassung
Modellzellmembranen sind ein nützliches Screening-Tool mit Anwendungen, die von der frühen Wirkstoffentdeckung bis hin zu Toxizitätsstudien reichen. Die Zellmembran ist eine entscheidende Schutzbarriere für alle Zelltypen, die die internen zellularen Komponenten von der extrazellulären Umgebung trennt. Diese Membranen bestehen größtenteils aus einer Lipiddoppelschicht, die äußere hydrophile Kopfgruppen und innere hydrophobe Schwanzgruppen sowie verschiedene Proteine und Cholesterin enthält. Die Zusammensetzung und Struktur der Lipide selbst spielen eine entscheidende Rolle bei der Regulierung der biologischen Funktion, einschließlich der Wechselwirkungen zwischen Zellen und der zellulären Mikroumgebung, die Arzneimittel, biologische Toxine und Umweltgifte enthalten kann. In dieser Studie werden Methoden zur Formulierung von Ein-Lipid- und Multi-Lipid-gestützten und suspendierten Zell-imitierenden Lipiddoppelschichten beschrieben. Zuvor wurden Ein-Lipid-Phosphatidylcholin (PC)-Lipiddoppelschichten sowie Multi-Lipid-Plazenta-Trophoblast-inspirierte Lipiddoppelschichten für das Verständnis molekularer Wechselwirkungen entwickelt. Hier werden Methoden zur Erreichung beider Arten von Doppelschichtmodellen vorgestellt. Für zellnachahmende Multilipid-Doppelschichten wird die gewünschte Lipidzusammensetzung zunächst durch Lipidextraktion aus Primärzellen oder Zelllinien bestimmt, gefolgt von der Flüssigkeitschromatographie-Massenspektrometrie (LC-MS). Unter Verwendung dieser Zusammensetzung werden Lipidvesikel unter Verwendung eines Dünnschichthydratations- und Extrusionsverfahrens hergestellt und ihr hydrodynamischer Durchmesser und ihr Zetapotential charakterisiert. Gestützte und suspendierte Lipiddoppelschichten können dann unter Verwendung einer Quarzkristallmikrowage mit Dissipationsüberwachung (QCM-D) und auf einer porösen Membran zur Verwendung in einem parallelen künstlichen Membranpermeabilitätsassay (PAMPA) gebildet werden. Die repräsentativen Ergebnisse unterstreichen die Reproduzierbarkeit und Vielseitigkeit von In-vitro-Zellmembran-Lipid-Doppelschichtmodellen. Die vorgestellten Methoden können bei der schnellen, einfachen Bewertung der Interaktionsmechanismen wie Permeation, Adsorption und Einbettung verschiedener Moleküle und Makromoleküle mit einer Zellmembran helfen, beim Screening von Arzneimittelkandidaten und der Vorhersage potenzieller zellulärer Toxizität helfen.
Einleitung
Die Zellmembran, die hauptsächlich aus Phospholipiden, Cholesterin und Proteinen besteht, ist ein entscheidender Bestandteil aller lebenden Zellen1. Mit einer durch Lipidamphiphilie getriebenen Organisation fungiert die Zellmembran als Schutzbarriere und reguliert, wie die Zelle mit ihrer Umgebung interagiert2. Mehrere zelluläre Prozesse sind abhängig von der Lipid- und Proteinzusammensetzung derMembran 1,2. Zum Beispiel sind Zellmembraninteraktionen wichtig für eine effektive Arzneimittelabgabe3. Pharmazeutika, Biologika, Nanomaterialien, biologische Toxine und Umweltgifte können die Integrität einer Zellmembran beeinflussen und dadurch die Zellfunktion beeinträchtigen4. Die Konstruktion von In-vitro-Zell-imitierenden Membranmodellen, die auf der Lipidzusammensetzung von Zellmembranen basieren, hat das Potenzial, einfache Werkzeuge bereitzustellen, um die Untersuchung der möglichen Auswirkungen dieser Materialien auf Zellen erheblich zu verbessern.
Modell-Lipiddoppelschichten umfassen Lipidvesikel, unterstützte Lipiddoppelschichten und suspendierte Lipiddoppelschichten. Unterstützte Lipiddoppelschichten sind ein Modell der Phospholipidzellmembran, die üblicherweise in biotechnologischen Anwendungen verwendet wird, bei denen Lipidvesikel auf einem trägern Substratmaterial5,6,7,8,9 gerissenwerden. Eine gängige Technik zur Überwachung der Doppelschichtbildung ist die Quarzkristallmikrowaage mit Dissipationsüberwachung (QCM-D), die die Adsorption von Vesikeln im Vergleich zu den Flüssigeneigenschaften in situuntersucht 8,10,11,12,13,14 . Zuvor wurde QCM-D verwendet, um zu zeigen, dass unter Strömungsbedingungen, sobald eine kritische Vesikelabdeckung von Phosphatidylcholin (PC) Lipidvesikeln auf der Oberfläche erreicht ist, sie spontan in starre Lipiddoppelschichten15aufbrechen. Frühere Arbeiten haben auch die unterstützte Lipiddoppelschichtbildung mit unterschiedlichen Lipidzusammensetzungen16,den Einbau von Lipidproteinen17,18,19und die Verwendung von Polymerkissen20untersucht, wodurch unterstützte Lipiddoppelschichten entstehen, die verschiedene Aspekte der Zellmembranfunktion nachahmen können.
Lipiddoppelschichten wurden verwendet, um verschiedene biologische Barrieren von subzellulären bis hin zu Organebenen nachzuahmen, einschließlich Mitochondrium, roten Blutkörperchen und Leberzellmembranen, indem die Phospholipid-, Cholesterin- und Glykolipidkomponenten verändert wurden21. Diese komplexeren Multilipidvesikel können je nach Lipidzusammensetzung zusätzliche Methoden erfordern, um eine Vesikelruptur zu erreichen. Zum Beispiel haben frühere Studien ein α-helikales (AH) Peptid verwendet, das vom nichtstrukturellen Protein 5A des Hepatitis-C-Virus abgeleitet ist, um die Doppelschichtbildung durch Destabilisierung der adsorbierten Lipidvesikel zu induzieren22,23. Unter Verwendung dieses AH-Peptids wurden zuvor unterstützte Lipiddoppelschichten gebildet, die Plazentazellen nachahmen24. Das große Potenzial unterstützter Lipiddoppelschichten für biomedizinische Anwendungen wurde mit Untersuchungen gezeigt, die den molekularen und Nanopartikeltransport25,26, umwelttoxische Wechselwirkungen27, Proteinaufbau und -funktion17,18,19, Peptidanordnung und -insertion28,29, Arzneimittelscreening30und mikrofluidische Plattformen31umfassen.
Suspendierte Lipiddoppelschichten wurden für pharmazeutische Screening-Studien über einen parallelen künstlichen Membranpermeabilitätstest (PAMPA) verwendet, bei dem eine Lipiddoppelschicht über einen porösen hydrophoben Einsatz32,33,34,35suspendiert ist. PAMPA-Lipidmodelle wurden für verschiedene biologische Grenzflächen entwickelt, einschließlich der Blut-Hirn-, bukkalen, intestinalen und transdermalen Grenzflächen36. Durch die Kombination sowohl der unterstützten Lipiddoppelschicht als auch der PAMPA-Techniken können Adsorption, Permeabilität und Einbettung von Verbindungen in Lipidkomponenten eines gewünschten Gewebes oder Zelltyps gründlich untersucht werden.
Dieses Protokoll beschreibt die Herstellung und Anwendung von In-vitro-Zellmembran-Lipiddoppelschichtmodellen zur Untersuchung verschiedener molekularer Wechselwirkungen. Die Herstellung von sowohl Uni-Lipid- als auch Multi-Lipid-gestützten und suspendierten Lipiddoppelschichten wird detailliert beschrieben. Um eine unterstützte Lipiddoppelschicht zu bilden, werden Lipidvesikel zunächst unter Verwendung von Dünnschichthydratations- und Extrusionsmethoden entwickelt, gefolgt von einer physikalisch-chemischen Charakterisierung. Die Bildung einer unterstützten Lipiddoppelschicht unter Verwendung von QCM-D-Überwachung und Herstellung von suspendierten Lipidmembranen für den Einsatz in PAMPA wird diskutiert. Schließlich werden Multilipidvesikel für die Entwicklung komplexerer zellimitierender Membranen untersucht. Unter Verwendung beider Arten von hergestellten Lipidmembranen zeigt dieses Protokoll, wie dieses Werkzeug zur Untersuchung molekularer Wechselwirkungen verwendet werden kann. Insgesamt konstruiert diese Technik zellnachahmende Lipiddoppelschichten mit hoher Reproduzierbarkeit und Vielseitigkeit.
Protokoll
1. Entwicklung von Uni-Lipid-Vesikeln
- Dünnschicht-Hydratationsmethode
- Herstellung und Lagerung von Lipidstocklösungen
HINWEIS: Alle Schritte mit Chloroform müssen in einem chemischen Abzug durchgeführt werden. Chloroform sollte immer mit lösungsmittelsicheren Kohlefaserpipettenspitzen pipettiert werden. Lösungen, die Chloroform enthalten, sollten immer in Glasfläschchen gelagert werden.- Bereiten Sie eine 10 mg/ml Lipidstocklösung vor, indem Sie das entsprechende Volumen Chloroform in die Durchstechflasche geben, die das Lipidpulver enthält, und gut mischen. Fügen Sie beispielsweise 20 ml Chloroform zu 200 mg L-α-Phosphatidylcholin (Ei, Huhn) (EggPC) hinzu. Die Stammlösung kann erforderlichenfalls in einer anderen Konzentration hergestellt werden.
HINWEIS: Wenn das Pulverlipid in einer Ampulle gelagert wurde, wird nach Zugabe von Chloroform in eine Glasfläschchen mit einer mit Polytetrafluorethylen (PTFE) ausgekleideten Kappe überführt. - Verschließen Sie den Durchstechflaschenverschluss mit Parafilm und lagern Sie ihn bis zu 6 Monate bei -20 °C.
- Bereiten Sie eine 10 mg/ml Lipidstocklösung vor, indem Sie das entsprechende Volumen Chloroform in die Durchstechflasche geben, die das Lipidpulver enthält, und gut mischen. Fügen Sie beispielsweise 20 ml Chloroform zu 200 mg L-α-Phosphatidylcholin (Ei, Huhn) (EggPC) hinzu. Die Stammlösung kann erforderlichenfalls in einer anderen Konzentration hergestellt werden.
- Bildung eines Trocken-Lipid-Films
- Geben Sie das entsprechende Volumen der Lipidstocklösung in eine durchsichtige Glasfläschchen, die für eine endgültige Vesikelkonzentration von 2,5 mg / ml erforderlich ist. Um beispielsweise 1 ml Ei-PC-Vesikel bei 2,5 mg/ml zu bilden, werden 250 μL Ei-PC-Brühenlösung in die Durchstechflasche pipettiert.
HINWEIS: Das vorbereitete Volumen kann vom verwendeten Extruderverfahren abhängen (siehe Schritt 1.3). Das maximale empfohlene Volumen des Miniextruders beträgt 1 ml, während der große Extrudervolumenbereich 5-50 ml beträgt. - Entfernen Sie Chloroform aus der Lipidstocklösung mit einem Strom vonN2-Gas (hochreines 5,0-Grad).
- Um eine vollständige Entfernung von Chloroform zu gewährleisten, schließen Sie den getrockneten Lipidfilm an das Vakuum an und lassen Sie ihn mindestens 4 h stehen.
HINWEIS: Der Vorgang kann hier gestoppt werden. Wenn der Lipidfilm nicht sofort nach der Vakuumtrocknung verwendet wird, lagern Sie ihn bis zur Verwendung in einem Exsikkator. Wir haben beobachtet, dass diese Lipidfilme nach 1 Woche Lagerung unter diesen Bedingungen Vesikel ähnlicher Qualität ergeben; die Vesikelqualität nach längerer Lagerdauer sollte erforderlichenfalls weiter untersucht werden.
- Geben Sie das entsprechende Volumen der Lipidstocklösung in eine durchsichtige Glasfläschchen, die für eine endgültige Vesikelkonzentration von 2,5 mg / ml erforderlich ist. Um beispielsweise 1 ml Ei-PC-Vesikel bei 2,5 mg/ml zu bilden, werden 250 μL Ei-PC-Brühenlösung in die Durchstechflasche pipettiert.
- Gefrier-Tau-Wirbel-Zyklen durchführen
- Herstellung einer Tris-Natriumchlorid (NaCl)-Pufferlösung, die 10 mM Tris-Base und 100 mM NaCl enthält. Rehydrieren Sie den getrockneten Lipidfilm mit dem erforderlichen Volumen des Tris NaCl-Puffers, um eine endgültige Vesikelkonzentration von 2,5 mg/ml und einen Wirbel für ca. 15-30 s zu erhalten.
- Die Vesikelsuspension in einen Behälter mit Trockeneis geben, bis sie eingefroren ist, ca. 30 min. Nachdem die Probe vollständig eingefroren ist, tauen Sie die Suspension in einem 30-40 °C warmen Wasserbad auf. Wirbeln Sie die aufgetaute Vesikelsuspension.
HINWEIS: FlüssigkeitN2 kann anstelle von Trockeneis verwendet werden. Die Vesikelsuspension 30 s lang in flüssigen Stickstoff überführen und dann sofort in einem 80 °C warmen Wasserbad auftauen. - Wiederholen Sie Schritt 1.1.3.2 weitere 4 Mal für insgesamt 5 Gefrier-Tau-Wirbel-Zyklen.
- Herstellung und Lagerung von Lipidstocklösungen
- Extrusion
HINWEIS: Nach Abschluss der Gefrier-Tau-Wirbel-Zyklen bilden sich mehrschichtige Vesikel. Die Extrusion hilft bei der Verringerung der Größe und der Entwicklung großer einlamellarer Vesikel.- Mini (1 ml) Extruderverfahren
- Reinigen Sie alle Komponenten des Extruders gründlich mit einem milden Reinigungsmittel in Reinstwasser und spülen Sie es mindestens dreimal mit Reinstwasser ab, um sicherzustellen, dass das gesamte Reinigungsmittel entfernt ist. MitN2-Gas trocknen.
- Montieren Sie die beiden internen Membranträger und O-Ringe (Innendurchmesser von 12,7 mm; Außendurchmesser von 15,2 mm). Positionieren Sie jede Membranstütze so, dass der O-Ring nach oben zeigt.
- Benetzen Sie eine Filterhalterung mit Reinstwasser vor. Legen Sie es auf die Membranträgerfläche im Inneren des O-Rings. Wiederholen Sie dies für die zweite interne Membranstütze.
- Positionieren Sie eine interne Membranstütze in das Außengehäuse des Extruders. Legen Sie eine 100 nm Polycarbonatmembran direkt über die Filterhalterung auf die interne Membranhalterung.
HINWEIS: Die Polycarbonatmembranen werden getrennt zwischen blau gefärbten Papierstücken gelagert. Entfernen Sie das Trennpapier, bevor Sie es auf den Membranträger legen. - Positionieren Sie den zweiten internen Membranträger in das Extruderaußengehäuse, wobei der O-Ring und die Filterträgerseite der Polycarbonatmembran zugewandt sind. Befestigen Sie das PTFE-Lager in der Haltemutter und schrauben Sie es mit dem Extruderaußengehäuse zu. Clippen Sie den Extruder in den Heizblock.
- Laden Sie die Lipidvesikelsuspension in eine der Spritzen und positionieren Sie die Spritze im Extruder-Wärmeblock, wobei Sie die Nadel vollständig in ein Ende des Extruders einführen. Setzen Sie die zweite, leere Spritze in die gegenüberliegende Seite ein und verriegeln Sie beide Spritzen mit den Armclips am Wärmeblock.
HINWEIS: Legen Sie bei Bedarf den Extruder-Wärmeblock auf eine Heizplatte und stellen Sie die Temperatur auf einen Wert über der Übergangstemperatur des Lipids ein. Stecken Sie ein Thermometer in den im Wärmeblock eingebauten Halter für genaue Temperaturmessungen und warten Sie, bis die erforderliche Temperatur erreicht ist (~ 15 min). Ei-PC-Lipidvesikel benötigen während der Extrusion keine Wärme. - Drücken Sie die Vesikelaufhängung langsam in die leere Spritze und dann wieder in die originale Spritze. Überwachen Sie auf Druckänderungen in der gesamten Extrusion, die auf ein Leck hinweisen. Wiederholen Sie dies 20 weitere Male für insgesamt 21 Durchgänge durch die Polycarbonatmembran. Übertragen Sie die Lipidvesikel zur Lagerung in ein sauberes Glasfläschchen.
HINWEIS: Die Anzahl der Extrusionen kann in Abhängigkeit von der Lipidzusammensetzung optimiert werden. - Wenn Wärme verwendet wurde, lassen Sie die extrudierte Vesikelsuspension Raumtemperatur erreichen. Lagern Sie die extrudierten Lipidvesikel bei 4 °C bis zur weiteren Verwendung.
HINWEIS: Die empfohlene Vesikelspeicherdauer hängt stark von der Lipidzusammensetzung ab, und die physikalisch-chemischen Eigenschaften des Vesikels (z. B. hydrodynamischer Durchmesser, Zetapotential) sollten im Laufe der Zeit überwacht werden. Zum Beispiel wurden EI-PC-Vesikel mindestens zwei Wochen lang gelagert, ohne dass sich die Vesikelgröße oder die Doppelschichtbildungskapazität geändert hat.
- Großer (5-50 ml) Extruderprozess
HINWEIS: Befolgen Sie die Schritte 1.2.2.1-1.2.2.5, wenn für das ausgewählte Lipid Wärme erforderlich ist. Fahren Sie mit Schritt 1.2.2.5 fort, wenn keine Wärme benötigt wird. Die Schritte 1.2.2.1-1.2.2.4 sind für egg PC nicht erforderlich.- Füllen Sie einen 1-Liter-Kolben mit Umkehrosmose(RO)-Wasser.
HINWEIS: Verwenden Sie kein Reinstwasser, um durch das 50-ml-System zu zirkulieren, da dies dazu führen kann, dass Metallionen aus dem Extruderzylinder austreten. - Stellen Sie den 1-Liter-Kolben in ein Wasserbad auf eine Heizplatte und stellen Sie die Heizplatte auf eine Temperatur über der Übergangstemperatur des Lipids.
- Befestigen Sie den Probenzylinder mit flexiblem Schlauch über den Einlass am Probenzylinder am Kolben. Befestigen Sie einen Schlauch am Auslass des Zylinders an der Oberseite des 1-Liter-Kolbens. Sichern Sie die Schläuche sowohl am Einlass als auch am Auslass nach Bedarf. Dadurch entsteht ein unidirektionaler Fluss des Wassers durch den Probenzylinder.
- Schalten Sie die Pumpe ein, um die Wasserzirkulation zu starten. Wenn Wärme benötigt wird, warten Sie ca. 30-45 Minuten, bis der Probenzylinder die gewünschte Temperatur erreicht hat.
- Verbinden Sie die Kappe des Probenzylinders über den flexiblen Stecker, der an der Überdruckventileinheit angebracht ist, mit einem Stickstofftank.
- Reinigen Sie alle Teile des 50 ml Extruders mit 70% (v/v) Ethanol.
- Montieren Sie den Extruder, indem Sie die große Lochsiebstütze, die Sinterscheibe, die Ablassscheiben und die Polycarbonatmembran in den Raum in der unteren Auflage des Extruders legen. Verbinden Sie die oberen und unteren Stützen des Extruders mit den vier Schrauben und ziehen Sie sie fest.
- Befestigen Sie die Extrudereinheit am Probenzylinder, indem Sie sie an den Boden schrauben und mit einem Schraubenschlüssel festziehen, um sie zu sichern.
HINWEIS: Wenn Wärme verwendet wird, legen Sie ein Thermometer in den Zylinder und warten Sie, bis das Wasser die gewünschte Temperatur erreicht hat, bevor Sie fortfahren. Dadurch wird sichergestellt, dass die Probentemperatur während des gesamten Extrusionsprozesses aufrechterhalten wird. - Füllen Sie den Probenzylinder mit Reinstwasser. Extrudieren Sie das Wasser durch die Extrudereinheit, bevor Sie die Probe in den Probenzylinder geben. Dies geschieht, um die Membranen vorzubefeuchten, ähnlich wie beim Mini-Extruder.
HINWEIS: Stellen Sie sicher, dass die Kappe vollständig verschraubt und das Überdruckventil vollständig geschlossen ist, bevor Sie den Stickstoff einschalten. Für diesen Schritt ist ein minimaler Druck erforderlich (~ 5-10 psi). - Die Lipidvesikelsuspension in den Probenzylinder geben und die Oberseite verschrauben. Erhöhen Sie langsam den Druck, bis die Probe mit einer Geschwindigkeit von ca. 2-3 Tropfen/s aus der Extrudereinheit in eine durchsichtige Glasflasche zu tropfen beginnt.
HINWEIS: Erhöhen Sie den Druck bei diesem Schritt nicht schnell, da sich zu viel Druck negativ auf die Membranen auswirken und zu einer erfolglosen Extrusion führen kann. - Sobald alle Proben extrudiert wurden, schalten Sie dieN2-Versorgung aus und geben Sie den Druck im Probenzylinder ab, indem Sie das Überdruckventil langsam öffnen. Gießen Sie die Lipidvesikel zurück in den Probenzylinder und wiederholen Sie Schritt 1.2.2.11, 9 weitere Male für insgesamt 10 Extrusionen.
HINWEIS: Der erforderliche Druck für die Extrusion kann mit zunehmender Anzahl von Extrusionen abnehmen, da die Probe homogener wird und sich der Porengröße der Polycarbonatmembran nähert. - Extrudierte Lipidvesikelsuspension bei 4 °C bis zur weiteren Verwendung lagern.
- Füllen Sie einen 1-Liter-Kolben mit Umkehrosmose(RO)-Wasser.
- Mini (1 ml) Extruderverfahren
2. Charakterisierung von Lipidvesikeln
- Hydrodynamische Durchmessermessung mittels dynamischer Lichtstreuung (DLS)
- Wirbellipidvesikel und Pipette 50 μL der Lipidvesikelsuspension in eine Einwegküvette mit geringem Volumen. Abdeckung, um eine Kontamination mit Staub und Schmutz zu verhindern.
- Laden Sie die Vesikelsuspension in das DLS-Gerät, geben Sie die Probendetails ein und führen Sie die Messung mit der zugehörigen Software durch.
- Zeta Potenzial
- Bereiten Sie eine gefaltete kapillare Zetazelle vor, indem Sie sie mit Reinstwasser, 70% Ethanol und Reinstwasser mit Spritzen waschen, die mit den Eingängen der Zelle verbunden sind. Drücken Sie die Flüssigkeit vorsichtig 3-4 Mal durch die Zelle und entleeren Sie die Zelle vollständig, bevor Sie zur nächsten Lösung wechseln.
- Wirbeln Sie die Lipidvesikel und bereiten Sie eine 1:10 (v/v) Verdünnung von Lipidvesikeln in Reinstwasser vor.
- Laden Sie die verdünnte Lipidvesikelsuspension. Entfernen Sie Luftblasen, indem Sie die Aufhängung zwischen den Spritzen hin und her drücken. Befestigen Sie die Stopfen an jedem Einlass.
HINWEIS: Es ist wichtig, alle Blasen zu entfernen, da dies die Messung beeinflusst. - Platzieren Sie die Zetazelle in der Probenkammer und stellen Sie sicher, dass die Elektroden in Kontakt sind. Schließen Sie die Oberseite der Probenkammer. Geben Sie in der zugehörigen Software die Probendetails ein und erfassen Sie die Messung.
3. Bildung einer ein-lipidgestützten Lipiddoppelschicht mit QCM-D
- Lösungsvorbereitungen
- Bereiten Sie eine 2%ige (w/v) Natriumdodecylsulfat (SDS)-Lösung in Reinstwasser vor. Auf einer Rührplatte rühren, bis sie vollständig aufgelöst ist. Aliquote Arbeitslösungen von mindestens 10 ml Reinstwasser, 2% SDS und Tris NaCl.
- Bereiten Sie eine Verdünnung der Lipidvesikel in Tris NaCl-Puffer vor. Die Konzentration der Vesikel ist abhängig von der Anwendung. Für Ei-PC wurde gezeigt, dass Konzentrationen im Bereich von 0,01-0,5 mg / ml zu einer erfolgreichen unterstützten Lipiddoppelschichtbildung führen.
- Reinigung von quarzbeschichteten Quarzkristallsensoren
HINWEIS: Die Reinigung von QCM-D-Kristallen hängt vom Oberflächenmaterial des verwendeten Sensors ab. Um unterstützte Lipiddoppelschichten zu bilden, werden in diesem Protokoll silikabeschichtete Quarzkristalle verwendet, die im Folgenden gemäß der Standardarbeitsanweisung des Herstellers beschrieben werden.- Setzen Sie den quarzbeschichteten Quarzkristallsensor in das Durchflussmodul ein und stellen Sie sicher, dass das "t" auf dem Kristall mit dem "t" auf dem Modul übereinstimmt. Schrauben Sie das Durchflussmodul zu.
HINWEIS: Wenn der verwendete QCM-D es zulässt, dass mehrere Durchflussmodule gleichzeitig angeschlossen und ausgeführt werden können, wiederholen Sie die folgenden Schritte für die zusätzlichen Module nach Bedarf. - Setzen Sie das Durchflussmodul mit den Elektroden des Durchflussmoduls in die Basis des Geräts ein, die mit dem Analysatorsystem verbunden sind. Verriegeln Sie das Modul.
- Schließen Sie den Einlass- und Auslassschlauch an das Durchflussmodul und die Pumpe an. Legen Sie den Schlauch in die Haltevorrichtungen und schließen Sie den Deckel des Analysatorsystems. Stellen Sie einen Abfallbehälter an den Auslass der Pumpe, um verbrauchte Lösungen zu sammeln.
- Um die Reinigung durchzuführen, schalten Sie zuerst die Pumpe ein. Stellen Sie die Durchflussgeschwindigkeit auf 400 μL/min ein. Setzen Sie den Einlassschlauch in Reinstwasser ein und strömen Sie 5-10 ml durch das Modul.
- Schalten Sie den Einlassschlauch in 2% SDS und fließen Sie 5-10 ml durch das Modul. Schalten Sie den Einlassschlauch wieder in Reinstwasser um und strömen Sie 10-20 ml durch das Modul. Entfernen Sie den Einlassschlauch aus der Lösung und strömen Sie Luft durch den Schlauch, bis die gesamte Flüssigkeit ausgestoßen ist.
HINWEIS: Das oben genannte Reinigungsprotokoll wird täglich vor und nach jeder Messung angewendet. Eine gründliche Reinigung kann nach Bedarf durchgeführt werden. Kurz gesagt, um eine gründliche Reinigung durchzuführen, zerlegen Sie die Durchflussmodule. Alle Komponenten mit Ausnahme der Elektrodenseite des Durchflussmoduls sollten in 2% (w/v) SDS eingetaucht und beschallt werden, gefolgt von einer gründlichen Spülung mit Reinstwasser und einer Trocknung mit einem Strom von N2-Gas. Die Komponente des Durchflussmoduls, die die Elektrodenstifte enthält, sollte niemals mit Flüssigkeit in Berührung kommen. - Entfernen Sie den Sensor aus dem Durchflussmodul und spülen Sie den Sensor mit Reinstwasser ab. Trocknen Sie den Sensor mit einem N2-Gasstrom. Trocknen Sie das Strömungsmodul mit einem N2-Gasstrom. Stellen Sie sicher, dass die Elektrode immer frei von Flüssigkeiten bleibt.
- Setzen Sie den quarzbeschichteten Quarzkristallsensor in einen chemischen Abzug in ein ultraviolettes (UV)/Ozon-Reinigungsinstrument ein. Schalten Sie das Gerät ein und lassen Sie die Behandlung mindestens 2 Minuten einwirken. Entfernen Sie die Sensoren vorsichtig und kehren Sie in das Durchflussmodul zurück.
- Setzen Sie den quarzbeschichteten Quarzkristallsensor in das Durchflussmodul ein und stellen Sie sicher, dass das "t" auf dem Kristall mit dem "t" auf dem Modul übereinstimmt. Schrauben Sie das Durchflussmodul zu.
- Bildung einer Tris NaCl Baseline
- Schalten Sie das Analysegerät ein, um eine Verbindung zur zugehörigen Software herzustellen, und stellen Sie die Temperatur auf den gewünschten Wert für die unterstützte Lipiddoppelschicht ein. Lassen Sie die Temperatur auf den gewünschten Eingang stabilisieren.
HINWEIS: Wenn die eingestellte Temperatur über Raumtemperatur liegt, sollten alle Lösungen mit einem Wärmeblock auf die gleiche Temperatur erhitzt werden. - Konfigurieren Sie die Messung und suchen Sie alle Sensorresonanzfrequenzen und -dissipationen für die Obertöne 3, 5, 7, 9, 11 und 13, bevor Sie mit der Messung beginnen.
HINWEIS: Der1. Oberton kann außer Acht gelassen werden, da diese Harmonische überempfindlich ist und verrauschte Daten erzeugt. - Schalten Sie die Pumpe ein und stellen Sie den Durchfluss auf 175 μL/min oder den gewünschten experimentellen Durchfluss ein.
- Wischen Sie den Einlassschlauch vor dem Einsetzen in Tris NaCl mit Ethanol ab. Starten Sie die Messung und beginnen Sie mit dem Fließen von Tris NaCl.
HINWEIS: Die Daten werden in Echtzeit gesammelt und überwacht. Der Wechsel von Luft zu Flüssigkeit im Strömungsmodul wird in der Datenerfassungssoftware durch eine schnelle Verluständerung (ΔD) Zunahme und Frequenzänderung (ΔF) beobachtet. - Lassen Sie Tris NaCl 5-10 min durch das Modul fließen, um sicherzustellen, dass die Basiswerte ΔF und ΔD in Flüssigkeit stabil bleiben.
- Schalten Sie das Analysegerät ein, um eine Verbindung zur zugehörigen Software herzustellen, und stellen Sie die Temperatur auf den gewünschten Wert für die unterstützte Lipiddoppelschicht ein. Lassen Sie die Temperatur auf den gewünschten Eingang stabilisieren.
- Bildung einer ein-lipidgestützten Lipiddoppelschicht
- Stoppen Sie die Pumpe und entfernen Sie den Einlassschlauch aus der Tris NaCl-Lösung und führen Sie ihn vorsichtig in die Lipidvesikellösung ein. Rückströmung für 5 s, um Luftblasen aus dem Einlassschlauch zu entfernen, und dann den Vorwärtsstrom fortsetzen. Starten Sie die Messung in der Software neu, um die Baseline auf Null zu setzen.
HINWEIS: Achten Sie darauf, Luftblasen im Schlauch zu vermeiden, die durch das Modul strömen und die Doppelschichtbildung und die Datenaufzeichnung stören können. - Fließen Lipidvesikel bis zur Doppelschichtbildung in Echtzeit in der Datenerfassungssoftware (mindestens 8 min für Ei-PC-Vesikel).
- Wiederholen Sie Schritt 3.4.1, um den Einlassschlauch von Lipidvesikeln wieder in Tris NaCl-Puffer zu ändern.
HINWEIS: Wenn die gewünschte Anwendung darin besteht, molekulare Wechselwirkungen zu untersuchen, fahren Sie direkt mit Schritt 6.1 fort, ohne den Lösungsfluss oder die Datenerfassung zu stoppen. Wenn die Doppelschichtbildung der Endpunkt ist, fahren Sie mit Schritt 3.4.4 fort. - Stoppen Sie in der Software die Messung und speichern Sie die Datei. Stoppen Sie die Pumpe.
- Reinigen Sie das Durchflussmodul und den quarzbeschichteten Quarzkristallsensor gemäß den Protokollschritten 3.2.4 und 3.2.5.
- Stoppen Sie die Pumpe und entfernen Sie den Einlassschlauch aus der Tris NaCl-Lösung und führen Sie ihn vorsichtig in die Lipidvesikellösung ein. Rückströmung für 5 s, um Luftblasen aus dem Einlassschlauch zu entfernen, und dann den Vorwärtsstrom fortsetzen. Starten Sie die Messung in der Software neu, um die Baseline auf Null zu setzen.
4. Bildung einer suspendierten Lipiddoppelschicht
HINWEIS: Das Protokoll zur Bildung einer suspendierten Lipiddoppelschicht basiert auf dem parallelen PAMPA-Protokoll (Artificial Membrane Permeability Assay), das vom Filterplattenhersteller37zur Verfügung gestellt wird.
- Solubilisieren Sie das gewünschte Lipid in Dodecan bei 20 mg/ml (z. B.1,2-Dioleoyl- sn-glycero-3-phosphocholin (DOPC)).
- 5 μL der Lipidlösung in das Donorkompartiment geben, bei dem es sich um eine poröse Polyvinylidendifluorid (PVDF) 96-Well-Multiscreen-Filterplatte (0,45 μm Porengröße) handelt.
- Tauchen Sie die Filterplatte sofort in das Akzeptorfach ein, bei dem es sich um eine Transportbehälterplatte handelt, die 300 μL 1× phosphatgepufferte Kochsalzlösung (PBS) enthält. 200 μL 1× PBS in das Spenderkompartiment geben.
HINWEIS: Kontrollen von Filtern mit nur Lipid und unbehandelten Filtern, die 1× PBS ausgesetzt sind, können eingeschlossen sein. - Fahren Sie direkt mit Abschnitt 6.2 fort, um die molekularen Wechselwirkungen mit der suspendierten Lipiddoppelschicht zu untersuchen. Es wird empfohlen, die Studie innerhalb von 16 Stunden nach Dem Bilden der suspendierten Doppelschicht abzuschließen.
5. Entwicklung von Multilipidzellen, die Vesikel und Doppelschichten nachahmen
- Lipidextraktion aus Säugetierzellen
ANMERKUNG: Die Lipidextraktion folgt dem Bligh-Dyer-Ansatz38.- Kulturieren Sie die gewünschte Zelllinie nach Bedarf. Nach Erreichen einer Konfluenz von 70-80% (T75-Kolben) werden die Zellen mit Trypsin-Ethylendiamintretaessigsäure bei 37 °C für 5 min abgetrennt.
- Zentrifugieren Sie Zellen bei 200 × g für 5 min. Entfernen Sie den Überstand und resuspenieren Sie das Zellpellet in 1 ml Reinstwasser.
- 3,75 ml eines 1:2 (v/v) Gemisches aus Chloroform:methanol in die Zellsuspension gegeben und 15 min lang gewirbelt. Dann 1,25 ml Chloroform und Wirbel für 1 min hinzufügen. Zum Schluss 1,25 ml Wasser und Wirbel für 1 min hinzufügen.
- Zentrifugenzellmischung bei 1000 x g für 10 min. Sammeln Sie die unterste Flüssigkeitsschicht, die Lipide in der organischen Phase enthält. Trocken unter einem Strom von N2-Gas.
- Quantifizieren Sie den Lipidgehalt mit Hilfe der Flüssigkeitschromatographie-Massenspektrometrie (LC-MS) unter Verwendung einer C18-Umkehrphase, 3,5 μm × 50-mm-Säule.
- Bereiten Sie für die mobile Phase zwei Lösungen vor, die erste mit 60:40 (v/v) Acetonitril:Wasser und die zweite mit 90:10 (v/v) Isopropanol:Acetonitril. Ammoniumformiat sollte beiden Lösungen in einer Endkonzentration von 10 mM zugesetzt werden. Über 60 Min wird der mobile Phasengradient von 35 % (v/v) der zweiten Lösung auf 95 % (v/v) erhöht.
- Nachweis des Abwassers im negativen Ionisationsmodus mit aufeinanderfolgenden Full-Scan-MS und Tandem-MS/MS. Identifizieren Sie die einzelnen Phospholipidspezies anhand ihrer Masse-Ladungs-Verhältnisse (m/z). Analysieren Sie die Massenspektren aus der kollisionsinduzierten Dissoziationsfragmentierung mit den LIPID MAPS-Massenspektrometrie-Analysewerkzeugen. Erhalten Sie extrahierte Ionenchromatogramme, um den Bereich unter der Kurve zu integrieren und die Häufigkeit jeder Lipidspezies zu bestimmen.
- Führen Sie die Schritte 5.1.5-5.1.7 für einen Lipidstandard aus, der die wichtigsten Lipidklassen enthält, um die relativen Nachweisempfindlichkeiten für jede einzelne Phospholipidklasse zu bestimmen.
- Entwicklung von Multilipidvesikeln
- Befolgen Sie die Schritte in 1.1.1, um Lipidstocklösungen für Lipide herzustellen, die jede gewünschte Doppelschichtkomponente repräsentieren, wie in Schritt 5.1 beschrieben.
- Geben Sie auf der Grundlage der aus Schritt 5.1 erhaltenen Lipidzusammensetzungen das entsprechende Volumen an Lipid/Chloroform-Stamm in eine durchsichtige Durchstechflasche aus Glas, die für eine endgültige Vesikelkonzentration von 2,5 mg/ml erforderlich ist. Bulk-Chloroform-Trocknungslösung unter einem Strom vonN2-Gas entfernen.
- Befolgen Sie die Schritte 1.1.2, 1.1.3 und 1.2, um Multilipidvesikel zu bilden. Befolgen Sie Schritt 2 für die Vesikelcharakterisierung.
- Bildung einer Multi-Lipid-gestützten Lipiddoppelschicht mit QCM-D
HINWEIS: Einige Multilipidvesikel können zu einer spontanen Lipidvesikelruptur und Doppelschichtbildung führen, ähnlich wie bei den in Schritt 3 dargestellten Einlipid-PC-Vesikeln. Komplexere Multilipidvesikel können jedoch einen externen Input erfordern, um bei der Vesikelruptur zu helfen. Hier wird das AH-Peptid verwendet, um das äußere Blättchen des Vesikels zu destabilisieren, was zur Bildung von Doppelschichten führt. Andere Methoden, um Destabilisierung und Vesikelruptur zu erreichen, können in Betracht gezogen werden, wenn gewünscht.- Befolgen Sie Schritt 3, um die Multilipid-unterstützte Lipiddoppelschicht unter Verwendung der in Schritt 5.2 gebildeten Multilipidvesikel zu bilden.
- Wenn ein spontaner Bruch der Vesikel in eine Doppelschicht nicht beobachtet wird, versuchen Sie eine Vesikeldestabilisierung mit dem AH-Peptid. Präparieren Sie das AH-Peptid (Peptidsequenz: H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−Ile−Cys−Thr−Val−Thr−Asp−Phe−Lys−Thr−Trp−Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2)Lösung bei 13 μM in Tris NaCl mit 1% (v/v) Dimethylsulfoxid, DMSO.
- Führen Sie die Schritte 3.4.1-3.4.3 aus. Nach Schritt 3.4.3 wird der Einlassschlauch in die AH-Peptidlösung umgewandelt. Führen Sie die Lösung in das Strömungsmodul ein, bis ΔF und ΔD aus der neuen Lösungszugabe beobachtet werden. Stoppen Sie die Pumpe und lassen Sie das AH-Peptid 10 Minuten lang mit den Vesikeln inkubieren.
- Schalten Sie den Einlassschlauch in Tris NaCl und starten Sie den Fluss, um das AH-Peptid aus den gerissenen Vesikeln zu entfernen, was zur erfolgreichen Bildung einer Lipiddoppelschicht führt.
HINWEIS: Wenn die gewünschte Anwendung darin besteht, molekulare Wechselwirkungen zu untersuchen, fahren Sie mit Schritt 6.1 fort, ohne den Lösungsfluss oder die Datenerfassung zu stoppen. - Stoppen Sie in der Software die Messung und speichern Sie die Datei. Stoppen Sie die Pumpe.
- Reinigen Sie das Durchflussmodul und den quarzbeschichteten Quarzkristallsensor gemäß den Protokollschritten 3.2.4-3.2.6.
- Suspendierte Multilipid-Doppelschichten
- Solubilisieren Sie die Mischung der gewünschten Lipide in Dodecan bei 20 mg / ml.
- Stellen Sie eine 5-μL-Lipidmischlösung unter Verwendung der gewünschten Zellimitationszusammensetzung her.
- Führen Sie die Schritte 4.2 und 4.3 aus.
HINWEIS: Fahren Sie direkt mit Schritt 6.2 fort, um molekulare Wechselwirkungen mit der suspendierten Lipiddoppelschicht zu untersuchen.
6. Molekülinteraktionsstudien mit Ein-Lipid- und Multilipid-Doppelschichten
- Untersuchung molekularer Wechselwirkungen mit einer unterstützten Lipiddoppelschicht mittels QCM-D
- Bereiten Sie eine Lösung des gewünschten Moleküls vor, um die Adsorption mit einer gestützten Lipiddoppelschicht zu untersuchen. Zum Beispiel wird eine Lösung von 200 μM Di(2-ethylhexyl)phthalat (DEHP) in Tris NaCl mit 1% (v/v) DMSO hergestellt.
- Wenn die Moleküllösung in Tris NaCl hergestellt wird, kann sie direkt nach Schritt 3.4.3 für eine Einlipid-Doppelschicht oder 5.3.4 für eine Multilipid-Doppelschicht fließen. Wenn das Molekül in einem anderen Lösungsmittel hergestellt werden muss, setzen Sie stattdessen den Einlassschlauch für mindestens 5 min allein in das gewünschte Lösungsmittel ein (z. B. Tris NaCl mit 1% (v/v) DMSO für DEHP).
HINWEIS: Viskositätsänderungen aufgrund des Lösungsmittels können überwacht und berücksichtigt werden, indem es vor und nach dem Einbringen des interessierenden Moleküls geflossen wird. - Schalten Sie den Einlassschlauch in die Lösung, die das interessierende Molekül enthält, und fließen Sie mindestens 5 Minuten lang. Der Fluss kann auch gestoppt werden und Flüssigkeit, die das gewünschte Molekül enthält, auf Wunsch mit der Doppelschicht inkubieren.
- Ändern Sie den Einlassschlauch zurück zum Moleküllösungsmittel allein, wenn etwas anderes als Tris NaCl. Durchfluss für mindestens 5 min. Schalten Sie dann den Einlassschlauch in Tris NaCl um und fließen Sie für mindestens 5 Minuten.
- Stoppen Sie in der Software die Messung und speichern Sie die Datei. Stoppen Sie die Pumpe.
- Reinigen Sie das Durchflussmodul und den quarzbeschichteten Quarzkristallsensor gemäß den Protokollschritten 3.2.4-3.2.6.
- Untersuchung molekularer Wechselwirkungen mit suspendierten Lipiddoppelschichten mit PAMPA
- Bereiten Sie eine Lösung des gewünschten Moleküls vor. Bereiten Sie beispielsweise ein 200 μM DEHP in 1× PBS mit 1% (v/v) DMSO vor.
- Bereiten Sie eine neue Transportbehälterplatte mit 300 μL frischem 1x PBS pro Well vor.
- Unmittelbar nach Schritt 3.3 für eine suspendierte Einlipiddoppelschicht oder 4.4.3 für eine suspendierte Multilipiddoppelschicht wird die 1× PBS aus dem Spenderkompartiment der Multiscreen-Filterplatte entfernt und durch 200 μL der Testlösung ersetzt. Tauchen Sie sofort in die in Schritt 6.2.2 vorbereitete Transportbehälterplatte ein.
- Mit sanftem Schaukeln für eine gewünschte Zeit (z.B. 2 h) bei 25 °C inkubieren.
- Nach der Inkubation werden 150 μL der Lösung aus den Spender- und Akzeptorkompartimenten entnommen. Messen Sie die Molekülkonzentration in beiden Proben mit einer geeigneten Methode, die auf den Eigenschaften dieses Moleküls basiert.
- Verwenden Sie beispielsweise ein Mikroplattenspektrophotometer mit der entsprechenden Absorptionswellenlänge, z. B. 280 nm für DEHP, und vergleichen Sie es mit einer Standardkurve des interessierenden Moleküls.
- Berechnen Sie die scheinbare Permeabilität (Papp) des interessierenden Moleküls mit den folgenden Gleichungen:
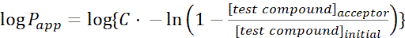 (1)
(1)
Wobei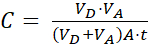 (2)
(2)
ANMERKUNG: [Testverbindung]Akzeptor ist die Konzentration des interessierenden Moleküls (z. B. DEHP) zum Zeitpunkt t im Akzeptorkompartiment; und [Testverbindung]Initial ist die Anfangskonzentration des Moleküls. A ist die Membranfläche, t ist die Zeit, VD ist das Volumen des Spenderfachs und VA ist das Volumen des Akzeptorfachs.
Ergebnisse
Dieses Protokoll beschreibt Methoden zur Bildung von unterstützten und suspendierten Lipiddoppelschichten (Abbildung 1). Der erste Schritt zur Bildung einer unterstützten Lipiddoppelschicht ist die Entwicklung von Lipidvesikeln. Der Mini-Extruder ermöglicht die Herstellung kleiner Mengen von Lipidvesikeln (1 ml oder weniger), während der große Extruder die Herstellung von 5-50 ml Lipidvesikeln in einer Charge ermöglicht. Größenverteilungen von Einlipidvesikeln, die entweder vom Mini-...
Diskussion
Dieses Protokoll ermöglicht die Bildung von Lipidvesikeln, unterstützten Lipiddoppelschichten und suspendierten Lipiddoppelschichten. Hier werden kritische Schritte vorgestellt, um jede dieser Strukturen zu bilden. Bei der Bildung von Lipidvesikeln ist es wichtig, oberhalb der Sprungtemperatur des Lipids39zu extrudieren. Wenn unterhalb der Übergangstemperatur das Lipid physisch in seiner geordneten Gelphase39vorhanden ist. In dieser geordneten Phase sind die Kohlenwasser...
Offenlegungen
Die Autoren erklären, dass sie keinen Interessenkonflikt oder konkurrierende finanzielle Interessen haben.
Danksagungen
Dieses Material basiert auf Arbeiten, die von der National Science Foundation im Rahmen von Grant No. 1942418 an AS und einem Graduate Research Fellowship der National Science Foundation an C.M.B.H. unter Grant No. 1644760 unterstützt werden. Alle Meinungen, Ergebnisse und Schlussfolgerungen oder Empfehlungen, die in diesem Material zum Ausdruck gebracht werden, sind die der Autoren und spiegeln nicht unbedingt die Ansichten der National Science Foundation wider. Die Autoren danken Dr. Noel Vera-González für die Datenerfassung zur Charakterisierung von Lipidvesikeln. Die Autoren danken Professor Robert (Brown University) für den Einsatz seines Zetasizers. Die Autoren danken der Brown University Mass Spectrometry Facility, insbesondere Dr. Tun-Li Shen für die Unterstützung bei der Quantifizierung der Lipidzusammensetzung.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
Referenzen
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten