Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Cancer Research
تحليل التدفق الخلوي للمؤشرات الحيوية لموت الخلايا المبرمج في خلايا سرطان عنق الرحم SiHa المعالجة بالأكتينومايسين D
يمكن تمييز موت الخلايا المبرمج عن طريق التحليل الخلوي للتدفق للمؤشرات الحيوية المبكرة والمتأخرة لموت الخلايا المبرمج. تم تحليل خط خلايا سرطان عنق الرحم ، SiHa ، بحثا عن المؤشرات الحيوية لموت الخلايا المبرمج بعد العلاج بالأكتينومايسين D باستخدام مقياس التدفق الخلوي على الطاولة.
تم فحص المؤشرات الحيوية لموت الخلايا المبرمج في خلايا سرطان عنق الرحم SiHa المعالجة بالأكتينومايسين D باستخدام مقياس التدفق الخلوي على الطاولة. تم قياس المؤشرات الحيوية المبكرة (الملحق الخامس وإمكانية غشاء الميتوكوندريا) والمؤشرات الحيوية المتأخرة (caspases 3 و 7 ، وتلف الحمض النووي) لموت الخلايا المبرمج في الثقافات التجريبية والضابطة. تم تحضين الثقافات لمدة 24 ساعة في حاضنة مرطبة عند 37 درجة مئوية مع 5٪ CO2. ثم تم فصل الخلايا باستخدام التربسين وتعدادها باستخدام مقايسة عدد الخلايا الخلوية للتدفق. تم تحليل الخلايا بشكل أكبر بحثا عن موت الخلايا المبرمج باستخدام مقايسة Annexin V ، ومقايسة محتملة عبر الغشاء الكهروكيميائية للميتوكوندريا ، ومقايسة كاسباز 3/7 ، ومقايسة تلف الحمض النووي. تقدم هذه المقالة نظرة عامة على موت الخلايا المبرمج وقياس التدفق الخلوي التقليدي ، وتوضح بروتوكولات قياس التدفق الخلوي لمعالجة وتحليل خلايا SiHa. تصف النتائج البيانات التجريبية الإيجابية والسلبية ودون المستوى الأمثل. كما تمت مناقشة التفسير والمحاذير في إجراء تحليل التدفق الخلوي لموت الخلايا المبرمج باستخدام هذه المنصة التحليلية. يوفر تحليل التدفق الخلوي قياسا دقيقا للمؤشرات الحيوية المبكرة والمتأخرة لموت الخلايا المبرمج.
موت الخلايا المبرمج ، المصنف علىأنه موت الخلايا المبرمج من النوع 1 1 ، يضمن التوازن بين تكاثر الخلايا وموت الخلايا2. موت الخلايا المبرمج ضروري أثناء التنمية البشرية ، وبعد الإصابة ، وللوقاية من أمراض مثل السرطان3. تتسبب مسارات إشارات موت الخلايا المبرمج الداخلية والخارجية4 في حدوث تغيرات كيميائية حيوية ومورفولوجية متسلسلة داخل الخلايا2،5،6. يمكن تحديد السمات المورفولوجية لموت الخلايا المبرمج عن طريق الفحص المجهري ، ويمكن تحليل الاضطراب الكيميائي الحيوي بواسطة المقايسات الكيميائية الحيوية ، بما في ذلك قياس التدفق الخلوي (FC)7.
ازدهر تحليل التدفق الخلوي لتحديد موت الخلايا المبرمج وفهم الآليات المرتبطة داخل الخلايا على مدى العقدين الماضيين8. FC هي منهجية علمية تحلل الخلايا في سائل يمر عبر ليزر أحادي أو متعدد القنوات (الشكل 1)9,10,11. يتم تركيز الخلايا الموجودة في السائل في ملف واحد بواسطة نظام الموائع لمقياس التدفق الخلوي باستخدام التركيز الهيدروديناميكي. عندما تمر الخلايا عبر الليزر ، يتشتت الضوء أو ينبعث من الخلايا. يمكن أن يكون الضوء المبعثر في الاتجاه الأمامي (التشتت الأمامي) أو باتجاه الجانب (التشتت الجانبي) ويوفر معلومات حول حجم الخلية ودقة الخلية أو الهياكل الداخلية ، على التوالي.
بالإضافة إلى ذلك ، تكتشف الكواشف الفلورية ، مثل الأصباغ الفلورية أو الأجسام المضادة الموسومة بالفلوروفورات ، هياكل أو جزيئات سطحية أو داخل الخلايا محددة. عندما يثير الليزر الفلوروفورات ، ينبعث الضوء عند طول موجي معين. تقوم أجهزة الكشف - عادة أنابيب المضاعف الضوئي - بتحديد كمية الضوء المتناثر والمنبعث من عينات الخلايا. تنتج أجهزة الكشف تيارا قابلا للقياس الكمي يتناسب مع تشتت الضوء وانبعاث التألق. يتم تحويل الإخراج الإلكتروني إلى إشارات رقمية عن طريق برنامج الحوسبة لتحديد مجموعات الخلايا بناء على حجم الخلية ودقة الخلية ومضان الخلية النسبي للجزيئات ذات العلامات الفلورية9،12،13.
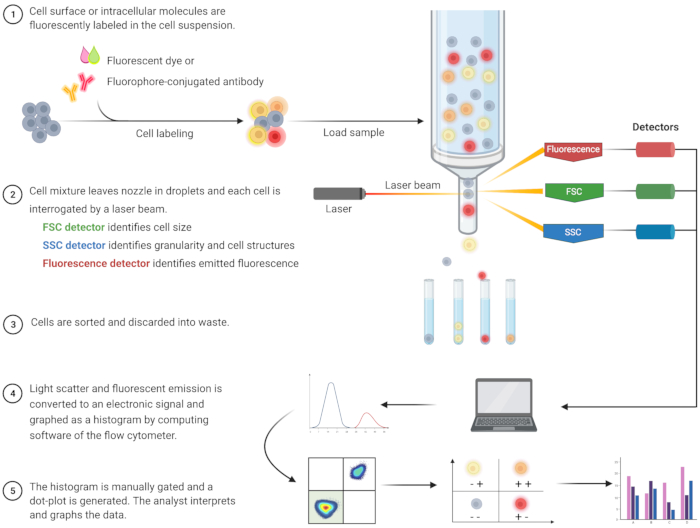
الشكل 1: رسم تخطيطي يصف العملية الفنية وسير العمل لقياس التدفق الخلوي التقليدي. الخلايا ملطخة بكواشف الفلورسنت ويتم فحصها بواسطة الليزر. يتم الكشف عن إشارات التألق المتولدة وتحويلها إلى مخرجات إلكترونية ، والتي يتم رقمنتها وتحليلها بواسطة برامج الكمبيوتر والبرامج الإحصائية. الاختصارات: FSC = مبعثر أمامي ؛ SSC = مبعثر جانبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يستخدم FC في كل من البحوث والتشخيص الصحي. الهدفان من FC في علم الأحياء الميت هما توضيح الخصائص الجزيئية والوظيفية لموت الخلايا والتمييز بين أنماط مختلفة من موت الخلايا14،15،16،17،18. تشمل تطبيقات FC تعداد الخلايا ، وفرز مجموعات الخلايا ، والتنميط المناعي ، والكشف عن العلامات الحيوية (على سبيل المثال ، المؤشرات الحيوية لموت الخلايا المبرمج) ، ودراسات السمية ، وهندسة البروتين12. بالإضافة إلى ذلك ، يتم تطبيق FC بشكل شائع على التشخيص الصحي للمساعدة في تشخيص ومراقبة المرضى الذين يعانون من الأورام الخبيثة الدموية. تعمل التطورات في الأجهزة والكشف عن الفلوروفور وأنظمة الكشف على توسيع تطبيقات FC لتشمل القياس الخلوي التصويري وقياس الكتلة الخلوية والقياس الخلوي الطيفي مع تطبيقات بحثية أوسع12.
يوفر تحليل التدفق الخلوي لموت الخلايا المبرمج مزايا على التقنيات التقليدية المستخدمة في تقييم صحة الخلايا. يمكن ل FC تحليل العديد من الخلايا المفردة في عينة غير متجانسة بسرعة وبشكل متكرر لتقدير موت الخلايا المبرمج 3,5. توفر قدرة FC على توفير معلومات كمية عن الأنماط الظاهرية للخلايا على أساس الخلية الفردية ، وتجنب التحليل بالجملة ، حساسية فائقة للنشاف الغربي ، ومقايسات الممتز المناعي المرتبط بالإنزيم (ELISAs) ، والقياس الفلوري ، وتقنيات القياس الطيفي المستخدمة في تحليل موت الخلايا المبرمج8،19. علاوة على ذلك ، فإن السهولة النسبية لتحليل FC على عكس الخطوات اليدوية المرهقة وغير القابلة للتكرار بشكل سيئ للبقع الغربية و ELISAs مفيدة. وبالتالي ، فإن التحليل القابل للتكرار والدقيق وعالي الإنتاجية ل FC مفيد في أبحاث السرطان20.
يسمح FC أيضا بالتحليل المتزامن لمعلمات دورة الخلية لمجموعات الخلايا المبرمج السليمة وغير الطبيعية21. نظرا لأن موت الخلايا المبرمج عملية ديناميكية ، يمكن أن تؤدي الطرق المختلفة إلى نتائج متغيرة وتعتمد على النقطة الزمنية التي يتم فيها حصاد الخلايا22. يسمح التقييم الكمي المتزامن للمعلمات المتعددة للنمط الظاهري للخلية بالكشف عن مجموعات فرعية ثانوية بدقة عالية ، على سبيل المثال ، يمكن اكتشاف مجموعات فرعية من الخلايا النادرة ذات التردد المنخفض بنسبة 0.01٪23. يعد تحليل FC متعدد المعلمات مفيدا بشكل خاص حيث يحدث موت الخلايا المبرمج على طول مجموعة من التغيرات الكيميائية الحيوية المبكرة والمتأخرة مع الخلايا في نقاط مختلفة على طول سلسلة موت الخلايا المبرمج. على سبيل المثال ، يتيح استخدام التلوين المزدوج باستخدام Annexin V ويوديد البروبيديوم في تحليل FC للخلايا المبرمج تصنيف الخلايا المبرمج المبكرة والخلايا المبرمج المتأخرة والخلايا الميتة24. يؤدي الكشف الدقيق عن موت الخلايا المبرمج في مراحل متعددة إلى تجنب التصنيف الخاطئ والنتائج السلبية الكاذبة. وبالتالي ، فإن التحليل متعدد المعلمات بواسطة FC يحسن الخصوصية العامة للكشف عن الأنماط الظاهرية للخلايا ويتجنب التصنيف الخاطئ للسكان الثانويين. علاوة على ذلك ، يسمح فرز الخلايا بواسطة FC بعزل مجموعات الخلايا ذات النقاء العالي للتحليل اللاحق7.
يشمل عيب FC استخدام الخلايا في التعليق ، والذي يمكن أن يكون صعبا في تحليل الأنسجة ، لأن تصنيف الأنسجة إلى خلايا قد يغير الوظيفة الخلوية19. وعلاوة على ذلك، فإن عدم توحيد إعداد أجهزة التيسير المالي، وتحليل البيانات، وتقارير الفحص قد يتسبب في تباين النتائج19، مما يؤكد الحاجة إلى التدريب الأمثل لمشغلي التدفقات المالية على أداء البيانات وتحليلها والإبلاغ عنها. على سبيل المثال ، تتطلب قدرة FC على تمييز الحطام الحقيقي لموت الخلايا المبرمج من نوى موت الخلايا المبرمج i) إعدادات اكتساب مناسبة ، ii) استخدام حبات المعايرة لتحديد ذروة الحمض النووي ثنائية الصيغة الصبغية ، و iii) عناصر التحكم في الخلايا السلبية والإيجابية الخاصة بالخلية3. وعلاوة على ذلك، فإن التحليل المتعدد المعلمات محدود بعدد أجهزة الكشف، ويلزم إجراء التعويض الأمثل لتجنب النتائج غير المحددة وامتداد الانبعاثات الفلورية عند استخدام كواشف فلورية متعددة25. أدى التقدم في تكنولوجيا الأدوات والفلوروفور إلى تحسين الكشف عن المعلمات إلى 30 معلمة12.
تحديد موت الخلايا المبرمج ليس دائما بسيطا7 ، ويجب مراعاة المؤشرات الحيوية الحساسة والمحددة. توصي لجنة التسميات المعنية بموت الخلايا (NCCD) باستخدام أكثر من اختبار واحد لدراسة وتحديد عملية موت الخلايا المبرمج26. يوصى أيضا بالتحليل المجهري لميزات موت الخلايا المبرمج الكلاسيكية26 لتأكيد موت الخلايا المبرمج وتجنب النتائج الإيجابية الكاذبة7. أربع ميزات كيميائية حيوية أساسية تمتد عبر أحداث موت الخلايا المبرمج المبكرة والمتأخرة هي (1) فقدان عدم تناسق غشاء الخلية. (2) تبديد إمكانات غشاء الميتوكوندريا (ΔΨm) ؛ (3) تفعيل الكاسباس ؛ و (4) تلف الحمض النووي26.
أثناء موت الخلايا المبرمج المبكر ، يتم إخراج الفوسفاتيديل سيرين إلى غشاء الخلية الخارجي 27 ويمكن اكتشافه بواسطة Annexin V المسمى بالفلورسنت مع phycoerythrin27،28،29. علاوة على ذلك ، فإن التلوين المزدوج مع صبغة ربط الحمض النووي الفلورية ، 7-aminoactinomycin D (7-AAD) ، يميز الخلايا الحية والمتأخرة والميتة. لذلك ، فإن الخلايا المبرمج المبكرة تلطخ إيجابية ل Annexin V وسالبة ل 7-AAD ، على عكس الخلايا المبرمج المتأخرة ، التي تلطخ إيجابية لكلا الصبغتين24.
تحفز إشارات موت الخلايا المبرمج الجوهرية تبديد إمكانات غشاء الميتوكوندريا (ΔΨm). يتسبب اضطراب ΔΨm في إطلاق بروتينات مبكرة مؤيدة لموت الخلايا المبرمج من الفضاء بين غشاء الميتوكوندريا إلى السيتوسول27،29،30. يمكن تقييم التغير في ΔΨm عن طريق التلوين المزدوج باستخدام صبغة موجبة الشحنة ، محبة للدهون ، إستر إيثيل رباعي ميثيل رودامين ، TMRE ، و 7-AAD. تتراكم صبغة TMRE داخل الغشاء الداخلي للميتوكوندريا السليمة عندما تكون إمكانات الغشاء عالية. تظهر الميتوكوندريا غير المستقطبة انخفاضا في التألق. الخلايا الحية ذات الميتوكوندريا المستقطبة (غشاء الميتوكوندريا السليم) تلطخ إيجابية ل TMRE وسلبية ل 7-AAD. الخلايا الميتة ذات الميتوكوندريا غير المستقطبة سلبية ل TMRE وإيجابية ل 7-AAD31.
ال caspases هي عائلة من البروتياز داخل الخلايا التي ، عند تنشيطها ، تشير وتنفذ موت الخلايا المبرمج26,27. الجلاد النهائي caspases (3،6،7) تأثير موت الخلايا المبرمج في وقت متأخر29،32،33. يمكن قياس أنشطة Caspase-3 و -7 بواسطة ركيزة موسومة بالفلورسنت ، والتي ، عند شقها ، ترتبط بالحمض النووي وتصدر إشارة فلورسنت. علاوة على ذلك ، يمكن تقييم أي حل وسط لسلامة غشاء الخلية عن طريق تلطيخ 7-AAD. الخلايا المبرمج تلطخ إيجابية للصبغة المرتبطة بالحمض النووي ولكنها سلبية ل 7-AAD. الخلايا المبرمج المتأخرة والميتة وصمة عار إيجابية لكلا الأصباغ34.
يتميز موت الخلايا المبرمج المتأخر بتلف الحمض النووي27،29،35 ، والذي يمكن تقييمه عن طريق الرنح المفسفر وكيناز المتحور (ATM) وهيستون H2A.X. تتسبب فواصل الحمض النووي المزدوجة التي تقطعت بها السبل (DSBs) في فسفرة H2A.X. الأجسام المضادة ذات العلامات الفلورية ضد ATM و H2A. X يمكن أن يحدد تلف الحمض النووي. الكشف السلبي عن كل من أجهزة الصراف الآلي و H2A. يشير X إلى عدم وجود تلف في الحمض النووي ، بينما يشير اكتشاف كلا الصبغتين إلى وجود فواصل مزدوجة الخيوط في الحمض النووي36.
الأكتينومايسين D هو محفز قوي لموت الخلايا المبرمج ويعمل عن طريق الارتباط بالحمض النووي لمنع أحداث النسخ والترجمة37. تهدف هذه الدراسة إلى تقييم موت الخلايا المبرمج الكيميائي الحيوي الناجم عن الأكتينومايسين D في خط خلايا SiHa من خلال تحليل المؤشرات الحيوية المبكرة والمتأخرة لموت الخلايا المبرمج. قامت أربعة مؤشرات حيوية كيميائية حيوية لموت الخلايا المبرمج بتقييم الخطوات المتسلسلة في سلسلة موت الخلايا المبرمج التي تضمنت فقدان عدم تناسق غشاء الخلية ، والتغيير في إمكانات غشاء الميتوكوندريا ، وتنشيط الكاسباس الطرفي ، وتلف الحمض النووي.
ملاحظة: يصف هذا البروتوكول خطوات تحضير الخلايا ، وتعداد الخلايا ، وتلطيخ الخلايا ، وتحليل خلايا SiHa المعالجة بالأكتينومايسين D باستخدام المقايسات التجارية لقياس التدفق الخلوي التي تم قياسها وتحليلها على مقياس التدفق الخلوي على الطاولة (الشكل 2).
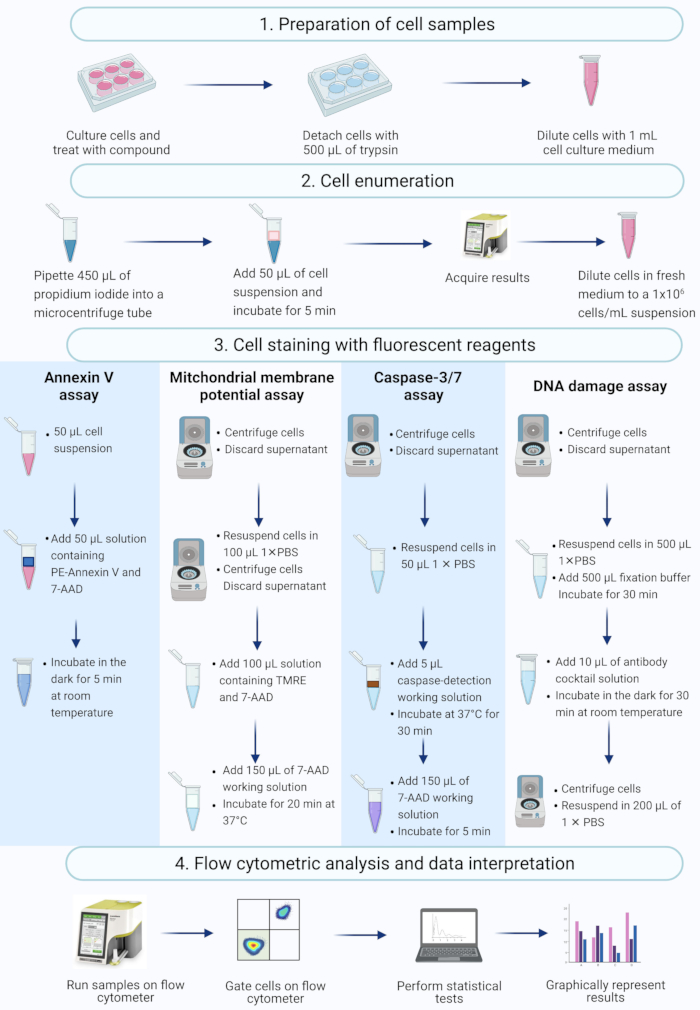
الشكل 2: سير العمل للكشف عن المؤشرات الحيوية لموت الخلايا المبرمج البيوكيميائية عن طريق قياس التدفق الخلوي. يتم استزراع الخلايا ومعالجتها كما هو موضح في الخطوة 1.1 من البروتوكول. (1) يتم استزراع الخلايا ، (2) تعدادها و (3) ملطخة بالكواشف الفلورية ، و (4) تحليلها بواسطة مقياس التدفق الخلوي على الطاولة. يتم إدخال المزيد من البيانات وتحليلها إحصائيا. الاختصارات: 7-AAD = 7-أمينوأكتينومايسين د ؛ PBS = محلول ملحي مخزن بالفوسفات ؛ PE = فيكوريثرين. TMRE = رباعي ميثيل رودامين إيثيل استر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد زراعة الخلايا وعلاجات قياس التدفق الخلوي
ملاحظة: تأكد من اتباع تقنية التعقيم عند التعامل مع مزارع الخلايا.
- تنمو مزارع الخلايا في بيئة CO 2 رطبة عند 37 درجة مئوية مع 5٪ CO2. تأكد من أن زراعة الخلايا متقاربة بنسبة 70٪ تقريبا في القارورة الأم قبل تمرير الخلايا لإجراء التجارب.
- قم بإزالة الوسط من القارورة ، واغسل الخلايا بمحلول ملحي مخزن بالفوسفات 1x (PBS) وأضف 500 ميكرولتر من التربسين لفصل الخلايا. بعد أن تبدأ الخلايا في الدوران والانفصال عن القارورة ، اطرق بحدة قاعدة القارورة على المقعد لفصل الخلايا. ثم قم بتحييد التربسين بإضافة حوالي 5 مل من وسط الاستزراع الطازج المكمل بمصل عجل الجنين بنسبة 10٪ قبل عد الخلايا.
- خلايا البذور عند 15000 خلية / مل في 3 مل من وسط زراعة الخلايا في صفيحة استزراع الخلايا المكونة من 6 آبار. احتضان لوحات الاستزراع طوال الليل عند 37 درجة مئوية مع 5٪ CO2 للسماح بربط الخلايا بقاع البئر.
- عالج المستنبتات التجريبية ب 100 نانوغرام / مل أكتينومايسين D والتحكم في الوسط والمذيب بوسط استزراع طازج وثنائي ميثيل سلفوكسيد (DMSO) ، على التوالي ، لمدة 24 ساعة. اجمع الوسط المستهلك في أنبوب سعة 15 مل واغسل الخلايا باستخدام 1x PBS. بعد ذلك ، أضف غسل 1x PBS إلى الأنبوب ، ثم أضف 500 ميكرولتر من التربسين إلى البئر. بعد ذلك ، قم بتحييد التربسين بإضافة 5 مل من وسط الاستزراع الطازج.
ملاحظة: (1) قد يؤدي احتضان التربسين لفترات طويلة أو التحييد غير الكامل إلى هضم الخلايا وتعريض غشاء الخلية للخطر ، مما قد يؤدي إلى انحراف النتائج. بالإضافة إلى ذلك ، قد يغير أيضا عدم تناسق غشاء الخلية ، وبالتالي إمكانية الوصول إلى الفوسفاتيديل سيرين. (2) يمكن تضمين الخلايا التي انفصلت وطفت على السطح في التحليل اللاحق عن طريق الطرد المركزي للوسط الذي تمت إزالته عند 300 × جم لمدة 5 دقائق وإعادة تعليق الخلايا في وسط استزراع جديد.
2. تعداد الخلايا باستخدام مقايسة الصلاحية
- ماصة 450 ميكرولتر من يوديد البروبيديوم في أنبوب طرد مركزي دقيق. أضف 50 ميكرولتر من تعليق الخلية إلى أنبوب الطرد المركزي الدقيق. احتضان الأنبوب في درجة حرارة الغرفة لمدة 5 دقائق. تعداد الخلايا عن طريق قياس التدفق الخلوي (راجع القسم 4).
- خفف جميع العينات إلى تركيز 1 × 106 خلايا / مل مع وسط زراعة الخلايا قبل الانتقال إلى مقايسات موت الخلايا المبرمج.
3. تلطيخ الخلايا لقياس التدفق الخلوي
ملاحظة: الشروط المعقمة غير مطلوبة لهذا الجزء من البروتوكول.
- الكشف عن الفوسفاتيديل سيرين الخارجي باستخدام الملحق الخامس
- أضف 100 ميكرولتر من تعليق الخلية إلى أنبوب الطرد المركزي الدقيق. أضف 100 ميكرولتر من خليط 1: 1 من كاشف Annexin V و 7-AAD المترافق الفلوري. احتضان في درجة حرارة الغرفة لمدة 20 دقيقة ، محمية من الضوء.
- تحليل إزالة استقطاب غشاء الميتوكوندريا
- جهاز طرد مركزي 100 ميكرولتر من تعليق الخلية عند 300 × جم لمدة 5 دقائق وتخلص من المادة الطافية.
- أعد تعليق الخلايا في 1 مل من 1x PBS ، وأضف 100 ميكرولتر من محلول تلطيخ TMRE إلى كل عينة ، وامزج التعليق عن طريق السحب الخلفي اللطيف.
- احتضان الخلايا لمدة 20 دقيقة في بيئة CO2 رطبة عند 37 درجة مئوية. لف العينات بورق ألومنيوم نظيف للحماية من الضوء.
ملاحظة: إمكانات غشاء الميتوكوندريا هي علامة وظيفية حساسة للتغيرات الطفيفة في بيئة الخلية. لذلك ، يجب تحضين العينات وقياسها في ظل ظروف متطابقة (درجة الحرارة ودرجة الحموضة والوقت المنقضي بين بداية الحضانة وقياس الفلورسنت) للحفاظ على قابلية التكاثر). لاحظ أيضا أن الحماية غير الكافية للعينات من الضوء تسبب التبييض الضوئي للفلوروفورات مما يؤدي إلى انخفاض التألق المنبعث بشكل خاطئ. - بعد الحضانة ، أضف 5 ميكرولتر من محلول تلطيخ 7-AAD لكل عينة واخلطها. احتضان لمدة 5 دقائق في درجة حرارة الغرفة ، محمية من الضوء.
- الكشف عن الكاسباز الطرفي المنشط -3 و -7 باستخدام ركيزة الكاسباز DEVD
ملاحظة: يتم إعداد الحلول التالية قبل إجراء هذا الفحص.- قم بتخفيف الببتيد المرتبط بالحمض النووي المرتبط ب DEVD في DMSO إلى نسبة 1: 8 باستخدام 1x PBS معقم لجعل حل عمل الكشف عن الكاسباس. قم بتخزين المحلول على الثلج أو في درجة حرارة 2-8 درجة مئوية ، محميا من الضوء.
ملاحظة: ستتطلب كل عينة 5 ميكرولتر من هذا المحلول. - أضف 2 ميكرولتر من محلول مخزون 7-AAD إلى 148 ميكرولتر من 1x PBS لجعل حل العمل 7-AAD. قم بتخزين المحلول على الثلج أو في درجة حرارة 2-8 درجة مئوية ، محميا من الضوء.
ملاحظة: ستتطلب كل عينة 150 ميكرولتر من هذا المحلول. - أجهزة الطرد المركزي 50 ميكرولتر من تعليق الخلية لمدة 5 دقائق عند 300 × جم. تخلص من المادة الطافية. أعد تعليق الخلايا في 50 ميكرولتر من 1x PBS ، متبوعا ب 5 ميكرولتر من محلول عمل الكشف عن الكاسباس. تخلط جيدا.
- قم بفك غطاء الأنابيب واحتضانها لمدة 30 دقيقة في بيئة CO2 رطبة عند 37 درجة مئوية ، محمية من الضوء. أضف 150 ميكرولتر من محلول العمل 7-AAD لكل عينة واخلطها. احتضان لمدة 5 دقائق في درجة حرارة الغرفة ، محمية من الضوء.
- قم بتخفيف الببتيد المرتبط بالحمض النووي المرتبط ب DEVD في DMSO إلى نسبة 1: 8 باستخدام 1x PBS معقم لجعل حل عمل الكشف عن الكاسباس. قم بتخزين المحلول على الثلج أو في درجة حرارة 2-8 درجة مئوية ، محميا من الضوء.
- الكشف عن فواصل الحمض النووي مزدوجة الشريط وتلف الحمض النووي الكلي
- جهاز طرد مركزي 50 ميكرولتر من تعليق الخلية لمدة 5 دقائق عند 300 × جم. تخلص من المادة الطافية.
- أعد تعليق الخلايا في 500 ميكرولتر من 1x PBS. أضف 500 ميكرولتر من مخزن التثبيت القائم على الفورمالديهايد واخلطه. احتضان العينات على الجليد لمدة 10 دقائق.
- أجهزة الطرد المركزي لمدة 5 دقائق في 300 × غرام وتجاهل الطاف. أعد تعليق الخلايا في 90 ميكرولتر من 1x PBS في أنبوب طرد مركزي دقيق. أضف 10 ميكرولتر من محلول الأجسام المضادة إلى أنبوب الطرد المركزي الدقيق. احتضان في درجة حرارة الغرفة لمدة 30 دقيقة في الظلام.
- أضف 100 ميكرولتر من 1x PBS وأجهزة الطرد المركزي لمدة 5 دقائق عند 300 × جم. تخلص من المادة الطافية. أعد تعليق الخلايا في 200 ميكرولتر من 1x PBS.
4. تشغيل العينات على مقياس التدفق الخلوي.
- تحقق من الأداء التحليلي لمقياس التدفق الخلوي عن طريق تشغيل مجموعة فحص نظام الجهاز. لا تتابع تشغيل العينات حتى تكتمل جميع الفحوصات وتجتازها.
- حدد موقع الفحص المطلوب من خلال تصفح كتالوج المقايسات المبرمجة مسبقا على الأداة وحدد تشغيل الفحص.
- امزج العينة عن طريق سحب العينة برفق قبل تحميل العينة على مقياس التدفق الخلوي.
ملاحظة: يضمن الخلط الكافي بقاء الخلايا معلقة ويمنع انخفاض عدد الخلايا. - أولا ، قم بتحميل عينة تحكم سلبية على مقياس التدفق الخلوي ، وحدد تشغيل (ضبط الإعدادات) بحيث تبدأ الأداة في شفط العينة وتوفر معاينة في الوقت الفعلي للأحداث المكتشفة. ارجع إلى جدول المواد للحصول على اسم الأداة وتفاصيلها.
- باستخدام المعاينة المباشرة ، اضبط عتبات التألق وحجم الخلية وارسم بوابة مستطيلة حول محتوى الخلية. اسحب علامة العتبة لاستبعاد الحطام الخلوي. حدد التالي (تعيين ملف تعريف الصحة) للمتابعة.
ملاحظة: من المهم معرفة حجم الخلايا. اسحب أشرطة التمرير ولاحظ التغييرات في كيفية رسم الأحداث المكتشفة في المعاينة في الوقت الفعلي ، حيث سيؤدي ذلك إلى تحديد دقيق للعتبات. إذا لم يتم استبعاد الحطام الخلوي في هذه المرحلة ، فلا يمكن إزالته في تحليلات ما بعد الاكتساب. - انقر واسحب العلامات الرباعية لفصل مجموعات الخلايا بحيث ترسم الأداة الأحداث المكتشفة في الوقت الفعلي. استخدم هذه المخططات لتوجيه المستخدم النهائي بشأن الموضع المناسب للعلامات الربعية. حدد التالي (التحقق من العينات) للمتابعة بحيث تعرض الأداة ملخصا للإعدادات. بعد مراجعة الإعدادات، حدد التالي (التحقق من الإعدادات) لتطبيق هذه الإعدادات على جميع العينات داخل التجربة.
ملاحظة: يوفر الجهاز معاينة مباشرة لمدة 2 دقيقة للخلايا المستخدمة لضبط إعدادات الجهاز. إذا انتهت صلاحية هذا الحد الزمني ، فسيقوم الصك بإصدار العينة ، وسيتعين تكرار الخطوات 4.2.2-4.2. قم بإزالة العينة واخلطها جيدا قبل إعادة التحميل والمتابعة. - بوابة مجموعة من الخلايا عن طريق رسم منطقة حول مجتمع الخلية. اضبط عتبات التألق وحجم الخلية باستخدام أشرطة التمرير الموجودة على المحور x و y للمعاينة المباشرة. قم بتطبيق هذه الإعدادات على جميع العينات داخل التجربة.
- امزج العينة الأولى عن طريق سحب العينة الخلفية برفق وقم بتحميل العينة الأولى على مقياس التدفق الخلوي وحدد التالي. قم بتسمية العينة وحدد تشغيل بحيث يبدأ النظام في تشغيل العينة.
ملاحظة: يمكن للأداة تشغيل عينة واحدة فقط في كل مرة. - بمجرد تشغيل جميع العينات ، احفظ التجربة بإعطائها عنوانا مناسبا. احفظ إعدادات التجربة الحالية لاستردادها في عمليات التشغيل المستقبلية (اختياري).
- امزج العينة عن طريق سحب العينة برفق قبل تحميل العينة على مقياس التدفق الخلوي.
5. تحليل ما بعد الاستحواذ
- إذا لزم الأمر ، قم بإجراء ضبط دقيق للبوابات أو العلامات الرباعية بعد الاستحواذ.
- حدد موقع التجربة التي تحتاج إلى تعديل من خلال التنقل في متصفح ملفات النظام وافتح التجربة.
- اضغط على معاينة الصورة المصغرة للمؤامرة لتكبيرها. اضغط على الزوايا العلوية اليسرى أو السفلية اليمنى لبوابة الخلية لضبط أبعاد البوابة. لضبط العلامات الرباعية ، انقر فوق تقاطع الخطوط الرأسية والأفقية لتحريك العلامات كما هي. لضبط زاوية أي من الخطين ، انقر فوق الخط واسحب المقبض.
- اضبط العلامات (كما هو موضح سابقا في الخطوات 4.1.3-4.1.4) حسب الرغبة وقم بتطبيق هذه الإعدادات على جميع العينات في التجربة عن طريق تحديد رمز علامة الاختيار ووضع علامة على جميع العينات وتحديد قبول.
6. التحليل الإحصائي
- قم بإجراء الاختبارات في ثلاث نسخ وقم بإجراء تحليل التباين (ANOVA) باستخدام اختبار Bonferroni اللاحق لتقييم الاختلافات المهمة بين العينات المعالجة والضوابط.
ملاحظة: يعتمد الاختبار الإحصائي المختار على الباحث والمتغيرات التي يتم تحليلها.
أظهرت نتائج عدد الخلايا وصلاحيتها (الشكل 3) أن 95.2٪ من الخلايا في العينة كانت حية ، و 4.8٪ ماتت. كان تركيز الخلية الكلي في العينة الأصلية 6.20 × 106 خلايا / مل.
أظهر اختبار Annexin V واختبار موت الخلايا (الشكل 4) زيادة كبيرة (p < 0.0001) في الخلايا المبرمج في خلايا SiHa المعالجة ب 100 نانوغرام / مل أكتينومايسين D مقارنة بالضوابط. نظرا لأن تلطيخ Annexin V يزداد في الخلايا أثناء موت الخلايا المبرمج في المرحلة المبكرة ، فإن هذه النتيجة تشير إلى أن 100 نانوغرام / مل من الأكتينومايسين D يسببه موت الخلايا المبرمج في خلايا SiHa.
أظهر مقايسة جهد الغشاء الكهروكيميائي للميتوكوندريا (الشكل 5) انخفاضا كبيرا (p < 0.0001) في ملامح صحة الخلية (حية ، غير مستقطبة وحية ، غير مستقطبة ، وميتة ، ميتة) بين الأكتينومايسين D ، التحكم المتوسط ، والتحكم في المذيبات. تشير هذه البيانات إلى أن 100 نانوغرام / مل من الأكتينومايسين D تسبب في إزالة استقطاب الميتوكوندريا في خلايا SiHa.
أظهر اختبار caspase 3/7 (الشكل 6) تنشيطا معنويا (p < 0.0001) للكاسباز 3 و 7 في خلايا SiHa المعالجة ب 100 نانوغرام / مل أكتينومايسين D مقارنة بالضوابط. توضح هذه النتائج أن 100 نانوغرام / مل من الأكتينومايسين D تسبب موت الخلايا المبرمج في خلايا SiHa.
أظهر فحص تلف الحمض النووي (الشكل 7) أن 100 نانوغرام / مل أكتينومايسين D بشكل كبير (p < 0.0001) تسبب في علامات تلف الحمض النووي ، ATM و H2A. X ، في خلايا SiHa. تشير هذه النتيجة إلى زيادة كبيرة في تلف الحمض النووي في خلايا SiHa المعالجة بالأكتينومايسين D.
توضح نتائج التجارب دون المستوى الأمثل (الشكل 8) اعتبارات تحليلية في جميع المقايسات. يؤثر تركيز الخلية على دقة البيانات. في الشكل 8 أ ، يكون عدد الخلايا منخفضا بشكل غير مقبول. مجموعات الخلايا المسورة في جميع الأرباع ال 4 من المخطط النقطي لها كثافة إشارة منخفضة. تقوم الشركة المصنعة بتحسين الفحص ل 300-700 خلية / ميكرولتر في حجم العينة النهائي. يوضح هذا المثال أهمية استخدام تركيز العينة الصحيح الذي تحدده الشركة المصنعة.
بالإضافة إلى ذلك ، تسببت تركيزات الخلايا العالية أيضا في نتائج خاطئة (الشكل 8 ب). أظهرت الثقافات المتوسطة والتجريبية 99.95٪ و 100٪ خلايا حية ، على التوالي. تجاوز معدل التدفق لكلا المقايسات التركيز الأمثل للشركة المصنعة البالغ 100-500 خلية / ميكرولتر وتطلب التخفيف باستخدام 1x Assay Buffer لتجنب التحليل غير الدقيق.
يجب تجنب تكتل الخلايا أثناء تحضير الثقافات التجريبية لأنه ينتج نتائج خاطئة بسبب زيادة مؤشرات حجم الخلية ، كما هو موضح في اختبار الملحق الخامس. يوضح الشكل 8C مشكلة مزدوجة تتمثل في ارتفاع تركيز الخلايا الذي يتجاوز تعليمات الشركة المصنعة وتكتل الخلايا ، كما يتضح من مؤشرات حجم الخلية التي تتجاوز 4 في التحكم في وسط SiHa. يتضح تركيز الخلايا المرتفع من خلال صفائح الخلايا التي تشكل مستوى أحمر ساطع من الخلايا في الثقافات المتوسطة ، مما يدل على ارتفاع أعداد الخلايا المبرمج بشكل متناف.
يمكن أن يؤدي تلطيخ الثقافات لفترات طويلة إلى ارتباط غير محدد للبروتينات ويؤدي إلى نتائج خاطئة ، كما يتضح من فحص الملحق الخامس. يوضح الشكل 8D نتائج مماثلة للمزارع المتوسطة والتجريبية بسبب التلوين لفترات طويلة.
يؤدي سوء التعامل مع العينات ، والتربسين الممتد للخلايا الملتصقة ، والامتصاص القوي أثناء خطوات الغسيل ، وخطوات الطرد المركزي عالية السرعة والطويلة إلى تحلل الخلايا وكميات كبيرة من حطام الخلية. في الشكل 8E ، تظهر الثقافات التي تم تحليلها بواسطة مقايسة caspase 3/7 زيادة حطام الخلايا كما يتضح من مؤشر حجم الخلية الصغير (مؤشر حجم الخلية < 2.2). لذلك يجب توخي الحذر عند إعداد العينات للحصول على البيانات.
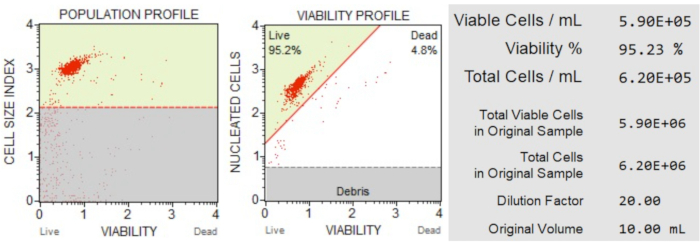
الشكل 3: عدد الخلايا ومقايسة الجدوى. يفصل ملف تعريف السكان الحطام عن الخلايا الحية والميتة. مخطط النقطة ثنائي الأبعاد مسور ويقسم مجموعات الخلايا الحية والميتة. توفر لوحة المعلومات بيانات كمية عن عدد الخلايا والنسبة المئوية لإجمالي الخلايا القابلة للحياة والعدد الإجمالي للخلايا القابلة للحياة في العينة. يمكن استخدام هذه البيانات لتوحيد عدد الخلايا في جميع العينات لتحليلات موت الخلايا المبرمج اللاحقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
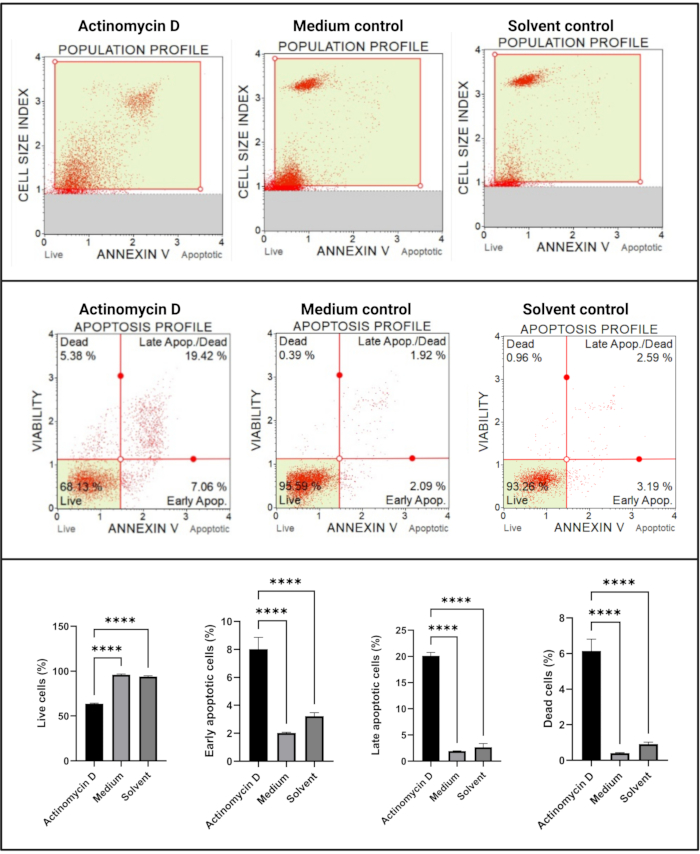
الشكل 4: فحص الملحق الخامس. تظهر جميع العينات معلمات بوابات متطابقة ، ويكشف التحليل الإحصائي لكل مجموعة فرعية عن زيادة كبيرة في موت الخلايا المبرمج في الخلايا المعالجة بالأكتينومايسين D. تم إجراء جميع المقايسات كثلاث تجارب مستقلة ، وتم فحص كل تجربة في ثلاث نسخ. يتم عرض البيانات كمتوسط ± SD ، واعتبر p < 0.05 ذا دلالة إحصائية. ص < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
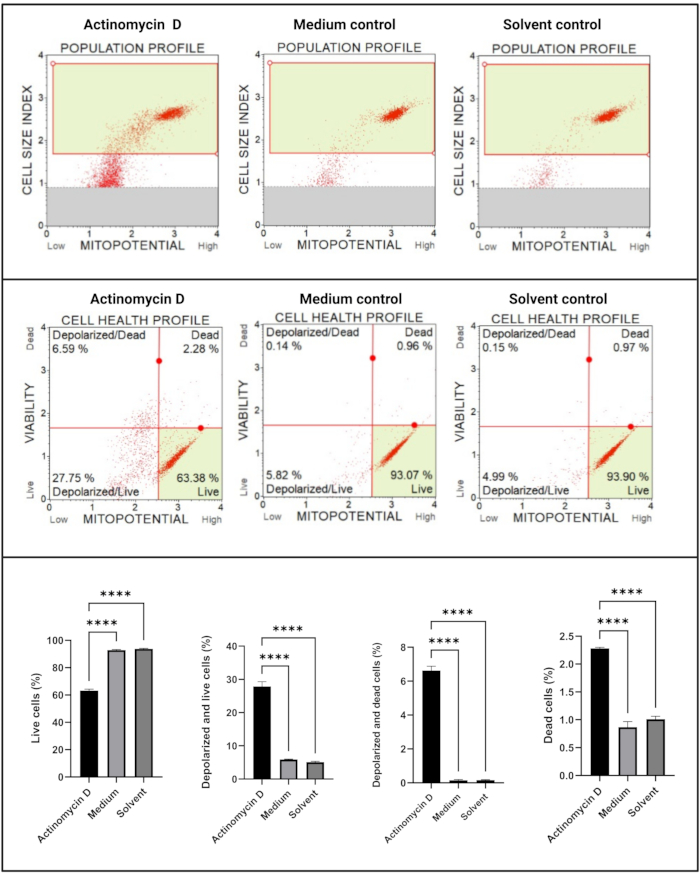
الشكل 5: مقايسة جهد الميتوكوندريا الكهروكيميائية عبر الغشاء. تظهر جميع العينات معلمات بوابات متطابقة ، ويكشف التحليل الإحصائي لكل مجموعة فرعية عن اضطراب كبير في إمكانات غشاء الميتوكوندريا في الخلايا المعالجة بالأكتينومايسين D. تم إجراء جميع المقايسات كثلاث تجارب مستقلة ، وتم فحص كل تجربة في ثلاث نسخ. يتم عرض البيانات كمتوسط ± SD ، واعتبر p < 0.05 ذا دلالة إحصائية. ص < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
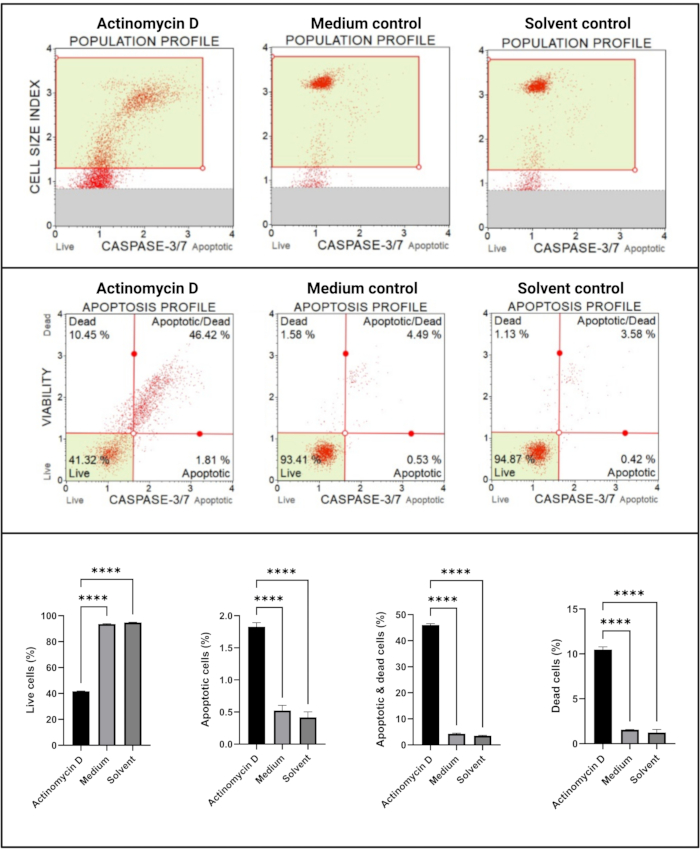
الشكل 6: فحص الكشف Caspase 3/7. تظهر جميع العينات معلمات بوابات متطابقة ، ويكشف التحليل الإحصائي لكل مجموعة فرعية عن زيادة كبيرة في نشاط caspase 3/7 في الخلايا المعالجة بالأكتينومايسين D. تم إجراء جميع المقايسات كثلاث تجارب مستقلة ، وتم فحص كل تجربة في ثلاث نسخ. يتم عرض البيانات كمتوسط ± SD ، واعتبر p < 0.05 ذا دلالة إحصائية. ص < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
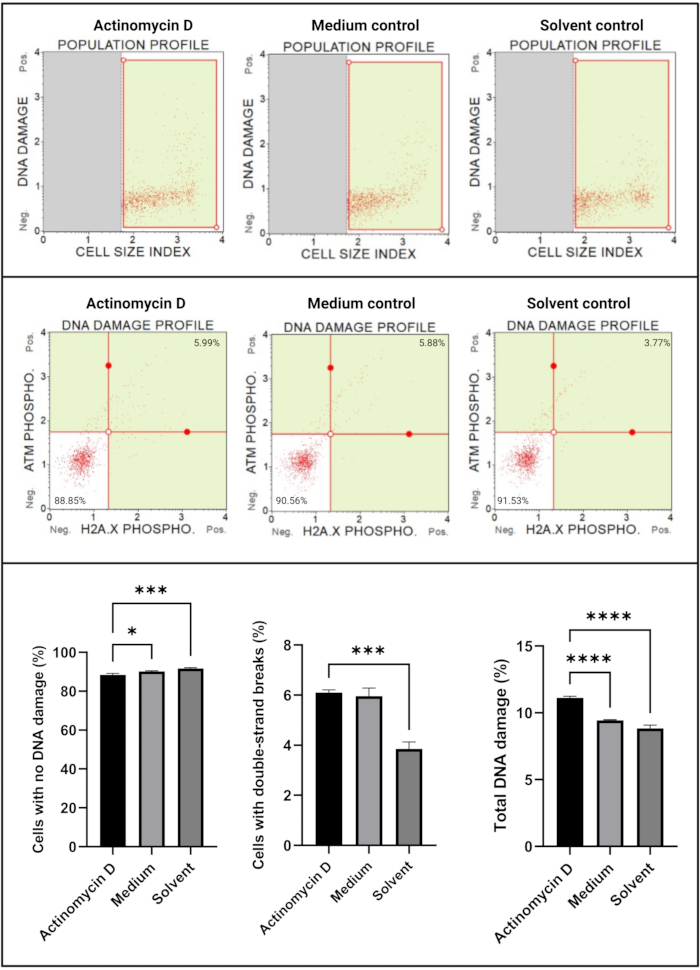
الشكل 7: فحص تلف الحمض النووي. تظهر جميع العينات معلمات بوابات متطابقة ، ويكشف التحليل الإحصائي لكل مجموعة فرعية عن زيادة كبيرة في تلف الحمض النووي المزدوج الشريط وتلف الحمض النووي الكلي في الخلايا المعالجة بالأكتينومايسين D. تم إجراء جميع المقايسات على ثلاث تجارب مستقلة ، وتم فحص كل تجربة في ثلاث نسخ. يتم عرض البيانات كمتوسط ± SD ، واعتبر p < 0.05 ذا دلالة إحصائية. * ص < 0.05 ؛ ص < 0.001 ؛ ص < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
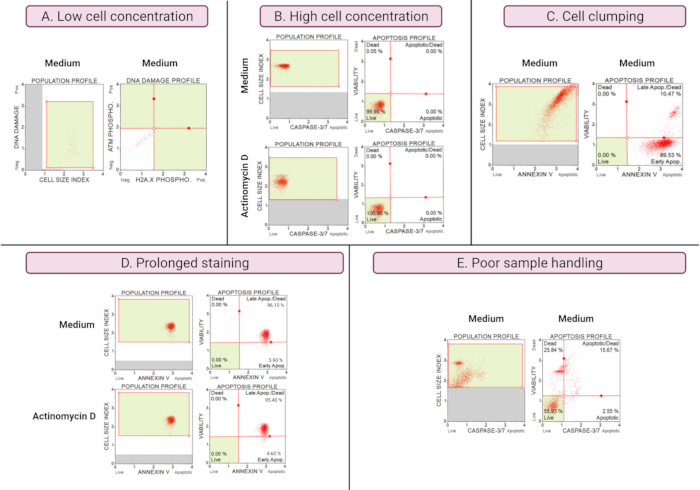
الشكل 8: الظروف التجريبية دون المستوى الأمثل تسفر عن نتائج سيئة. (أ) تركيز منخفض للخلايا، (ب) تركيز عال للخلايا، (ج) تكتل الخلايا وتجميعها واضح بمؤشر ارتفاع حجم الخلية، (د) تلطيخ عينات الخلايا لفترات طويلة واضح من خلال زيادة التلوين الإيجابي في كلتا العينتين، (ه) سوء التعامل مع العينات يتضح من زيادة الحطام الخلوي (مؤشر حجم الخلية < 2.2). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
في هذه الدراسة ، كشفت خلايا SiHa المعالجة بالأكتينومايسين D التي تم تحليلها بواسطة FC عن مؤشرات حيوية مبكرة ومتأخرة لموت الخلايا المبرمج. حددت الظروف دون المثلى لإعداد الخلايا والتعداد والتلوين نتائج غير دقيقة ، مما يؤكد الحاجة إلى الالتزام الوثيق بتعليمات الشركة المصنعة عند إجراء FC.
تتوافق هذه الدراسة حول موت الخلايا المبرمج عن طريق تحديد العلامات الحيوية المبكرة والمتأخرة مع إرشادات NCCD1 للتحقيق في موت الخلايا المبرمج. أظهرت مزارع SiHa المعالجة بالأكتينومايسين D مؤشرات حيوية إيجابية لمراحل موت الخلايا المبرمج المبكرة والمتأخرة. أظهر فحص Annexin V / PI ومقايسة نفاذية الميتوكوندريا أن الأكتينومايسين D تسبب في نمط PS-flip وتبديد انتقال غشاء الميتوكوندريا ، على التوالي. بمجرد وصول الخلايا المبرمج إلى نقطة اللاعودة الناجمة عن اضطراب الميتوكوندريا ، يتم تنشيط الكاسباز الطرفي 3,7. يشير تنشيط caspases الطرفي 3 و 7 الذي لوحظ في هذه الدراسة إلى موت الخلايا المبرمج في المرحلة المتأخرة. علاوة على ذلك ، يتسبب تنشيط الكاسباز النهائي في انقسام الحمض النووي بين النواة وتجزئة الحمض النووي على نطاق واسع ، والذي تم الإبلاغ عنه بشكل كلاسيكي كنمط سلم متدرج لوحظ بواسطة الرحلان الكهربائي الهلامي28,38.
الضرر النووي مع أجهزة الصراف الآلي و H2A. أظهر فحص تلف الحمض النووي X FC فواصل مزدوجة في الحمض النووي وتلف إجمالي للحمض النووي. أكدت هذه النتائج الضرر النووي الكلاسيكي الناجم عن الكاسباس (karyorrhexis و karyorrlysis) في الثقافات التجريبية. وهكذا كشف استخدام المؤشرات الحيوية للتدفق الخلوي المتعدد عن الأحداث المتسلسلة متعددة المراحل في موت الخلايا المبرمج وتم تحديد مجموعات الخلايا بدقة وتكرار في المراحل المبكرة والمتأخرة من موت الخلايا المبرمج. تتوافق هذه النتائج مع السمات المعروفة المؤيدة لموت الخلايا المبرمج للأكتينومايسين D في علاج السرطان لدى البشر37،39،40،41 وتدعم أيضا استخدام الأكتينومايسين D كعنصر تحكم إيجابي في تجارب زراعة الخلايا FC التي تبحث في موت الخلايا المبرمج.
تم إبلاغ بوابات مجموعات الخلايا في هذه الدراسة من خلال الضوابط السلبية للوسط والمذيبات ، والتي فصلت موت الخلايا المبرمج عن الخلايا السليمة. بدلا من ذلك ، يمكن أيضا استخدام مزيج من مجموعات الضوابط الإيجابية والسلبية لتحديد مجموعات الخلايا الحية وموت الخلايا المبرمج لتعيين بوابات سكان الخلايا 7,9. بمجرد تحديد الحالات الخلوية المريضة والصحية وبوابها ، يمكن تطبيق إعدادات القالب على جميع الثقافات التجريبية والضابطة اللاحقة.
الالتزام الصارم ببروتوكول FC ضروري لتجنب النتائج الخاطئة. أثناء تحسين البروتوكول ، لوحظت المشاكل التالية: (1) تركيز منخفض للخلايا ، (2) تركيز مرتفع للخلايا ، (3) تكتل الخلايا ، (4) تلطيخ طويل الأمد ، و (5) سوء معالجة العينات. يمكن منع هذه المشاكل من خلال الالتزام الصارم بمتطلبات البروتوكول المحسنة. وهذا يؤكد الطبيعة الحاسمة للخطوات ما قبل التحليلية والتحليلية لهيئة التيسير للحصول على بيانات دقيقة. أثناء تحضير الخلية ، يجب إجراء التربسين ، والامتصاص ، والطرد المركزي ، والتخفيفات بعناية. قد يؤدي الإفراط في التربسين والامتصاص القوي إلى القص الكيميائي والميكانيكي للخلايا ، على التوالي. قد يؤدي الطرد المركزي المطول وعالي السرعة إلى انهيار الخلايا وارتفاع عدد الحطام الخلوي. مطلوب تركيز الخلية الأمثل لتقليل الاستحواذ غير الصحيح لأحداث الخلية. لذلك ، يجب تخفيف معلقات الخلايا الأولية للحصول على التركيز الأمثل للخلايا.
علاوة على ذلك ، أثناء التعامل مع العينات ، يجب توخي الحذر لمنع تكتل الخلايا وتجزئتها وضمان بقاء الخلايا معلقة أثناء التحليل. تسمح معالجة العينات لمنع تكتل الخلايا بتدفق خلية رقائقية واحدة ، وتمنع الانسداد الميكانيكي للأنبوب الشعري للأداة ، وتحد من مؤشرات حجم الخلية الكبيرة الزائفة. تحذير آخر هو حماية الثقافات من الضوء لتجنب الأكسدة الضوئية وإخماد الفلوروفورات في المقايسات لمنع النتائج السلبية الكاذبة. يجب توخي الحذر لضمان الحد الأدنى من التعرض للضوء في خطوة تلطيخ الخلايا وخطوات المعالجة اللاحقة. علاوة على ذلك ، قد تؤدي أوقات التلوين المناعي المطولة إلى نتائج إيجابية كاذبة لأن البروتينات غير ملطخة على وجه التحديد. لذلك ، من المهم الالتزام بفترات تلطيخ الحضانة التي تحددها الشركة المصنعة.
باختصار ، يمكن ل FC اكتشاف موت الخلايا المبرمج بدقة والتمييز بين المؤشرات الحيوية المبكرة والمتأخرة لموت الخلايا المبرمج في زراعة الخلايا. بالإضافة إلى ذلك ، أدى التقدم في التكنولوجيا إلى تصنيع أجهزة قياس التدفق الخلوي الموضوعة على الطاولة للعلماء غير الخبراء لدراسة صحة الخلايا ومسارات الإشارات المعقدة داخل الخلايا.
قدمت شركة Luminex® رسوم معالجة المقالات.
تم دعم الدراسة ماليا من قبل المؤسسة الوطنية للبحوث (NRF) ومجلس البحوث الطبية في جنوب إفريقيا (SAMRC). نود أن نعرب عن تقديرنا لخدمة المختبرات الصحية الوطنية (NHLS) لشراء محلل خلايا الجوافة Muse. تم إنشاء جميع الأرقام في هذا المنشور مع Biorender.com.
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved