زرع RPE تحت الشبكية على حامل في الخنازير الصغيرة: إرشادات للاستعدادات قبل الجراحة والتقنيات الجراحية والرعاية بعد الجراحة
* These authors contributed equally
In This Article
Summary
يعد زرع ظهارة الشبكية المصطبغة تحت الشبكية (RPE) أحد أكثر الأساليب الواعدة لعلاج أمراض الشبكية التنكسية. ومع ذلك ، لا يزال أداء الدراسات قبل السريرية على النماذج الحيوانية ذات العين الكبيرة يمثل تحديا. يقدم هذا التقرير مبادئ توجيهية لزرع RPE تحت الشبكية على حامل خلية في خنازير صغيرة.
Abstract
تؤدي الاضطرابات التنكسية في شبكية العين (بما في ذلك التنكس البقعي المرتبط بالعمر) ، والتي تنشأ بشكل أساسي في أو داخل الطبقة الظهارية المصطبغة في شبكية العين (RPE) ، إلى عدم تنظيم تدريجي لتشريح الشبكية وتدهور الوظيفة البصرية. أظهر استبدال خلايا RPE التالفة (RPEs) بخلايا RPE المزروعة في المختبر باستخدام حامل خلية تحت الشبكية إمكانية إعادة إنشاء البنية التشريحية لطبقات الشبكية الخارجية ، وبالتالي ، يتم دراستها بشكل أكبر. هنا ، نقدم مبادئ تقنية جراحية تسمح بالزرع الفعال تحت الشبكية لحامل الخلايا مع RPEs المزروعة في الخنازير الصغيرة. تم إجراء العمليات الجراحية تحت التخدير العام وشملت استئصال الزجاجية المسطحة (PPV) القياسي مع الحفاظ على العدسة ، والتطبيق تحت الشبكية لمحلول ملح متوازن (BSS) ، وبضع الشبكية 2.7 مم ، وزرع حامل خلية ليفية نانوية في الفضاء تحت الشبكية من خلال بضع تصلب إضافي 3.0 مم ، وتبادل السوائل والهواء (FAX) ، وسدادة زيت السيليكون ، وإغلاق جميع عمليات التصلب. تم استخدام هذا النهج الجراحي في 29 عملية جراحية (18 حيوانا) على مدى السنوات ال 8 الماضية بنسبة نجاح 93.1٪. تم إجراء التحقق التشريحي للموضع الجراحي باستخدام تصوير قاع العين في الجسم الحي (تصوير قاع العين والتصوير المقطعي للتماسك البصري). يمكن استخدام الخطوات الجراحية الموصى بها لزرع RPEs تحت الشبكية على حامل في عيون الخنزير الصغير في الدراسات قبل السريرية المستقبلية باستخدام نماذج حيوانية كبيرة العين.
Introduction
يعتبر التنكس البقعي المرتبط بالعمر (AMD) السبب الرئيسي لفقدان الرؤية المركزية في البلدان المتقدمة وهو واحد من العديد من الحالات المتعلقة بخلل ظهارة الشبكية المصطبغة (RPE) 1,2. تم العثور على RPE على غشاء Bruch الموجود بشكل أساسي (BM) ويوفر الصيانة اللازمة للمستقبلات الضوئية. يعد الانحطاط التدريجي لطبقة RPE سمة مميزة للشكل الضموري المبكر ل AMD ، كما أنه يصاحب تطور الشكل النضحي المتأخر من AMD أيضا. على الرغم من العديد من التطورات في علاج أمراض الشبكية ، لا يزال تطوير طريقة علاج فعالة يمثل تحديا3. إحدى الطرق الواعدة هي استبدال RPE باستخدام طبقة RPE مستزرعة في المختبر. يرتبط هذا العلاج بالتقدم في أبحاث الخلايا الجذعية باستخدام RPE المشتق من الخلايا الجذعية الجنينية البشرية (hESC-RPE) و RPE المستحث المشتق من الخلايا الجذعية متعددة القدرات (iPSC-RPE)3،4،5،6،7. في السنوات الأخيرة ، ركزت العديد من مجموعات البحث على تطوير مناهج مختلفة لاستبدال RPE مع إثبات المفهوم المقبول في البداية8،9،10،11،12،13،14،15. عادة ما يتم تسليم خلايا RPE (RPEs) إلى الفضاء تحت الشبكية في شكل تعليق خلية ، أو ورقة خلية ذاتية الدعم ، أو طبقة أحادية الخلية مدعومة بناقل اصطناعي3،16،17،18،19،20،21. يعد حقن تعليق الخلية أسهل طريقة ، لكن الحالة المعرضة للخطر في BM يمكن أن تمنع في كثير من الأحيان ارتباط الخلايا المزروعة. يمكن أن يؤدي هذا إلى اتجاه apicobasal غير صحيح من RPEs والفشل في تشكيل طبقة أحادية22,23. الميزة الرئيسية للطريقتين الأخريين (أي ورقة خلية ذاتية الدعم وطبقة أحادية الخلية مدعومة بركيزة اصطناعية) هي أن الخلايا بالفعل في حالة أحادية الطبقة متباينة عند زرعها مباشرة في الفضاء تحت الشبكية24.
تم نشر العديد من التقنيات الجراحية التي تصف توصيل حاملات الخلايا إلى الفضاء تحت الشبكية في السنوات الأخيرة8،9،10،11،12،13،14،15. وصفت هذه الدراسات استخدام النماذج الحيوانية ذات العين الكبيرة ، وأنواع الناقلات الخلوية ، واستخدام الثقافات الخلوية المزروعة ، وأدوات الزرع ، وكذلك التقنيات الجراحية ، وركز المؤلفون بشكل أساسي على نتائج زرع تحت الشبكية. في عام 2015 ، أبلغ Popelka et al. عن استخدام غشاء بوليمر فائق النحافة مدعوم بالإطار لزرع RPEs في عيون جثة الخنازير8. سمحت التقنية الجراحية الموصوفة هنا مع زرع الشبكية تحت الشبكية لحامل الخلايا بمعالجة دقيقة نسبيا للناقل ووضع سهل للسقالة في الفضاء تحت الشبكية. قام كوزاك وآخرون بتقييم جدوى تقنية التسليم لناقل بحجم تقريبي يبلغ 2 مم × 5 مم في عيون الخنازير9. سمح التصميم الفريد لحامل الخلية بوضعه الصحيح ، مما منع الطبقة الأحادية الخلوية من الطي والتجاعيد6. قدم النوايصة وآخرون أولا إرشادات مفصلة خطوة بخطوة لزراعة سقالة تحت الشبكية في الأرانب25. ثم نشر Stanzel et al. بروتوكولا مشابها في عام 2019 للزرع في القوارض الصغيرة والأرانب والخنازير والرئيسيات غير البشرية26. وكما نشر سابقا، أدى زرع طبقة أحادية متمايزة ومستقطبة من قواعد الحماية الحثيثة على حامل صلب إلى تحسين البقاء على قيد الحياة وتحسين تكامل الكسب غير المشروع مقارنة بتقنيات الإيصال الأخرى (الملف التكميلي 1)27.
الغرض من أي دراسات على الحيوانات قبل السريرية يتم إجراؤها في الجسم الحي هو الكشف عن الجوانب المختلفة للزرع الجراحي تحت الشبكية عبر الجسم الزجاجي لحامل الخلايا مع التركيز على سلامة الإجراء ، وبقاء الخلايا المزروعة ، واستجابة الأنسجة للمناورات تحت الشبكية ، ونتائج ما بعد الجراحة على المدى القصير والطويل. تم الإبلاغ عن استخدام عيون الخنازير كنموذج حيواني للعين الكبيرة ليكون ذا صلة من حيث نطاق البيانات التي تم الحصول عليها ، والتي يمكن أن تكون مفيدة ويحتمل أن تنطبق على البشر10،11،14. تشير دراستنا إلى التقنية الجراحية المستخدمة في زرع تحت الشبكية في الجسم الحي لحامل خلية في نموذج حيواني كبير العين. نقدم وصفا مفصلا للاستعدادات قبل الجراحة ، والتقنية الجراحية لزرع حامل الخلايا تحت الشبكية ، والرعاية بعد العملية الجراحية لعيون minipig بناء على تجربتنا على مدى السنوات ال 8 الماضية. وصفنا المبادئ الجراحية الأساسية التي يمكن استخدامها في الدراسات التجريبية في الجسم الحي التي تنطوي على زرع أنواع مختلفة من الخلايا وناقلات الخلايا.
نموذج حيواني كبير
تأسس القطيع التجريبي للخنازير الصغيرة Liběchov من خلال استيراد خمسة من سلالة Hormel من الولايات المتحدة الأمريكية في عام 1967. تم تهجين هذه الحيوانات لدراسات فصيلة دم الخنازير مع العديد من السلالات أو السلالات الأخرى: Landrace ، الأبيض الكبير ، كورنوال ، الخنازير الفيتنامية ، والخنازير المصغرة من أصل غوتنغن28,29. في عمر 5 أشهر وحوالي 20 كجم من وزن الجسم (BW) ، تصل الخنازير الصغيرة إلى مرحلة النضج الجنسي. تم الإبلاغ عن بقاء سلالات الخنازير الصغيرة الأبوية (Hormel و Göttingen) من 12 إلى 20 عاما. يستهدف زرع تحت الشبكية لحامل الخلية الجزء المركزي من الشبكية. شبكية العين من الخنازير الصغيرة تفتقر إلى البقعة والنقرة. ومع ذلك ، فإنه يحتوي على مناطق من المستقبلات الضوئية المخروطية عالية التركيز تسمى المنطقة المركزية والخطوط البصرية30,31. هذه المناطق هي المسؤولة عن أعلى حدة البصر.
تم إجراء العمليات الجراحية من قبل أربعة جراحين ذوي خبرة في الشبكية والجسم الزجاجي بمساعدة مساعد مرفق جراحي متمرس (TA). قبل التجارب في الجسم الحي ، تم تعليم الجراحين وحصلوا على معرفة خاصة بتشريح عين الخنزير الصغير ، مثل ما يتعلق بانخفاض نسبة العدسة إلى الحجم الزجاجي ، والطول المحوري الأقصر (15-19 مم) ، وغياب غشاء بومان في القرنية ، والحجم الزجاجي الأصغر (2.8-3.2 مل) ، وغياب البقعة والنقرة ، غياب حلقة الزنك، وقطر القرص البصري (رأسي/أفقي: 1.5 مم/2.1 مم). في جميع الحالات ، تم إجراء الجراحة تحت التخدير العام في غرفة عمليات منظمة خصيصا مع تنفيذ تدابير معقمة ومطهرة قياسية.
Protocol
تلتزم هذه الدراسة بمبادئ المبادئ التوجيهية لإعلان هلسنكي والمبادئ الأخلاقية للبحوث الطبية التي تشمل البشر. أجريت جميع التجارب وفقا للمبادئ التوجيهية لرعاية واستخدام المختبر ووفقا لجمعية البحوث في الرؤية وطب العيون (ARVO) لاستخدام الحيوانات في أبحاث العيون والبصرية. تمت الموافقة على بروتوكول الدراسة من قبل اللجنة المهنية للمنتجع التابعة ل CAS للموافقة على مشاريع التجارب على الحيوانات في معهد فسيولوجيا الحيوان وعلم الوراثة التابع لأكاديمية العلوم التشيكية (Liběchov ، جمهورية التشيك) (البروتوكول المعتمد رقم 60/2016 ورقم 64/2019).
1. اعتبارات أثناء زرع الخلايا تحت الشبكية للخلايا على الناقل إلى الخنازير الصغيرة
- اختيار الحيوان
- الحصول على واستخدام الخنازير الصغيرة Liběchov التي تتراوح أعمارها بين 12 و 36 شهرا ، سواء من الجنسين ، وحوالي 40-80 كجم من وزن الجسم (BW).
- احتفظ بالخنازير الصغيرة في الداخل في بيت مكيف مع درجات حرارة تتراوح بين 18-22 درجة مئوية ، والتعرض لدورة ضوء / ظلام اصطناعية لمدة 13 ساعة / 11 ساعة ، وأقلام فردية موحدة ، وحرية الوصول إلى الماء ، والتغذية مرتين يوميا.
- التحضير قبل الجراحة
- تحقق من الاتجاه الجراحي للعين وارسم مخططات قاع العين. للقيام بذلك ، قم بتقسيم شبكية العين بشكل تخطيطي للخنازير الصغيرة على قاع العين باستخدام قلم بخط عمودي في الصدغي (من القرص البصري باتجاه الأذن) ، والأنف (من القرص البصري باتجاه خطم الخنزير) ، والمناطق المركزية (بين الأوعية الشبكية الرئيسية على الجانب الأنفي) (الشكل 1 أ ، ب).
- اختر فقط الحيوانات السليمة دون أي أمراض سلوكية وعصبية وذات جودة طبيعية للجلد وفتحات الجسم والبراز واستهلاك الطعام. اطلب من طبيب بيطري ماهر إجراء الملاحظة السريرية واختيار الحيوانات.
- يتم حقن 3 ملغ/كغ من هيدروكلوريد سيفتيوفور (1 مل/كغ) في يوم الجراحة.
- كبت المناعة قبل الجراحة
- تحضير الكريات المجهرية البوليمرية المحملة بالتاكروليموس كما هو موضح في Wang et al. و Sevc et al. 32,33 مع التعديل.
- تأكد من أن تركيز تاكروليموس في الكريات المجهرية البوليمرية هو 51.3 مجم / جم كما هو محدد بواسطة HPLC (جدول المواد).
- إجراء حقن تحت الجلد من الكريات المجهرية البوليمرية المحملة بالتاكروليموس بجرعة 0.25 ملغم/كغ من وزن الجسم قبل 6 أيام من جراحة العين لإعاقة رفض الطعم الخلوي. يتم ذلك لضمان بقاء الخلايا المانحة البشرية RPE أثناء الزرع الجيني في عيون الخنزير الصغير.
- حقن الحيوانات في العضل في يوم الجراحة مع 80 ملغ من ديبو ميدرول والبنزيل بنسلين في 1 مل / 10 كجم وفقا لوزن الجسم.
- تخدير
- تحفيز التخدير العام بالحقن العضلي لمزيج من التيلتامين (2 مجم / كجم) ، زولازيبام (2 مجم / كجم) ، الكيتامين (2 مجم / كجم) ، والزيلازين (0.4 مجم / كجم) -TKX34,35 قبل الجراحة. تحقق من عمق التخدير من خلال حالة من فقدان الوعي وعن طريق فحص منعكس الدواسة (قرصة من الجلد بين الأصابع في الساق الخلفية) ، ومنعكس القرنية (لمسة خفيفة من القرنية) ، ومنعكس الحدقة (رد فعل على الضوء) ، ومنعكس الجفن (لمسة على الجفن). تأكد من أن الحيوان لا يومض. تأكيد انتظام معدل القلب والتنفس.
- بعد تحريض التخدير ، انقل الحيوان المخدر إلى غرفة العمليات على عربة الرفع (الشكل 2 أ).
- ضع الحيوان على طاولة العمليات على جانبه الأيسر لتمكين الجراحة في العين اليمنى (الشكل 2 ب).
- قم بإجراء تعديل رأس الحيوان باستخدام وسادات الستايروفوم لتحقيق أنسب موضع للشبكية المركزية للزرع (أي أفقيا وموازيا للأرضية) (الشكل 2 ج).
- ضع قطرات العين من محلول بروباراكايين هيدروكلوريد للعيون 0.5٪ في كيس الملتحمة ثلاث مرات على بعد 1 دقيقة للحث على التخدير الموضعي.
- أدخل قنية الوريد وقم بتنبيب الحيوان بأنبوب القصبة الهوائية لاستنشاق صيانة التخدير (1.5٪ إيزوفلوران) باستخدام آلة تخدير مجهزة بجهاز مراقبة المريض (الشكل 2 أ ، ب).
- تطبيق الحقن العضلي 1 مل من إيفيكور لكل 16 كغ من وزن الجسم و20 ملغ من ديبو ميدرول 1 قبل 15 دقيقة تقريبا من بداية جراحة العيون (جدول المواد).
- الحفاظ على درجة حرارة الجسم الفسيولوجية من خلال تغطية الحيوان برقائق متساوية الحرارة وإجراء الجراحة كما هو موضح في القسم 3.
- أثناء الجراحة ، راقب درجة حرارة الحيوان جنبا إلى جنب مع معدل ضربات القلب وتشبع الأكسجين في الدم باستخدام مشبك الأذن ومراقبة المريض. تجنب خفض درجة حرارة الجسم إلى أقل من 38 درجة مئوية أثناء الإجراءات التي تعتبر حد آمن36. حافظ على تشبع الأكسجين (>96٪) ومعدل النبض (70-90 نبضة في الدقيقة) خلال التجربة بأكملها.
- عند اكتمال الجراحة ، قم بإيقاف تدفق الأيزوفلوران ونزع أنبوب الحيوان.
- بعد التنفس التلقائي والاستيقاظ ، انقل الحيوانات إلى أقلامهم.
- إعداد غرفة العمليات
- رتب غرفة العمليات وفقا لاحتياجات الجراحة على عيون النموذج الحيواني ذو العين الكبيرة (الشكل 3 أ ، ب). ضبط ارتفاع كراسي الجراح ، وكذلك ارتفاع المجهر ، لتحقيق وضع مريح للجراحين فيما يتعلق بموضع خطم الخنزير.
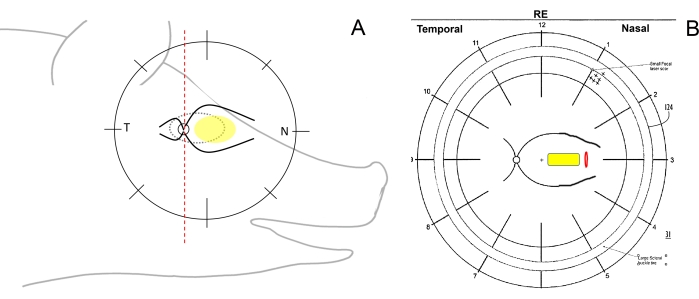
الشكل 1: رسم تخطيطي لمناطق الشبكية في الخنازير الصغيرة. (أ) رسم تخطيطي لمناطق الشبكية بالنسبة لرأس الخنزير الصغير؛ يصور القطع الناقص الأصفر المنطقة المرغوبة من زرع تحت الشبكية ، ويشير T إلى منطقة الشبكية الصدغية ، ويشير N إلى منطقة الشبكية الأنفية. (ب) مثال على مخطط قاع العين بعد زرع حامل الخلية تحت الشبكية (الأصفر) من خلال بضع الشبكية (أحمر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
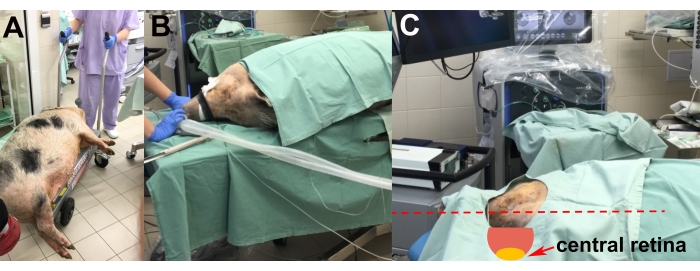
الشكل 2: نقل الحيوان ووضعه . (أ) نقل الحيوان المخدر إلى غرفة العمليات. ب: وضع الحيوان أثناء التنبيب. (ج) تعديل رأس الحيوان للوصول الأمثل إلى الشبكية المركزية أثناء الجراحة (السهم الأحمر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
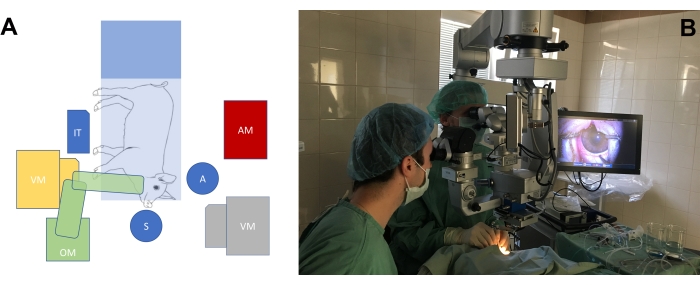
الشكل 3: إعداد غرفة العمليات القياسي. (أ) تصوير تخطيطي لموضع الجراحين (S = جراح ، A = مساعد) فيما يتعلق بموضع طاولة العمليات مع minipig ، مجهر التشغيل (OM) ، آلة استئصال الزجاجية (VM) ، طاولة الأدوات (IT) ، وآلة التخدير (AM). هناك وضعان محتملان لآلة استئصال الزجاجية (الأصفر والرمادي). (ب) إعداد واقعي في غرفة العمليات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. حامل الخلية ، مزارع الخلايا المزروعة ، وحاقن الزرع
- الناقل الخلوي
- قم بقص الإطار البيضاوي بعرض 30 ميكرومتر بأبعاد خارجية تبلغ 1.7 مم × 4.8 مم ، ومجهز بنتوءات مثلثة الشكل تقع بشكل غير متماثل على الإطار (الشكل 4 أ) ، من رقائق بولي إيثيلين تيريفثاليت (PET) ثنائية المحور بسمك 36 ميكرومتر باستخدام ليزر الفيمتو ثانية.
- تحضير محلول بوليمر بولي (L-lactide-co-DL-lactide) (LLA / DLLA 90/10 ، MW 868 ، 270 جم / مول) في البيريدين بتركيز 11٪ بالوزن مع إضافة 2.2 ميكرولتر من حمض الفورميك لكل 1 جم من المحلول.
- قم بإعداد الغشاء الليفي النانوي بإطار داعم مضمن (الشكل 4 ب) عن طريق الغزل الكهربائي لمحلول البوليمر في ثلاث خطوات8: (1) إيداع الطبقة الأولى من الألياف النانوية على ركيزة السيليكون ، (2) ضع الإطار على الطبقة ، و (3) إيداع الطبقة الثانية من الألياف النانوية.
ملاحظة: قم بإيداع كل طبقة لمدة 7 دقائق للوصول إلى سمك غشاء إجمالي يبلغ 3.7 ميكرومتر. استخدم المعلمات التالية للحصول على غشاء يتكون من ألياف بسمك 380 نانومتر وبمتوسط حجم مسام 0.4 ميكرومتر ومسامية حوالي 70٪ 37: إبرة فولاذية بالكامل 20 جم ، جهد 7.1 كيلو فولت ، فجوة 10 سم ، معدل تدفق 250 ميكرولتر / دقيقة ، ودرجة حرارة 25.0 درجة مئوية ± 0.5 درجة مئوية. - قم بإزالة الغشاء بعناية مع الإطار المضمن من ركيزة السيليكون وتثبيته على جسم 12 بئرا تجاريا لإدراج خلية خالية من الغشاء الأصلي لتسهيل بذر الخلايا ونموها.
- عالج الغشاء الليفي النانوي قبل بذر الخلايا في بلازما الهواء لمدة 30 ثانية بقوة 70 واط في منظف البلازما.
- مزارع الخلايا المستخدمة للزراعة على حامل الخلية
ملاحظة: يمكن استخدام حاملات الخلايا التالية: 1) حاملات الخلايا الليفية النانوية بدون أي خلايا. 2) حاملات الخلايا الليفية النانوية مع RPEs البشرية الأولية (hRPEs) ؛ 3) حاملات الخلايا الليفية النانوية مع خلايا RPE البشرية المشتقة من iPSC.- زراعة hRPEs الأولية
- اعزل خلايا hRPE الأولية عن عيون المتبرعين البشريين وفقا لتقنية تم الإبلاغ عنها مسبقا38.
- الحصول على الخلايا عن طريق العلاج الأنزيمي للشبكية لمدة 30 دقيقة. بعد ذلك ، قم بزراعة خلايا hRPE الأولية (المقطع 0) لمدة تصل إلى أسبوعين في DMEM / F12 المكمل بمصل بقري جنيني بنسبة 10٪ (FBS).
- بمجرد وصول مزارع الخلايا إلى نقطة التقاء ، قم بتغيير الوسيط إلى 1٪ FBS والثقافة لمدة 30 يوما إضافية.
- قم بزرع hRPEs الأولية على ألواح عبر الآبار وعلى حامل خلايا ليفية نانوية مغلفة باللامينين بكثافة 2000 خلية / مم2. بعد 30 يوما أخرى من الحضانة في 1٪ FBS ، استخدم حاملات الخلايا مع hRPEs الأولية لزرع تحت الشبكية في الخنازير الصغيرة.
- RPEs البشرية المشتقة من iPSC
- استخدم hiPSCs المشتقة من الخلايا الليفية المشتقة من المريض المرتبطة بالتهاب الشبكية الصباغيMERTK 39 والتي يتم تصحيحها جينيا في أليلين باستخدام نظام CRISPR / Cas9 (RP1-FiPS4F1-GC2)40 ، بالإضافة إلى hiPSCs المشتقة من الخلايا الليفية لموضوع سليم (Ctrl2-FiPS5F2)41 التي تستخدم كعنصر تحكم.
- قم بإنشاء خطوط خلايا hiPSCs وتمييزها لاحقا نحو خلايا RPE (hiPSC-RPE) كما ورد سابقا42.
- قم بطلاء hiPSC-RPEs عند 200000 خلية / سم2 على إدخالات زراعة الخلايا المغلفة باللامينين مع أغشية ليفية نانوية من poly (L-lactide-co-DL-lactide) مع إطارات زرع بيضاوية في وسط RPE يحتوي على DMEM بالضربة القاضية ، مصل خروج المغلوب 20٪ ، 0.1 mM أحماض أمينية غير أساسية ، 0.23 mM β-mercaptoethanol ، 100 U / mL البنسلين ، 0.1 مجم / مل ستربتومايسين ، و 10 mM نيكوتيناميد.
- تغيير الوسط كل يوم ، وثقافة hiPSC-RPE لمدة 2 أشهر قبل الزرع لتشجيع النمو المستقطب.
- حاقن الزرع
- قم بإعداد شعرية بلاستيكية ذات مقطع عرضي مستطيل 2.8 مم × 0.8 مم عن طريق النفخ من أنبوب بلاستيكي OD 1.75 مم / معرف 1.10 مم.
- قطع نافذة تحميل 4 مم × 2.2 مم في الشعيرات الدموية البلاستيكية 6 مم من النهاية.
- قم بتجميع الحاقن من الشعيرات الدموية البلاستيكية ، ومقبض السيليكون ، ومكبس الشفرة الفولاذية ، والمكبس (الشكل 5 أ).
- قم بتحميل الناقل في الحاقن من خلال نافذة تحميل ثم أخرجه لاحقا في الفضاء تحت الشبكية عن طريق دفع المكبس ، كما هو موضح في الخطوة 3.5.2 (الشكل 5B).
- تحضير الناقل الليفي النانوي وتحميل الحاقن
- املأ طبق بتري بلاستيكي صغير ب 2 مل من محلول ملحي مخزن بالفوسفات (PBS). أخرج ملحقا بطبقة الخلية المحضرة ، وضعه على طبق بوليسترين شبه ناعم ، وقم بتوسيطه تحت المجهر الضوئي. استخدم لكمة معدلة خصيصا لقطع الحامل على طول الإطار البيضاوي باستخدام المجهر. يجب أن تكون أبعاد الناقل 2 مم × 5 مم.
- استخدام حاقن حسب الطلب مع أنابيب شفافة مسطحة لتحميل الناقل ؛ 6 مم من الطرف البعيد للشعيرات الدموية ، هناك نافذة لتحميل الناقل. املأ نافذة الحاقن ببرنامج تلفزيوني.
- باستخدام الملقط ، حرر العينة من أسفل الطبق ، وارفعها من السائل ، وانقلها إلى نافذة الحاقن أثناء التحقق من علامات الاتجاه الجانبية على الإطار أولا لاكتشاف الجانب العلوي من الناقل بخلايا ملتصقة. إطار بيضاوي يسهل التلاعب مع الناقل.
- باستخدام مسبار الأسنان (أداة طب الأسنان المصنوعة من الفولاذ المقاوم للصدأ ذات النهاية الحادة) ، ضع الناقل في نافذة الحاقن. استخدم المكبس لدفع الناقل إلى الجزء العلوي المغلق والآمن من الحاقن. ثم قم بإعداد الناقل للجراحة.
- تحقق من الاتجاه الجانبي للناقل في كل خطوة. قم بتفريغ الناقل الليفي النانوي من الحاقن عن طريق دفع المكبس المعدني.

الشكل 4: حامل ليفي نانوي مع إطار PET داعم مضمن. (أ) ثلاث علامات مرئية على الإطار تسمح بالتحكم في الاتجاه الجانبي للحامل (الأسهم البيضاء). (ب) عرض تكبير لجزء إطار PET المضمن في الغشاء الليفي النانوي (الأسهم البيضاء) لحامل الخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: حاقن الانغراس. أ: أجزاء الحاقن. (ب) حامل الخلايا الليفية النانوية مع إطار PET داعم مدمج محمل بالشعيرات الدموية البلاستيكية المستطيلة لحاقن الزرع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. الإجراء الجراحي
- المعدات الجراحية
- استخدم المعدات الجراحية التالية: مجهر جراحي للعيون ، ونظام تشغيل للعمليات الجراحية على أجزاء العين الأمامية والخلفية ، ونظام جراحي للشبكية والجسم الزجاجي غير الملامس ، وجهاز التخثير الضوئي بالليزر ، وكاميرا رقمية.
ملاحظة: يوضح الجدول 1 المعلمات القياسية المستخدمة في استئصال الزجاجية ، والكي الخارجي والداخلي ، ومعدات التخثير الضوئي بالليزر.
- استخدم المعدات الجراحية التالية: مجهر جراحي للعيون ، ونظام تشغيل للعمليات الجراحية على أجزاء العين الأمامية والخلفية ، ونظام جراحي للشبكية والجسم الزجاجي غير الملامس ، وجهاز التخثير الضوئي بالليزر ، وكاميرا رقمية.
- الأدوات الجراحية
- تعقيم الأدوات الجراحية القابلة لإعادة الاستخدام باستخدام معقم بخار الأوتوكلاف المتنقل أو ما شابه ذلك وفقا لبروتوكول قياسي. يتم سرد الأدوات والمواد الجراحية ذات الاستخدام الواحد المطلوبة أثناء الجراحة في جدول المواد.
- التحضير للخطوات الجراحية
- بعد تخدير الحيوان كما هو موضح في الخطوة 1.4.1 ، ضع قطرات العين بمحلول تروبيكاميد 1٪ ومحلول فينيليفرين هيدروكلوريد 10٪ في كيس الملتحمة قبل 15 دقيقة من الإجراء لإثارة توسع حدقة العين الناجم عن المخدرات.
- اقترب من طاولة العمليات مع الجراح في الموضع العلوي والمساعد في الوضع الجانبي (الشكل 3).
- احلقي المنطقة المحيطة بالعين باستخدام ماكينة حلاقة تستخدم لمرة واحدة وأزيلي الأوساخ الخشنة.
- تطهير كيس الملتحمة بمحلول 5 ٪ بوفيدون اليود لمدة 5 دقائق.
- تطهير المنطقة المحيطة بالحجاج بمسحات القطن عن طريق التنظيف من الجفون إلى المحيط. كرر العملية ثلاث مرات باستخدام محلول بوفيدون اليود 10٪ واتركه لمدة 5 دقائق.
- قم بتغطية مجال التشغيل بالعين في المنتصف باستخدام ثنى عيني معقم قياسي بورق شفاف لزج. حرك الرموش بعيدا عن كرة العين. تجنب قص الرموش لتقليل خطر التهاب باطن المقلة بعد العملية الجراحية.
- أدخل منظار الغطاء (منظار ليبرمان أو منظار عين كوك). اختياريا ، قم بتثبيت الغشاء النيكتيتي على الجلد باستخدام 8-0 خياطة بوليجلاكتين.
- افتح الملتحمة على الجانب الأنفي من 2 مم إلى 3 مم من الحافة من أجل كشف الصلبة لاستئصال التصلب باستخدام ملقط جراحي ومقص الملتحمة ويستكوت.
- أدخل المبازل 25 G ثلاثي الصمامات 2.5-3 مم من الحافة في منطقة pars plana (ضعها في الساعة 7 والساعة 10 والساعة 11). استخدم الحركات الدوارة أثناء الإدخال بطريقة مائلة قليلا (100 درجة -110 درجة) باتجاه الشبكية الخلفية وأمسك المبزل بالملقط (الشكل 6).
- حافظ على القرنية مبللة أو قم بتغطيتها بميثيل سلولوز أثناء الجراحة بأكملها لمنع وذمة القرنية التناضحية.
- بارس بلانا استئصال الزجاجية (PPV)
- قم بإزالة الجزء الأوسط من الجسم الزجاجي باستخدام نهج استئصال الزجاجية القياسي ثلاثي المنافذ. قم بإزالة الجسم الزجاجي خلف العدسة بعناية في منطقة بضع التصلب الكبير في المستقبل.
- استخدم 2-4 ملغ داخل الجسم الزجاجي من حقن تريامسينولون أسيتونيد (TA) (50-100 ميكرولتر) لتلطيخ الجسم الزجاجي الخلفي ، والذي يظل عادة ملتصقا بالشبكية ، من أجل إجراء انفصال زجاجي خلفي متحكم فيه.
- بعد ذلك ، قم بإجراء حقن تحت الشبكية ببطء من 0.05-0.1 مل من BSS مع قنية 41 G بشكل أكثر مركزية ، وتجنب تكوين فقاعة باتجاه المحيط.
- تقليل إعدادات ضغط العين مع نظام الري وصولا إلى 15 مم زئبق أثناء الحقن تحت الشبكية من أجل منع انسداد الأوعية الدموية الشبكية العابرة.
- قم بإجراء الإنفاذ الحراري الداخلي الخطي الكبير للشبكية باستخدام مسبار الإنفاذ الحراري الداخلي 27 G 3 مم بالقرب من قاعدة فقاعة الأنف.
- بعد ذلك ، قم بعمل بضع شبكية كبير 3 مم بشفرة 25 G MVR أو مقص عمودي مع إعداد ضغط العين المرتفع (IOP) لنظام الري حتى 60 مم زئبق لمدة 3 دقائق إلى 5 دقائق. تأكد من عدم وجود نزيف من بضع الشبكية ، ثم قم بتقليل IOP إلى 25 مم زئبق.
- قم بإجراء الإنفاذ الحراري الخارجي للأوعية فوق الصلبة بين المبازل الأنفي 2.5-3 مم من الحافة باستخدام مسبار 27 G endodiathermy عن طريق تطبيق لمسة لطيفة على سطح الصلبة.
- تحقق من مستوى السائل في زجاجة التسريب قبل توسيع بضع التصلب ، كما هو الحال بعد تكبير بضع التصلب ، يكون استهلاك السوائل مرتفعا مؤقتا.
- قم بعمل بضع تصلب كبير 3.0 مم ، 3 مم من الحافة ، باستخدام سكين فاكو 2.75 مم.
- انتبه إلى النزيف المحتمل من الأوعية الصلبة والجسم الهدبي داخل بضع التصلب الكبير. في حالة النزيف ، استخدم مسبار الإنفاذ الحراري الداخلي 27 جيجا لتخثر الأوعية التالفة. قم بتكبير بضع التصلب إلى 3.0 مم بسكين ساتان لاستيعاب طرف الحاقن (0.8 مم × 2.8 مم).
- إزالة الجسم الزجاجي المتدلي على موقع بضع التصلب الكبير مع vitrector. الحفاظ على ضخ BSS عند مستوى 25-30 مم زئبق مع نظام استئصال الزجاجية لتجنب انهيار الكرة الأرضية.
- زرع حامل الخلية
- أدخل الحاقن برفق باليد المهيمنة في التجويف الزجاجي من خلال بضع التصلب الكبير. في حالة المقاومة ، قم بتكبير حجم بضع التصلب.
- زرع حامل الخلية من خلال بضع الشبكية في الفضاء تحت الشبكية. إذا لزم الأمر ، استخدم تقنية bimanual مع بضع صلب إضافي وضوء الثريا من أجل تحسين التحكم في الزرع.
- سحب الحاقن من العين وإغلاق بضع الصلبة الكبير مع 8-0 خياطة Polyglactin لتجنب المضاعفات المرتبطة بنقص التوتر داخل العين.
- إجراء تبادل كامل للسائل والهواء (FAX) وتصريف السائل تحت الشبكية باستخدام قنية ذات رأس سيليكون.
- بعد ذلك ، قم بحقن زيت السيليكون (1000 cSt) في التجويف الزجاجي باستخدام نظام استئصال الزجاجية ونظام الأنابيب لحقن زيت السيليكون حتى يصبح IOP طبيعيا.
- التصوير والتوثيق أثناء العملية
- قم بإجراء تسجيل فيديو أثناء الجراحة بأكملها مع توثيق الصور للخطوات الرئيسية للزرع باستخدام نظام تسجيل الفيديو.
- أكمل رسم قاع العين من خلال توثيق موقع عمليات استئصال التصلب ، وبضع الشبكية ، وزرع تحت الشبكية ، وأي مضاعفات حدثت باستخدام مخططات رسم قاع العين.
- خطوات ما بعد الجراحة
- في نهاية الجراحة ، قم بإزالة المبازل وأغلق عمليات التصلب الثلاثة والملتحمة بنتيجة 8-0 خيوط بوليجلاكتين.
- شطف كيس الملتحمة بمحلول 5 ٪ بوفيدون اليود.
- إجراء 0.3 مل حقن تحت الملتحمة من 20 ملغ من الجنتاميسين ، 2 ملغ من ديكساميثازون ، و 2 ٪ زيلوكائين.
- تحقق من حالة قاع العين والعدسة باستخدام منظر مجهري.
- قم بإزالة الغرز (الغرائز) من الغشاء باستخدام ملقط جراحي ومقص الملتحمة Westcott (اختياري).
- تطبيق مرهم نيومايسين أو مرهم أوفلوكساسين للعيون في كيس الملتحمة.
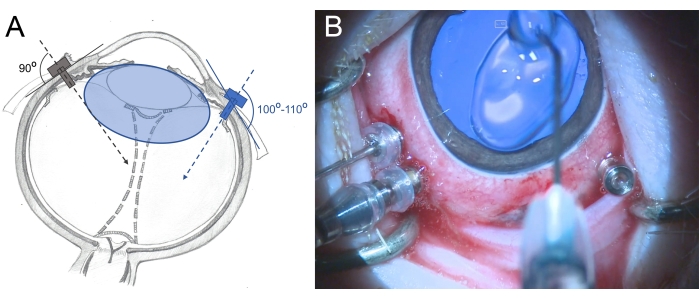
الشكل 6: إدخال المبازل في عين خنزير صغير . (أ) تصوير تخطيطي للمبازل، التي يتم إدخالها بشكل عمودي في الصلبة باتجاه مركز التجويف الزجاجي في العين البشرية (اللون الرمادي) وبطريقة مائلة نحو الشبكية الخلفية في عين الخنزير الصغير (اللون الأزرق) لتجنب تلف العدسة. عدسة minipig (اللون الأزرق) أكبر من تلك الموجودة في البشر ونسبة إلى حجم التجويف الزجاجي. (ب) عرض أثناء العملية للمبازل المدرج في PPV ثلاثي المنافذ. القرنية مغطاة بميثيل سلولوز لمنع الجفاف والتورم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. رعاية ما بعد الجراحة
- ضع الباسيتراسين الموضعي الزنك / أسيتات الهيدروكورتيزون / كبريتات النيومايسين أو 0.3٪ أوفلوكساسين في كيس الملتحمة للحيوانات خمس مرات في اليوم.
- بعد الجراحة ، تحقق من معلمات العين التالية: تورم الأنسجة الرخوة للعين باستخدام الجس ، رد الفعل الالتهابي على سطح العين ، والتحديق كرد فعل وقائي للجفون باستخدام مصباح شق محمول باليد أو منظار العين غير المباشر.
- للرعاية الجهازية بعد العملية الجراحية ، استخدم المضادات الحيوية التالية:
- يتم حقن سيفتيوفور هيدروكلوريد العضلي بجرعة 3 مغ/كغ من وزن الجسم (1 مل/كغ) في اليومين الثاني والثالث من الاستقرار.
- حقن تولاثروميسين (1 مل / 40 كجم من وزن الجسم) بعد 72 ساعة بعد الجراحة للوقاية من العدوى البكتيرية الثانوية.
- إجراء الحقن العضلي للفلونيكسين (2 مل / 45 كجم من الوزن الحي) وترامادول هيدروكلوريد (100 مجم) كل 24 ساعة لمدة 3 أيام بعد الجراحة لمنع الألم.
- احتفظ بالخنازير الصغيرة في منشأة متخصصة مكيفة الهواء مع درجة حرارة تتراوح من 18-22 درجة مئوية ونظام اصطناعي 13 ساعة / 11 ساعة ضوء / ظلام.
- تأكد من حصولهم مجانا على المياه والتغذية القياسية (مرتين في اليوم).
5. إجراءات ما بعد الجراحة
- فحوصات العيون بعد العملية الجراحية
- في فترة ما بعد الجراحة ، افحص العينين باستخدام منظار العين غير المباشر لوجود التهاب (أي احمرار أو تورم الأنسجة أو احتقان المخاط في كيس الملتحمة). قياس ضغط العين في العين التي يتم تشغيلها باستخدام طريقة الجس.
- التصوير بعد العملية الجراحية
- تحفيز التخدير في الخنزير الصغير عن طريق الحقن العضلي لخليط TKX قبل تصوير قاع العين وفحص OCT. غرس 1 ٪ تروبيكاميد و 10 ٪ فينيليفرين هيدروكلوريد قطرات العين في كيس الملتحمة من minipig من أجل إحداث توسع حدقة العين.
- استخدم منظار الجفن للحفاظ على عيون مفتوحة. لترطيب سطح العين والحصول على صورة OCT واضحة ، اغسل قرنية الحيوان بمحلول ملحي (0.9٪ كلوريد الصوديوم) كل 30-60 ثانية.
- ضع الخنزير الصغير على طاولة العمليات بنفس الطريقة التي تم بها أثناء العملية (الشكل 2B ، C ، الشكل 3A). الشرط الرئيسي هو وضع الرأس على الجانب وعموديا على قطعة المسح الضوئي لجهاز OCT. استخدم وسادات الستايروفوم تحت خطم الحيوان لتثبيت الرأس ، مما يجعل سطح العين في وضع أفقي.
- اجمع صور قاع العين الملونة باستخدام كاميرا قاع العين الملونة غير الحدقة ، حيث يسمح ذلك بتوثيق الجزء الأمامي والشبكية والقرص البصري. بالإضافة إلى ذلك ، التقط صورة خالية من اللون الأحمر لشبكية العين باستخدام كاميرا قاع العين غير الحدقة العينية.
- إجراء التصوير المقطعي للتماسك البصري باستخدام نظام OCT للمجال الطيفي. أثناء التصوير المقطعي المحوسب أو تصوير قاع العين ، قم بإمالة رأس الخنزير الصغير يدويا نحو عدسات OCT أو عدسات كاميرا قاع العين لتحسين رؤية الشبكية الخلفية ومنطقة الزرع (الشكل 2C). للحصول على التصوير الأمثل للحامل المزروع على قاع العين ، قم بتطبيق ضوء انعكاس الأشعة تحت الحمراء لجهاز OCT للتركيز على الغرسة (الشكل 2C). استخدم أوضاع مسح الخطوط المتقاطعة OCT وخريطة شبكية العين.
- تطبيق مرهم العيون ofloxacin في نهاية الفحص تحت غطاء عين الحيوان.
- انقل الخنزير الصغير إلى المنشأة الداخلية وراقب حالته العامة حتى نهاية التخدير (حوالي 2 ساعة إلى 5 ساعات).
6. استئصال العين بعد الوفاة بعد القتل الرحيم
- قم بتخدير الخنازير الصغيرة بالحقن العضلي لخليط TKX متبوعا ببلعة في الوريد (من خلال قنية أذن 22-G) بنسبة 1٪ بروبوفول (20 مل /) متبوعا بالاستنزاف. لا تستخدم المثبتات العامة.
- التضحية بالحيوانات عن طريق الاستنزاف أثناء التخدير العام العميق بعد 7 أيام و 14 يوما و 28 يوما و 42 يوما من زرع الكسب غير المشروع للخلية.
- استخدم الملقط والمقص لإزالة الجفون العلوية والسفلية. قم بإزالة جفن العين الثالث وقطع الملتحمة. قطع عضلات العين والعصب البصري.
- استئصال العينين بعد الوفاة باستخدام المقص الجراحي والملقط الجراحي. تأكد من تنفيذ الإجراء من قبل شخص ذي خبرة.
Representative Results
يتم عرض نتائج زرع تحت الشبكية من حامل الخلية في الخنازير الصغيرة Liběchov في Tقادرة 2. تم تعريف الزرع الناجح على أنه الحصول على بيانات كافية للدراسة النسيجية والكيميائية المناعية. تم تعريف الحالات الفاشلة على أنها عيون ذات مضاعفات شديدة أثناء العملية ، مما جعل المزيد من المراقبة لأنسجة العين مستحيلة.
يسمح تطبيق التقنية المقترحة باستخدام سدادة زيت السيليكون بالتحكم في حالة زرع تحت الشبكية باستخدام طرق التصوير بدءا من اليوم التالي بعد الجراحة حتى وقت الاستئصال (الشكل 7 والشكل 8 والشكل 9).
تصوير قاع العين و SD-OCT
تم فحص الخنازير الصغيرة في فترة ما بعد الجراحة باستخدام تصوير قاع العين والتصوير الخالي من اللون الأحمر والتصوير المقطعي البصري المتماسك بالمجال الطيفي (الشكل 7). تم تمكين تصوير قاع العين عالي الجودة باستخدام وسائط بصرية واضحة ، بما في ذلك عدسة شفافة واستخدام سدادة زيت السيليكون (الشكل 7 أ). لم يظهر موقع بضع الشبكية أي علامات على تفاعل تكاثري (الشكل 7 أ ، الأسهم الصفراء) ، وكان إطار PTE لحامل الخلية مرئيا بوضوح من خلال الطبقات شبه الشفافة لشبكية الخنازير. في التصوير الخالي من اللون الأحمر ، لم تختلف انعكاسية hRPEs المزروعة على الناقل عن انعكاسية طبقة RPE الخنازير الداخلية (الشكل 7B). على SD-OCT ، تسبب إطار PTE في تظليل طفيف فقط للهياكل التشريحية الأساسية وسماكة طفيفة في شبكية العين (الشكل 7C ، الأسهم الحمراء). لم يلاحظ أي مناطق غير نمطية ناقصة أو مفرطة الانعكاس على SD-OCT ، ويبدو أن غشاء Bruch لا يزال غير تالف أيضا. يعرض الشكل 8 صور قاع العين و iOCT للسقالة المزروعة بخلايا RPE البشرية الأولية بعد 1 شهر من الجراحة (الشكل 8). لم يتسبب حامل الخلية نفسه (بدون أي خلايا) في زيادة كبيرة في سمك الشبكية (الشكل 9C). تشير هذه النتائج إلى أن التأثير علاجي المنشأ أثناء العملية للزرع كان ضئيلا وأن حامل الخلايا المزروعة خضع للتكيف الكافي للخلايا المزروعة مع الخلايا المستقبلة للضوء والأنسجة العصبية الشبكية.
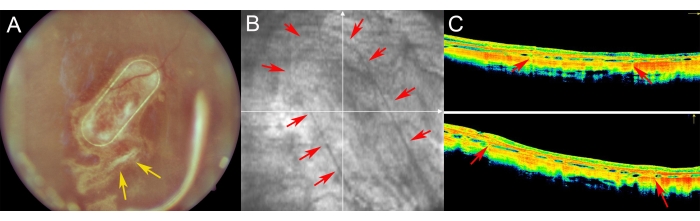
الشكل 7: تصوير شبكية العين بعد العملية الجراحية في الخنازير الصغيرة . (أ) تصوير قاع العين ، (ب) صورة خالية من اللون الأحمر ، و (ج) التصوير المقطعي للتماسك البصري للناقل الليفي النانوي مع خلايا RPE البشرية الأولية في متابعة أسبوع 1 بعد زرع تحت الشبكية في عين خنزير صغير. (أ) تشير الأسهم الصفراء إلى موضع بضع الشبكية. (ب) توضح الأسهم الحمراء هوامش الخلية الليفية النانوية. (C) تظهر الأسهم الحمراء التظليل الطفيف لإشارة OCT الناتجة عن إطار PET الداعم للناقل الليفي النانوي ، والذي تم زرعه في الفضاء تحت الشبكية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
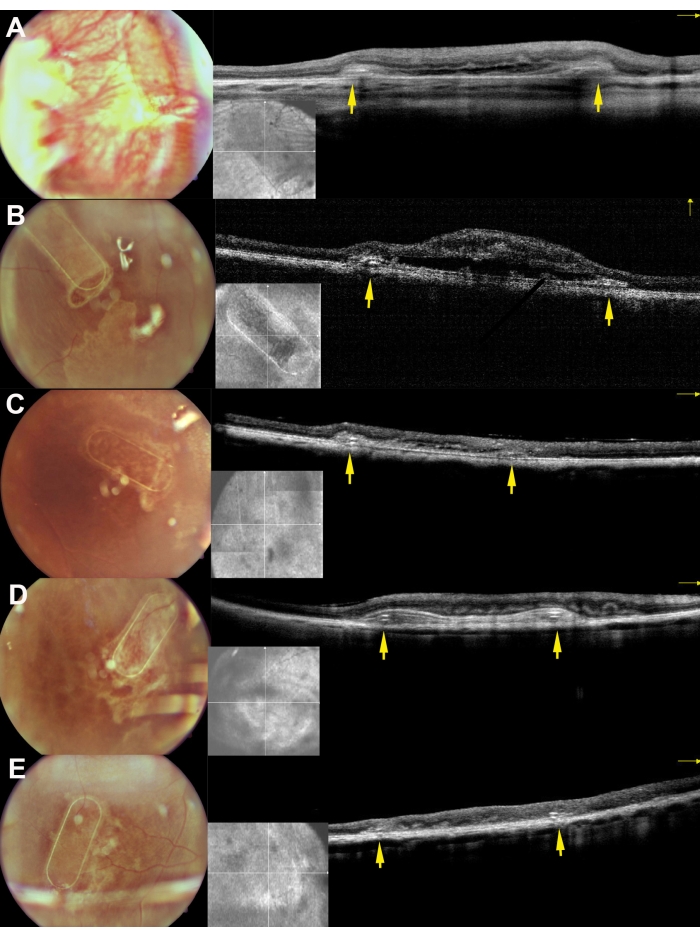
الشكل 8: تصوير قاع العين وصور iOCT للسقالات بعد 30 يوما من زرع تحت الشبكية في الخنازير الصغيرة. تتوافق A و B و C و D و E مع الخنازير 169 و 182 و 179 و 199 و 224 على التوالي. تصور الأسهم الصفراء إطار السقالة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
التحليل النسيجي والكيميائي المناعي
بعد القتل الرحيم للحيوانات ، تمت إزالة عيون minipig كاملة وتثبيتها في 4 ٪ paraformaldehyde (PFA) لمدة 24 ساعة. تمت إزالة الجزء الأمامي من العين ، وتم تحديد الناقل الليفي النانوي المزروع في شبكية العين المركزية للأنف وعزله مع الصلبة المرفقة. كانت جميع الأنسجة محمية بالتبريد في محاليل السكروز المتدرجة ، وتم قطع المقاطع المجمدة الرأسية ، كما هو موضح بالتفصيل43. كشفت أنسجة الغشاء الليفي النانوي بدون خلايا RPE بعد 4 أسابيع من الزرع عن شبكية العين دون التهاب وتغيرات تنكسية (الشكل 9 أ). تم الكشف عن وجود الغشاء الليفي النانوي في الضوء المستقطب (الشكل 9 ب).
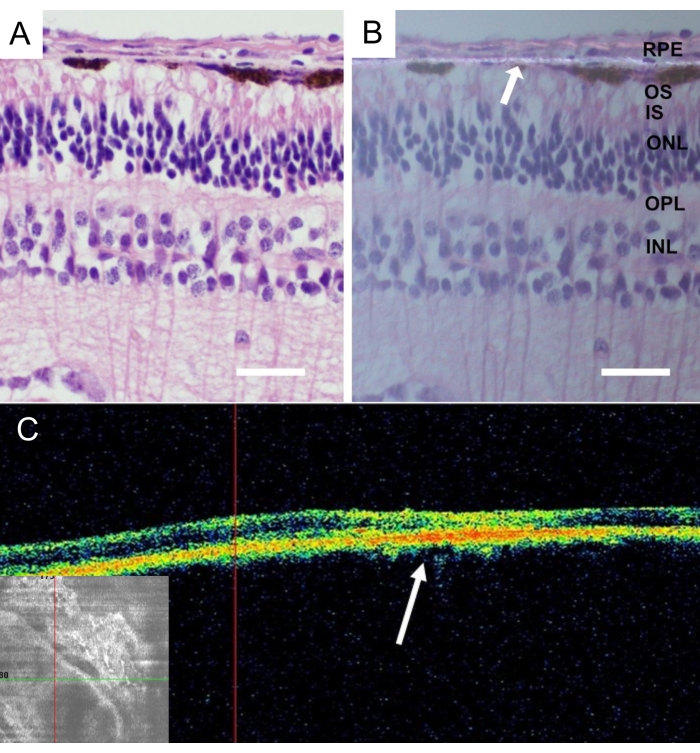
الشكل 9: التحليل النسيجي للغشاء الليفي النانوي اللاخلوي المزروع. تلطيخ الهيماتوكسيلين-يوزين للغشاء الليفي النانوي اللاخلوي بعد 4 أسابيع من الزرع (A) مع الإضاءة القياسية و (B) مع الفحص المجهري الضوئي المستقطب. يشير السهم الأبيض إلى توطين الغشاء الليفي النانوي (شريط المقياس: 50 ميكرومتر). (ج) صور التصوير المقطعي للتماسك البصري في الجسم الحي للغشاء الليفي النانوي اللاخلوي بعد 4 أسابيع بعد الزرع تصور القبول الجيد والالتصاق الغشاء الليفي النانوي في الفضاء تحت الشبكية. يشير السهم الأبيض إلى موقع الغرسة في صورة المقطع العرضي لشبكية العين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يوضح الشكل 10 تلطيخ الهيماتوكسيلين-يوزين (H&E) لمنطقة الشبكية التي تحتوي على خلايا hRPE الأولية المزروعة على حامل ليفي نانوي (سهم أصفر) في عين الخنزير الصغير. شكل المظهر المصطبغ ل hRPEs الأولية المزروعة طبقة مصطبغة مستمرة ولكنها غير منتظمة (الشكل 10 ، الأسهم الحمراء). بعد فترات مراقبة أطول (6 أسابيع) ، أظهرت الشبكية العصبية الموجودة أسفل الغرسات مظهرا يشبه الوردة أو يشبه رد الفعل الضخامي حول موقع بضع الشبكية ، على الأرجح نتيجة للتلاعب علاجي المنشأ. هذه النتائج المورفولوجية قابلة للمقارنة مع نتائج SD-OCT وتدعم الأدلة على الحد الأدنى من تأثير توصيل الناقل على أنسجة الشبكية.
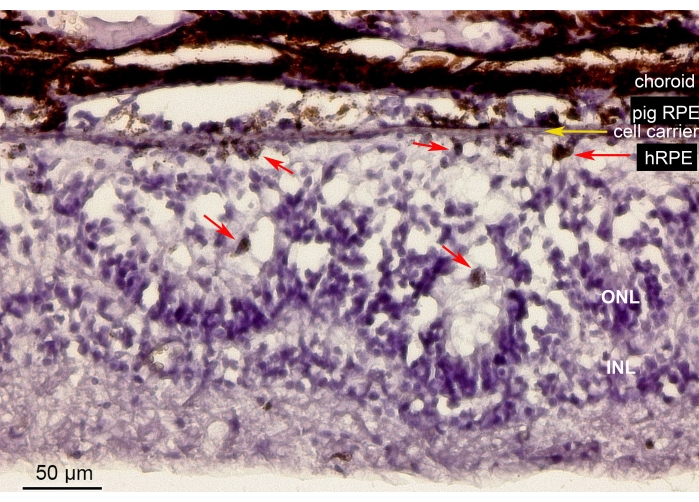
الشكل 10: التحليل النسيجي للغشاء الليفي النانوي المزروع باستخدام hRPEs الأولية. تلطيخ الهيماتوكسيلين-يوزين لمنطقة الشبكية التي تحتوي على الناقل الليفي النانوي المزروع (السهم الأصفر) مع hRPEs الأولية في عين الخنزير الصغير. تم القتل الرحيم للحيوان وتحليله بعد 6 أسابيع من الزرع. كان من الممكن تمييز hRPEs الأولية بوضوح من خلال حجمها وشكلها الدائري وتصبغها (الأسهم الحمراء) في الفضاء تحت الشبكية المقابل للمستقبلات الضوئية. تقوم نوى المستقبلات الضوئية في ONL ببناء هياكل تشبه الوردة. يبدو الفضاء تحت الشبكية ضخما. الاختصارات: hRPE = ظهارة مصطبغة من شبكية العين البشرية الأولية ، ONL = الطبقة النووية الخارجية ، INL = الطبقة النووية الداخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم إجراء التلوين المناعي باستخدام طريقة غير مباشرة من خطوتين. تم تحضين الأقسام في درجة حرارة الغرفة طوال الليل في CRALBP ، وهو جسم مضاد أولي وحيد النسيلة ، بتخفيف 1: 100. تم إجراء التألق المناعي باستخدام الجسم المضاد الثانوي المترافق Alexa Fluor 488.
كانت hRPEs الأولية المزروعة موجودة في منطقة الزرع وعبرت عن علامة RPE CRALBP النموذجية المشابهة لخلايا RPE الصغيرة الداخلية (الشكل 11A). في المقابل ، يبدو أن مورفولوجيا الخلايا المزروعة لا تتخذ شكلا أحادي الطبقة بعد الزرع ، لكنها ظلت موضعية داخل الفضاء تحت الشبكية المحدد (الشكل 11A ، B ، الأسهم البيضاء). ظلت علامات RPE / الشبكية التالية والمظهر المورفولوجي إيجابية بعد فترة 6 أسابيع بعد الزرع: وجود حبيبات الصباغ / الميلانين ، وعلامات الخلايا العصبية الخاصة بالشبكية في المرحلة النهائية للقضيب ثنائي القطب (PKC-alpha) والمستقبلات الضوئية المخروطية (PNA) ، وإيجابية GFAP - علامة على تنشيط الخلايا الدبقية الصغيرة.
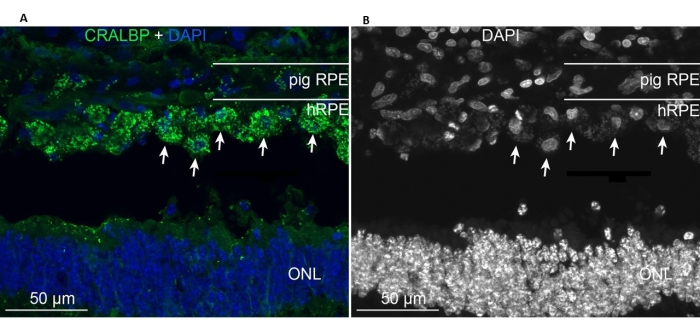
الشكل 11: وضع العلامات المناعية باستخدام علامة خلية RPE CRALBP (بروتين ربط ريتينالديهيد الخلوي) في خنزير صغير بعد 6 أشهر من زرع hRPEs الأولية. (أ) تم تمييز الأجزاء المجمدة الرأسية من عين الخنزير المعالجة بجسم مضاد أحادي النسيلة CRALBP (أخضر) ومضطهدة ب DAPI (أزرق). (B) تصوير واحد لنوى الخلية مع DAPI بالأبيض والأسود ، حيث يكشف التباين العالي عن الشكل الدائري لخلايا hRPE الفردية (بعضها موضح بأسهم بيضاء). الاختصارات: hRPE = ظهارة صبغة الشبكية البشرية ، ONL = الطبقة النووية الخارجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
مضاعفات العين
في المجموع ، كان هناك 27 من 29 (93.1٪) نفذت العمليات بنجاح. تم تطبيق تعريف "العمليات الجراحية التي تم إجراؤها بنجاح" على تلك الحالات التي لم تظهر فيها العين التي خضعت للجراحة أي مضاعفات مهمة سريريا بعد الجراحة حتى وقت الاستئصال يمكن أن تؤثر على الدراسة النسيجية والكيميائية المناعية. أثر انخفاض شفافية الوسائط البصرية على التصوير بعد الجراحة في أربع حالات (13.7٪) ؛ ومع ذلك ، تمت معالجة هذه العيون بمزيد من التحليل النسيجي والكيميائي المناعي.
حدث انفصال الشبكية المحيطية أثناء العملية في أربع حالات (13.8٪). في حالتين ، تمت إدارته عن طريق شفط السائل تحت الشبكية أثناء تبادل السوائل والغاز وتطبيق التخثير الضوئي بالليزر للشبكية في منطقة الانفصال. في الحالتين الأخريين (6.9٪) ، ارتبط انفصال الشبكية بنزيف هائل في الشبكية وتحت الشبكية ، مما جعل زرع حامل الخلية مستحيلا وأدى إلى إنهاء الجراحة والقتل الرحيم الفوري للخنزير الصغير أثناء وجوده على طاولة العمليات.
| لا | البارامترات | الإعدادات القياسية المستخدمة |
| 1 | سرعة استئصال الزجاجية (معدل القطع) | ما يصل إلى 20000 قطعة/دقيقة |
| 2 | مضخة فنتوري | 50-180 مم زئبق |
| 3 | وقت الارتفاع | 1 ثانية |
| 4 | ضغط الري | 18-25 مم زئبق |
| 5 | ضغط ضخ الهواء | 20-25 مم زئبق |
| 6 | ثنائي القطب exodiathermy | 18-26% |
| 7 | الإنفاذ الحراري أحادي القطب | 16-18% |
| 8 | التخثير الضوئي بالليزر للشبكية ، 532 نانومتر | قوة 100-150 ميغاواط |
| الفاصل الزمني 100 مللي ثانية | ||
| المدة 100 مللي ثانية |
الجدول 1: المعلمات القياسية المستخدمة أثناء استئصال الزجاجية والتخثير الضوئي بالليزر.
| مجموع الحيوانات ، ن | 18 |
| مجموع العيون ، ن | 36 |
| عيون تعمل ، ن | 29 |
| زرع ناجح ، ن | 27 |
| الحالات الفاشلة، n | 2 |
| متوسط وقت الجراحة ، دقيقة | 57 |
| نسبة النجاح ،٪ | 93.1 |
الجدول 2: نتائج التقنية الجراحية الموحدة مع زرع تحت الشبكية لحامل الخلية في الخنازير الصغيرة Liběchov بين عامي 2016 و 2020.
الملف التكميلي 1: ملخص الدراسات المخصصة لزرع الخلايا تحت الشبكية لخلايا RPE على حامل الخلية. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يعد زرع خلايا RPE تحت الشبكية ذات الأصول المختلفة اتجاها واعدا للغاية في أبحاث العيون لعلاج الاضطرابات التنكسية للشبكية ، مثل AMD3،4،8،9،10،11،12،13،14،15،25. الفكرة الرئيسية لهذا النهج هي استبدال RPEs التالفة ب RPEs صحية مستزرعة خارج الجسم الحي (الملف التكميلي 1)44،45،46،47،48. يمثل استخدام حاملات الخلايا لزرع خلايا RPE المزروعة النهج الأكثر منطقية ، لأن الأغشية المسامية تحافظ على طبقة خلايا RPE المستقطبة في الاتجاه الصحيح فيما يتعلق بالطبقة الحسية الضوئية.
النموذج الحيواني الأمثل
خطوة حاسمة في تطوير مناهج العلاج هذه هي استخدام النموذج الحيواني الأمثل49. في الماضي ، تم استخدام نماذج حيوانية صغيرة وكبيرة ، بما في ذلك الأرانب والكلاب والخنازير والرئيسيات غير البشرية8،9،10،11،12،13،14،15،27،29. في هذه الورقة ، نقترح استخدام نموذج Liběchov minipig ونصف الخطوات قبل الجراحة والجراحية وما بعد الجراحة التي تتيح كفاءة زرع قوية. تم تربية الخنزير الصغير Liběchov في الأصل منذ حوالي 20 عاما وكثيرا ما استخدم في الأبحاث الطبية الحيوية في مجال الأمراض التنكسية العصبية ، مثل مرض باركنسون ومرض هنتنغتون29,50. نظرا لأن الخنزير يمتلك دماغا كبيرا نسبيا مع إمداد بالدم واستجابة مناعية مماثلة لتلك الموجودة في البشر ، فقد تم استخدامه كنموذج حيواني لتجارب الزرع الخيفي أيضا51،52،53،54. على الرغم من أن شبكية العين من الخنازير الصغيرة لا تمتلك بقعة تشبه الإنسان والنقرة ، إلا أنها تحتوي على المنطقة المركزية والخطوط البصرية ، وهي مناطق من شبكية العين ذات تركيز عال من المستقبلات الضوئيةالمخروطية 30. الحجم المماثل للعين البشرية ، ووجود شبكية مركزية غنية بالمخروط ، والجهاز المناعي الموصوف جيدا ، ووجود طرق لتقييم التشكل والوظيفة بعد الجراحة هي حجج مهمة لاستخدام هذا النموذج الحيواني الكبير في الدراسة المقدمة.
الإجراء الجراحي
على حد علمنا ، لا توجد تقنيات جراحية موحدة ومقبولة على نطاق واسع لزراعة الشبكية والجسم الزجاجي لخلايا RPE على الناقلات. واحدة من القضايا الرئيسية للعلاج باستبدال الخلايا هي التقنية الجراحية الصعبة التي تنطوي على خطر حدوث مضاعفات أثناء العملية وبعد العملية الجراحية مرتبطة بانفصال الشبكية ، ونقص التوتر ، والنزيف فوق الصلب ، والمشيمية ، و / أو الشبكية ، وارتفاع الاضطراب داخل العين ، مما قد يؤدي إلى تلف السقالة. بعد الجراحة ، هناك خطر من اعتلال الشبكية الزجاجي التكاثري ، التهاب باطن المقلة ، نقص التوتر ، انفصال الشبكية ، وتشكيل إعتام عدسة العين4،10،13،14،15.
أجريت الدراسات الأولى على النهج باستخدام ناقلات الخلايا في الأرانب لقيط شينشيلا13،16،25. على الرغم من أن هذه الحيوانات تمثل نموذجا حيوانيا صغيرا ، إلا أن النتائج التي تركز على الجوانب الفنية للجراحة كانت حاسمة في تطوير الإجراءات في النماذج الحيوانية الكبيرة ، وبالتالي ، يتم تلخيصها أدناه.
تم استخدام قنية ضخ 23 G مخصصة في البداية مع منفذين جانبيين من أجل إعادة توجيه التيار النفاث ، مما ساعد على حل انهيار الفقاعة وما يترتب على ذلك من انفصال الشبكية13. في الدراسة الحالية ، لم نلاحظ أي انهيار من هذا القبيل للفقاعة. قد يكون السبب المحتمل لذلك هو الحجم الأكبر لمقلة العين وأداء استئصال الزجاجية الأساسية مع تجنيب الجسم الزجاجي على المحيط في موقع تسريب القنية ، مما قد يقلل من قوة التيار النفاث الموجه.
كانت الصعوبات أثناء طرد حامل الخلية من الأداة عقبة أخرى أثناء العملية في النماذج الحيوانية الصغيرة ، والتي تم تصنيفها على أنها "محاصرة بالأداة". بالإضافة إلى ذلك ، اقترح المؤلفون أن الجسم الزجاجي المتبقي على سطح الشبكية يمكن أن يتسبب في "قفزة" للخلف من الناقل خارج فتحة بضع الشبكية بعد الزرع. يمكن حل هذه المشكلة عن طريق استئصال الزجاجية بمساعدة الإنزيم ، والذي يتيح طردا سلسا ومستمرا لحامل الخلية في الفضاء تحت الشبكية. في معظم الحالات ، أعاد المؤلفون وضع الناقل للحصول على موقع أبعد للزرع بعيدا عن بضع الشبكية. في سلسلة الحالات الخاصة بنا ، واجهنا أيضا موقفا ظل فيه حامل الخلية مرتبطا بطرف الحاقن. ومع ذلك ، تمت إدارة ذلك عن طريق التلاعب البطيء واللطيف بأنبوب الضوء وطرف الحاقن. لم نلاحظ أي زجاج متبقي في موقع بضع الشبكية في أي من حالاتنا. يمكن اقتراح استخدام PPV بمساعدة TA في العمليات الجراحية كوسيلة لتقليل خطر الإصابة بالجسم الزجاجي المتبقي. قد يكون من الضروري تلطيخ متعدد مع TA لإزالة الجسم الزجاجي العلوي تماما.
في دراسة مختلفة ، تم الإبلاغ عن نتائج زرع تحت الشبكية للخلايا الجذعية البشرية RPE نمت كطبقة أحادية خلوية مستقطبة على غشاء بوليستر24. خلال التجارب ، تم استخدام نفس التقنية الجراحية الموصوفة سابقا13 ، ولكن تم تطبيق نهج PPV ثنائي المنفذ. أخيرا ، تم نشر بروتوكول خطوة بخطوة لزرع تحت الشبكية لجراحة حامل الخلايا في الأرانب في وقت لاحق25. تقدم هذه الدراسة وصفا مفصلا للغاية ويمكن تكراره بسهولة للإجراء الجراحي ، بما في ذلك الرعاية قبل الجراحة وبعدها ، والتي تستند إلى الخبرة السابقة أيضا.
أثناء استخدام النماذج الحيوانية الكبيرة في الدراسات اللاحقة ، لم يتم تناول الأسئلة الفنية فحسب ، بل تم أيضا تناول الأسئلة المتعلقة برد الفعل المناعي للخلايا المزروعة ، بالإضافة إلى المشكلات المتعلقة بحجم حامل الخلية. وصفت دراسة باستخدام cynomolgus (Macaca fascicularis) نتائج زرع تحت الشبكية لأحاديات RPE المشتقة من الخلايا الجذعية البشرية15. خضعت جميع الحيوانات لكبت المناعة الجهازية ، والتي تتكون من سيروليموس (جرعة تحميل 2 ملغ ، جرعة يومية من 1 ملغ) والتتراسيكلين (7.5 ملغ / كغ - وزن الجسم) تبدأ قبل 7 أيام من الجراحة وتستمر 3 أشهر بعد الجراحة. تم إجراء العملية الجراحية وفقا للبروتوكولات الموضحة سابقا24,25. استخدم المؤلفون نهج PPV ثلاثي المنافذ 25 G مع إضاءة داخلية للثريا. الأهم من ذلك ، تم استخدام PVD بمساعدة TA لاستبعاد التصاق الشبكية والجسم الزجاجي المتبقي على الشبكية الخلفية. كإضافة إلى الإجراء الموصوف أصلا ، أزال المؤلفون طبقة RPE المضيفة في منطقة الزرع المستقبلي باستخدام أداة حلقة قابلة للتمديد 20 G حسب الطلب.
في دراستنا minipig ، استخدمنا أيضا كبت المناعة الجهازية. ومع ذلك ، يختلف نوع كبت المناعة عن النوع الموصوف أعلاه. قمنا بإعطاء حقنة تحت الجلد من الكريات المجهرية البوليمرية المحملة بالتاكروليموس كمستودع بجرعة 0.25 ملغم / كغم من وزن الجسم لإعاقة رفض الكسب غير المشروع للخلايا والتفاعلات الالتهابية. لم نقم بإزالة طبقة خلايا RPE المضيفة أثناء الجراحة ، حيث كان هدفنا الأساسي هو تحليل سلامة الإجراء وصلاحية الخلايا المزروعة ولكن ليس اندماجها في شبكية العين المضيفة.
في السابق ، تم تقييم سلامة وجدوى الزرع تحت الشبكية لطبقة أحادية من RPEs المشتقة من hESC على غشاء شبه ميكرون parylene-C قابل للطي وغير قابل للتحلل (6.25 مم × 3.5 مم ، سمك 0.4 ميكرومتر) في 14 أنثى من خنازير يوكاتانالصغيرة 10. بعد الزراعة ، تم زرع الخلايا على غشاء مدعوم بالشبكة. تم إجراء كبت المناعة باستخدام الإدارة الجهازية لتاكروليموس (لا يوجد نظام وجرعة مبينة) والحقن داخل الجسم الزجاجي من 0.7 ملغ من زرع ديكساميثازون في نهاية الجراحة. تم تنفيذ PPV مع نهج 20 G. استخدم المؤلفون حقنة داخل الجسم الزجاجي من تريامسينولون أسيتونيد لتحسين تصور الجسم الزجاجي. كان حجم بضع التصلب الكبير من 2 مم إلى 3 مم. بعد الحقن تحت الشبكية ، تم تسطيح الشبكية بحقن مؤقت لسائل الكربون المشبع بالفلور. بعد تبادل السائل والهواء ، تم إجراء سدادة زيت السيليكون (1000 / 5000 cSt). وشملت الرعاية بعد العملية الجراحية التطبيق العيني لمرهم ديكساميثازون / نيومايسين / بوليميكسين ب بعد 1 أسبوع من الجراحة. أبلغ المؤلفون عن معدل نجاح بنسبة 91٪ (أي زرع فعال تحت الشبكية وبيانات تصوير كافية بعد العملية الجراحية). في دراستنا ، تم استخدام الحقن داخل الجسم الزجاجي لبلورات TA أثناء الجراحة وبشكل أساسي لتصور الجسم الزجاجي. ومع ذلك ، فإن العمل المثبط للمناعة المحلية لهذا الدواء لا يزال غير واضح. كانت حاملات الخلايا الليفية النانوية المستخدمة في دراستنا 5.2 مم × 2.1 مم وسمك 3.7 ميكرومتر ، مع أحجام مسام تبلغ 0.4 ميكرومتر. أثناء الجراحة ، أجرينا الفاكس المباشر بدلا من حقن سائل الكربون المشبع بالفلور. كان معدل نجاحنا الجراحي (93.1٪) متسقا مع معدل نجاح Koss et al.10 وأفضل قليلا منه.
تمت دراسة زرع تحت الشبكية لحاملات الخلايا القابلة للتحلل بالكامل (سقالة) لزراعة تحت الشبكية لأول مرة في عام 2019 في يوركشاير الخنازير14. ركزت الدراسة بشكل أساسي على الخصائص القابلة للتحلل الحيوي لزراعة هيدروجيل الفيبرين. لاحظ المؤلفون أن كبت المناعة العدواني المستخدم على الخنازير المحلية يمكن أن يمنع التفاعل الالتهابي المحلي الذي يحتمل أن يحدث أثناء التحلل البيولوجي لزراعة هيدروجيل الفيبرين. ومع ذلك ، لم يحددوا العلاج المثبط للمناعة المستخدم في الخنازير. خلال PPV ، أجروا بضع تصلب بطول 3.6 مم لإدخال جهاز زرع تحت الشبكية مواز وحوالي 3.5 مم خلفي للطرف. بالإضافة إلى ذلك ، استخدموا نظام حقن يعمل بالهواء المضغوط يهدف إلى تقليل عدم استقرار وضع اليد الناجم عن التلاعب بالأصابع. في سلسلة حالاتنا ، كانت جميع عمليات التصلب من 2.5 مم إلى 3.0 مم من النسيان . كان طول بضع التصلب الكبير لإدخال الحاقن 3 مم. تم تشغيل حاقن الزرع المستخدم في دراستنا يدويا. يبدو أن الكي الشامل للبارس بلانا في الجسم الهدبي والقطع الكافي داخل بضع التصلب الكبير أمران حاسمان لتجنب المضاعفات أثناء العملية مثل انفصال الشبكية المحيطية علاجي المنشأ والنزيف وفقدان الزرع.
باختصار ، نصف استخدام نموذج Liběchov minipig لزرع خلايا RPE على ناقلات قابلة للتحلل كخيار علاجي لأمراض الشبكية الوراثية والمكتسبة. تسمح لنا أوجه التشابه في تشريح العين وعلم وظائف الأعضاء ، وكذلك فيما يتعلق بالجهاز المناعي ، بتطوير وتحسين التقنيات الجراحية والأجهزة لزرع الخلايا تحت الشبكية ، والتي يمكن نقلها بسهولة إلى علاج اضطرابات العين البشرية. من المهم التأكد من إجراء العمليات الجراحية على الخنازير الصغيرة باستخدام نفس الأجهزة (بما في ذلك أدوات توصيل الزرع) عند استخدامها في العمليات الجراحية البشرية ، وبالتالي تسهيل تطبيق الخبرة المكتسبة والدراية على البشر. يمكن أن تكون النماذج الحيوانية البديلة للعين الكبيرة مع وجود منطقة بقعية ، مثل الرئيسيات غير البشرية ، مفيدة لمتابعة وتحليل التغيرات التشريحية والوظيفية بعد زرع تحت الشبكية في منطقة الشبكية المركزية. سيكون الوصف التفصيلي لإجراءات الرعاية قبل الجراحة والجراحية وما بعد الجراحة مفيدا للدراسات المستقبلية من خلال زيادة توليد البيانات بكفاءة وموحدة.
Acknowledgements
تم دعم المشروع من قبل مؤسسة العلوم التشيكية (رقم المشروع 18-04393S) والوكالة النرويجية للمنح والتكنولوجيا في الجمهورية التشيكية (برنامج KAPPA ، رقم المشروع TO01000107).
Materials
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
References
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved