Implantation sous-rétinienne de l’EPR sur un porteur chez les miniporcs: lignes directrices pour les préparations préopératoires, les techniques chirurgicales et les soins postopératoires
* These authors contributed equally
In This Article
Summary
L’implantation sous-rétinienne de l’épithélium pigmenté rétinien (EPR) est l’une des approches les plus prometteuses pour le traitement des maladies dégénératives de la rétine. Cependant, la réalisation d’études précliniques sur des modèles animaux à grands yeux reste difficile. Ce rapport présente des lignes directrices pour la transplantation sous-rétinienne d’EPR sur un support cellulaire chez des miniporcs.
Abstract
Les troubles dégénératifs de la rétine (y compris la dégénérescence maculaire liée à l’âge), qui proviennent principalement de la couche épithéliale pigmentée rétinienne (EPR) ou de celle-ci, entraînent une désorganisation progressive de l’anatomie rétinienne et une détérioration de la fonction visuelle. La substitution des cellules EPR endommagées (EPR) par des cellules EPR en culture in vitro à l’aide d’un transporteur cellulaire sous-rétinien a montré un potentiel de rétablissement de la structure anatomique des couches rétiniennes externes et fait donc l’objet d’études plus approfondies. Ici, nous présentons les principes d’une technique chirurgicale qui permet la transplantation sous-rétinienne efficace d’un porteur cellulaire avec des EPR cultivés chez des miniporcs. Les chirurgies ont été effectuées sous anesthésie générale et comprenaient une vitrectomie normale à trois ports pars plana (PPV) à trois orifices épargnant la lentille, l’application sous-rétinienne d’une solution saline équilibrée (BSS), une rétinotomie de 2,7 mm, l’implantation d’un transporteur cellulaire nanofibreux dans l’espace sous-rétinien par une sclérotomie supplémentaire de 3,0 mm, un échange fluide-air (FAX), une tamponnade à l’huile de silicone et la fermeture de toutes les sclérotomies. Cette approche chirurgicale a été utilisée dans 29 chirurgies (18 animaux) au cours des 8 dernières années avec un taux de réussite de 93,1%. La vérification anatomique de la mise en place chirurgicale a été réalisée à l’aide de l’imagerie du fond d’œil in vivo (photographie du fond d’œil et tomographie par cohérence optique). Les étapes chirurgicales recommandées pour l’implantation sous-rétinienne d’EPR sur un porteur dans des yeux de miniporc peuvent être utilisées dans de futures études précliniques utilisant des modèles animaux à grands yeux.
Introduction
La dégénérescence maculaire liée à l’âge (DMLA) est considérée comme la principale cause de perte de vision centrale dans les pays développés et est l’une des nombreuses affections liées au dysfonctionnement de l’épithélium pigmenté rétinien (EPR) 1,2. L’EPR se trouve sur la membrane de Bruch (BM) située à la base et fournit l’entretien nécessaire aux photorécepteurs. La dégénérescence progressive de la couche RPE est une caractéristique de la forme atrophique précoce de la DMLA, et elle accompagne également le développement de la forme exsudative tardive de la DMLA. Malgré de nombreux progrès dans le traitement des maladies de la rétine, le développement d’une modalité de traitement efficace reste difficile3. L’une des méthodes prometteuses est le remplacement de l’EPR à l’aide d’une couche d’EPR cultivée in vitro. Ce traitement est associé aux progrès de la recherche sur les cellules souches utilisant l’EPR dérivée de cellules souches embryonnaires humaines (CSE-EPh) et l’EPR induite dérivée de cellules souches pluripotentes (iPSC-RPE)3,4,5,6,7. Au cours des dernières années, de nombreux groupes de recherche se sont concentrés sur le développement de différentes approches pour le remplacement de l’EPR avec la preuve de concept initialement acceptée 8,9,10,11,12,13,14,15. Les cellules EPR (EPR) sont généralement délivrées dans l’espace sous-rétinien sous la forme d’une suspension cellulaire, d’une feuille cellulaire autoportante ou d’une monocouche cellulaire soutenue par un support artificiel 3,16,17,18,19,20,21. L’injection d’une suspension cellulaire est la méthode la plus simple, mais l’état compromis du BM peut souvent empêcher la fixation des cellules transplantées. Cela peut entraîner une orientation apicobasale incorrecte des EPR et l’échec de la formation d’une monocouche22,23. Le principal avantage des deux autres méthodes (c’est-à-dire une feuille cellulaire autoportante et une monocouche cellulaire soutenue par un substrat artificiel) est que les cellules sont déjà dans un état monocouche différencié lorsqu’elles sont implantées directement dans l’espace sous-rétinien24.
De nombreuses techniques chirurgicales décrivant l’administration de porteurs cellulaires dans l’espace sous-rétinien ont été publiées ces dernières années 8,9,10,11,12,13,14,15. Ces études décrivaient l’utilisation de modèles animaux à gros yeux, les types de porteurs cellulaires, l’utilisation de cultures cellulaires transplantées, les instruments d’implantation, ainsi que les techniques chirurgicales, et les auteurs se sont concentrés principalement sur les résultats de l’implantation sous-rétinienne. En 2015, Popelka et al. ont signalé l’utilisation d’une membrane polymère électrofilée ultramince supportée par cadre pour la transplantation d’EPR dans les yeux de cadavres porcins8. La technique chirurgicale décrite ici avec implantation sous-rétinienne du porteur cellulaire a permis une manipulation relativement précise du porteur et un positionnement facile de l’échafaudage dans l’espace sous-rétinien. Kozak et al. ont évalué la faisabilité de la technique d’administration d’un support d’une taille approximative de 2 mm x 5 mm dans les yeux du porc9. La conception unique du support cellulaire a permis son placement correct, empêchant la monocouche cellulaire de se plier et de se froisser6. Al-Nawaiseh et al. ont d’abord présenté des lignes directrices détaillées étape par étape pour l’implantation d’échafaudages sous-rétiniens chez le lapin25. Stanzel et al. ont ensuite publié un protocole similaire en 2019 pour la transplantation chez les petits rongeurs, les lapins, les porcs et les primates non humains26. Comme publié précédemment, la transplantation d’une monocouche d’EPR différenciée et polarisée sur un porteur solide a permis d’améliorer la survie et la meilleure intégration du greffon par rapport à d’autres techniques d’administration (dossier supplémentaire 1)27.
Le but de toute étude préclinique sur les animaux réalisée in vivo est de révéler les différents aspects de l’implantation sous-rétinienne transvitréenne chirurgicale d’un porteur cellulaire en mettant l’accent sur la sécurité de la procédure, la survie des cellules transplantées, la réponse tissulaire aux manœuvres sous-rétiniennes et les résultats postopératoires à court et à long terme. L’utilisation des yeux de porc comme modèle animal à grands yeux a été jugée pertinente en termes de portée des données obtenues, qui pourraient être utiles et potentiellement applicables aux humains10,11,14. Notre étude rapporte la technique chirurgicale utilisée pour l’implantation sous-rétinienne in vivo d’un porteur cellulaire dans un modèle animal à grands yeux. Nous présentons une description détaillée des préparations préopératoires, de la technique chirurgicale d’implantation de porteurs cellulaires sous-rétiniens et des soins postopératoires des yeux de miniporc basée sur notre expérience au cours des 8 dernières années. Nous décrivons les principes chirurgicaux de base qui peuvent être utilisés pour des études expérimentales in vivo impliquant l’implantation de différents types de cellules et de transporteurs cellulaires.
Grand modèle animal
Le troupeau expérimental de miniporcs Liběchov a été fondé en important cinq animaux de la souche Hormel des États-Unis en 1967. Ces animaux ont été croisés pour des études de groupes sanguins porcins avec plusieurs autres races ou souches: Landrace, Large White, Cornwall, porcs vietnamiens et porcs miniatures d’origine Göttingen28,29. À l’âge de 5 mois et à environ 20 kg de poids corporel (PC), les miniporcs atteignent la maturité sexuelle. La survie des races parentales de miniporcs (Hormel et Göttingen) serait de 12 à 20 ans. L’implantation sous-rétinienne du transporteur cellulaire cible la partie centrale de la rétine. La rétine des miniporcs manque de macula et de fovéa. Cependant, il a des régions de photorécepteurs coniques très concentrés appelés la zone centralis et des stries visuelles30,31. Ces régions sont responsables de l’acuité visuelle la plus élevée.
Les chirurgies ont été effectuées par quatre chirurgiens vitréo-rétiniens expérimentés avec l’aide d’un assistant expérimenté en établissement chirurgical (TA). Avant les expériences in vivo , les chirurgiens ont été formés et ont acquis des connaissances particulières sur l’anatomie des yeux de miniporc, telles que le rapport plus faible entre le cristallin et le volume vitreux, la longueur axiale plus courte (15-19 mm), l’absence de membrane de Bowman dans la cornée, le plus petit volume vitré (2,8-3,2 mL), l’absence de la macula et de la fovéa, l’absence de l’anneau de Zinn et le diamètre du disque optique (vertical/horizontal : 1,5 mm/2,1 mm). Dans tous les cas, la chirurgie a été réalisée sous anesthésie générale dans une salle d’opération spécialement organisée avec la mise en œuvre de mesures aseptiques et antiseptiques standard.
Protocol
Cette étude adhère aux principes des lignes directrices de la Déclaration d’Helsinki et aux principes éthiques pour la recherche médicale impliquant des sujets humains. Toutes les expériences ont été réalisées conformément aux Directives pour le soin et l’utilisation des animaux de laboratoire et selon l’Association pour la recherche en vision et ophtalmologie (ARVO) pour l’utilisation des animaux dans la recherche ophtalmique et visuelle. Le protocole d’étude a été approuvé par la Commission professionnelle de villégiature de la CAS pour l’approbation des projets d’expériences sur les animaux à l’Institut de physiologie et de génétique animales de l’Académie tchèque des sciences (Liběchov, République tchèque) (Protocole approuvé n ° 60/2016 et n ° 64/2019).
1. Considérations lors de la transplantation sous-rétinienne de cellules sur un porteur chez des miniporcs
- Sélection des animaux
- Procurez-vous et utilisez des miniporcs Liběchov âgés de 12 à 36 mois, quel que soit leur sexe, et pesant environ 40 à 80 kg de poids corporel (PC).
- Gardez les miniporcs à l’intérieur dans un poulailler climatisé avec des températures comprises entre 18 et 22 °C, une exposition à un cycle artificiel lumière/obscurité de 13 h/11 h, des enclos individuels standardisés, un accès gratuit à l’eau et une alimentation deux fois par jour.
- Préparation avant la chirurgie
- Vérifiez l’orientation chirurgicale de l’œil et dessinez les schémas du fond d’œil. Pour ce faire, divisez schématiquement la rétine des miniporcs sur le dessin du fond d’œil à l’aide d’un stylo avec une ligne verticale dans les régions temporale (du disque optique vers l’oreille), nasale (du disque optique vers le museau du porc) et centrale (entre les principaux vaisseaux rétiniens du côté nasal) (Figure 1A, B).
- Ne sélectionnez que des animaux en bonne santé sans aucune pathologie comportementale et neurologique et avec une qualité normale de la peau, des orifices corporels, des matières fécales et de la consommation alimentaire. Demandez à un vétérinaire qualifié d’effectuer l’observation clinique et de sélectionner les animaux.
- Injecter par voie intramusculaire 3 mg/kg p.c. de chlorhydrate de ceftiofur (1 mL/kg) le jour de la chirurgie.
- Immunosuppression préopératoire
- Préparer des microsphères polymères à élution de tacrolimus comme décrit dans Wang et al. et Sevc et al. 32,33 avec modification.
- S’assurer que la concentration de tacrolimus dans les microsphères polymères est de 51,3 mg/g telle que déterminée par CLHP (Tableau des matériaux).
- Effectuer une injection sous-cutanée de microsphères polymères chargées de tacrolimus à une dose de 0,25 mg/kg p.c. 6 jours avant la chirurgie oculaire pour empêcher le rejet du greffon cellulaire. Ceci est fait pour assurer la survie des cellules du donneur d’EPR humain pendant la transplantation xénogénique dans les yeux du miniporc.
- Injecter les animaux par voie intramusculaire le jour de la chirurgie avec 80 mg de depo-medrol et de benzylpénicilline à 1 mL/10 kg selon le poids corporel.
- Anesthésie
- Induire une anesthésie générale avec une injection intramusculaire d’un mélange de tilétamine (2 mg / kg), de zolazépam (2 mg / kg), de kétamine (2 mg / kg) et de xylazine (0,4 mg / kg)-TKX34,35 avant la chirurgie. Vérifiez la profondeur de l’anesthésie par un état d’inconscience et en vérifiant le réflexe de pédale (une pincée de la peau interdigitale de la patte postérieure), le réflexe cornéen (un léger contact de la cornée), le réflexe pupillaire (réaction à la lumière) et le réflexe palpébral (un toucher de la paupière). Assurez-vous que l’animal ne cligne pas des yeux. Confirmez la régularité du rythme cardiaque et respiratoire.
- Après l’induction de l’anesthésie, transportez l’animal sous sédation à la salle d’opération sur un chariot élévateur (figure 2A).
- Placez l’animal sur la table d’opération du côté gauche pour permettre la chirurgie de l’œil droit (figure 2B).
- Effectuer le réglage de la tête de l’animal à l’aide de coussinets en polystyrène expansé afin d’obtenir la position la plus appropriée de la rétine centrale pour l’implantation (c.-à-d. horizontale et parallèle au sol) (figure 2C).
- Placez des gouttes ophtalmiques de solution ophtalmique de chlorhydrate de proparacaïne à 0,5% dans le sac conjonctival à trois fois à 1 min d’intervalle pour induire une anesthésie locale.
- Insérer une canule veineuse et intuber l’animal à l’aide d’un tube endotrachéal pour le maintien par inhalation de l’anesthésie (isoflurane à 1,5 %) à l’aide d’un appareil d’anesthésie équipé d’un moniteur patient (figure 2A, B).
- Administrer une injection intramusculaire de 1 mL d’Eficur par 16 kg de poids corporel et de 20 mg de Depo-Medrol 1 environ 15 minutes avant le début de la chirurgie oculaire (Tableau des matières).
- Maintenir la température corporelle physiologique en recouvrant l’animal d’une feuille isotherme et effectuer la chirurgie décrite à la rubrique 3.
- Pendant la chirurgie, surveillez la température de l’animal ainsi que la fréquence cardiaque et la saturation en oxygène du sang à l’aide d’un clip auriculaire et d’un moniteur patient. Évitez d’abaisser la température corporelle en dessous de 38 °C pendant les procédures, ce qui est considéré comme une limite de sécurité36. Maintenez la saturation en oxygène (>96%) et le pouls (70-90 battements par minute) pendant toute l’expérience.
- Lorsque la chirurgie est terminée, coupez l’écoulement d’isoflurane et extuberez l’animal.
- Après la respiration spontanée et le réveil, transférez les animaux dans leurs enclos.
- Configuration de la salle d’opération
- Aménager la salle d’opération en fonction des besoins de la chirurgie sur les yeux du modèle animal à gros yeux (Figure 3A, B). Ajustez la hauteur des fauteuils du chirurgien, ainsi que la hauteur du microscope, pour obtenir une position confortable pour les chirurgiens par rapport à la position du museau du porc.
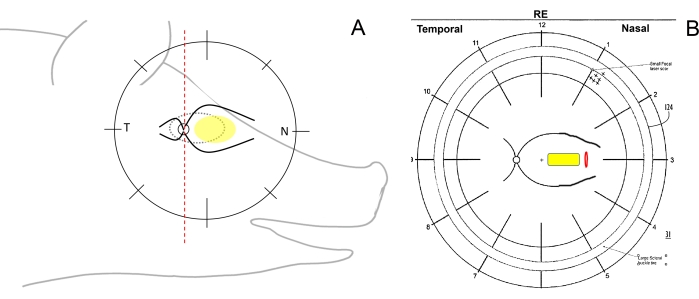
Figure 1: Dessin schématique des zones rétiniennes chez les miniporcs. A) Dessin schématique des zones rétiniennes par rapport à la tête du miniporc; l’ellipse jaune représente la zone souhaitée d’implantation sous-rétinienne, T fait référence à la zone rétinienne temporale et N à la zone rétinienne nasale. (B) Exemple du schéma du fond d’œil après implantation sous-rétinienne du porteur cellulaire (jaune) par rétinotomie (rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.
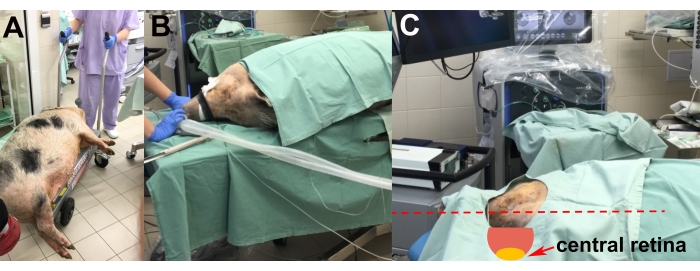
Figure 2 : Transport et placement de l’animal. (A) Transport de l’animal sous sédation jusqu’à la salle d’opération. (B) Mise en place de l’animal pendant l’intubation. (C) Ajustement de la tête de l’animal pour un accès optimal à la rétine centrale pendant la chirurgie (flèche rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.
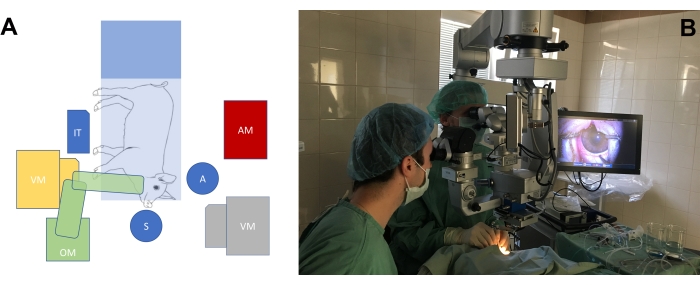
Figure 3 : Configuration standard de la salle d’opération. (A) Représentation schématique de la position des chirurgiens (S = chirurgien, A = assistant) par rapport à la position de la table d’opération avec le miniporc, du microscope opératoire (OM), de l’appareil de vitrectomie (VM), de la table instrumentale (IT) et de l’appareil d’anesthésiologie (AM). Il existe deux positions possibles de l’appareil de vitrectomie (jaune et gris). (B) Contexte réel dans la salle d’opération. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Porteur cellulaire, cultures de cellules cultivées et injecteur d’implantation
- Porteur de cellule
- Couper le cadre ovale de 30 μm de large avec des dimensions extérieures de 1,7 mm x 4,8 mm, équipé de saillies triangulaires situées de manière asymétrique sur le cadre (figure 4A), à partir d’une feuille de polyéthylène-téréphtalate (PET) orientée biaxialement de 36 μm d’épaisseur à l’aide d’un laser femtoseconde.
- Préparer la solution poly(L-lactide-co-DL-lactide) (LLA/DLLA 90/10, MW 868, 270 g/mol) dans la pyridine à une concentration de 11 % en poids avec addition de 2,2 μL d’acide formique pour 1 g de solution.
- Préparer la membrane nanofibreuse avec un cadre de support embarqué (Figure 4B) par électrofilage de la solution polymère en trois étapes8 : (1) déposer la première couche de nanofibres sur un substrat de silicium, (2) placer le cadre sur la couche, et (3) déposer la deuxième couche de nanofibres.
NOTE: Déposer chaque couche pendant 7 minutes pour atteindre une épaisseur totale de membrane de 3,7 μm. Utilisez les paramètres suivants pour obtenir une membrane composée de fibres de 380 nm d’épaisseur et avec une taille moyenne de pores de 0,4 μm et une porosité d’environ 70%37: une aiguille tout acier de 20 G, une tension de 7,1 kV, un espace de 10 cm, un débit de 250 μL/min et une température de 25,0 °C ± 0,5 °C. - Retirez soigneusement la membrane avec le cadre intégré du substrat de silicium et fixez-la au corps d’un insert commercial de culture cellulaire de 12 puits dépourvu de la membrane d’origine pour faciliter l’ensemencement et la croissance des cellules.
- Traiter la membrane nanofibreuse avant l’ensemencement cellulaire dans du plasma air-plasma pendant 30 s à une puissance de 70 W dans un nettoyant plasma.
- Cultures cellulaires utilisées pour la culture sur le support cellulaire
NOTE: Les transporteurs cellulaires suivants pourraient être utilisés: 1) porteurs de cellules nanofibreuses sans cellules; 2) les porteurs de cellules nanofibreuses avec des EPR humains primaires (EPRh); 3) les porteurs cellulaires nanofibreux avec des cellules RPE humaines dérivées de l’iPSC.- Culture d’hEPR primaires
- Isoler les cellules hRPE primaires des yeux de donneurs humains selon une technique précédemment rapportée38.
- Obtenir les cellules par traitement enzymatique de la rétine pendant 30 min. Ensuite, cultivez les cellules hRPE primaires (passage 0) jusqu’à 2 semaines dans DMEM/F12 supplémenté avec 10% de sérum bovin fœtal (FBS).
- Une fois que les cultures cellulaires atteignent la confluence, changer le milieu à 1% FBS et la culture pendant 30 jours supplémentaires.
- Ensemencer les hRPE primaires sur des plaques trans-puits et sur un support cellulaire nanofibreux recouvert de laminine à une densité de 2 000 cellules/mm2. Après 30 jours supplémentaires d’incubation dans le FBS à 1%, utiliser les porteurs cellulaires avec des hEPR primaires pour l’implantation sous-rétinienne chez les miniporcs.
- EPR humaines dérivées de CSPi
- Utiliser des hiPSCs dérivés de fibroblastes dérivés de la rétinite pigmentaire associée à MERTK39 qui sont corrigés en deux allèles à l’aide du système CRISPR/Cas9 (RP1-FiPS4F1-GC2)40, ainsi que des hiPSC dérivés des fibroblastes d’un sujet sain (Ctrl2-FiPS5F2)41 qui sont utilisés comme témoin.
- Générer et différencier par la suite les deux lignées cellulaires des CSPhi en cellules EPR (HIPSC-RPE) comme indiqué précédemment42.
- Plaquer les piq-EPR hiPSC à 200 000 cellules/cm2 sur des inserts de culture cellulaire recouverts de laminine avec des membranes nanofibreuses de poly(L-lactide-co-DL-lactide) avec des cadres d’implantation ovales dans un milieu RPE contenant du DMEM knockout, 20% de sérum knockout, 0,1 mM d’acides aminés non essentiels, 0,23 mM de β-mercaptoéthanol, 100 U/mL de pénicilline, 0,1 mg/mL de streptomycine et 10 mM de nicotinamide.
- Changez le milieu tous les deux jours et cultivez l’hiPSC-RPE pendant 2 mois avant l’implantation pour favoriser une croissance polarisée.
- Injecteur d’implantation
- Préparer un capillaire en plastique de section rectangulaire de 2,8 mm x 0,8 mm par moulage par soufflage à partir d’un tube en plastique de 1,75 mm de diamètre extérieur/ID 1,10 mm.
- Découpez une fenêtre de chargement de 4 mm x 2,2 mm dans le capillaire en plastique à 6 mm de l’extrémité.
- Assemblez l’injecteur à partir du capillaire en plastique, d’une poignée en silicone, d’un piston à lame en acier et d’un piston (Figure 5A).
- Chargez le support dans l’injecteur par une fenêtre de chargement et éjectez-le plus tard dans l’espace sous-rétinien en appuyant sur le piston, comme décrit à l’étape 3.5.2 (Figure 5B).
- Préparation du support nanofibreux et chargement de l’injecteur
- Remplissez une petite boîte de Petri en plastique avec 2 ml de solution saline tamponnée au phosphate (PBS). Sortez un insert avec la couche cellulaire préparée, placez-le sur une boîte de polystyrène semi-doux et centrez-le au microscope optique. Utilisez un poinçon modifié sur mesure pour découper le support le long du cadre ovale à l’aide d’un microscope. Les dimensions du support doivent être de 2 mm x 5 mm.
- Utilisez un injecteur sur mesure avec un tube transparent plat pour charger le support; À 6 mm de l’extrémité distale du capillaire, il y a une fenêtre pour charger le support. Remplissez la fenêtre de l’injecteur avec du PBS.
- À l’aide de la pince, libérez l’échantillon du fond de la capsule, soulevez-le du liquide et transportez-le jusqu’à la fenêtre de l’injecteur tout en vérifiant d’abord les marques d’orientation latérale sur le cadre afin de détecter la face supérieure du support avec des cellules adhérentes. Un cadre ovale facilite la manipulation avec le support.
- À l’aide d’une sonde dentaire (un instrument dentaire en acier inoxydable avec une extrémité tranchante), placez le support dans la fenêtre de l’injecteur. Utilisez le piston pour pousser le support dans la partie supérieure fermée et sûre de l’injecteur. Ensuite, préparez le porteur pour la chirurgie.
- Vérifiez l’orientation latérale du porte-bagages à chaque étape. Déchargez le support nanofibreux de l’injecteur en poussant le piston métallique.

Figure 4 : Porteur nanofibreux avec un cadre PET de support intégré. (A) Trois marques visibles sur le cadre permettent de contrôler l’orientation latérale du support (flèches blanches). (B) Vue d’agrandissement du fragment de trame PET encastré dans la membrane nanofibreuse (flèches blanches) du porteur cellulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Injecteur d’implantation. (A) Parties de l’injecteur. (B) Vecteur cellulaire nanofibreux avec cadre PET de support intégré chargé sur le capillaire rectangulaire en plastique de l’injecteur d’implantation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Intervention chirurgicale
- Matériel chirurgical
- Utilisez l’équipement chirurgical suivant : un microscope chirurgical ophtalmique, un système opératoire pour les chirurgies sur les segments antérieur et postérieur de l’œil, un système chirurgical vitréo-rétinien sans contact, un appareil de photocoagulation au laser et un appareil photo numérique.
REMARQUE : Les paramètres standard utilisés dans l’équipement de vitrectomie, d’exo- et d’endocautérisation et de photocoagulation au laser sont illustrés dans le tableau 1.
- Utilisez l’équipement chirurgical suivant : un microscope chirurgical ophtalmique, un système opératoire pour les chirurgies sur les segments antérieur et postérieur de l’œil, un système chirurgical vitréo-rétinien sans contact, un appareil de photocoagulation au laser et un appareil photo numérique.
- Instruments chirurgicaux
- Stérilisez les instruments chirurgicaux réutilisables avec un stérilisateur à vapeur à autoclave mobile ou similaire selon un protocole standard. Les instruments chirurgicaux à usage unique et le matériel requis pendant la chirurgie sont énumérés dans le tableau des matériaux.
- Préparation aux étapes chirurgicales
- Après avoir anesthésié l’animal comme décrit à l’étape 1.4.1, appliquer des gouttes ophtalmiques en solution de tropicamide à 1 % et une solution de chlorhydrate de phényléphrine à 10 % dans le sac conjonctival 15 minutes avant l’intervention pour provoquer une mydriase d’origine médicamenteuse.
- Approchez-vous de la table d’opération avec le chirurgien en position supérieure et l’assistant en position latérale (Figure 3).
- Rasez la zone autour de l’œil à l’aide d’un rasoir à raser à usage unique et enlevez la saleté rugueuse.
- Désinfecter le sac conjonctival avec une solution de povidone iodée à 5% pendant 5 min.
- Désinfectez la zone périorbitaire avec des cotons-tiges en frottant des paupières à la périphérie. Répétez le processus trois fois en utilisant une solution de povidone iodée à 10% et laissez agir pendant 5 minutes.
- Couvrez le champ opératoire avec l’œil au milieu à l’aide d’un champ ophtalmique stérile standard avec une feuille transparente collante. Éloignez les cils du globe oculaire. Évitez de couper les cils pour réduire le risque d’endophtalmie postopératoire.
- Insérez le spéculum du couvercle (spéculum oculaire de type Liberman ou Cook). En option, fixez la membrane nictitante à la peau avec 8-0 Suture de polyglactine.
- Ouvrez la conjonctive du côté nasal à 2 mm à 3 mm du limbe afin d’exposer la sclérotique pour les sclérotomies à l’aide de forceps chirurgicaux et de ciseaux conjonctivals Westcott.
- Insérez les trocarts 25 G à trois soupapes à 2,5-3 mm du limbe dans la zone des pars plana (placez-les à 7 heures, 10 heures et 11 heures). Utilisez des mouvements de rotation pendant l’insertion de manière légèrement oblique (100°-110°) vers la rétine postérieure et tenez le trocart avec la pince (Figure 6).
- Gardez la cornée humide ou enduit-la de méthylcellulose pendant toute la chirurgie pour prévenir l’œdème cornéen osmotique.
- Vitrectomie pars plana (VPP)
- Retirez la partie médiane du corps vitré avec l’approche standard de vitrectomie pars plana à trois orifices. Retirez délicatement le vitré derrière la lentille dans la zone de la future grande sclérotomie.
- Utilisez une injection intravitréenne de 2 à 4 mg d’acétonide de triamcinolone (TA) (50-100 μL) pour colorer le vitré postérieur, qui reste généralement adhérent à la rétine, afin d’effectuer un décollement du vitré postérieur contrôlé.
- Après cela, effectuez lentement une injection sous-rétinienne de 0,05 à 0,1 mL de BSS avec une canule de 41 G plus centrale, en évitant la formation d’un bleb vers la périphérie.
- Réduire les réglages de pression intraoculaire avec le système d’irrigation jusqu’à 15 mmHg lors de l’injection sous-rétinienne afin d’éviter une occlusion vasculaire rétinienne transitoire.
- Effectuer une grande endodiathermie linéaire de la rétine avec une sonde d’endodiathermie de 27 G à 3 mm près de la base du bulbe nasal.
- Ensuite, faites une rétinotomie de 3 mm de large avec une lame MVR de 25 G ou des ciseaux verticaux avec un réglage de pression intraoculaire (PIO) élevée du système d’irrigation jusqu’à 60 mmHg pendant 3 min à 5 min. Assurez-vous qu’il n’y a pas de saignement de la rétinotomie, puis réduisez la PIO à 25 mmHg.
- Effectuer une exodiathermie des vaisseaux épiscléraux entre les deux trocarts nasaux à 2,5-3 mm du limbe avec une sonde d’endodiathermie de 27 G en appliquant un toucher doux sur la surface de la sclérotique.
- Vérifiez le niveau de liquide du flacon de perfusion avant d’agrandir la sclérotomie, car après l’élargissement de la sclérotomie, la consommation de liquide est temporairement élevée.
- Faites une sclérotomie de 3,0 mm de large, à 3 mm du limbe, à l’aide d’un couteau phaco de 2,75 mm.
- Faites attention aux saignements possibles des vaisseaux scléraux et du corps ciliaire à l’intérieur de la grande sclérotomie. En cas de saignement, utilisez une sonde d’endodiathermie de 27 G pour coaguler les vaisseaux endommagés. Agrandir la sclérotomie à 3,0 mm avec un couteau en satin pour accueillir la pointe de l’injecteur (0,8 mm x 2,8 mm).
- Retirez le corps vitré prolabé sur le site de la grande sclérotomie avec un vitrecteur. Maintenir la perfusion de BSS au niveau de 25-30 mmHg avec le système de vitrectomie pour éviter l’effondrement du globe.
- Implantation du porteur cellulaire
- Insérez doucement l’injecteur avec la main dominante dans la cavité vitrée par la grande sclérotomie. En cas de résistance, agrandir la taille de la sclérotomie.
- Implanter le porteur cellulaire à travers la rétinotomie dans l’espace sous-rétinien. Si nécessaire, utilisez une technique bimanuelle avec sclérotomie supplémentaire et lumière de lustre afin d’améliorer le contrôle de l’implantation.
- Retirez l’injecteur de l’œil et fermez la grande sclérotomie avec un 8-0 Suture polyglactine pour éviter les complications associées à l’hypotonie intraoculaire.
- Effectuer un échange fluide-air complet (FAX) et un drainage du liquide sous-rétinien avec une canule à embout en silicone.
- Après cela, injectez de l’huile de silicone (1 000 cSt) dans la cavité vitrée en utilisant le système de vitrectomie et le système de tubulure pour l’injection d’huile de silicone jusqu’à ce que la PIO soit normale.
- Imagerie peropératoire et documentation
- Effectuez un enregistrement vidéo pendant toute la durée de la chirurgie avec une documentation photographique des étapes clés de l’implantation à l’aide d’un système d’enregistrement vidéo.
- Complétez le dessin du fond d’œil en documentant l’emplacement des sclérotomies, de la rétinotomie, de l’implant sous-rétinien et de toute complication survenue à l’aide de schémas de dessin du fond d’œil.
- Étapes post-opératoires
- À la fin de la chirurgie, retirez les trocarts et fermez les trois sclérotomies et la conjonctive avec 8-0 sutures de polyglactine.
- Rincer le sac conjonctival avec une solution de povidone iodée à 5%.
- Effectuer une injection sous-conjonctivale de 0,3 mL de 20 mg de gentamicine, 2 mg de dexaméthasone et 2% de xylocaïne.
- Vérifiez l’état du fond d’œil et du cristallin à l’aide d’une vue microscopique.
- Retirez la ou les sutures de la membrane nictitante à l’aide d’une pince chirurgicale et de ciseaux conjonctivals Westcott (facultatif).
- Appliquez une pommade à la néomycine ou une pommade ophtalmique à l’ofloxacine dans le sac conjonctival.
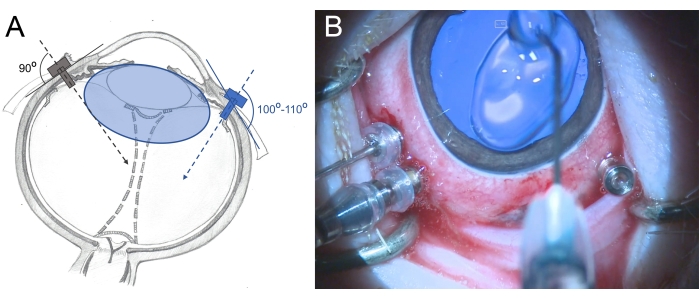
Figure 6 : Insertion des trocarts dans l’œil d’un minicochon. (A) Représentation schématique des trocarts, qui sont insérés perpendiculairement dans la sclérotique vers le centre de la cavité vitrée dans l’œil humain (couleur grise) et de manière oblique vers la rétine postérieure dans l’œil de minicochon (couleur bleue) pour éviter d’endommager la lentille. La lentille du minicochon (de couleur bleue) est plus grande que celle de l’homme et relative à la taille de la cavité vitrée. (B) Vue peropératoire des trocarts insérés dans un PPV à trois orifices. La cornée est recouverte de méthylcellulose pour éviter le dessèchement et l’enflure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Soins postopératoires
- Appliquez de la bacitracine, de l’acétate de zinc/d’hydrocortisone/sulfate de néomycine ou 0,3 % d’ofloxacine dans le sac conjonctival des animaux cinq fois par jour.
- Après l’opération, vérifier les paramètres oculaires suivants: turgescence des tissus mous de l’œil à l’aide de la palpation, réaction inflammatoire à la surface de l’œil et plissage des yeux comme réaction protectrice des paupières à l’aide d’une lampe à fente portative ou d’un ophtalmoscope indirect.
- Pour les soins postopératoires systémiques, utilisez les antibiotiques suivants:
- Injecter du chlorhydrate de ceftiofur par voie intramusculaire à la dose de 3 mg/kg p.c. (1 mL/kg) les deuxième et troisième jours de stabilité.
- Injecter de la tulathromycine (1 mL/40 kg de poids corporel) 72 heures après la chirurgie pour prévenir une infection bactérienne secondaire.
- Effectuer une injection intramusculaire de flunixine (2 mL/45 kg de poids vif) et de chlorhydrate de tramadol (100 mg) toutes les 24 heures pendant 3 jours après la chirurgie pour prévenir la douleur.
- Garder les miniporcs dans une installation climatisée spécialisée avec une plage de température de 18 à 22 °C et un régime artificiel 13 h/11 h lumière/obscurité.
- Assurez-vous qu’ils ont un accès gratuit à l’eau et à une alimentation standard (deux fois par jour).
5. Procédures postopératoires
- Examens ophtalmiques postopératoires
- Dans la période postopératoire, inspectez les yeux avec un ophtalmoscope indirect pour détecter la présence d’inflammation (c.-à-d. rougeur, gonflement des tissus ou congestion du mucus dans le sac conjonctival). Mesurer la pression intraoculaire dans l’œil opéré en utilisant la méthode de palpation.
- Imagerie postopératoire
- Induire une sédation chez le miniporc par injection intramusculaire d’un mélange TKX avant la photographie du fond d’œil et l’examen OCT. Instiller des gouttes ophtalmiques de chlorhydrate de tropicamide à 1% et de chlorhydrate de phényléphrine à 10% dans le sac conjonctival du miniporc afin d’induire une mydriase.
- Utilisez un spéculum de couvercle pour maintenir les yeux ouverts. Pour hydrater la surface de l’œil et obtenir une image OCT claire, laver la cornée de l’animal avec une solution saline (0,9% NaCl) toutes les 30-60 s.
- Placez le minicochon sur la table d’opération de la même manière que pendant l’opération (Figure 2B, C, Figure 3A). La principale exigence est de placer la tête sur le côté et perpendiculairement à la pièce de balayage de l’appareil OCT. Utilisez des coussinets en polystyrène sous le museau de l’animal pour stabiliser la tête, amenant la surface de l’œil en position horizontale.
- Collectez des images du fond d’œil couleur avec une caméra couleur non mydriatique, car cela permet de documenter le segment antérieur, la rétine et le disque optique. De plus, prenez une image sans rouge de la rétine avec la caméra du fond d’œil non mydriatique.
- Effectuer une imagerie par tomographie par cohérence optique à l’aide du système OCT du domaine spectral. Pendant l’imagerie de la TCO ou du fond d’œil, inclinez manuellement la tête du miniporc vers les lentilles OCT ou les lentilles de la caméra du fond d’œil pour optimiser la vue de la rétine postérieure et de la zone d’implantation (Figure 2C). Pour une imagerie optimale du porteur implanté sur le fond d’œil, appliquez la lumière de réflectance infrarouge du dispositif OCT pour vous concentrer sur l’implant (Figure 2C). Utilisez les modes de numérisation de la carte transversale et de la carte de la rétine de l’OCT.
- Appliquer une pommade ophtalmique à l’ofloxacine à la fin de l’examen sous la paupière de l’œil de l’animal.
- Déplacer le minicochon vers l’installation intérieure et observer son état général jusqu’à la fin de la sédation (environ 2 h à 5 h).
6. Énucléation post mortem de l’œil après euthanasie
- Sédater les miniporcs par injection intramusculaire du mélange TKX suivie d’une application intraveineuse (par une canule auriculaire de 22 G) de propofol à 1 % (20 mL/animal) suivie d’une exsanguination. N’utilisez pas de fixateurs généraux.
- Sacrifier les animaux par exsanguination pendant l’anesthésie générale profonde 7 jours, 14 jours, 28 jours et 42 jours après l’implantation de la greffe cellulaire.
- Utilisez des pinces et des ciseaux pour enlever les paupières supérieures et inférieures. Retirez la troisième paupière et coupez à travers la conjonctive. Couper les muscles oculaires et le nerf optique.
- Énucléer les yeux post mortem à l’aide de ciseaux chirurgicaux et de forceps chirurgicaux. Assurez-vous que la procédure est effectuée par une personne expérimentée.
Representative Results
Les résultats de l’implantation sous-rétinienne du porteur cellulaire chez les miniporcs Liběchov sont présentés dans le tableau T2. Une implantation réussie a été définie comme l’obtention de données suffisantes pour l’étude histologique et immunohistochimique. Les cas d’échec ont été définis comme des yeux présentant de graves complications peropératoires, ce qui rendait impossible toute observation ultérieure des tissus oculaires.
L’application de la technique proposée avec l’utilisation de tamponnade à l’huile de silicone permet de contrôler l’état de la greffe sous-rétinienne à l’aide de modalités d’imagerie à partir du lendemain de la chirurgie jusqu’au moment de l’énucléation (Figure 7, Figure 8 et Figure 9).
Imagerie du fond d’œil et SD-OCT
Les miniporcs ont été examinés dans la période postopératoire en utilisant l’imagerie du fond d’œil, l’imagerie sans rouge et la tomographie cohérente optique du domaine spectral (Figure 7). L’imagerie du fond d’œil de haute qualité a été rendue possible par l’utilisation de supports optiques transparents, y compris une lentille transparente et l’utilisation de tamponnade à l’huile de silicone (Figure 7A). Le site de la rétinotomie n’a montré aucun signe de réaction proliférative (Figure 7A, flèches jaunes), et le cadre PTE du porteur cellulaire était clairement visible à travers les couches semi-transparentes de la rétine porcine. Sur l’imagerie sans rouge, la réflectivité des EPR cultivés sur le support ne différait pas de la réflectivité de la couche endogène d’EPR porcine (figure 7B). Sur le SD-OCT, le cadre PTE n’a causé qu’une ombre mineure des structures anatomiques sous-jacentes et un léger épaississement de la rétine (Figure 7C, flèches rouges). Aucune zone hypo- ou hyper-réfléchissante atypique n’a été remarquée sur le SD-OCT, et la membrane de Bruch semblait également rester intacte. La figure 8 présente des images du fond d’œil et de l’iOCT de l’échafaudage cultivé avec des cellules humaines primaires d’EPR 1 mois après la chirurgie (figure 8). Le porteur cellulaire lui-même (sans aucune cellule) n’a pas provoqué d’augmentation significative de l’épaisseur de la rétine (Figure 9C). Ces résultats suggèrent que l’impact iatrogène peropératoire de l’implant était minime et que le porteur cellulaire implanté a subi une adaptation suffisante des cellules implantées aux cellules photoréceptrices sus-jacentes et au tissu neurorétinien.
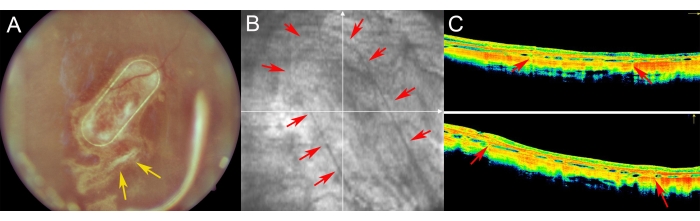
Figure 7 : Imagerie postopératoire de la rétine chez les miniporcs. (A) imagerie du fond d’œil, (B) image sans rouge, et (C) imagerie par tomographie par cohérence optique du porteur nanofibreux avec des cellules EPR humaines primaires dans un suivi de 1 semaine après transplantation sous-rétinienne dans un œil de miniporc. (A) Les flèches jaunes indiquent le site de la rétinotomie. (B) Les flèches rouges montrent les marges du transporteur cellulaire nanofibreux. (C) Les flèches rouges montrent la légère ombrage du signal OCT causé par le cadre PET de support du porteur nanofibreux, qui a été implanté dans l’espace sous-rétinien. Veuillez cliquer ici pour voir une version agrandie de cette figure.
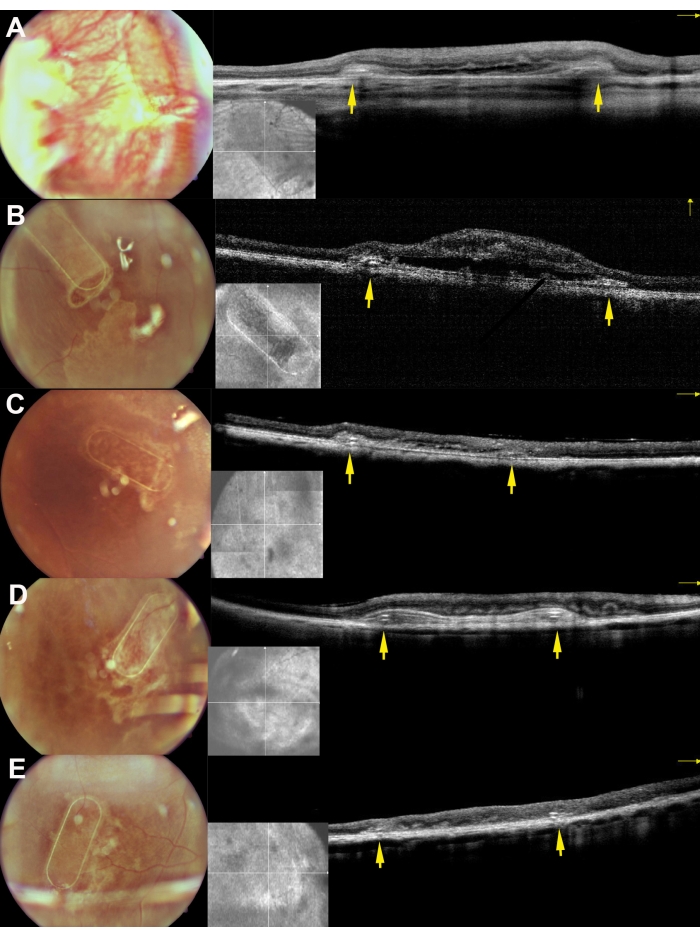
Figure 8 : Imagerie du fond d’œil et images iOCT des échafaudages 30 jours après l’implantation sous-rétinienne chez les miniporcs. A, B, C, D et E correspondent respectivement aux porcs 169, 182, 179, 199 et 224. Les flèches jaunes représentent le cadre de l’échafaudage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Analyse histologique et immunohistochimique
Après l’euthanasie des animaux, des yeux entiers de miniporc ont été retirés et fixés dans du paraformaldéhyde (PFA) à 4% pendant 24 heures. La partie antérieure de l’œil a été retirée et le porteur nanofibreux implanté a été identifié dans la rétine centrale nasale et isolé avec la sclérotique attachée. Tous les tissus ont été cryoprotégés dans des solutions de saccharose graduées et des coupes verticales congelées ont été coupées, comme décrit en détail43. L’histologie de la membrane nanofibreuse sans cellules EPR après 4 semaines d’implantation a révélé des rétines sans inflammation ni changements dégénératifs (Figure 9A). La présence de la membrane nanofibreuse a été détectée en lumière polarisée (Figure 9B).
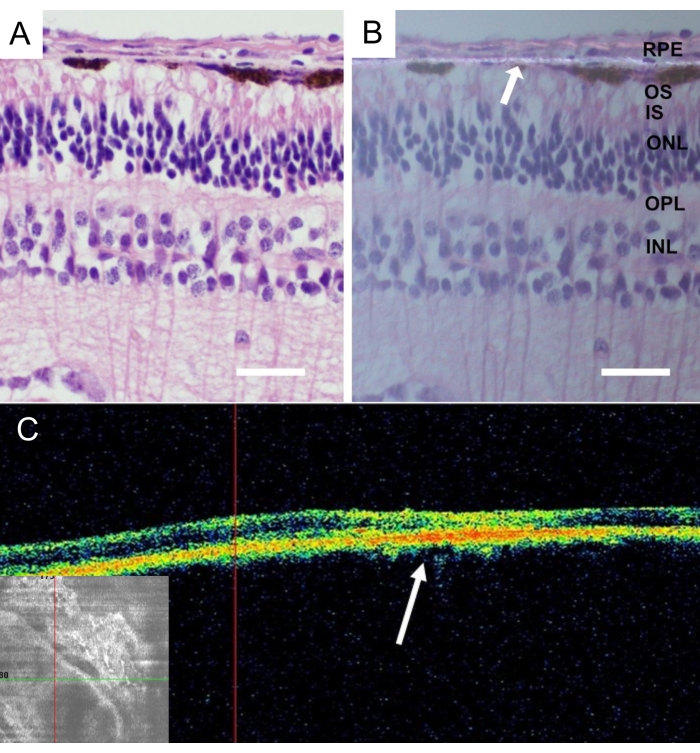
Figure 9 : Analyse histologique de la membrane nanofibreuse acellulaire implantée. Coloration à l’hématoxyline-éosine de la membrane nanofibreuse acellulaire 4 semaines après l’implantation (A) avec éclairage standard et (B) avec microscopie à lumière polarisée. La flèche blanche indique la localisation de la membrane nanofibreuse (barre d’échelle : 50 μm). (C) Les images de tomographie par cohérence optique in vivo de la membrane nanofibreuse acellulaire après 4 semaines après l’implantation montrent une bonne acceptation et adhérence de la membrane nanofibreuse dans l’espace sous-rétinien. La flèche blanche indique l’emplacement de l’implant dans l’image en coupe transversale de la rétine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure 10 montre la coloration à l’hématoxyline-éosine (H&E) de la région rétinienne contenant les cellules hRPE primaires implantées sur un support nanofibreux (flèche jaune) dans l’œil de miniporc. L’aspect pigmenté des hRPE primaires implantés formait une couche pigmentée continue mais irrégulière (figure 10, flèches rouges). Après des périodes d’observation plus longues (6 semaines), la neurorétine sous les implants a montré une apparence de rosette ou de réaction hypertrophique autour du site de rétinotomie, probablement à la suite d’une manipulation iatrogène. Ces résultats morphologiques sont comparables aux résultats de la SD-OCT et soutiennent les preuves de l’impact minimal de l’administration de porteurs sur le tissu rétinien.
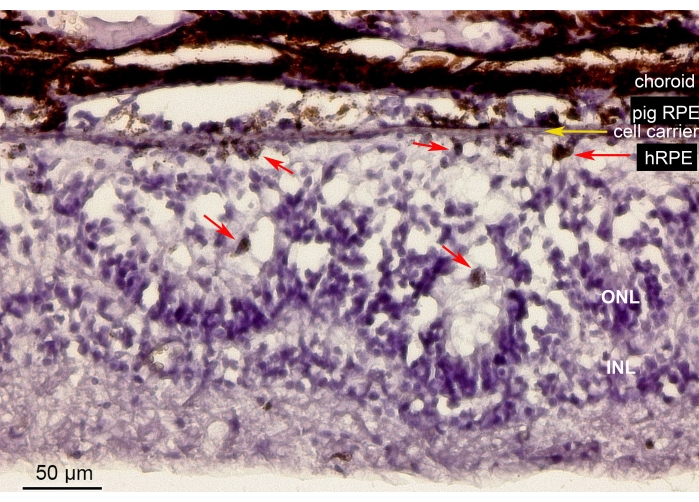
Figure 10 : Analyse histologique de la membrane nanofibreuse implantée avec les hRPE primaires. Coloration à l’hématoxyline-éosine de la zone rétinienne contenant le porteur nanofibreux implanté (flèche jaune) avec les hRPE primaires dans l’œil de miniporc. L’animal a été euthanasié et analysé 6 semaines après l’implantation. Les hRPE primaires se distinguaient clairement par leur taille, leur forme ronde et leur pigmentation (flèches rouges) dans l’espace sous-rétinien opposé aux photorécepteurs. Les noyaux photorécepteurs de l’ONL construisent des structures en forme de rosette. L’espace sous-rétinien apparaît hypertrophique. Abréviations : hRPE = épithélium pigmenté rétinien humain primaire, ONL = couche nucléaire externe, INL = couche nucléaire interne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’immunomarquage a été réalisé à l’aide d’une méthode indirecte en deux étapes. Les sections ont été incubées à température ambiante pendant une nuit dans CRALBP, un anticorps primaire monoclonal, à une dilution de 1:100. L’immunofluorescence a été réalisée à l’aide d’anticorps secondaires conjugués Alexa Fluor 488.
Les EPRh primaires implantées étaient présentes dans la zone d’implantation et exprimaient le marqueur CRALBP typique de l’EPR semblable aux cellules RPE miniporcines endogènes (Figure 11A). En revanche, la morphologie des cellules implantées ne semblait pas prendre une forme monocouche après l’implantation tout en restant localisée dans l’espace sous-rétinien défini (Figure 11A, B, flèches blanches). Les marqueurs RPE/rétiniens et l’aspect morphologique suivants sont restés positifs après la période post-implantation de 6 semaines : la présence de granules pigmentaires/mélanine, les marqueurs neuronaux spécifiques de la rétine en phase terminale pour le bipolaire bâtonnet (PKC-alpha) et les photorécepteurs coniques (PNA), et la positivité GFAP, signe d’activation microgliale.
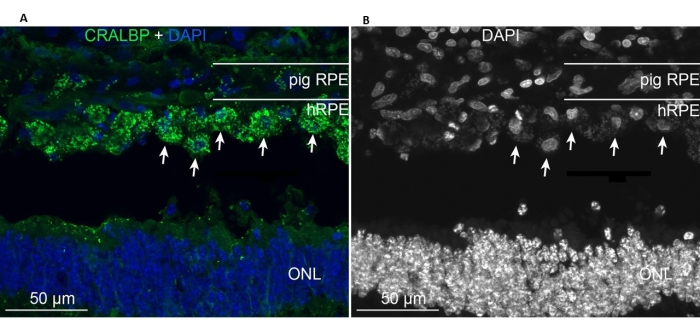
Figure 11 : Immunomarquage avec le marqueur cellulaire RPE CRALBP (protéine de liaison cellulaire au rétinaldéhyde) chez un miniporc 6 mois après l’implantation d’hEPh primaires. (A) Des coupes verticales congelées de l’œil de porc traité ont été immunomarquées avec l’anticorps monoclonal CRALBP (vert) et contre-colorées avec DAPI (bleu). (B) Représentation unique des noyaux cellulaires marqués avec DAPI en noir et blanc, car un contraste élevé révèle la forme ronde des cellules hRPE individuelles (certaines sont représentées avec des flèches blanches). Abréviations : hRPE = épithélium pigmentaire rétinien humain, ONL = couche nucléaire externe. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Complications oculaires
Au total, 27 des 29 opérations (93,1 %) ont été réalisées avec succès. La définition de « chirurgies effectuées avec succès » a été appliquée aux cas où l’œil opéré n’a présenté aucune complication postopératoire cliniquement significative jusqu’au moment de l’énucléation qui pourrait influencer l’étude histologique et immunohistochimique. La réduction de la transparence des supports optiques a eu un impact sur l’imagerie postopératoire dans quatre cas (13,7 %) ; Néanmoins, ces yeux ont été traités avec une analyse histologique et immunohistochimique plus poussée.
Un décollement périphérique peropératoire de la rétine est survenu dans quatre cas (13,8 %). Dans deux cas, il a été géré par aspiration du liquide sous-rétinien lors de l’échange fluide-gaz et l’application de la photocoagulation laser de la rétine dans la zone de décollement. Dans les deux autres cas (6,9%), le décollement de la rétine était associé à un saignement rétinien et sous-rétinien massif, ce qui rendait impossible l’implantation du porteur cellulaire et entraînait l’interruption de la chirurgie et l’euthanasie immédiate du miniporc sur la table d’opération.
| Non | Paramètres | Paramètres standard utilisés |
| 1 | Vitesse de vitrectomie (taux de coupe) | Jusqu’à 20 000 coupes/min |
| 2 | Pompe Venturi | 50-180 mmHg |
| 3 | Temps de montée | 1 sec |
| 4 | Pression d’irrigation | 18-25 mmHg |
| 5 | Pression d’infusion d’air | 20-25 mmHg |
| 6 | Exodiathermie bipolaire | 18-26% |
| 7 | Endodiathermie monopolaire | 16-18% |
| 8 | Photocoagulation laser de la rétine, 532 nm | Puissance 100-150 mW |
| Intervalle 100 ms | ||
| Durée 100 ms |
Tableau 1 : Paramètres standard utilisés lors de la vitrectomie et de la photocoagulation au laser.
| Nombre total d’animaux, n | 18 |
| Nombre total d’yeux, n | 36 |
| Yeux opérés, n | 29 |
| Implantation réussie, n | 27 |
| Dossiers ayant échoué, n | 2 |
| Temps moyen de chirurgie, min | 57 |
| Taux de réussite, % | 93.1 |
Tableau 2 : Résultats de la technique chirurgicale standardisée avec implantation sous-rétinienne du porteur cellulaire chez les miniporcs Liběchov entre 2016 et 2020.
Fichier supplémentaire 1 : Résumé des études dédiées à l’implantation sous-rétinienne des cellules EPR sur le support cellulaire. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
L’implantation sous-rétinienne de cellules EPR d’origines différentes est une tendance très prometteuse dans la recherche oculaire pour le traitement des troubles dégénératifs rétiniens, tels que la DMLA 3,4,8,9,10,11,12,13,14,15,25 . L’idée principale de cette approche est de remplacer les EPR endommagés par des EPR sains cultivés ex vivo (Dossier supplémentaire 1)44,45,46,47,48. L’utilisation de porteurs cellulaires pour transplanter les cellules RPE cultivées représente l’approche la plus raisonnable, puisque les membranes poreuses maintiennent la couche cellulaire RPE polarisée dans la bonne orientation par rapport à la couche photosensorielle.
Modèle animal optimal
Une étape cruciale dans le développement de telles approches de traitement est l’utilisation du modèle animal optimal49. Dans le passé, des modèles animaux de petite et de grande taille ont été utilisés, y compris des lapins, des chiens, des porcs et des primates non humains 8,9,10,11,12,13,14,15,27,29. Dans cet article, nous proposons l’utilisation du modèle de miniporc Liběchov et décrivons les étapes préopératoires, chirurgicales et postopératoires qui permettent une efficacité de transplantation robuste. Le miniporc Liběchov a été élevé à l’origine il y a environ 20 ans et a été fréquemment utilisé dans la recherche biomédicale dans le domaine des maladies neurodégénératives, telles que la maladie de Parkinson et la maladie de Huntington29,50. Étant donné que le porc possède un cerveau relativement gros avec un apport sanguin et une réponse immunologique similaires à ceux des humains, il a également été utilisé comme modèle animal pour des expériences de transplantation allogénique51,52,53,54. Même si la rétine des miniporcs ne possède pas de macula et de fovéa de type humain, elle contient la zone centrale et les stries visuelles, qui sont des régions de la rétine avec une forte concentration de photorécepteurs coniques30. La taille similaire à l’œil humain, la présence d’une rétine centrale enrichie en cônes, le système immunitaire bien décrit et la présence de méthodes pour évaluer la morphologie et la fonction post-opératoire sont des arguments importants pour l’utilisation de ce grand modèle animal dans l’étude présentée.
Intervention chirurgicale
À notre connaissance, il n’existe pas de techniques chirurgicales normalisées et largement acceptées pour la transplantation vitréo-rétinienne de cellules EPR sur des porteurs. L’un des principaux problèmes de la thérapie de remplacement cellulaire est la technique chirurgicale difficile qui présente un risque de complications peropératoires et postopératoires liées au décollement de la rétine, à l’hypotonie, aux saignements épiscléraux, choroïdiens et / ou rétiniens et à une turbulence intraoculaire élevée, ce qui peut entraîner des dommages à l’échafaudage. En postopératoire, il existe un risque de vitréorétinopathie proliférative, d’endophtalmie, d’hypotonie, de décollement de la rétine et de formation de cataracte 4,10,13,14,15.
Les premières études sur les approches utilisant des porteurs cellulaires ont été réalisées chez des lapins bâtards chinchilla13,16,25. Même si ces animaux représentent un modèle de petit animal, les résultats axés sur les aspects techniques de la chirurgie ont été cruciaux dans le développement des procédures dans les grands modèles animaux et sont donc résumés ci-dessous.
Une canule de perfusion de 23 G sur mesure a d’abord été utilisée avec deux orifices latéraux afin de rediriger le courant-jet, ce qui a aidé à résoudre l’effondrement du bleb et le décollement de la rétine qui en a résulté13. Dans la présente étude, nous n’avons pas remarqué un tel effondrement du bleb. La raison possible pourrait être la plus grande taille du globe oculaire et la performance de la vitrectomie centrale avec un vitré épargné à la périphérie du site de perfusion de la canule, ce qui pourrait réduire la force du jet d’eau dirigé.
Les difficultés lors de l’éjection du porteur cellulaire de l’instrument étaient un autre obstacle peropératoire dans les modèles de petits animaux, qui ont été classés comme « piégés avec l’instrument ». De plus, les auteurs ont suggéré que le vitré résiduel sur la surface rétinienne pourrait provoquer un « saut » en arrière du porteur hors de l’orifice de rétinotomie après l’implantation. Ce problème peut être résolu par une vitrectomie assistée par enzyme, qui permet une éjection continue et en douceur du transporteur cellulaire dans l’espace sous-rétinien. Dans la majorité des cas, les auteurs ont repositionné le porteur pour obtenir un emplacement plus éloigné de l’implant loin de la rétinotomie. Dans notre série de cas, nous avons également connu une situation dans laquelle le porteur de cellule est resté attaché à l’extrémité de l’injecteur. Cependant, cela a été géré par une manipulation lente et douce du tuyau d’éclairage et de la pointe de l’injecteur. Nous n’avons observé aucun résidu du vitré sur le site de la rétinotomie dans aucun de nos cas. L’utilisation de la VPP assistée par TA dans les chirurgies peut être suggérée comme méthode pour réduire le risque de fixation résiduelle du vitré. Une coloration multiple avec TA peut être nécessaire pour enlever complètement le vitré sus-jacent.
Dans une autre étude, les résultats de l’implantation sous-rétinienne de cellules souches humaines EPR cultivées comme monocouche cellulaire polarisée sur une membrane de polyester ont été rapportés24. Au cours des expériences, la même technique chirurgicale décrite précédemment a été utilisée13, mais une approche PPV à deux ports a été appliquée. Enfin, un protocole étape par étape pour l’implantation sous-rétinienne de la chirurgie des porteurs cellulaires chez le lapin a été publié par la suite25. Cette étude présente une description très détaillée et facilement reproductible de l’intervention chirurgicale, y compris les soins préopératoires et postopératoires, qui sont également basés sur l’expérience antérieure.
Lors de l’utilisation de grands modèles animaux dans des études ultérieures, non seulement des questions techniques ont été abordées, mais aussi des questions concernant la réaction immunitaire aux cellules transplantées, ainsi que des problèmes liés à la taille du porteur cellulaire. Une étude utilisant des singes cynomolgus (Macaca fascicularis) a décrit les résultats de l’implantation sous-rétinienne de monocouches RPE dérivées de cellules souches humaines15. Tous les animaux ont subi une immunosuppression systémique, qui consistait en sirolimus (dose de charge de 2 mg, dose quotidienne de 1 mg) et en tétracycline (7,5 mg/kg p.c.) commençant 7 jours avant la chirurgie et durant 3 mois après la chirurgie. L’intervention chirurgicale a été réalisée selon les protocoles décrits précédemment24,25. Les auteurs ont utilisé une approche PPV à trois ports de 25 G avec endo-éclairage du lustre. Il est important de noter qu’une MVP assistée par TA a été utilisée pour exclure l’adhérence vitréo-rétinienne résiduelle sur la rétine postérieure. En complément de la procédure décrite à l’origine, les auteurs ont retiré la couche RPE hôte dans la zone d’implantation future à l’aide d’un instrument à boucle extensible de 20 G sur mesure.
Dans notre étude sur les miniporcs, nous avons également utilisé l’immunosuppression systémique. Cependant, le type d’immunosuppression différait de celui décrit ci-dessus. Nous avons administré une injection sous-cutanée de microsphères polymères à élution de tacrolimus en dépôt à une dose de 0,25 mg/kg de poids corporel pour empêcher le rejet du greffon cellulaire et les réactions inflammatoires. Nous n’avons pas retiré la couche de cellules EPR de l’hôte pendant la chirurgie, car notre objectif principal était d’analyser la sécurité de la procédure et la viabilité des cellules implantées, mais pas leur intégration dans la rétine hôte.
Auparavant, l’innocuité et la faisabilité de l’implantation sous-rétinienne d’une monocouche d’EPR dérivés de CSEh sur une membrane de parylène-C submicronique pliable non dégradable supportée par un maillage (6,25 mm x 3,5 mm, 0,4 μm d’épaisseur) ont été évaluées chez 14 miniporcs femelles du Yucatán10. Après la culture, les cellules ont été ensemencées sur une membrane supportée par un maillage. L’immunosuppression a été réalisée par l’administration systémique de tacrolimus (aucun schéma et dose indiqués) et des injections intravitréennes de 0,7 mg d’un implant de dexaméthasone à la fin de la chirurgie. La VPP a été réalisée avec une approche de 20 G. Les auteurs ont utilisé une injection intravitréenne d’acétonide de triamcinolone pour une meilleure visualisation du corps vitré. La grande sclérotomie mesurait de 2 mm à 3 mm. Après l’injection sous-rétinienne, la rétine a été aplatie avec une injection temporaire de liquide perfluorocarboné. Après l’échange fluide-air, une tamponnade d’huile de silicone (1 000/5 000 cSt) a été effectuée. Les soins postopératoires comprenaient l’application oculaire de la pommade de dexaméthasone/néomycine/polymyxine B 1 semaine après la chirurgie. Les auteurs ont rapporté un taux de réussite de 91 % (c.-à-d. implantation sous-rétinienne efficace et données d’imagerie postopératoires suffisantes). Dans notre étude, l’injection intravitréenne de cristaux TA a été utilisée en peropératoire et principalement pour visualiser le corps vitré. Cependant, l’action immunosuppressive locale de ce médicament reste incertaine. Les supports cellulaires nanofibreux utilisés dans notre étude étaient de 5,2 mm x 2,1 mm et 3,7 μm d’épaisseur, avec des tailles de pores de 0,4 μm. Pendant la chirurgie, nous avons effectué un FAX direct au lieu d’injecter du liquide perfluorocarboné. Notre taux de réussite chirurgicale (93,1 %) était conforme et légèrement supérieur à celui de Koss et coll.10.
La transplantation sous-rétinienne de porteurs cellulaires entièrement dégradables (échafaudage) pour implantation sous-rétinienne a été étudiée pour la première fois en 2019 chez des porcs Yorkshire14. L’étude était principalement axée sur les caractéristiques biodégradables des implants d’hydrogel de fibrine. Les auteurs ont noté que l’immunosuppression agressive utilisée sur les porcs domestiques pourrait inhiber une réaction inflammatoire locale potentiellement causée lors de la biodégradation des implants d’hydrogel de fibrine. Cependant, ils n’ont pas précisé le traitement immunosuppresseur utilisé chez les porcs. Au cours de la VPP, ils ont effectué une sclérotomie de 3,6 mm de long pour l’insertion du dispositif d’implantation sous-rétinienne parallèle et d’environ 3,5 mm postérieur au limbe. De plus, ils ont utilisé un système d’injection pneumatique visant à réduire l’instabilité du placement des mains causée par la manipulation des doigts. Dans notre série de cas, toutes les sclérotomies se trouvaient à 2,5 mm à 3,0 mm du limbe. La grande sclérotomie pour l’insertion de l’injecteur mesurait 3 mm de long. L’injecteur d’implantation utilisé dans notre étude a été actionné à la main. Une cautérisation complète de la pars plana du corps ciliaire et une coupure suffisante à l’intérieur de la grande sclérotomie semblent être cruciales pour éviter les complications peropératoires telles que le décollement périphérique de la rétine iatrogène, les saignements et la perte de l’implant.
En résumé, nous décrivons l’utilisation du modèle de miniporc Liběchov pour la transplantation de cellules EPR sur des porteurs biodégradables comme option de traitement pour les maladies rétiniennes héréditaires et acquises. Les similitudes dans l’anatomie et la physiologie des yeux, ainsi qu’en ce qui concerne le système immunitaire, nous permettent de développer et d’améliorer les techniques chirurgicales et l’instrumentation pour l’implantation sous-rétinienne de cellules, qui peuvent être facilement transférées au traitement des troubles oculaires humains. Il est important de veiller à ce que les chirurgies sur les miniporcs soient effectuées à l’aide des mêmes instruments (y compris les outils d’administration d’implantation) lorsqu’elles sont utilisées dans les chirurgies humaines, facilitant ainsi l’application de l’expérience et du savoir-faire acquis aux humains. D’autres modèles animaux à grands yeux avec la présence d’une région maculaire, tels que les primates non humains, pourraient être utiles pour le suivi et l’analyse des changements anatomiques et fonctionnels après implantation sous-rétinienne dans la région centrale de la rétine. La description détaillée des procédures de soins préopératoires, chirurgicaux et postopératoires sera utile pour les études futures en augmentant la production de données efficaces et normalisées.
Acknowledgements
Le projet a été soutenu par la Fondation tchèque pour la science (projet numéro 18-04393S) et l’Agence norvégienne des subventions et de la technologie de la République tchèque (programme KAPPA, numéro de projet TO01000107).
Materials
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
References
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved