"मिनीपिग्स में एक वाहक पर आरपीई का सबरेटिनल आरोपण: प्रीऑपरेटिव तैयारी, सर्जिकल तकनीक और पोस्टऑपरेटिव देखभाल के लिए दिशानिर्देश"
* These authors contributed equally
In This Article
Summary
रेटिना पिगमेंटेड एपिथेलियम (आरपीई) का सबरेटिनल आरोपण अपक्षयी रेटिना रोगों के उपचार के लिए सबसे आशाजनक दृष्टिकोणों में से एक है। हालांकि, बड़ी आंखों वाले पशु मॉडल पर प्रीक्लिनिकल अध्ययनों का प्रदर्शन चुनौतीपूर्ण बना हुआ है। यह रिपोर्ट एक सेल वाहक पर आरपीई के सबरेटिनल प्रत्यारोपण के लिए दिशानिर्देश प्रस्तुत करती है।
Abstract
रेटिना के अपक्षयी विकार (उम्र से संबंधित मैकुलर अपघटन सहित), जो मुख्य रूप से रेटिना पिगमेंटेड एपिथेलियल (आरपीई) परत पर या उसके भीतर उत्पन्न होते हैं, रेटिना शरीर रचना विज्ञान के प्रगतिशील विघटन और दृश्य समारोह की गिरावट का कारण बनते हैं। एक सबरेटिनल सेल वाहक का उपयोग करके इन विट्रो सुसंस्कृत आरपीई कोशिकाओं के साथ क्षतिग्रस्त आरपीई कोशिकाओं (आरपीई) के प्रतिस्थापन ने बाहरी रेटिना परतों की शारीरिक संरचना को फिर से स्थापित करने की क्षमता दिखाई है और इसलिए, आगे का अध्ययन किया जा रहा है। यहां, हम एक सर्जिकल तकनीक के सिद्धांतों को प्रस्तुत करते हैं जो खेती किए गए आरपीई के साथ सेल वाहक के प्रभावी सबरेटिनल प्रत्यारोपण के लिए अनुमति देता है। सर्जरी सामान्य संज्ञाहरण के तहत की गई थी और इसमें एक मानक लेंस-मुक्त तीन-पोर्ट पार्स प्लाना विट्रोक्टॉमी (पीपीवी), संतुलित नमक समाधान (बीएसएस) का सबरेटिनल अनुप्रयोग, 2.7 मिमी रेटिनोटॉमी, एक अतिरिक्त 3.0 मिमी स्क्लेरोटॉमी के माध्यम से सबरेटिनल स्पेस में एक नैनोफाइब्रोस सेल वाहक का आरोपण, द्रव-वायु विनिमय (फैक्स), सिलिकॉन तेल टैम्पोनैड, और सभी स्क्लेरोटोमी को बंद करना शामिल था। इस सर्जिकल दृष्टिकोण का उपयोग पिछले 8 वर्षों में 93.1% की सफलता दर के साथ 29 सर्जरी (18 जानवरों) में किया गया था। सर्जिकल प्लेसमेंट का शारीरिक सत्यापन विवो फंडस इमेजिंग (फंडस फोटोग्राफी और ऑप्टिकल समेकन टोमोग्राफी) में उपयोग करके किया गया था। मिनीपिग आंखों में एक वाहक पर आरपीई के सबरेटिनल प्रत्यारोपण के लिए अनुशंसित सर्जिकल चरणों का उपयोग भविष्य के प्रीक्लिनिकल अध्ययनों में बड़ी आंखों वाले पशु मॉडल का उपयोग करके किया जा सकता है।
Introduction
उम्र से संबंधित मैकुलर अपघटन (एएमडी) को विकसित देशों में केंद्रीय दृष्टि हानि का मुख्य कारण माना जाता है और यह रेटिना पिगमेंटेड एपिथेलियम (आरपीई) डिसफंक्शन 1,2 से संबंधित कई स्थितियों में से एक है। आरपीई बेसल रूप से स्थित ब्रुच की झिल्ली (बीएम) पर पाया जाता है और फोटोरिसेप्टर के लिए आवश्यक रखरखाव प्रदान करता है। आरपीई परत का प्रगतिशील अध: पतन एएमडी के शुरुआती एट्रोफिक रूप की एक पहचान है, और यह एएमडी के देर से बहिर्मुखी रूप के विकास के साथ भी है। रेटिना रोग चिकित्सा में कई प्रगति के बावजूद, एक प्रभावी उपचार पद्धति काविकास चुनौतीपूर्ण बना हुआ है। आशाजनक तरीकों में से एक इन विट्रो सुसंस्कृत आरपीई परत का उपयोग करके आरपीई प्रतिस्थापन है। यह उपचार मानव भ्रूण स्टेम सेल-व्युत्पन्न आरपीई (एचईएससी-आरपीई) और प्रेरित प्लुरिपोटेंट स्टेम सेल-व्युत्पन्न आरपीई (आईपीएससी-आरपीई) 3,4,5,6,7 का उपयोग करके स्टेम सेल अनुसंधान में प्रगति से जुड़ा हुआ है। हाल के वर्षों में, कई शोध समूहों ने आरपीई प्रतिस्थापन के लिए विभिन्न दृष्टिकोणों को विकसित करने पर ध्यान केंद्रित किया है, जिसमें शुरू में स्वीकृत प्रूफ-ऑफ-कॉन्सेप्ट 8,9,10,11,12,13,14,15 शामिल हैं। आरपीई कोशिकाओं (आरपीई) को आमतौर पर सेल सस्पेंशन, एक स्व-सहायक सेल शीट, या एक कृत्रिम वाहक 3,16,17,18,19,20,21 द्वारा समर्थित सेल मोनोलेयर के रूप में सबरेटिनल स्पेस में वितरित किया जाता है। सेल निलंबन का इंजेक्शन सबसे आसान तरीका है, लेकिन बीएम की समझौता की गई स्थिति अक्सर प्रत्यारोपित कोशिकाओं के लगाव को रोक सकती है। इसके परिणामस्वरूप आरपीई का गलत एपिकोबेसल अभिविन्यास हो सकता है और मोनोलेयर22,23 बनाने में विफलता हो सकती है। अन्य दो तरीकों (यानी, एक आत्म-सहायक सेल शीट और एक कृत्रिम सब्सट्रेट द्वारा समर्थित सेल मोनोलेयर) का मुख्य लाभ यह है कि कोशिकाएं पहले से ही एक विभेदित मोनोलेयर अवस्था में होती हैं जब सीधे सबरेटिनल स्पेस24 में प्रत्यारोपित किया जाता है।
सबरेटिनल स्पेस में सेल वाहक के वितरण का वर्णन करने वाली कई सर्जिकल तकनीकों को हालके वर्षों में 8,9,10,11,12,13,14,15 में प्रकाशित किया गया है। इन अध्ययनों ने बड़ी आंखों वाले पशु मॉडल, सेलुलर वाहक के प्रकार, प्रत्यारोपित सेलुलर संस्कृतियों के उपयोग, आरोपण उपकरणों, साथ ही शल्य चिकित्सा तकनीकों के उपयोग का वर्णन किया, और लेखकों ने मुख्य रूप से सबरेटिनल प्रत्यारोपण के परिणामों पर ध्यान केंद्रित किया। 2015 में, पोपेलका एट अल ने पोर्सिन कैडेवरआंखों में आरपीई के प्रत्यारोपण के लिए एक फ्रेम-समर्थित अल्ट्राथिन इलेक्ट्रोस्पन बहुलक झिल्ली के उपयोग की सूचना दी। सेल वाहक के सबरेटिनल आरोपण के साथ यहां वर्णित शल्य चिकित्सा तकनीक ने वाहक की अपेक्षाकृत सटीक हैंडलिंग और सबरेटिनल स्पेस में मचान की आसान स्थिति के लिए अनुमति दी। कोज़ाक एट अल ने पोर्सिनआंखों में 2 मिमी x 5 मिमी के अनुमानित आकार के साथ एक वाहक की वितरण तकनीक की व्यवहार्यता का आकलन किया। सेल वाहक के अद्वितीय डिजाइन ने इसके सही प्लेसमेंट की अनुमति दी, जिससे सेलुलर मोनोलेयर को फोल्ड होने और झुर्रियोंसे रोका जा सके। अल-नवैसेह एट अल ने पहलेखरगोशों में सबरेटिनल पाड़ प्रत्यारोपण के लिए विस्तृत चरण-दर-चरण दिशानिर्देश प्रस्तुत किए। स्टैनज़ेल एट अल ने 2019 में छोटे कृन्तकों, खरगोशों, सूअरों और गैर-मानव प्राइमेट्स26 में प्रत्यारोपण के लिए एक समान प्रोटोकॉल प्रकाशित किया। जैसा कि पहले प्रकाशित किया गया था, एक ठोस वाहक पर एक विभेदित और ध्रुवीकृत आरपीई मोनोलेयर के प्रत्यारोपण के परिणामस्वरूप अन्य वितरण तकनीकों की तुलना में ग्राफ्ट के बेहतर अस्तित्व और बेहतर एकीकरण में सुधार हुआ (पूरक फ़ाइल 1)27।
विवो में किए गए किसी भी प्रीक्लिनिकल पशु अध्ययन का उद्देश्य प्रक्रिया सुरक्षा, प्रत्यारोपित कोशिकाओं के अस्तित्व, सबरेटिनल पैंतरेबाज़ी के लिए ऊतक प्रतिक्रिया और अल्पकालिक और दीर्घकालिक पोस्टऑपरेटिव परिणामों पर ध्यान देने के साथ सेल वाहक के सर्जिकल ट्रांसविट्रल सबरेटिनल प्रत्यारोपण के विभिन्न पहलुओं को प्रकट करना है। एक बड़ी आंख वाले पशु मॉडल के रूप में पोर्सिन आंखों का उपयोग प्राप्त डेटा के दायरे के संदर्भ में प्रासंगिक बताया गया है, जो उपयोगी हो सकता है और संभावित रूप से मनुष्यों पर लागू हो सकता है10,11,14. हमारा अध्ययन एक बड़ी आंख वाले पशु मॉडल में सेल वाहक के विवो सबरेटिनल आरोपण के लिए उपयोग की जाने वाली शल्य चिकित्सा तकनीक की रिपोर्ट करता है। हम पिछले 8 वर्षों में हमारे अनुभव के आधार पर प्रीऑपरेटिव तैयारी, सबरेटिनल सेल वाहक प्रत्यारोपण की सर्जिकल तकनीक और मिनीपिग आंखों की पोस्टऑपरेटिव देखभाल का विस्तृत विवरण प्रस्तुत करते हैं। हम उन बुनियादी सर्जिकल सिद्धांतों का वर्णन करते हैं जिनका उपयोग विवो प्रयोगात्मक अध्ययनों में विभिन्न प्रकार की कोशिकाओं और सेल वाहक के आरोपण से जुड़े हो सकता है।
बड़े पशु मॉडल
लिबोव मिनीपिग्स के प्रयोगात्मक झुंड की स्थापना 1967 में संयुक्त राज्य अमेरिका से होर्मेल स्ट्रेन से पांच जानवरों को आयात करके की गई थी। इन जानवरों को कई अन्य नस्लों या उपभेदों के साथ पोर्सिन रक्त समूह के अध्ययन के लिए क्रॉसब्रीड किया गया था: लैंडरेस, लार्ज व्हाइट, कॉर्नवाल, वियतनामी सूअर, और गौटिंगेन मूल के लघु सूअर28,29। 5 महीने की उम्र में और लगभग 20 किलो शरीर का वजन (बीडब्ल्यू), मिनीपिग्स यौन परिपक्वता तक पहुंचते हैं। माता-पिता की मिनीपिग नस्लों (होर्मेल और गौटिंगेन) का अस्तित्व 12-20 साल बताया गया है। सेल वाहक का सबरेटिनल आरोपण रेटिना के केंद्रीय भाग को लक्षित करता है। मिनीपिग्स के रेटिना में मैक्यूला और फोवे की कमी होती है। हालांकि, इसमें अत्यधिक केंद्रित शंकु फोटोरिसेप्टर के क्षेत्र हैं जिन्हें क्षेत्र सेंट्रलिस और दृश्य लकीरें30,31 कहा जाता है। ये क्षेत्र उच्चतम दृश्य तीक्ष्णता के लिए जिम्मेदार हैं।
सर्जरी एक अनुभवी सर्जिकल सुविधा सहायक (टीए) की सहायता से चार अनुभवी विट्रियोरेटिनल सर्जनों द्वारा की गई थी। विवो प्रयोगों से पहले, सर्जनों को शिक्षित किया गया था और मिनीपिग आंख शरीर रचना विज्ञान का विशेष ज्ञान प्राप्त किया गया था, जैसे कि लेंस से विट्रस वॉल्यूम के कम अनुपात, छोटी अक्षीय लंबाई (15-19 मिमी), कॉर्निया में बोमन की झिल्ली की अनुपस्थिति, छोटी विट्रस मात्रा (2.8-3.2 एमएल), मैक्युला और फोवा की अनुपस्थिति, ज़िन के वार्षिकी की अनुपस्थिति, और ऑप्टिक डिस्क व्यास (ऊर्ध्वाधर / क्षैतिज: 1.5 मिमी / 2.1 मिमी)। सभी मामलों में, मानक सड़न रोकनेवाला और एंटीसेप्टिक उपायों के कार्यान्वयन के साथ एक विशेष रूप से संगठित ऑपरेटिंग रूम में सामान्य संज्ञाहरण के तहत सर्जरी की गई थी।
Protocol
यह अध्ययन हेलसिंकी की घोषणा के दिशानिर्देशों और मानव विषयों से जुड़े चिकित्सा अनुसंधान के लिए नैतिक सिद्धांतों के सिद्धांतों का पालन करता है। सभी प्रयोग प्रयोगशाला जानवरों की देखभाल और उपयोग के लिए दिशानिर्देशों के अनुसार और नेत्र और दृश्य अनुसंधान में जानवरों के उपयोग के लिए एसोसिएशन फॉर रिसर्च इन विजन एंड ओप्थाल्मोलॉजी (एआरवीओ) के अनुसार किए गए थे। अध्ययन प्रोटोकॉल को चेक एकेडमी ऑफ साइंसेज (लिबचोव, चेक गणराज्य) के पशु फिजियोलॉजी और जेनेटिक्स संस्थान में जानवरों पर प्रयोगों की परियोजनाओं की मंजूरी के लिए सीएएस के रिसॉर्ट प्रोफेशनल कमीशन द्वारा अनुमोदित किया गया था (अनुमोदित प्रोटोकॉल नंबर 60/2016 और नंबर 64/2019)।
1. मिनीपिग्स में एक वाहक पर कोशिकाओं के सबरेटिनल प्रत्यारोपण के दौरान विचार।
- पशु चयन
- लिब्चोव मिनीपिग्स प्राप्त करें और उपयोग करें जो 12-36 महीने के हैं, या तो सेक्स, और लगभग 40-80 किलोग्राम शरीर का वजन (बीडब्ल्यू)।
- मिनीपिग्स को 18-22 डिग्री सेल्सियस के बीच तापमान के साथ एक वातानुकूलित पशु घर में घर के अंदर रखें, कृत्रिम 13 घंटे / 11 घंटे प्रकाश / अंधेरे चक्र के संपर्क में, मानकीकृत व्यक्तिगत पेन, पानी तक मुफ्त पहुंच, और दो बार दैनिक भोजन।
- सर्जरी से पहले तैयारी
- आंख के सर्जिकल अभिविन्यास की जांच करें और फंडस योजनाओं को आकर्षित करें। ऐसा करने के लिए, योजनाबद्ध रूप से एक ऊर्ध्वाधर रेखा के साथ एक पेन का उपयोग करके फंडस ड्राइंग पर मिनीपिग्स के रेटिना को अस्थायी (ऑप्टिक डिस्क से कान की ओर), नाक (ऑप्टिक डिस्क से सुअर के स्नूट की ओर), और केंद्रीय (नाक की तरफ प्रमुख रेटिना वाहिकाओं के बीच) क्षेत्रों में विभाजित करें (चित्रा 1 ए, बी)।
- किसी भी व्यवहार और न्यूरोलॉजिकल विकृति के बिना और त्वचा, शरीर के छिद्र, मल और भोजन की खपत की सामान्य गुणवत्ता के साथ केवल स्वस्थ जानवरों का चयन करें। एक कुशल पशु चिकित्सक को नैदानिक अवलोकन करने और जानवरों का चयन करने दें।
- सर्जरी के दिन इंट्रामस्क्युलर रूप से 3 मिलीग्राम / किग्रा बीडब्ल्यू सेफ्टियोफर हाइड्रोक्लोराइड (1 एमएल / किलोग्राम) इंजेक्ट करें।
- प्रीऑपरेटिव इम्यूनोसप्रेशन।
- संशोधन के साथ वांग एट अल और सेवक एट अल 32,33 में वर्णित टैक्रोलिमस-एल्यूटिंग पॉलिमर माइक्रोसेफर्स तैयार करें।
- सुनिश्चित करें कि बहुलक माइक्रोसेफर्स में टैक्रोलिमस की एकाग्रता 51.3 मिलीग्राम / जी है जैसा कि एचपीएलसी (सामग्री की तालिका) द्वारा निर्धारित किया गया है।
- सेल ग्राफ्ट अस्वीकृति को रोकने के लिए आंखों की सर्जरी से 6 दिन पहले 0.25 मिलीग्राम / किग्रा बीडब्ल्यू की खुराक पर टैक्रोलिमस-लोडेड पॉलिमर माइक्रोसेफर्स का एक चमड़े के नीचे इंजेक्शन करें। यह मिनीपिग आंखों में ज़ेनोजेनिक प्रत्यारोपण के दौरान मानव आरपीई दाता कोशिकाओं के अस्तित्व को सुनिश्चित करने के लिए किया जाता है।
- सर्जरी के दिन जानवरों को इंट्रामस्क्युलर रूप से 80 मिलीग्राम डेपो-मेड्रोल और बेंज़िलपेनिसिलिन के साथ शरीर के वजन के अनुसार 1 एमएल / 10 किलोग्राम पर इंजेक्ट करें।
- संज्ञाहरण
- सर्जरी से पहले टिलेटामाइन (2 मिलीग्राम / किग्रा), ज़ोलाज़ेपम (2 मिलीग्राम / किग्रा), केटामाइन (2 मिलीग्राम / किग्रा), और ज़ाइलेज़िन (0.4 मिलीग्राम / किग्रा) -टीकेएक्स34,35 के मिश्रण के इंट्रामस्क्युलर इंजेक्शन के साथ सामान्य संज्ञाहरण को प्रेरित करें। बेहोशी की स्थिति से संज्ञाहरण की गहराई की जांच करें और पेडल रिफ्लेक्स (पिछले पैर की इंटरडिजिटल त्वचा की एक चुटकी), कॉर्नियल रिफ्लेक्स (कॉर्निया का थोड़ा सा स्पर्श), प्यूपिलरी रिफ्लेक्स (प्रकाश की प्रतिक्रिया), और पल्पेब्रल रिफ्लेक्स (पलक पर एक स्पर्श) की जांच करके। सुनिश्चित करें कि जानवर पलकें न झपकाए। हृदय और श्वसन दर नियमितता की पुष्टि करें।
- संज्ञाहरण के प्रेरण के बाद, बेहोश जानवर को लिफ्ट ट्रॉली (चित्रा 2 ए) पर ऑपरेटिंग रूम में ले जाएं।
- दाईं आंख पर सर्जरी को सक्षम करने के लिए जानवर को उसके बाईं ओर ऑपरेटिंग टेबल पर रखें (चित्रा 2 बी)।
- आरोपण के लिए केंद्रीय रेटिना की सबसे उपयुक्त स्थिति प्राप्त करने के लिए स्टायरोफोम पैड का उपयोग करके जानवर के सिर का समायोजन करें (यानी, क्षैतिज और फर्श के समानांतर) (चित्रा 2 सी)।
- स्थानीय संज्ञाहरण को प्रेरित करने के लिए नेत्रश्लेष्मला थैली में 0.5% प्रोपैराकेन हाइड्रोक्लोराइड नेत्र समाधान की आईड्रॉप को तीन बार 1 मिनट अलग रखें।
- एक नस प्रवेशनी डालें और रोगी मॉनिटर (चित्रा 2 ए, बी) से लैस संज्ञाहरण मशीन का उपयोग करके संज्ञाहरण (1.5% आइसोफ्लुरेन) के साँस लेने के रखरखाव के लिए एक एंडोट्राचेल ट्यूब के साथ जानवर को इंजेक्ट करें।
- आंखों की सर्जरी की शुरुआत से लगभग 15 मिनट पहले प्रति 16 किलोग्राम बीडब्ल्यू में 1 मिलीलीटर एफिकुर और 20 मिलीग्राम डेपो-मेड्रोल 1 का इंट्रामस्क्युलर इंजेक्शन दें (सामग्री की तालिका)।
- इज़ोटेर्मल पन्नी के साथ जानवर को कवर करके शारीरिक शरीर के तापमान को बनाए रखें और अनुभाग 3 में वर्णित सर्जरी करें।
- सर्जरी के दौरान, कान क्लिप और रोगी मॉनिटर का उपयोग करके हृदय गति और रक्त ऑक्सीजन संतृप्ति के साथ जानवर के तापमान की निगरानी करें। प्रक्रियाओं के दौरान शरीर के तापमान को 38 डिग्री सेल्सियस से कम करने से बचें, जिसे एक सुरक्षित सीमा36 माना जाता है। पूरे प्रयोग के दौरान ऑक्सीजन संतृप्ति (>96%) और पल्स दर (70-90 बीट प्रति मिनट) बनाए रखें।
- जब सर्जरी पूरी हो जाती है, तो आइसोफ्लुरेन के प्रवाह को बंद कर दें और जानवर को बाहर निकालें।
- सहज सांस लेने और जागने के बाद, जानवरों को उनके पेन में स्थानांतरित करें।
- ऑपरेटिंग रूम सेटअप
- बड़ी आंखों वाले पशु मॉडल (चित्रा 3 ए, बी) की आंखों पर सर्जरी की जरूरतों के अनुसार ऑपरेटिंग रूम की व्यवस्था करें। सुअर के स्नूट की स्थिति के संबंध में सर्जनों के लिए एक आरामदायक स्थिति प्राप्त करने के लिए, सर्जन की कुर्सियों की ऊंचाई, साथ ही माइक्रोस्कोप की ऊंचाई को समायोजित करें।
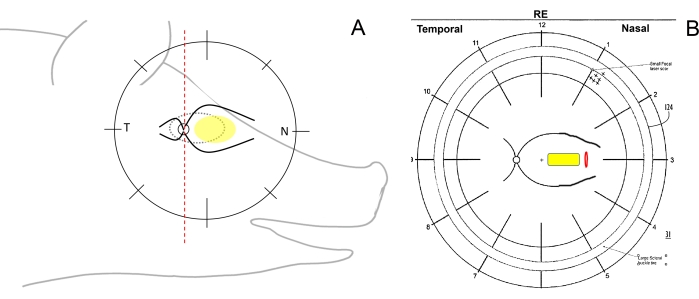
चित्र 1: मिनीपिग्स में रेटिना ज़ोन का योजनाबद्ध चित्रण। (ए) मिनीपिग के सिर के संबंध में रेटिना ज़ोन का योजनाबद्ध चित्रण; पीला दीर्घवृत्त सबरेटिनल आरोपण के वांछित क्षेत्र को दर्शाता है, टी अस्थायी रेटिना क्षेत्र को संदर्भित करता है, और एन नाक रेटिना क्षेत्र को संदर्भित करता है। (बी) रेटिनोटॉमी (लाल) के माध्यम से सेल वाहक (पीला) के सबरेटिनल प्रत्यारोपण के बाद फंडस योजना का उदाहरण। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
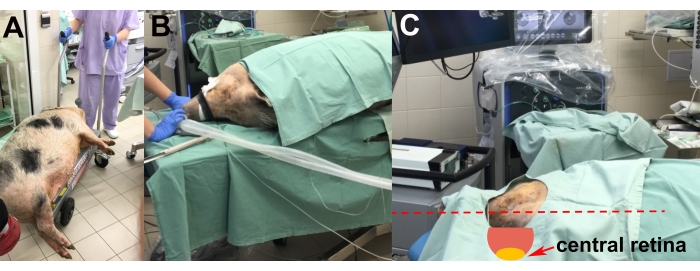
चित्र 2: पशु का परिवहन और प्लेसमेंट । (ए) बेहोश जानवर को ऑपरेटिंग रूम में ले जाना। (बी) इंटुबैशन के दौरान जानवर का प्लेसमेंट। (सी) सर्जरी (लाल तीर) के दौरान केंद्रीय रेटिना तक इष्टतम पहुंच के लिए जानवर के सिर का समायोजन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
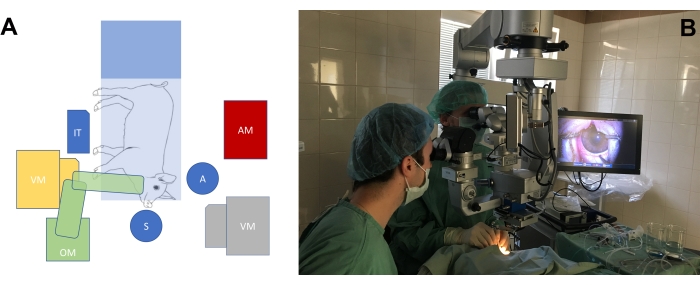
चित्र 3: मानक ऑपरेटिंग रूम सेटअप । (ए) मिनीपिग, ऑपरेटिंग माइक्रोस्कोप (ओएम), विट्रोक्टॉमी मशीन (वीएम), इंस्ट्रूमेंटल टेबल (आईटी), और एनेस्थिसियोलॉजी मशीन (एएम) के साथ ऑपरेटिंग टेबल की स्थिति के संबंध में सर्जनों की स्थिति (एस = सर्जन, ए = सहायक) का योजनाबद्ध चित्रण। विट्रोक्टॉमी मशीन (पीला और ग्रे) के दो संभावित स्थान हैं। (बी) ऑपरेटिंग रूम में वास्तविक जीवन सेटिंग। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
2. सेल वाहक, खेती की गई कोशिकाओं की संस्कृति, और आरोपण इंजेक्टर
- सेल वाहक
- 1.7 मिमी x 4.8 मिमी के बाहरी आयामों के साथ 30 μm चौड़े अंडाकार फ्रेम को काटें, जो फ्रेम (चित्रा 4 ए) पर स्थित त्रिकोणीय प्रोट्रूशियंस से लैस है, एक फेम्टोसेकंड लेजर का उपयोग करके द्वि-अक्षीय उन्मुख 36 μm मोटी पॉली-एथिलीन-टेरेफ्थेलेट (पीईटी) पन्नी से।
- पॉली (एल-लैक्टाइड-को-डीएल-लैक्टाइड) (एलएलए / डीएलए 90/10, एमडब्ल्यू 868, 270 ग्राम / मोल) बहुलक घोल को पाइरिडिन में 11 डब्ल्यूटी% की एकाग्रता पर तैयार करें, जिसमें प्रति 1 ग्राम घोल में 2.2 μL फॉर्मिक एसिड जोड़ा जाता है।
- तीन चरणों में बहुलक समाधान के इलेक्ट्रोस्पिनिंग द्वारा एक एम्बेडेड सहायक फ्रेम (चित्रा 4 बी) के साथ नैनोफाइब्रोस झिल्ली तैयार करें8: (1) सिलिकॉन सब्सट्रेट पर नैनोफाइबर की पहली परत जमा करें, (2) परत पर फ्रेम रखें, और (3) नैनोफाइबर की दूसरी परत जमा करें।
नोट: 3.7 μm की कुल झिल्ली मोटाई तक पहुंचने के लिए 7 मिनट के लिए हर परत जमा करें। 380 एनएम मोटी तंतुओं से बनी झिल्ली प्राप्त करने के लिए निम्नलिखित मापदंडों का उपयोग करें और 0.4 μm के औसत छिद्र आकार और लगभग 70% 37 की सरंध्रता के साथ: एक 20 ग्राम ऑल स्टील सुई, 7.1 kV का वोल्टेज, 10 सेमी का अंतर, 250 μL / min की प्रवाह दर, और 25.0 डिग्री सेल्सियस ± 0.5 डिग्री सेल्सियस का तापमान। - सिलिकॉन सब्सट्रेट से एम्बेडेड फ्रेम के साथ झिल्ली को सावधानीपूर्वक हटा दें और इसे कोशिकाओं के बीज और विकास की सुविधा के लिए मूल झिल्ली से रहित एक वाणिज्यिक 12 वेल सेल कल्चर के शरीर पर ठीक करें।
- प्लाज्मा क्लीनर में 70 वाट की शक्ति पर 30 सेकंड के लिए वायु-प्लाज्मा में सेल सीडिंग से पहले नैनोफाइब्रोस झिल्ली का इलाज करें।
- सेल वाहक पर खेती के लिए उपयोग की जाने वाली सेल संस्कृतियां।
नोट: निम्नलिखित सेल वाहक का उपयोग किया जा सकता है: 1) किसी भी कोशिका के बिना नैनोफाइब्रोस सेल वाहक; 2) प्राथमिक मानव आरपीई (एचआरपीई) के साथ नैनोफाइब्रोस सेल वाहक; 3) मानव आईपीएससी-व्युत्पन्न आरपीई कोशिकाओं के साथ नैनोफाइब्रोस सेल वाहक।- प्राथमिक एचआरपीई की खेती
- पहले बताई गई तकनीक38 के अनुसार मानव दाता आंखों से प्राथमिक एचआरपीई कोशिकाओं को अलग करें।
- 30 मिनट के लिए रेटिना के एंजाइमेटिक उपचार द्वारा कोशिकाओं को प्राप्त करें। फिर, डीएमईएम / एफ 12 में 2 सप्ताह तक प्राथमिक एचआरपीई कोशिकाओं (मार्ग 0) को 10% भ्रूण गोजातीय सीरम (एफबीएस) के साथ पूरक करें।
- एक बार जब सेल संस्कृतियां सामंजस्य तक पहुंच जाती हैं, तो अतिरिक्त 30 दिनों के लिए माध्यम को 1% एफबीएस और संस्कृति में बदल दें।
- प्राथमिक एचआरपीई को ट्रांस-वेल प्लेटों पर और 2,000 कोशिकाओं / मिमी2 के घनत्व पर एक लैमिनिन लेपित नैनोफाइब्रोस सेल वाहक पर बीज दें। 1% एफबीएस में इनक्यूबेशन के 30 दिनों के बाद, मिनीपिग्स में सबरेटिनल आरोपण के लिए प्राथमिक एचआरपीई के साथ सेल वाहक का उपयोग करें।
- मानव आईपीएससी-व्युत्पन्न आरपीई
- एमईआरटीके से जुड़े रेटिनाइटिस पिगमेंटोसा रोगी-व्युत्पन्न फाइब्रोब्लास्ट39 से प्राप्त HIPSC का उपयोग करें जो CRISPR / Cas9 सिस्टम (RP1-FiPS4F1-GC2)40 का उपयोग करके दो एलील्स में जीन-सही किए जाते हैं, साथ ही एक स्वस्थ विषय (Ctrl2-FiPS5F2)41 के फाइब्रोब्लास्ट ्स से प्राप्त HIPSC जो नियंत्रण के रूप में उपयोग किए जाते हैं।
- आरपीई कोशिकाओं (एचआईपीएससी-आरपीई) की ओर दोनों एचपीएससी सेल लाइनों को उत्पन्न करें और बाद में अंतर करें जैसा कि पहले42 बताया गया था।
- लेमिनिन-लेपित सेल कल्चर पर 200,000 कोशिकाओं/सेमी2 पर एचआईपीएस-आरपीई को प्लेट करें, जिसमें पॉली (एल-लैक्टाइड-को-डीएल-लैक्टाइड) के नैनोफाइब्रोस झिल्ली के साथ नॉकआउट डीएमईएम, 20% नॉकआउट सीरम, 0.1 एमएम गैर-आवश्यक अमीनो एसिड, 0.23 एमएम β-मर्कैप्टोइथेनॉल, 100 यू/एमएल पेनिसिलिन, 0.1 मिलीग्राम /
- हर दूसरे दिन माध्यम बदलें, और ध्रुवीकृत विकास को प्रोत्साहित करने के लिए आरोपण से 2 महीने पहले HIPSC-RPE को कल्चर करें।
- इम्प्लांटेशन इंजेक्टर
- 1.10 मिमी की प्लास्टिक ट्यूब से ब्लो मोल्डिंग करके 2.8 मिमी x 0.8 मिमी के आयताकार क्रॉस-सेक्शन के साथ एक प्लास्टिक केशिका तैयार करें।
- अंत से 6 मिमी प्लास्टिक केशिका में 4 मिमी x 2.2 मिमी की लोडिंग विंडो काटें।
- प्लास्टिक केशिका, एक सिलिकॉन हैंडल, एक स्टील ब्लेड प्लंजर और एक पिस्टन (चित्रा 5 ए) से इंजेक्टर को इकट्ठा करें।
- वाहक को लोडिंग विंडो के माध्यम से इंजेक्टर में लोड करें और बाद में इसे प्लंजर के धक्का द्वारा सबरेटिनल स्पेस में निकाल दें, जैसा कि चरण 3.5.2 (चित्रा 5 बी) में वर्णित है।
- नैनोफिब्रोस वाहक की तैयारी और इंजेक्टर की लोडिंग
- 2 एमएल फॉस्फेट-बफर्ड सेलाइन (पीबीएस) के साथ एक छोटा प्लास्टिक पेट्री डिश भरें। तैयार सेल परत के साथ एक सम्मिलित करें, इसे अर्ध-नरम पॉलीस्टाइनिन डिश पर रखें, और इसे प्रकाश माइक्रोस्कोप के नीचे केंद्रित करें। माइक्रोस्कोप का उपयोग करके अंडाकार फ्रेम के साथ वाहक को काटने के लिए एक कस्टम-संशोधित पंच का उपयोग करें। वाहक आयाम 2 मिमी x 5 मिमी होना चाहिए।
- वाहक को लोड करने के लिए फ्लैट पारदर्शी टयूबिंग के साथ एक कस्टम-निर्मित इंजेक्टर का उपयोग करें; केशिका के बाहर के छोर से 6 मिमी, वाहक को लोड करने के लिए एक खिड़की है। पीबीएस के साथ इंजेक्टर की खिड़की भरें।
- फोर्सप्स का उपयोग करके, डिश के नीचे से नमूना जारी करें, इसे तरल से उठाएं, और अनुयायी कोशिकाओं के साथ वाहक के शीर्ष पक्ष का पता लगाने के लिए पहले फ्रेम पर साइड ओरिएंटेशन निशान की जांच करते हुए इसे इंजेक्टर की खिड़की तक ले जाएं। एक अंडाकार फ्रेम वाहक के साथ हेरफेर की सुविधा प्रदान करता है।
- एक दंत जांच (तेज अंत के साथ एक स्टेनलेस स्टील दंत उपकरण) का उपयोग करके, इंजेक्टर की खिड़की में वाहक को रखें। इंजेक्टर के बंद और सुरक्षित ऊपरी हिस्से में वाहक को धक्का देने के लिए प्लंजर का उपयोग करें। फिर, सर्जरी के लिए वाहक तैयार करें।
- प्रत्येक चरण में वाहक के साइड ओरिएंटेशन की जांच करें। मेटल प्लंजर को धक्का देकर इंजेक्टर से नैनोफिब्रोस वाहक को अनलोड करें।

चित्रा 4: एक एम्बेडेड सहायक पीईटी फ्रेम के साथ नैनोफाइब्रोस वाहक । (ए) फ्रेम पर तीन दृश्यमान निशान वाहक (सफेद तीर) के साइड ओरिएंटेशन के नियंत्रण की अनुमति देते हैं। (बी) सेल वाहक के नैनोफाइब्रोस झिल्ली (सफेद तीर) में एम्बेडेड पीईटी फ्रेम टुकड़े का इज़ाफ़ा दृश्य। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.

चित्र 5: आरोपण इंजेक्टर । (ए) इंजेक्टर के हिस्से। (बी) एम्बेडेड सहायक पीईटी फ्रेम के साथ नैनोफाइब्रोस सेल वाहक आरोपण इंजेक्टर के प्लास्टिक आयताकार केशिका से भरा हुआ है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
3. शल्य चिकित्सा प्रक्रिया
- शल्य चिकित्सा उपकरण
- निम्नलिखित सर्जिकल उपकरणों का उपयोग करें: एक नेत्र शल्य चिकित्सा माइक्रोस्कोप, पूर्ववर्ती और पीछे की आंख खंडों पर सर्जरी के लिए एक ऑपरेटिंग सिस्टम, एक गैर-संपर्क विट्रोरेटिनल सर्जिकल सिस्टम, एक लेजर फोटोकॉगुलेशन डिवाइस और एक डिजिटल कैमरा।
नोट: विट्रोक्टॉमी, एक्सो- और एंडो-कॉटरी, और लेजर फोटोकॉगुलेशन उपकरण में उपयोग किए जाने वाले मानक मापदंडों को तालिका 1 में दर्शाया गया है।
- निम्नलिखित सर्जिकल उपकरणों का उपयोग करें: एक नेत्र शल्य चिकित्सा माइक्रोस्कोप, पूर्ववर्ती और पीछे की आंख खंडों पर सर्जरी के लिए एक ऑपरेटिंग सिस्टम, एक गैर-संपर्क विट्रोरेटिनल सर्जिकल सिस्टम, एक लेजर फोटोकॉगुलेशन डिवाइस और एक डिजिटल कैमरा।
- शल्य चिकित्सा उपकरण
- एक मानक प्रोटोकॉल के अनुसार मोबाइल आटोक्लेव स्टीम स्टरलाइज़र या इसी तरह के साथ पुन: प्रयोज्य सर्जिकल उपकरणों को स्टरलाइज़ करें। सर्जरी के दौरान आवश्यक एकल-उपयोग वाले सर्जिकल उपकरण और सामग्री सामग्री की तालिका में सूचीबद्ध हैं।
- सर्जिकल चरणों के लिए तैयारी
- चरण 1.4.1 में वर्णित जानवर को एनेस्थेटाइज करने के बाद, दवा-प्रेरित मायड्रियासिस को उत्तेजित करने के लिए प्रक्रिया से 15 मिनट पहले नेत्रश्लेष्मला थैली में 1% ट्रॉपिकामाइड समाधान आई ड्रॉप और 10% फेनिलफ्राइन हाइड्रोक्लोराइड समाधान लागू करें।
- ऊपरी स्थिति में सर्जन और साइड स्थिति में सहायक के साथ ऑपरेटिंग टेबल पर जाएं (चित्रा 3)।
- एकल-उपयोग शेविंग रेजर का उपयोग करके आंख के आसपास के क्षेत्र को शेव करें और खुरदरी गंदगी को हटा दें।
- 5 मिनट के लिए 5% पोविडोन-आयोडीन समाधान के साथ नेत्रश्लेष्मला थैली कीटाणुरहित करें।
- पलकों से परिधि तक स्क्रब करके कपास के फाहे के साथ पेरिऑर्बिटल क्षेत्र को कीटाणुरहित करें। 10% पोविडोन-आयोडीन समाधान का उपयोग करके प्रक्रिया को तीन बार दोहराएं और 5 मिनट के लिए छोड़ दें।
- चिपचिपा पारदर्शी पन्नी के साथ एक मानक बाँझ नेत्र आवरण का उपयोग करके बीच में आंख के साथ ऑपरेटिंग क्षेत्र को कवर करें। पलकों को आंखों के ग्लोब से दूर ले जाएं। पोस्टऑपरेटिव एंडोफथाल्मिटिस के जोखिम को कम करने के लिए पलकें काटने से बचें।
- ढक्कन स्पेकुलम (लिबरमैन-प्रकार या कुक आई स्पेकुलम) डालें। वैकल्पिक रूप से, 8-0 के साथ त्वचा पर निकोटिटेटिंग झिल्ली को ठीक करें। पॉलीग्लाक्टिन सीवन।
- सर्जिकल फोर्सप्स और वेस्टकोट कंजंक्टिवल कैंची का उपयोग करके स्क्लेरोटोमी के लिए स्क्लेरोटोमी के लिए स्क्लेरा को उजागर करने के लिए लिम्बस से नाक की तरफ 2 मिमी से 3 मिमी तक नेत्रश्लेष्मला खोलें।
- तीन वाल्व वाले 25 ग्राम ट्रोकार्स को लिम्बस से 2.5-3 मिमी को पार्स प्लाना के क्षेत्र में डालें (उन्हें 7 बजे, 10 बजे और 11 बजे रखें)। सम्मिलन के दौरान पीछे के रेटिना की ओर थोड़ा तिरछा तरीके (100 ° -110 °) में घूर्णन आंदोलनों का उपयोग करें और ट्रोकर को बल के साथ पकड़ें (चित्र 6)।
- आसमाटिक कॉर्नियल एडिमा को रोकने के लिए पूरी सर्जरी के दौरान कॉर्निया को गीला रखें या मिथाइलसेल्यूलोज के साथ कोट करें।
- पार्स प्लाना विट्रोक्टॉमी (पीपीवी)
- मानक तीन-पोर्ट पार्स प्लाना विट्रोक्टॉमी दृष्टिकोण के साथ विट्रस शरीर के मध्य भाग को हटा दें। भविष्य के बड़े स्क्लेरोटॉमी के क्षेत्र में लेंस के पीछे के विट्रस को ध्यान से हटा दें।
- एक नियंत्रित पश्चवर्ती विट्रस डिटेचमेंट करने के लिए पश्चवर्ती विट्रस को दागने के लिए 2-4 मिलीग्राम ट्रायमसिनोलोन एसीटोनाइड (टीए) इंजेक्शन (50-100 μL) का उपयोग करें, जो आमतौर पर रेटिना के अनुरूप रहता है।
- उसके बाद, धीरे-धीरे 41 ग्राम कैनुला के साथ बीएसएस के 0.05-0.1 एमएल का सबरेटिनल इंजेक्शन करें, परिधि की ओर एक ब्लीब के गठन से बचें।
- क्षणिक रेटिना संवहनी रोड़ा को रोकने के लिए सबरेटिनल इंजेक्शन के दौरान सिंचाई प्रणाली के साथ इंट्राओकुलर दबाव सेटिंग्स को 15 मिमीएचजी तक कम करें।
- नाक के ब्लीब बेस के पास 27 जी एंडोडायथर्मी प्रोब 3 मिमी के साथ रेटिना का एक रैखिक बड़ा एंडोडायथर्मी करें।
- बाद में, 25 ग्राम एमवीआर ब्लेड या ऊर्ध्वाधर कैंची के साथ 3 मिमी बड़ा रेटिनोटॉमी बनाएं, जिसमें 3 मिनट से 5 मिनट के लिए 60 मिमीएचजी तक सिंचाई प्रणाली की एक ऊंचा इंट्राओकुलर दबाव (आईओपी) सेटिंग हो। सुनिश्चित करें कि रेटिनोटॉमी से कोई रक्तस्राव नहीं है, और फिर आईओपी को 25 मिमीएचजी तक कम करें।
- श्वेतपटल की सतह पर एक कोमल स्पर्श लागू करके 27 ग्राम एंडोडायथर्मी जांच के साथ लिम्बस से 2.5-3 मिमी दो नाक ट्रोकार्स के बीच एपिस्क्लेरल वाहिकाओं का एक्सोडिएथर्मी करें।
- स्क्लेरोटॉमी को बढ़ाने से पहले जलसेक बोतल के द्रव स्तर की जांच करें, क्योंकि स्क्लेरोटॉमी वृद्धि के बाद, तरल पदार्थ की खपत अस्थायी रूप से अधिक होती है।
- 2.75 मिमी फाको चाकू का उपयोग करके लिम्बस से 3 मिमी बड़ा स्क्लेरोटॉमी बनाएं।
- बड़े स्क्लेरोटॉमी के अंदर स्क्लरल वाहिकाओं और सिलिअरी शरीर से संभावित रक्तस्राव पर ध्यान दें। रक्तस्राव के मामले में, क्षतिग्रस्त वाहिकाओं को जमा करने के लिए 27 ग्राम एंडोडायथर्मी जांच का उपयोग करें। इंजेक्टर (0.8 मिमी x 2.8 मिमी) की नोक को समायोजित करने के लिए साटन चाकू के साथ स्क्लेरोटॉमी को 3.0 मिमी तक बढ़ाएं।
- एक विट्रेक्टर के साथ बड़े स्क्लेरोटॉमी की साइट पर प्रोलैप्स ्ड विट्रस बॉडी को हटा दें। ग्लोब पतन से बचने के लिए विट्रोक्टॉमी प्रणाली के साथ 25-30 मिमीएचजी के स्तर पर बीएसएस के जलसेक को बनाए रखें।
- सेल वाहक का आरोपण।
- धीरे से इंजेक्टर को प्रमुख हाथ से बड़े स्क्लेरोटॉमी के माध्यम से विट्रस गुहा में डालें। प्रतिरोध के मामले में, स्क्लेरोटॉमी के आकार को बढ़ाएं।
- रेटिनोटॉमी के माध्यम से सेल वाहक को सबरेटिनल स्पेस में प्रत्यारोपित करें। यदि आवश्यक हो, तो आरोपण के नियंत्रण में सुधार के लिए अतिरिक्त स्क्लेरोटॉमी और झूमर प्रकाश के साथ एक बाइमैनुअल तकनीक का उपयोग करें।
- इंजेक्टर को आंख से वापस लें और 8-0 के साथ बड़े स्क्लेरोटॉमी को बंद करें। इंट्राओकुलर हाइपोटोनी से जुड़ी जटिलताओं से बचने के लिए पॉलीग्लाक्टिन सीवन।
- सिलिकॉन-टिंप ्ड कैनुला के साथ सबरेटिनल द्रव का एक पूर्ण द्रव-वायु विनिमय (फैक्स) और जल निकासी करें।
- उसके बाद, आईओपी सामान्य होने तक सिलिकॉन तेल इंजेक्शन के लिए विट्रोक्टॉमी सिस्टम और ट्यूबिंग सिस्टम का उपयोग करके विट्रस कैविटी में सिलिकॉन तेल (1,000 सीएसटी) इंजेक्ट करें।
- इंट्राऑपरेटिव इमेजिंग और प्रलेखन
- वीडियो रिकॉर्डिंग सिस्टम का उपयोग करके आरोपण के प्रमुख चरणों के फोटो प्रलेखन के साथ पूरी सर्जरी के दौरान एक वीडियो रिकॉर्डिंग करें।
- स्क्लेरोटोमी, रेटिनोटॉमी, सबरेटिनल इम्प्लांट और फंडस ड्राइंग स्कीमा का उपयोग करके होने वाली किसी भी जटिलता के स्थान का दस्तावेजीकरण करके फंडस ड्राइंग को पूरा करें।
- सर्जरी के बाद के कदम
- सर्जरी के अंत में, ट्रोकार्स को हटा दें और 8-0 के साथ तीन स्क्लेरोडोमी और नेत्रश्लेष्मला को बंद करें। पॉलीग्लाक्टिन सीवन।
- नेत्रश्लेष्मला थैली को 5% पोविडोन-आयोडीन घोल से धो लें।
- 20 मिलीग्राम जेंटामाइसिन, 2 मिलीग्राम डेक्सामेथासोन और 2% जाइलोकेन का 0.3 एमएल सबकंजंक्टिवल इंजेक्शन करें।
- एक सूक्ष्म दृश्य का उपयोग करके फंडस और लेंस की स्थिति की जांच करें।
- सर्जिकल फोर्सेस और वेस्टकोट कंजंक्टिवल कैंची (वैकल्पिक) का उपयोग करके निकोटिटेटिंग झिल्ली से सीवन (ओं) को हटा दें।
- नेत्रश्लेष्मला थैली में नियोमाइसिन मरहम या ओफ्लोक्सासिन नेत्र मरहम लागू करें।
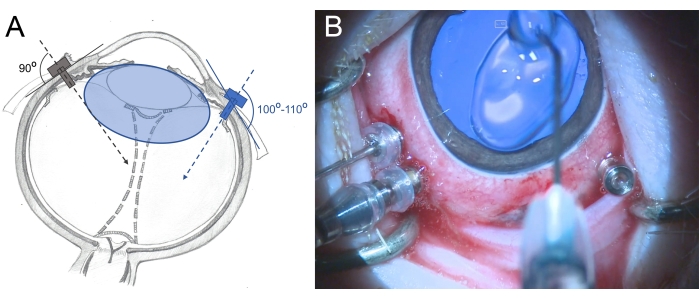
चित्र 6: एक मिनीपिग की आंख में ट्रोकार्स का सम्मिलन। (ए) ट्रोकार्स का योजनाबद्ध चित्रण, जो लेंस को नुकसान से बचाने के लिए मानव आंख (ग्रे रंग) में विट्रियस गुहा के केंद्र की ओर श्वेतपटल में लंबवत रूप से और मिनीपिग आंख (नीले रंग) में पीछे के रेटिना की ओर तिरछे तरीके से डाला जाता है। मिनीपिग (नीले रंग का) का लेंस मनुष्यों की तुलना में बड़ा होता है और विट्रस गुहा आकार के सापेक्ष होता है। (बी) तीन-पोर्ट पीपीवी में सम्मिलित ट्रोकार्स का इंट्राऑपरेटिव दृश्य। सुखाने और सूजन को रोकने के लिए कॉर्निया को मिथाइलसेल्यूलोज के साथ कवर किया जाता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
4. पोस्टऑपरेटिव देखभाल
- हाइड्रोकार्टिसोन एसीटेट/नियोमाइसिन सल्फेट या 0.3% लोक्सासिन को प्रति दिन पांच बार जानवरों के नेत्रश्लेष्मला थैली में सामयिक बेसिट्रासिन जिंक / हाइड्रोकार्टिसोन एसीटेट / नियोमाइसिन सल्फेट या 0.3% लागू करें।
- पोस्टऑपरेटिव रूप से, निम्नलिखित आंखों के मापदंडों की जांच करें: धड़कन का उपयोग करके आंख के नरम ऊतकों का झुकाव, आंख की सतह पर भड़काऊ प्रतिक्रिया, और हाथ से पकड़े गए स्लिट लैंप या अप्रत्यक्ष ऑप्थेल्मोस्कोप का उपयोग करके पलकों की सुरक्षात्मक प्रतिक्रिया के रूप में स्क्विंटिंग।
- प्रणालीगत पोस्टऑपरेटिव देखभाल के लिए, निम्नलिखित एंटीबायोटिक दवाओं का उपयोग करें:
- स्थिरता के दूसरे और तीसरे दिन 3 मिलीग्राम / किग्रा बीडब्ल्यू (1 एमएल / किलोग्राम) की खुराक पर इंट्रामस्क्युलर रूप से सेफ्टियोफर हाइड्रोक्लोराइड इंजेक्ट करें।
- द्वितीयक जीवाणु संक्रमण की रोकथाम के लिए सर्जरी के बाद 72 घंटे के बाद ट्यूलाथ्रोमाइसिन (1 एमएल / 40 किलोग्राम बीडब्ल्यू) इंजेक्ट करें।
- दर्द को रोकने के लिए सर्जरी के बाद 3 दिनों के लिए हर 24 घंटे में फ्लुनिक्सिन (2 एमएल / 45 किलोग्राम जीवित वजन) और ट्रामाडोल हाइड्रोक्लोराइड (100 मिलीग्राम) का इंट्रामस्क्युलर इंजेक्शन करें।
- मिनीपिग्स को 18-22 डिग्री सेल्सियस की तापमान सीमा और कृत्रिम 13 घंटे / 11 घंटे प्रकाश / अंधेरे शासन के साथ एक विशेष वातानुकूलित सुविधा में रखें।
- सुनिश्चित करें कि उनके पास पानी और मानक भोजन (प्रति दिन दो बार) तक मुफ्त पहुंच है।
5. पोस्टऑपरेटिव प्रक्रियाएं
- पोस्टऑपरेटिव नेत्र परीक्षाएं
- पोस्टऑपरेटिव अवधि में, सूजन की उपस्थिति के लिए अप्रत्यक्ष नेत्रकोस्कोप के साथ आंखों का निरीक्षण करें (यानी, लालिमा, ऊतक सूजन, या नेत्रश्लेष्मला थैली में बलगम जमाव)। पैल्पेशन विधि का उपयोग करके संचालित आंख में इंट्राओकुलर दबाव को मापें।
- पोस्टऑपरेटिव इमेजिंग
- फंडस फोटोग्राफी और ओसीटी परीक्षा से पहले टीकेएक्स मिश्रण के इंट्रामस्क्युलर इंजेक्शन द्वारा मिनीपिग में बेहोश करने की क्रिया को प्रेरित करें। माइड्रियासिस को प्रेरित करने के लिए मिनीपिग की नेत्रश्लेष्मला थैली में 1% ट्रॉपिकामाइड और 10% फेनिलफ्राइन हाइड्रोक्लोराइड आई ड्रॉप ्स डालें।
- खुली आंखों को बनाए रखने के लिए ढक्कन स्पेकुलम का उपयोग करें। आंखों की सतह को मॉइस्चराइज करने के लिए और एक स्पष्ट ओसीटी छवि प्राप्त करने के लिए, जानवर के कॉर्निया को हर 30-60 सेकंड में नमकीन घोल (0.9% एनएसीएल) से धोएं।
- ऑपरेशन के दौरान ऑपरेटिंग टेबल पर मिनीपिग को उसी तरह से रखें (चित्रा 2 बी, सी, चित्रा 3 ए)। मुख्य आवश्यकता सिर को साइड पर और ओसीटी डिवाइस के स्कैनिंग टुकड़े के लंबवत रखना है। सिर को स्थिर करने के लिए जानवर के स्नूट के नीचे स्टायरोफोम पैड का उपयोग करें, जिससे आंख की सतह क्षैतिज स्थिति में आ जाए।
- एक रंग गैर-माइड्रिएटिक फंडस कैमरे के साथ रंगीन फंडस छवियों को एकत्र करें, क्योंकि यह पूर्वकाल खंड, रेटिना और ऑप्टिक डिस्क का दस्तावेजीकरण करने की अनुमति देता है। इसके अतिरिक्त, गैर-माइड्रियाटिक फंडस कैमरे के साथ रेटिना की लाल-मुक्त छवि लें।
- वर्णक्रमीय-डोमेन ओसीटी प्रणाली का उपयोग करके ऑप्टिकल समेकन टोमोग्राफी इमेजिंग करें। ओसीटी या फंडस इमेजिंग के दौरान, पीछे के रेटिना के दृश्य और आरोपण के क्षेत्र को अनुकूलित करने के लिए मिनीपिग के सिर को मैन्युअल रूप से ओसीटी लेंस या फंडस कैमरा लेंस की ओर झुकाएं (चित्रा 2 सी)। फंडस पर प्रत्यारोपित वाहक की इष्टतम इमेजिंग के लिए, इम्प्लांट पर ध्यान केंद्रित करने के लिए ओसीटी डिवाइस के अवरक्त परावर्तनीयता प्रकाश को लागू करें (चित्रा 2 सी)। OCT क्रॉसलाइन और रेटिना मैप स्कैनिंग मोड का उपयोग करें।
- पशु की आंख के ढक्कन के नीचे परीक्षा के अंत में ओफ्लोक्सासिन नेत्र मरहम लागू करें।
- मिनीपिग को इनडोर सुविधा में ले जाएं और बेहोशी के अंत तक इसकी सामान्य स्थिति का निरीक्षण करें (लगभग 2 घंटे से 5 घंटे)।
6. इच्छामृत्यु के बाद आंख के पोस्टमार्टम का न्यूक्लियेशन
- टीकेएक्स मिश्रण के इंट्रामस्क्युलर इंजेक्शन के साथ मिनीपिग्स को अलग करें, इसके बाद 1% प्रोपोफोल (20 एमएल / जानवर) के अंतःशिरा (22-जी कान प्रवेशनी के माध्यम से) बोलस आवेदन किया जाता है। सामान्य फिक्सेटिव का उपयोग न करें।
- सेल ग्राफ्ट प्रत्यारोपण के 7 दिन, 14 दिन, 28 दिन और 42 दिन बाद गहरे सामान्य संज्ञाहरण के दौरान एक्सेंग्यूनेशन द्वारा जानवरों की बलि दें।
- ऊपरी और निचले आंख के ढक्कन को हटाने के लिए बल और कैंची का उपयोग करें। तीसरी आंख के ढक्कन को हटा दें और नेत्रश्लेष्मला के माध्यम से काट लें। आंख की मांसपेशियों और ऑप्टिक तंत्रिका को काटें।
- सर्जिकल कैंची और सर्जिकल फोर्सप्स का उपयोग करके आंखों के पोस्टमार्टम को एन्यूक्लिएट करें। सुनिश्चित करें कि प्रक्रिया एक अनुभवी व्यक्ति द्वारा की जाती है।
Representative Results
लिबोव मिनीपिग्स में सेल वाहक के सबरेटिनल आरोपण के परिणाम टीएबल 2 में प्रस्तुत किए गए हैं। सफल आरोपण को हिस्टोलॉजिकल और इम्यूनोहिस्टोकेमिकल अध्ययन के लिए पर्याप्त डेटा प्राप्त करने के रूप में परिभाषित किया गया था। असफल मामलों को गंभीर इंट्राऑपरेटिव जटिलताओं के साथ आंखों के रूप में परिभाषित किया गया था, जिसने आंखों के ऊतकों के आगे के अवलोकन को असंभव बना दिया।
सिलिकॉन तेल टैम्पोनैड के उपयोग के साथ प्रस्तावित तकनीक का अनुप्रयोग सर्जरी के अगले दिन से न्यूक्लियेशन के समय तक इमेजिंग तौर-तरीकों का उपयोग करके सबरेटिनल प्रत्यारोपण की स्थिति को नियंत्रित करने की अनुमति देता है (चित्रा 7, चित्रा 8, और चित्रा 9)।
फंडस इमेजिंग और एसडी-ओसीटी।
फंडस इमेजिंग, रेड-फ्री इमेजिंग और स्पेक्ट्रल डोमेन ऑप्टिकल सुसंगत टोमोग्राफी (चित्रा 7) का उपयोग करके पोस्टऑपरेटिव अवधि में मिनीपिग्स की जांच की गई थी। स्पष्ट ऑप्टिक मीडिया का उपयोग करके उच्च गुणवत्ता वाले फंडस इमेजिंग को सक्षम किया गया था, जिसमें एक स्पष्ट लेंस और सिलिकॉन तेल टैम्पोनैड (चित्रा 7 ए) का उपयोग शामिल था। रेटिनोटॉमी की साइट ने प्रोलिफेरेटिव प्रतिक्रिया (चित्रा 7 ए, पीले तीर) का कोई संकेत नहीं दिखाया, और सेल वाहक का पीटीई फ्रेम पोर्सिन रेटिना की अर्ध-पारदर्शी परतों के माध्यम से स्पष्ट रूप से दिखाई दे रहा था। लाल-मुक्त इमेजिंग पर, वाहक पर खेती किए गए एचआरपीई की परावर्तकता अंतर्जात पोर्सिन आरपीई परत (चित्रा 7 बी) की परावर्तकता से भिन्न नहीं थी। एसडी-ओसीटी पर, पीटीई फ्रेम ने अंतर्निहित शारीरिक संरचनाओं की केवल मामूली छाया और रेटिना के मामूली मोटा होने का कारण बना (चित्रा 7 सी, लाल तीर)। एसडी-ओसीटी पर कोई एटिपिकल हाइपो- या हाइपर-रिफ्लेक्टिव ज़ोन नहीं देखा गया था, और ब्रुच की झिल्ली भी क्षतिग्रस्त नहीं हुई थी। चित्रा 8 सर्जरी के 1 महीने बाद प्राथमिक मानव आरपीई कोशिकाओं के साथ खेती की गई मचान की फंडस और आईओसीटी छवियों को प्रस्तुत करता है (चित्रा 8)। सेल वाहक स्वयं (किसी भी कोशिका के बिना) रेटिना मोटाई में कोई महत्वपूर्ण वृद्धि नहीं हुई (चित्रा 9 सी)। इन निष्कर्षों से पता चलता है कि इम्प्लांट का इंट्राऑपरेटिव आयट्रोजेनिक प्रभाव न्यूनतम था और प्रत्यारोपित सेल वाहक ने प्रत्यारोपित कोशिकाओं को फोटोरिसेप्टर कोशिकाओं और न्यूरोरेटिनल ऊतक के लिए पर्याप्त अनुकूलन किया।
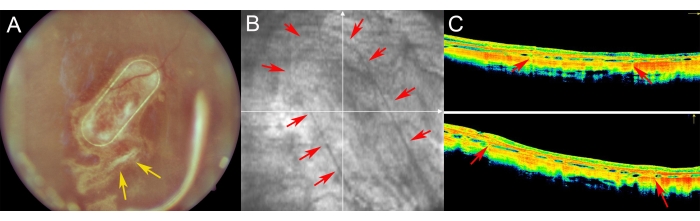
चित्रा 7: मिनीपिग्स में रेटिना की पोस्टऑपरेटिव इमेजिंग। (ए) फंडस इमेजिंग, (बी) रेड-फ्री इमेजिंग, और (सी) एक मिनीपिग आंख में सबरेटिनल प्रत्यारोपण के बाद 1 सप्ताह के फॉलो-अप में प्राथमिक मानव आरपीई कोशिकाओं के साथ नैनोफिब्रोस वाहक की ऑप्टिकल समेकन टोमोग्राफी इमेजिंग। (ए) पीले तीर रेटिनोटॉमी की साइट को इंगित करते हैं। (बी) लाल तीर नैनोफाइब्रोस सेल वाहक के मार्जिन को प्रदर्शित करते हैं। (सी) लाल तीर नैनोफाइब्रोस वाहक के सहायक पीईटी फ्रेम के कारण ओसीटी सिग्नल की मामूली छाया दिखाते हैं, जिसे सबरेटिनल स्पेस में प्रत्यारोपित किया गया था। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
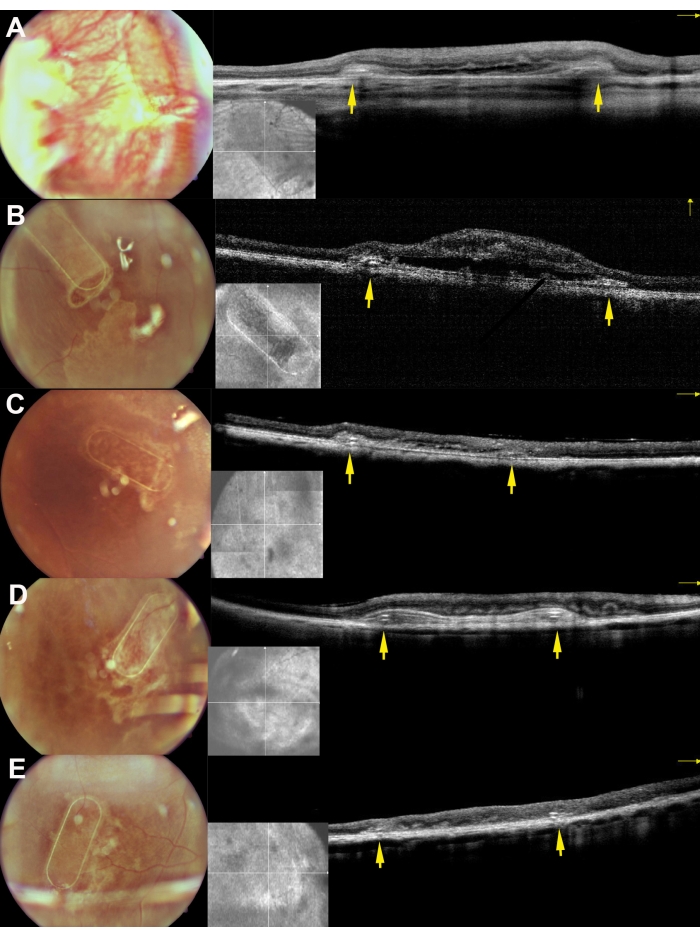
चित्रा 8: मिनिपिग्स में सबरेटिनल प्रत्यारोपण के 30 दिन बाद मचानों की फंडस इमेजिंग और आईओसीटी छवियां। ए, बी, सी, डी, और ई क्रमशः सूअरों 169, 182, 179, 199 और 224 के अनुरूप हैं। पीले तीर मचान के फ्रेम को दर्शाते हैं। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
हिस्टोलॉजिकल और इम्यूनोहिस्टोकेमिकल विश्लेषण
जानवरों की इच्छामृत्यु के बाद, पूरे मिनीपिग आंखों को हटा दिया गया और 24 घंटे के लिए 4% पैराफॉर्मलडिहाइड (पीएफए) में तय किया गया। आंख के पूर्ववर्ती भाग को हटा दिया गया था, और प्रत्यारोपित नैनोफाइब्रोस वाहक को नाक के केंद्रीय रेटिना में पहचाना गया था और श्वेतपटल के साथ अलग किया गया था। सभी ऊतकों को वर्गीकृत सुक्रोज समाधानों में क्रायोप्रोटेक्टेड किया गया था, और ऊर्ध्वाधर जमे हुए वर्गों को काट दिया गया था, जैसा कि विस्तार से वर्णितहै। प्रत्यारोपण के 4 सप्ताह के बाद आरपीई कोशिकाओं के बिना नैनोफाइब्रोस झिल्ली की हिस्टोलॉजी ने सूजन और अपक्षयी परिवर्तनों के बिना रेटिना का खुलासा किया (चित्रा 9 ए)। ध्रुवीकृत प्रकाश में नैनोफाइब्रोस झिल्ली की उपस्थिति का पता चला (चित्रा 9 बी)।
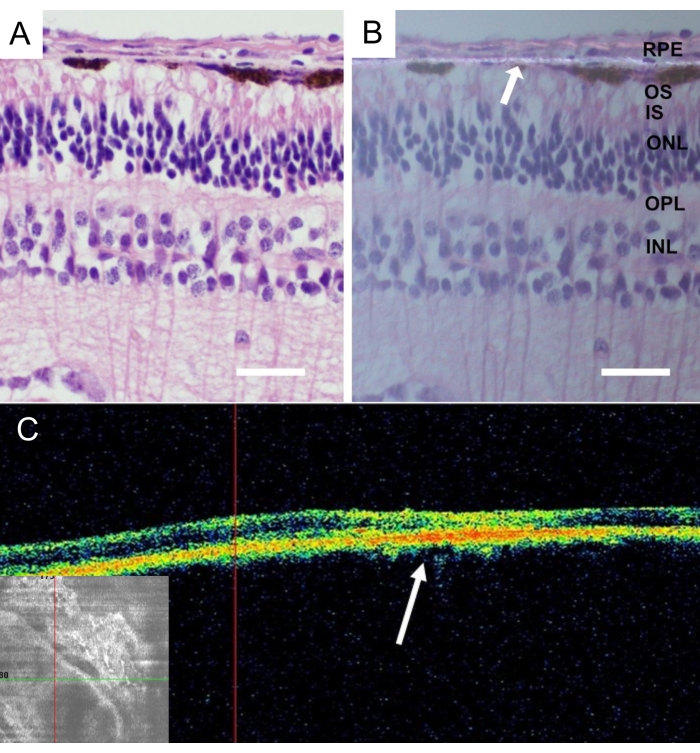
चित्रा 9: प्रत्यारोपित एककोशिकीय नैनोफाइब्रोस झिल्ली का हिस्टोलॉजिकल विश्लेषण। मानक रोशनी के साथ आरोपण (ए) और ध्रुवीकृत प्रकाश माइक्रोस्कोपी के साथ (बी) के 4 सप्ताह बाद एककोशिकीय नैनोफाइब्रोस झिल्ली का हेमटोक्सिलिन-ईओसिन धुंधला होना। सफेद तीर नैनोफाइब्रोस झिल्ली स्थानीयकरण (स्केल बार: 50 μm) को इंगित करता है। (सी) विवो ऑप्टिकल समेकन टोमोग्राफी में प्रत्यारोपण के बाद 4 सप्ताह के बाद एककोशिकीय नैनोफाइब्रोस झिल्ली के चित्र सबरेटिनल स्पेस में नैनोफाइब्रोस झिल्ली की अच्छी स्वीकृति और पालन को दर्शाते हैं। सफेद तीर रेटिना की क्रॉस-अनुभागीय छवि में प्रत्यारोपण के स्थान को इंगित करता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
चित्र 10 मिनीपिग आंख में एक नैनोफाइब्रोस वाहक (पीले तीर) पर प्रत्यारोपित प्राथमिक एचआरपीई कोशिकाओं वाले रेटिना क्षेत्र के हेमटोक्सिलिन-ईओसिन (एच एंड ई) धुंधला पन को दर्शाता है। प्रत्यारोपित प्राथमिक एचआरपीई की रंजित उपस्थिति ने एक निरंतर लेकिन अनियमित वर्णक परत का गठन किया (चित्रा 10, लाल तीर)। लंबे समय तक अवलोकन अवधि (6 सप्ताह) के बाद, प्रत्यारोपण के नीचे न्यूरोरेटिना ने रेटिनोटॉमी साइट के चारों ओर एक रोसेट जैसी या हाइपरट्रॉफिक प्रतिक्रिया जैसी उपस्थिति दिखाई, संभवतः आयट्रोजेनिक हेरफेर के परिणामस्वरूप। ये आकृति विज्ञान के परिणाम एसडी-ओसीटी निष्कर्षों के बराबर हैं और रेटिना ऊतक पर वाहक वितरण के न्यूनतम प्रभाव के लिए सबूत का समर्थन करते हैं।
चित्रा 10: प्राथमिक एचआरपीई के साथ प्रत्यारोपित नैनोफाइब्रोस झिल्ली का हिस्टोलॉजिकल विश्लेषण। हेमटोक्सिलिन-इओसिन रेटिना क्षेत्र का धुंधला होना जिसमें मिनीपिग आंख में प्राथमिक एचआरपीई के साथ प्रत्यारोपित नैनोफाइब्रोस वाहक (पीला तीर) होता है। आरोपण के 6 सप्ताह बाद जानवर को इच्छामृत्यु और विश्लेषण किया गया था। प्राथमिक एचआरपीई फोटोरिसेप्टर के विपरीत सबरेटिनल स्पेस में उनके आकार, गोल आकार और रंजकता (लाल तीर) से स्पष्ट रूप से अलग थे। ओएनएल में फोटोरिसेप्टर नाभिक रोसेट जैसी संरचनाओं का निर्माण करते हैं। सबरेटिनल स्पेस हाइपरट्रॉफिक दिखाई देता है। संक्षेप: एचआरपीई = प्राथमिक मानव रेटिना पिगमेंटेड एपिथेलियम, ओएनएल = बाहरी परमाणु परत, आईएनएल = आंतरिक परमाणु परत। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
इम्यूनोस्टेनिंग को दो-चरणीय अप्रत्यक्ष विधि का उपयोग करके किया गया था। इन खंडों को सीआरएएलबीपी में रात भर कमरे के तापमान पर इनक्यूबेट किया गया, जो एक मोनोक्लोनल प्राथमिक एंटीबॉडी है, जिसे 1:100 के कमजोर पड़ने पर रखा गया था। इम्यूनोफ्लोरेसेंस एलेक्सा फ्लुर 488-संयुग्मित द्वितीयक एंटीबॉडी का उपयोग करके किया गया था।
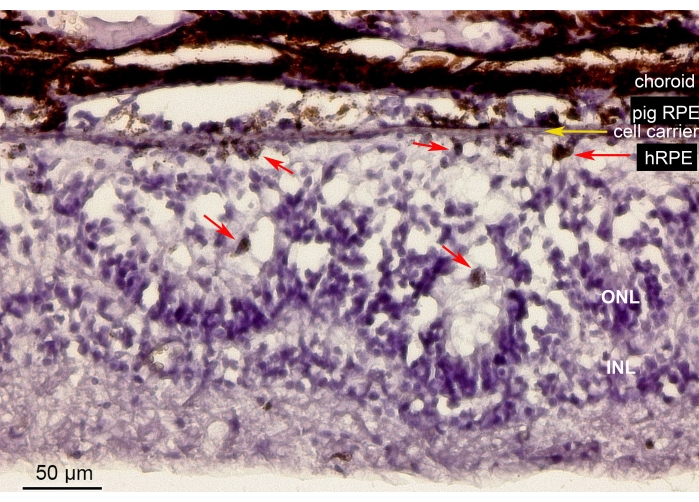
प्रत्यारोपित प्राथमिक एचआरपीई आरोपण के क्षेत्र में मौजूद थे और अंतर्जात मिनिपिग आरपीई कोशिकाओं (चित्रा 11 ए) के समान विशिष्ट आरपीई सीआरएएलबीपी मार्कर व्यक्त करते थे। इसके विपरीत, प्रत्यारोपित कोशिकाओं की आकृति विज्ञान आरोपण के बाद एक मोनोलेयर आकार ग्रहण नहीं करती है, फिर भी परिभाषित सबरेटिनल स्पेस (चित्रा 11 ए, बी, सफेद तीर) के भीतर स्थानीयकृत बनी हुई है। रेटिना मार्कर और रूपात्मक उपस्थिति 6 सप्ताह के प्रत्यारोपण अवधि के बाद सकारात्मक बनी रही: वर्णक / मेलेनिन कणिकाओं की उपस्थिति, रॉड द्विध्रुवी (पीकेसी-अल्फा) और शंकु फोटोरिसेप्टर (पीएनए) के लिए अंत-चरण रेटिना विशिष्ट न्यूरोनल मार्कर, और जीएफएपी सकारात्मकता- माइक्रोग्लियल सक्रियण का संकेत।
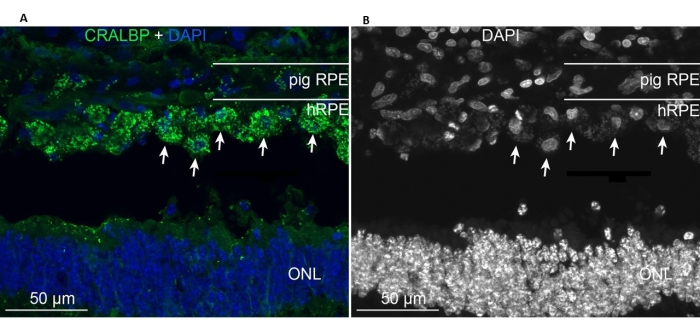
चित्र 11: प्राथमिक एचआरपीई के आरोपण के 6 महीने बाद एक मिनीपिग में आरपीई सेल मार्कर सीआरएएलबीपी (सेलुलर रेटिनाल्डिहाइड बाइंडिंग प्रोटीन) के साथ इम्यूनोलेबलिंग । (ए) उपचारित सुअर आंख के ऊर्ध्वाधर जमे हुए वर्गों को सीआरएएलबीपी मोनोक्लोनल एंटीबॉडी (हरे) के साथ इम्यूनोलेबल किया गया था और डीएपीआई (नीले) के साथ प्रतिरूप किया गया था। (बी) काले और सफेद रंग में डीएपीआई के साथ सेल नाभिक लेबलिंग का एकल चित्रण, क्योंकि उच्च विपरीत व्यक्तिगत एचआरपीई कोशिकाओं के गोल आकार को प्रकट करता है (कुछ सफेद तीर के साथ दिखाए गए हैं)। संक्षेप: एचआरपीई = मानव रेटिना वर्णक उपकला, ओएनएल = बाहरी परमाणु परत। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
नेत्र संबंधी जटिलताएं
कुल मिलाकर, 29 में से 27 (93.1%) ने सफलतापूर्वक ऑपरेशन किए। परिभाषा "सफलतापूर्वक की गई सर्जरी" उन मामलों पर लागू की गई थी जहां संचालित आंख ने न्यूक्लियेशन के समय तक कोई नैदानिक रूप से महत्वपूर्ण पोस्टऑपरेटिव जटिलताओं को नहीं दिखाया था जो हिस्टोलॉजिकल और इम्यूनोहिस्टोकेमिकल अध्ययन को प्रभावित कर सकता था। ऑप्टिकल मीडिया की कम पारदर्शिता ने चार मामलों (13.7%) में पोस्टऑपरेटिव इमेजिंग को प्रभावित किया; बहरहाल, इन आंखों को आगे हिस्टोलॉजिकल और इम्यूनोहिस्टोकेमिकल विश्लेषण के साथ संसाधित किया गया था।
इंट्राऑपरेटिव परिधीय रेटिना डिटेचमेंट चार मामलों (13.8%) में हुआ। दो मामलों में, यह द्रव-गैस विनिमय के दौरान सबरेटिनल द्रव की आकांक्षा और अलगाव के क्षेत्र में रेटिना के लेजर फोटोकॉगुलेशन के आवेदन द्वारा प्रबंधित किया गया था। अन्य दो मामलों (6.9%) में, रेटिना डिटेचमेंट बड़े पैमाने पर रेटिना और सबरेटिनल रक्तस्राव से जुड़ा था, जिसने सेल वाहक के आरोपण को असंभव बना दिया और ऑपरेशन टेबल पर रहते हुए सर्जरी की समाप्ति और मिनीपिग की तत्काल इच्छामृत्यु का कारण बना।
| नहीं | पैरामीटर | मानक उपयोग की गई सेटिंग्स |
| 1 | विट्रोक्टॉमी गति (काटने की दर) | 20,000 कट प्रति मिनट तक |
| 2 | वेंचुरी पंप | 50-180 mmHg |
| 3 | उठने का समय | 1 सेकंड |
| 4 | सिंचाई का दबाव | 18-25 mmHg |
| 5 | वायु जलसेक दबाव | 20-25 mmHg |
| 6 | बाइपोलर एक्सोडिएथेर्मी | 18-26% |
| 7 | मोनोपोलर एंडोडायथर्मी | 16-18% |
| 8 | रेटिना का लेजर फोटोकॉएलेशन, 532 एनएम | बिजली 100-150 mW |
| अंतराल 100 एमएस | ||
| अवधि: 100 एमएस |
तालिका 1: विट्रोक्टॉमी और लेजर फोटोकॉगुलेशन के दौरान उपयोग किए जाने वाले मानक पैरामीटर।
| कुल जानवर, एन | 18 |
| कुल आँखें, n | 36 |
| संचालित आंखें, एन। | 29 |
| सफल आरोपण, एन | 27 |
| असफल मामले, n | 2 |
| सर्जरी का औसत समय, मिनट | 57 |
| सफलता दर, % | 93.1 |
तालिका 2: 2016 और 2020 के बीच लिब्चोव मिनीपिग्स में सेल वाहक के सबरेटिनल प्रत्यारोपण के साथ मानकीकृत सर्जिकल तकनीक के परिणाम।
पूरक फ़ाइल 1: सेल वाहक पर आरपीई कोशिकाओं के सबरेटिनल आरोपण के लिए समर्पित अध्ययनों का सारांश। कृपया इस फ़ाइल को डाउनलोड करने के लिए यहाँ क्लिक करें.
Discussion
विभिन्न मूल के साथ आरपीई कोशिकाओं का सबरेटिनल आरोपण रेटिना अपक्षयी विकारों के उपचार के लिए आंखों के अनुसंधान में एक बहुत ही आशाजनक प्रवृत्ति है, जैसे कि एएमडी 3,4,8,9,10,11,12,13,14,15,25।. इस दृष्टिकोण का मुख्य विचार क्षतिग्रस्त आरपीई को स्वस्थ आरपीई सुसंस्कृत एक्स विवो (पूरक फाइल 1) 44,45,46,47,48 के साथ प्रतिस्थापित करना है। खेती की गई आरपीई कोशिकाओं को प्रत्यारोपण करने के लिए सेल वाहक का उपयोग सबसे उचित दृष्टिकोण का प्रतिनिधित्व करता है, क्योंकि छिद्रपूर्ण झिल्ली फोटोसेंसरी परत के संबंध में सही अभिविन्यास में ध्रुवीकृत आरपीई सेल परत को बनाए रखती है।
इष्टतम पशु मॉडल
इस तरह के उपचार दृष्टिकोण विकसित करने में एक महत्वपूर्ण कदम इष्टतम पशु मॉडल49 का उपयोग है। अतीत में, छोटे और बड़े पशु मॉडल का उपयोग किया गया है, जिसमें खरगोश, कुत्ते, सूअर और गैर-मानव प्राइमेट्स 8,9,10,11,12,13,14,15,27,29 शामिल हैं। इस पेपर में, हम लिब्चोव मिनीपिग मॉडल के उपयोग का प्रस्ताव करते हैं और प्रीऑपरेटिव, सर्जिकल और पोस्टऑपरेटिव चरणों का वर्णन करते हैं जो मजबूत प्रत्यारोपण दक्षता को सक्षम करते हैं। लिब्चोव मिनिपिग मूल रूप से लगभग 20 साल पहले पैदा हुआ था और अक्सर पार्किंसंस और हंटिंगटन रोग29,50 जैसे न्यूरोडीजेनेरेटिव रोगों के क्षेत्र में जैव चिकित्सा अनुसंधान में उपयोग किया जाता है। चूंकि सुअर के पास मनुष्यों के समान रक्त की आपूर्ति और प्रतिरक्षाविज्ञानी प्रतिक्रिया के साथ अपेक्षाकृत बड़ा मस्तिष्क होता है, इसलिए इसका उपयोग एलोजेनिक प्रत्यारोपण प्रयोगों के साथ-साथ51,52,53,54 के लिए एक पशु मॉडल के रूप में किया गया है। भले ही मिनीपिग्स के रेटिना में मानव जैसा मैक्यूला और फोविया नहीं होता है, लेकिन इसमें क्षेत्र केंद्रीय और दृश्य लकीरें होती हैं, जो शंकु फोटोरिसेप्टर30 की उच्च सांद्रता के साथ रेटिना के क्षेत्र होते हैं। मानव आंख के समान आकार, शंकु-समृद्ध केंद्रीय रेटिना की उपस्थिति, अच्छी तरह से वर्णित प्रतिरक्षा प्रणाली, और शल्य चिकित्सा के बाद आकृति विज्ञान और कार्य का आकलन करने के तरीकों की उपस्थिति प्रस्तुत अध्ययन में इस बड़े पशु मॉडल के उपयोग के लिए महत्वपूर्ण तर्क हैं।
शल्य चिकित्सा प्रक्रिया
हमारे ज्ञान के अनुसार, वाहक पर आरपीई कोशिकाओं के विट्रियोरेटिनल प्रत्यारोपण के लिए कोई मानकीकृत और व्यापक रूप से स्वीकृत शल्य चिकित्सा तकनीक नहीं हैं। सेल रिप्लेसमेंट थेरेपी के प्रमुख मुद्दों में से एक चुनौतीपूर्ण सर्जिकल तकनीक है जिसमें रेटिना डिटेचमेंट, हाइपोटनी, एपिस्क्लेरल, कोरॉयडल और / या रेटिना रक्तस्राव और उच्च इंट्राओकुलर अशांति से जुड़ी इंट्राऑपरेटिव और पोस्टऑपरेटिव जटिलताओं का खतरा होता है, जिससे मचान क्षति हो सकती है। पोस्टऑपरेटिव रूप से, प्रोलिफेरेटिव विट्रोरेटिनोपैथी, एंडोफथाल्मिटिस, हाइपोटनी, रेटिना डिटेचमेंट और मोतियाबिंद गठन 4,10,13,14,15 का खतरा होता है।
सेल वाहक का उपयोग करने वाले दृष्टिकोण पर पहला अध्ययन चिंचिलाखरगोशों 13,16,25 में किया गया था। भले ही ये जानवर एक छोटे से पशु मॉडल का प्रतिनिधित्व करते हैं, सर्जरी के तकनीकी पहलुओं पर ध्यान केंद्रित करने वाले परिणाम बड़े पशु मॉडल में प्रक्रियाओं के विकास में महत्वपूर्ण थे और इसलिए, नीचे संक्षेप में दिए गए हैं।
जेट स्ट्रीम को रीडायरेक्ट करने के लिए शुरू में दो साइड पोर्ट के साथ एक कस्टम-निर्मित 23 जी इन्फ्यूजन कैनुला का उपयोग किया गया था, जिसने ब्लीब के पतन और परिणामस्वरूप रेटिना डिटेचमेंट13 को हल करने में मदद की। वर्तमान अध्ययन में, हमने ब्लीब के ऐसे किसी भी पतन को नहीं देखा। इसका संभावित कारण नेत्रगोलक का बड़ा आकार और कैनुला जलसेक स्थल पर परिधि पर बख्शे गए विट्रस के साथ कोर विट्रोक्टॉमी का प्रदर्शन हो सकता है, जो निर्देशित जेट स्ट्रीम के बल को कम कर सकता है।
उपकरण से सेल वाहक के इजेक्शन के दौरान कठिनाइयां छोटे पशु मॉडल में एक और इंट्राऑपरेटिव बाधा थीं, जिन्हें "उपकरण के साथ फंसे" के रूप में वर्गीकृत किया गया था। इसके अतिरिक्त, लेखकों ने सुझाव दिया कि रेटिना सतह पर अवशिष्ट विट्रस आरोपण के बाद रेटिनोटॉमी छिद्र से वाहक के पीछे की "छलांग" का कारण बन सकता है। इस समस्या को एंजाइम-असिस्टेड विट्रोक्टॉमी के साथ हल किया जा सकता है, जो सेल वाहक को सबरेटिनल स्पेस में एक चिकनी, निरंतर इजेक्शन में सक्षम बनाता है। अधिकांश मामलों में, लेखकों ने रेटिनोटॉमी से दूर प्रत्यारोपण के अधिक दूर के स्थान को प्राप्त करने के लिए वाहक को पुनर्स्थापित किया। हमारी केस सीरीज़ में, हमने एक ऐसी स्थिति का भी अनुभव किया जिसमें सेल वाहक इंजेक्टर की नोक से जुड़ा रहा। हालांकि, यह प्रकाश पाइप और इंजेक्टर की नोक के धीमे और कोमल हेरफेर द्वारा प्रबंधित किया गया था। हमने अपने किसी भी मामले में रेटिनोटॉमी की साइट पर किसी भी अवशिष्ट विट्रस का निरीक्षण नहीं किया। सर्जरी में टीए-असिस्टेड पीपीवी के उपयोग को अवशिष्ट रूप से संलग्न विट्रस के जोखिम को कम करने के लिए एक विधि के रूप में सुझाया जा सकता है। पूरी तरह से ओवरलाइंग विट्रस को हटाने के लिए टीए के साथ मल्टीपल स्टेनिंग आवश्यक हो सकती है।
एक अलग अध्ययन में, पॉलिएस्टर झिल्ली पर ध्रुवीकृत सेलुलर मोनोलेयर के रूप में विकसित मानव आरपीई स्टेम कोशिकाओं के सबरेटिनल आरोपण के परिणाम24 बताए गए थे। प्रयोगों के दौरान, पहले वर्णित एक ही शल्य चिकित्सा तकनीक का उपयोग13 किया गया था, लेकिन दो-पोर्ट पीपीवी दृष्टिकोण लागू किया गया था। अंत में, खरगोशों में सेल वाहक सर्जरी के सबरेटिनल आरोपण के लिए एक चरण-दर-चरणप्रोटोकॉल बाद में प्रकाशित किया गया था। यह अध्ययन शल्य चिकित्सा प्रक्रिया का एक बहुत विस्तृत और आसानी से दोहराने योग्य विवरण प्रस्तुत करता है, जिसमें प्रीऑपरेटिव और पोस्टऑपरेटिव देखभाल शामिल है, जो पिछले अनुभव पर भी आधारित हैं।
बाद के अध्ययनों में बड़े पशु मॉडल के उपयोग के दौरान, न केवल तकनीकी प्रश्नों को संबोधित किया गया था, बल्कि प्रत्यारोपित कोशिकाओं के लिए प्रतिरक्षा प्रतिक्रिया, साथ ही सेल वाहक आकार से संबंधित मुद्दों के बारे में भी प्रश्न थे। साइनोमोलगस बंदरों (मैकाका फासिकुलरिस) का उपयोग करके एक अध्ययन ने मानव स्टेम सेल-व्युत्पन्न आरपीई मोनोलेयर15 के सबरेटिनल आरोपण के परिणामों का वर्णन किया। सभी जानवरों को प्रणालीगत इम्यूनोसप्रेशन से गुजरना पड़ा, जिसमें सिरोलिमस (2 मिलीग्राम की लोडिंग खुराक, 1 मिलीग्राम की दैनिक खुराक) और टेट्रासाइक्लिन (7.5 मिलीग्राम / किग्रा- बीडब्ल्यू) सर्जरी से 7 दिन पहले शुरू हुआ और सर्जरी के बाद 3 महीने तक चला। सर्जिकल प्रक्रिया पहलेवर्णित प्रोटोकॉल 24,25 के अनुसार की गई थी। लेखकों ने झूमर एंडो-रोशनी के साथ 25 जी तीन-पोर्ट पीपीवी दृष्टिकोण का उपयोग किया। महत्वपूर्ण रूप से, पीछे के रेटिना पर अवशिष्ट विट्रियोरेटिनल आसंजन को बाहर करने के लिए एक टीए-सहायता प्राप्त पीवीडी का उपयोग किया गया था। मूल रूप से वर्णित प्रक्रिया के अतिरिक्त, लेखकों ने 20 जी कस्टम-निर्मित विस्तार योग्य लूप उपकरण का उपयोग करके भविष्य के आरोपण के क्षेत्र में मेजबान आरपीई परत को हटा दिया।
हमारे मिनीपिग अध्ययन में, हमने प्रणालीगत इम्यूनोसप्रेशन का भी उपयोग किया। हालांकि, इम्यूनोसप्रेशन का प्रकार ऊपर वर्णित से भिन्न था। हमने सेल ग्राफ्ट अस्वीकृति और भड़काऊ प्रतिक्रियाओं को बाधित करने के लिए 0.25 मिलीग्राम / किग्रा बीडब्ल्यू की खुराक पर डिपो के रूप में टैक्रोलिमस-एल्यूटिंग पॉलिमर माइक्रोसेफर्स के चमड़े के नीचे इंजेक्शन दिया। हमने सर्जरी के दौरान मेजबान आरपीई सेल परत को नहीं हटाया, क्योंकि हमारा प्राथमिक उद्देश्य प्रक्रिया की सुरक्षा और प्रत्यारोपित कोशिकाओं की व्यवहार्यता का विश्लेषण करना था, लेकिन मेजबान रेटिना में उनका एकीकरण नहीं।
इससे पहले, एक फोल्डेबल नॉन-डिग्रेडेबल जाल-समर्थित सबमाइक्रोन पेरिलीन-सी झिल्ली (6.25 मिमी x 3.5 मिमी, 0.4 μm मोटी) पर एचईएससी-व्युत्पन्न आरपीई के एक मोनोलेयर के सबरेटिनल प्रत्यारोपण की सुरक्षा और व्यवहार्यता का मूल्यांकन 14 मादा युकाटन मिनीपिग्स10 में किया गया था। खेती के बाद, कोशिकाओं को एक जाल-समर्थित झिल्ली पर बीज दिया गया था। सर्जरी के अंत में डेक्सामेथासोन प्रत्यारोपण के 0.7 मिलीग्राम के टैक्रोलिमस (कोई शासन और खुराक संकेतित) और इंट्राविट्रल इंजेक्शन के प्रणालीगत प्रशासन का उपयोग करके इम्यूनोसप्रेशन किया गया था। पीपीवी को 20 जी दृष्टिकोण के साथ प्रदर्शन किया गया था। लेखकों ने विट्रियस शरीर के बेहतर विज़ुअलाइज़ेशन के लिए ट्रायमसिनोलोन एसिटोनिड के एक इंट्राविट्रल इंजेक्शन का उपयोग किया। बड़ा स्क्लेरोटॉमी आकार में 2 मिमी से 3 मिमी था। सबरेटिनल इंजेक्शन के बाद, रेटिना को परफ्लोरोकार्बन तरल के अस्थायी इंजेक्शन के साथ चपटा किया गया था। द्रव-वायु विनिमय के बाद, एक सिलिकॉन तेल टैम्पोनैड (1,000/5,000 सीएसटी) का प्रदर्शन किया गया था। पोस्टऑपरेटिव देखभाल में सर्जरी के 1 सप्ताह बाद डेक्सामेथासोन / नियोमाइसिन / पॉलीमाइक्सिन बी मलहम का ओकुलर अनुप्रयोग शामिल था। लेखकों ने 91% की सफलता दर की सूचना दी (यानी, कुशल सबरेटिनल आरोपण और पर्याप्त पोस्टऑपरेटिव इमेजिंग डेटा)। हमारे अध्ययन में, टीए क्रिस्टल के इंट्राविट्रल इंजेक्शन का उपयोग इंट्राऑपरेटिव रूप से और मुख्य रूप से विट्रस शरीर की कल्पना करने के लिए किया गया था। हालांकि, इस दवा की स्थानीय इम्यूनोसप्रेसिव कार्रवाई स्पष्ट नहीं है। हमारे अध्ययन में उपयोग किए जाने वाले नैनोफाइब्रोस सेल वाहक 5.2 मिमी x 2.1 मिमी और 3.7 μm मोटे थे, जिनमें 0.4 μm के छिद्र आकार थे। सर्जरी के दौरान, हमने परफ्लोरोकार्बन तरल इंजेक्ट करने के बजाय प्रत्यक्ष फैक्स किया। हमारी सर्जिकल सफलता दर (93.1%) कोस एट अल .10 की तुलना में सुसंगत और थोड़ी बेहतर थी।
सबरेटिनल इम्प्लांटेशन के लिए पूरी तरह से डिग्रेडेबल सेल वाहक (मचान) के सबरेटिनल प्रत्यारोपण का अध्ययन पहली बार 2019 में यॉर्कशायर सूअरों14 में किया गया था। अध्ययन मुख्य रूप से फाइब्रिन हाइड्रोगेल प्रत्यारोपण की बायोडिग्रेडेबल विशेषताओं पर केंद्रित था। लेखकों ने नोट किया कि घरेलू सूअरों पर उपयोग किए जाने वाले आक्रामक इम्यूनोसप्रेशन फाइब्रिन हाइड्रोगेल प्रत्यारोपण के बायोडिग्रेडेशन के दौरान संभावित रूप से स्थानीय भड़काऊ प्रतिक्रिया को रोक सकते हैं। हालांकि, उन्होंने सूअरों में उपयोग की जाने वाली इम्यूनोसप्रेसिव थेरेपी को निर्दिष्ट नहीं किया। पीपीवी के दौरान, उन्होंने लिम्बस के समानांतर और लगभग 3.5 मिमी पीछे सबरेटिनल इम्प्लांटेशन डिवाइस के सम्मिलन के लिए 3.6 मिमी लंबा स्क्लेरोटॉमी किया। इसके अतिरिक्त, उन्होंने उंगली के हेरफेर के कारण हाथ-प्लेसमेंट अस्थिरता को कम करने के उद्देश्य से एक वायवीय-संचालित इंजेक्शन प्रणाली का उपयोग किया। हमारी केस श्रृंखला में, सभी स्क्लेरोटोमी लिम्बस से 2.5 मिमी से 3.0 मिमी थे। इंजेक्टर के सम्मिलन के लिए बड़ा स्क्लेरोटॉमी 3 मिमी लंबा था। हमारे अध्ययन में इस्तेमाल किए गए आरोपण इंजेक्टर को हाथ से संचालित किया गया था। सिलिअरी बॉडी के पार्स प्लाना की पूरी तरह से कैउटेरी और बड़े स्क्लेरोटॉमी के अंदर पर्याप्त कटौती इंट्राऑपरेटिव जटिलताओं जैसे कि आयट्रोजेनिक परिधीय रेटिना डिटेचमेंट, रक्तस्राव और प्रत्यारोपण के नुकसान से बचने के लिए महत्वपूर्ण प्रतीत होती है।
सारांश में, हम विरासत में मिली और अधिग्रहित रेटिना बीमारियों के लिए उपचार विकल्प के रूप में बायोडिग्रेडेबल वाहक पर आरपीई कोशिकाओं के प्रत्यारोपण के लिए लिब्चोव मिनीपिग मॉडल के उपयोग का वर्णन करते हैं। आंखों की शारीरिक रचना और शरीर विज्ञान में समानताएं, साथ ही प्रतिरक्षा प्रणाली के संबंध में, हमें कोशिकाओं के सबरेटिनल आरोपण के लिए शल्य चिकित्सा तकनीकों और इंस्ट्रूमेंटेशन पर विकसित और सुधार करने की अनुमति देती हैं, जिन्हें आसानी से मानव आंख विकारों के उपचार में स्थानांतरित किया जा सकता है। यह सुनिश्चित करना महत्वपूर्ण है कि मानव सर्जरी में उपयोग किए जाने पर मिनीपिग्स पर सर्जरी एक ही इंस्ट्रूमेंटेशन (आरोपण वितरण उपकरण सहित) का उपयोग करके की जाती है, इस प्रकार मनुष्यों के लिए प्राप्त अनुभव और ज्ञान के आवेदन की सुविधा प्रदान की जाती है। मैकुलर क्षेत्र की उपस्थिति के साथ वैकल्पिक बड़ी आंखों वाले पशु मॉडल, जैसे कि गैर-मानव प्राइमेट्स, केंद्रीय रेटिना क्षेत्र में सबरेटिनल आरोपण के बाद शारीरिक और कार्यात्मक परिवर्तनों के अनुवर्ती और विश्लेषण के लिए उपयोगी हो सकते हैं। प्रीऑपरेटिव, सर्जिकल और पोस्टऑपरेटिव देखभाल प्रक्रियाओं का विस्तृत विवरण कुशल और मानकीकृत डेटा उत्पादन को बढ़ाकर भविष्य के अध्ययनों के लिए उपयोगी होगा।
Acknowledgements
परियोजना को चेक साइंस फाउंडेशन (परियोजना संख्या 18-04393 एस) और चेक गणराज्य के नॉर्वे अनुदान और प्रौद्योगिकी एजेंसी (कप्पा कार्यक्रम, परियोजना संख्या टीओ01000107) द्वारा समर्थित किया गया था।
Materials
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
References
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved