Minipigs의 캐리어에 RPE의 망막하 이식: 수술 전 준비, 수술 기술 및 수술 후 관리에 대한 지침
* These authors contributed equally
In This Article
Summary
망막 색소 상피(RPE)의 망막하 이식은 퇴행성 망막 질환 치료를 위한 가장 유망한 접근법 중 하나입니다. 그러나 큰 눈 동물 모델에 대한 전임상 연구의 성과는 여전히 도전적입니다. 이 보고서는 세포 운반체에 대한 RPE의 망막하 이식을 미니피그로 하기 위한 지침을 제시합니다.
Abstract
주로 망막 색소 상피(RPE) 층 또는 그 내에서 발생하는 망막의 퇴행성 장애(연령 관련 황반변성 포함)는 망막 해부학의 점진적인 해체 및 시각 기능의 저하를 초래합니다. 손상된 RPE 세포(RPE)를 망막하 세포 운반체를 사용하여 시험관 내 배양된 RPE 세포로 대체하는 것은 외부 망막층의 해부학적 구조를 재확립할 수 있는 가능성을 보여주었고, 따라서 추가 연구가 진행되고 있습니다. 여기에서 우리는 배양된 RPE가 있는 세포 운반체를 미니피그로 효과적으로 망막하 이식할 수 있는 수술 기술의 원리를 제시합니다. 수술은 전신 마취하에 수행되었으며 표준 수정체 보존 3포트 유리체 절제술(PPV), 균형 잡힌 염 용액(BSS)의 망막하 도포, 2.7mm 망막 절개술, 추가 3.0mm 경화술을 통해 망막하 공간에 나노섬유 세포 운반체 이식, 체액-공기 교환(FAX), 실리콘 오일 탐포네이드 및 모든 경화술 폐쇄. 이 수술적 접근법은 지난 8년 동안 29건의 수술(18마리)에서 사용되었으며 성공률은 93.1%입니다. 외과적 배치의 해부학적 검증은 생체 내 안저 영상(안저 사진 및 광간섭 단층촬영)을 사용하여 수행하였다. 미니피그 눈의 보체에 RPE의 망막하 이식을 위해 권장되는 수술 단계는 큰 눈 동물 모델을 사용한 향후 전임상 연구에서 사용할 수 있습니다.
Introduction
연령 관련 황반변성(AMD)은 선진국에서 중심 시력 상실의 주요 원인으로 간주되며 망막 색소 상피(retinal pigmented epithelium, RPE) 기능 장애와 관련된 많은 질환 중 하나이다 1,2. RPE는 기저부에 위치한 Bruch's membrane(BM)에서 발견되며 광수용체에 필요한 유지 관리를 제공합니다. RPE 층의 점진적인 퇴행은 AMD의 초기 위축성 형태의 특징이며, 또한 후기 삼출성 형태의 AMD의 발달을 동반합니다. 망막 질환 치료의 많은 발전에도 불구하고 효과적인 치료 방식의 개발은 여전히 어려운 과제입니다3. 유망한 방법 중 하나는 시험관 내 배양 RPE 층을 사용한 RPE 대체입니다. 이 치료는 인간 배아 줄기 세포 유래 RPE (hESC-RPE) 및 유도 만능 줄기 세포 유래 RPE (iPSC-RPE)를 사용한 줄기 세포 연구의 진행과 관련이 있습니다 3,4,5,6,7. 최근 몇 년 동안 많은 연구 그룹은 처음에 승인된 개념 증명 8,9,10,11,12,13,14,15를 사용하여 RPE 교체를 위한 다양한 접근 방식을 개발하는 데 중점을 두었습니다. RPE 세포(RPE)는 일반적으로 세포 현탁액, 자립형 세포 시트 또는 인공 운반체(3,16,17,18,19,20,21)에 의해 지지되는 세포 단층의 형태로 망막하 공간으로 전달됩니다. 세포 현탁액의 주입이 가장 쉬운 방법이지만 BM의 손상된 상태는 종종 이식된 세포의 부착을 방해할 수 있습니다. 이로 인해 RPE의 apicobasal 방향이 잘못되고 단일층 형성이 실패할 수 있습니다(22,23). 다른 두 가지 방법(즉, 자립형 세포 시트 및 인공 기판에 의해 지지되는 세포 단층)의 주요 이점은 세포가 망막하 공간(24) 내로 직접 이식될 때 이미 분화된 단층 상태에 있다는 것이다.
망막하 공간으로의 세포 운반체의 전달을 기술하는 많은 수술 기법이 최근 8,9,10,11,12,13,14,15에 발표되었다. 이 연구에서는 큰 눈 동물 모델의 사용, 세포 운반체의 유형, 이식된 세포 배양의 사용, 이식 기구 및 수술 기술에 대해 설명했으며 저자는 주로 망막하 이식 결과에 중점을 두었습니다. 2015년, Popelka et al. 돼지 사체의 눈에 RPE를 이식하기 위해 프레임 지지형 초박형 전기방사 고분자 멤브레인을 사용했다고 보고했다 8. 세포 운반체의 망막하 이식과 함께 여기에 설명된 수술 기술은 담체의 비교적 정밀한 취급 및 망막하 공간에서 스캐폴드의 쉬운 위치 지정을 허용했습니다. Kozak et al. 돼지의 눈에서 대략 2mm x 5mm 크기의 운반체 전달 기술의 타당성을 평가했다9. 세포 운반체의 독특한 설계는 올바른 배치를 허용하여 세포 단층이 접히거나 구겨지는 것을 방지했습니다6. Al-Nawaiseh et al. 토끼의 망막하 스캐폴드 이식에 대한 자세한 단계별 지침을 처음 제시했습니다25. Stanzel et al. 그런 다음 2019년에 작은 설치류, 토끼, 돼지 및 비인간 영장류에 이식하기 위한 유사한 프로토콜을 발표했습니다26. 이전에 발표된 바와 같이, 고체 캐리어에 분화되고 편광된 RPE 단층을 이식하면 다른 전달 기술에 비해 생존율이 향상되고 이식편이 더 잘 통합되었습니다(보충 파일 1)27.
생체 내에서 수행되는 모든 전임상 동물 연구의 목적은 절차 안전성, 이식된 세포의 생존, 망막하 조작에 대한 조직 반응, 장단기 수술 후 결과에 중점을 두고 세포 운반체의 외과적 유리체강하 망막하 이식의 다양한 측면을 밝히는 것입니다. 큰 눈 동물 모델로서 돼지 눈을 사용하는 것은 얻어진 데이터의 범위 측면에서 관련성이 있는 것으로 보고되었으며, 이는 인간에게 유용하고 잠재적으로 적용될 수 있다10,11,14. 우리의 연구는 큰 눈 동물 모델에서 세포 운반체의 생체 내 망막하 이식에 사용된 수술 기술을 보고합니다. 지난 8년간의 경험을 바탕으로 수술 전 준비, 망막하 세포 운반체 이식의 수술 기법, 미니피그 눈의 수술 후 관리에 대해 자세히 설명합니다. 우리는 다양한 유형의 세포 및 세포 운반체의 이식과 관련된 생체 내 실험 연구에 사용할 수 있는 기본 수술 원리를 설명합니다.
대형 동물 모델
Liběchov minipigs의 실험용 무리는 1967 년 미국에서 Hormel 계통에서 5 마리의 동물을 수입하여 설립되었습니다. 이 동물들은 돼지 혈액형 연구를 위해 Landrace, Large White, Cornwall, 베트남 돼지 및 괴팅겐 기원의 소형 돼지와 같은 여러 다른 품종 또는 균주와 교배되었습니다28,29. 생후 5 개월과 약 20kg의 체중 (BW)에 미니 피그는 성적으로 성숙합니다. 부모 미니피그 품종(Hormel 및 Göttingen)의 생존 기간은 12-20년으로 보고됩니다. 세포 운반체의 망막하 이식은 망막의 중앙 부분을 표적으로 합니다. minipigs의 망막에는 황반과 중심와가 없습니다. 그러나, 그것은 영역 centralis라고 불리는 고농축 원뿔 광 수용체 영역과 시각적 줄무늬30,31을 가지고 있습니다. 이 영역은 가장 높은 시력을 담당합니다.
수술은 경험이 풍부한 수술 시설 보조원(TA)의 도움을 받아 4명의 숙련된 유리체 망막 외과의가 수행했습니다. 생체 내 실험 전에 외과의는 유리체 부피에 대한 수정체의 비율 감소, 축 길이 단축(15-19mm), 각막에 Bowman's membrane의 부재, 더 작은 유리체 부피(2.8-3.2mL), 황반 및 중심와, Zinn의 고리가 없고 시신경 디스크 직경(수직/수평: 1.5mm/2.1mm). 모든 경우에 수술은 표준 무균 및 방부 조치를 시행하여 특별히 조직 된 수술실에서 전신 마취하에 수행되었습니다.
Protocol
이 연구는 헬싱키 선언 지침의 신조와 인간 피험자와 관련된 의학 연구에 대한 윤리적 원칙을 준수합니다. 모든 실험은 실험실 동물의 관리 및 사용에 대한 지침 및 안과 및 시각 연구에서 동물의 사용에 대한 시력 및 안과 연구 협회 (ARVO)에 따라 수행되었습니다. 연구 프로토콜은 체코 과학 아카데미(체코 공화국 리베호프)의 동물 생리학 및 유전학 연구소에서 동물 실험 프로젝트 승인을 위해 CAS의 리조트 전문 위원회의 승인을 받았습니다(승인된 프로토콜 번호 60/2016 및 번호 64/2019).
1. 캐리어의 세포를 minipigs로 망막 하 이식하는 동안 고려 사항
- 동물 선택
- 생후 12-36개월, 성별, 체중 약 40-80kg(BW)인 Liběchov 미니피그를 구하여 사용하십시오.
- 미니피그를 18-22 °C 사이의 온도, 인공 13시간/11시간 명암 주기에 노출, 표준화된 개별 펜, 물에 대한 자유로운 접근, 하루에 두 번 먹이는 에어컨이 설치된 동물 집에서 실내에 보관하십시오.
- 수술 전 준비
- 눈의 수술 방향을 확인하고 안저 구성표를 그립니다. 이를 위해 수직선이 있는 펜을 사용하여 안저 그림에서 미니피그의 망막을 측두엽(시신경에서 귀 방향으로), 비강(시신경에서 돼지 방향으로) 및 중앙(비강 쪽의 주요 망막 혈관 사이) 영역으로 개략적으로 나눕니다(그림 1A, B).
- 행동 및 신경 병리가없고 피부, 신체 구멍, 대변 및 음식 섭취의 정상적인 품질을 가진 건강한 동물 만 선택하십시오. 숙련된 수의사에게 임상 관찰을 수행하고 동물을 선택하도록 합니다.
- 수술 당일 세프티오푸르 염산염(1mL/kg) 3mg/kg BW를 근육주사한다.
- 수술 전 면역 억제
- Wang et al. 및 Sevc et al. 32,33에 설명된 바와 같이 타크로리무스 용출 폴리머 마이크로스피어를 변형하여 준비합니다.
- 폴리머 마이크로스피어의 타크로리무스 농도가 HPLC(재료 표)에 의해 결정된 대로 51.3mg/g인지 확인합니다.
- 세포 이식 거부를 방해하기 위해 눈 수술 6일 전에 0.25mg/kg BW의 용량으로 타크로리무스가 로드된 폴리머 마이크로스피어를 피하 주사합니다. 이것은 minipig 눈에 이종 이식하는 동안 인간 RPE 기증자 세포의 생존을 보장하기 위해 수행됩니다.
- 수술 당일 동물에게 depo-medrol 80mg과 벤질페니실린을 체중에 따라 1mL/10kg으로 근육주사한다.
- 마취
- 수술 전 틸레타민(2mg/kg), 졸라제팜(2mg/kg), 케타민(2mg/kg), 자일라진(0.4mg/kg)-TKX34,35의 혼합물을 근육주사하여 전신마취를 유도한다. 무의식 상태와 페달 반사 (뒷다리의 디지털 간 피부의 꼬집음), 각막 반사 (각막의 약간의 접촉), 동공 반사 (빛에 대한 반응) 및 안검 반사 (눈꺼풀에 대한 접촉)를 확인하여 마취 깊이를 확인하십시오. 동물이 깜박이지 않도록하십시오. 심장 및 호흡수 규칙성을 확인하십시오.
- 마취 유도 후, 진정 된 동물을 리프트 트롤리의 수술실로 이송하십시오 (그림 2A).
- 오른쪽 눈 수술이 가능하도록 동물을 왼쪽 수술대에 놓습니다(그림 2B).
- 스티로폼 패드를 사용하여 동물의 머리를 조정하여 이식을 위한 중앙 망막의 가장 적합한 위치(즉, 수평 및 바닥과 평행)를 얻습니다(그림 2C).
- 0.5% 프로파라카인 염산염 점안액의 점안액을 결막낭에 1분 간격으로 3회 넣어 국소 마취를 유도합니다.
- 정맥 캐뉼라를 삽입하고 환자 모니터가 장착 된 마취 기계를 사용하여 마취 (1.5 % 이소 플루 란)의 흡입 유지를 위해 기관 내 튜브로 동물을 삽관합니다 (그림 2A, B).
- 눈 수술 시작 약 15분 전에 BW 16kg당 Eficur 1mL와 Depo-Medrol 1 20mg을 근육주사합니다(표 참조).
- 동물을 등온 호일로 덮어 생리적 체온을 유지하고 섹션 3에 설명된 대로 수술을 수행합니다.
- 수술 중 이어 클립과 환자 모니터를 사용하여 심박수 및 혈중 산소 포화도와 함께 동물의 체온을 모니터링합니다. 시술 중 체온이 38°C 이하로 떨어지는 것을 피하며, 이는 안전 한계36으로 간주됩니다. 전체 실험 동안 산소 포화도(>96%)와 맥박수(분당 70-90회)를 유지합니다.
- 수술이 완료되면 이소 플루 란의 흐름을 차단하고 동물을 발관하십시오.
- 자발적인 호흡과 각성 후 동물을 펜으로 옮깁니다.
- 수술실 설치
- 큰 눈 동물 모델의 눈에 대한 수술의 필요에 따라 수술실을 배치합니다(그림 3A, B). 외과 의사의 의자 높이와 현미경의 높이를 조정하여 돼지 주둥이의 위치와 관련하여 외과의가 편안한 자세를 취할 수 있도록 합니다.
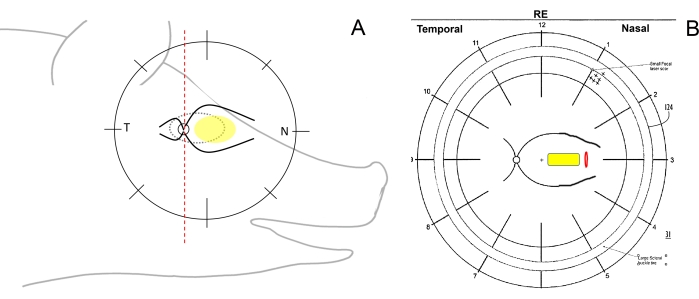
그림 1: 미니피그의 망막 영역의 개략도. (A) 미니피그의 머리에 대한 망막 영역의 개략도; 노란색 타원은 원하는 망막하 이식 부위를 나타내고, T는 측두엽 망막 부위를, N은 비강 망막 부위를 나타냅니다. (B) 망막절개술(빨간색)을 통한 세포 운반체(노란색)의 망막하 이식 후 안저 계획의 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
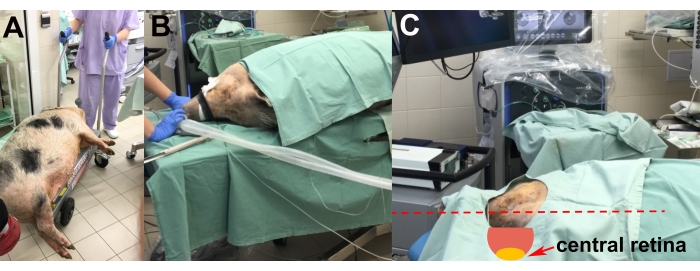
그림 2 : 동물의 운송 및 배치. (A) 진정제를 투여한 동물을 수술실로 이송. (B) 삽관 중 동물의 배치. (C) 수술 중 중앙 망막에 최적으로 접근하기 위한 동물의 머리 조정(빨간색 화살표). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
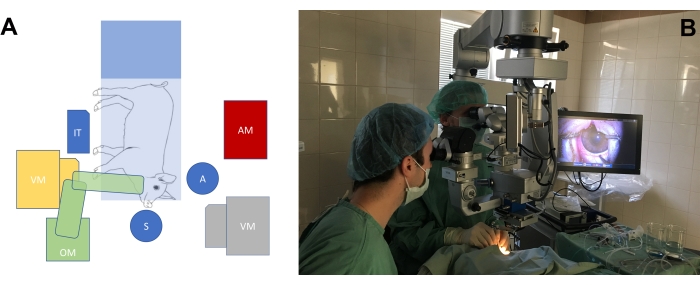
그림 3: 표준 수술실 설정 . (A) 미니피그, 수술현미경(OM), 유리체절제술기(VM), 기구대(IT) 및 마취기(AM)가 있는 수술대의 위치와 관련된 외과의의 위치(S = 외과의사, A = 조수)의 개략도. 유리체 절제술 기계에는 두 가지 가능한 위치 (노란색과 회색)가 있습니다. (B) 수술실의 실제 환경. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 세포 운반체, 배양 세포 배양 및 이식 주입기
- 세포 운반체
- 펨토초 레이저를 사용하여 이축 방향 36μm 두께의 폴리에틸렌 테레프탈레이트(PET) 호일에서 프레임에 비대칭으로 위치한 삼각형 돌출부가 장착된 외부 치수가 1.7mm x 4.8mm인 폭 30μm 타원형 프레임을 절단합니다(그림 4A).
- 용액 1g 당 2.2μL의 포름산을 첨가하여 11wt% 농도의 피리딘 중 폴리(L-lactide-co-DL-lactide)(LLA/DLLA 90/10, MW 868, 270g/mol) 고분자 용액을 준비합니다.
- (1) 실리콘 기판 상에 제1 나노섬유를 증착하고, (2) 상기 층 상에 프레임을 배치하고, (3) 제2 나노섬유층을 증착하는세 단계로 고분자 용액을 전기방사하여 지지 프레임(도 4B)이 내장된 나노섬유 멤브레인을 준비한다.
참고: 총 멤브레인 두께가 3.7μm가 되도록 모든 층을 7분 동안 증착합니다. 380nm 두께의 섬유로 구성되고 평균 기공 크기가 0.4μm이고 다공률이 약 70%37인 멤브레인을 얻으려면 20G 전체 강철 바늘, 7.1kV의 전압, 10cm의 간격, 250μL/min의 유속, 25.0°C ± 0.5°C의 온도를 사용합니다. - 실리콘 기판에서 프레임이 내장된 멤브레인을 조심스럽게 제거하고 세포의 파종 및 성장을 촉진하기 위해 원래 멤브레인이 없는 상업용 12웰 세포 배양 삽입물의 본체에 고정합니다.
- 플라즈마 클리너에서 70W의 전력으로 30초 동안 공기 플라즈마에서 세포 파종 전에 나노 섬유 막을 처리합니다.
- 세포 담체에서 배양에 사용되는 세포 배양
참고: 다음의 세포 운반체를 사용할 수 있다: 1) 세포가 없는 나노섬유 세포 운반체; 2) 일차 인간 RPE(hRPE)를 갖는 나노섬유 세포 운반체; 3) 인간 iPSC 유래 RPE 세포를 갖는 나노섬유 세포 운반체.- 1차 hRPE 배양
- 이전에 보고된 기술38에 따라 인간 공여자의 눈으로부터 1차 hRPE 세포를 분리한다.
- 30분 동안 망막을 효소 처리하여 세포를 얻었다. 그런 다음 10% 소 태아 혈청(FBS)이 보충된 DMEM/F12에서 최대 2주 동안 1차 hRPE 세포(계대 0)를 배양합니다.
- 세포 배양이 합류도에 도달하면 배지를 1% FBS로 변경하고 추가로 30일 동안 배양합니다.
- 1차 hRPE를 트랜스-웰 플레이트와 2,000 cells/mm2의 밀도로 라미닌 코팅된 나노섬유 세포 운반체에 시딩합니다. 1% FBS에서 30일 동안 추가로 배양한 후 미니피그에 망막하 이식을 위해 1차 hRPE가 있는 세포 운반체를 사용합니다.
- 인간 iPSC 유래 RPE
- CRISPR/Cas9 시스템(RP1-FiPS4F1-GC2)40을 사용하여 두 개의 대립유전자에서 유전자 보정된 MERTK 관련 색소성 망막염 환자 유래 섬유아세포39에서 유래한 hiPSC와 대조군으로 사용되는 건강한 피험자(Ctrl2-FiPS5F2)41의 섬유아세포에서 유래한 hiPSC를 사용합니다.
- 이전에 보고된 바와 같이 RPE 세포(hiPSC-RPE)를 향한 두 hiPSC 세포주를 생성하고 후속적으로 분화시킨다42.
- 녹아웃 DMEM, 20% 녹아웃 혈청, 0.1mM 비필수 아미노산, 0.23mM β메르캅토에탄올, 100U/mL 페니실린, 0.1mg/mL 스트렙토마이신 및 10mM 니코틴아미드를 포함하는 RPE 배지에 타원형 이식 프레임이 있는 폴리(L-lactide-co-DL-lactide)의 나노섬유 멤브레인으로 라미닌 코팅된 세포 배양 삽입물에 hiPSC-RPE를 200,000 cells/cm2 로 플레이트합니다.
- 배지를 격일로 교체하고 이식 전 2개월 동안 hiPSC-RPE를 배양하여 분극 성장을 촉진합니다.
- 임플란트 인젝터
- OD 1.75 mm/ID 1.10 mm의 플라스틱 튜브에서 블로우 몰딩하여 단면적이 2.8 mm x 0.8 mm인 플라스틱 모세관을 준비합니다.
- 플라스틱 모세관에서 4mm x 2.2mm의 로딩 창을 끝에서 6mm 자릅니다.
- 플라스틱 모세관, 실리콘 핸들, 강철 블레이드 플런저 및 피스톤에서 인젝터를 조립합니다(그림 5A).
- 캐리어를 로딩 창을 통해 인젝터에 로드하고 나중에 3.5.2단계(그림 5B)에 설명된 대로 플런저를 밀어 망막하 공간으로 배출합니다.
- 나노섬유 담체의 준비 및 주입기의 로딩
- 작은 플라스틱 페트리 접시에 2mL의 인산염 완충 식염수(PBS)를 채웁니다. 준비된 세포층이 있는 삽입물을 꺼내 반연질 폴리스티렌 접시에 놓고 광학 현미경으로 중앙에 놓습니다. 맞춤형으로 수정된 펀치를 사용하여 현미경을 사용하여 타원형 프레임을 따라 캐리어를 잘라냅니다. 캐리어 치수는 2mm x 5mm여야 합니다.
- 캐리어를 적재하기 위해 평평한 투명 튜브가 있는 맞춤형 인젝터를 사용하십시오. 모세관의 말단부에서 6mm 떨어진 곳에 캐리어를 적재하기 위한 창이 있습니다. 인젝터의 창을 PBS로 채웁니다.
- 집게를 사용하여 접시 바닥에서 샘플을 방출하고 액체에서 들어 올린 다음 접착 세포가 있는 캐리어의 상단을 감지하기 위해 먼저 프레임의 측면 방향 표시를 확인하면서 주입기 창으로 운반합니다. 타원형 프레임은 캐리어로 조작을 용이하게합니다.
- 치과용 프로브(끝이 뾰족한 스테인리스 스틸 치과용 기구)를 사용하여 캐리어를 인젝터 창에 놓습니다. 플런저를 사용하여 캐리어를 인젝터의 닫히고 안전한 상부로 밀어 넣습니다. 그런 다음 수술을 위해 캐리어를 준비합니다.
- 각 단계에서 캐리어의 측면 방향을 확인하십시오. 금속 플런저를 밀어 인젝터에서 나노섬유 캐리어를 내립니다.

그림 4: 지지 PET 프레임이 내장된 나노섬유 캐리어. (A) 프레임에 3개의 가시 표시가 있어 캐리어의 측면 방향(흰색 화살표)을 제어할 수 있습니다. (B) 세포 운반체의 나노섬유막에 포매된 PET 프레임 단편의 확대도(흰색 화살표). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 주입 인젝터. (A) 인젝터의 부품. (B) 임플란트 인젝터의 플라스틱 직사각형 모세관에 로딩된 지지 PET 프레임이 내장된 나노섬유 세포 운반체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 수술 절차
- 수술 장비
- 다음 수술 장비를 사용하십시오: 안과용 수술용 현미경, 전방 및 후방 안구 수술용 운영 체제, 비접촉 유리체 망막 수술 시스템, 레이저 광응고 장치 및 디지털 카메라.
참고: 유리체 절제술, 엑소 및 엔도 소작, 레이저 광응고 장비에 사용되는 표준 매개변수는 표 1에 나와 있습니다.
- 다음 수술 장비를 사용하십시오: 안과용 수술용 현미경, 전방 및 후방 안구 수술용 운영 체제, 비접촉 유리체 망막 수술 시스템, 레이저 광응고 장치 및 디지털 카메라.
- 수술 기구
- 표준 프로토콜에 따라 이동식 오토클레이브 증기 멸균기 또는 이와 유사한 것으로 재사용 가능한 수술 기구를 소독합니다. 수술 중 필요한 일회용 수술 기구 및 재료는 재료 표에 나열되어 있습니다.
- 수술 단계 준비
- 단계 1.4.1에 기술된 바와 같이 동물을 마취한 후, 약물 유발성 산동을 유발하기 위해 시술 15분 전에 결막낭에 1% 트로피아미드 용액 점안액과 10% 페닐에프린 염산염 용액을 도포한다.
- 외과의를 위쪽 위치에 놓고 보조자를 옆 위치에 두고 수술대에 접근합니다(그림 3).
- 일회용 면도기로 눈 주위를 면도하고 거친 먼지를 제거합니다.
- 결막낭을 5% 포비돈 요오드 용액으로 5분 동안 소독합니다.
- 면봉으로 눈꺼풀에서 주변으로 문질러 안와 주위 부위를 소독하십시오. 10% 포비돈 요오드 용액을 사용하여 이 과정을 세 번 반복하고 5분 동안 그대로 두십시오.
- 끈적끈적한 투명 호일이 있는 표준 멸균 안과용 드레이프를 사용하여 가운데에 눈으로 수술 부위를 덮습니다. 속눈썹을 아이 글로브에서 멀리 옮깁니다. 수술 후 안내염의 위험을 줄이기 위해 속눈썹을 자르지 마십시오.
- 뚜껑 검경(Liberman-type 또는 Cook eye speculum)을 삽입합니다. 선택적으로 니트 테팅 멤브레인을 8-0으로 피부에 고정하십시오 폴리 글락틴 봉합사.
- 외과 용 겸자와 Westcott 결막 가위를 사용하여 경화술 용 공막을 노출시키기 위해 윤부에서 2mm에서 3mm 떨어진 코 쪽의 결막을 엽니 다.
- 윤부에서 2.5-3mm 떨어진 3 밸브 25G 투관침을 평평 부위에 삽입하십시오 (7시 방향, 10시 방향 및 11시 방향에 배치). 삽입하는 동안 후방 망막을 향해 약간 비스듬한 방식(100°-110°)으로 회전 운동을 사용하고 집게로 투관침을 잡습니다(그림 6).
- 삼투성 각막 부종을 예방하기 위해 전체 수술 중에 각막을 젖게 유지하거나 메틸셀룰로오스로 코팅하십시오.
- 편평 유리체 절제술(PPV)
- 표준 3포트 편평 유리체 절제술 접근법으로 유리체의 중간 부분을 제거합니다. 미래의 큰 경화술 부위에서 렌즈 뒤의 유리체를 조심스럽게 제거하십시오.
- 유리체강내 2-4mg의 트리암시놀론 아세토나이드(TA) 주사제(50-100μL)를 사용하여 제어된 후유리체 박리를 수행하기 위해 일반적으로 망막에 부착되어 있는 후유리체를 염색합니다.
- 그 후, 0.05-0.1 mL의 BSS를 41 G 캐뉼라와 함께 천천히 중앙에 주사하여 주변으로 출혈이 형성되지 않도록합니다.
- 일시적인 망막 혈관 폐색을 방지하기 위해 망막하 주사 동안 세척 시스템을 사용하여 안압 설정을 15mmHg로 줄입니다.
- 비강 기저부 근처에서 3mm 27G 내투석 요법 프로브를 사용하여 망막의 선형 큰 투과투석술을 수행합니다.
- 그 후, 25G MVR 블레이드 또는 관개 시스템의 안압(IOP) 설정이 최대 60mmHg인 수직 가위로 3mm에서 5분 동안 3mm 대형 망막 절개술을 합니다. 망막 절개술로 인한 출혈이 없는지 확인한 다음 IOP를 25mmHg로 줄입니다.
- 공막 표면에 부드러운 터치를 적용하여 27G 내투석 요법 프로브를 사용하여 윤부에서 2.5-3mm 떨어진 두 개의 비강 투관침 사이의 상공막 혈관의 외투석술을 수행합니다.
- 경화 절개술을 확대하기 전에 주입 병의 유체 레벨을 확인하십시오., 경화술 확대 후, 유체 소비가 일시적으로 높습니다.
- 2.75mm phaco knife를 사용하여 윤부에서 3mm 떨어진 3.0mm 대형 경화술을 만듭니다.
- 큰 경화술 내부의 공막 혈관과 모양체에서 발생할 수있는 출혈에주의하십시오. 출혈의 경우 27G 내투석 요법 프로브를 사용하여 손상된 혈관을 응고시킵니다. 주사기 끝(0.8mm x 2.8mm)을 수용할 수 있도록 새틴 나이프로 경화절개술을 3.0mm로 확대합니다.
- 유리체로 큰 경화술 부위에서 탈출 된 유리체를 제거하십시오. 유리체 절제술 시스템으로 BSS의 주입을 25-30 mmHg 수준으로 유지하여 지구 붕괴를 방지하십시오.
- 세포 운반체의 이식
- 큰 경화술을 통해 유리체강에 주로 사용하는 손으로 주입기를 부드럽게 삽입합니다. 저항의 경우, 경화술의 크기를 확대하십시오.
- 망막 절개술을 통해 세포 운반체를 망막하 공간에 이식합니다. 필요한 경우 이식 제어를 개선하기 위해 추가 경화술 및 샹들리에 조명과 함께 양손 기술을 사용하십시오.
- 눈에서 인젝터를 빼내고 8-0으로 큰 경화술을 닫습니다. polyglactin 봉합은 안내 내 hypotony와 관련된 합병증을 피하기 위해.
- 실리콘 팁 캐뉼라를 사용하여 완전한 유체-공기 교환(FAX) 및 망막하 유체의 배액을 수행합니다.
- 그 후, IOP가 정상이 될 때까지 유리체 절제술 시스템과 실리콘 오일 주입용 튜브 시스템을 사용하여 실리콘 오일(1,000cSt)을 유리체강에 주입합니다.
- 수술 중 영상 및 문서화
- 비디오 녹화 시스템을 사용하여 이식의 주요 단계에 대한 사진 문서와 함께 전체 수술 중에 비디오 녹화를 수행합니다.
- 안저 그리기 도식을 사용하여 경화술, 망막 절개술, 망막하 임플란트 및 발생한 합병증의 위치를 문서화하여 안저 그리기를 완료합니다.
- 수술 후 단계
- 수술이 끝나면 투관침을 제거하고 3 개의 경화술과 결막을 8-0으로 닫습니다. polyglactin 봉합사.
- 결막낭을 5% 포비돈 요오드 용액으로 헹굽니다.
- 겐타마이신 20mg, 덱사메타손 2mg 및 자일로카인 0.3mL를 결막하 주사합니다.
- 안저와 렌즈의 상태를 현미경으로 확인하십시오.
- 수술용 집게와 Westcott 결막 가위(선택 사항)를 사용하여 니칭 멤브레인에서 봉합사를 제거합니다.
- 네오마이신 연고 또는 ofloxacin 안과용 연고를 결막낭에 바릅니다.
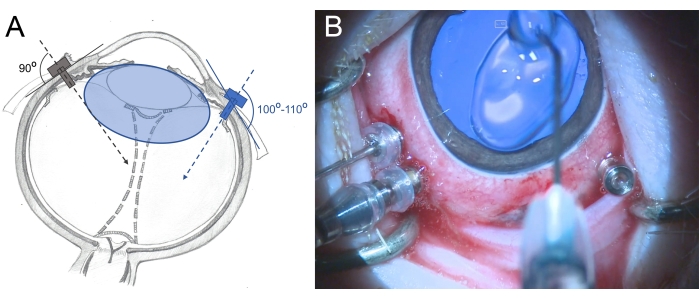
그림 6: 미니피그의 눈에 투관침 삽입. (A) 인간의 눈에서 유리체의 중심을 향해 공막에 수직으로 삽입되고(회색) 수정체의 손상을 방지하기 위해 미니피그 눈의 후방 망막을 향해 비스듬히 삽입되는 투관침의 개략도(파란색). minipig (파란색)의 수정체는 인간보다 크고 유리체 크기에 비례합니다. (B) 3포트 PPV에서 삽입된 투관침의 수술 중 모습. 각막은 건조와 부기를 방지하기 위해 메틸 셀룰로오스로 덮여 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 수술 후 관리
- 국소 바시트라신 아연/하이드로코르티손 아세테이트/네오마이신 설페이트 또는 0.3% 오플록사신을 동물의 결막낭에 하루에 5번 바릅니다.
- 수술 후 다음과 같은 눈 매개 변수를 확인하십시오 : 촉진을 이용한 눈의 연조직의 팽창, 눈 표면의 염증 반응, 휴대용 세극등 또는 간접 검안경을 사용하여 눈꺼풀의 보호 반응으로 곁눈질.
- 전신 수술 후 관리를 위해 다음 항생제를 사용하십시오.
- 안정성 2일째와 3일째에 3mg/kg BW(1mL/kg)의 용량으로 ceftiofur hydrochloride를 근육내 주사합니다.
- 2차 세균 감염 예방을 위해 수술 후 72시간 후에 툴라트로마이신(1mL/40kg BW)을 주사합니다.
- 통증을 예방하기 위해 수술 후 3 일 동안 24 시간마다 flunixin (체중 2mL / 45kg)과 트라마돌 염산염 (100mg)을 근육 주사합니다.
- 미니피그를 18-22 °C의 온도 범위와 13시간/11시간의 인공 명암비 체계를 갖춘 에어컨이 설치된 특수 시설에 보관하십시오.
- 물과 표준 먹이를 자유롭게 섭취할 수 있도록 합니다(하루에 두 번).
5. 수술 후 절차
- 수술 후 안과 검사
- 수술 후 기간에 간접 검안경으로 눈에 염증(예: 결막낭의 발적, 조직 부종 또는 점액 울혈)이 있는지 검사합니다. 촉진 방법을 사용하여 수술한 눈의 안압을 측정합니다.
- 수술 후 영상
- 안저 사진 촬영 및 OCT 검사 전에 TKX 혼합물을 근육내 주사하여 미니피그에서 진정을 유도합니다. 산동을 유도하기 위해 1% 트로피아미드와 10% 페닐에프린 염산염 점안액을 미니피그의 결막낭에 주입합니다.
- 눈을 뜨고 유지하기 위해 눈꺼풀 검경을 사용하십시오. 눈 표면에 수분을 공급하고 선명한 OCT 이미지를 얻으려면 30-60 초마다 식염수 (0.9 % NaCl)로 동물의 각막을 씻으십시오.
- 수술 중과 동일한 방식으로 미니피그를 수술대에 놓습니다(그림 2B, C, 그림 3A). 주요 요구 사항은 헤드를 OCT 장치의 스캔 조각에 수직으로 측면에 배치하는 것입니다. 동물의 아래에 스티로폼 패드를 사용하여 머리를 안정시키고 눈 표면을 수평 위치로 가져옵니다.
- 컬러 비산동 안저 카메라로 컬러 안저 이미지를 수집하면 전안부, 망막 및 시신경을 문서화할 수 있습니다. 또한 non-mydriatic fundus camera로 망막의 적색 없는 이미지를 촬영합니다.
- 스펙트럼 영역 OCT 시스템을 사용하여 광간섭 단층 촬영 이미징을 수행합니다. OCT 또는 안저 이미징 중에 미니피그의 머리를 OCT 렌즈 또는 안저 카메라 렌즈 쪽으로 수동으로 기울여 view 후방 망막과 이식 부위를 최적화합니다(그림 2C). 안저에 이식된 캐리어를 최적으로 이미징하려면 OCT 장치의 적외선 반사광을 적용하여 임플란트에 초점을 맞춥니다(그림 2C). OCT 크로스라인 및 망막 맵 스캔 모드를 사용합니다.
- 동물의 눈꺼풀 아래 검사가 끝날 때 ofloxacin 안과 연고를 바르십시오.
- 미니피그를 실내 시설로 옮기고 진정제가 끝날 때까지(약 2시간에서 5시간) 일반적인 상태를 관찰합니다.
6. 안락사 후 안구 적출
- TKX 혼합물을 근육주사한 후 1% 프로포폴(20mL/동물)을 정맥내(22G 귀 캐뉼라를 통해) 볼루스 도포한 후 방혈을 하여 미니피그를 진정시킵니다. 일반 고정제를 사용하지 마십시오.
- 세포이식 이식 후 7일, 14일, 28일 및 42일째에 심부 전신 마취 동안 피를 흘려 동물을 희생시킨다.
- 집게와 가위를 사용하여 위아래 눈꺼풀을 제거합니다. 세 번째 눈꺼풀을 제거하고 결막을 자릅니다. 눈 근육과 시신경을 자릅니다.
- 수술 용 가위와 수술 용 집게를 사용하여 사후 눈을 적출합니다. 절차가 숙련 된 사람에 의해 수행되었는지 확인하십시오.
Representative Results
Liběchov minipigs에서 세포 운반체의 망막하 이식 결과는 Table 2에 제시되어 있습니다. 성공적인 이식은 조직학적 및 면역조직화학적 연구를 위한 충분한 데이터를 얻는 것으로 정의되었습니다. 실패한 사례는 심각한 수술 중 합병증이 있는 눈으로 정의되어 눈 조직을 더 이상 관찰할 수 없었습니다.
실리콘 오일 탐폰을 사용하여 제안된 기술을 적용하면 수술 후 다음날부터 적출 시점까지 이미징 양식을 사용하여 망막하 이식의 상태를 제어할 수 있습니다(그림 7, 그림 8 및 그림 9).
안저 영상 및 SD-OCT
미니피그는 수술 후 기간 동안 안저 영상, 적색 없는 영상 및 스펙트럼 도메인 광간섭 단층촬영을 사용하여 검사했습니다(그림 7). 투명 렌즈와 실리콘 오일 탐폰을 포함한 투명 광학 매체를 사용하여 고품질 안저 이미징을 가능하게 했습니다(그림 7A). 망막 절개술 부위는 증식 반응의 징후를 보이지 않았으며(그림 7A, 노란색 화살표), 세포 운반체의 PTE 프레임은 돼지 망막의 반투명층을 통해 명확하게 볼 수 있었습니다. 적색이 없는 이미징에서 담체 상에서 배양된 hRPE의 반사율은 내인성 돼지 RPE 층의 반사율과 다르지 않았습니다(그림 7B). SD-OCT에서 PTE 프레임은 기본 해부학적 구조의 약간의 그림자와 망막의 약간의 두꺼움을 유발했습니다(그림 7C, 빨간색 화살표). SD-OCT에서 비정형 저반사 또는 과반사 영역은 발견되지 않았으며 Bruch의 막도 손상되지 않은 상태로 유지되는 것으로 나타났습니다. 그림 8은 수술 1개월 후 일차 인간 RPE 세포로 배양된 스캐폴드의 안저 및 iOCT 이미지를 보여줍니다(그림 8). 세포 운반체 자체(세포가 없음)는 망막 두께의 유의한 증가를 일으키지 않았습니다(그림 9C). 이러한 발견은 임플란트의 수술 중 의원성 영향이 최소화되고 이식된 세포 운반체가 이식된 세포가 위에 놓인 광수용체 세포 및 신경망막 조직에 충분한 적응을 겪었음을 시사합니다.
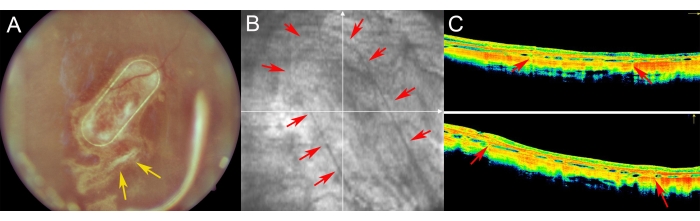
그림 7: 미니피그의 망막 수술 후 영상. (A) 안저 영상, (B) 적색 없는 영상, (C) 미니피그 눈에서 망막하 이식 후 1주일 추적 관찰에서 일차 인간 RPE 세포를 사용한 나노섬유 담체의 광간섭 단층촬영 영상. (A) 노란색 화살표는 망막 절개술 부위를 나타냅니다. (B) 빨간색 화살표는 나노섬유 세포 운반체의 가장자리를 나타냅니다. (C) 빨간색 화살표는 망막하 공간에 이식된 나노섬유 캐리어의 지지 PET 프레임에 의해 발생하는 OCT 신호의 약간의 그림자를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
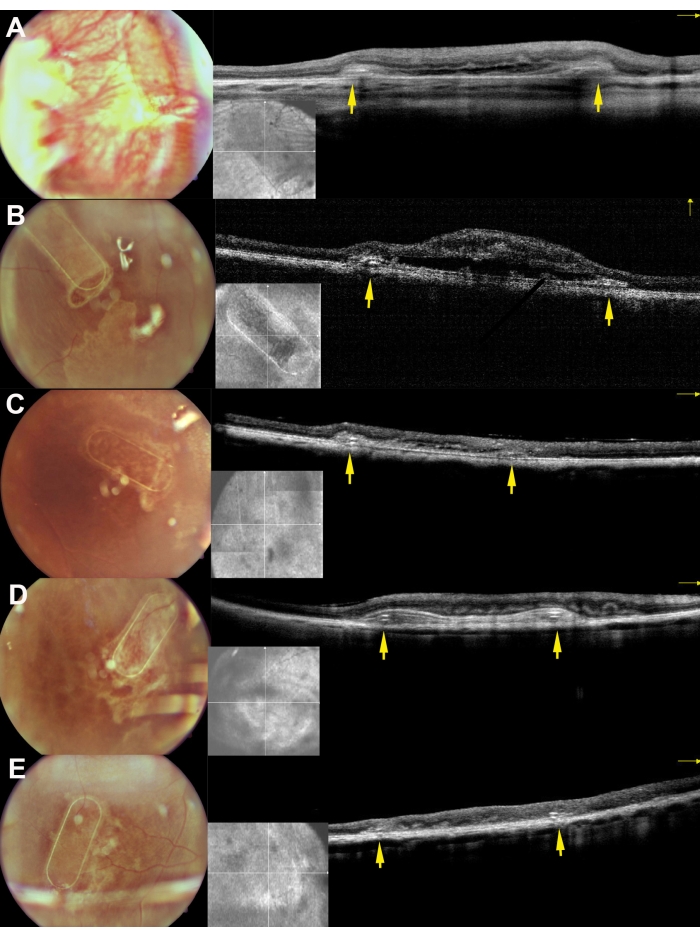
그림 8: 미니피그에서 망막하 이식 30일 후 스캐폴드의 안저 이미징 및 iOCT 이미지. A, B, C, D, E 는 각각 돼지 169, 182, 179, 199, 224에 해당한다. 노란색 화살표는 비계의 프레임을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
조직학적 및 면역조직화학적 분석
동물을 안락사시킨 후, 미니피그 눈 전체를 제거하고 24시간 동안 4% 파라포름알데히드(PFA)에 고정했습니다. 눈의 앞부분을 제거하고, 이식된 나노섬유 담체를 비강 중앙 망막에서 확인하고 공막이 부착된 상태로 분리하였다. 모든 조직은 등급이 매겨진 수크로스 용액에서 냉동 보호되었고, 수직 동결 절편은 상세히43에 기재된 바와 같이 절단되었다. 이식 4주 후 RPE 세포가 없는 나노섬유막의 조직학은 염증 및 퇴행성 변화가 없는 망막을 나타냈습니다(그림 9A). 나노섬유질막의 존재는 편광에서 검출되었다(도 9B).
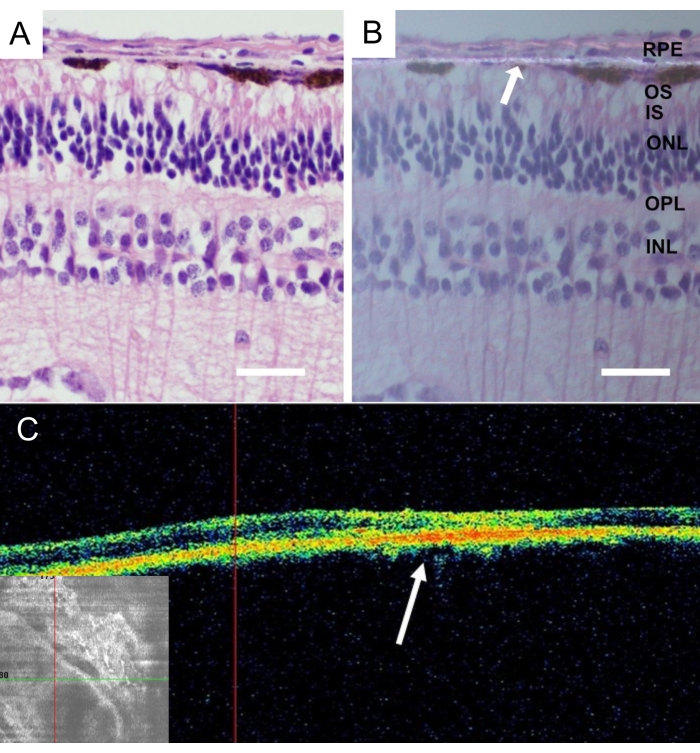
그림 9: 이식된 무세포 나노섬유막의 조직학적 분석. 이식 4주 후 무세포 나노섬유막을 헤마톡실린-에오신 염색하여 (A) 표준 조명으로 및 (B) 편광 현미경으로 염색하였다. 흰색 화살표는 나노섬유막 국소화를 나타냅니다(스케일 바: 50μm). (C) 이식 후 4주 후의 무세포 나노섬유막의 생체내 광간섭 단층촬영 사진은 망막하 공간에서 나노섬유막의 양호한 수용 및 부착을 나타낸다. 흰색 화살표는 망막의 단면상에서 임플란트의 위치를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 10은 미니피그 눈의 나노섬유 담체(노란색 화살표)에 이식된 일차 hRPE 세포를 포함하는 망막 영역의 헤마톡실린-에오신 (H&E) 염색을 나타낸 것이다. 이식된 1차 hRPE의 착색된 외관은 연속적이지만 불규칙한 착색층을 형성했습니다(그림 10, 빨간색 화살표). 더 긴 관찰 기간(6주) 후, 임플란트 아래의 신경망막은 의원성 조작의 결과일 가능성이 있는 망막 절개술 부위 주위에 로제트와 유사하거나 비대성 반응과 유사한 모양을 보였습니다. 이러한 형태학적 결과는 SD-OCT 소견과 유사하며 망막 조직에 대한 운반체 전달의 최소 영향에 대한 증거를 뒷받침합니다.
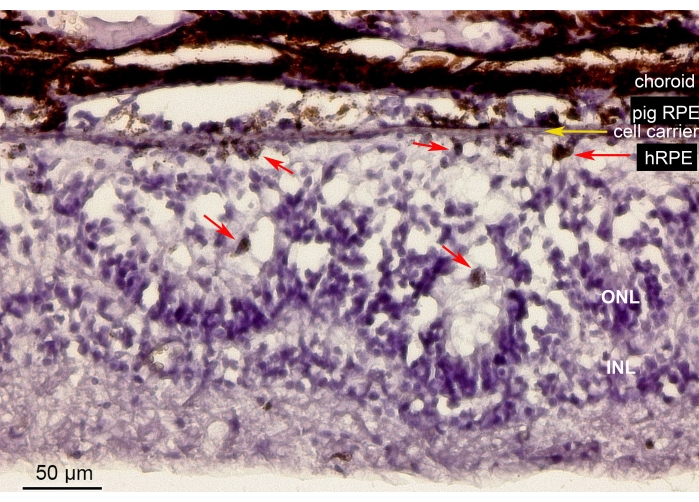
그림 10: 1차 hRPE를 사용한 이식된 나노섬유막의 조직학적 분석. 헤마톡실린-에오신 미니피그 눈에 1차 hRPEs를 이식한 나노섬유 담체(노란색 화살표)를 포함하는 망막 영역의 염색. 동물을 안락사시키고 이식 6주 후에 분석하였다. 1차 hRPE는 광수용체 반대편 망막하 공간의 크기, 둥근 모양 및 색소침착(빨간색 화살표)으로 명확하게 구별할 수 있었습니다. ONL의 광 수용체 핵은 로제트와 같은 구조를 만듭니다. 망막하 공간은 비대하게 보입니다. 약어: hRPE = 일차 인간 망막 색소 상피, ONL = 외부 핵층, INL = 내부 핵층. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
면역염색은 2단계 간접 방법을 사용하여 수행하였다. 절편을 단클론 1차 항체인 CRALBP에서 하룻밤 동안 실온에서 1:100으로 희석하여 배양했습니다. 면역형광은 Alexa Fluor 488-conjugated secondary antibody를 사용하여 수행하였다.
이식된 1차 hRPE는 이식 부위에 존재하였고, 내인성 미니피그 RPE 세포와 유사한 전형적인 RPE CRALBP 마커를 발현하였다(도 11A). 대조적으로, 이식된 세포의 형태는 이식 후 단층 형태를 취하지 않고 정의된 망막하 공간 내에 국한된 상태로 남아 있는 것으로 나타났습니다(그림 11A, B, 흰색 화살표). 다음 RPE/망막 마커 및 형태학적 외관은 이식 후 6주 후에도 양성으로 유지되었습니다: 색소/멜라닌 과립의 존재, 간상 양극성(PKC-알파) 및 원추 광수용체(PNA)에 대한 말기 망막 특이적 뉴런 마커, GFAP 양성 - 소교세포 활성화의 징후.
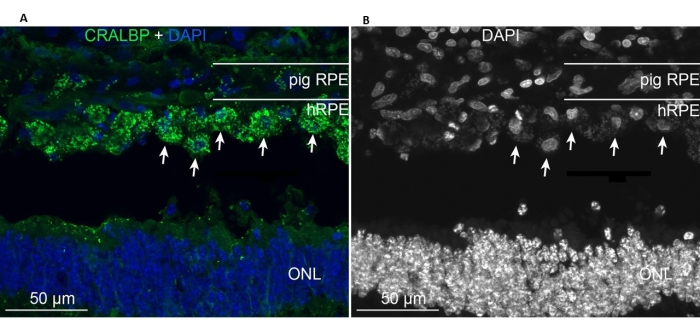
그림 11: 1차 hRPE 이식 6개월 후 미니돼지에서 RPE 세포 마커 CRALBP(세포 레틴알데히드 결합 단백질 )를 사용한 면역표지. (A) 처리된 돼지 눈의 수직 냉동 절편을 CRALBP 단클론 항체(녹색)로 면역표지하고 DAPI(파란색)로 대조염색했습니다. (B) DAPI를 사용한 세포핵 표지를 흑백으로 단일 묘사한 것으로, 고대비는 개별 hRPE 세포의 둥근 모양을 나타냅니다(일부는 흰색 화살표로 표시됨). 약어: hRPE = 인간 망막 색소 상피, ONL = 외부 핵층. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
안구 합병증
총 29 개 중 27 개 (93.1 %)가 성공적으로 작업을 수행했습니다. "성공적으로 수술을 수행했다"는 정의는 조직학적 및 면역조직화학적 연구에 영향을 미칠 수 있는 적출술 시점까지 수술된 눈이 임상적으로 유의한 수술 후 합병증을 나타내지 않은 경우에 적용되었습니다. 광학 매체의 투명도 감소는 4건(13.7%)에서 수술 후 영상에 영향을 미쳤습니다. 그럼에도 불구하고, 이 눈은 추가적인 조직학적 및 면역조직화학적 분석으로 처리되었습니다.
수술 중 말초 망막 박리는 4 건 (13.8 %)에서 발생했다. 두 가지 경우, 유체-가스 교환 중 망막하액의 흡인과 박리 부위에 망막의 레이저 광응고술을 적용하여 관리했습니다. 다른 두 가지 경우 (6.9 %)에서 망막 박리는 대규모 망막 및 망막 하 출혈과 관련이 있었으며, 이로 인해 세포 운반체의 이식이 불가능 해졌고 수술대에있는 동안 수술이 종료되고 미니 돼지가 즉시 안락사되었습니다.
| 아니요 | 매개 변수 | 표준 사용 설정 |
| 1 | 유리체 절제술 속도(절삭 속도) | 최대 20,000 컷/분 |
| 2 | 벤츄리 펌프 | 50-180 mmHg |
| 3 | 상승 시간 | 1 초 |
| 4 | 관개 압력 | 18-25 mmHg |
| 5 | 공기 주입 압력 | 20-25 mmHg |
| 6 | 양극성 외투석술 | 18-26% |
| 7 | 단극성 endodiathermy | 16-18% |
| 8 | 망막의 레이저 광응고, 532nm | 힘: 100-150 mW |
| 간격 100ms | ||
| 기간 100ms |
표 1: 유리체 절제술 및 레이저 광응고술 중에 사용되는 표준 매개변수.
| 총 동물, n | 18 |
| 총 눈, n | 36 |
| 수술된 눈, n | 29 |
| 성공적인 이식, n | 27 |
| 실패한 사례, n | 2 |
| 평균 수술 시간, 분 | 57 |
| 성공률, % | 93.1 |
표 2: 2016년에서 2020년 사이에 Liběchov 미니피그에서 세포 운반체의 망막하 이식을 통한 표준화된 수술 기술의 결과.
보충 파일 1: 세포 운반체에 대한 RPE 세포의 망막하 이식에 전념하는 연구 요약. 이 파일을 다운로드하려면 여기를 클릭하십시오.
Discussion
기원이 다른 RPE 세포의 망 막하 이식은 AMD 3,4,8,9,10,11,12,13,14,15,25와 같은 망막 퇴행성 장애의 치료를 위한 안구 연구에서 매우 유망한 추세입니다 . 이 접근법의 주요 아이디어는 손상된 RPE를 생체 외에서 배양된 건강한 RPE로 대체하는 것입니다(보충 파일 1)44,45,46,47,48. 배양된 RPE 세포를 이식하기 위해 세포 운반체를 사용하는 것은 다공성 막이 광감각층과 관련하여 편광된 RPE 세포층을 올바른 방향으로 유지하기 때문에 가장 합리적인 접근 방식을 나타냅니다.
최적 동물 모델
이러한 치료 접근법을 개발하는데 있어서 중요한 단계는 최적 동물 모델(49)의 사용이다. 과거에는 토끼, 개, 돼지 및 비인간 영장류를 포함한 크고 작은 동물 모델이 사용되었습니다 8,9,10,11,12,13,14,15,27,29. 이 논문에서 우리는 Liběchov minipig 모델의 사용을 제안하고 강력한 이식 효과를 가능하게 하는 수술 전, 수술 및 수술 후 단계를 설명합니다. Liběchov minipig는 원래 약 20 년 전에 사육되었으며 파킨슨 병 및 헌팅턴 병29,50과 같은 신경 퇴행성 질환 분야의 생물 의학 연구에 자주 사용되었습니다. 돼지는 인간과 유사한 혈액 공급 및 면역 반응을 가진 비교적 큰 뇌를 가지고 있기 때문에 동종 이식 실험의 동물 모델로도 사용되었습니다51,52,53,54. 미니피그의 망막은 인간과 같은 황반과 중심와를 가지고 있지 않지만, 원추형 광수용체가 고농도인 망막 영역인 중심과 시각 줄무늬를 포함하고 있다(30). 인간의 눈과 유사한 크기, 원뿔이 풍부한 중심 망막의 존재, 잘 설명된 면역 체계, 수술 후 형태 및 기능을 평가하는 방법의 존재는 제시된 연구에서 이 큰 동물 모델을 사용하는 데 중요한 논거입니다.
수술
우리가 아는 한, 보균자에 대한 RPE 세포의 유리체 망막 이식을 위한 표준화되고 널리 인정되는 수술 기술은 없습니다. 세포 대체 요법의 주요 문제 중 하나는 망막 박리, 저긴장, 상과, 맥락막 및/또는 망막 출혈, 높은 안구 난류와 관련된 수술 중 및 수술 후 합병증의 위험이 있는 까다로운 수술 기술로, 이는 스캐폴드 손상으로 이어질 수 있습니다. 수술 후, 증식성 유리체 망막병증, 안내염, 저긴장, 망막 박리 및 백내장 형성의 위험이 있다 4,10,13,14,15.
세포 운반체를 이용한 접근법에 대한 첫 번째 연구는 친칠라 놈 토끼13,16,25에서 수행되었다. 이 동물들은 작은 동물 모델을 대표하지만, 수술의 기술적 측면에 초점을 맞춘 결과는 큰 동물 모델에서 절차를 개발하는 데 결정적이었으므로 아래에 요약되어 있습니다.
주문 제작한 23 G 주입 캐뉼라는 처음에 제트 기류의 방향을 바꾸기 위해 두 개의 측면 포트와 함께 사용되었으며, 이는 안검의 붕괴와 그에 따른 망막 박리를 해결하는 데 도움이 되었다13. 본 연구에서, 우리는 그러한 블레브의 붕괴를 발견하지 못했습니다. 그 가능한 이유는 안구의 크기가 더 크고 캐뉼라 주입 부위의 주변에 유리체가 남아 있는 코어 유리체 절제술의 성능 때문일 수 있으며, 이는 지시된 제트 기류의 힘을 감소시킬 수 있습니다.
기구에서 세포 운반체를 배출하는 동안의 어려움은 "기구에 갇힌" 것으로 분류된 작은 동물 모델의 또 다른 수술 중 장애물이었습니다. 또한, 저자들은 망막 표면의 잔류 유리체가 이식 후 망막 절개술 구멍에서 캐리어의 역방향 "점프"를 유발할 수 있다고 제안했습니다. 이 문제는 효소 보조 유리체 절제술로 해결할 수 있으며, 이를 통해 세포 운반체를 망막하 공간으로 부드럽고 지속적으로 배출할 수 있습니다. 대부분의 경우 저자는 망막 절개술에서 멀리 떨어진 임플란트의 더 먼 위치를 얻기 위해 캐리어를 재배치했습니다. 우리의 사례 시리즈에서, 우리는 또한 세포 캐리어가 인젝터의 팁에 부착 된 상태를 경험했습니다. 그러나 이는 광 파이프와 인젝터의 팁을 느리고 부드럽게 조작하여 관리되었습니다. 우리는 어떤 경우에도 망막 절개술 부위에 잔류 유리체를 관찰하지 못했습니다. 수술에서 TA 보조 PPV를 사용하는 것은 잔류 부착 유리체의 위험을 줄이는 방법으로 제안될 수 있습니다. 위에 있는 유리체를 완전히 제거하기 위해 TA를 사용한 다중 염색이 필요할 수 있습니다.
다른 연구에서, 폴리에스터 막에 편광된 세포 단층으로 성장한 인간 RPE 줄기 세포의 망막하 이식 결과가 보고되었습니다24. 실험 중에, 이전에 기술된 것과 동일한 수술 기법이 사용되었지만(13), 2-포트 PPV 접근법이 적용되었다. 마지막으로, 토끼에서 세포 운반체 수술의 망막하 이식을 위한 단계별 프로토콜이25일 이후에 발표되었습니다. 이 연구는 이전 경험을 기반으로 수술 전 및 수술 후 관리를 포함하여 수술 절차에 대한 매우 상세하고 쉽게 반복 가능한 설명을 제공합니다.
후속 연구에서 대형 동물 모델을 사용하는 동안 기술적인 문제뿐만 아니라 이식된 세포에 대한 면역 반응에 관한 질문과 세포 운반체 크기 관련 문제도 다루었습니다. 시노몰구스원숭이(Macaca fascicularis)를 이용한 연구에서는 인간 줄기세포 유래 RPE 단층의 망막하 이식 결과를 설명했다15. 모든 동물은 수술 7일 전부터 수술 후 3개월 동안 지속되는 시롤리무스(부하 용량 2mg, 일일 용량 1mg) 및 테트라사이클린(7.5mg/kg-BW)으로 구성된 전신 면역억제를 받았습니다. 수술 절차는 이전에 설명한 프로토콜24,25에 따라 수행되었습니다. 저자는 샹들리에 엔도 조명과 함께 25G 3포트 PPV 접근 방식을 사용했습니다. 중요하게도, TA 보조 PVD는 후방 망막의 잔류 유리체 망막 유착을 배제하는 데 사용되었습니다. 원래 설명된 절차에 추가하여 저자는 20G 맞춤형 확장 가능한 루프 기기를 사용하여 향후 이식 영역에서 호스트 RPE 층을 제거했습니다.
미니피그 연구에서는 전신 면역억제제도 사용했습니다. 그러나 면역 억제의 유형은 위에서 설명한 것과 다릅니다. 우리는 세포 이식 거부 및 염증 반응을 방해하기 위해 0.25mg/kg BW의 용량으로 저장소로 타크로리무스 용출 폴리머 마이크로스피어를 피하 주사했습니다. 우리의 주요 목표는 절차의 안전성과 이식된 세포의 생존력을 분석하는 것이었지만 숙주 망막으로의 통합은 분석하지 않았기 때문에 수술 중 숙주 RPE 세포층을 제거하지 않았습니다.
이전에는 14마리의 암컷 유카탄 미니피그에서 접을 수 있는 비분해성 메쉬 지지 서브미크론 파릴렌-C 멤브레인(6.25mm x 3.5mm, 0.4μm 두께)에 hESC 유래 RPE의 단층을 이식하는 망막하 이식의 안전성과 타당성을 평가했습니다10. 배양 후, 세포를 메쉬 지지 막에 시딩하였다. 면역억제는 타크로리무스의 전신 투여(정권 및 용량 없음)와 수술 종료 시 덱사메타손 임플란트 0.7mg의 유리체강내 주사를 사용하여 수행되었습니다. PPV는 20G 접근 방식으로 수행되었습니다. 저자는 유리체의 더 나은 시각화를 위해 트리암시놀론 아세토니드의 유리체강내 주사를 사용했습니다. 큰 경화 절제술은 크기가 2mm에서 3mm였습니다. 망막하 주사 후, 망막은 과불화탄소 액체의 일시적인 주사로 평평해졌습니다. 유체-공기 교환 후, 실리콘 오일 탐폰(1,000/5,000 cSt)을 수행하였다. 수술 후 관리에는 수술 1주일 후 덱사메타손/네오마이신/폴리믹신 B 연고의 안구 도포가 포함되었습니다. 저자는 91%의 성공률을 보고했습니다(즉, 효율적인 망막하 이식 및 충분한 수술 후 영상 데이터). 본 연구에서는 TA 결정의 유리체강내 주사를 수술 중 주로 유리체체를 시각화하는 데 사용했습니다. 그러나이 약물의 국소 면역 억제 작용은 아직 명확하지 않습니다. 본 연구에 사용된 나노섬유 세포 운반체는 두께가 5.2mm x 2.1mm이고 두께가 3.7μm이고 기공 크기가 0.4μm입니다. 수술 중 과불화탄소 액체를 주입하는 대신 직접 FAX를 시행했습니다. 수술 성공률(93.1%)은 Koss et al.10과 일치하고 약간 더 높았다.
망막하 이식을 위한 완전 분해성 세포 운반체(스캐폴드)의 망막하 이식은 2019년 요크셔 돼지14마리에서 처음 연구되었습니다. 이 연구는 주로 피브린 하이드로겔 임플란트의 생분해성 특성에 초점을 맞췄습니다. 저자들은 국내 돼지에 사용 된 공격적인 면역 억제가 피브린 하이드로 겔 임플란트의 생분해 중에 잠재적으로 유발 될 수있는 국소 염증 반응을 억제 할 수 있다고 언급했다. 그러나 그들은 돼지에 사용 된 면역 억제 요법을 명시하지 않았다. PPV 동안 그들은 윤부와 평행하고 약 3.5mm 뒤쪽에 망막하 이식 장치를 삽입하기 위해 3.6mm 길이의 경화술을 수행했습니다. 또한 손가락 조작으로 인한 손 배치 불안정성을 줄이기 위해 공압 구동 주입 시스템을 사용했습니다. 우리의 경우 시리즈에서 모든 경화술은 윤부에서 2.5mm에서 3.0mm였습니다. 인젝터 삽입을 위한 대형 경화절개술의 길이는 3mm였습니다. 본 연구에 사용된 임플란트 인젝터는 수작업으로 조작하였다. 모양체의 편평상근에 대한 철저한 소작과 큰 경화술 내부의 충분한 절개는 의원성 말초 망막 박리, 출혈 및 임플란트 손실과 같은 수술 중 합병증을 피하는 데 중요한 것으로 보입니다.
요약하면, 우리는 유전 및 후천성 망막 질환의 치료 옵션으로 생분해성 담체에 RPE 세포를 이식하기 위한 Liběchov minipig 모델의 사용을 설명합니다. 안구 해부학 및 생리학뿐만 아니라 면역 체계와 관련하여 우리는 인간의 안구 질환 치료로 쉽게 전환 될 수있는 세포의 망막 하 이식을위한 수술 기술 및기구를 개발하고 개선 할 수 있습니다. 미니피그에 대한 수술은 인간 수술에 활용될 때 동일한 기구(이식 전달 도구 포함)를 사용하여 수행되어 얻은 경험과 노하우를 인간에게 쉽게 적용할 수 있도록 하는 것이 중요합니다. 비인간 영장류와 같은 황반 영역이 존재하는 대안적인 대눈 동물 모델은 중앙 망막 영역에서 망막하 이식 후 해부학적 및 기능적 변화의 추적 및 분석에 유용할 수 있습니다. 수술 전, 수술 및 수술 후 관리 절차에 대한 자세한 설명은 효율적이고 표준화된 데이터 생성을 증가시켜 향후 연구에 유용할 것입니다.
Acknowledgements
이 프로젝트는 체코 과학 재단(프로젝트 번호 18-04393S)과 체코 공화국 노르웨이 보조금 및 기술 기관(KAPPA 프로그램, 프로젝트 번호 TO01000107)의 지원을 받았습니다.
Materials
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
References
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved