Subretinal implantasjon av RPE på en bærer i minigriser: retningslinjer for preoperative preparater, kirurgiske teknikker og postoperativ behandling
* These authors contributed equally
In This Article
Summary
Den subretinale implantasjonen av retinalpigmentert epitel (RPE) er en av de mest lovende tilnærmingene for behandling av degenerative retinale sykdommer. Imidlertid er ytelsen til prekliniske studier på store øyedyrmodeller fortsatt utfordrende. Denne rapporten presenterer retningslinjer for subretinal transplantasjon av RPE på en cellebærer i minigriser.
Abstract
Degenerative forstyrrelser i netthinnen (inkludert aldersrelatert makuladegenerasjon), som primært stammer fra eller innenfor retinalpigmentert epitel (RPE), fører til en progressiv disorganisering av retinalanatomien og forverring av visuell funksjon. Substitusjonen av skadede RPE-celler (RPE) med in vitro-dyrkede RPE-celler ved bruk av en subretinal cellebærer har vist potensial for å gjenopprette den anatomiske strukturen til de ytre retinale lagene og blir derfor studert videre. Her presenterer vi prinsippene for en kirurgisk teknikk som muliggjør effektiv subretinal transplantasjon av en cellebærer med dyrkede RPEer til minigriser. Operasjonene ble utført under generell anestesi og inkluderte en standard linsesparende tre-port pars plana vitrektomi (PPV), subretinal påføring av en balansert saltløsning (BSS), en 2,7 mm retinotomi, implantasjon av en nanofibrøs cellebærer i subretinalrommet gjennom en ytterligere 3,0 mm sklerotomi, væske-luftutveksling (FAX), silikonoljetamponade og lukking av alle sklerotomiene. Denne kirurgiske tilnærmingen ble brukt i 29 operasjoner (18 dyr) de siste 8 årene med en suksessrate på 93,1%. Anatomisk verifikasjon av operasjonsplasseringen ble utført med in vivo fundusavbildning (fundusfotografering og optisk koherenstomografi). De anbefalte kirurgiske trinnene for subretinal implantasjon av RPE på en bærer i minigrisøyne kan brukes i fremtidige prekliniske studier ved bruk av store øyedyrmodeller.
Introduction
Aldersrelatert makuladegenerasjon (AMD) regnes som hovedårsaken til sentralt synstap i utviklede land og er en av mange forhold relatert til retinalpigmentert epitel (RPE) dysfunksjon 1,2. RPE finnes på den basalt lokaliserte Bruchs membran (BM) og gir nødvendig vedlikehold for fotoreceptorene. Den progressive degenerasjonen av RPE-laget er et kjennetegn ved den tidlige atrofiske formen for AMD, og den følger også med utviklingen av den sene eksudative formen for AMD også. Til tross for mange fremskritt innen retinal sykdomsterapi, er utviklingen av en effektiv behandlingsmodalitet fortsatt utfordrende3. En av de lovende metodene er RPE-erstatning ved hjelp av et in vitro-dyrket RPE-lag. Denne behandlingen er assosiert med fremgang i stamcelleforskning ved bruk av human embryonal stamcelleavledet RPE (hESC-RPE) og indusert pluripotent stamcelleavledet RPE (iPSC-RPE) 3,4,5,6,7. I de senere år har mange forskningsgrupper fokusert på å utvikle ulike tilnærminger for RPE-erstatning med det opprinnelig aksepterte proof-of-concept 8,9,10,11,12,13,14,15. RPE-cellene (RPE) leveres vanligvis inn i det subretinale rommet i form av en cellesuspensjon, et selvbærende celleark eller et cellemonolag støttet av en kunstig bærer 3,16,17,18,19,20,21. Injeksjon av en cellesuspensjon er den enkleste metoden, men den kompromitterte tilstanden til BM kan ofte forhindre vedlegg av de transplanterte cellene. Dette kan resultere i feil apikobasal orientering av RPEene og manglende dannelse av et monolag22,23. Den største fordelen med de to andre metodene (dvs. et selvbærende celleark og et cellemonolag støttet av et kunstig substrat) er at cellene allerede er i en differensiert monolagstilstand når de implanteres direkte i subretinalrommet24.
Mange kirurgiske teknikker som beskriver levering av cellebærere i subretinalrommet har blitt publisert de siste årene 8,9,10,11,12,13,14,15. Disse studiene beskrev bruken av store øye dyremodeller, typer cellulære bærere, bruk av transplanterte cellulære kulturer, implantasjonsinstrumenter, samt kirurgiske teknikker, og forfatterne fokuserte hovedsakelig på resultatene av subretinal implantasjon. I 2015 rapporterte Popelka et al. bruken av en rammestøttet ultratynn elektrospunnet polymermembran for transplantasjon av RPE i svinekadaver øyne8. Den kirurgiske teknikken beskrevet her med subretinal implantasjon av cellebæreren tillot relativt presis håndtering av bæreren og enkel posisjonering av stillaset i subretinalrommet. Kozak et al. vurderte muligheten for leveringsteknikken til en transportør med en omtrentlig størrelse på 2 mm x 5 mm i svineøyne9. Den unike utformingen av cellebæreren tillot riktig plassering, og forhindret det cellulære monolaget i å brette seg og rynke6. Al-Nawaiseh et al. presenterte først detaljerte trinnvise retningslinjer for subretinal stillasimplantasjon hos kaniner25. Stanzel et al. publiserte deretter en lignende protokoll i 2019 for transplantasjon hos smågnagere, kaniner, griser og ikke-menneskelige primater26. Som tidligere publisert resulterte transplantasjon av et differensiert og polarisert RPE-monosjikt på en fast bærer i bedret overlevelse og bedre integrering av transplantatet sammenlignet med andre forløsningsteknikker (tilleggsfil 1)27.
Formålet med alle prekliniske dyrestudier utført in vivo er å avdekke de ulike aspektene ved kirurgisk transvitreal subretinal implantasjon av en cellebærer med fokus på prosedyren sikkerhet, overlevelse av de transplanterte cellene, vevsrespons på subretinale manøvrer og kortsiktige og langsiktige postoperative utfall. Bruken av svineøyne som en storøyet dyremodell har blitt rapportert å være relevant med tanke på omfanget av dataene som er innhentet, noe som kan være nyttig og potensielt anvendelig for mennesker10,11,14. Vår studie rapporterer den kirurgiske teknikken som brukes til in vivo subretinal implantasjon av en cellebærer i en storøyet dyremodell. Vi presenterer en detaljert beskrivelse av preoperative preparater, kirurgisk teknikk for subretinal cellebærerimplantasjon og postoperativ pleie av minigrisøynene basert på vår erfaring de siste 8 årene. Vi beskriver de grunnleggende kirurgiske prinsippene som kan brukes til in vivo eksperimentelle studier som involverer implantasjon av ulike typer celler og cellebærere.
Stor dyremodell
Den eksperimentelle flokken av Liběchov minipigs ble grunnlagt ved å importere fem dyr fra Hormel-stammen fra USA i 1967. Disse dyrene ble krysset for blodgruppestudier av svin med flere andre raser eller stammer: Landrace, Large White, Cornwall, vietnamesiske griser og miniatyrgriser av Göttingen opprinnelse28,29. Ved 5 måneders alder og ca. 20 kg kroppsvekt blir minigrisene kjønnsmodne. Overlevelsen av foreldrenes minigrisraser (Hormel og Göttingen) er rapportert å være 12-20 år. Den subretinale implantasjonen av cellebæreren retter seg mot den sentrale delen av netthinnen. Netthinnen av minipigs mangler en makula og fovea. Imidlertid har den regioner med høyt konsentrerte kjeglefotoreseptorer kalt området centralis og visuelle striper30,31. Disse områdene er ansvarlige for den høyeste synsstyrken.
Operasjonene ble utført av fire erfarne vitreoretinale kirurger med hjelp av en erfaren kirurgisk anleggsassistent (TA). Før in vivo-eksperimentene ble kirurgene utdannet og oppnådd spesiell kunnskap om minipig øyeanatomi, for eksempel med hensyn til det lavere forholdet mellom linse og glassvolum, den kortere aksiale lengden (15-19 mm), fraværet av Bowmans membran i hornhinnen, det mindre glassvolumet (2, 8-3, 2 ml), fraværet av makula og fovea, fraværet av ringrommet til Zinn, og den optiske skivediameteren (vertikal/horisontal: 1,5 mm/2,1 mm). I alle tilfeller ble operasjonen utført under generell anestesi i et spesielt organisert operasjonsrom med implementering av standard aseptiske og antiseptiske tiltak.
Protocol
Denne studien følger prinsippene i retningslinjene i Helsinkideklarasjonen og etiske prinsipper for medisinsk forskning som involverer mennesker. Alle forsøkene ble utført i henhold til Retningslinjer for stell og bruk av forsøksdyr og i henhold til Association for Research in Vision and Ophthalmology (ARVO) for bruk av dyr i oftalmisk og visuell forskning. Studieprotokollen ble godkjent av Resort Professional Commission of CAS for godkjenning av prosjekter av eksperimenter på dyr ved Institutt for dyrefysiologi og genetikk ved det tsjekkiske vitenskapsakademiet (Liběchov, Tsjekkia) (godkjent protokoll nr. 60/2016 og nr. 64/2019).
1. Betraktninger under subretinal transplantasjon av celler på en bærer i minigriser
- Valg av dyr
- Skaff og bruk Liběchov minigriser som er 12-36 måneder gamle, begge kjønn, og rundt 40-80 kg kroppsvekt (BW).
- Hold minigrisene innendørs i et luftkondisjonert dyrehus med temperaturer mellom 18-22 ° C, eksponering for en kunstig 13 t / 11 t lys / mørk syklus, standardiserte individuelle penner, fri tilgang til vann og to ganger daglig fôring.
- Forberedelse før operasjonen
- Sjekk for øyets kirurgiske orientering og tegne fundusordningene. For å gjøre dette, del skjematisk netthinnen til minigrisene på fundustegningen ved hjelp av en penn med en vertikal linje inn i temporale (fra optisk skive mot øret), nasal (fra optisk plate mot grisens snute) og sentrale (mellom de store retinalkarene på nesesiden) regioner (figur 1A, B).
- Velg bare friske dyr uten atferdsmessig og nevrologisk patologi og med normal kvalitet på hud, kroppsåpninger, avføring og matforbruk. Få en dyktig veterinær til å utføre den kliniske observasjonen og velge ut dyrene.
- Injiser intramuskulært 3 mg/kg kroppsvekt ceftiofurhydroklorid (1 ml/kg) på operasjonsdagen.
- Preoperativ immunsuppresjon
- Forbered takrolimus-eluerende polymermikrosfærer som beskrevet i Wang et al. og Sevc et al. 32,33 med modifikasjon.
- Sørg for at konsentrasjonen av takrolimus i polymermikrosfærene er 51,3 mg/g som bestemt ved HPLC (materialfortegnelse).
- Utfør en subkutan injeksjon av takrolimusbelastede polymermikrosfærer i en dose på 0,25 mg/kg kroppsvekt 6 dager før øyekirurgien for å hindre avstøtning av celletransplantat. Dette gjøres for å sikre overlevelse av de humane RPE-donorcellene under xenogen transplantasjon i minigrisøynene.
- Injiser dyrene intramuskulært på operasjonsdagen med 80 mg depo-medrol og benzylpenicillin på 1 ml / 10 kg i henhold til kroppsvekten.
- Anestesi
- Indusere generell anestesi med intramuskulær injeksjon av en blanding av tiletamin (2 mg / kg), zolazepam (2 mg / kg), ketamin (2 mg / kg) og xylazin (0,4 mg / kg) -TKX34,35 før operasjonen. Kontroller dybden av anestesi ved en tilstand av bevisstløshet og ved å kontrollere pedalrefleksen (en klype av den interdigitale huden på bakbenet), hornhinnerefleksen (en liten berøring av hornhinnen), pupillrefleksen (reaksjon på lyset) og palpebralrefleksen (en berøring på øyelokket). Sørg for at dyret ikke blinker. Bekreft regelmessig hjerte og respirasjonsfrekvens.
- Etter innledning av anestesi, transporter det bedøvede dyret til operasjonssalen på en heisvogn (figur 2A).
- Plasser dyret på operasjonsbordet på venstre side for å muliggjøre kirurgi på høyre øye (figur 2B).
- Utfør justeringen av dyrets hode ved hjelp av isoporputer for å oppnå den mest passende posisjonen til den sentrale netthinnen for implantasjon (dvs. horisontal og parallelt med gulvet) (figur 2C).
- Plasser øyedråper med 0,5% proparakainhydroklorid oftalmisk oppløsning i konjunktivalsekken tre ganger 1 min fra hverandre for å indusere lokalbedøvelse.
- Sett inn en venekanyle og intuber dyret med en endotrakealslange for inhalasjon vedlikehold av anestesi (1,5 % isofluran) ved hjelp av en anestesimaskin utstyrt med pasientmonitor (figur 2A, B).
- Administrer en intramuskulær injeksjon med 1 ml Eficur per 16 kg kroppsvekt og 20 mg Depo-Medrol 1 ca. 15 minutter før øyekirurgien begynner (materialfortegnelse).
- Oppretthold den fysiologiske kroppstemperaturen ved å dekke dyret med isotermisk folie og utfør operasjonen som beskrevet i avsnitt 3.
- Under operasjonen må du overvåke dyrets temperatur sammen med hjertefrekvensen og oksygenmetningen i blodet ved hjelp av en øreklemme og pasientmonitor. Unngå senking av kroppstemperaturen under 38 °C under prosedyrene, som regnes som en sikker grense36. Oppretthold oksygenmetningen (>96%) og pulsfrekvensen (70-90 slag per minutt) under hele eksperimentet.
- Når operasjonen er fullført, slå av strømmen av isofluran og ekstuber dyret.
- Etter spontan pust og oppvåkning, overfør dyrene til pennene.
- Oppsett av operasjonsstue
- Ordne operasjonssalen i henhold til operasjonens behov på øynene til storøyedyrmodellen (figur 3A, B). Juster høyden på kirurgens stoler, så vel som mikroskopets høyde, for å oppnå en komfortabel stilling for kirurgene med hensyn til posisjonen til grisens snute.
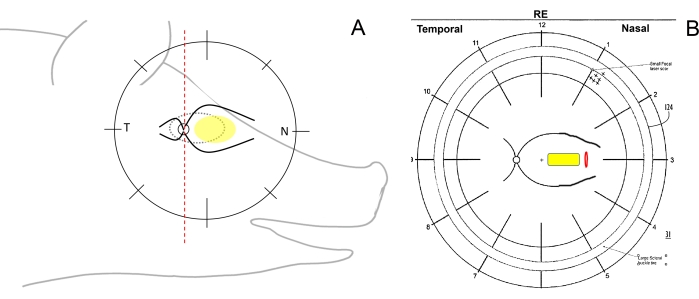
Figur 1: Skjematisk tegning av netthinnesonene hos minigriser. (A) Skjematisk tegning av netthinnesonene i forhold til minigrisens hode; den gule ellipsen skildrer det ønskede området med subretinal implantasjon, T refererer til det temporale retinalområdet, og N refererer til det nasale retinalområdet. (B) Eksempel på fundusordningen etter subretinal implantasjon av cellebæreren (gul) gjennom retinotomi (rød). Klikk her for å se en større versjon av denne figuren.
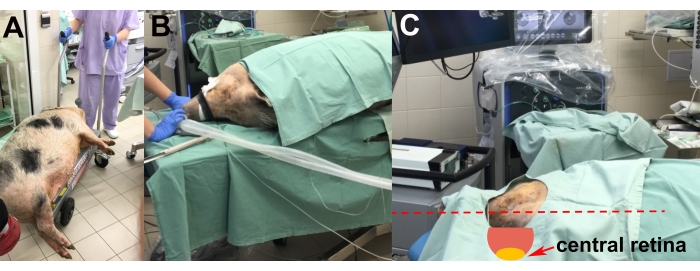
Figur 2: Transport og plassering av dyret . (A) Transport av det bedøvede dyret til operasjonssalen. (B) Plassering av dyret under intubasjon. (C) Justering av dyrets hode for optimal tilgang til den sentrale netthinnen under operasjonen (rød pil). Klikk her for å se en større versjon av denne figuren.
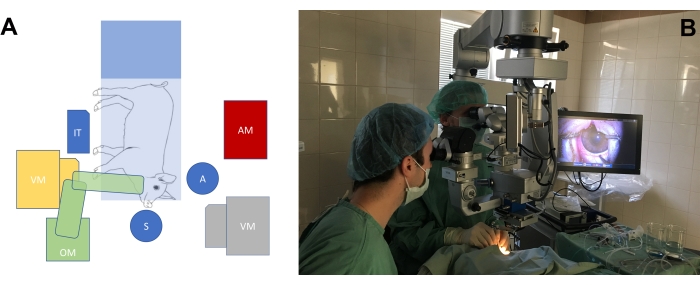
Figur 3: Standard operasjonsstueoppsett. (A) Skjematisk fremstilling av kirurgenes posisjon (S = kirurg, A = assistent) i forhold til operasjonsbordets plassering med minigrisen, operasjonsmikroskopet (OM), vitrektomimaskinen (VM), instrumentaltabellen (IT) og anestesiologimaskinen (AM). Det er to mulige posisjoner av vitrektomimaskinen (gul og grå). (B) Real-life setting i operasjonssalen. Klikk her for å se en større versjon av denne figuren.
2. Cellebærer, dyrkede cellekulturer og implantasjonsinjektor
- Cellebærer
- Klipp den 30 μm brede ovale rammen med ytre dimensjoner på 1,7 mm x 4,8 mm, utstyrt med trekantede fremspring asymmetrisk plassert på rammen (figur 4A), fra en bi-aksialt orientert 36 μm tykk polyetylentereftalat (PET) folie ved hjelp av en femtosekund laser.
- Klargjør poly (L-laktid-co-DL-laktid) (LLA / DLLA 90/10, MW 868, 270 g / mol) polymeroppløsning i pyridin i en konsentrasjon på 11 vekt% med tilsetning av 2,2 μL maursyre per 1 g oppløsning.
- Forbered nanofibrøs membran med en innebygd støtteramme (figur 4B) ved elektrospinning av polymeroppløsningen i tre trinn8: (1) avsett det første laget av nanofibre på et silisiumsubstrat, (2) plasser rammen på laget, og (3) avsett det andre laget av nanofibre.
MERK: Legg hvert lag i 7 minutter for å nå en total membrantykkelse på 3,7 μm. Bruk følgende parametere for å oppnå en membran sammensatt av 380 nm tykke fibre og med en gjennomsnittlig porestørrelse på 0,4 μm og en porøsitet på ca. 70%37: en 20 G allstålnål, en spenning på 7,1 kV, et gap på 10 cm, en strømningshastighet på 250 μL/min og en temperatur på 25,0 °C ± 0,5 °C. - Fjern forsiktig membranen med den innebygde rammen fra silisiumsubstratet og fest den til kroppen til en kommersiell 12-brønns cellekulturinnsats uten den opprinnelige membranen for å lette såing og vekst av celler.
- Behandle nanofibrøs membran før cellesåing i luftplasma i 30 s med en effekt på 70 W i en plasmarenser.
- Cellekulturer som brukes til dyrking på cellebæreren
MERK: Følgende cellebærere kan brukes: 1) nanofibrøse cellebærere uten celler; 2) nanofibrøse cellebærere med primære humane RPEs (hRPEs); 3) nanofibrøse cellebærere med humane iPSC-avledede RPE-celler.- Dyrking av primære hRPEs
- Isoler primære hRPE-celler fra humane donorøyne i henhold til en tidligere rapportert teknikk38.
- Få cellene ved enzymatisk behandling av netthinnen i 30 minutter. Deretter dyrker du de primære hRPE-cellene (passasje 0) i opptil 2 uker i DMEM / F12 supplert med 10% føtalt bovint serum (FBS).
- Når cellekulturene når sammenløp, endre mediet til 1% FBS og kultur i ytterligere 30 dager.
- Frø de primære hRPEene på transbrønnplater og på en lamininbelagt nanofibrøs cellebærer med en tetthet på 2000 celler / mm2. Etter ytterligere 30 dagers inkubasjon i 1% FBS, bruk cellebærerne med primære hRPEer for subretinal implantasjon i minigriser.
- Humane iPSC-avledede RPE-er
- Bruk hiPSCs avledet fra MERTK assosiert retinitis pigmentosa pasientavledede fibroblaster 39 som er genkorrigert i to alleler ved bruk av CRISPR /Cas9-systemet (RP1-FiPS4F1-GC2) 40, samt hiPSCs avledet fra fibroblaster av et sunt individ (Ctrl2-FiPS5F2) 41 som brukes som en kontroll.
- Generere og deretter differensiere begge hiPSCs cellelinjer mot RPE-celler (hiPSC-RPE) som rapportert tidligere42.
- Plate hiPSC-RPEene ved 200 000 celler / cm2 på lamininbelagte cellekulturinnsatser med nanofibrøse membraner av poly (L-laktid-co-DL-laktid) med ovale implantasjonsrammer i RPE-medium som inneholder knockout DMEM, 20% knockout serum, 0,1 mM ikke-essensielle aminosyrer, 0,23 mM β-merkaptoetanol, 100 U / ml penicillin, 0,1 mg / ml streptomycin og 10 mM nikotinamid.
- Bytt medium annenhver dag, og dyrk hiPSC-RPE i 2 måneder før implantasjon for å oppmuntre polarisert vekst.
- Implantasjon injektor
- Klargjør en plastkapillær med et rektangulært tverrsnitt på 2,8 mm x 0,8 mm ved formblåsing fra et plastrør av OD 1,75 mm / ID 1,10 mm.
- Klipp et lastevindu på 4 mm x 2,2 mm i plastkapillæren 6 mm fra enden.
- Monter injektoren fra plastkapillæren, et silikonhåndtak, et bladstempel av stål og et stempel (figur 5A).
- Sett holderen inn i injektoren gjennom et lastevindu og kast den senere ut i subretinalrommet ved å trykke på stempelet, som beskrevet i trinn 3.5.2 (figur 5B).
- Forberedelse av den nanofibrøse bæreren og lasting av injektoren
- Fyll en liten petriskål av plast med 2 ml fosfatbufret saltvann (PBS). Ta ut en innsats med det forberedte cellelaget, legg det på en halvmyk polystyrenfat, og sentrer den under et lysmikroskop. Bruk en tilpasset modifisert stans for å kutte ut bæreren langs den ovale rammen ved hjelp av et mikroskop. Bæredimensjonene skal være 2 mm x 5 mm.
- Bruk en skreddersydd injektor med flatt gjennomsiktig rør for lasting av bæreren; 6 mm fra den distale enden av kapillæren er det et vindu for lasting av bæreren. Fyll injektorens vindu med PBS.
- Bruk tangen, slipp prøven fra bunnen av fatet, løft den fra væsken og transporter den til injektorvinduet mens du kontrollerer sideorienteringsmerkene på rammen først for å oppdage oversiden av bæreren med tilhørende celler. En oval ramme letter manipulering med bæreren.
- Bruk en tannsonde (et tanninstrument i rustfritt stål med skarp slutt), og plasser bæreren i injektorvinduet. Bruk stempelet til å skyve holderen inn i den lukkede og sikre øvre delen av injektoren. Forbered deretter transportøren for kirurgi.
- Kontroller sideretningen til transportøren ved hvert trinn. Losse nanofibrøs bærer fra injektoren ved å skyve metall stempelet.

Figur 4: Nanofibrøs bærer med innebygd PET-ramme. (A) Tre synlige merker på rammen tillater kontroll av bærerens sideretning (hvite piler). (B) Forstørrelsesbilde av PET-rammefragmentet innebygd i den nanofibrøse membranen (hvite piler) på cellebæreren. Klikk her for å se en større versjon av denne figuren.

Figur 5: Implantasjonsinjektor. (A) Deler av injektoren. (B) Nanofibrøs cellebærer med innebygd støttende PET-ramme lastet til den rektangulære plastkapillæren til implantasjonsinjektoren. Klikk her for å se en større versjon av denne figuren.
3. Kirurgisk prosedyre
- Kirurgisk utstyr
- Bruk følgende kirurgisk utstyr: et oftalmisk kirurgisk mikroskop, et operativsystem for operasjoner på de fremre og bakre øyesegmentene, et ikke-kontakt vitreoretinalt kirurgisk system, en laserfotokoagulasjonsenhet og et digitalt kamera.
MERK: Standardparametrene som brukes i vitrektomi, ekso- og endokauteri og laserfotokoagulasjonsutstyr er vist i tabell 1.
- Bruk følgende kirurgisk utstyr: et oftalmisk kirurgisk mikroskop, et operativsystem for operasjoner på de fremre og bakre øyesegmentene, et ikke-kontakt vitreoretinalt kirurgisk system, en laserfotokoagulasjonsenhet og et digitalt kamera.
- Kirurgiske instrumenter
- Steriliser de gjenbrukbare kirurgiske instrumentene med en mobil autoklavdampsterilisator eller lignende i henhold til en standardprotokoll. Engangskirurgiske instrumenter og materialer som kreves under operasjonen er oppført i materialfortegnelsen.
- Forberedelse for kirurgiske trinn
- Etter bedøvelse av dyret som beskrevet i trinn 1.4.1, påfør 1% øyedråper med tropikamidoppløsning og 10% fenylefrinhydrokloridoppløsning i konjunktivalsekken 15 minutter før prosedyren for å provosere legemiddelindusert mydriasis.
- Gå til operasjonsbordet med kirurgen i øvre stilling og assistenten i sidestilling (figur 3).
- Barber området rundt øyet med en barberhøvel til engangsbruk og fjern det grove smusset.
- Desinfiser konjunktivalsekken med 5% povidon-jodoppløsning i 5 minutter.
- Desinfiser periorbitalområdet med bomullspinne ved å skrubbe fra øyelokkene til periferien. Gjenta prosessen tre ganger med en 10% povidon-jodløsning og la den virke i 5 minutter.
- Dekk operasjonsfeltet med øyet i midten ved hjelp av en standard steril oftalmisk drapering med klebrig gjennomsiktig folie. Flytt øyevippene bort fra øyekulen. Unngå å kutte øyevippene for å redusere risikoen for postoperativ endoftalmitt.
- Sett inn lokkspekulumet (Liberman-type eller Cook eye speculum). Eventuelt kan du feste niktiteringsmembranen til huden med 8-0 polyglaktin sutur.
- Åpne konjunktivene på nesesiden 2 mm til 3 mm fra limbus for å eksponere sclera for sklerotomiene ved hjelp av kirurgisk tang og Westcott konjunktivsaks.
- Sett de tre-valved 25 G trocars 2,5-3 mm fra limbus i området av pars plana (plasser dem klokka 7, 10 og 11). Bruk roterende bevegelser under innføringen på en lett skrå måte (100°-110°) mot bakre netthinne og hold trokaren med tangen (figur 6).
- Hold hornhinnen våt eller belegg den med metylcellulose under hele operasjonen for å forhindre osmotisk hornhinneødem.
- Pars plana vitrektomi (PPV)
- Fjern den midterste delen av glasslegemet med standard tre-port pars plana vitrektomi tilnærming. Fjern forsiktig glasslegemet bak linsen i området for fremtidig stor sklerotomi.
- Bruk en intravitreal 2-4 mg triamcinolonacetonid (TA) injeksjon (50-100 μL) for å flekke den bakre glasslegemet, som vanligvis forblir festet til netthinnen, for å utføre en kontrollert bakre glasslegemeløsning.
- Deretter utfører du sakte en subretinal injeksjon av 0,05-0,1 ml BSS med en 41 G kanyle mer sentralt, og unngår dannelsen av en bleb mot periferien.
- Reduser de intraokulære trykkinnstillingene med vanningssystemet ned til 15 mmHg under subretinal injeksjon for å forhindre forbigående retinal vaskulær okklusjon.
- Utfør en lineær stor endodiatermi i netthinnen med en 27 G endodiatermisonde 3 mm nær neseblebbasen.
- Etterpå lager du en 3 mm stor retinotomi med et 25 G MVR-blad eller vertikal saks med en forhøyet intraokulært trykk (IOP) innstilling av vanningssystemet opp til 60 mmHg i 3 minutter til 5 minutter. Sørg for at det ikke er blødning fra retinotomi, og reduser deretter IOP til 25 mmHg.
- Utfør en eksodiatermi av episkleralkarene mellom de to nesebuksene 2,5-3 mm fra limbus med en 27 G endodiatermisonde ved å påføre en mild berøring på overflaten av sclera.
- Kontroller væskenivået på infusjonsflasken før forstørring av sklerotomien, som etter sklerotomiforstørrelse er væskeforbruket midlertidig høyt.
- Lag en 3,0 mm stor sklerotomi, 3 mm fra limbus, ved hjelp av en 2,75 mm phaco kniv.
- Vær oppmerksom på mulig blødning fra skleralkarene og ciliary kroppen inne i den store sklerotomien. Ved blødning, bruk en 27 G endodiatermisonde for å koagulere de skadede karene. Forstørr sklerotomien til 3,0 mm med en satengkniv for å få plass til spissen av injektoren (0,8 mm x 2,8 mm).
- Fjern den prolapserte glasslegemet på stedet for den store sklerotomien med en vitrektor. Opprettholde infusjonen av BSS på nivået 25-30 mmHg med vitrektomisystemet for å unngå klodekollaps.
- Implantasjon av cellebæreren
- Sett injektoren forsiktig med den dominerende hånden inn i glasslegemet gjennom den store sklerotomien. Ved motstand, forstørre størrelsen på sklerotomi.
- Implanter cellebæreren gjennom retinotomien inn i det subretinale rommet. Bruk om nødvendig en bimanuell teknikk med ekstra sklerotomi og lysekrone lys for å forbedre kontrollen av implantasjonen.
- Trekk injektoren fra øyet og lukk den store sklerotomien med en 8-0 polyglaktin sutur for å unngå komplikasjoner forbundet med intraokulær hypotoni.
- Utfør en fullstendig væske-luftutveksling (FAX) og drenering av subretinalvæsken med en silikontippet kanyle.
- Deretter injiserer du silikonolje (1,000 cSt) i glasslegemet ved hjelp av vitrektomisystemet og slangesystemet for injeksjon av silikonolje til IOP er normal.
- Intraoperativ avbildning og dokumentasjon
- Utfør et videoopptak under hele operasjonen med fotodokumentasjon av de viktigste trinnene i implantasjonen ved hjelp av et videoopptakssystem.
- Fullfør fundustegningen ved å dokumentere plasseringen av sklerotomiene, retinotomi, subretinalt implantat og eventuelle komplikasjoner som oppstod ved hjelp av fundustegningsskjemaer.
- Trinn etter operasjonen
- På slutten av operasjonen, fjern trokarene og lukk de tre sklerotomiene og bindehinnen med 8-0 polyglaktin suturer.
- Skyll konjunktivalsekken med 5% povidon-jodoppløsning.
- Utfør en 0,3 ml subkonjunktival injeksjon på 20 mg gentamicin, 2 mg deksametason og 2% xylokain.
- Kontroller tilstanden til fundus og linsen ved hjelp av en mikroskopisk visning.
- Fjern suturen(e) fra niktiteringsmembranen ved hjelp av kirurgisk tang og Westcott konjunktivsaks (valgfritt).
- Påfør neomycin salve eller ofloxacin oftalmisk salve i konjunktivalsekken.
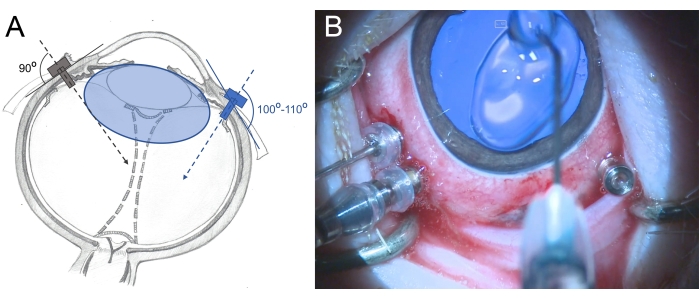
Figur 6: Innsetting av trocarene i øyet til en minigris . (A) Skjematisk avbildning av trokarene, som settes vinkelrett inn i scleraen mot midten av glasslegemet i det menneskelige øye (grå farge) og på en skrå måte mot bakre netthinne i minigrisøyet (blå farge) for å unngå skade på linsen. Linsen til minipigen (blåfarget) er større enn hos mennesker og i forhold til glasshulestørrelsen. (B) Intraoperativ visning av de innsatte trokarene i en tre-port PPV. Hornhinnen er dekket med metylcellulose for å forhindre tørking og hevelse. Klikk her for å se en større versjon av denne figuren.
4. Postoperativ behandling
- Påfør aktuell bacitracin sink / hydrokortisonacetat / neomycinsulfat eller 0,3% ofloksacin i konjunktivalsekken til dyrene fem ganger per dag.
- Postoperativt, kontroller følgende øyeparametere: turgor av øyets myke vev ved hjelp av palpasjon, inflammatorisk reaksjon på øyets overflate og mysing som en beskyttende reaksjon av øyelokkene ved hjelp av en håndholdt spaltelampe eller indirekte oftalmoskop.
- For systemisk postoperativ behandling, bruk følgende antibiotika:
- Injiser ceftiofurhydroklorid intramuskulært med en dose på 3 mg/kg kroppsvekt (1 ml/kg) på den andre og tredje stabilitetsdagen.
- Injiser tulatromycin (1 ml / 40 kg kroppsvekt) etter 72 timer etter kirurgi for forebygging av sekundær bakteriell infeksjon.
- Utfør en intramuskulær injeksjon av flunixin (2 ml/45 kg levende vekt) og tramadolhydroklorid (100 mg) hver 24. time i 3 dager etter operasjonen for å forhindre smerte.
- Hold minigrisene i et spesialisert luftkondisjonert anlegg med et temperaturområde på 18-22 ° C og et kunstig 13 t / 11 t lys / mørkt regime.
- Sørg for at de har fri tilgang til vann og standard fôring (to ganger per dag).
5. Postoperative prosedyrer
- Postoperative oftalmiske undersøkelser
- I den postoperative perioden, kontroller øynene med et indirekte oftalmoskop for tilstedeværelse av betennelse (dvs. rødhet, vevshevelse eller slimbelastning i konjunktivalsekken). Mål det intraokulære trykket i det opererte øyet ved hjelp av palpasjonsmetoden.
- Postoperativ bildebehandling
- Indusere sedasjon i minigrisen ved intramuskulær injeksjon av en TKX-blanding før fundusfotografering og OCT-undersøkelse. Still inn 1% tropikamid og 10% fenylefrinhydroklorid øyedråper i konjunktivalsekken til minigrisen for å indusere mydriasis.
- Bruk et lokkspekulum for å opprettholde åpne øyne. For fuktighet av øyeoverflaten og for å oppnå et klart OCT-bilde, vask hornhinnen av dyret med saltoppløsning (0,9% NaCl) hver 30-60 s.
- Plasser minigrisen på operasjonsbordet på samme måte som under operasjonen (figur 2B,C, figur 3A). Hovedkravet er å plassere hodet på siden og vinkelrett på skannestykket på OCT-enheten. Bruk styrofoam pads under dyrets snute for å stabilisere hodet, og bringe øyeoverflaten i horisontal stilling.
- Samle fargefundusbilder med et ikke-mydriatisk funduskamera i farger, da dette gjør det mulig å dokumentere fremre segment, netthinnen og optisk plate. I tillegg ta et rødfritt bilde av netthinnen med det ikke-mydriatiske funduskameraet.
- Utføre optisk koherenstomografiavbildning ved hjelp av OCT-systemet for spektraldomene. Under OCT- eller fundus-avbildningen, vipp minigrisens hode manuelt mot OCT-linsene eller funduskameralinsene for å optimalisere utsikten over den bakre netthinnen og implantasjonsområdet (figur 2C). For optimal avbildning av den implanterte bæreren på fundus, bruk det infrarøde refleksjonslyset til OCT-enheten for å fokusere på implantatet (figur 2C). Bruk modusene OCT-krysslinje og netthinnekartskanning.
- Påfør ofloxacin oftalmisk salve ved slutten av undersøkelsen under lokket på dyrets øye.
- Flytt minigrisen til innendørsanlegget og observer dens generelle tilstand til slutten av sedasjonen (ca. 2 timer til 5 timer).
6. Enukleasjon av øyet post mortem etter eutanasi
- Berolig minigrisene med en intramuskulær injeksjon av TKX-blandingen etterfulgt av en intravenøs (gjennom en 22-G ørekanyle) boluspåføring av 1 % propofol (20 ml/dyr) etterfulgt av ekssanguinering. Ikke bruk generelle fikseringsmidler.
- Ofre dyrene ved ekssanguinering under dyp generell anestesi 7 dager, 14 dager, 28 dager og 42 dager etter celletransplantatimplantasjon.
- Bruk tang og saks for å fjerne øvre og nedre øyelokk. Fjern det tredje øyelokket og skjær gjennom bindehinden. Klipp øyemuskulaturen og optisk nerve.
- Enucleate øynene post mortem ved hjelp av kirurgisk saks og kirurgisk tang. Sørg for at prosedyren utføres av en erfaren person.
Representative Results
Resultatene av subretinal implantasjon av cellebæreren i Liběchov minipiger er presentert i Table 2. Vellykket implantasjon ble definert som å oppnå tilstrekkelige data for histologisk og immunhistokjemisk studie. Mislykkede tilfeller ble definert som øyne med alvorlige intraoperative komplikasjoner, noe som gjorde videre observasjon av øyevevet umulig.
Anvendelsen av den foreslåtte teknikken ved bruk av silikonoljetamponade gjør det mulig å kontrollere tilstanden til subretinaltransplantasjonen ved hjelp av bildebehandlingsmodaliteter fra neste dag etter operasjonen til tidspunktet for enukleasjon (figur 7, figur 8 og figur 9).
Fundus-avbildning og SD-OCT
Minigrisene ble undersøkt i den postoperative perioden med fundusavbildning, rødfri avbildning og spektraldomeneoptisk koherent tomografi (figur 7). Fundus-avbildning av høy kvalitet ble muliggjort ved bruk av klare optiske medier, inkludert en klar linse og bruk av silikonoljetamponade (figur 7A). Retinotomistedet viste ingen tegn til en proliferativ reaksjon (figur 7A, gule piler), og PTE-rammen til cellebæreren var tydelig synlig gjennom de halvtransparente lagene i svinenetthinnen. På den rødfrie avbildningen skilte reflektiviteten til de dyrkede hRPEene på bæreren seg ikke fra reflektiviteten til det endogene RPE-laget av svin (figur 7B). På SD-OCT forårsaket PTE-rammen bare mindre skyggelegging av de underliggende anatomiske strukturer og svak fortykkelse av netthinnen (figur 7C, røde piler). Ingen atypiske hypo- eller hyperreflekssoner ble lagt merke til på SD-OCT, og Bruchs membran så også ut til å forbli uskadet. Figur 8 viser fundus- og iOCT-bilder av stillaset dyrket med primære humane RPE-celler 1 måned etter operasjonen (figur 8). Selve cellebæreren (uten celler) forårsaket ingen signifikant økning i retinal tykkelse (figur 9C). Disse funnene tyder på at den intraoperative iatrogene effekten av implantatet var minimal, og at den implanterte cellebæreren gjennomgikk tilstrekkelig tilpasning av de implanterte cellene til de overliggende fotoreseptorcellene og nevroretinalt vev.
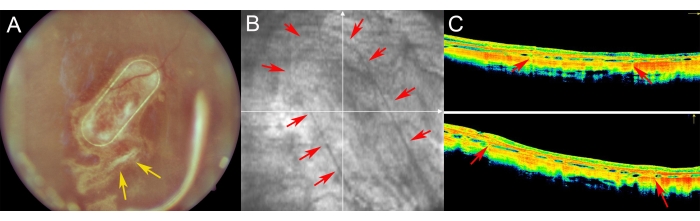
Figur 7: Postoperativ avbildning av netthinnen hos minigriser . (A) Fundus imaging, (B) Rødfritt bilde, og (C) optisk koherens tomografi avbildning av nanofibrøs bærer med primære humane RPE celler i en 1 uke oppfølging etter subretinal transplantasjon i en minigris øye. (A) De gule pilene indikerer stedet for retinotomi. (B) Røde piler demonstrerer marginene til den nanofibrøse cellebæreren. (C) De røde pilene viser den svake skyggen av OCT-signalet forårsaket av den støttende PET-rammen til den nanofibrøse bæreren, som ble implantert i subretinalrommet. Klikk her for å se en større versjon av denne figuren.
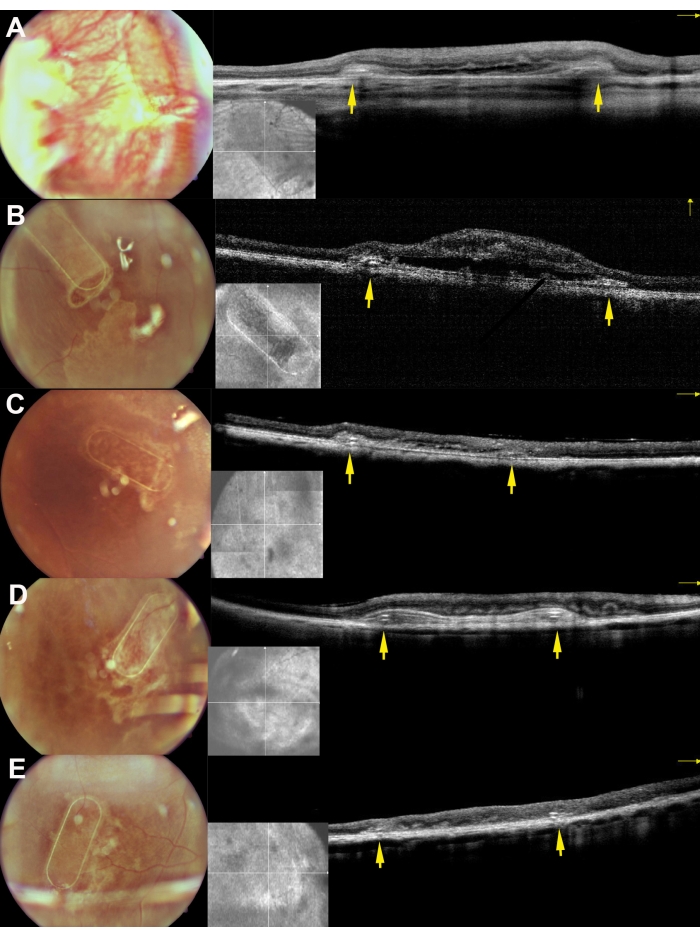
Figur 8: Fundusbilder og iOCT-bilder av stillasene 30 dager etter subretinal implantasjon i minigrisene. A, B, C, D og E tilsvarer henholdsvis grisene 169, 182, 179, 199 og 224. De gule pilene viser stillasets ramme. Klikk her for å se en større versjon av denne figuren.
Histologisk og immunhistokjemisk analyse
Etter avlivning av dyrene ble hele minigrisøyne fjernet og festet i 4% paraformaldehyd (PFA) i 24 timer. Den fremre delen av øyet ble fjernet, og den implanterte nanofibrøse bæreren ble identifisert i nasal sentral retina og isolert med scleraen festet. Alle vevene ble kryobeskyttet i graderte sukroseløsninger, og vertikale frosne seksjoner ble kuttet, som beskrevet i detalj43. Histologi av nanofibrøs membran uten RPE-celler etter 4 ukers implantasjon viste retina uten inflammasjon og degenerative forandringer (figur 9A). Tilstedeværelsen av nanofibrøs membran ble påvist i polarisert lys (figur 9B).
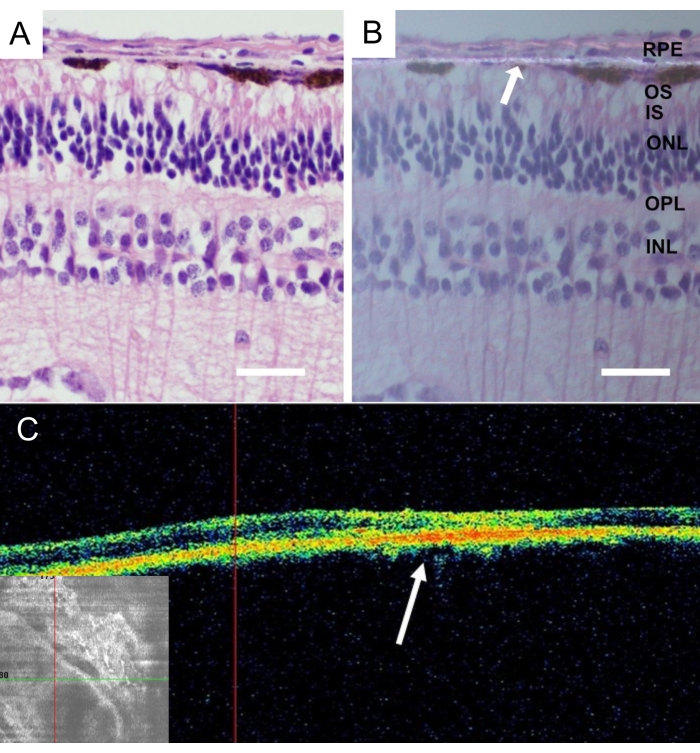
Figur 9: Histologisk analyse av den implanterte acellulære nanofibrøse membranen. Hematoksylin-eosinfarging av den acellulære nanofibrøse membranen 4 uker etter implantasjon (A) med standard belysning og (B) med polarisert lysmikroskopi. Den hvite pilen indikerer nanofibrøs membranlokalisering (skala bar: 50 μm). (C) In vivo optisk koherens tomografi bilder av den acellulære nanofibrøse membranen etter 4 uker etter implantasjon viser god aksept og adherens av nanofibrøs membran i subretinalrommet. Den hvite pilen indikerer plasseringen av implantatet i tverrsnittsbildet av netthinnen. Klikk her for å se en større versjon av denne figuren.
Figur 10 viser hematoksylin-eosin (H&E)-fargingen av netthinneområdet som inneholder de implanterte primære hRPE-cellene på en nanofibrøs bærer (gul pil) i minigrisøyet. Det pigmenterte utseendet til de implanterte primære hRPEene dannet et kontinuerlig, men uregelmessig pigmentert lag (figur 10, røde piler). Etter lengre observasjonsperioder (6 uker) viste nevroretina under implantatene et rosettlignende eller hypertrofisk reaksjonslignende utseende rundt retinotomistedet, sannsynligvis som følge av iatrogen manipulasjon. Disse morfologiske resultatene er sammenlignbare med SD-OCT-funnene og støtter bevisene for den minimale effekten av bærerlevering på retinalvevet.
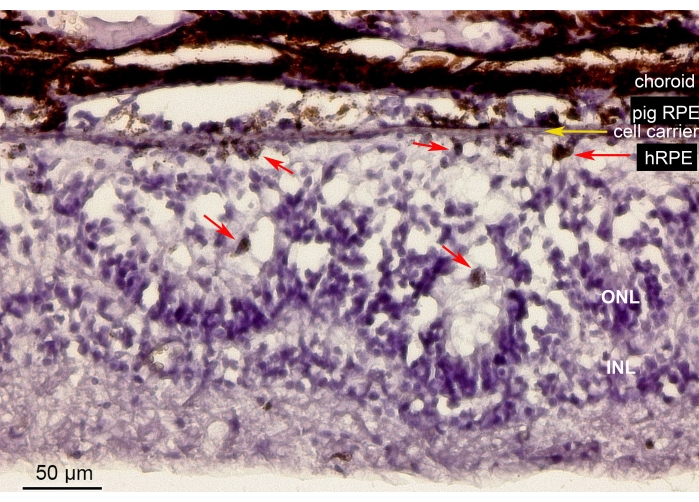
Figur 10: Histologisk analyse av den implanterte nanofibrøse membranen med de primære hRPEene. Hematoksylin-eosinfarging av retinalområdet som inneholder den implanterte nanofibrøse bæreren (gul pil) med de primære hRPEene i minigrisøyet. Dyret ble avlivet og analysert 6 uker etter implantasjon. De primære hRPEene var tydelig skilt av deres størrelse, runde form og pigmentering (røde piler) i det subretinale rommet motsatt fotoreceptorene. Fotoreseptorkjernene i ONL bygger rosettlignende strukturer. Det subretinale rommet virker hypertrofisk. Forkortelser: hRPE = primært humant retinalpigmentert epitel, ONL = ytre nukleært lag, INL = indre nukleært lag. Klikk her for å se en større versjon av denne figuren.
Immunfarging ble utført med totrinns indirekte metode. Snittene ble inkubert ved romtemperatur over natten i CRALBP, et monoklonalt primærantistoff, ved en fortynning på 1:100. Immunfluorescens ble utført med Alexa Fluor 488-konjugert sekundært antistoff.
De implanterte primære hRPEene var tilstede i implantasjonsområdet og uttrykte den typiske RPE CRALBP-markøren som ligner på de endogene minigris RPE-cellene (figur 11A). I motsetning til dette syntes morfologien til de implanterte cellene ikke å anta en monolagsform etter implantasjon, men forble lokalisert innenfor det definerte subretinale rommet (figur 11A, B, hvite piler). Følgende RPE/retinale markører og morfologisk utseende forble positive etter 6 uker etter implantasjonsperioden: tilstedeværelsen av pigment / melaningranulater, sluttstadiet retinale spesifikke nevronmarkører for stavbipolar (PKC-alfa) og kjeglefotoreceptorene (PNA), og GFAP-positiviteten - et tegn på mikrogliaaktivering.
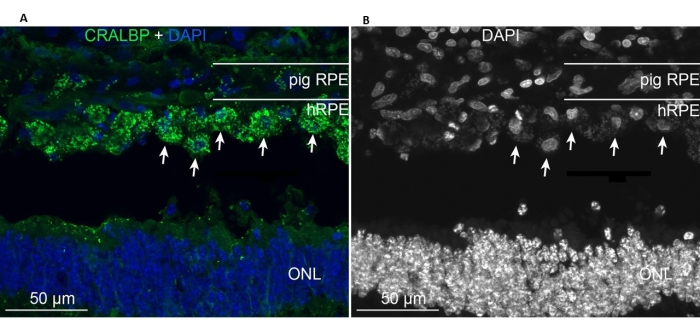
Figur 11: Immunmerking med RPE-cellemarkøren CRALBP (cellulært retinaldehydbindende protein) i en minigris 6 måneder etter implantasjon av primære hRPEs. (A) Vertikale frosne seksjoner av det behandlede griseøyet ble immunmerket med CRALBP monoklonalt antistoff (grønt) og motfarget med DAPI (blått). (B) Enkel avbildning av cellekjerner merking med DAPI i svart og hvitt, da høy kontrast avslører den runde formen til de enkelte hRPE-cellene (noen vist med hvite piler). Forkortelser: hRPE = humant retinalt pigmentepitel, ONL = ytre nukleært lag. Klikk her for å se en større versjon av denne figuren.
Okulære komplikasjoner
Totalt var det 27 av 29 (93,1%) vellykkede utførte operasjoner. Definisjonen "vellykket utførte operasjoner" ble brukt på de tilfellene der det opererte øyet ikke viste noen klinisk signifikante postoperative komplikasjoner før tidspunktet for enukleasjon som kunne påvirke den histologiske og immunhistokjemiske studien. Redusert gjennomsiktighet av optiske medier påvirket postoperativ avbildning i fire tilfeller (13,7%); Likevel ble disse øynene behandlet med ytterligere histologisk og immunhistokjemisk analyse.
Intraoperativ perifer netthinneløsning forekom i fire tilfeller (13,8 %). I to tilfeller ble det styrt av aspirasjon av subretinalvæsken under væskegassutveksling og anvendelse av laserfotokoagulering av retina i løsrivelsesområdet. I de to andre tilfellene (6,9%) var netthinneløsningen assosiert med massiv retinal og subretinal blødning, noe som gjorde implantasjon av cellebæreren umulig og førte til avslutning av operasjonen og umiddelbar eutanasi av minigrisen mens den var på operasjonsbordet.
| Nei | Parametere | Standard brukte innstillinger |
| 1 | Vitrektomi hastighet (skjærehastighet) | opptil 20 000 kutt/min |
| 2 | Venturi pumpe | 50-180 mmHg |
| 3 | Stigende tid | 1 sek |
| 4 | Vanningstrykk | 18-25 mmHg |
| 5 | Luftinfusjonstrykk | 20-25 mmHg |
| 6 | Bipolar eksodiatermi | 18-26% |
| 7 | Monopolar endodiatermi | 16-18% |
| 8 | Laser fotokoagulering av netthinnen, 532 nm | Effekt 100-150 mW |
| Intervall 100 ms | ||
| Varighet 100 ms |
Tabell 1 Standardparametere som brukes under vitrektomi og laserfotokoagulasjon.
| Totalt antall dyr, n | 18 |
| Totalt antall øyne, n | 36 |
| Opererte øyne, n | 29 |
| Vellykket implantasjon, n | 27 |
| Mislykkede saker, n | 2 |
| Gjennomsnittlig operasjonstid, min | 57 |
| Suksessrate, % | 93.1 |
Tabell 2: Resultater av den standardiserte kirurgiske teknikken med subretinal implantasjon av cellebæreren i Liběchov minigriser mellom 2016 og 2020.
Tilleggsfil 1: Sammendrag av studiene dedikert til subretinal implantasjon av RPE-celler på cellebæreren. Klikk her for å laste ned denne filen.
Discussion
Den subretinale implantasjonen av RPE-celler med forskjellig opprinnelse er en svært lovende trend innen øyeforskning for behandling av retinale degenerative lidelser, som AMD 3,4,8,9,10,11,12,13,14,15,25 . Hovedideen med denne tilnærmingen er å erstatte de skadede RPEene med sunne RPEer dyrket ex vivo (tilleggsfil 1) 44,45,46,47,48. Bruken av cellebærere for å transplantere de dyrkede RPE-cellene representerer den mest fornuftige tilnærmingen, siden de porøse membranene opprettholder det polariserte RPE-cellelaget i riktig orientering med hensyn til det fotosensoriske laget.
Optimal dyremodell
Et kritisk skritt i å utvikle slike behandlingsmetoder er bruken av den optimale dyremodellen49. Tidligere har små og store dyremodeller blitt brukt, inkludert kaniner, hunder, griser og ikke-menneskelige primater 8,9,10,11,12,13,14,15,27,29. I denne artikkelen foreslår vi bruk av Liběchov minigris-modellen og beskriver de preoperative, kirurgiske og postoperative trinnene som muliggjør robuste transplantasjonseffekter. Liběchov minigris ble opprinnelig oppdrettet for rundt 20 år siden og har blitt hyppig brukt i biomedisinsk forskning innen nevrodegenerative sykdommer, som Parkinsons og Huntingtons sykdom29,50. Siden grisen har en relativt stor hjerne med blodtilførsel og immunologisk respons som ligner på mennesker, har den blitt brukt som dyremodell for allogene transplantasjonseksperimenter også51,52,53,54. Selv om netthinnen til minipigene ikke har en menneskelignende makula og fovea, inneholder den området centralis og visuelle striper, som er regioner i netthinnen med høy konsentrasjon av kjeglefotoreseptorer30. Den samme størrelsen som det menneskelige øye, tilstedeværelsen av en kegleberiket sentral retina, det velbeskrevne immunsystemet og tilstedeværelsen av metoder for å vurdere morfologien og funksjonen etter operasjonen er viktige argumenter for bruken av denne store dyremodellen i den presenterte studien.
Kirurgisk prosedyre
Så vidt vi vet, finnes det ingen standardiserte og allment aksepterte kirurgiske teknikker for vitreoretinal transplantasjon av RPE-celler på bærere. Et av hovedproblemene med celleutskiftningsterapi er den utfordrende kirurgiske teknikken som har risiko for intraoperative og postoperative komplikasjoner knyttet til retinal detachment, hypotoni, episkleral, choroidal og / eller retinal blødning og høy intraokulær turbulens, noe som kan føre til stillasskader. Postoperativt er det risiko for proliferativ vitreoretinopati, endoftalmitt, hypotoni, netthinneløsning og kataraktdannelse 4,10,13,14,15.
De første studiene på tilnærminger ved bruk av cellebærere ble utført i chinchilla bastard kaniner13,16,25. Selv om disse dyrene representerer en liten dyremodell, var resultatene som fokuserte på de tekniske aspektene ved operasjonen avgjørende for utviklingen av prosedyrene i store dyremodeller og er derfor oppsummert nedenfor.
En skreddersydd 23 G infusjonskanyle ble opprinnelig brukt med to sideporter for å omdirigere jetstrømmen, noe som bidro til å løse sammenbruddet av bleb og påfølgende retinal detachment13. I denne studien la vi ikke merke til noen slik kollaps av bleb. Den mulige årsaken til det kan være den større størrelsen på øyebollet og ytelsen til kjernevitrektomien med spart glasslegeme i periferien på kanyleinfusjonsstedet, noe som kan redusere kraften til den rettede jetstrømmen.
Vanskeligheter under utkastet av cellebæreren fra instrumentet var en annen intraoperativ hindring i smådyrmodellene, som ble kategorisert som "fanget med instrumentet". I tillegg foreslo forfatterne at gjenværende glasslegeme på retinaloverflaten kunne forårsake et bakover "hopp" av bæreren ut av retinotomiåpningen etter implantasjon. Dette problemet kan løses med en enzymassistert vitrektomi, som muliggjør en jevn, kontinuerlig utstøting av cellebæreren i det subretinale rommet. I de fleste tilfeller flyttet forfatterne bæreren for å oppnå en fjernere plassering av implantatet vekk fra retinotomi. I vår kasusserie opplevde vi også en situasjon der cellebæreren forble festet til spissen av injektoren. Det ble imidlertid håndtert ved langsom og forsiktig manipulering av lysrøret og injektorspissen. Vi observerte ingen rester av glasslegemet på retinotomistedet i noen av våre tilfeller. Bruk av TA-assistert PPV i operasjonene kan foreslås som en metode for å redusere risikoen for restfestet glasslegeme. Flere farginger med TA kan være nødvendig for å fjerne det overliggende glasslegemet helt.
I en annen studie ble resultatene av subretinal implantasjon av humane RPE-stamceller dyrket som et polarisert cellulært monolag på en polyestermembran rapportert24. Under forsøkene ble den samme kirurgiske teknikken beskrevet tidligere brukt13, men en to-port PPV-tilnærming ble brukt. Til slutt ble en trinnvis protokoll for subretinal implantasjon av cellebærerkirurgi hos kaniner publisert senere25. Denne studien presenterer en svært detaljert og lett repeterbar beskrivelse av det kirurgiske inngrepet, inkludert preoperativ og postoperativ behandling, som også er basert på tidligere erfaringer.
Under bruk av store dyremodeller i etterfølgende studier ble ikke bare tekniske spørsmål adressert, men også spørsmål angående immunreaksjonen til de transplanterte cellene, samt cellebærerstørrelsesrelaterte problemer. En studie med cynomolgusaper (Macaca fascicularis) beskrev resultatene av subretinal implantasjon av humane stamcelleavledede RPE-monolag15. Alle dyrene gjennomgikk systemisk immunsuppresjon, som besto av sirolimus (startdose på 2 mg, daglig dose på 1 mg) og tetracyklin (7,5 mg/kg kroppsvekt) med start 7 dager før operasjonen og som varte i 3 måneder etter operasjonen. Den kirurgiske prosedyren ble utført i henhold til protokoller beskrevet tidligere24,25. Forfatterne brukte en 25 G tre-port PPV-tilnærming med lysekrone endo-belysning. Det er viktig at en TA-assistert PVD ble brukt til å utelukke gjenværende vitreoretinal adhesjon på bakre retina. Som et tillegg til den opprinnelig beskrevne prosedyren fjernet forfatterne verts-RPE-laget i området for fremtidig implantasjon ved hjelp av et 20 G skreddersydd utvidbart sløyfeinstrument.
I vår minigrisstudie brukte vi også systemisk immunsuppresjon. Imidlertid var typen immunosuppresjon forskjellig fra den som er beskrevet ovenfor. Vi administrerte en subkutan injeksjon av takrolimus-eluerende polymermikrosfærer som et depot i en dose på 0,25 mg/kg kroppsvekt for å hindre avstøtning av celletransplantat og inflammatoriske reaksjoner. Vi fjernet ikke RPE-cellelaget under operasjonen, da vårt primære mål var å analysere sikkerheten til prosedyren og levedyktigheten til de implanterte cellene, men ikke deres integrering i vertsnetthinnen.
Tidligere ble sikkerheten og gjennomførbarheten av subretinal implantasjon av et monolag av hESC-avledede RPEer på en sammenleggbar ikke-nedbrytbar maskestøttet submikron parylen-C-membran (6,25 mm x 3,5 mm, 0,4 μm tykk) vurdert hos 14 kvinnelige Yucatán minigriser10. Etter dyrking ble cellene sådd på en maskestøttet membran. Immunsuppresjon ble utført ved systemisk administrering av takrolimus (ingen regime og dosering indisert) og intravitreale injeksjoner av 0,7 mg av et deksametason implantat ved slutten av kirurgi. PPV ble utført med en 20 G tilnærming. Forfatterne brukte en intravitreal injeksjon av triamcinolonacetonid for bedre visualisering av glasslegemet. Den store sklerotomien var 2 mm til 3 mm stor. Etter subretinal injeksjon ble retina flatt med en midlertidig injeksjon av perfluorkarbonvæske. Etter væske-luftutvekslingen ble det utført en silikonoljetamponade (1000/5000 cSt). Postoperativ behandling inkluderte okulær påføring av deksametason / neomycin / polymyksin B salve 1 uke etter operasjonen. Forfatterne rapporterte en suksessrate på 91% (dvs. effektiv subretinal implantasjon og tilstrekkelige postoperative bildedata). I vår studie ble intravitreal injeksjon av TA-krystaller brukt intraoperativt og hovedsakelig for å visualisere glasslegemet. Den lokale immunsuppressive virkningen av dette legemidlet er imidlertid fortsatt uklar. De nanofibrøse cellebærerne som ble brukt i vår studie var 5,2 mm x 2,1 mm og 3,7 μm tykke, med porestørrelser på 0,4 μm. Under operasjonen utførte vi direkte faks i stedet for å injisere perfluorkarbonvæske. Vår kirurgiske suksessrate (93,1%) var konsistent med og litt bedre enn Koss et al.10.
Subretinal transplantasjon av fullt nedbrytbare cellebærere (stillas) for subretinal implantasjon ble først studert i 2019 i Yorkshiregriser 14. Studien var hovedsakelig fokusert på de biologisk nedbrytbare egenskapene til fibrinhydrogelimplantater. Forfatterne bemerket at den aggressive immunsuppresjonen som ble brukt på tamgrisene, kunne hemme en lokal inflammatorisk reaksjon som potensielt ble forårsaket under biologisk nedbrytning av fibrinhydrogelimplantatene. De spesifiserte imidlertid ikke hvilken immundempende behandling som ble brukt hos grisene. Under PPV utførte de en 3,6 mm lang sklerotomi for innsetting av subretinal implantasjonsenhet parallelt med og ca. 3,5 mm bakenfor limbus. I tillegg brukte de et pneumatisk drevet injeksjonssystem som tar sikte på å redusere ustabiliteten ved håndplassering forårsaket av fingermanipulering. I vår kasusserie var alle sklerotomiene 2,5 mm til 3,0 mm fra limbus. Den store sklerotomien for innsetting av injektoren var 3 mm lang. Implantasjonsinjektoren som ble brukt i vår studie, ble operert for hånd. Grundig cautery av pars plana i ciliary kroppen og et tilstrekkelig kutt inne i den store sklerotomi synes å være avgjørende for å unngå intraoperative komplikasjoner som iatrogen perifer retinal detachment, blødning og tap av implantatet.
Oppsummert beskriver vi bruken av Liběchov minigris-modellen for transplantasjon av RPE-celler på biologisk nedbrytbare bærere som et behandlingsalternativ for arvelige og ervervede retinale sykdommer. Likheter i øyeanatomi og fysiologi, samt med hensyn til immunsystemet, tillater oss å utvikle og forbedre kirurgiske teknikker og instrumentering for subretinal implantasjon av celler, som lett kan overføres til behandling av humane øyesykdommer. Det er viktig å sikre at operasjoner på minigriser utføres ved hjelp av samme instrumentering (inkludert implantasjonsleveringsverktøy) når de brukes i menneskelige operasjoner, og dermed lette anvendelsen av oppnådd erfaring og kunnskap til mennesker. Alternative storøyde dyremodeller med tilstedeværelse av et makulært område, som ikke-menneskelige primater, kan være nyttige for oppfølging og analyse av de anatomiske og funksjonelle endringene etter subretinal implantasjon i det sentrale retinalområdet. Den detaljerte beskrivelsen av preoperative, kirurgiske og postoperative prosedyrer vil være nyttig for fremtidige studier ved å øke effektiv og standardisert datagenerering.
Acknowledgements
Prosjektet ble støttet av The Czech Science Foundation (prosjektnummer 18-04393S) og Norway Grants and Technology Agency of the Czech Republic (KAPPA-programmet, prosjektnummer TO01000107).
Materials
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
References
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved