Implantación subretiniana de EPR en un portador en minicerdos: pautas para preparaciones preoperatorias, técnicas quirúrgicas y cuidados postoperatorios
* These authors contributed equally
In This Article
Summary
La implantación subretiniana de epitelio pigmentado retiniano (EPR) es uno de los enfoques más prometedores para el tratamiento de enfermedades degenerativas de la retina. Sin embargo, el rendimiento de los estudios preclínicos en modelos animales de ojo grande sigue siendo un desafío. Este informe presenta pautas para el trasplante subretiniano de EPR en un portador de células en minicerdos.
Abstract
Los trastornos degenerativos de la retina (incluida la degeneración macular relacionada con la edad), que se originan principalmente en o dentro de la capa epitelial pigmentada de la retina (EPR), conducen a una desorganización progresiva de la anatomía de la retina y al deterioro de la función visual. La sustitución de células EPR dañadas (EPR) con células EPR cultivadas in vitro utilizando un portador de células subretinianas ha demostrado potencial para restablecer la estructura anatómica de las capas retinianas externas y, por lo tanto, se está estudiando más a fondo. Aquí, presentamos los principios de una técnica quirúrgica que permite el trasplante subretiniano efectivo de un portador de células con EPR cultivados en minicerdos. Las cirugías se realizaron bajo anestesia general e incluyeron una vitrectomía estándar de pars plana (VPP) de tres puertos con preservación de lente, aplicación subretiniana de una solución salina balanceada (BSS), una retinotomía de 2,7 mm, implantación de un portador de células nanofibrosas en el espacio subretiniano a través de una esclerotomía adicional de 3,0 mm, intercambio líquido-aire (FAX), taponamiento de aceite de silicona y cierre de todas las esclerotomías. Este abordaje quirúrgico se utilizó en 29 cirugías (18 animales) en los últimos 8 años con una tasa de éxito del 93,1%. La verificación anatómica de la colocación quirúrgica se realizó mediante imágenes de fondo de ojo in vivo (fotografía de fondo de ojo y tomografía de coherencia óptica). Los pasos quirúrgicos recomendados para la implantación subretiniana de EPR en un portador en ojos de minicerdo se pueden utilizar en futuros estudios preclínicos utilizando modelos animales de ojos grandes.
Introduction
La degeneración macular asociada a la edad (DMAE) es considerada la principal causa de pérdida de la visión central en los países desarrollados y es una de las muchas afecciones relacionadas con la disfunción del epitelio pigmentado de la retina (EPR) 1,2. El EPR se encuentra en la membrana de Bruch (BM) ubicada basalmente y proporciona el mantenimiento necesario para los fotorreceptores. La degeneración progresiva de la capa RPE es un sello distintivo de la forma atrófica temprana de AMD, y también acompaña el desarrollo de la forma exudativa tardía de AMD también. A pesar de muchos avances en la terapia de la enfermedad de la retina, el desarrollo de una modalidad de tratamiento eficaz sigue siendo un desafío3. Uno de los métodos prometedores es el reemplazo de EPR utilizando una capa de EPR cultivada in vitro. Este tratamiento se asocia con el progreso en la investigación con células madre utilizando EPR derivado de células madre embrionarias humanas (hESC-RPE) y EPR derivado de células madre pluripotentes inducidas (iPSC-RPE)3,4,5,6,7. En los últimos años, muchos grupos de investigación se han centrado en desarrollar diferentes enfoques para el reemplazo de EPR con la prueba de concepto inicialmente aceptada 8,9,10,11,12,13,14,15. Las células del EPR (EPR) generalmente se entregan en el espacio subretiniano en forma de suspensión celular, una lámina celular autoportante o una monocapa celular soportada por un portador artificial 3,16,17,18,19,20,21. La inyección de una suspensión celular es el método más fácil, pero la condición comprometida del BM a menudo puede evitar la unión de las células trasplantadas. Esto puede resultar en una orientación apicobasal incorrecta de los EPR y la falta de formación de una monocapa22,23. La principal ventaja de los otros dos métodos (es decir, una lámina celular autoportante y una monocapa celular soportada por un sustrato artificial) es que las células ya están en un estado monocapa diferenciado cuando se implantan directamente en el espacio subretiniano24.
Muchas técnicas quirúrgicas que describen la administración de portadores celulares en el espacio subretiniano han sido publicadas en los últimos años 8,9,10,11,12,13,14,15. Estos estudios describieron el uso de modelos animales de ojos grandes, los tipos de portadores celulares, el uso de cultivos celulares trasplantados, los instrumentos de implantación, así como las técnicas quirúrgicas, y los autores se centraron principalmente en los resultados de la implantación subretiniana. En 2015, Popelka et al. informaron el uso de una membrana polimérica electrohilada ultrafina soportada por marco para el trasplante de EPR en ojos de cadáver porcino8. La técnica quirúrgica descrita aquí con la implantación subretiniana del portador celular permitió un manejo relativamente preciso del portador y un fácil posicionamiento del andamio en el espacio subretiniano. Kozak et al. evaluaron la viabilidad de la técnica de entrega de un portador con un tamaño aproximado de 2 mm x 5 mm en ojos porcinos9. El diseño único del portador celular permitió su correcta colocación, evitando que la monocapa celular se pliegue y se arrugue6. Al-Nawaiseh et al. presentaron por primera vez directrices detalladas paso a paso para la implantación de andamios subretinianos en conejos25. Stanzel et al. publicaron un protocolo similar en 2019 para el trasplante en pequeños roedores, conejos, cerdos y primates no humanos26. Como se publicó anteriormente, el trasplante de una monocapa de EPR diferenciada y polarizada en un portador sólido resultó en una mejor supervivencia y una mejor integración del injerto en comparación con otras técnicas de administración (Archivo Suplementario 1)27.
El propósito de cualquier estudio preclínico en animales realizado in vivo es revelar los diversos aspectos de la implantación subretiniana transvítrea quirúrgica de un portador celular con un enfoque en la seguridad del procedimiento, la supervivencia de las células trasplantadas, la respuesta del tejido a las maniobras subretinianas y los resultados postoperatorios a corto y largo plazo. Se ha informado que el uso de ojos porcinos como modelo animal de ojo grande es relevante en términos del alcance de los datos obtenidos, que podrían ser útiles y potencialmente aplicables a los humanos10,11,14. Nuestro estudio informa sobre la técnica quirúrgica utilizada para la implantación subretiniana in vivo de un portador celular en un modelo animal de ojo grande. Presentamos una descripción detallada de los preparativos preoperatorios, la técnica quirúrgica de implantación de portadores de células subretinianas y el cuidado postoperatorio de los ojos de minicerdo basados en nuestra experiencia en los últimos 8 años. Describimos los principios quirúrgicos básicos que se pueden utilizar para estudios experimentales in vivo que implican la implantación de diferentes tipos de células y portadores celulares.
Modelo animal grande
El rebaño experimental de minicerdos Liběchov fue fundado por la importación de cinco animales de la cepa Hormel de los Estados Unidos en 1967. Estos animales fueron cruzados para estudios de grupos sanguíneos porcinos con varias otras razas o cepas: Landrace, Large White, Cornwall, cerdos vietnamitas y cerdos miniatura de origen de Göttingen28,29. A los 5 meses de edad y aproximadamente 20 kg de peso corporal (PC), los minipigs alcanzan la madurez sexual. Se informa que la supervivencia de las razas parentales de minipigs (Hormel y Göttingen) es de 12 a 20 años. La implantación subretiniana del portador celular se dirige a la porción central de la retina. La retina de los minipigs carece de mácula y fóvea. Sin embargo, tiene regiones de fotorreceptores de cono altamente concentrados llamados área central y rayas visuales30,31. Estas regiones son responsables de la mayor agudeza visual.
Las cirugías fueron realizadas por cuatro cirujanos vitreorretinianos experimentados con la asistencia de un asistente experimentado en el centro quirúrgico (TA). Antes de los experimentos in vivo , los cirujanos fueron educados y obtuvieron conocimientos especiales de la anatomía del ojo de minipig, como con respecto a la menor relación de lente a volumen vítreo, la longitud axial más corta (15-19 mm), la ausencia de la membrana de Bowman en la córnea, el volumen vítreo más pequeño (2.8-3.2 mL), la ausencia de la mácula y la fóvea, la ausencia del anillo de Zinn, y el diámetro del disco óptico (vertical/horizontal: 1,5 mm/2,1 mm). En todos los casos, la cirugía se realizó bajo anestesia general en un quirófano especialmente organizado con la implementación de medidas asépticas y antisépticas estándar.
Protocol
Este estudio se adhiere a los principios de las Directrices de la Declaración de Helsinki y los principios éticos para la investigación médica con seres humanos. Todos los experimentos se llevaron a cabo de acuerdo con las Directrices para el cuidado y uso de animales de laboratorio y de acuerdo con la Asociación para la Investigación en Visión y Oftalmología (ARVO) para el uso de animales en la investigación oftálmica y visual. El protocolo del estudio fue aprobado por la Comisión Profesional de Resorts de la CAS para la Aprobación de Proyectos de Experimentos con Animales en el Instituto de Fisiología y Genética Animal de la Academia Checa de Ciencias (Liběchov, República Checa) (Protocolo aprobado No. 60/2016 y No. 64/2019).
1. Consideraciones durante el trasplante subretiniano de células de un portador en minicerdos
- Selección de animales
- Obtenga y use minicerdos Liběchov que tengan entre 12 y 36 meses de edad, de cualquier sexo y alrededor de 40-80 kg de peso corporal (PC).
- Mantenga a los minipigs en el interior en un gallinero con aire acondicionado con temperaturas entre 18-22 °C, exposición a un ciclo artificial de luz/oscuridad de 13 h/11 h, corrales individuales estandarizados, acceso gratuito al agua y alimentación dos veces al día.
- Preparación previa a la cirugía
- Verifique la orientación quirúrgica del ojo y dibuje los esquemas de fondo de ojo. Para ello, divida esquemáticamente la retina de los minipigs en el dibujo del fondo de ojo usando una pluma con una línea vertical en las regiones temporal (desde el disco óptico hacia la oreja), nasal (desde el disco óptico hacia el hocico del cerdo) y central (entre los principales vasos retinianos en el lado nasal) (Figura 1A, B).
- Seleccione solo animales sanos sin ninguna patología conductual y neurológica y con calidad normal de la piel, orificios corporales, heces y consumo de alimentos. Haga que un veterinario experto realice la observación clínica y seleccione los animales.
- Inyecte por vía intramuscular 3 mg/kg de peso corporal de clorhidrato de ceftiofur (1 ml/kg) el día de la cirugía.
- Inmunosupresión preoperatoria
- Preparar microesferas poliméricas liberadoras de tacrolimus como se describe en Wang et al. y Sevc et al. 32,33 con modificación.
- Asegúrese de que la concentración de tacrolimus en las microesferas poliméricas sea de 51,3 mg/g según lo determinado por HPLC (Tabla de materiales).
- Realizar una inyección subcutánea de microesferas poliméricas cargadas con tacrolimus a una dosis de 0,25 mg/kg de peso corporal 6 días antes de la cirugía ocular para impedir el rechazo del injerto celular. Esto se hace para garantizar la supervivencia de las células del donante del EPR humano durante el trasplante xenogénico en los ojos de los minicerdos.
- Inyectar los animales por vía intramuscular el día de la cirugía con 80 mg de depo-medrol y bencilpenicilina a 1 mL/10 kg según el peso corporal.
- Anestesia
- Inducir anestesia general con una inyección intramuscular de una mezcla de tiletamina (2 mg/kg), zolazepam (2 mg/kg), ketamina (2 mg/kg) y xilazina (0,4 mg/kg)-TKX34,35 antes de la cirugía. Verifique la profundidad de la anestesia mediante un estado de inconsciencia y verificando el reflejo pedal (un pellizco de la piel interdigital de la pata trasera), el reflejo corneal (un ligero toque de la córnea), el reflejo pupilar (reacción a la luz) y el reflejo palpebral (un toque en el párpado). Asegúrese de que el animal no parpadee. Confirme la regularidad del ritmo cardíaco y respiratorio.
- Después de la inducción de la anestesia, transportar al animal sedado al quirófano en un carro elevador (Figura 2A).
- Coloque al animal en la mesa de operaciones en su lado izquierdo para permitir la cirugía en el ojo derecho (Figura 2B).
- Realizar el ajuste de la cabeza del animal utilizando almohadillas de espuma de poliestireno para conseguir la posición más adecuada de la retina central para la implantación (es decir, horizontal y paralela al suelo) (Figura 2C).
- Coloque gotas oftálmicas de clorhidrato de proparacaína al 0,5% en la solución oftálmica en el saco conjuntival tres veces separadas por 1 minuto para inducir anestesia local.
- Insertar una cánula venosa e intubar al animal con un tubo endotraqueal para el mantenimiento por inhalación de la anestesia (isoflurano al 1,5%) utilizando una máquina de anestesia equipada con un monitor de paciente (Figura 2A, B).
- Administrar una inyección intramuscular de 1 mL de Eficur por cada 16 kg de peso corporal y 20 mg de Depo-Medrol 1 aproximadamente 15 min antes del inicio de la cirugía ocular (Tabla de materiales).
- Mantener la temperatura corporal fisiológica cubriendo al animal con lámina isotérmica y realizar la cirugía como se describe en la sección 3.
- Durante la cirugía, controle la temperatura del animal junto con la frecuencia cardíaca y la saturación de oxígeno en la sangre utilizando un clip para la oreja y un monitor del paciente. Evitar la disminución de la temperatura corporal por debajo de 38 °C durante los procedimientos, que se considera un límite seguro36. Mantener la saturación de oxígeno (>96%) y la frecuencia del pulso (70-90 latidos por minuto) durante todo el experimento.
- Cuando se complete la cirugía, cierre el flujo de isoflurano y extube al animal.
- Después de la respiración espontánea y el despertar, transfiera a los animales a sus corrales.
- Configuración del quirófano
- Organice el quirófano de acuerdo con las necesidades de la cirugía en los ojos del modelo animal de ojo grande (Figura 3A, B). Ajuste la altura de las sillas del cirujano, así como la altura del microscopio, para lograr una posición cómoda para los cirujanos con respecto a la posición del hocico del cerdo.
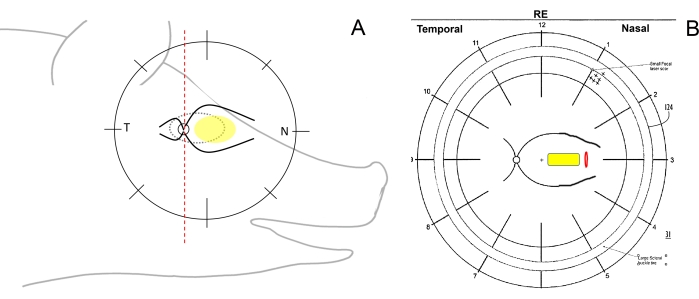
Figura 1: Dibujo esquemático de las zonas retinianas en minicerdos. (A) Dibujo esquemático de las zonas retinianas en relación con la cabeza del minipig; la elipse amarilla representa el área deseada de implantación subretiniana, T se refiere al área temporal de la retina y N se refiere al área nasal de la retina. (B) Ejemplo del esquema del fondo de ojo después de la implantación subretiniana del portador celular (amarillo) mediante retinotomía (rojo). Haga clic aquí para ver una versión más grande de esta figura.
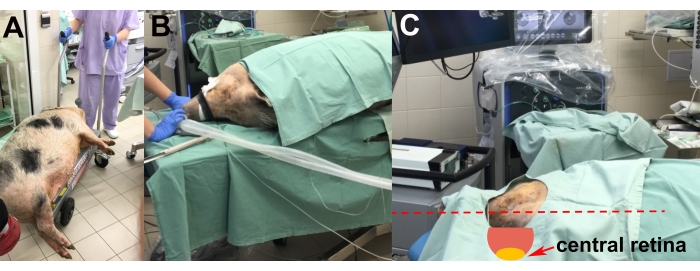
Figura 2: Transporte y colocación del animal. (A) Transporte del animal sedado al quirófano. (B) Colocación del animal durante la intubación. (C) Ajuste de la cabeza del animal para un acceso óptimo a la retina central durante la cirugía (flecha roja). Haga clic aquí para ver una versión más grande de esta figura.
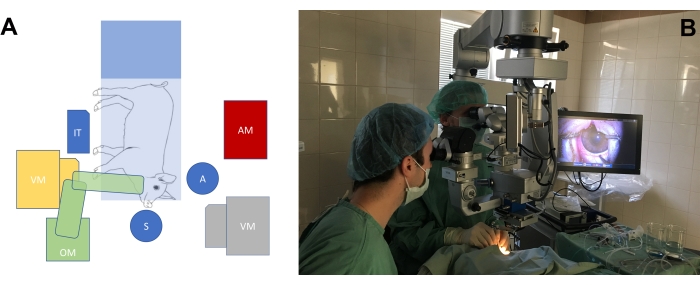
Figura 3: La configuración estándar de la sala de operaciones. (A) Representación esquemática de la posición de los cirujanos (S = cirujano, A = asistente) en relación con la posición de la mesa de operaciones con el minipig, el microscopio quirúrgico (OM), la máquina de vitrectomía (VM), la mesa instrumental (IT) y la máquina de anestesiología (AM). Hay dos posiciones posibles de la máquina de vitrectomía (amarillo y gris). (B) Entorno de la vida real en la sala de operaciones. Haga clic aquí para ver una versión más grande de esta figura.
2. Portador celular, cultivos de células cultivadas e inyector de implantación
- Portador celular
- Corte el marco ovalado de 30 μm de ancho con dimensiones exteriores de 1,7 mm x 4,8 mm, equipado con salientes triangulares ubicados asimétricamente en el marco (Figura 4A), de una lámina de polietileno-tereftalato (PET) de 36 μm de espesor orientada biaxialmente utilizando un láser de femtosegundo.
- Preparar una solución polimérica de poli(L-lactida-co-DL-lactida) (LLA/DLLA 90/10, MW 868, 270 g/mol) en piridina a una concentración del 11% en peso con la adición de 2,2 μL de ácido fórmico por 1 g de solución.
- Prepare la membrana nanofibrosa con un marco de soporte incrustado (Figura 4B) mediante el electrohilado de la solución polimérica en tres pasos8: (1) depositar la primera capa de nanofibras sobre un sustrato de silicio, (2) colocar el marco sobre la capa y (3) depositar la segunda capa de nanofibras.
NOTA: Deposite cada capa durante 7 minutos para alcanzar un espesor total de membrana de 3,7 μm. Utilice los siguientes parámetros para obtener una membrana compuesta por fibras de 380 nm de espesor y con un tamaño de poro promedio de 0,4 μm y una porosidad de aproximadamente 70%37: una aguja de acero de 20 G, una tensión de 7,1 kV, un espacio de 10 cm, un caudal de 250 μL/min y una temperatura de 25,0 °C ± 0,5 °C. - Retire cuidadosamente la membrana con el marco incrustado del sustrato de silicio y fíjela al cuerpo de un inserto comercial de cultivo celular de 12 pozos desprovisto de la membrana original para facilitar la siembra y el crecimiento de las células.
- Tratar la membrana nanofibrosa antes de la siembra celular en aire-plasma durante 30 s a una potencia de 70 W en un limpiador de plasma.
- Cultivos celulares utilizados para el cultivo en el portador celular
NOTA: Se pueden utilizar los siguientes portadores celulares: 1) portadores de células nanofibrosas sin células; 2) portadores de células nanofibrosas con EPR humanos primarios (EPR h); 3) portadores de células nanofibrosas con células RPE humanas derivadas de iPSC.- Cultivo de hRPE primarios
- Aislar células hRPE primarias de ojos de donantes humanos de acuerdo con una técnica previamente reportada38.
- Obtener las células mediante tratamiento enzimático de la retina durante 30 min. Luego, cultive las células hRPE primarias (pasaje 0) durante un máximo de 2 semanas en DMEM / F12 suplementado con suero bovino fetal al 10% (FBS).
- Una vez que los cultivos celulares alcancen la confluencia, cambie el medio a FBS al 1% y cultive durante 30 días adicionales.
- Sembrar los hRPE primarios en placas trans-pocillo y en un portador de células nanofibrosas recubierto de laminina a una densidad de 2.000 células/mm2. Después de otros 30 días de incubación en FBS al 1%, utilice los portadores celulares con hRPE primarios para la implantación subretiniana en minicerdos.
- RPE derivados de iPSC humanos
- Utilizar hiPSCs derivadas de fibroblastos derivados de pacientes con retinitis pigmentosa asociada a MERTK39 que se corrigen genéticamente en dos alelos utilizando el sistema CRISPR/Cas9 (RP1-FiPS4F1-GC2)40, así como hiPSCs derivadas de los fibroblastos de un sujeto sano (Ctrl2-FiPS5F2)41 que se utilizan como control.
- Generar y posteriormente diferenciar ambas líneas celulares hiPSCs hacia células EPR (hiPSC-RPE) como se informó anteriormente42.
- Colocar en placa los hiPSC-RPEs a 200.000 células/cm2 en insertos de cultivo celular recubiertos con laminina con membranas nanofibrosas de poli(L-lactida-co-DL-lactida) con marcos de implantación ovalados en medio RPE que contiene DMEM knockout, 20% de suero knockout, 0,1 mM de aminoácidos no esenciales, 0,23 mM β-mercaptoetanol, 100 U/ml de penicilina, 0,1 mg/ml de estreptomicina y 10 mM de nicotinamida.
- Cambie el medio cada dos días y cultive el hiPSC-RPE durante 2 meses antes de la implantación para estimular el crecimiento polarizado.
- Inyector de implantación
- Preparar un capilar de plástico con una sección transversal rectangular de 2,8 mm x 0,8 mm mediante moldeo por soplado a partir de un tubo de plástico de OD 1,75 mm/ID 1,10 mm.
- Corte una ventana de carga de 4 mm x 2,2 mm en el capilar de plástico a 6 mm del extremo.
- Ensamble el inyector a partir del capilar de plástico, un mango de silicona, un émbolo de cuchillas de acero y un pistón (Figura 5A).
- Cargue el portador en el inyector a través de una ventana de carga y luego expulsarlo al espacio subretiniano empujando el émbolo, como se describe en el paso 3.5.2 (Figura 5B).
- Preparación del portador nanofibroso y carga del inyector
- Llene una pequeña placa de Petri de plástico con 2 ml de solución salina tamponada con fosfato (PBS). Saque un inserto con la capa celular preparada, colóquelo en un plato de poliestireno semiblando y céntrelo bajo un microscopio óptico. Use un punzón modificado a medida para cortar el portador a lo largo del marco ovalado con un microscopio. Las dimensiones del portador deben ser de 2 mm x 5 mm.
- Utilice un inyector hecho a medida con tubo plano transparente para cargar el transportador; A 6 mm del extremo distal del capilar, hay una ventana para cargar el portador. Llene la ventana del inyector con PBS.
- Usando los fórceps, suelte la muestra del fondo del plato, levántela del líquido y transpórtela a la ventana del inyector mientras verifica primero las marcas de orientación lateral en el marco para detectar primero la parte superior del portador con células adherentes. Un marco ovalado facilita la manipulación con el portador.
- Usando una sonda dental (un instrumento dental de acero inoxidable con un extremo afilado), coloque el portador en la ventana del inyector. Use el émbolo para empujar el portador hacia la parte superior cerrada y segura del inyector. Luego, prepare al portador para la cirugía.
- Compruebe la orientación lateral del transportín en cada paso. Descargue el portador nanofibroso del inyector empujando el émbolo metálico.

Figura 4: Portador nanofibroso con un marco de PET de soporte incorporado. (A) Tres marcas visibles en el marco permiten controlar la orientación lateral del portador (flechas blancas). (B) Vista de ampliación del fragmento de marco de PET incrustado en la membrana nanofibrosa (flechas blancas) del portador celular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Inyector de implantación . (A) Partes del inyector. (B) Portador de células nanofibrosas con marco de PET de soporte incorporado cargado en el capilar rectangular de plástico del inyector de implantación. Haga clic aquí para ver una versión más grande de esta figura.
3. Procedimiento quirúrgico
- Equipo quirúrgico
- Utilice el siguiente equipo quirúrgico: un microscopio quirúrgico oftálmico, un sistema operativo para cirugías en los segmentos ocular anterior y posterior, un sistema quirúrgico vitreorretiniano sin contacto, un dispositivo de fotocoagulación con láser y una cámara digital.
NOTA: Los parámetros estándar utilizados en vitrectomía, exocauterización y endocauterización y equipos de fotocoagulación con láser se representan en la Tabla 1.
- Utilice el siguiente equipo quirúrgico: un microscopio quirúrgico oftálmico, un sistema operativo para cirugías en los segmentos ocular anterior y posterior, un sistema quirúrgico vitreorretiniano sin contacto, un dispositivo de fotocoagulación con láser y una cámara digital.
- Instrumentos quirúrgicos
- Esterilice los instrumentos quirúrgicos reutilizables con un esterilizador de vapor de autoclave móvil o similar de acuerdo con un protocolo estándar. Los instrumentos quirúrgicos de un solo uso y los materiales requeridos durante la cirugía se enumeran en la Tabla de materiales.
- Preparación para los pasos quirúrgicos
- Después de anestesiar al animal como se describe en el paso 1.4.1, aplique gotas oftálmicas de solución de tropicamida al 1% y solución de clorhidrato de fenilefrina al 10% en el saco conjuntival 15 min antes del procedimiento para provocar midriasis inducida por fármacos.
- Acérquese a la mesa de operaciones con el cirujano en la posición superior y el asistente en la posición lateral (Figura 3).
- Afeite el área alrededor del ojo con una maquinilla de afeitar de un solo uso y retire la suciedad áspera.
- Desinfecte el saco conjuntival con una solución de povidona yodada al 5% durante 5 min.
- Desinfecte el área periorbitaria con hisopos de algodón frotando desde los párpados hasta la periferia. Repita el proceso tres veces con una solución de povidona yodada al 10% y déjelo actuar durante 5 minutos.
- Cubra el campo de operación con el ojo en el medio usando una cortina oftálmica estéril estándar con lámina transparente pegajosa. Aleja las pestañas del globo ocular. Evite cortar las pestañas para reducir el riesgo de endoftalmitis postoperatoria.
- Inserte el espéculo de la tapa (espéculo tipo Liberman o Ojo de cocinero). Opcionalmente, fije la membrana nictitante a la piel con 8-0 Sutura de poliglactina.
- Abra la conjuntiva en el lado nasal de 2 mm a 3 mm del limbo para exponer la esclerótica para las esclerotomías usando fórceps quirúrgicos y tijeras conjuntivales de Westcott.
- Inserte los trócares 25 G de tres válvulas a 2.5-3 mm del limbo en el área de la pars plana (colóquelos a las 7 en punto, 10 en punto y 11 en punto). Utilice movimientos giratorios durante la inserción de manera ligeramente oblicua (100°-110°) hacia la retina posterior y sujete el trócar con los fórceps (Figura 6).
- Mantenga la córnea húmeda o cúbrala con metilcelulosa durante toda la cirugía para prevenir el edema corneal osmótico.
- Vitrectomía de la pars plana (VPP)
- Extirpar la porción media del cuerpo vítreo con el enfoque estándar de vitrectomía de la pars plana de tres puertos. Retire con cuidado el vítreo detrás de la lente en el área de la futura esclerotomía grande.
- Utilizar una inyección intravítrea de 2-4 mg de acetónido de triamcinolona (AT) (50-100 μL) para teñir el vítreo posterior, que suele permanecer adherido a la retina, con el fin de realizar un desprendimiento vítreo posterior controlado.
- Después de eso, realice lentamente una inyección subretiniana de 0.05-0.1 mL de BSS con una cánula de 41 G más centralmente, evitando la formación de una ampolla hacia la periferia.
- Reducir los ajustes de presión intraocular con el sistema de irrigación hasta 15 mmHg durante la inyección subretiniana para evitar una oclusión vascular retiniana transitoria.
- Realizar una endodiatermia lineal grande de la retina con una sonda de endodiatermia 27 G de 3 mm cerca de la base de la ampolla nasal.
- Después, realice una retinotomía grande de 3 mm con una cuchilla MVR de 25 G o tijeras verticales con un ajuste de presión intraocular elevada (PIO) del sistema de irrigación hasta 60 mmHg durante 3 min a 5 min. Asegúrese de que no haya sangrado por la retinotomía y luego reduzca la PIO a 25 mmHg.
- Realizar una exodiatermia de los vasos epiesclerales entre los dos trócares nasales a 2,5-3 mm del limbo con una sonda de endodiatermia de 27 G aplicando un toque suave sobre la superficie de la esclerótica.
- Compruebe el nivel de líquido del frasco de infusión antes de agrandar la esclerotomía, ya que después del agrandamiento de la esclerotomía, el consumo de líquidos es temporalmente alto.
- Realice una esclerotomía grande de 3,0 mm, a 3 mm del limbo, utilizando un cuchillo phaco de 2,75 mm.
- Preste atención a un posible sangrado de los vasos esclerales y el cuerpo ciliar dentro de la esclerotomía grande. En caso de sangrado, utilice una sonda de endodiatermia de 27 G para coagular los vasos dañados. Amplíe la esclerotomía a 3,0 mm con un cuchillo de satén para acomodar la punta del inyector (0,8 mm x 2,8 mm).
- Retire el cuerpo vítreo prolapsado en el sitio de la esclerotomía grande con un vitrector. Mantener la infusión de BSS al nivel de 25-30 mmHg con el sistema de vitrectomía para evitar el colapso del globo.
- Implantación del portador celular
- Inserte suavemente el inyector con la mano dominante en la cavidad vítrea a través de la esclerotomía grande. En caso de resistencia, ampliar el tamaño de la esclerotomía.
- Implante el portador de células a través de la retinotomía en el espacio subretiniano. Si es necesario, utilice una técnica bimanual con esclerotomía adicional y lámpara de araña para mejorar el control de la implantación.
- Retire el inyector del ojo y cierre la esclerotomía grande con un 8-0 Sutura de poliglactina para evitar complicaciones asociadas con hipotonía intraocular.
- Realice un intercambio completo de fluido-aire (FAX) y drenaje del líquido subretiniano con una cánula con punta de silicona.
- Después de eso, inyecte aceite de silicona (1,000 cSt) en la cavidad vítrea utilizando el sistema de vitrectomía y el sistema de tubos para la inyección de aceite de silicona hasta que la PIO sea normal.
- Imágenes y documentación intraoperatoria
- Realice una grabación de video durante toda la cirugía con documentación fotográfica de los pasos clave de la implantación utilizando un sistema de grabación de video.
- Complete el dibujo del fondo de ojo documentando la ubicación de las esclerotomías, la retinotomía, el implante subretiniano y cualquier complicación que haya ocurrido utilizando esquemas de dibujo de fondo de ojo.
- Pasos posteriores a la cirugía
- Al final de la cirugía, retire los trócares y cierre las tres esclerotomías y la conjuntiva con 8-0 Suturas de poliglactina.
- Enjuague el saco conjuntival con una solución de povidona yodada al 5%.
- Realizar una inyección subconjuntival de 0,3 ml de 20 mg de gentamicina, 2 mg de dexametasona y xilococaína al 2%.
- Compruebe el estado del fondo de ojo y del cristalino mediante una vista microscópica.
- Retire la(s) sutura(s) de la membrana nictitante usando fórceps quirúrgicos y tijeras conjuntivales de Westcott (opcional).
- Aplique ungüento de neomicina o ungüento ofoftálmico de ofloxacino en el saco conjuntival.
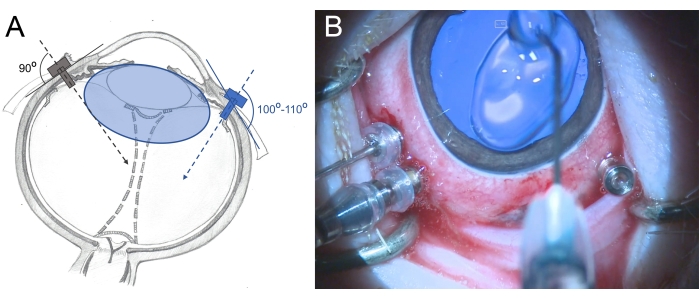
Figura 6: Inserción de los trócares en el ojo de un minipig. (A) Representación esquemática de los trócares, que se insertan perpendicularmente en la esclerótica hacia el centro de la cavidad vítrea en el ojo humano (color gris) y de manera oblicua hacia la retina posterior en el ojo de minipig (color azul) para evitar daños en el cristalino. La lente del minipig (de color azul) es más grande que la de los humanos y relativa al tamaño de la cavidad vítrea. (B) Vista intraoperatoria de los trócares insertados en un PPV de tres puertos. La córnea está cubierta con metilcelulosa para evitar la sequedad y la hinchazón. Haga clic aquí para ver una versión más grande de esta figura.
4. Cuidados postoperatorios
- Aplique bacitracina zinc tópica / acetato de hidrocortisona / sulfato de neomicina o 0.3% de ofloxacino en el saco conjuntival de los animales cinco veces al día.
- Después de la operación, verifique los siguientes parámetros oculares: turgencia de los tejidos blandos del ojo mediante palpación, reacción inflamatoria en la superficie del ojo y entrecerrar los ojos como reacción protectora de los párpados con una lámpara de hendidura de mano o un oftalmoscopio indirecto.
- Para la atención postoperatoria sistémica, use los siguientes antibióticos:
- Inyecte por vía intramuscular clorhidrato de ceftiofur a la dosis de 3 mg/kg de peso corporal (1 ml/kg) el segundo y tercer día de estabilidad.
- Inyectar tulatromicina (1 mL/40 kg pc) después de 72 h después de la cirugía para la prevención de la infección bacteriana secundaria.
- Realizar una inyección intramuscular de flunixina (2 mL/45 kg de peso vivo) y clorhidrato de tramadol (100 mg) cada 24 h durante 3 días después de la cirugía para prevenir el dolor.
- Mantener a los minipigs en una instalación especializada con aire acondicionado con un rango de temperatura de 18-22 °C y un régimen artificial de luz/oscuridad de 13 h/11 h.
- Asegúrese de que tengan acceso gratuito al agua y a la alimentación estándar (dos veces al día).
5. Procedimientos postoperatorios
- Exámenes oftalmológicos postoperatorios
- En el período postoperatorio, inspeccione los ojos con un oftalmoscopio indirecto para detectar la presencia de inflamación (es decir, enrojecimiento, hinchazón de los tejidos o congestión de moco en el saco conjuntival). Medir la presión intraocular en el ojo operado mediante el método de palpación.
- Imagen postoperatoria
- Inducir la sedación en el minipig mediante la inyección intramuscular de una mezcla TKX antes de la fotografía de fondo de ojo y el examen de OCT. Instilar gotas oftálmicas de clorhidrato de tropicamida al 1% y clorhidrato de fenilefrina al 10% en el saco conjuntival del minicerdo para inducir midriasis.
- Emplee un espéculo de párpado para mantener los ojos abiertos. Para hidratar la superficie ocular y obtener una imagen clara de OCT, lavar la córnea del animal con solución salina (0,9% NaCl) cada 30-60 s.
- Coloque el minipig en la mesa de operaciones de la misma manera que durante la operación (Figura 2B, C, Figura 3A). El requisito principal es colocar la cabeza en el costado y perpendicular a la pieza de escaneo del dispositivo OCT. Use almohadillas de espuma de poliestireno debajo del hocico del animal para estabilizar la cabeza, llevando la superficie del ojo a una posición horizontal.
- Recopile imágenes de fondo de ojo en color con una cámara de fondo de ojo no midriático en color, ya que esto permite documentar el segmento anterior, la retina y el disco óptico. Además, tome una imagen libre de rojo de la retina con la cámara de fondo de ojo no midriático.
- Realizar imágenes de tomografía de coherencia óptica utilizando el sistema OCT de dominio espectral. Durante la OCT o la imagen del fondo de ojo, incline la cabeza del minipig manualmente hacia las lentes OCT o las lentes de la cámara del fondo de ojo para optimizar la vista de la retina posterior y el área de implantación (Figura 2C). Para obtener imágenes óptimas del portador implantado en el fondo, aplique la luz de reflectancia infrarroja del dispositivo OCT para enfocar el implante (Figura 2C). Utilice los modos de escaneo de línea cruzada y mapa de retina de OCT.
- Aplique ungüento ofloxacina oftálmico al final del examen debajo del párpado del ojo del animal.
- Trasladar el minipig a la instalación interior y observar su estado general hasta el final de la sedación (aproximadamente 2 h a 5 h).
6. Enucleación de la autopsia del ojo después de la eutanasia
- Sedar a los minicerdos con una inyección intramuscular de la mezcla TKX seguida de una aplicación intravenosa (a través de una cánula de oído 22-G) de propofol al 1% (20 mL/animal) seguida de exsanguición. No utilice fijadores generales.
- Sacrificar a los animales por exsanguinación durante la anestesia general profunda 7 días, 14 días, 28 días y 42 días después de la implantación del injerto celular.
- Use fórceps y tijeras para quitar los párpados superiores e inferiores. Retire el tercer párpado y corte a través de la conjuntiva. Cortar los músculos del ojo y el nervio óptico.
- Enuclear los ojos post mortem usando tijeras quirúrgicas y fórceps quirúrgicos. Asegúrese de que el procedimiento sea realizado por una persona experimentada.
Representative Results
Los resultados de la implantación subretiniana del portador celular en minicerdos de Liběchov se presentan en Table 2. La implantación exitosa se definió como la obtención de datos suficientes para el estudio histológico e inmunohistoquímico. Los casos fallidos se definieron como ojos con complicaciones intraoperatorias graves, lo que hizo imposible la observación adicional de los tejidos oculares.
La aplicación de la técnica propuesta con el uso de taponamiento de aceite de silicona permite controlar la condición del trasplante subretiniano utilizando modalidades de imagen desde el día siguiente después de la cirugía hasta el momento de la enucleación (Figura 7, Figura 8 y Figura 9).
Imágenes de fondo de ojo y SD-OCT
Los minipigs fueron examinados en el postoperatorio utilizando imágenes de fondo de ojo, imágenes libres de rojo y tomografía óptica coherente de dominio espectral (Figura 7). Las imágenes de fondo de ojo de alta calidad se permitieron mediante el uso de medios ópticos transparentes, incluida una lente transparente y el uso de taponamiento de aceite de silicona (Figura 7A). El sitio de la retinotomía no mostró signos de reacción proliferativa (Figura 7A, flechas amarillas), y el marco PTE del portador celular fue claramente visible a través de las capas semitransparentes de la retina porcina. En la imagen libre de rojo, la reflectividad de los hRPE cultivados en el portador no difirió de la reflectividad de la capa endógena de EPR porcino (Figura 7B). En el SD-OCT, el marco PTE causó solo un ligero sombreado de las estructuras anatómicas subyacentes y un ligero engrosamiento de la retina (Figura 7C, flechas rojas). No se observaron zonas hiporreflectantes o hiperrreflectantes atípicas en la SD-OCT, y la membrana de Bruch también pareció permanecer intacta. La Figura 8 presenta imágenes de fondo de ojo e iOCT del andamio cultivado con células RPE humanas primarias 1 mes después de la cirugía (Figura 8). El portador celular en sí (sin células) no causó un aumento significativo en el grosor de la retina (Figura 9C). Estos hallazgos sugieren que el impacto iatrogénico intraoperatorio del implante fue mínimo y que el portador de células implantadas experimentó una adaptación suficiente de las células implantadas a las células fotorreceptoras suprayacentes y al tejido neurorretiniano.
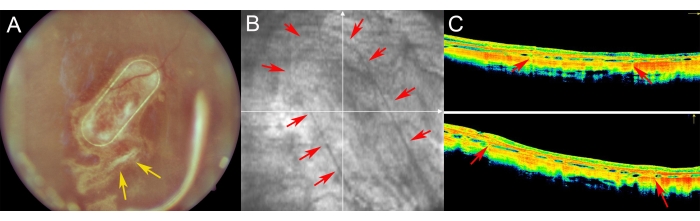
Figura 7: Imagen postoperatoria de la retina en minicerdos . (A) imágenes de fondo de ojo, (B) imagen libre de rojo y (C) tomografía de coherencia óptica del portador nanofibroso con células RPE humanas primarias en un seguimiento de 1 semana después del trasplante subretiniano en un ojo de minicerdo. (A) Las flechas amarillas indican el sitio de la retinotomía. (B) Las flechas rojas muestran los márgenes del portador de células nanofibrosas. (C) Las flechas rojas muestran el ligero sombreado de la señal OCT causado por el marco PET de soporte del portador nanofibroso, que se implantó en el espacio subretiniano. Haga clic aquí para ver una versión más grande de esta figura.
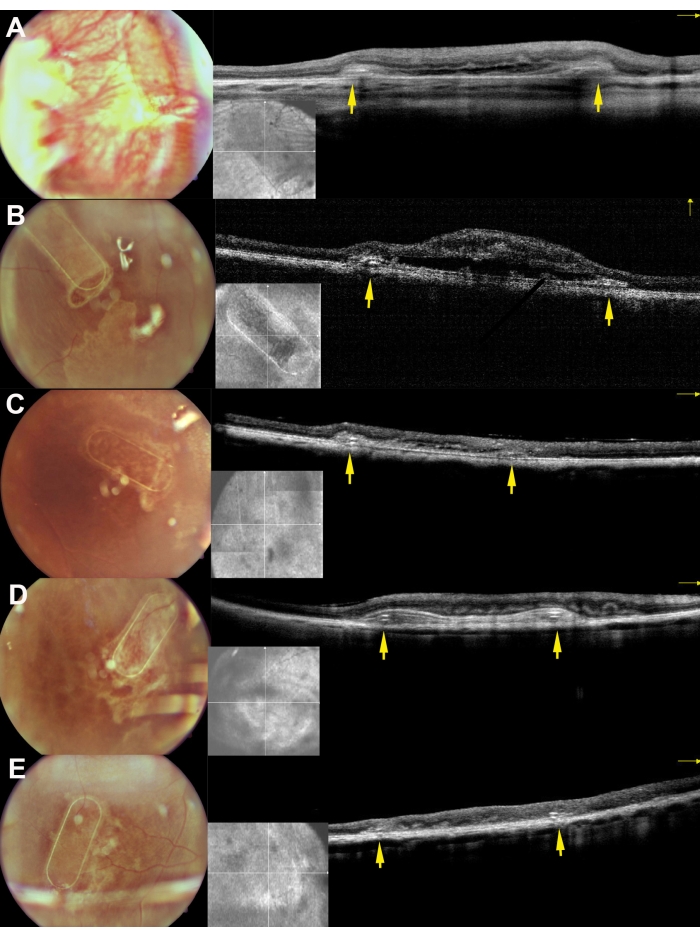
Figura 8: Imágenes de fondo de ojo e iOCT de los andamios 30 días después de la implantación subretiniana en los minicerdos. A, B, C, D y E corresponden a los cerdos 169, 182, 179, 199 y 224, respectivamente. Las flechas amarillas representan el marco del andamio. Haga clic aquí para ver una versión más grande de esta figura.
Análisis histológico e inmunohistoquímico
Después de la eutanasia de los animales, se retiraron los ojos enteros de minicerdo y se fijaron en paraformaldehído al 4% (PFA) durante 24 h. Se extirpó la parte anterior del ojo y se identificó el portador nanofibroso implantado en la retina central nasal y se aisló con la esclerótica adherida. Todos los tejidos fueron crioprotegidos en soluciones graduadas de sacarosa y secciones verticales congeladas, como se describe en detalle43. La histología de la membrana nanofibrosa sin células del EPR después de 4 semanas de implantación reveló retinas sin inflamación y cambios degenerativos (Figura 9A). La presencia de la membrana nanofibrosa se detectó en luz polarizada (Figura 9B).
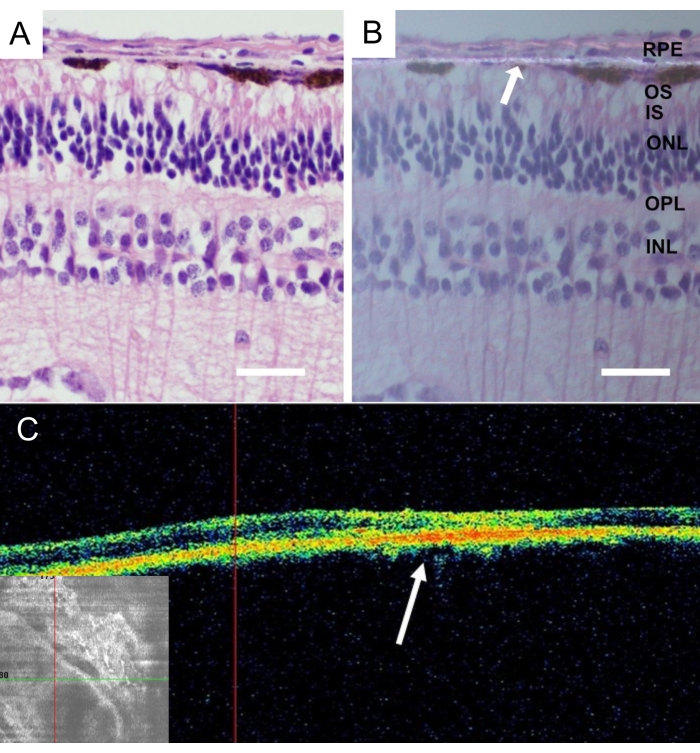
Figura 9: Análisis histológico de la membrana nanofibrosa acelular implantada. Tinción con hematoxilina-eosina de la membrana nanofibrosa acelular 4 semanas después de la implantación (A) con iluminación estándar y (B) con microscopía de luz polarizada. La flecha blanca indica la localización de la membrana nanofibrosa (barra de escala: 50 μm). (C) Las imágenes de tomografía de coherencia óptica in vivo de la membrana nanofibrosa acelular después de 4 semanas después de la implantación muestran una buena aceptación y adherencia de la membrana nanofibrosa en el espacio subretiniano. La flecha blanca indica la ubicación del implante en la imagen transversal de la retina. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 10 muestra la tinción de hematoxilina-eosina (H&E) del área retiniana que contiene las células hRPE primarias implantadas en un portador nanofibroso (flecha amarilla) en el ojo de minicerdo. La apariencia pigmentada de los hRPE primarios implantados formó una capa pigmentada continua pero irregular (Figura 10, flechas rojas). Después de períodos de observación más largos (6 semanas), la neuroretina debajo de los implantes mostró una apariencia similar a una roseta o reacción hipertrófica alrededor del sitio de la retinotomía, probablemente como resultado de la manipulación iatrogénica. Estos resultados morfológicos son comparables a los hallazgos de SD-OCT y apoyan la evidencia del impacto mínimo de la administración de portadores en el tejido retiniano.
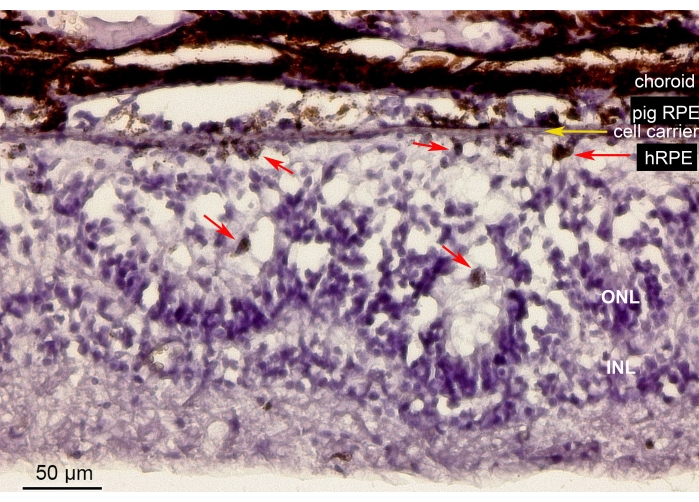
Figura 10: Análisis histológico de la membrana nanofibrosa implantada con los hRPEs primarios. Tinción con hematoxilina-eosina del área retiniana que contiene el portador nanofibroso implantado (flecha amarilla) con los hRPE primarios en el ojo de minicerdo. El animal fue sacrificado y analizado 6 semanas después de la implantación. Los hRPE primarios se distinguieron claramente por su tamaño, forma redonda y pigmentación (flechas rojas) en el espacio subretiniano opuesto a los fotorreceptores. Los núcleos fotorreceptores en el ONL construyen estructuras en forma de roseta. El espacio subretiniano parece hipertrófico. Abreviaturas: hRPE = epitelio pigmentado retiniano humano primario, ONL = capa nuclear externa, INL = capa nuclear interna. Haga clic aquí para ver una versión más grande de esta figura.
La inmunotinción se realizó empleando un método indirecto de dos pasos. Las secciones se incubaron a temperatura ambiente durante la noche en CRALBP, un anticuerpo primario monoclonal, a una dilución de 1:100. La inmunofluorescencia se realizó utilizando el anticuerpo secundario conjugado con Alexa Fluor 488.
Los hRPE primarios implantados estaban presentes en el área de implantación y expresaban el marcador CRALBP típico del EPR similar a las células del EPR de minicerdo endógeno (Figura 11A). En contraste, la morfología de las células implantadas parecía no asumir una forma de monocapa después de la implantación, pero permaneció localizada dentro del espacio subretiniano definido (Figura 11A, B, flechas blancas). Los siguientes marcadores RPE/retiniana y apariencia morfológica permanecieron positivos después del período posterior a la implantación de 6 semanas: la presencia de gránulos de pigmento/melanina, los marcadores neuronales específicos de la retina en etapa terminal para el bastón bipolar (PKC-alfa) y los fotorreceptores de cono (PNA), y la positividad GFAP, un signo de activación microglial.
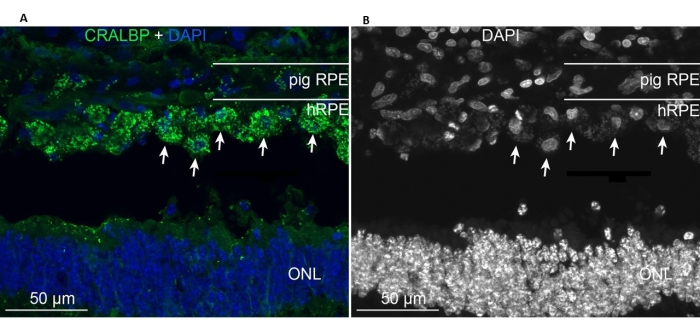
Figura 11: Inmunomarcaje con el marcador celular del EPR CRALBP (proteína de unión a retinaldehído celular) en un minicerdo 6 meses después de la implantación de hRPEs primarios. (A) Las secciones verticales congeladas del ojo de cerdo tratado fueron inmunomarcadas con anticuerpo monoclonal CRALBP (verde) y contrateñidas con DAPI (azul). (B) Representación única del etiquetado de núcleos celulares con DAPI en blanco y negro, ya que el alto contraste revela la forma redonda de las células hRPE individuales (algunas se muestran con flechas blancas). Abreviaturas: hRPE = epitelio pigmentario de la retina humana, ONL = capa nuclear externa. Haga clic aquí para ver una versión más grande de esta figura.
Complicaciones oculares
En total, hubo 27 de 29 (93,1%) operaciones realizadas con éxito. La definición de "cirugías realizadas con éxito" se aplicó a aquellos casos en que el ojo operado no mostró complicaciones postoperatorias clínicamente significativas hasta el momento de la enucleación que pudieran influir en el estudio histológico e inmunohistoquímico. La reducción de la transparencia de los medios ópticos afectó la imagen postoperatoria en cuatro casos (13,7%); No obstante, estos ojos se procesaron con análisis histológicos e inmunohistoquímicos adicionales.
El desprendimiento de retina periférica intraoperatorio ocurrió en cuatro casos (13,8%). En dos casos, se manejó mediante la aspiración del líquido subretiniano durante el intercambio fluido-gas y la aplicación de fotocoagulación con láser de la retina en el área de desprendimiento. En los otros dos casos (6,9%), el desprendimiento de retina se asoció con sangrado masivo retiniano y subretiniano, lo que imposibilitó la implantación del portador celular y condujo a la finalización de la cirugía y la eutanasia inmediata del minicerdo mientras estaba en la mesa de operaciones.
| No | Parámetros | Configuración estándar utilizada |
| 1 | Velocidad de la vitrectomía (velocidad de corte) | hasta 20.000 cortes/min |
| 2 | Bomba Venturi | 50-180 mmHg |
| 3 | Tiempo de subida | 1 segundo |
| 4 | Presión de riego | 18-25 mmHg |
| 5 | Presión de infusión de aire | 20-25 mmHg |
| 6 | Exodiatermia bipolar | 18-26% |
| 7 | Endodiatermia monopolar | 16-18% |
| 8 | Fotocoagulación láser de la retina, 532 nm | Potencia 100-150 mW |
| Intervalo 100 ms | ||
| Duración 100 ms |
Tabla 1: Parámetros estándar utilizados durante la vitrectomía y la fotocoagulación con láser.
| Total animales, n | 18 |
| Total ojos, n | 36 |
| Ojos operados, n | 29 |
| Implantación exitosa, n | 27 |
| Casos fallidos, n | 2 |
| Tiempo medio de cirugía, min | 57 |
| Tasa de éxito, % | 93.1 |
Tabla 2: Resultados de la técnica quirúrgica estandarizada con implantación subretiniana del portador celular en minicerdos de Liběchov entre 2016 y 2020.
Expediente complementario 1: Resumen de los estudios dedicados a la implantación subretiniana de células EPR en el portador celular. Haga clic aquí para descargar este archivo.
Discussion
La implantación subretiniana de células del EPR con diferentes orígenes es una tendencia muy prometedora en la investigación ocular para el tratamiento de trastornos degenerativos retinianos, como la DMAE 3,4,8,9,10,11,12,13,14,15,25 . La idea principal de este enfoque es sustituir los EPR dañados por EPR sanos cultivados ex vivo (Archivo Suplementario 1)44,45,46,47,48. El uso de portadores celulares para trasplantar las células RPE cultivadas representa el enfoque más razonable, ya que las membranas porosas mantienen la capa celular RPE polarizada en la orientación correcta con respecto a la capa fotosensorial.
Modelo animal óptimo
Un paso crítico en el desarrollo de tales enfoques de tratamiento es el uso del modelo animal óptimo49. En el pasado, se han utilizado modelos de animales pequeños y grandes, incluidos conejos, perros, cerdos y primates no humanos 8,9,10,11,12,13,14,15,27,29. En este artículo, proponemos el uso del modelo de minicerdo de Liběchov y describimos los pasos preoperatorios, quirúrgicos y postoperatorios que permiten una eficacia robusta del trasplante. El minicerdo Liběchov fue criado originalmente hace unos 20 años y se ha utilizado con frecuencia en la investigación biomédica en el campo de las enfermedades neurodegenerativas, como el Parkinson y la enfermedad de Huntington29,50. Dado que el cerdo posee un cerebro relativamente grande con un suministro de sangre y una respuesta inmunológica similar a los de los humanos, también se ha utilizado como modelo animal para experimentos de trasplante alogénico51,52,53,54. A pesar de que la retina de los minipigs no posee una mácula y fóvea de tipo humano, contiene el área central y las rayas visuales, que son regiones de la retina con una alta concentración de fotorreceptores de cono30. El tamaño similar al ojo humano, la presencia de una retina central enriquecida con conos, el sistema inmune bien descrito y la presencia de métodos para evaluar la morfología y la función después de la cirugía son argumentos importantes para el uso de este modelo animal grande en el estudio presentado.
Procedimiento quirúrgico
Hasta donde sabemos, no existen técnicas quirúrgicas estandarizadas y ampliamente aceptadas para el trasplante vitreorretiniano de células EPR en portadores. Uno de los problemas clave de la terapia de reemplazo celular es la técnica quirúrgica desafiante que tiene un riesgo de complicaciones intraoperatorias y postoperatorias relacionadas con el desprendimiento de retina, hipotonía, sangrado epiescleral, coroideo y / o retiniano, y alta turbulencia intraocular, que puede conducir a daños en el andamio. En el postoperatorio, existe riesgo de vitreorretinopatía proliferativa, endoftalmitis, hipotonía, desprendimiento de retina y formación de cataratas 4,10,13,14,15.
Los primeros estudios sobre aproximaciones con portadores celulares fueron realizados en conejos bastardos chinchilla13,16,25. A pesar de que estos animales representan un modelo animal pequeño, los resultados centrados en los aspectos técnicos de la cirugía fueron cruciales en el desarrollo de los procedimientos en modelos animales grandes y, por lo tanto, se resumen a continuación.
Inicialmente se utilizó una cánula de infusión de 23 G hecha a medida con dos puertos laterales para redirigir la corriente en chorro, lo que ayudó a resolver el colapso de la ampolla y el consecuente desprendimiento de retina13. En el presente estudio, no notamos tal colapso de la ampolla. La posible razón de esto podría ser el mayor tamaño del globo ocular y el rendimiento de la vitrectomía central con vítreo preservado en la periferia en el sitio de infusión de la cánula, lo que podría reducir la fuerza de la corriente en chorro dirigida.
Las dificultades durante la eyección del portador celular del instrumento fueron otro obstáculo intraoperatorio en los modelos de animales pequeños, que fueron categorizados como "atrapados con el instrumento". Además, los autores sugirieron que el vítreo residual en la superficie de la retina podría causar un "salto" hacia atrás del portador fuera del orificio de la retinotomía después de la implantación. Este problema se puede resolver con una vitrectomía asistida por enzimas, que permite una expulsión suave y continua del portador celular en el espacio subretiniano. En la mayoría de los casos, los autores reposicionaron al portador para obtener una ubicación más distante del implante lejos de la retinotomía. En nuestra serie de casos, también experimentamos una situación en la que el portador celular permaneció unido a la punta del inyector. Sin embargo, eso se logró mediante una manipulación lenta y suave del tubo de luz y la punta del inyector. No observamos ningún vítreo residual en el sitio de la retinotomía en ninguno de nuestros casos. El uso de VPP asistido por AATT en las cirugías se puede sugerir como un método para reducir el riesgo de vítreo adherido residualmente. Puede ser necesaria una tinción múltiple con TA para eliminar completamente el vítreo suprayacente.
En un estudio diferente, los resultados de la implantación subretiniana de células madre del EPR humano cultivadas como una monocapa celular polarizada en una membrana de poliéster fueron reportados24. Durante los experimentos, se utilizó la misma técnica quirúrgica descrita anteriormente13, pero se aplicó un enfoque PPV de dos puertos. Finalmente, posteriormente se publicó un protocolo paso a paso para la implantación subretiniana de cirugía de portadores celulares en conejos25. Este estudio presenta una descripción muy detallada y fácilmente repetible del procedimiento quirúrgico, incluyendo la atención preoperatoria y postoperatoria, que también se basan en la experiencia previa.
Durante el uso de modelos animales grandes en estudios posteriores, no solo se abordaron cuestiones técnicas, sino también preguntas relacionadas con la reacción inmune a las células trasplantadas, así como cuestiones relacionadas con el tamaño del portador celular. Un estudio con monos cynomolgus (Macaca fascicularis) describió los resultados de la implantación subretiniana de monocapas de EPR derivadas de células madre humanas15. Todos los animales se sometieron a inmunosupresión sistémica, que consistió en sirolimus (dosis de carga de 2 mg, dosis diaria de 1 mg) y tetraciclina (7,5 mg/kg- PC) comenzando 7 días antes de la cirugía y durando 3 meses después de la cirugía. El procedimiento quirúrgico fue realizado de acuerdo con los protocolos descritos anteriormente24,25. Los autores utilizaron un enfoque PPV de tres puertos 25 G con endo-iluminación de araña. Es importante destacar que se utilizó una PVD asistida por AATT para excluir la adhesión vitreorretiniana residual en la retina posterior. Como una adición al procedimiento descrito originalmente, los autores eliminaron la capa de RPE del huésped en el área de implantación futura utilizando un instrumento de bucle extensible hecho a medida de 20 G.
En nuestro estudio de minipigs, también utilizamos inmunosupresión sistémica. Sin embargo, el tipo de inmunosupresión difería del descrito anteriormente. Administramos una inyección subcutánea de microesferas poliméricas liberadoras de tacrolimus como depósito a una dosis de 0,25 mg/kg de peso corporal para dificultar el rechazo del injerto celular y las reacciones inflamatorias. No eliminamos la capa de células EPR huésped durante la cirugía, ya que nuestro objetivo principal era analizar la seguridad del procedimiento y la viabilidad de las células implantadas, pero no su integración en la retina del huésped.
Previamente, se evaluó la seguridad y viabilidad de la implantación subretiniana de una monocapa de EPR derivados de hESC en una membrana submicrónica de parileno-C plegable no degradable soportada por malla (6.25 mm x 3.5 mm, 0.4 μm de espesor) en 14 minicerdos hembras de Yucatán10. Después del cultivo, las células se sembraron en una membrana soportada por malla. La inmunosupresión se realizó mediante la administración sistémica de tacrolimus (sin régimen y dosis indicadas) e inyecciones intravítreas de 0,7 mg de un implante de dexametasona al final de la cirugía. El VPP se realizó con un enfoque de 20 G. Los autores utilizaron una inyección intravítrea de acetónido de triamcinolona para una mejor visualización del cuerpo vítreo. La esclerotomía grande fue de 2 mm a 3 mm de tamaño. Después de la inyección subretiniana, la retina se aplanó con una inyección temporal de líquido de perfluorocarbono. Después del intercambio fluido-aire, se realizó un taponamiento de aceite de silicona (1.000/5.000 cSt). El cuidado postoperatorio incluyó la aplicación ocular de pomada de dexametasona/neomicina/polimixina B 1 semana después de la cirugía. Los autores informaron una tasa de éxito del 91% (es decir, implantación subretiniana eficiente y suficientes datos de imágenes postoperatorias). En nuestro estudio, la inyección intravítrea de cristales de TA se utilizó intraoperatoriamente y principalmente para visualizar el cuerpo vítreo. Sin embargo, la acción inmunosupresora local de este fármaco sigue sin estar clara. Los portadores de células nanofibrosas utilizados en nuestro estudio fueron de 5,2 mm x 2,1 mm y 3,7 μm de espesor, con tamaños de poro de 0,4 μm. Durante la cirugía, realizamos FAX directo en lugar de inyectar líquido de perfluorocarbono. Nuestra tasa de éxito quirúrgico (93,1%) fue consistente y ligeramente mejor que la de Koss et al.10.
El trasplante subretiniano de portadores de células totalmente degradables (andamio) para implantación subretiniana se estudió por primera vez en 2019 en cerdos de Yorkshire14. El estudio se centró principalmente en las características biodegradables de los implantes de hidrogel de fibrina. Los autores señalaron que la inmunosupresión agresiva utilizada en los cerdos domésticos podría inhibir una reacción inflamatoria local potencialmente causada durante la biodegradación de los implantes de hidrogel de fibrina. Sin embargo, no especificaron la terapia inmunosupresora utilizada en los cerdos. Durante la VPP, realizaron una esclerotomía de 3,6 mm de longitud para la inserción del dispositivo de implantación subretiniana paralelo y aproximadamente 3,5 mm posterior al limbo. Además, utilizaron un sistema de inyección neumático con el objetivo de reducir la inestabilidad de la colocación de la mano causada por la manipulación de los dedos. En nuestra serie de casos, todas las esclerotomías fueron de 2,5 mm a 3,0 mm del limbo. La esclerotomía grande para la inserción del inyector fue de 3 mm de largo. El inyector de implantación utilizado en nuestro estudio fue operado a mano. La cauterización completa de la pars plana del cuerpo ciliar y un corte suficiente dentro de la esclerotomía grande parecen ser cruciales para evitar complicaciones intraoperatorias como el desprendimiento de retina periférica iatrogénica, el sangrado y la pérdida del implante.
En resumen, describimos el uso del modelo de minicerdo de Liběchov para el trasplante de células del EPR en portadores biodegradables como una opción de tratamiento para enfermedades retinianas hereditarias y adquiridas. Las similitudes en la anatomía y fisiología ocular, así como con respecto al sistema inmunológico, nos permiten desarrollar y mejorar las técnicas quirúrgicas y la instrumentación para la implantación subretiniana de células, que pueden transferirse fácilmente al tratamiento de trastornos oculares humanos. Es importante asegurarse de que las cirugías en minicerdos se realicen utilizando la misma instrumentación (incluidas las herramientas de administración de implantación) cuando se utilizan en cirugías humanas, facilitando así la aplicación de la experiencia y los conocimientos adquiridos a los humanos. Los modelos alternativos de animales de ojo grande con presencia de un área macular, como los primates no humanos, podrían ser útiles para el seguimiento y análisis de los cambios anatómicos y funcionales después de la implantación subretiniana en el área central de la retina. La descripción detallada de los procedimientos de atención preoperatoria, quirúrgica y postoperatoria será útil para estudios futuros al aumentar la generación de datos eficiente y estandarizada.
Disclosures
Ninguno.
Acknowledgements
El proyecto fue apoyado por la Fundación Checa para la Ciencia (número de proyecto 18-04393S) y la Agencia Noruega de Subvenciones y Tecnología de la República Checa (Programa KAPPA, número de proyecto TO01000107).
Materials
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
References
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved