Minipiglerde RPE'nin taşıyıcı üzerine subretinal implantasyonu: Preoperatif preparatlar, cerrahi teknikler ve postoperatif bakım için kılavuzlar
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Retina pigmentli epitelin (RPE) subretinal implantasyonu, dejeneratif retina hastalıklarının tedavisinde en umut verici yaklaşımlardan biridir. Bununla birlikte, büyük gözlü hayvan modelleri üzerinde yapılan klinik öncesi çalışmaların performansı zorlu olmaya devam etmektedir. Bu yazıda RPE'nin bir hücre taşıyıcısı üzerinde minidomuzlara subretinal transplantasyonu için kılavuzlar sunulmaktadır.
Özet
Retinanın dejeneratif bozuklukları (yaşa bağlı makula dejenerasyonu dahil), esas olarak retina pigmentli epitel (RPE) tabakasında veya içinde ortaya çıkan, retina anatomisinin ilerleyici bir şekilde bozulmasına ve görme fonksiyonunun bozulmasına neden olur. Hasarlı RPE hücrelerinin (RPE'ler) bir subretinal hücre taşıyıcısı kullanılarak in vitro kültürlü RPE hücreleri ile ikame edilmesi, dış retinal tabakaların anatomik yapısını yeniden kurma potansiyeli göstermiştir ve bu nedenle daha fazla çalışılmaktadır. Burada, ekili RPE'lere sahip bir hücre taşıyıcısının minidomuzlara etkili subretinal transplantasyonunu sağlayan cerrahi bir tekniğin prensiplerini sunuyoruz. Ameliyatlar genel anestezi altında gerçekleştirildi ve standart lens koruyucu üç portlu pars plana vitrektomi (PPV), dengeli bir tuz çözeltisinin (BSS) subretinal uygulaması, 2.7 mm retinotomi, nanofibröz hücre taşıyıcısının ek bir 3.0 mm sklerotomi yoluyla subretinal boşluğa implantasyonu, sıvı-hava değişimi (FAX), silikon yağı tamponadı ve tüm sklerotominin kapatılmasını içeriyordu. Bu cerrahi yaklaşım son 8 yılda 29 ameliyatta (18 hayvanda) %93,1 başarı oranı ile uygulanmıştır. Cerrahi yerleşimin anatomik doğrulaması in vivo fundus görüntüleme (fundus fotoğrafçılığı ve optik koherens tomografi) kullanılarak yapıldı. Minipig gözlerde RPE'lerin taşıyıcı üzerine subretinal implantasyonu için önerilen cerrahi adımlar, büyük gözlü hayvan modelleri kullanılarak gelecekteki preklinik çalışmalarda kullanılabilir.
Giriş
Yaşa bağlı makula dejenerasyonu (YBMD), gelişmiş ülkelerde santral görme kaybının ana nedeni olarak kabul edilir ve retinal pigmente epitel (RPE) disfonksiyonu ile ilişkili birçok durumdan biridir 1,2. RPE, bazal olarak yerleştirilmiş Bruch zarında (BM) bulunur ve fotoreseptörler için gerekli bakımı sağlar. RPE tabakasının ilerleyici dejenerasyonu, AMD'nin erken atrofik formunun bir işaretidir ve aynı zamanda AMD'nin geç eksüdatif formunun gelişimine de eşlik eder. Retina hastalığı tedavisindeki birçok ilerlemeye rağmen, etkin bir tedavi yönteminin geliştirilmesi hala zor olmaya devametmektedir 3. Umut verici yöntemlerden biri, in vitro kültürlü RPE tabakası kullanılarak RPE replasmanıdır. Bu tedavi, insan embriyonik kök hücre kaynaklı RPE (hESC-RPE) ve indüklenmiş pluripotent kök hücre kaynaklı RPE (iPSC-RPE) kullanılarak kök hücre araştırmalarındaki ilerlemelerle ilişkilidir3,4,5,6,7. Son yıllarda, birçok araştırma grubu, başlangıçta kabul edilenkavram kanıtı 8,9,10,11,12,13,14,15 ile RPE replasmanı için farklı yaklaşımlar geliştirmeye odaklanmıştır. RPE hücreleri (RPE'ler) genellikle bir hücre süspansiyonu, kendi kendini destekleyen bir hücre tabakası veya yapay bir taşıyıcı 3,16,17,18,19,20,21 tarafından desteklenen bir hücre tek katmanı şeklinde subretinal boşluğa verilir. Bir hücre süspansiyonunun enjeksiyonu en kolay yöntemdir, ancak BM'nin tehlikeye giren durumu genellikle nakledilen hücrelerin bağlanmasını önleyebilir. Bu, RPE'lerin yanlış apikobazal oryantasyonuna ve tek katmanlı bir22,23 oluşturamamasına neden olabilir. Diğer iki yöntemin (yani, kendi kendini destekleyen bir hücre tabakası ve yapay bir substrat tarafından desteklenen bir hücre tek katmanlı) temel avantajı, hücrelerin doğrudan subretinal boşluk24'e implante edildiğinde zaten farklılaşmış bir tek katmanlı durumda olmasıdır.
Hücre taşıyıcılarının subretinal boşluğa verilmesini tanımlayan birçok cerrahi teknik son yıllardayayınlanmıştır 8,9,10,11,12,13,14,15. Bu çalışmalar, büyük gözlü hayvan modellerinin kullanımını, hücresel taşıyıcıların tiplerini, nakledilen hücresel kültürlerin kullanımını, implantasyon aletlerini ve cerrahi teknikleri tanımlamış ve yazarlar esas olarak subretinal implantasyonun sonuçlarına odaklanmıştır. 2015 yılında Popelka ve ark., RPE'lerin domuz kadavra gözlerine nakli için çerçeve destekli ultra ince elektrospun polimer membran kullanıldığını bildirmiştir8. Burada hücre taşıyıcısının subretinal implantasyonu ile tarif edilen cerrahi teknik, taşıyıcının nispeten hassas bir şekilde ele alınmasını ve iskelenin subretinal boşlukta kolay konumlandırılmasını sağlamıştır. Kozak ve ark., domuz gözünde yaklaşık 2 mm x 5 mm boyutlarında bir taşıyıcının doğum tekniğinin fizibilitesini değerlendirmişlerdir9. Hücre taşıyıcısının benzersiz tasarımı, hücresel tek katmanın katlanmasını ve buruşmasını önleyerek doğru şekilde yerleştirilmesine izin verdi6. Al-Nawaiseh ve ark. ilk olarak tavşanlarda subretinal iskele implantasyonu için ayrıntılı adım adım kılavuzlar sunmuşlardır25. Stanzel ve ark. daha sonra 2019'da küçük kemirgenlerde, tavşanlarda, domuzlarda ve insan olmayan primatlarda transplantasyon için benzer bir protokol yayınladılar26. Daha önce de yayınlandığı gibi, farklılaşmış ve polarize bir RPE tek katmanının katı bir taşıyıcı üzerine transplantasyonu, diğer dağıtım tekniklerine kıyasla sağkalımın iyileşmesi ve greftin daha iyi entegrasyonu ile sonuçlanmıştır (Ek Dosya 1)27.
İn vivo olarak yapılan herhangi bir preklinik hayvan çalışmasının amacı, prosedür güvenliğine, nakledilen hücrelerin sağkalımına, subretinal manevralara doku yanıtına ve kısa ve uzun vadeli postoperatif sonuçlara odaklanarak bir hücre taşıyıcısının cerrahi transvitreal subretinal implantasyonunun çeşitli yönlerini ortaya koymaktır. Domuz gözlerinin büyük gözlü bir hayvan modeli olarak kullanılmasının, elde edilen verilerin kapsamı açısından alakalı olduğu bildirilmiştir, bu da insanlar için yararlı ve potansiyel olarak uygulanabilir olabilir10,11,14. Çalışmamızda, büyük gözlü bir hayvan modelinde bir hücre taşıyıcısının in vivo subretinal implantasyonu için kullanılan cerrahi teknik bildirilmiştir. Bu yazıda preoperatif preparatların, subretinal hücre taşıyıcı implantasyonunun cerrahi tekniğinin ve minipig gözlerin postoperatif bakımının son 8 yıldaki tecrübelerimize dayanarak detaylı bir tanımı sunulmuştur. Farklı hücre tiplerinin ve hücre taşıyıcılarının implantasyonunu içeren in vivo deneysel çalışmalar için kullanılabilecek temel cerrahi prensipleri tanımladık.
Büyük hayvan modeli
Liběchov minipiglerinin deneysel sürüsü, 1967'de ABD'den Hormel suşundan beş hayvan ithal edilerek kuruldu. Bu hayvanlar, domuz kan grubu çalışmaları için diğer birkaç cins veya suşla melezleştirildi: Landrace, Büyük Beyaz, Cornwall, Vietnam domuzları ve Göttingen kökenli minyatür domuzlar28,29. 5 aylıkken ve yaklaşık 20 kg vücut ağırlığında (BW), minipigler cinsel olgunluğa ulaşır. Ebeveyn minipig ırklarının (Hormel ve Göttingen) hayatta kalma süresinin 12-20 yıl olduğu bildirilmektedir. Hücre taşıyıcısının subretinal implantasyonu, retinanın orta kısmını hedefler. Minipiglerin retinasında makula ve fovea yoktur. Bununla birlikte, alan centralis adı verilen yüksek konsantrasyonlu koni fotoreseptörlerinin bölgelerine ve30,31 görsel çizgilere sahiptir. Bu bölgeler en yüksek görme keskinliğinden sorumludur.
Ameliyatlar, deneyimli bir cerrahi tesis asistanının (TA) yardımıyla dört deneyimli vitreoretinal cerrah tarafından gerçekleştirildi. İn vivo deneylerden önce, cerrahlar eğitildi ve lensin vitreus hacmine daha düşük oranı, daha kısa eksenel uzunluk (15-19 mm), korneada Bowman zarının yokluğu, daha küçük vitreus hacmi (2.8-3.2 mL), makula ve foveanın yokluğu gibi minipig göz anatomisi hakkında özel bilgi edindiler. Zinn anulusunun yokluğu ve optik disk çapı (dikey/yatay: 1,5 mm/2,1 mm). Tüm vakalarda ameliyat, standart aseptik ve antiseptik önlemlerin uygulanmasıyla özel olarak organize edilmiş bir ameliyathanede genel anestezi altında gerçekleştirildi.
Protokol
Bu çalışma, Helsinki Deklarasyonu Kılavuz İlkeleri'nin ilkelerine ve insan denekleri içeren tıbbi araştırmalar için etik ilkelere bağlıdır. Tüm deneyler, Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzuna ve hayvanların oftalmik ve görsel araştırmalarda kullanılması için Görme ve Oftalmoloji Araştırma Derneği'ne (ARVO) göre gerçekleştirilmiştir. Çalışma protokolü, Çek Bilimler Akademisi Hayvan Fizyolojisi ve Genetiği Enstitüsü'nde (Liběchov, Çek Cumhuriyeti) Hayvanlar Üzerinde Deney Projelerinin Onaylanması için CAS Resort Profesyonel Komisyonu tarafından onaylanmıştır (Onaylanmış protokol No. 60/2016 ve No. 64/2019).
1. Bir taşıyıcı üzerindeki hücrelerin minipiglere subretinal transplantasyonu sırasında dikkat edilmesi gerekenler
- Hayvan seçimi
- 12-36 aylık, cinsiyetten ve yaklaşık 40-80 kg vücut ağırlığından (BW) oluşan Liběchov minipiglerini edinin ve kullanın.
- Mini domuzları 18-22 ° C arasındaki sıcaklıklara, yapay 13 saat / 11 saat ışık / karanlık döngüsüne maruz kalmaya, standartlaştırılmış bireysel kalemlere, suya serbest erişime ve günde iki kez beslenmeye sahip klimalı bir hayvan evinde iç mekanda tutun.
- Ameliyat öncesi hazırlık
- Gözün cerrahi yönünü kontrol edin ve fundus şemalarını çizin. Bunu yapmak için, dikey çizgili bir kalem kullanarak fundus çizimindeki minipiglerin retinasını şematik olarak temporal (optik diskten kulağa doğru), nazal (optik diskten domuzun burnuna doğru) ve merkezi (burun tarafındaki ana retinal damarlar arasında) bölgelere bölün (Şekil 1A, B).
- Herhangi bir davranışsal ve nörolojik patolojisi olmayan ve cildin normal kalitesine, vücut deliklerine, dışkıya ve yiyecek tüketimine sahip sadece sağlıklı hayvanları seçin. Yetenekli bir veterinerin klinik gözlemi yapmasını ve hayvanları seçmesini sağlayın.
- Ameliyat günü kas içine 3 mg/kg BW seftiofur hidroklorür (1 mL/kg) enjekte edin.
- Preoperatif immünsüpresyon
- Wang ve ark. ve Sevc ve ark. 32,33'te tarif edildiği gibi takrolimus salınımlı polimer mikrosferleri modifikasyonla hazırlayın.
- Polimer mikrosferlerdeki takrolimus konsantrasyonunun HPLC (Malzeme Tablosu) tarafından belirlenen 51.3 mg / g olduğundan emin olun.
- Hücre grefti reddini engellemek için göz ameliyatından 6 gün önce 0.25 mg / kg BW dozunda takrolimus yüklü polimer mikrosferlerin deri altı enjeksiyonunu gerçekleştirin. Bu, minipig gözlerine ksenojeneik transplantasyon sırasında insan RPE donör hücrelerinin hayatta kalmasını sağlamak için yapılır.
- Ameliyat günü vücut ağırlığına göre 1 mL/10 kg'da 80 mg depo-medrol ve benzilpenisilin ile hayvanlara kas içinden enjekte edin.
- Anestezi
- Ameliyattan önce tiletamin (2 mg / kg), zolazepam (2 mg / kg), ketamin (2 mg / kg) ve ksilazin (0.4 mg / kg) -TKX34,35 karışımının kas içi enjeksiyonu ile genel anestezi indükleyin. Anestezinin derinliğini bilinçsizlik durumu ile ve pedal refleksini (arka bacağın interdigital derisinin bir tutam tutam), kornea refleksini (korneanın hafif bir dokunuşu), pupilla refleksini (ışığa tepki) ve palpebral refleksi (göz kapağına bir dokunuş) kontrol ederek kontrol edin. Hayvanın göz kırpmadığından emin olun. Kalp ve solunum hızı düzenliliğini onaylayın.
- Anestezi indüksiyonundan sonra, sedatif hayvanı bir asansör arabası ile ameliyathaneye taşıyın (Şekil 2A).
- Sağ gözde ameliyat yapılabilmesi için hayvanı sol tarafındaki ameliyat masasına yerleştirin (Şekil 2B).
- İmplantasyon için merkezi retinanın en uygun pozisyonunu elde etmek için strafor pedler kullanarak hayvanın kafasının ayarlanmasını gerçekleştirin (yani, yatay ve zemine paralel) (Şekil 2C).
- Lokal anesteziyi indüklemek için %0.5 proparakain hidroklorür oftalmik solüsyonundaki göz damlalarını konjonktiva kesesine 1 dakika arayla üç kez yerleştirin.
- Bir damar kanülü yerleştirin ve bir hasta monitörü ile donatılmış bir anestezi makinesi kullanarak anestezinin inhalasyon bakımı için hayvanı bir endotrakeal tüp ile entübe edin (% 1.5 izofluran) (Şekil 2A, B).
- Göz ameliyatının başlamasından yaklaşık 15 dakika önce 16 kg BW başına 1 mL Eficur ve 20 mg Depo-Medrol 1 kas içi enjeksiyonu uygulayın (Malzeme Tablosu).
- Hayvanı izotermal folyo ile kaplayarak fizyolojik vücut ısısını koruyun ve ameliyatı bölüm 3'te açıklandığı gibi gerçekleştirin.
- Ameliyat sırasında, bir kulak klipsi ve hasta monitörü kullanarak hayvanın sıcaklığını kalp atış hızı ve kan oksijen doygunluğu ile birlikte izleyin. İşlemler sırasında vücut ısısının 38 ° C'nin altına düşürülmesinden kaçının, bu da güvenli bir sınır olarak kabul edilir36. Tüm deney boyunca oksijen doygunluğunu (% >96) ve nabız hızını (dakikada 70-90 atım) koruyun.
- Ameliyat tamamlandığında, izofluran akışını kapatın ve hayvanı ekstübe edin.
- Kendiliğinden nefes alıp verdikten ve uyandıktan sonra, hayvanları kalemlerine aktarın.
- Ameliyathane kurulumu
- Ameliyathaneyi büyük gözlü hayvan modelinin gözlerinde ameliyatın ihtiyaçlarına göre düzenleyin (Şekil 3A, B). Domuzun burnunun pozisyonuna göre cerrahlar için rahat bir pozisyon elde etmek için cerrahın sandalyelerinin yüksekliğini ve mikroskopun yüksekliğini ayarlayın.
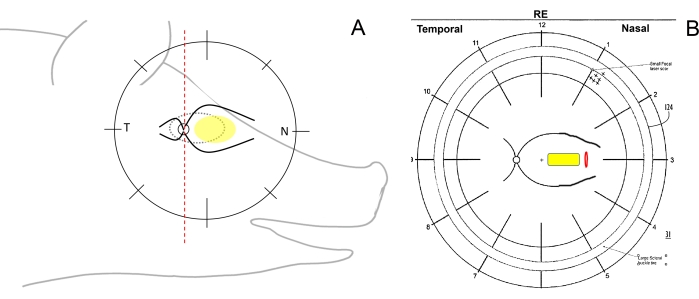
Resim 1: Minidomuzlarda retina bölgelerinin şematik çizimi. (A) Retina bölgelerinin minipig'in kafasına göre şematik çizimi; sarı elips subretinal implantasyonun istenen alanını, T temporal retinal alanı ve N nazal retinal alanı ifade eder. (B) Retinotomi (kırmızı) yoluyla hücre taşıyıcısının (sarı) subretinal implantasyonundan sonra fundus şeması örneği. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
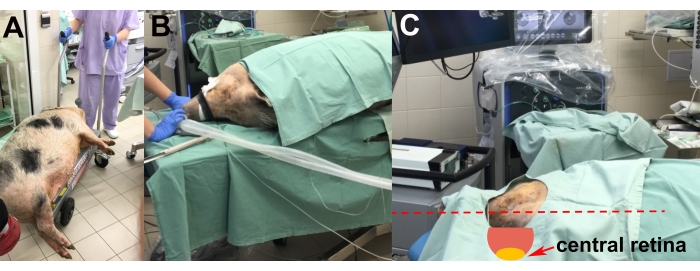
Şekil 2: Hayvanın taşınması ve yerleştirilmesi . (A) Yatıştırılmış hayvanın ameliyathaneye taşınması. (B) Entübasyon sırasında hayvanın yerleştirilmesi. (C) Ameliyat sırasında merkezi retinaya optimum erişim için hayvanın başının ayarlanması (kırmızı ok). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
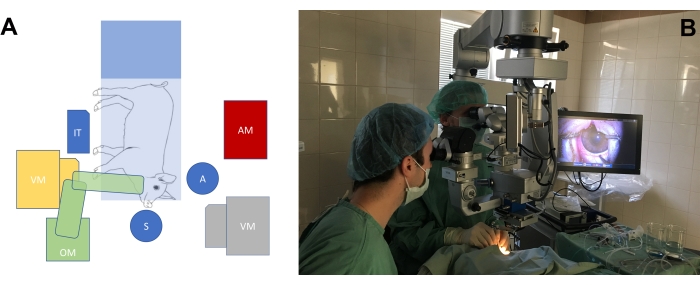
Şekil 3: Standart ameliyathane kurulumu . (A) Cerrahların pozisyonunun (S = cerrah, A = asistan) minipig, ameliyat mikroskobu (OM), vitrektomi makinesi (VM), enstrümantal masa (IT) ve anesteziyoloji makinesi () ile ameliyat masasının pozisyonuna göre şematik gösterimi. Vitrektomi makinesinin iki olası pozisyonu vardır (sarı ve gri). (B) Ameliyathanede gerçek hayat ortamı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. Hücre taşıyıcı, ekili hücre kültürleri ve implantasyon enjektörü
- Hücre taşıyıcı
- Dış boyutları 1,7 mm x 4,8 mm olan, çerçeve üzerinde asimetrik olarak yerleştirilmiş üçgen çıkıntılarla donatılmış 30 μm genişliğindeki oval çerçeveyi (Şekil 4A), femtosaniye lazer kullanarak çift eksenli yönelimli 36 μm kalınlığında poli-etilen-tereftalat (PET) folyodan kesin.
- Poli(L-laktid-co-DL-laktid) (LLA/DLLA 90/10, MW 868, 270 g/mol) polimer çözeltisini, 1 g çözelti başına 2.2 μL formik asit ilavesi ile ağırlıkça% 11'lik bir konsantrasyonda piridin içinde hazırlayın.
- Nanofibröz membranı, polimer çözeltisinin elektrospinning ile üç adımda 8: (1) nanoliflerin ilk katmanını bir silikon substrat üzerine biriktirin, (2) çerçeveyi tabakaya yerleştirin ve (3) ikinci nanofiber katmanını biriktirin.
NOT: Toplam 3,7 μm membran kalınlığına ulaşmak için her katmanı 7 dakika bekletin. 380 nm kalınlığında liflerden oluşan ve ortalama gözenek boyutu 0,4 μm ve gözenekliliği yaklaşık %70 olanaklılığı olan bir membran elde etmek için aşağıdaki parametreleri kullanın37: 20 G tamamen çelik iğne, 7,1 kV voltaj, 10 cm boşluk, 250 μL / dak akış hızı ve 25,0 °C ± 0,5 °C sıcaklık. - Gömülü çerçeveye sahip zarı silikon substrattan dikkatlice çıkarın ve hücrelerin tohumlanmasını ve büyümesini kolaylaştırmak için orijinal zardan yoksun ticari bir 12 kuyucuklu hücre kültürü ekinin gövdesine sabitleyin.
- Bir plazma temizleyicide 70 W'lık bir güçte 30 s boyunca hava plazmasında hücre tohumlamadan önce nanofibröz membranı tedavi edin.
- Hücre taşıyıcısında yetiştirme için kullanılan hücre kültürleri
NOT: Aşağıdaki hücre taşıyıcıları kullanılabilir: 1) herhangi bir hücresiz nanofibröz hücre taşıyıcıları; 2) birincil insan RPE'leri (hRPE'ler) ile nanofibröz hücre taşıyıcıları; 3) İnsan iPSC türevi RPE hücrelerine sahip nanofibröz hücre taşıyıcıları.- Birincil hRPE'lerin kültürlenmesi
- Primer hRPE hücrelerini daha önce bildirilen bir tekniğe göre insan donör gözlerinden izole edin38.
- Retinanın 30 dakika boyunca enzimatik tedavisi ile hücreleri elde edin. Daha sonra,% 10 fetal sığır serumu (FBS) ile desteklenmiş DMEM / F12'de 2 haftaya kadar birincil hRPE hücrelerini (pasaj 0) yetiştirin.
- Hücre kültürleri birleşime ulaştığında, ortamı 30 gün daha boyunca% 1 FBS ve kültüre değiştirin.
- Birincil hRPE'leri trans-kuyu plakalarına ve 2.000 hücre /mm2 yoğunluğunda laminin kaplı nanofibröz hücre taşıyıcısına tohumlayın. % 1 FBS'de 30 günlük bir inkübasyonun ardından, minipiglere subretinal implantasyon için primer hRPE'lere sahip hücre taşıyıcılarını kullanın.
- İnsan iPSC türevi RPE'ler
- CRISPR/Cas9 sistemi (RP1-FiPS4F1-GC2)40 kullanılarak iki alelde gen düzeltmesi yapılan MERTK ilişkili retinitis pigmentosa hasta kaynaklı fibroblastlar39'dan türetilen hiPSC'leri ve kontrol olarak kullanılan sağlıklı bir deneğin fibroblastlarından (Ctrl2-FiPS5F2)41 türetilen hiPSC'leri kullanın.
- Her iki hiPSC hücre çizgisini daha önce bildirildiği gibi RPE hücrelerine (hiPSC-RPE) doğru oluşturun ve daha sonra ayırt edin42.
- HiPSC-RPE'leri, nakavt DMEM, %20 nakavt serumu, 0.1 mM esansiyel olmayan amino asitler, 0.23 mM β-merkaptoetanol, 100 U/mL penisilin, 0.1 mg/mL streptomisin ve 10 mM nikotinamid içeren RPE ortamında oval implantasyon çerçeveleri ile nanofibröz poli(L-laktid-ko-DL-laktid) membranları ile laminin kaplı hücre kültürü ekleri üzerine 200.000 hücre/cm2'de plakalayın.
- Ortamı her geçen gün değiştirin ve polarize büyümeyi teşvik etmek için implantasyondan önce 2 ay boyunca hiPSC-RPE'yi kültüre alın.
- İmplantasyon enjektörü
- OD 1,75 mm/ID 1,10 mm'lik plastik bir tüpten üflemeli kalıplama ile 2,8 mm x 0,8 mm dikdörtgen kesitli plastik bir kılcal damar hazırlayın.
- Plastik kılcal damarda 4 mm x 2,2 mm'lik bir yükleme penceresini uçtan 6 mm kesin.
- Enjektörü plastik kılcal damardan, silikon saptan, çelik bıçaklı pistondan ve pistondan monte edin (Şekil 5A).
- Taşıyıcıyı bir yükleme penceresinden enjektöre yükleyin ve daha sonra adım 3.5.2'de açıklandığı gibi pistonun itmesiyle subretinal boşluğa çıkarın (Şekil 5B).
- Nanofibröz taşıyıcının hazırlanması ve enjektörün yüklenmesi
- Küçük bir plastik Petri kabını 2 mL fosfat tamponlu salin (PBS) ile doldurun. Hazırlanan hücre tabakası ile bir ek parça çıkarın, yarı yumuşak bir polistiren kabın üzerine yerleştirin ve hafif bir mikroskop altında ortalayın. Taşıyıcıyı oval çerçeve boyunca mikroskop kullanarak kesmek için özel olarak modifiye edilmiş bir zımba kullanın. Taşıyıcı boyutları 2 mm x 5 mm olmalıdır.
- Taşıyıcıyı yüklemek için düz şeffaf borulu özel yapım bir enjektör kullanın; Kılcal damarın distal ucundan 6 mm, taşıyıcıyı yüklemek için bir pencere vardır. Enjektörün penceresini PBS ile doldurun.
- Forsepsleri kullanarak, numuneyi kabın altından serbest bırakın, sıvıdan kaldırın ve taşıyıcının üst tarafını yapışkan hücrelerle tespit etmek için önce çerçevedeki yan yönlendirme işaretlerini kontrol ederken enjektörün penceresine taşıyın. Oval bir çerçeve, taşıyıcı ile manipülasyonu kolaylaştırır.
- Bir diş probu (keskin uçlu paslanmaz çelik bir diş aleti) kullanarak, taşıyıcıyı enjektörün penceresine yerleştirin. Taşıyıcıyı enjektörün kapalı ve güvenli üst kısmına itmek için pistonu kullanın. Ardından, taşıyıcıyı ameliyat için hazırlayın.
- Her adımda taşıyıcının yan yönünü kontrol edin. Metal pistonu iterek nanofibröz taşıyıcıyı enjektörden boşaltın.

Resim 4: Gömülü destekleyici PET çerçeveli nanofibröz taşıyıcı . (A) Çerçeve üzerindeki üç görünür işaret, taşıyıcının yan yönünün (beyaz oklar) kontrol edilmesini sağlar. (B) Hücre taşıyıcısının nanofibröz zarına (beyaz oklar) gömülü PET çerçeve parçasının büyütülmüş görünümü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: İmplantasyon enjektörü . (A) Enjektörün parçaları. (B) İmplantasyon enjektörünün plastik dikdörtgen kılcal damarına yüklenen gömülü destekleyici PET çerçeveli nanofibröz hücre taşıyıcısı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Cerrahi prosedür
- Cerrahi ekipman
- Aşağıdaki cerrahi ekipmanı kullanın: bir oftalmik cerrahi mikroskop, ön ve arka göz segmentlerindeki ameliyatlar için bir işletim sistemi, temassız bir vitreoretinal cerrahi sistem, bir lazer fotokoagülasyon cihazı ve bir dijital kamera.
NOT: Vitrektomi, ekzo- ve endo-koter ve lazer fotokoagülasyon ekipmanlarında kullanılan standart parametreler Tablo 1'de gösterilmiştir.
- Aşağıdaki cerrahi ekipmanı kullanın: bir oftalmik cerrahi mikroskop, ön ve arka göz segmentlerindeki ameliyatlar için bir işletim sistemi, temassız bir vitreoretinal cerrahi sistem, bir lazer fotokoagülasyon cihazı ve bir dijital kamera.
- Cerrahi aletler
- Yeniden kullanılabilir cerrahi aletleri, standart bir protokole göre mobil bir otoklav buharlı sterilizatör veya benzeri bir yöntemle sterilize edin. Ameliyat sırasında ihtiyaç duyulan tek kullanımlık cerrahi alet ve malzemeler Malzeme Tablosunda listelenmiştir.
- Cerrahi adımlar için hazırlık
- Hayvanı adım 1.4.1'de tarif edildiği gibi uyuşturduktan sonra, ilaca bağlı midriyazisi provoke etmek için işlemden 15 dakika önce konjonktival kesede% 1 tropikamid çözeltisi göz damlası ve% 10 fenilefrin hidroklorür çözeltisi uygulayın.
- Ameliyat masasına cerrah üst pozisyonda ve asistan yan pozisyonda olacak şekilde yaklaşın (Şekil 3).
- Tek kullanımlık tıraş bıçağı kullanarak göz çevresindeki alanı tıraş edin ve pürüzlü kirleri temizleyin.
- Konjonktiva kesesini 5 dakika boyunca% 5 povidon-iyot çözeltisi ile dezenfekte edin.
- Göz kapaklarından çevreye doğru ovalayarak periorbital bölgeyi pamuklu çubuklarla dezenfekte edin. İşlemi% 10'luk bir povidon-iyot çözeltisi kullanarak üç kez tekrarlayın ve 5 dakika bekletin.
- Yapışkan şeffaf folyo ile standart bir steril oftalmik örtü kullanarak ameliyat alanını ortadaki gözle örtün. Kirpikleri göz küresinden uzaklaştırın. Postoperatif endoftalmi riskini azaltmak için kirpikleri kesmekten kaçının.
- Kapak spekulumunu (Liberman tipi veya Cook eye spekulum) takın. İsteğe bağlı olarak, niktitasyon zarını cilde 8-0 ile sabitleyin poliglactin sütür.
- Cerrahi forseps ve Westcott konjonktival makas kullanarak sklerotomiler için sklerayı ortaya çıkarmak için burun tarafındaki konjonktivayı limbustan 2 mm ila 3 mm arasında açın.
- Üç valfli 25 G trokarları limbustan 2,5-3 mm uzakta pars plana bölgesine yerleştirin (saat 7, saat 10 ve saat 11 pozisyonlarında yerleştirin). Yerleştirme sırasında posterior retinaya doğru hafif eğik bir şekilde (100°-110°) dönen hareketler kullanın ve trokarı forseps ile tutun (Şekil 6).
- Ozmotik kornea ödemini önlemek için korneayı ıslak tutun veya tüm ameliyat boyunca metilselüloz ile kaplayın.
- Pars plana vitrektomi (PPV)
- Standart üç portlu pars plana vitrektomi yaklaşımı ile vitreus gövdesinin orta kısmını çıkarın. Gelecekteki büyük sklerotomi alanında lensin arkasındaki vitreusu dikkatlice çıkarın.
- Kontrollü bir posterior vitreus dekolmanı gerçekleştirmek için genellikle retinaya yapışık kalan posterior vitreusu boyamak için intravitreal 2-4 mg triamsinolon asetonid (TA) enjeksiyonu (50-100 μL) kullanın.
- Bundan sonra, daha merkezi olarak 41 G'lik bir kanül ile 0.05-0.1 mL'lik bir BSS'nin subretinal enjeksiyonunu yavaşça gerçekleştirin ve çevreye doğru bir bleb oluşumunu önleyin.
- Geçici retinal damar tıkanıklığını önlemek için subretinal enjeksiyon sırasında irrigasyon sistemi ile göz içi basınç ayarlarını 15 mmHg'ye kadar düşürün.
- Nazal bleb tabanının 3 mm yakınında 27 G endodiatermi probu ile retinanın lineer büyük endodiatermisini gerçekleştirin.
- Daha sonra, 25 G MVR bıçak veya dikey makas ile 3 mm büyük bir retinotomi yapın, sulama sisteminin yüksek göz içi basıncı (IOP) ayarı ile 3 dakika ila 5 dakika boyunca 60 mmHg'ye kadar yapın. Retinotomiden kanama olmadığından emin olun ve ardından GİB'yi 25 mmHg'ye düşürün.
- Sklera yüzeyine nazik bir dokunuş uygulayarak 27 G endodiatermi probu ile limbustan 2.5-3 mm uzaklıktaki iki nazal trokar arasındaki episkleral damarların ekzodiatermisini gerçekleştirin.
- Sklerotomi büyütmeden önce infüzyon şişesinin sıvı seviyesini kontrol edin, çünkü sklerotomi genişlemesinden sonra sıvı tüketimi geçici olarak yüksektir.
- 2.75 mm'lik bir fako bıçağı kullanarak limbustan 3 mm uzakta 3.0 mm'lik büyük bir skleromi yapın.
- Büyük sklerotomi içindeki skleral damarlardan ve siliyer gövdeden olası kanamalara dikkat edin. Kanama durumunda, hasarlı damarları pıhtılaştırmak için 27 G endodiatermi probu kullanın. Enjektörün ucunu (0,8 mm x 2,8 mm) yerleştirmek için sklerotomiyi saten bıçakla 3,0 mm'ye kadar büyütün.
- Büyük sklerotomi bölgesindeki prolapsus vitreus gövdesini bir vitrektör ile çıkarın. Dünya çökmesini önlemek için BSS infüzyonunu vitrektomi sistemi ile 25-30 mmHg seviyesinde tutun.
- Hücre taşıyıcısının implantasyonu
- Enjektörü baskın elinizle yavaşça büyük skleromi yoluyla vitreus boşluğuna yerleştirin. Direnç durumunda, sklerotominin boyutunu büyütün.
- Hücre taşıyıcısını retinotomi yoluyla subretinal boşluğa implante edin. Gerekirse, implantasyonun kontrolünü iyileştirmek için ek sklerotomi ve avize ışığı ile bimanual bir teknik kullanın.
- Enjektörü gözden çekin ve büyük sklerotomiyi 8-0 ile kapatın göz içi hipotonisi ile ilişkili komplikasyonları önlemek için poliglactin sütür.
- Tam bir sıvı-hava değişimi (FAX) ve subretinal sıvının silikon uçlu bir kanül ile drenajını gerçekleştirin.
- Bundan sonra, IOP normal olana kadar silikon yağı enjeksiyonu için vitrektomi sistemini ve boru sistemini kullanarak vitreus boşluğuna silikon yağı (1.000 cSt) enjekte edin.
- İntraoperatif görüntüleme ve dokümantasyon
- Bir video kayıt sistemi kullanarak implantasyonun önemli adımlarının fotoğraflı dokümantasyonu ile tüm ameliyat boyunca bir video kaydı yapın.
- Sklerotomilerin, retinotomin, subretinal implantın yerini ve fundus çizim şemalarını kullanarak meydana gelen komplikasyonları belgeleyerek fundus çizimini tamamlayın.
- Ameliyat sonrası adımlar
- Ameliyatın sonunda trokarları çıkarın ve üç sklerotomi ile konjonktivayı 8-0 ile kapatın. poliglactin dikişleri.
- Konjonktiva kesesini %5 povidon-iyot çözeltisi ile durulayın.
- 20 mg gentamisin, 2 mg deksametazon ve% 2 ksilokainin 0.3 mL subkonjonktival enjeksiyonunu gerçekleştirin.
- Fundus ve lensin durumunu mikroskobik bir görünüm kullanarak kontrol edin.
- Dikiş(ler)i cerrahi forseps ve Westcott konjonktiva makası (isteğe bağlı) kullanarak niktitasyon membranından çıkarın.
- Konjonktival keseye neomisin merhem veya ofloksasin oftalmik merhem uygulayın.
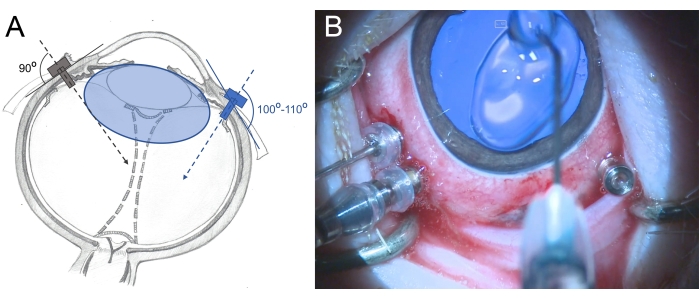
Şekil 6: Trokarların bir minipigin gözüne sokulması . (A) Lensin zarar görmesini önlemek için skleraya insan gözündeki vitreus boşluğunun merkezine doğru dik olarak (gri renk) ve minipig gözündeki arka retinaya doğru eğik bir şekilde (mavi renk) yerleştirilen trokarların şematik tasviri. Minipigin lensi (mavi renkli) insanlardakinden daha büyüktür ve vitreus boşluğu boyutuna göredir. (B) Üç portlu PPV'ye yerleştirilen trokarların intraoperatif görünümü. Kornea kurumayı ve şişmeyi önlemek için metilselüloz ile kaplanmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
4. Postoperatif bakım
- Topikal bacitracin çinko / hidrokortizon asetat / neomisin sülfat veya% 0.3 ofloksasini günde beş kez hayvanların konjonktiva kesesine uygulayın.
- Postoperatif olarak, aşağıdaki göz parametrelerini kontrol edin: palpasyon kullanarak gözün yumuşak dokularının turgoru, göz yüzeyinde enflamatuar reaksiyon ve elde tutulan yarık lamba veya dolaylı oftalmoskop kullanarak göz kapaklarının koruyucu bir reaksiyonu olarak kısma.
- Sistemik postoperatif bakım için aşağıdaki antibiyotikleri kullanın:
- Stabilitenin ikinci ve üçüncü gününde 3 mg / kg BW (1 mL / kg) dozunda kas içi seftiofur hidroklorür enjekte edin.
- Sekonder bakteriyel enfeksiyonun önlenmesi için ameliyattan 72 saat sonra tulatromisin (1 mL/40 kg BW) enjekte edin.
- Ağrıyı önlemek için ameliyattan sonraki 3 gün boyunca her 24 saatte bir kas içi fluniksin (2 mL / 45 kg canlı ağırlık) ve tramadol hidroklorür (100 mg) enjeksiyonu yapın.
- Minipigleri 18-22 ° C sıcaklık aralığına ve yapay 13 saat / 11 saat aydınlık / karanlık rejimine sahip özel bir klimalı tesiste saklayın.
- Suya ve standart beslenmeye (günde iki kez) serbestçe erişebildiklerinden emin olun.
5. Postoperatif işlemler
- Postoperatif oftalmik muayeneler
- Postoperatif dönemde, gözleri inflamasyon varlığı için dolaylı bir oftalmoskopla inceleyin (yani, konjonktival kesede kızarıklık, doku şişmesi veya mukus tıkanıklığı). Palpasyon yöntemini kullanarak ameliyat edilen gözdeki göz içi basıncını ölçün.
- Postoperatif görüntüleme
- Fundus fotoğrafçılığı ve OCT muayenesinden önce kas içine bir TKX karışımının enjeksiyonu ile minipigde sedasyon indükleyin. Midriyazisi indüklemek için minidomuzun konjonktival kesesine % 1 tropikamid ve% 10 fenilefrin hidroklorür göz damlası damlatın.
- Açık gözleri korumak için bir kapak spekulumu kullanın. Göz yüzeyini nemlendirmek ve net bir OCT görüntüsü elde etmek için, hayvanın korneasını her 30-60 saniyede bir tuzlu su çözeltisi (% 0.9 NaCl) ile yıkayın.
- Minipig'i ameliyat masasına operasyon sırasında olduğu gibi yerleştirin (Şekil 2B,C, Şekil 3A). Temel gereksinim, kafayı yana ve OCT cihazının tarama parçasına dik olarak yerleştirmektir. Kafayı stabilize etmek için hayvanın burnunun altında strafor pedler kullanın ve göz yüzeyini yatay konuma getirin.
- Renkli fundus görüntülerini midriatik olmayan renkli bir fundus kamerasıyla toplayın, çünkü bu ön segmenti, retinayı ve optik diski belgelemeye izin verir. Ek olarak, midriatik olmayan fundus kamerası ile retinanın kırmızısız bir görüntüsünü alın.
- Spektral etki alanı OCT sistemini kullanarak optik koherens tomografi görüntülemesi gerçekleştirin. OCT veya fundus görüntüleme sırasında, posterior retinanın görünümünü ve implantasyon alanını optimize etmek için minipig'in kafasını OCT lenslerine veya fundus kamera lenslerine doğru manuel olarak eğin (Şekil 2C). İmplante edilen taşıyıcının fundus üzerinde optimal görüntülenmesi için, implanta odaklanmak üzere OCT cihazının kızılötesi yansıtma ışığını uygulayın (Şekil 2C). OCT çapraz çizgisi ve retina harita tarama modlarını kullanın.
- Muayenenin sonunda ofloksasin oftalmik merhemi hayvanın gözünün kapağının altına uygulayın.
- Minipig'i kapalı tesise taşıyın ve sedasyonun sonuna kadar (yaklaşık 2 saat ila 5 saat) genel durumunu gözlemleyin.
6. Ötanazi sonrası göz sonrası ölümün enükleasyonu
- Minipigleri TKX karışımının intramüsküler enjeksiyonu ile sakinleştirin, ardından intravenöz (22-G kulak kanülü yoluyla) bolus uygulaması,% 1 propofol (20 mL / hayvan) ve ardından ekssanguinasyon uygulayın. Genel fiksatifler kullanmayın.
- Hücre grefti implantasyonundan 7 gün, 14 gün, 28 gün ve 42 gün sonra derin genel anestezi sırasında ekssanguinasyon ile hayvanları kurban edin.
- Üst ve alt göz kapaklarını çıkarmak için forseps ve makas kullanın. Üçüncü göz kapağını yeniden çıkarın ve konjonktivayı kesin. Göz kaslarını ve optik siniri kesin.
- Cerrahi makas ve cerrahi forseps kullanarak ölüm sonrası gözleri enüklee edin. İşlemin deneyimli bir kişi tarafından yapıldığından emin olun.
Sonuçlar
Liběchov minipiglerinde hücre taşıyıcısının subretinal implantasyonunun sonuçları Table 2'de sunulmuştur. Başarılı implantasyon, histolojik ve immünohistokimyasal çalışma için yeterli veri elde edilmesi olarak tanımlandı. Başarısız vakalar, göz dokularının daha fazla gözlemlenmesini imkansız kılan ciddi intraoperatif komplikasyonları olan gözler olarak tanımlandı.
Önerilen tekniğin silikon yağ tamponadı kullanımı ile uygulanması, ameliyattan sonraki ertesi günden başlayarak enükleasyon zamanına kadar görüntüleme yöntemleri kullanılarak subretinal transplantasyonun durumunun kontrol altına alınmasını sağlar (Şekil 7, Şekil 8 ve Şekil 9).
Fundus görüntüleme ve SD-OCT
Minipigler postoperatif dönemde fundus görüntüleme, kırmızısız görüntüleme ve spektral domain optik koherens tomografi kullanılarak incelendi (Şekil 7). Şeffaf lens ve silikon yağı tamponad kullanımı da dahil olmak üzere şeffaf optik medya kullanılarak yüksek kaliteli fundus görüntülemesi sağlandı (Şekil 7A). Retinotomi bölgesi proliferatif reaksiyon belirtisi göstermedi (Şekil 7A, sarı oklar) ve hücre taşıyıcısının PTE çerçevesi domuz retinasının yarı saydam katmanlarından açıkça görülebiliyordu. Kırmızısız görüntülemede, yetiştirilen hRPE'lerin taşıyıcı üzerindeki yansıtıcılığı, endojen domuz RPE tabakasının yansıtıcılığından farklı değildi (Şekil 7B). SD-OCT'de, PTE çerçevesi altta yatan anatomik yapıların sadece küçük gölgelenmesine ve retinanın hafif kalınlaşmasına neden oldu (Şekil 7C, kırmızı oklar). SD-OCT'de atipik hipo veya hiper yansıtıcı bölgeler fark edilmedi ve Bruch'un zarının da hasar görmediği görüldü. Şekil 8'de ameliyattan 1 ay sonra primer insan RPE hücreleri ile yetiştirilen iskelenin fundus ve iOCT görüntüleri sunulmaktadır (Şekil 8). Hücre taşıyıcısının kendisi (herhangi bir hücre olmadan) retina kalınlığında önemli bir artışa neden olmamıştır (Şekil 9C). Bu bulgular, implantın intraoperatif iyatrojenik etkisinin minimal olduğunu ve implante edilen hücre taşıyıcısının, implante edilen hücrelerin üstteki fotoreseptör hücrelere ve nöroretinal dokuya yeterli adaptasyona tabi tutulduğunu göstermektedir.
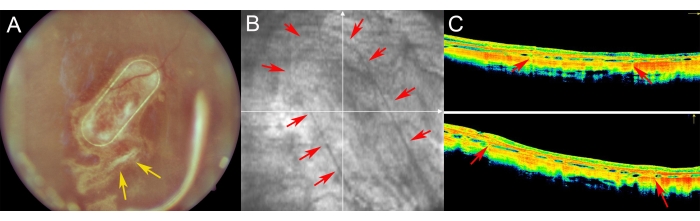
Şekil 7: Minipiglerde retinanın postoperatif görüntülemesi. (A) Fundus görüntüleme, (B) Kırmızısız görüntü ve (C) minipig gözde subretinal transplantasyon sonrası 1 haftalık takipte primer insan RPE hücreleri ile nanofibröz taşıyıcının optik koherens tomografi görüntülemesi. (A) Sarı oklar retinotomi bölgesini gösterir. (B) Kırmızı oklar, nanofibröz hücre taşıyıcısının kenar boşluklarını gösterir. (C) Kırmızı oklar, subretinal boşluğa implante edilen nanofibröz taşıyıcının destekleyici PET çerçevesinin neden olduğu OCT sinyalinin hafif gölgelenmesini gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
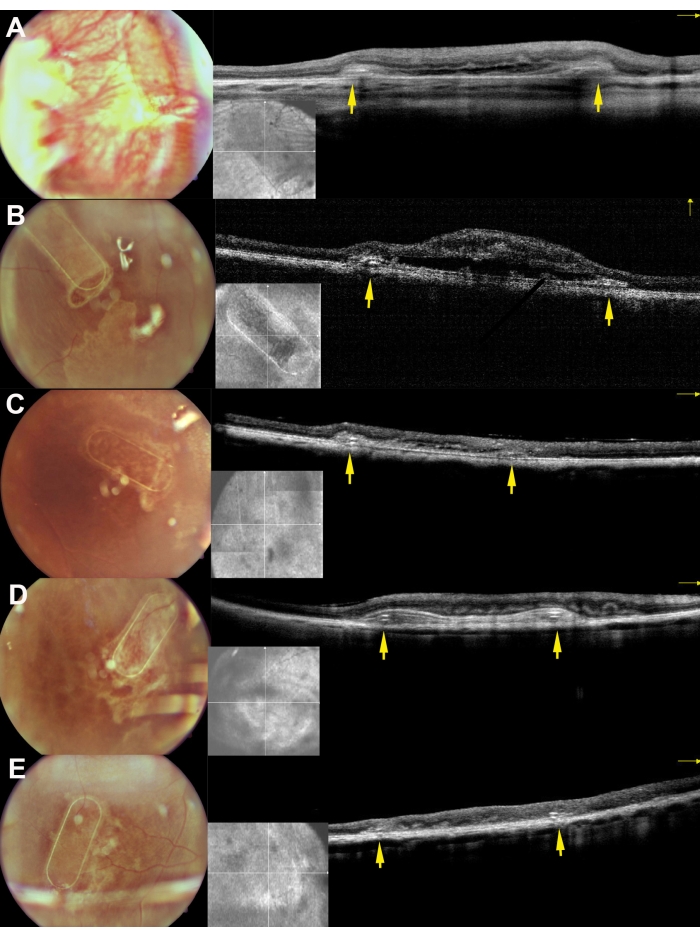
Şekil 8: Minipiglerde subretinal implantasyondan 30 gün sonra iskelelerin fundus görüntüleme ve iOCT görüntüleri. A, B, C, D ve E , sırasıyla 169, 182, 179, 199 ve 224 domuzlarına karşılık gelir. Sarı oklar iskelenin çerçevesini tasvir etmektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Histolojik ve immünohistokimyasal analiz
Hayvanların ötenazisinden sonra, bütün minipig gözleri çıkarıldı ve 24 saat boyunca% 4 paraformaldehit (PFA) içinde sabitlendi. Gözün ön kısmı çıkarıldı ve implante edilen nanofibröz taşıyıcı nazal merkezi retinada tanımlandı ve sklera takılı olarak izole edildi. Tüm dokular derecelendirilmiş sakkaroz çözeltilerinde kriyoproteksiyon uygulandı ve dikey dondurulmuş kesitler ayrıntılı olarak açıklandığı gibi kesildi43. İmplantasyondan 4 hafta sonra RPE hücresi olmayan nanofibröz membranın histolojisinde inflamasyon ve dejeneratif değişiklikler olmaksızın retinalar saptandı (Şekil 9A). Nanofibröz membranın varlığı polarize ışıkta tespit edildi (Şekil 9B).
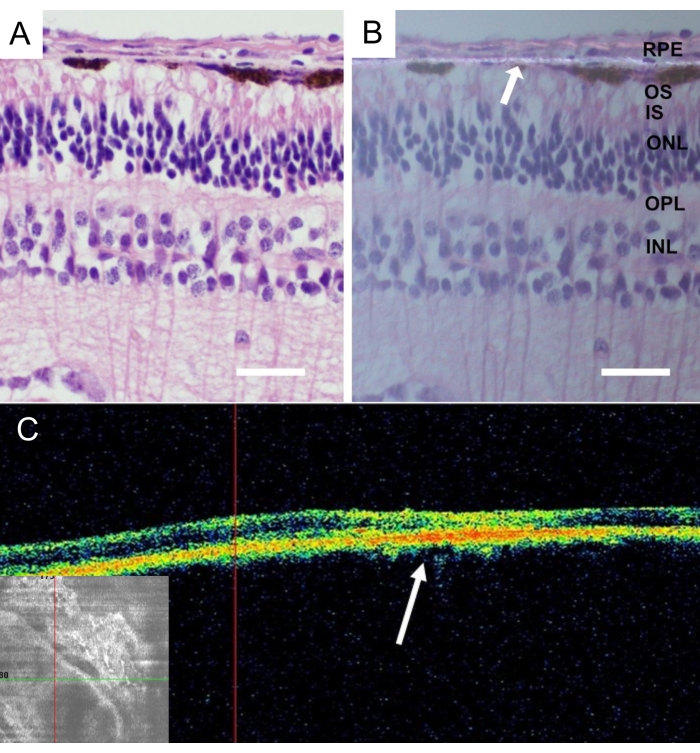
Şekil 9: İmplante edilen asellüler nanofibröz membranın histolojik analizi. İmplantasyondan 4 hafta sonra asellüler nanofibröz membranın hematoksilin-eozin boyanması (A) standart aydınlatma ve (B) polarize ışık mikroskobu ile. Beyaz ok, nanofibröz membran lokalizasyonunu gösterir (ölçek çubuğu: 50 μm). (C) İmplantasyondan 4 hafta sonra asellüler nanofibröz membranın in vivo optik koherens tomografi resimleri, subretinal boşlukta nanofibröz membranın iyi kabul edildiğini ve yapıştığını göstermektedir. Beyaz ok, retinanın kesitsel görüntüsünde implantın yerini gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Şekil 10, minipig gözündeki nanofibröz bir taşıyıcı (sarı ok) üzerine implante edilmiş primer hRPE hücrelerini içeren retina bölgesinin hematoksilin-eozin (H&E) boyamasını göstermektedir. İmplante edilen primer hRPE'lerin pigmentli görünümü sürekli fakat düzensiz pigmentli bir tabaka oluşturmuştur (Şekil 10, kırmızı oklar). Daha uzun gözlem sürelerinden sonra (6 hafta), implantların altındaki nöroretina, muhtemelen iyatrojenik manipülasyonun bir sonucu olarak, retinotomi bölgesi etrafında rozet benzeri veya hipertrofik reaksiyon benzeri bir görünüm gösterdi. Bu morfolojik sonuçlar SD-OCT bulguları ile karşılaştırılabilir ve taşıyıcı doğumun retina dokusu üzerindeki minimal etkisine dair kanıtları desteklemektedir.
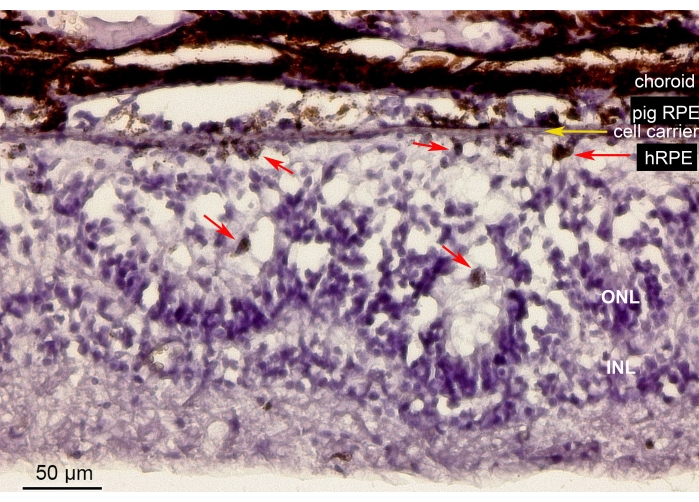
Şekil 10: İmplante edilen nanofibröz membranın primer hRPE'ler ile histolojik analizi. İmplante edilen nanofibröz taşıyıcıyı (sarı ok) içeren retina bölgesinin minipig gözündeki primer hRPE'ler ile hematoksilin-eozin boyaması. Hayvan ötenazi yapıldı ve implantasyondan 6 hafta sonra analiz edildi. Primer hRPE'ler, fotoreseptörlerin karşısındaki subretinal boşlukta boyutları, yuvarlak şekilleri ve pigmentasyonları (kırmızı oklar) ile açıkça ayırt edilebilirdi. ONL'deki fotoreseptör çekirdekleri rozet benzeri yapılar oluşturur. Subretinal boşluk hipertrofik görünür. Kısaltmalar: hRPE = birincil insan retinal pigmentli epitel, ONL = dış nükleer tabaka, INL = iç nükleer tabaka. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
İmmün boyama iki aşamalı dolaylı bir yöntem kullanılarak yapıldı. Kesitler, bir monoklonal primer antikor olan CRALBP'de gece boyunca oda sıcaklığında 1:100'lük bir seyreltmeyle inkübe edildi. İmmünofloresan, Alexa Fluor 488-konjuge sekonder antikor kullanılarak gerçekleştirildi.
İmplante edilen primer hRPE'ler implantasyon alanında mevcuttu ve endojen minipig RPE hücrelerine benzer tipik RPE CRALBP belirtecini ifade ettiler (Şekil 11A). Buna karşılık, implante edilen hücrelerin morfolojisi, implantasyondan sonra tek katmanlı bir şekil almamış, ancak tanımlanmış subretinal boşluk içinde lokalize kalmıştır (Şekil 11A, B, beyaz oklar). Aşağıdaki RPE/retinal belirteçler ve morfolojik görünüm, implantasyon sonrası 6 haftalık dönemden sonra pozitif kalmıştır: pigment/melanin granüllerinin varlığı, çubuk bipolar (PKC-alfa) ve koni fotoreseptörleri (PNA) için son dönem retinal spesifik nöronal belirteçler ve GFAP pozitifliği-mikroglial aktivasyonun bir işareti.
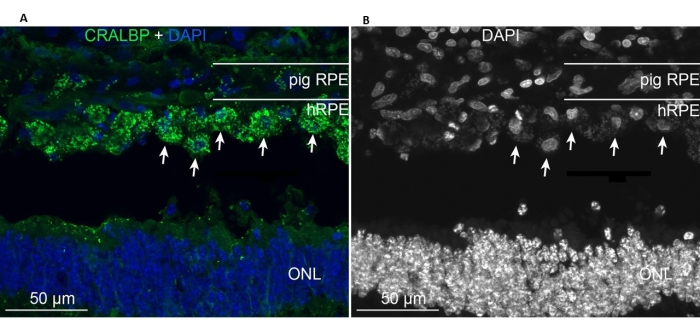
Şekil 11: Primer hRPE'lerin implantasyonundan 6 ay sonra bir minipigde RPE hücre belirteci CRALBP (hücresel retinaldehit bağlayıcı protein) ile immünoetiketleme . (A) Tedavi edilen domuz gözünün dikey dondurulmuş bölümleri CRALBP monoklonal antikoru (yeşil) ile immüno-etiketli ve DAPI (mavi) ile boyanmıştır. (B) DAPI ile etiketlenen hücre çekirdeklerinin siyah beyaz tek tasviri, çünkü yüksek kontrast bireysel hRPE hücrelerinin yuvarlak şeklini ortaya çıkarır (bazıları beyaz oklarla gösterilmiştir). Kısaltmalar: hRPE = insan retinal pigment epiteli, ONL = dış nükleer tabaka. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Oküler komplikasyonlar
Toplamda 29 kişiden 27'si (%93,1) başarılı bir şekilde ameliyat edildi. "Başarılı bir şekilde gerçekleştirilen ameliyatlar" tanımı, ameliyat edilen gözün histolojik ve immünohistokimyasal çalışmayı etkileyebilecek enükleasyon zamanına kadar klinik olarak anlamlı postoperatif komplikasyon göstermediği olgulara uygulandı. Optik ortamın saydamlığının azalması dört olguda postoperatif görüntülemeyi etkilemiştir (%13.7); Bununla birlikte, bu gözler daha ileri histolojik ve immünohistokimyasal analizlerle işlendi.
İntraoperatif periferik retina dekolmanı dört olguda (%13.8) görüldü. İki olguda, sıvı-gaz değişimi sırasında subretinal sıvının aspirasyonu ve retinanın dekolmanı bölgesinde lazer fotokoagülasyonunun uygulanması ile tedavi edildi. Diğer iki olguda (%6.9) retina dekolmanı masif retinal ve subretinal kanama ile ilişkiliydi, bu da hücre taşıyıcısının implantasyonunu imkansız hale getirdi ve ameliyatın sonlandırılmasına ve ameliyat masasındayken minipigin derhal ötenazisine yol açtı.
| Hayır | Parametre | Standart kullanılan ayarlar |
| 1 | Vitrektomi hızı (kesme hızı) | dakikada 20.000 kesime kadar |
| 2 | Venturi pompası | 50-180 mmHg |
| 3 | Yükselme zamanı | 1 saniye |
| 4 | Sulama basıncı | 18-25 mmHg |
| 5 | Hava infüzyon basıncı | 20-25 mmHg |
| 6 | Bipolar ekzodiatermi | 18-26% |
| 7 | Monopolar endodiatermi | 16-18% |
| 8 | Retinanın lazer fotokoagülasyonu, 532 nm | Güç 100-150 mW |
| Aralık 100 ms | ||
| Süre: 100 ms |
Tablo 1: Vitrektomi ve lazer fotokoagülasyon sırasında kullanılan standart parametreler.
| Toplam hayvan, n | 18 |
| Toplam gözler, n | 36 |
| Ameliyat edilen gözler, n | 29 |
| Başarılı implantasyon, n | 27 |
| Başarısız vakalar, n | 2 |
| Ortalama ameliyat süresi, min | 57 |
| Başarı oranı, % | 93.1 |
Tablo 2: 2016 ve 2020 yılları arasında Liběchov minipiglerinde hücre taşıyıcısının subretinal implantasyonu ile standartlaştırılmış cerrahi tekniğin sonuçları.
Ek Dosya 1: RPE hücrelerinin hücre taşıyıcı üzerine subretinal implantasyonuna adanmış çalışmaların özeti. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Farklı kökenlere sahip RPE hücrelerinin subretinal implantasyonu, AMD 3,4,8,9,10,11,12,13,14,15,25 gibi retinal dejeneratif bozuklukların tedavisi için göz araştırmalarında çok umut verici bir eğilimdir . Bu yaklaşımın ana fikri, hasarlı RPE'leri ex vivo kültürlenmiş sağlıklı RPE'lerle değiştirmektir (Ek Dosya 1)44,45,46,47,48. Ekili RPE hücrelerini nakletmek için hücre taşıyıcılarının kullanılması en makul yaklaşımı temsil eder, çünkü gözenekli membranlar polarize RPE hücre tabakasını fotosensör tabakaya göre doğru yönde tutar.
Optimal hayvan modeli
Bu tür tedavi yaklaşımlarının geliştirilmesinde kritik bir adım, optimal hayvan modeli49'un kullanılmasıdır. Geçmişte, tavşanlar, köpekler, domuzlar ve insan olmayanprimatlar 8,9,10,11,12,13,14,15,27,29 dahil olmak üzere küçük ve büyük hayvan modelleri kullanılmıştır. Bu yazıda, Liběchov minipig modelinin kullanımını öneriyoruz ve sağlam transplantasyon etkinliklerini sağlayan preoperatif, cerrahi ve postoperatif adımları tanımlıyoruz. Liběchov minipig aslen yaklaşık 20 yıl önce yetiştirildi ve Parkinson ve Huntington hastalığı29,50 gibi nörodejeneratif hastalıklar alanında biyomedikal araştırmalarda sıklıkla kullanıldı. Domuz, insanlardakine benzer bir kan kaynağı ve immünolojik yanıtı olan nispeten büyük bir beyne sahip olduğundan, allojenik transplantasyon deneyleri için de bir hayvan modeli olarak kullanılmıştır51,52,53,54. Minipiglerin retinası insan benzeri bir makula ve foveaya sahip olmasa da, retinanın yüksek konsantrasyonda koni fotoreseptörleri30 olan bölgeleri olan alan centralis ve görsel çizgileri içerir. İnsan gözüne benzer boyut, koni ile zenginleştirilmiş merkezi retinanın varlığı, iyi tanımlanmış bağışıklık sistemi ve ameliyat sonrası morfolojiyi ve işlevi değerlendirmek için yöntemlerin varlığı, sunulan çalışmada bu büyük hayvan modelinin kullanımı için önemli argümanlardır.
Cerrahi prosedür
Bildiğimiz kadarıyla, taşıyıcılar üzerinde RPE hücrelerinin vitreoretinal transplantasyonu için standartlaştırılmış ve yaygın olarak kabul görmüş cerrahi teknikler bulunmamaktadır. Hücre replasman tedavisinin en önemli konularından biri, retina dekolmanı, hipotoni, episkleral, koroidal ve / veya retina kanaması ve iskele hasarına yol açabilecek yüksek göz içi türbülansı ile bağlantılı intraoperatif ve postoperatif komplikasyon riski taşıyan zorlu cerrahi tekniktir. Postoperatif dönemde proliferatif vitreoretinopati, endoftalmi, hipotoni, retina dekolmanı ve katarakt oluşumu riski 4,10,13,14,15'tir.
Hücre taşıyıcılarını kullanan yaklaşımlarla ilgili ilk çalışmalar çinçilla tavşanlarında 13,16,25 gerçekleştirilmiştir. Bu hayvanlar küçük bir hayvan modelini temsil etse de, ameliyatın teknik yönlerine odaklanan sonuçlar, büyük hayvan modellerinde prosedürlerin geliştirilmesinde çok önemliydi ve bu nedenle aşağıda özetlenmiştir.
Özel yapım bir 23 G infüzyon kanülü başlangıçta jet akımını yönlendirmek için iki yan portla kullanıldı, bu da blebin çöküşünü ve bunun sonucunda retina dekolmanı13'ün çözülmesine yardımcı oldu. Bu çalışmada, bleb'in böyle bir çöküşünü fark etmedik. Bunun olası nedeni, göz küresinin daha büyük boyutu ve kanül infüzyon bölgesindeki çevrede korunmuş vitreus ile çekirdek vitrektominin performansı olabilir, bu da yönlendirilmiş jet akımının kuvvetini azaltabilir.
Hücre taşıyıcısının aletten atılması sırasındaki zorluklar, "aletle sıkışmış" olarak sınıflandırılan küçük hayvan modellerinde başka bir intraoperatif engeldi. Ek olarak, yazarlar retina yüzeyindeki kalıntı vitreusun, implantasyondan sonra taşıyıcının retinotomi deliğinden geriye doğru "sıçramasına" neden olabileceğini öne sürmüşlerdir. Bu sorun, hücre taşıyıcısının subretinal boşluğa düzgün, sürekli olarak atılmasını sağlayan enzim yardımlı bir vitrektomi ile çözülebilir. Vakaların çoğunda, yazarlar implantın retinotomiden daha uzak bir yerini elde etmek için taşıyıcıyı yeniden konumlandırdılar. Vaka serimizde, hücre taşıyıcısının enjektörün ucuna bağlı kaldığı bir durum da yaşadık. Bununla birlikte, bu, ışık borusunun ve enjektörün ucunun yavaş ve nazik manipülasyonu ile yönetildi. Olgularımızın hiçbirinde retinotomi bölgesinde herhangi bir rezidüel vitreus gözlenmedi. Ameliyatlarda TA yardımlı PPV'nin kullanılması, rezidüel olarak bağlanmış vitreus riskini azaltmak için bir yöntem olarak önerilebilir. Üst kısımdaki vitreusun tamamen çıkarılması için TA ile çoklu boyama gerekebilir.
Farklı bir çalışmada, polyester membran üzerinde polarize hücresel tek tabaka olarak yetiştirilen insan RPE kök hücrelerinin subretinal implantasyonunun sonuçları bildirilmiştir24. Deneyler sırasında, daha önce tarif edilen aynı cerrahi teknik kullanıldı13, ancak iki portlu bir PPV yaklaşımı uygulandı. Son olarak, tavşanlarda hücre taşıyıcı cerrahisinin subretinal implantasyonu için adım adım bir protokol daha sonra yayınlanmıştır25. Bu çalışma, ameliyat öncesi ve sonrası bakım da dahil olmak üzere, cerrahi prosedürün önceki deneyimlere dayanan çok ayrıntılı ve kolay tekrarlanabilir bir tanımını sunmaktadır.
Daha sonraki çalışmalarda büyük hayvan modellerinin kullanımı sırasında, sadece teknik sorular değil, aynı zamanda nakledilen hücrelere karşı bağışıklık reaksiyonu ve hücre taşıyıcısı büyüklüğü ile ilgili sorunlar ile ilgili sorular da ele alınmıştır. Cynomolgus maymunlarını (Macaca fascicularis) kullanan bir çalışma, insan kök hücresinden türetilmiş RPE monokatmanlarının subretinal implantasyonunun sonuçlarını tanımlamıştır15. Tüm hayvanlara ameliyattan 7 gün önce başlayan ve ameliyattan 3 ay sonra süren sirolimus (yükleme dozu 2 mg, günlük doz 1 mg) ve tetrasiklin (7.5 mg/kg- BW) içeren sistemik immünsüpresyon uygulandı. Cerrahi işlem daha öncetarif edilen protokollere göre yapıldı 24,25. Yazarlar, avize endo-aydınlatmalı 25 G üç portlu bir PPV yaklaşımı kullandılar. Önemli olarak, posterior retinada rezidüel vitreoretinal adezyonu dışlamak için TA yardımlı PVD kullanıldı. Orijinal olarak tarif edilen prosedüre ek olarak, yazarlar 20 G ısmarlama uzatılabilir döngü aleti kullanarak gelecekteki implantasyon alanında konakçı RPE katmanını çıkardılar.
Minipig çalışmamızda sistemik immünsüpresyon da kullandık. Bununla birlikte, immünsüpresyon tipi yukarıda tarif edilenden farklıydı. Hücre grefti reddini ve enflamatuar reaksiyonları engellemek için depo olarak takrolimus salınımlı polimer mikrosferlerin deri altı enjeksiyonunu 0.25 mg / kg BW dozunda uyguladık. Ameliyat sırasında konakçı RPE hücre tabakasını çıkarmadık, çünkü birincil amacımız prosedürün güvenliğini ve implante edilen hücrelerin yaşayabilirliğini analiz etmekti, ancak konakçı retinaya entegrasyonlarını değil.
Daha önce, katlanabilir parçalanamayan ağ destekli bir submikron parilen-C membranı (6.25 mm x 3.5 mm, 0.4 μm kalınlığında) üzerine tek katmanlı bir hESC türevli RPE'nin subretinal implantasyonunun güvenliği ve fizibilitesi 14 dişi Yucatán minipig10'da değerlendirildi. Ekimden sonra, hücreler ağ destekli bir zar üzerine ekildi. İmmünsüpresyon, sistemik takrolimus uygulaması (rejim ve doz belirtilmemiş) ve ameliyat sonunda 0.7 mg deksametazon implantının intravitreal enjeksiyonları kullanılarak gerçekleştirildi. PPV 20 G yaklaşımı ile yapıldı. Yazarlar, vitreus gövdesinin daha iyi görselleştirilmesi için intravitreal bir triamsinolon asetonid enjeksiyonu kullandılar. Büyük sklerotominin büyüklüğü 2 mm ile 3 mm arasındaydı. Subretinal enjeksiyondan sonra, retina geçici bir perflorokarbon sıvısı enjeksiyonu ile düzleştirildi. Akışkan-hava değişiminden sonra silikon yağı tamponadı (1.000/5.000 cSt) uygulandı. Postoperatif bakım, ameliyattan 1 hafta sonra deksametazon/neomisin/polimiksin B merheminin oküler uygulamasını içeriyordu. Yazarlar %91'lik bir başarı oranı bildirmişlerdir (yani, etkili subretinal implantasyon ve yeterli postoperatif görüntüleme verileri). Çalışmamızda TA kristallerinin intravitreal enjeksiyonu intraoperatif olarak ve esas olarak vitreus cismini görselleştirmek için kullanılmıştır. Bununla birlikte, bu ilacın lokal immünosüpresif etkisi belirsizliğini korumaktadır. Çalışmamızda kullanılan nanofibröz hücre taşıyıcıları 5.2 mm x 2.1 mm kalınlığında ve 3.7 μm kalınlığında, gözenek boyutları 0.4 μm idi. Ameliyat sırasında perflorokarbon sıvısı enjekte etmek yerine direkt faks uyguladık. Cerrahi başarı oranımız (%93.1) Koss ve ark.10 ile tutarlı ve biraz daha iyiydi.
Subretinal implantasyon için tamamen parçalanabilir hücre taşıyıcılarının (iskele) subretinal transplantasyonu ilk olarak 2019 yılında Yorkshire domuzlarındaincelenmiştir 14. Çalışma esas olarak fibrin hidrojel implantların biyolojik olarak parçalanabilir özelliklerine odaklanmıştır. Yazarlar, evcil domuzlarda kullanılan agresif immünosupresyonun, fibrin hidrojel implantlarının biyolojik olarak parçalanması sırasında potansiyel olarak ortaya çıkan lokal bir enflamatuar reaksiyonu inhibe edebileceğini belirtmişlerdir. Bununla birlikte, domuzlarda kullanılan immünosüpresif tedaviyi belirtmediler. PPV sırasında, subretinal implantasyon cihazının limbusa paralel ve yaklaşık 3.5 mm posterior olarak yerleştirilmesi için 3.6 mm uzunluğunda bir sklerotomi uyguladılar. Ek olarak, parmak manipülasyonunun neden olduğu el yerleştirme dengesizliğini azaltmayı amaçlayan pnömatik tahrikli bir enjeksiyon sistemi kullandılar. Olgu serimizde tüm sklerotomilerle limbustan 2.5 mm ile 3.0 mm arasında değişikliğe gidildi. Enjektörün yerleştirilmesi için büyük sklerotomi 3 mm uzunluğundaydı. Çalışmamızda kullanılan implantasyon enjektörü elle ameliyat edildi. Siliyer cismin pars planasının tam koterisi ve büyük sklerotominin içinde yeterli bir kesik, iyatrojenik periferik retina dekolmanı, kanama ve implant kaybı gibi intraoperatif komplikasyonlardan kaçınmak için çok önemli görünmektedir.
Özetle, Liběchov minipig modelinin biyolojik olarak parçalanabilen taşıyıcılar üzerindeki RPE hücrelerinin transplantasyonu için kalıtsal ve edinsel retina hastalıkları için bir tedavi seçeneği olarak kullanımını açıklıyoruz. Göz anatomisi ve fizyolojisindeki benzerliklerin yanı sıra bağışıklık sistemi ile ilgili benzerlikler, insan göz bozukluklarının tedavisine kolayca aktarılabilen hücrelerin subretinal implantasyonu için cerrahi teknikleri ve enstrümantasyonu geliştirmemize ve iyileştirmemize olanak tanır. Minipigler üzerindeki ameliyatların, insan ameliyatlarında kullanıldığında aynı enstrümantasyon (implantasyon dağıtım araçları dahil) kullanılarak gerçekleştirilmesini sağlamak önemlidir, böylece kazanılan deneyim ve bilgi birikiminin insanlara uygulanmasını kolaylaştırır. İnsan olmayan primatlar gibi bir makula alanının varlığına sahip alternatif büyük gözlü hayvan modelleri, merkezi retinal bölgede subretinal implantasyon sonrası anatomik ve fonksiyonel değişikliklerin takibi ve analizi için yararlı olabilir. Preoperatif, cerrahi ve postoperatif bakım prosedürlerinin ayrıntılı olarak tanımlanması, etkin ve standartlaştırılmış veri üretimini artırarak gelecekteki çalışmalar için yararlı olacaktır.
Açıklamalar
Hiç kimse.
Teşekkürler
Proje, Çek Bilim Vakfı (Proje Numarası 18-04393S) ve Çek Cumhuriyeti Norveç Hibeleri ve Teknoloji Ajansı (KAPPA Programı, Proje Numarası TO01000107) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Technical equipment | |||
| Wato EX-65 with a Mindray iMEC10 | Mindray, Shenzhen, China | Wato Ex-65 | anesthesia machine |
| R-Evolution CR | Optikon, Rome, Italy | R-Evolution CR | phacoemulsifier/vitrectome |
| Green laser Merilas 532α | Meridian, Thun, Switzerland | Merilas 532α | ophthalmic green laser |
| Microscope Hi-R NEO 900A | Haag-Streit Surgical, Wedel, Germany) | Hi-R NEO 900A | ophthalmic surgery microscope |
| Camera Sony PMW-10MD | Sony, Tokyo, Japan | PMW-10MD | full HD medical 2-piece |
| Non-contact vitreoretinal surgical system MERLIN BIOM | Volk, Mentor, OH, USA | MERLIN BIOM | BIOM |
| Steam sterilizer | Tuttnauer Europe B.V., Breda, NL | 3870 HSG | sterilizer |
| iCam100 | Optovue, Fremont, CA, USA | iCAM100 | funduscamera |
| iVue OCT100-2 | Optovue, Fremont, CA, USA | iVue OCT100-2 | OCT |
| Microsurgical instruments and devices | |||
| Cook Eye Speculum | Katena, New Jersey, US | K1-5403 | 15mm blades |
| Ophthalmology surgical drape | Hylyard, Alpharetta, Georgie, USA | 79304 | 132 x 142cm |
| Disposable Two step vitrectomy system. (23 gauge/ 0.6 mm) | DORC, Zuidland, Netherlands | 1272.ED06 | |
| Infusion line for 23G / 0.6 mm infusion cannula | DORC, Zuidland, Netherlands | 1279.P | |
| knife 2.75mm, IQ Geometry Tm Slit Knife Angled, Bevel Up | Surgical Specialties Corporation, Reading, USA | 72-2761G | |
| Extendible 41G subretinal injection needle. (23 gauge / 0.6 mm) | DORC, Zuidland, Netherlands | 1270.EXT | |
| Omnifix 3ml Luer Lock Solo siringe | BBraun, Melsungen, Germany | 4617022V | 3ml |
| 1ml soft-inject Tuberculin | Henke Sass Wolf, Tuttlingen, Germany | 5010.200V0 | 1ml |
| 8-0 Coated Vicryl | Ethicon, Puerto Rico, USA | J409G | |
| Purified Silicone Oil (in syringe) 10 ml | (FCI, Paris, France) | S5.7170 | 1000cSt |
| Pinnacle 360 Morris Vertical Scissors 23Ga | Synergetics, O'Fallon, USA | 10.24.23PIN | 23Ga |
| Revolution DSP 23Ga ILM forceps | Alcon, Geneva, Switzerland | 706.44 | Griesharber revolution |
| 23ga Straight Laser Probe | Synergetics, O’Fallon, USA | 55.21.23 | |
| FCI Protect 2.0% | FCI Ophthalmics, Paris, France | S5.9100 | viscoelastic |
| DK Westcott style Stitch Scissors, Curve | Duckworth & Kent, Hertfordshire, England | 1-501 | Curve |
| Pierse Notched Forceps, 0,3mm Straigh | Duckworth & Kent, Hertfordshire, England | 2-100-1E | 0,3mm straigh |
| DK Harms-Tubingen Straight Tying Forceps | Duckworth & Kent, Hertfordshire, England | 2-504E | 6mm |
| DK Needle Holder, Straigh | Duckworth & Kent, Hertfordshire, England | 3-201 | 9mm straigh |
| Medications and solutions | |||
| Unitropic 1% gtt. | UNIMED PHARMA spol. s r.o., Bratislava, Slovak republic | tropicamidum 10 mg/ml | eye drops |
| Diprophos | Merck Sharp & Dohme B.V., Haarlem, Netherlands | betamethasonum 7 mg/ml | 1ml |
| Alcon BSS Irrigation Solution | Alcon, Geneva, Switzerland | balance salt solution (BSS) | 500ml |
| Betaisodona | Mundipharma, Cambridge, United Kingdom | povidon-Iodine 1g/10ml | 30ml |
| Depo-medrol 120mg | Pfizer, New Yourk, USA | methylprednisolon | 5ml/200mg |
| Shotapen | Virbac Carros Cedex, France | benzylpenicillin, dihydrostreptomycin | 250ml |
| Flunixin a.u.v. | Norbrook, Newry, Northern Ireland | flunixinum 50,0 mg | 250ml |
| Tramal 100MG/2ML | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadol | 2ml |
| Zoletil 100 | Virbac Carros Cedex, France | tiletamine, zolazepam | 100mg |
| Narkeran 10 | Vetoquinol, Magny-Vernois, France | ketamin | 2ml |
| Rometar 20mg/ml | Spofa pharmaceutica, Prague, Czech republic | xylazinum | 20mg |
| Braunol 75mg/g | B.Braun medical, Prague, Czech republic | povidone iodine | 75mg/g |
| Propofol 1% MCT/LCT | Fresenius Kabi, Bad Homburg, Deutschland | propofol | 10mg/1ml |
| Isoflurane 100% Inhalation vapour, liquid | Piramal Critical Care Limited, West Drayton, United Kingdom | isoflurane | 100% |
| Benoxi gtt. 4mg/1ml | Unimed pharma, Bratislava, Slovakia | oxybuprakaine | 10ml |
| Neosynephrin POS 10% gtt. | Ursapharm , Saarbrücken, Deutschland | fenylefrin chloride | 10ml |
| Ophthalmo-framykoin 1X5GM | Zentiva a.s., Prague, Czech republic | bacitracin zinc/hydrocortisone acetate/hydrocortisoneacetate/neomycin sulfate | 5mg |
| Floxal ung. | Dr. Gerhard Mann Chem.-Pharm. Fabrik, Berlin, Germany | ofloxacin | 0.30% |
| Eficur inj. | Hipra, Amer, Spain | ceftiofurum hydrochloridum | 50mg / 1ml |
| Draxxin | Zoetis Inc., New Jersey, USA | tulathromycinum | 100mg / 1ml |
| Tramal | Stada Arzneimittel AG, Bad Vilbel, Deutschland | tramadoli hydrochloridum | 100mg / 2ml |
| Xylapan | Vetoquinol, Magny-Vernois, France | xylazinum | 0.4 mg/kg |
| Proparacaine hydrochlorid ophthalmic solution 0,5% | Bausch&Lomb Incorporated Tampa, FL, USA | Proparacaine hydrochlorid | 0.50% |
| Prograf | Astellas Pharma, Deerfield, Illinois, USA | Tacrolimus powder | 1mg |
| Cell carrier, cultivated cells cultures, and implantation injector | |||
| Falcon Cell Culture Inserts | Corning Inc., Kenneburg, ME, USA | 353103 | |
| TrypLE Express Enzyme (1X) | Thermo Fisher Scientific, MA, USA | 12604021 | |
| DMEM/F-12 | Thermo Fisher Scientific, MA, USA | 11320033 | |
| Biolaminin 521 LN (LN521) | BioLamina, Sundbyberg, Sweden | LN521-02 | |
| GlutaMAX Supplement | Thermo Fisher Scientific, MA, USA | 35050061 | |
| 2-Mercaptoethanol | Thermo Fisher Scientific, MA, USA | J66742.0B | |
| Penicillin-Streptomycin | Sigma-Aldrich, San Luis, Mi, USA | P4333 | |
| CRALBP | Novus Biologicals, Abingdon, UK | NB100-74392 | |
| Alexa Fluor 488 | Thermo Fisher Scientific, Germany | 21202 |
Referanslar
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment: 2010. British Journal of Ophthalmology. 96 (5), 614-618 (2011).
- Bressler, N. M., Bressler, S. B., Fine, S. L. Age-related macular degeneration. Survey of Ophthalmology. 32 (6), 375-413 (1988).
- Binder, S., Stanzel, B. V., Krebs, I., Glittenberg, C. Transplantation of the RPE in AMD. Progress in Retinal and Eye Research. 26 (5), 516-554 (2007).
- Mano, F., et al. Methodological approach to improve surgical outcomes of a pig subretinal implantation model. Translational Vision Science & Technology. 11 (4), 24 (2022).
- Ramsden, C. M., et al. Stem cells in retinal regeneration: Past, present and future. Development. 140 (12), 2576-2585 (2013).
- Carr, A. -. J. F., et al. Development of human embryonic stem cell therapies for age-related macular degeneration. Trends in Neurosciences. 36 (7), 385-395 (2013).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Popelka, S., et al. A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomedical Materials. 10 (4), 045022 (2015).
- Kozak, I., et al. Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Investigative Ophthalmology & Visual Science. 59 (9), 5670 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatan minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 254 (8), 1553-1565 (2016).
- Ghosh, F., Wong, F., Johansson, K., Bruun, A., Petters, R. M. Transplantation of full-thickness retina in the rhodopsin transgenic pig. Retina. 24 (1), 98-109 (2004).
- Christiansen, A. T., et al. Subretinal implantation of electrospun, short nanowire, and smooth poly(epsilon-caprolactone) scaffolds to the subretinal space of porcine eyes. Stem Cells International. 2012, 454295 (2012).
- Stanzel, B. V., et al. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Gandhi, J. K., et al. Fibrin hydrogels are safe, degradable scaffolds for sub-retinal implantation. PloS One. 15 (1), 0227641 (2020).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: Experience from a phase 1/2a study. Ophthalmology Retina. 4 (3), 264-273 (2020).
- Kashani, A. H., et al. Subretinal implantation of a human embryonic stem cell-derived retinal pigment epithelium monolayer in a porcine model. Advances in Experimental Medicine and Biology. 1185, 569-574 (2019).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), 4097 (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: Improved survival when implanted as a monolayer. Invest Ophthalmol Vis Sci. 54 (7), 5087-5096 (2013).
- Sharma, R., et al. Clinical-grade stem cell-derived retinal pigment epithelium patch rescues retinal degeneration in rodents and pigs. Science Translational Medicine. 11 (475), 7624 (2019).
- Stanzel, B., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments. (115), e53927 (2016).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Yaji, N., Yamato, M., Yang, J., Okano, T., Hori, S. Transplantation of tissue-engineered retinal pigment epithelial cell sheets in a rabbit model. Biomaterials. 30 (5), 797-803 (2009).
- Hruban, V., et al. Inheritance of malignant melanoma in the MeLiM strain of miniature pigs. Veterinarni Medicina. 49 (12), 453-459 (2004).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Annals of the New York Academy of Sciences. 1049, 161-171 (2005).
- Vízina, M., Wier, A. B., Collins, M. Comparative Ocular Anatomy in Commonly Used Laboratory Animals. Ocular Toxicology in Laboratory Animals. , 9-12 (2013).
- Chandler, M. J., Smith, P. J., Samuelson, D. A., MacKay, E. O. Photoreceptor density of the domestic pig retina. Veterinary Ophthalmology. 2 (3), 179-184 (1999).
- Wang, Q. X., et al. Biodegradable microsphere-loaded tacrolimus enhanced the effect on mice islet allograft and reduced the adverse effect on insulin secretion. American Journal of Transplantation. 4 (5), 721-727 (2004).
- Sevc, J., et al. Effective long-term immunosuppression in rats by subcutaneously implanted sustained-release tacrolimus pellet: Effect on spinally grafted human neural precursor survival. Experimental Neurology. 248, 85-99 (2013).
- Juhásová, J., et al. Osteogenic differentiation of miniature pig mesenchymal stem cells in 2D and 3D environment. Physiological Research. 60 (3), 559-571 (2011).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic. 156 (2), 128-134 (2012).
- Soerensen, D. D., Pedersen, L. J. Infrared skin temperature measurements for monitoring health in pigs: a review. Acta Veterinaria Scandinavica. 57 (1), 5 (2015).
- Eichhorn, S. J., Sampson, W. W. Statistical geometry of pores and statistics of porous nanofibrous assemblies. Journal of the Royal Society Interface. 2 (4), 309-318 (2005).
- Szatmári-Tóth, M., et al. Clearance of autophagy-associated dying retinal pigment epithelial cells - a possible source for inflammation in age-related macular degeneration. Cell Death & Disease. 7 (9), 2367 (2016).
- Lukovic, D., et al. Human iPSC derived disease model of MERTK-associated retinitis pigmentosa. Scientific Reports. 5, 12910 (2015).
- Artero Castro, A., et al. Generation of gene-corrected human induced pluripotent stem cell lines derived from retinitis pigmentosa patient with Ser331Cysfs*5 mutation in MERTK. Stem Cell Research. 34, 101341 (2019).
- Artero Castro, A., León, M., Del Buey Furió, V., Erceg, S., Lukovic, D. Generation of a human iPSC line by mRNA reprogramming. Stem Cell Research. 28, 157-160 (2018).
- Artero-Castro, A., et al. correction recovers phagocytosis in retinal pigment epithelium derived from retinitis pigmentosa-human-induced pluripotent stem cells. International Journal of Molecular Sciences. 22 (4), 2092 (2021).
- Müller, B., Wagner, F., Lorenz, B., Stieger, K. Organotypic cultures of adult mouse retina: Morphologic changes and gene expression. Investigative Ophthalmology & Visual Science. 58 (4), 1930-1940 (2017).
- Sheridan, C. M., et al. Replacement of the RPE monolayer. Eye. 23 (10), 1910-1915 (2009).
- Radtke, N. D., et al. Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium. American Journal of Ophthalmology. 146 (2), 172-182 (2008).
- Maaijwee, K. J. M., et al. Histological evidence for revascularisation of an autologous retinal pigment epithelium--choroid graft in the pig. The British Journal of Ophthalmology. 91 (4), 546-550 (2007).
- Ghosh, F., Engelsberg, K., English, R. V., Petters, R. M. Long-term neuroretinal full-thickness transplants in a large animal model of severe retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur Klinische und Experimentelle Ophthalmologie. 245 (6), 835-846 (2007).
- Radtke, N. D., Seiler, M. J., Aramant, R. B., Petry, H. M., Pidwell, D. J. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. American Journal of Ophthalmology. 133 (4), 544-550 (2002).
- Slijkerman, R. W., et al. The pros and cons of vertebrate animal models for functional and therapeutic research on inherited retinal dystrophies. Progress in Retinal and Eye Research. 48, 137-159 (2015).
- Schramke, S., et al. The Libechov minipig as a large animal model for preclinical research in Huntington's disease - Thoughts and perspectives. Czech and Slovak Neurology and Neurosurgery. 78/111, 55-60 (2015).
- Tohyama, S., Kobayashi, E. Age-appropriateness of porcine models used for cell transplantation. Cell Transplantation. 28 (2), 224-228 (2019).
- Dall, A. M., et al. Quantitative [18F] fluorodopa/PET and histology of fetal mesencephalic dopaminergic grafts to the striatum of MPTP-poisoned minipigs. Cell Transplantation. 11 (8), 733-746 (2002).
- Shrader, S. M., Greentree, W. F. Göttingen minipigs in ocular research. Toxicologic Pathology. 46 (4), 403-407 (2018).
- Duarri, A., et al. Transplantation of human induced pluripotent stem cell-derived retinal pigment epithelium in a swine model of geographic atrophy. International Journal of Molecular Sciences. 22 (19), 10497 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır