Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
جيل قوي وقابل للتكرار للغاية من عضويات الدماغ القشرية لنمذجة الشيخوخة العصبية الدماغية في المختبر
في هذه الدراسة ، نقدم تقنية مفصلة لنظام زراعة عضوي قشري بسيط ولكنه قوي باستخدام ثقافات hPSC القياسية الخالية من التغذية. هذا بروتوكول سريع وفعال وقابل للتكرار لتوليد المواد العضوية التي تشكل جوانب شيخوخة الدماغ في المختبر.
العضوية الدماغية هي نماذج ثلاثية الأبعاد للدماغ البشري النامي وتوفر منصة مقنعة ومتطورة لنمذجة الأمراض والفحص الجيني والأدوية على نطاق واسع. نظرا لطبيعة التنظيم الذاتي للخلايا في المواد العضوية في الدماغ والمجموعة المتزايدة من البروتوكولات المتاحة لتوليدها ، تم تحديد المشكلات المتعلقة بعدم التجانس والتباين بين المواد العضوية. في ورقة البروتوكول هذه ، نصف بروتوكولا قويا وقابلا للتكرار يتغلب إلى حد كبير على هذه المشكلات ويولد عضويات قشرية من أسلاف الجلد العصبي في غضون شهر 1 ، ويمكن الحفاظ عليه لأكثر من 1 سنة. يمكن تنفيذ هذا البروتوكول القابل للتكرار بسهولة في غرفة زراعة الأنسجة القياسية وينتج عنه عضويات مع تنوع غني من أنواع الخلايا الموجودة عادة في القشرة البشرية النامية. على الرغم من تركيبتها التنموية المبكرة ، ستبدأ الخلايا العصبية وأنواع خلايا الدماغ البشرية الأخرى في إظهار العلامات النموذجية للشيخوخة في الخلايا العصبية بعد فترة طويلة من الثقافة المخبرية ، مما يجعلها منصة قيمة ومفيدة لدراسة العمليات العصبية المرتبطة بالشيخوخة. يحدد هذا البروتوكول أيضا طريقة للكشف عن هذه الخلايا الشائخة في عضويات الدماغ القشرية باستخدام تلطيخ بيتا غالاكتوزيداز المرتبط بالشيخوخة.
استندت معرفتنا الحالية بالدماغ البشري إلى حد كبير على النماذج الحيوانية وعينات الدماغ بعد الوفاة. بيولوجيا الخلايا الجذعية هو مجال سريع التقدم يوفر رؤى جديدة في البيولوجيا الأساسية لنمو الدماغ البشري والدوافع المرضية لاضطرابات الدماغ البشري. الخلايا الجذعية البشرية متعددة القدرات (hPSCs) هي أداة لا تقدر بثمن لنمذجة الدماغ البشري عن طريق توليد المواد العضوية ، والأنسجة ثلاثية الأبعاد (3D) الشبيهة بالأعضاء التي تلخص عادة مسارات النمو ، والتركيب الخلوي ، وبنية الدماغ البشري النامي. يتم تجميع عضويات الدماغ ذاتيا وتتكون من خلايا جذعية عصبية ، وأسلاف عصبيين محددين ، وخلايا عصبية ناضجة ، وأنواع الخلايا الدبقية. وبالتالي ، توفر المواد العضوية فرصة فريدة لدراسة الدماغ البشري المبكر ، والذي غالبا ما يتعذر الوصول إليه لإجراء تجارب مباشرة ولكن له أيضا قيود جوهرية مثل عدم وجود الأوعية الدموية والجهاز المناعي.
تم اتباع منهجيات لتوليد المواد العضوية في الدماغ بطريقتين مختلفتين: التمايز غير الموجه والموجه. تعتمد طرق الدماغ العضوية غير الموجهة على قدرات التمايز الجوهرية التلقائية للخلايا الجذعية التي تدفع تكوين الأنسجة 1,2 وتسمح بظهور مجموعة متنوعة من هويات نسب الخلايا التي تتراوح من الدماغ الأمامي والدماغ المتوسط والدماغ الخلفي إلى الضفيرة المشيمية والشبكية والأديم المتوسط. في المقابل ، تتطلب طرق الدماغ العضوية الموجهة استخداما كبيرا للعوامل الخارجية لدفع hPSCs نحو النمط المطلوب للسلالات العصبية التي تمثل نوعا واحدا من مناطق الدماغ ، مثل البروز العقدي الإنسي3 ، والدماغ الأمامي4 ، والدماغ المتوسط5 ، وتحت المهاد6 ، والمخيخ7 ، والضفيرة المشيمية8. هذه القدرة على توليد مناطق مختلفة من الدماغ مع سلالات خلايا مختلفة ، وإمكانية دمجها حسب الرغبة ، تجعل من عضويات الدماغ نموذجا ممتازا للتحقيق في نمو الدماغ البشري وفك رموز الآليات الأساسية للأمراض المرتبطة بالدماغ. على الرغم من أن هذه الطرق لتوليد المواد العضوية في الدماغ تقدم طفرة في نمذجة مناطق الدماغ البشري ، إلا أن التباين وعدم التجانس بين المواد العضوية لا يزالان يشكلان قيدا كبيرا على الدراسات المنهجية والكمية ، مثل فحص الأدوية.
يعتمد البروتوكول الحالي على طريقة تم تطويرها في ورقتنا البحثية الأخيرة9 وتتضمن التمايز الانتقائي لمستعمرات hPSC نحو هوية الأديم العصبي (NEct) مع مثبطات SMAD المزدوجة (SB-431542 و LDN 193189) ، والتي لديها بعد ذلك القدرة على التنظيم الذاتي في غضون 4 أيام في كرويات الظهارة العصبية ثلاثية الأبعاد تحت تأثير إشارات FGF2. تولد هذه الظهارة العصبية كروية بشكل موثوق عضويات قشرية متجانسة مع تركيبة خلوية تشبه الجسم الحي في غضون 4 أسابيع من التمايز. البروتوكول الموصوف هنا مبني على النتائج السابقة التي توصلنا إليها والتي تبين أن تثبيط إشارات SMAD المزدوجة (مثبط الأمهات ضد Decapentaplegic) يعزز تمايز hPSCs نحو الخلايا الجذعية العصبية السطحية المشتقة من أسلاف الجلد العصبيالخارجي 10 عن طريق ، من بين أمور أخرى ، تثبيط اختيار مصير خلايا الجلد الباطن والجلد المتوسط والأديم التغذي11 . علاوة على ذلك ، فإن تضمين كرويات الظهارة العصبية في مصفوفة الغشاء السفلي المؤهل من قبل hESC يؤدي إلى ظهور كبير في الظهارة العصبية ، مما يشكل البطينين مع قطبية أبيكوبازية. أظهرت الثقافة واسعة النطاق قابلية التكاثر والتجانس للعضويات القشرية المستقلة عن خطوط الخلايا أو المستنسخات أو الدفعات ، وبالتالي تمثل نظاما موثوقا ومستقرا للخلايا الجذعية لمحاكاة التطور القشري البشري المبكر في الصحة والمرض في المختبر. كما أننا نحدد بروتوكولا للكشف عن علامات الخلايا العصبية الشائخة في عضويات الدماغ القشرية المشتقة من hPSCs والتي تم زراعتها لفترات طويلة من الزمن.
بعد طلاء hPSCs بكثافة بذر تتراوح بين 20٪ و 30٪ ، يتم التعامل مع الخلايا بمثبطات SMAD المزدوجة لمدة 3 أيام لتمييز مستعمرات hPSC نحو مستعمرات الجلد العصبي. ثم يتم رفع هذه المستعمرات بلطف مع dispase وبذورها في لوحات 6-well منخفضة للغاية المرفقة مع استكمال FGF2. المستعمرات العائمة ثنائية الأبعاد تنظم نفسها ذاتيا في كرويات ثلاثية الأبعاد عصبية بين عشية وضحاها ويتم الحفاظ عليها لمدة 4 أيام في وسط N2 تستكمل يوميا مع FGF2. بمجرد أن تنشئ الكرويات الطبقة الظهارية العصبية ، يمكن تضمينها في مصفوفة الغشاء السفلي. من خلال إضافة وسط تمايز طرفي جديد بشكل روتيني ، سيلاحظ الباحثون التوسع التدريجي والبهار الظهاري العصبي في المواد العضوية القشرية . قد يرغب الباحثون في فصل هذه المواد العضوية لإجراء التنميط النسخي والبروتيني. بالإضافة إلى ذلك ، يوصى بالتصوير الساطع لمراقبة جودة المواد العضوية القشرية . يمكن إجراء التحليل عن طريق التثبيت والاستئصال بالتبريد والتلطيخ المناعي. وقد سبق وصف أوصاف وأساليب هذه التقنيات12. في نهاية المطاف ، يسمح هذا البروتوكول للباحثين بتوليد عضويات دماغية قشرية متجانسة بسرعة وقوة لنمذجة الدماغ القشري البشري النامي ، بتكلفة منخفضة ومعدات محدودة ، ولدراسة جوانب الشيخوخة العصبية الخلوية ، كما هو موضح في هذه الورقة.
1. توليد عضويات الدماغ القشرية
ملاحظة: ستحدث جميع الخطوات الواردة في هذا القسم من البروتوكول في غطاء أمان أحيائي من الفئة 2، ما لم ينص على خلاف ذلك.
- تحريض المستعمرات العصبية ثنائية الأبعاد من ثقافة hPSC ثنائية الأبعاد (أيام -1 إلى 3)
- قبل الحث ، قم بلوحة مستعمرات hPSC على مصفوفة غشاء سفلي مؤهل hESC في لوحة من 6 آبار بكثافة 20٪ -30٪. حقق هذه الكثافة عن طريق تمرير مستعمرات hPSC من بئر واحد من صفيحة 6 آبار عند التقاء 60٪ إلى ثلاثة آبار من صفيحة 6 آبار.
- بالنسبة لطلاء مصفوفة الغشاء السفلي ، قم بتخفيف مصفوفة الغشاء السفلي بنسبة 1:50 في وسط قاعدي عادي. قم بإيداع 1 مل / بئر بالتساوي من لوحة 6 آبار ، واحتضنها لمدة 1 ساعة في درجة حرارة الغرفة (RT) ، ثم استنشقها.
- الحفاظ على مستعمرات hPSC لمدة 1 يوم في 2 مل من وسط زراعة الخلايا الخالية من المصل قبل التمايز.
- في يوم تمايز hPSC ، افحص مستعمرات hPSC باستخدام المجهر الساطع عند تكبير 4x إلى 10x لضمان مستعمرات صحية بدون تمايز يمكن اكتشافه.
ملاحظة: ستشكل hPSCs الصحية مستعمرات حافة ضيقة مع خلايا تحتوي على نواة كبيرة وسيتوبلازم صغير جدا ونواة بارزة. ستظهر مستعمرات iPSC المتباينة اختلافات مورفولوجية واضحة عن مستعمرات hPSC الموصوفة أعلاه ، خاصة حول الحواف الخارجية للمستعمرات أو في المركز. - أضف الكواشف المدرجة في الجدول 1 لتكوين الوسط N2 المطلوب للتمايز. أحضر هذه الوسيلة إلى RT قبل الاستخدام.
- بمجرد الوصول إلى RT ، قم بشفط وسط زراعة الخلايا الخالي من المصل من كل بئر من الصفيحة المكونة من 6 آبار واستبدلها ب 2 مل من وسط N2 المضاف بلطف إلى ماصة مصلية سعة 5 مل.
- أضف مثبطات SMAD المزدوجة ، SB-431542 (10 ميكرومتر) و LDN 193189 (100 نانومتر).
ملاحظة: يمكن إضافة مثبطات SMAD إلى وسط N2 بعد وضع الوسط في كل بئر ، أو إلى الكمية المطلوبة من وسط N2 قبل استبدال وسط زراعة الخلايا الخالي من المصل. يمكن دمج المثبطات بالتساوي في الوسط عن طريق تدوير اللوحة بلطف أو عكس الأنبوب الذي يحتوي على الوسط والمثبطات 3-4 مرات. - أضف وسائط N2 جديدة مكملة ب SB-431542 (10 ميكرومتر) و LDN 193189 (100 نانومتر) يوميا إلى كل بئر خلال اليومين التاليين.
ملاحظة: يضاف وسط N2 الطازج لتقليل التعرض المطول للخلايا ل DMSO الذي يستخدم لإذابة مركبات 193189 SB-431542 و LDN ومنع السمية الخلوية.
- جيل من الكرويات ثلاثية الأبعاد العصبية من المستعمرات العصبية الظاهرية الجلدية المستحثة ثنائية الأبعاد (الأيام 3 إلى 7)
- ارفع المستعمرات العصبية الخارجية المستحثة باستخدام التباعد باتباع الخطوات 1.2.2-1.2.8.
- أولا ، قم بإزالة 2 مل من وسط N2 من اللوحة المكونة من 6 آبار ، واغسل 1x باستخدام HBSS لضمان إزالة كل وسط N2.
ملاحظة: يمكن أن يتداخل وسط N2 مع نشاط إنزيم dispase ، مما يمنع الانفصال الكافي للمستعمرات العصبية الخارجية عن البئر. - أضف 1 مل من 2.4 وحدة / مل إلى كل بئر يحتوي على مستعمرة.
- احتضن البئر لمدة 20-25 دقيقة (بحد أقصى 30 دقيقة) عند 37 درجة مئوية. تحقق من وجود مفرزة مستعمرة بانتظام.
ملاحظة: قد تنفصل المستعمرات الصغيرة في غضون 20 دقيقة. يجب تجاهل أي مستعمرات تظل عالقة بعد 30 دقيقة. - بعد الحضانة ، أضف 1 مل من وسط N2 إلى البئر لوقف نشاط إنزيم dispase ونقل المستعمرات إلى أنبوب 15 مل باستخدام طرف ماصة P1000 واسع التجويف أو طرف ماصة P1000 معدل مقطوع بمقص معقم (مما يجعله طرف P1000 واسع التجويف).
- اسمح لكتل المستعمرة بالغرق في قاع الأنبوب بالجاذبية.
ملاحظة: ستستغرق هذه العملية حوالي 1 دقيقة. - بمجرد غرق الكتل ، قم بإزالة supernatant بعناية باستخدام طرف ماصة P1000 قياسي واستبدله ب 1 مل من وسط N2 الطازج. كرر خطوة الغسيل هذه ثلاث مرات لضمان الإزالة الكاملة للديسباس.
ملاحظة: أي تباعد متبق سيمنع تكوينا موحدا للكرويات العصبية والجلدية ويحفز موت الخلايا. - بعد الغسيل ، أعد تعليق كتل الخلايا في 3 مل من وسط N2 ونقلها إلى بئر واحد من صفيحة 6 آبار وأضف 40 نانوغرام / مل من bFGF.
ملاحظة: إذا تم فصل عدد كبير من مستعمرات الجلد العصبي ، فيمكن طلاء هذه المستعمرات عبر بئرين أو أكثر من صفيحة 6 آبار لمنع اندماج الكرويات. 24 ساعة بعد انفصال مفرزة المستعمرات ، تحقق مما إذا كانت الكرويات قد تشكلت. - حافظ على الكرويات في نفس الوسائط لمدة 3-4 أيام قادمة ولكن أضف bFGF طازجا (40 نانوغرام / مل) إلى كل بئر يوميا لتعزيز انتشار الخلايا العصبية والجلدية ، والتنظيم الذاتي ، وتحفيز وتوسيع الظهارة العصبية.
ملاحظة: إذا تم طلاء الكرويات بكثافة أعلى ، فمن المحتمل أن تتحول الوسائط إلى اللون الأصفر وتتطلب استبدالها كل 2 أيام ب bFGF طازج (40 نانوغرام / مل). ومع ذلك ، لا ينصح بذلك ، وبدلا من ذلك ، يجب الحفاظ على عدد أقل من الكرويات في كل بئر لتجنب هذه المشكلة. يمكن تضمين الكرويات في مصفوفة الغشاء السفلي بعد 3 أيام إذا كانت الظهارة العصبية واضحة. إذا لم تكن الظهارة العصبية واضحة أو لا تبدو قوية ، فحافظ على الكرويات ليوم آخر وتحقق مرة أخرى.
- تمايز الدماغ العضوي القشري وصيانته (اليوم 8)
- إعداد وسائط التمايز الطرفي (DM) باستخدام الكواشف المدرجة في الجدول 2. أحضر هذه الوسائط إلى RT.
- قم بإذابة مصفوفة الغشاء السفلي المؤهل بنسبة 100٪ من hESC على الجليد.
- قم بإعداد ورقة من البارافيلم مع الدمامل المعقمة بنسبة 70٪ من الإيثانول في طبق بتري 10 سم ووضعها على مجهر ستيريو تحت غطاء محرك السيارة.
ملاحظة: يمكن استخدام صينية فارغة من أطراف ماصة 200 ميكرولتر لإنشاء شبكة من الغمازات. - اقطع الطرف من طرف ماصة 100 ميكرولتر (لجعله واسع التجويف). سيتم استخدام هذا لتضمين الكرويات العصبية في مصفوفة الطابق السفلي دون كسرها.
- باستخدام المجهر المجسم، اختر كرويات عصبية متشابهة الحجم (500 ميكرومتر) من الصفيحة المكونة من 6 آبار وانقلها إلى الدمامل شبه السينمائية باستخدام طرف ماصة 100 ميكرولتر واسع التجويف، ووضع كروي عصبي واحد لكل دملة.
- قم بإزالة أي وسائط زائدة بلطف ، مع ترك ما يكفي لتغطية الكرويات.
ملاحظة: هذا هو للحفاظ على جودة الكروية قبل إضافة مصفوفة الطابق السفلي وضمان عدم جفافها. - أضف بلطف 18 ميكرولتر من مصفوفة الطابق السفلي فوق الكروية ، مع وضع الكروي داخل مركز قطرة المصفوفة. استخدم نهاية طرف ماصة 10 ميكرولتر لتوسيط الكرويات في المصفوفة.
ملاحظة: حاول إضافة مصفوفة الطابق السفلي في أسرع وقت ممكن لتجنب جفاف الوسائط الزائدة حول الكرويات. - قم بتغطية طبق بتري 10 سم وانقله إلى الحاضنة واحتضن طبق البارافيلم مع كرويات مدمجة في مصفوفة الطابق السفلي عند 37 درجة مئوية لمدة 25 دقيقة.
- بعد الحضانة، اشطف الكرويات المدمجة في صفيحة منخفضة التركيب ذات 24 بئرا باستخدام طرف P1000 مع 0.5 مل من وسائط DM، مع التأكد من وضع الكرويات المدمجة الفردية في بئر واحد لكل منها.
ملاحظة: إذا سقط أكثر من كروي مضمن في بئر واحد، فاستخدم طرف P1000 عريض التجويف لنقل الكروي الآخر إلى بئر جديد. - الحفاظ على عضويات الدماغ القشرية المتمايزة في وسائط DM لفترات طويلة من الزمن ، مع حدوث تغييرات في الوسائط كل 2 أيام عندما تصبح المواد العضوية أكبر وأكبر.
ملاحظة: خلال الأسبوع الأول من التمايز ، يمكن تغيير الوسيط كل 3 أيام.
2. توصيف الشيخوخة العصبية في المواد العضوية القشرية
- معالجة المواد العضوية القشرية للعمليات التبريدية:
ملاحظة: تم تنفيذ الخطوات في غطاء محرك السيارة للسلامة الأحيائية من الفئة 2.- تحضير أنابيب 2 مل ، كل منها مملوء ب 1.5 مل من 4٪ بارافورمالديهايد (PFA).
- اقطع نهاية طرف ماصة P1000 (لجعله تجويف واسع) وانقل بلطف كل عضو عضوي إلى أحد أنابيب 2 مل المحضرة أعلاه (واحد عضوي لكل أنبوب).
ملاحظة: لمنع الاختلاط الزائد لوسائط DM مع PFA، اسمح للعضوي بالغرق نحو فتحة طرف الماصة P1000 وقم بإراحة الطرف فوق الجزء العلوي من PFA مباشرة في الأنبوب قبل سحب العضو إلى الخارج. هذا سيمكن الباحث من نقل الوسائط العضوية والحد الأدنى جدا من الوسائط. - اسمح لعملية التثبيت أن تتم عند 4 درجات مئوية لمدة 1 ساعة.
- باستخدام طرف ماصة P1000 غير مقطوع ، قم بشفط PFA الزائد بعناية وأضف 1.5 مل من PBS 1x البارد.
- انقل الأنابيب إلى شاكر مداري تم ضبطه عند 70 دورة في الدقيقة لمدة 10 دقائق في RT.
- كرر عملية الغسيل باستخدام 1x PBS البارد ثلاث مرات لضمان إزالة جميع PFA تماما.
ملاحظة: لا تتخلص من PFA في حاويات النفايات العادية. بدلا من ذلك ، قم بإعداد حاوية محددة للتخلص من النفايات الكيميائية لهذا الغرض ، لأن PFA يشكل خطرا. - اغمر المواد العضوية في 1x PBS التي تحتوي على 30٪ من السكروز واحتضنها عند 4 درجات مئوية حتى تغرق جميع المواد العضوية في قاع الأنبوب.
ملاحظة: يعتمد الوقت اللازم للسماح للعضويات بالغرق على حجم/عمر المواد العضوية. قد تستغرق المواد العضوية البالغة من العمر 3 أشهر ما يصل إلى 5 ساعات. - باستخدام طرف ماصة P1000 واسع التجويف ، انقل بلطف ثلاثة إلى خمسة عضويات إلى قالب تركيب يحتوي على محلول تركيب مصنوع من 30٪ سكروز و 100٪ من درجة حرارة القطع المثلى (OCT) المتوسطة ، بنسبة 3: 2.
- استخدم طرف ماصة 10 ميكرولتر بمساعدة مجهر مجسم لتوجيه المواد العضوية ووضعها في نمط يشبه الشبكة.
- ضع القالب على الثلج الجاف لتصلب محلول السكروز OCT قبل الشروع في التقسيم المبرد (16-20 ميكرومتر) باستخدام الكريستات.
ملاحظة: بالنسبة للبيتا غالاكتوزيداز المرتبط بالشيخوخة ، يجب معالجة جميع الأنسجة للتقسيم بمجرد غرقها. بالنسبة للتألق المناعي ، يمكن معالجة الأنسجة للتقسيم في اليوم التالي. يجب تخزين جميع الشرائح التي تحتوي على أقسام عند -20 درجة مئوية قبل التألق المناعي اللاحق أو بيتا غالاكتوزيداز ، إذا لم تكن ملطخة على الفور.
- عملية تحليل الشيخوخة في عضويات الدماغ القشرية :
ملاحظة: يمكن تنفيذ الخطوات التالية على مقعد المختبر العادي.- انقل الشرائح إلى حاوية تلطيخ شرائح المجهر بغطاء واغسل الأنسجة العضوية المجزأة ثلاث مرات باستخدام 1x PBS لمدة 10 دقائق في RT لإزالة أي محلول تركيب زائد.
- بعد ذلك ، احتضن الأنسجة المغسولة بمحلول تلطيخ بيتا غالاكتوزيداز الطازج بين عشية وضحاها عند 37 درجة مئوية.
ملاحظة: يتكون محلول تلطيخ بيتا غالاكتوزيداز من مخزن فوسفات مؤقت (ل 10 مل من المخزن المؤقت للفوسفات: 8.15 مل من 1 M NaH 2 PO 4 ، 1.85 مل من 1M Na 2 HPO4) معدل الأس الهيدروجيني = 6 ، 100 mM من سداسي أسيانوفارات البوتاسيوم (III) ، 100 mM من سداسي أسيانوفيرات البوتاسيوم (II) ثلاثي الهيدرات ، 5 M من كلوريد الصوديوم ، 1 M من MgCl2، 20 ملغم/مل من X-Gal. تجنب استخدام حاضنة زراعة الخلايا القياسية التي تحتوي على CO 2 لأن CO2 سيغير درجة الحموضة في محلول تلطيخ بيتا غالاكتوزيداز. - اغسل الأنسجة الملطخة ب 1x PBS ثلاث مرات لمدة 10 دقائق لكل منها في RT لإزالة محلول بيتا غالاكتوزيداز.
- قم بتركيب الأنسجة المغسولة باستخدام حامل زجاجي مضاد للتلاشي واسمح لمحلول التركيب بالتصلب لمدة 30 دقيقة في RT قبل المشاهدة تحت المجهر.
لقد وصفنا هنا بروتوكولا قويا يسمح للباحثين بتوليد عضويات دماغية قشرية متجانسة مشتقة من hPSC تحاكي منطقة الدماغ القشرية البشرية في الجسم الحي في غضون 1-3 أشهر من الثقافة. يتم استزراع مستعمرات hPSC أولا في وسائط التمايز لتوليد مستعمرات عصبية ، والتي يمكن استخدامها بعد ذلك لتشكيل كرويات عصبية. يتم تضمين هذه الكرويات لاحقا في مصفوفة غشاء الطابق السفلي ويتم الاحتفاظ بها لفترات طويلة من الزمن لإنتاج عضويات يمكن استخدامها لنمذجة الشيخوخة العصبية (انظر الشكل 1 للحصول على مخطط للبروتوكول). تجدر الإشارة إلى أن زراعة هذه المواد العضوية في ألواح 24 بئرا غير المطلية للغاية تسبب الإجهاد الخلوي وتعزز الأنماط الظاهرية المرتبطة بالشيخوخة على مدى 13 أسبوعا من الثقافة في المختبر . يمكن أيضا الحفاظ على المواد العضوية المشتقة من هذا البروتوكول في المفاعلات الحيوية المتحركة من أجل النمو الأمثل والتمايز بين الخلايا العصبية للصفائح القشرية أو في الواجهة الهوائية السائلة.
للبدء ، يتم استزراع مستعمرات hPSC لمدة 1 يوم قبل التمايز العصبي الوراثي. من الأهمية بمكان أن يتم استزراع مستعمرات hPSC هذه إلى التقاء 20٪ -30٪ فقط وأن تكون من أعلى مستويات الجودة الممكنة: طبقة أحادية مسطحة ضيقة مع عدم وجود خلايا متمايزة تلوث المستعمرات (الشكل 2A ، B). يجب تأكيد تعدد قدرات مستعمرات hPSC من خلال التعبير عن علامات مثل NANOG (الشكل 2C). ثم تتعرض مستعمرات hPSC التي تم التحقق من صحتها لوسائط التمايز العصبي الخارجي N2 مع SB-431542 و LDN 193189. بعد 3 أيام من الصيانة في هذه الوسائط ، يجب أن تكون مستعمرات hPSC قد تمايزت إلى مستعمرات عصبية خارجية ولم تعد تظهر نفس المورفولوجيا أحادية الطبقة المسطحة الضيقة ل hPSCs (الشكل 2B) ، ولكن بدلا من ذلك ، ستصبح خلايا أطول على شكل عمود (الشكل 2B). ستكون هذه الخلايا سلبية أيضا لعلامات تعدد القدرات مثل NANOG (الشكل 2C).
في هذه المرحلة ، يتم فصل المستعمرات العصبية الخارجية عن طريق الأنزيم مع dispase ، ويسمح لكل مستعمرة صحية ومنفصلة بنجاح بالتنظيم الذاتي وتشكيل كروية عصبية شابة (الشكل 2D ، الفيديو التكميلي 1). فقط المستعمرات العصبية الخارجية السليمة والنظيفة سوف تنفصل في الإطار الزمني المحدد لنشاط dispase ؛ يجب تجاهل جميع المستعمرات الأخرى لأنها ستؤدي إلى نوعية رديئة من الكروية. مع التعرض اليومي ل FGF2 في وسائط N2 ، سوف تتكاثر الخلايا الجذعية العصبية (SOX2 +) في هذه الكرويات (الشكل 2D ، اليوم 1) وتشكل عددا كبيرا من الورود العصبية (الشكل 2D ، اليوم 4). ستعبر هذه الورود عن التقاطع الضيق والعلامة الظهارية ZO1 في الخلايا الموجودة داخل مركز الورود وعلى طول الحافة الخارجية للكروية ، مما يدل على القطبية القمية القاعدية للكروية (الشكل 2D ، اليوم 4). تم وصف طريقة التصوير ثلاثي الأبعاد الكامل للكرويات قبل13. يجب أن يوضح الفحص اليومي للكرويات تكوين حافة خارجية ضيقة ومظلمة ومحيط مشرق من الكرويات ، وهذه هي الطبقة الظهارية العصبية. يجب تشكيل هذه الطبقة بشكل كاف بعد 3-4 أيام بقطر تقريبي يبلغ 500 ميكرومتر ، وفي ذلك الوقت يمكن تضمين الكرويات في مصفوفة الطابق السفلي. إذا لم تكن هذه الطبقة موجودة أو تم تشكيلها بشكل ضعيف فقط ، فإن الكرويات ليست متطورة بما يكفي للمضي قدما. يوصى بالانتظار يوما آخر لمراقبة أي تغيير ، ولكن إذا لم يتم ملاحظة ذلك ، فتجاهل هذه الكرويات.
يمكن رؤية صورة سطعة تمثيلية للكرويات بعد 3 أيام من الثقافة في الشكل 2D. يتم اختيار الكرويات ذات الطبقة الظهارية العصبية الضيقة التي لم تندمج مع الكرويات المجاورة الأخرى ، ولها أنسجة شبه شفافة ، وتظهر تكوين وردة عصبية ، ليتم تضمينها في مصفوفة الطابق السفلي. بمجرد تضمينه ، سوف يتكاثر الكروي بسرعة ويبدأ في التبرعم: ستظهر عقد من الأنسجة المدمجة ، وتتوسع إلى الخارج من الجسم الرئيسي للكروية. هذا واضح بين 1-3 أسابيع في مصفوفة الطابق السفلي ويمكن ملاحظته عبر خطوط خلايا متعددة (الشكل 3A). يؤكد التحليل الكمي للكرويات المدمجة وجود خلايا ظهارية في ما يصل إلى 100٪ من الكرويات عبر ثلاثة خطوط خلوية مختلفة ، مما يؤكد التجانس والتكرار المتوقعين من هذا البروتوكول (الشكل 3B). ويؤكد التحديد الكمي لقطر المواد العضوية أثناء التمايز في المختبر أيضا إمكانية التكاثر عبر خطوط مختلفة من hPSC (الشكل 3C). إذا لم يحدث التبرعم ، فإن الكرويات لا تتطور بشكل مناسب ويجب التخلص منها. بمجرد تضمين الكرويات في مصفوفة ، يتقدم تطورها ، ويشار إلى الكرويات الآن باسم المواد العضوية. يؤكد تلطيخ التألق المناعي أيضا وجود خلايا سلف عصبية (PAX6) بالإضافة إلى علامات الطبقة القشرية الملطخة ب CTIP2 و SATB2 في المواد العضوية ذات الطبقات الواضحة (الشكل 3D ، E). يمكن ملاحظة هذه الطبقات عبر نقاط زمنية مختلفة لصيانة المواد العضوية (الشكل 3D ، E). تم وصف طريقة الكيمياء النسيجية المناعية للأنسجة قبل14.
أحد التطبيقات المحتملة لهذه المواد العضوية هو دراسة كيفية تأثير العمليات المرتبطة بالشيخوخة العصبية على الدماغ. للتحقيق في ذلك ، يتم حصاد المواد العضوية التي تم إنشاؤها بنجاح من نقاط زمنية مختلفة متعددة للتقسيم والتلطيخ للمؤشرات الحيوية الجزيئية القياسية للشيخوخة مثل بيتا غالاكتوزيداز المرتبط بالشيخوخة و p21. يوضح الشكل 4A صورة تمثيلية لتلطيخ بيتا غالاكتوزيداز المرتبط بالشيخوخة للعضويات بعد 4 و 13 أسبوعا من تضمينها في مصفوفة الغشاء السفلي. بين الأسبوعين 4 و 13 ، هناك زيادة ملحوظة في وجود بيتا غالاكتوزيداز المرتبط بالشيخوخة ، مما يشير إلى أن الشيخوخة الخلوية ، وهي محرك معترف به للشيخوخة العضوية ، قد حدثت خلال هذا الوقت في الثقافة. أكد تلطيخ التألق المناعي للعضويات في الأسبوع 13 وجود علامة شيخوخة أخرى ، p21 ، تحمل علامة مشتركة مع علامة الخلايا العصبية القشرية الناضجة (CTIP2) ويمكن رؤيتها في الشكل 4B. ومع ذلك ، تجدر الإشارة إلى أن وجود p21 هو علامة على اعتقال دورة الخلية وليس في حد ذاته علامة نهائية على الشيخوخة ، ويوصى بالكشف عن علامات الشيخوخة الأخرى مثل p16 و SASP (النمط الظاهري الإفرازي المرتبط بالشيخوخة) لتحديد الخلايا بشكل نهائي على أنها شيخوخة.
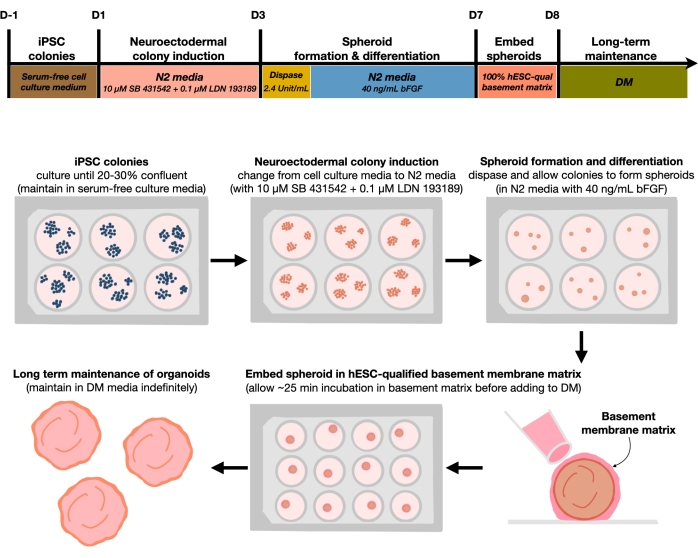
الشكل 1: مخطط تخطيطي لتوليد عضويات دماغية قشرية قابلة للتكرار. سير العمل التخطيطي للإجراء التجريبي لتوليد عضويات الدماغ القشرية من hPSCs التي يتم الاحتفاظ بها في الوسط الخالي من التغذية. يوفر سير العمل نظرة عامة على ست خطوات تشارك في التمييز بين hPSCs 2D في الأنسجة البشرية لوحة القشرية 3D منقوشة في المواد العضوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
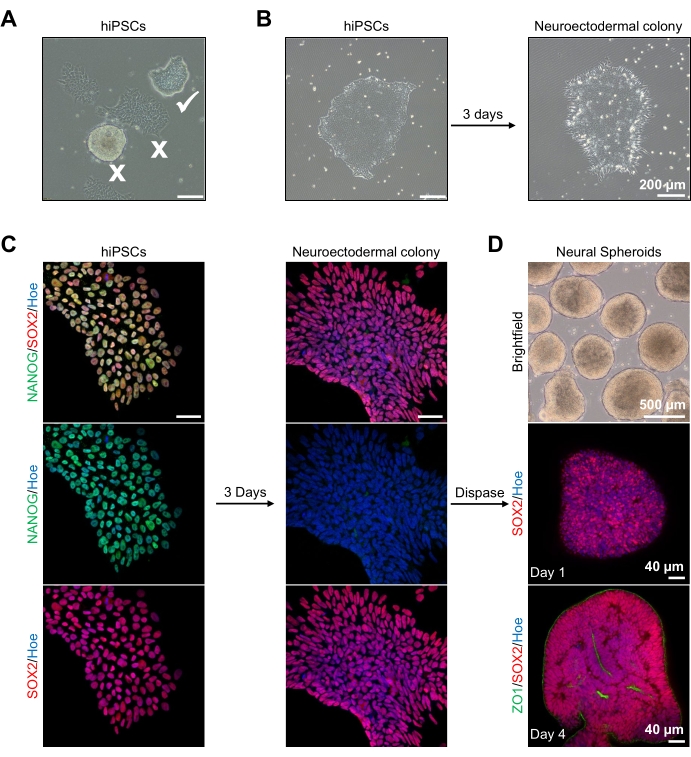
الشكل 2: توليد الكرويات العصبية المشتقة من المستعمرات العصبية الخارجية - hPSCs. (أ) صور تمثيلية ل PSC البشري تظهر الأمثل (القراد الأبيض) والمستعمرات المتباينة (الصليب الأبيض). شريط المقياس: 200 ميكرومتر، تكبير 4x. (ب) صورة تمثيلية لمستعمرة الجلد العصبي الخارجي المشتقة من hPSCs بعد 3 أيام من العلاجات المزدوجة لمثبطات SMAD. شريط المقياس: 200 ميكرومتر، تكبير 4x. (ج) تم تمييز مستعمرات PSC البشرية نحو مستعمرات عصبية الظاهرة. تمثل الصور تلطيخ مستعمرات PSC (في اليوم 1) و neuroectodermal (في اليوم 3) مع SOX2 (أحمر) ، NANOG (أخضر) ، تم تلطيخ جميع النوى ب Hoechst 33342 (أزرق). شريط المقياس: 40 ميكرومتر، تكبير 100x. (د) صور تظهر مراحل تطور كرويات الدماغ القشرية بمرور الوقت في الثقافة في المختبر تحت برايتفيلد، ومناعية كاملة ملطخة ب SOX2 (أحمر) في اليوم الأول، ومزدوجة ملطخة بالمناعة مع SOX2 (أحمر) و ZO1 (أخضر) في اليوم الرابع. شريط المقياس للصورة الساطعة هو 500 ميكرومتر ، تكبير 4x ، أشرطة المقياس للصور السفلية هي 40 ميكرومتر ، تكبير 20x. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
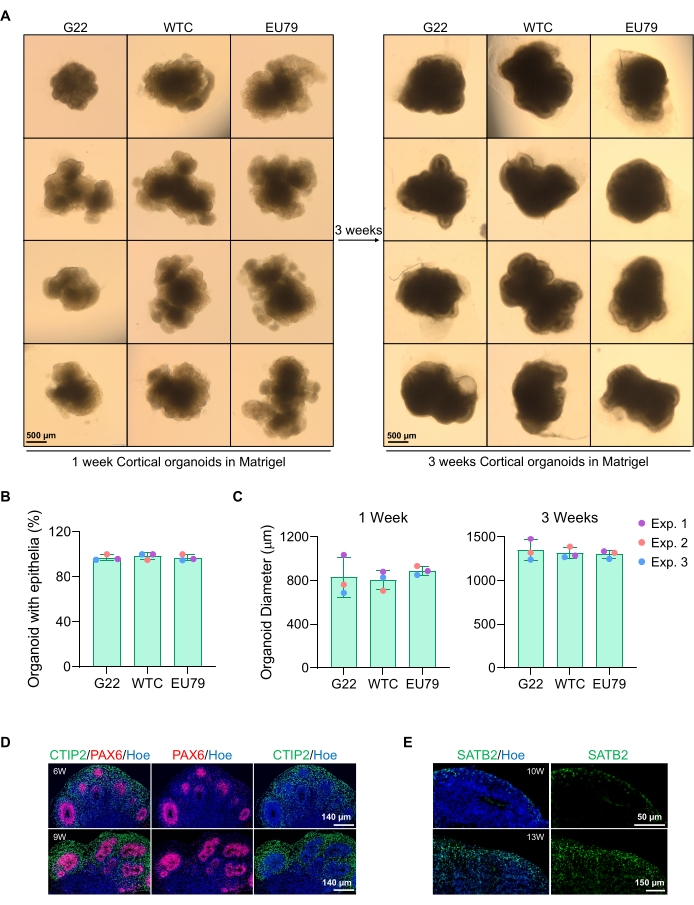
الشكل 3: توصيف عضويات الدماغ القشرية المشتقة من خطوط hPSC المختلفة. (أ) صور تمثيلية للعضويات القشرية في الدماغ المشتقة من خطوط iPSC البشرية G22 و WTC و EU79 المستزرعة على مدار 3 أسابيع في المختبر. شريط المقياس لجميع الصور هو 500 ميكرومتر ، تكبير 2x. (ب) النسب المئوية للتوليد الناجح للعضويات القشرية في الدماغ في 3 أسابيع من التمايز في المختبر في خطوط hPSC المختلفة (G22 و WTC و EU79). N = 3. يتم تقديم البيانات كمتوسط ± الانحراف المعياري. (ج) الرسوم البيانية الشريطية التي تبين نمو عضويات الدماغ القشرية (استنادا إلى متوسط القطر) في الأسبوعين 1 و 3 من التمايز في المختبر في خطوط مختلفة من خطوط الخلايا الجذعية البشرية متعددة القدرات (G22 و WTC و EU79). N = 3. يتم تقديم البيانات كمتوسط ± الانحراف المعياري. (د) صور تمثيلية لأجزاء من عضويات الدماغ القشرية البالغة من العمر 6 أسابيع و 9 أسابيع المشتقة من G22 hPSCs ، الملطخة بالمناعة لمنطقة البطين PAX6 (الحمراء) والصفيحة القشرية CTIP2 (الأخضر). تم تلطيخ جميع الأقسام ب Hoechst 33342 (أزرق). شريط المقياس = 140 ميكرومتر، تكبير 20x. W هو الأسبوع. (ه) صور تمثيلية لأجزاء من عضويات الدماغ القشرية التي يبلغ عمرها 10 أسابيع و 13 أسبوعا والمشتقة من hPSCs التابعة لمركز التجارة العالمي، والملطخة بالمناعة للطبقة القشرية IV SATB2 (الخضراء). تم تلطيخ جميع الأقسام ب Hoechst 33342 (أزرق). شريط مقياس الصورة لمدة 10 أسابيع = 50 ميكرومتر، تكبير 40x. شريط مقياس الصورة لمدة 13 أسبوعا = 150 ميكرومتر، تكبير 40x. W هو الأسبوع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
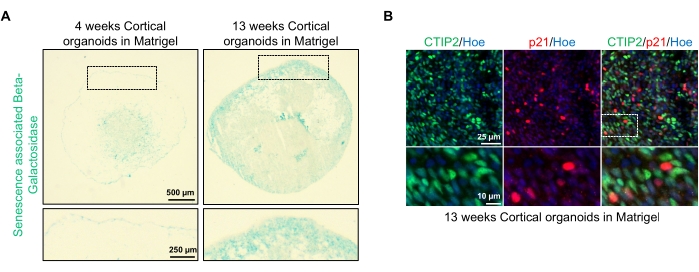
الشكل 4: توصيف الشيخوخة في عضويات الدماغ القشرية المشتقة من hPSCs. (أ) صور تمثيلية لأقسام من عضويات الدماغ القشرية البشرية المشتقة من hPSCs التابعة لمركز التجارة العالمي المستزرعة لمدة 4 و 13 أسبوعا في المختبر والملطخة ب SA-β-gal. شريط المقياس = 500 ميكرومتر، شريط مقياس الصور المكبرة = 250 ميكرومتر، التكبير 4x. يشير المربع المنقط إلى صورة مكبرة. (ب) صور تمثيلية لأقسام من عضويات دماغية قشرية عمرها 13 أسبوعا مشتقة من EU79 hPSCs البشرية ، ملطخة بالمناعة للخلايا العصبية القشرية CTIP2 (أخضر) و p21 (أحمر). تم تلطيخ جميع الأقسام ب Hoechst 33342 (أزرق). شريط المقياس = 25 ميكرومتر، شريط مقياس الصور المكبرة = 10 ميكرومتر، تكبير 40x. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مكونات الوسائط | تركيز |
| DMEM مزيج المغذيات F12 10x 500 مل (DMEM / F-12) | |
| N2 الملحق 5 مل (100x) | زائد بنسبة 1٪ |
| B 27 ملحق 10 مل | مكمل بنسبة 2٪ |
| محلول الأحماض الأمينية غير الأساسية MEM (100x) | مكمل بنسبة 1٪ |
| البنسلين الستربتومايسين (10000 وحدة / مل) | مكمل بنسبة 1٪ |
| 2-ميركابتوإيثانول 50 مل (1000x) | مكمل بنسبة 0.1٪ |
الجدول 1: N2 متوسط. يسرد الجدول الكواشف المطلوبة لإعداد وسيط N2.
| مكونات الوسائط | تركيز |
| DMEM مزيج المغذيات F12 10x 500 مل (DMEM / F-12) | وسائط DM مصنوعة بنسبة 1:1 من DMEM / F12 والوسائط العصبية القاعدية |
| الوسط العصبي القاعدي | |
| N2 الملحق 5 مل (100x) | نسبة 0.5٪ |
| B 27 ملحق 10 مل | مكمل بنسبة 1٪ |
| محلول الأحماض الأمينية غير الأساسية MEM (100x) | مكمل بنسبة 1٪ |
| جلوتاماكس الملحق 100x | مكمل بنسبة 1٪ |
| البنسلين الستربتومايسين (10000 وحدة / مل) | مكمل بنسبة 1٪ |
| محلول الأنسولين المؤتلف البشري | 12.5 ميكرولتر ل 50 مل من الوسائط |
| 2-ميركابتوإيثانول 50 مل (1000x) | 17.5 ميكرولتر ل 50 مل من الوسائط |
الجدول 2: وسيط التمايز (DM). يسرد الجدول الكواشف اللازمة لإعداد وسيط التمايز.
فيديو تكميلي 1. التصوير الحي لتحويل ورقة / مستعمرة hNEct 2D المستحثة إلى 3D تحت علاج bFGF. تم فصل المستعمرات المستحثة من hNEct بلطف عن الطبق مع dispase كما هو موضح أعلاه ونقلها إلى لوحة ثقافة منخفضة التعلق 6 آبار. تم تحويل مستعمرات 2D hNEct إلى كرويات hNEct ثلاثية الأبعاد في غضون 12 ساعة. تم التقاط الصور التسلسلية كل 5 دقائق. شريط المقياس = 100 ميكرومتر. يرجى النقر هنا لتنزيل هذا الفيديو.
لتمكين استخدام المواد العضوية الدماغية المشتقة من hPSC في فحص الأدوية ونمذجة الأمراض ، من الأهمية بمكان صنع المواد العضوية باتباع بروتوكول15 قابل للتكرار وموثوق به. عادة ما يتم توليد عضويات الدماغ من الأجسام الجنينية المشتقة من hPSCs ، والتي يتم تضمينها بعد ذلك في مصفوفة خارج الخلية تعزز توسع الأنسجة والتمايز العصبي. عند مقارنتها ببروتوكولات مثل لانكستر1،16،17 و Velasco18 ، والتي تبدأ من الأجسام الجنينية وتسمح بمسار التمايز الافتراضي الذي تتبعه المواد العضوية النامية ، وجدنا أن البدء في إنشاء عضويات الدماغ القشرية مع خلايا NEct البشرية بدلا من الأجسام الجنينية يحسن اتساق تكوين العضوية القشرية في الدماغ. وبالتالي يسمح هذا أيضا بالتحجيم المطلوب لفحص الأدوية والنمط الظاهري. نظرا لأنه لا يمكن توسيع خلايا NEct البشرية إلى كميات كبيرة فحسب ، بل يمكن أيضا حفظها بالتجميد بسهولة ، فإن هذا النهج يحسن أيضا من قابلية التكرار بين التجارب. وتجدر الإشارة أيضا إلى أنه بالمقارنة مع البروتوكولات الأخرى التي اعتمدت استخدام المفاعلات الحيوية والتكنولوجيات المماثلة، لا توجد حاجة إلى معدات متخصصة لهذا البروتوكول، مما يجعله مناسبا لأي مختبر6. وأخيرا ، يتم تقليل الوقت اللازم لتوليد المواد العضوية الناضجة التي تكون إيجابية لعلامات الطبقة القشرية مثل SATB2 مقارنة بكل من بروتوكولات لانكستر 1 والمفاعل الحيوي 6,19 مما يجعلها أكثر ملاءمة لدراسة المسار التنموي لتطور القشرة البشرية في الصحة والأمراض 1,6,16.
وعلاوة على ذلك، وبالنظر إلى تأثير الرعاية الصحية العالمية المتزايد باستمرار للأمراض المرتبطة بالشيخوخة مثل الخرف، والتي ترتبط بزيادة أنواع الخلايا الشائخة في الدماغ التي تسهم في الإمراض، فإن القدرة على تحديد واختبار المركبات التي يمكن أن تخفف من شيخوخة الدماغ هي ذات أهمية هائلة. على الرغم من أنه من المعروف أن hPSCs يتم تجديدها بشكل لاجيني خلال عملية إعادة البرمجة20 ، إلا أننا نجد زيادات قوية في الخلايا الشائخة في عضويات الدماغ القشرية المزروعة لفترات طويلة من الزمن. هذا تطور واعد يمكن الآن من فحص الأدوية التي تقضي على هذه الخلايا الشائخة من الدماغ (senolytics) أو التي تبطئ هذه العملية (senostatics)21. وبما أن عضويات الدماغ القشرية المشتقة من NEct البشري هي من أصل بشري ، فمن المرجح أن يؤدي هذا النهج إلى تقصير المسار التقليدي لتسويق مثل هذه العلاجات الجديدة.
هناك خطوتان حاسمتان في هذا البروتوكول. الأول هو المستوى الصحيح من التقاء مستعمرات hPSC في وقت التمايز. يجب أن تكون مستعمرات hPSC ملتقية بنسبة 30٪ على الأكثر لضمان عدم اندماج مستعمرات NEct المتولدة مع المستعمرات المجاورة وأن تكون المواد العضوية الفردية مدفوعة باستنساخ. تتضمن الخطوة الحرجة الثانية الاستخدام الصحيح للديسباز لرفع مستعمرات NEct وإنتاج الكرويات العصبية. توقيت الحضانة مع dispase أمر بالغ الأهمية للجودة النهائية للكرويات العصبية المتولدة. وذلك لأن التعرض المفرط للمستعمرات مع dispase سام للخلايا22 ويؤثر في النهاية على جودة المواد العضوية المتولدة. الحد من هذا البروتوكول هو أنه من الصعب التحكم في حجم الكرويات العصبية لأنه يعتمد على حجم المستعمرات الأولية التي يتم رفعها مع dispase. ومع ذلك ، يمكن التغلب على هذه المشكلة عن طريق اختيار الكرويات العصبية ذات الحجم المماثل عند المتابعة إلى مرحلة التضمين.
وأخيرا، يمكن أن تمتد التطبيقات المستقبلية إلى استخدام هذه المواد العضوية القشرية القابلة للتكرار في التحليل الروبوتي ونهج الفحص الصيدلاني الحيوي المستخدمة عادة في تلك الصناعة. ويدعم ذلك بيانات أولية من مختبرنا تشير إلى أن توليد عضويات الدماغ القشرية من خلايا NEct البشرية يمكن أن يكون آليا بسهولة ، مما يجعله متوافقا مع هذه الأساليب.
ليس لدى المؤلفين ما يكشفون عنه.
يتم دعم هذا العمل من قبل صندوق مستقبل البحوث الطبية - البحوث المعجلة ، وبعثة ماسيمو الرائدة في حثل المادة البيضاء (EPCD000034) ، وصندوق مستقبل البحوث الطبية - بعثة الخلايا الجذعية (APP2007653). يود المؤلفون أن يشكروا الدكتور جو هيون لي (جامعة كوريا) على توليد البيانات في الفيديو التكميلي 1.
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved