Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
Robust og meget reproducerbar generation af kortikale hjerneorganoider til modellering af hjernens neuronale ældning in vitro
I denne undersøgelse giver vi en detaljeret teknik til et simpelt, men robust kortikalt organoidkultursystem ved hjælp af standard feederfrie hPSC-kulturer. Dette er en hurtig, effektiv og reproducerbar protokol til generering af organoider, der modellerer aspekter af hjerneældning in vitro.
Hjerneorganoider er tredimensionelle modeller af den udviklende menneskelige hjerne og giver en overbevisende, banebrydende platform til sygdomsmodellering og storstilet genomisk og lægemiddelscreening. På grund af den selvorganiserende karakter af celler i hjerneorganoider og det voksende udvalg af tilgængelige protokoller til deres generation er der identificeret problemer med heterogenitet og variabilitet mellem organoider. I dette protokolpapir beskriver vi en robust og replikerbar protokol, der stort set overvinder disse problemer og genererer kortikale organoider fra neuroektodermale forfædre inden for 1 måned, og som kan opretholdes i mere end 1 år. Denne meget reproducerbare protokol kan let udføres i et standard vævskulturrum og resulterer i organoider med en rig mangfoldighed af celletyper, der typisk findes i den udviklende menneskelige cortex. På trods af deres tidlige udviklingsmæssige sammensætning vil neuroner og andre menneskelige hjernecelletyper begynde at udvise de typiske tegn på ældning i neuronale celler efter langvarig in vitro-kultur , hvilket gør dem til en værdifuld og nyttig platform til at studere aldringsrelaterede neuronale processer. Denne protokol skitserer også en metode til påvisning af sådanne senescente celler i kortikale hjerneorganoider ved anvendelse af ældningsassocieret beta-galactosidasefarvning.
Vores nuværende viden om den menneskelige hjerne har i høj grad været baseret på dyremodeller og post mortem hjerneprøver. Stamcellebiologi er et hurtigt fremadskridende felt, der giver ny indsigt i den grundlæggende biologi i menneskelig hjerneudvikling og de patologiske drivkræfter for menneskelige hjernesygdomme. Humane pluripotente stamceller (hPSC'er) er et uvurderligt værktøj til modellering af den menneskelige hjerne via generering af organoider, organlignende tredimensionelt (3D) væv, der typisk rekapitulerer udviklingsbanerne, cellulær sammensætning og arkitektur i den udviklende menneskelige hjerne. Hjerneorganoider er selvsamlede og sammensat af neurale stamceller, specificerede neurale forfædre, modne neuroner og gliacelletyper. Organoider giver derfor en unik mulighed for at studere den tidlige menneskelige hjerne, som ofte er utilgængelig for direkte eksperimentering, men også har iboende begrænsninger såsom fraværet af vaskulatur og et immunsystem.
Metoder til at generere hjerneorganoider er blevet forfulgt på to forskellige måder: uguidet og guidet differentiering. Uguidede hjerneorganoidmetoder er afhængige af den spontane iboende differentieringskapacitet af stamcellerne, der driver vævsmorfogenese 1,2 og giver mulighed for fremkomsten af en række cellelinjeidentiteter lige fra forhjerne, mellemhjernen og baghjernen til choroid plexus, nethinden og mesoderm. I modsætning hertil kræver guidede hjerneorganoidmetoder betydelig brug af eksterne faktorer til at drive hPSC'er mod den ønskede mønsterdannelse af neuronale afstamninger, der repræsenterer en hjerneregionstype, såsom mediale ganglionic eminence3, forhjerne4, mellemhjerne5, hypothalamus6, cerebellum7 og choroid plexus8. Denne evne til at generere forskellige hjerneområder med forskellige cellelinjer og potentialet til at smelte disse efter ønske gør hjerneorganoider til en fremragende model til at undersøge menneskelig hjerneudvikling og dechiffrere de underliggende mekanismer for hjernerelaterede sygdomme. Selvom disse metoder til generering af hjerneorganoider tilbyder et gennembrud i modellering af menneskelige hjerneområder, forbliver variabiliteten og heterogeniteten mellem organoider en betydelig begrænsning for systematiske og kvantitative undersøgelser, såsom lægemiddelscreening.
Den nuværende protokol er baseret på en metode udviklet i vores nylige papir9 og involverer selektiv differentiering af hPSC-kolonier mod neuroektoderm (NEct) identitet med dobbelte SMAD-hæmmere (SB-431542 og LDN 193189), som derefter har evnen til selvorganisering inden for 4 dage i 3D neuroepithelium sfæroider under påvirkning af FGF2-signalering. Disse neuroepithelium sfæroider genererer pålideligt homogene kortikale organoider med en in vivo-lignende cellulær sammensætning inden for 4 uger efter differentiering. Protokollen beskrevet her er bygget på vores tidligere resultater, der viser, at hæmning af dobbelt SMAD (Suppressor of Mothers Against Decapentaplegic) signalering fremmer differentieringen af hPSC'er mod rostral neurale stamceller afledt af neuroektodermale forfædre10 ved blandt andet at hæmme endodermal, mesodermal og trophectoderm celle skæbne valg11 . Desuden udløser indlejringen af neuroepitheliumsfæroider i den hESC-kvalificerede kældermembranmatrix signifikant spirende af neuroepithelia og danner ventrikler med apicobasal polaritet. Storskala kultur viste reproducerbarhed og homogenitet af kortikale organoider uafhængigt af cellelinjer, kloner eller batcher og repræsenterer således et pålideligt og stabilt stamcellesystem til at efterligne tidlig human kortikal udvikling i sundhed og sygdom in vitro. Vi skitserer yderligere en protokol til påvisning af senescente neuronale cellemarkører i hPSC-afledte kortikale hjerneorganoider, der er blevet dyrket i længere perioder.
Efter plettering af hPSC'er med en såtæthed på 20% -30% behandles cellerne med dobbelte SMAD-hæmmere i 3 dage for at differentiere hPSC-kolonier mod neuroektodermale kolonier. Disse kolonier løftes derefter forsigtigt med dispase og podes i ultralave fastgørelsesplader med 6 brønde suppleret med FGF2. De flydende 2D-kolonier organiserer sig selv i 3D neuroektodermale sfæroider natten over og opretholdes i 4 dage i N2-medium suppleret dagligt med FGF2. Når sfæroiderne har etableret det neuroepiteliske lag, kan de indlejres i kældermembranmatrixen. Ved rutinemæssigt at tilføje frisk terminal differentieringsmedium vil forskerne observere progressiv ekspansion og spirende neuroepithelia i kortikale organoider. Forskere ønsker måske at dissociere disse organoider for at udføre transkriptionel og proteomisk profilering. Derudover anbefales brightfield-billeddannelse til overvågning af kvaliteten af de kortikale organoider. Analyse kan udføres ved fiksering, kryosektion og immunostaining. Beskrivelser og metoder for disse teknikker er tidligere beskrevet12. I sidste ende giver denne protokol forskere mulighed for hurtigt og robust at generere homogene kortikale hjerneorganoider til modellering af den udviklende menneskelige kortikale hjerne med lave omkostninger og begrænset udstyr og til at studere aspekter af cellulær neuronal ældning, som beskrevet i dette papir.
1. Kortikale hjerneorganoider generation
BEMÆRK: Alle trin i dette afsnit af protokollen vil forekomme i en klasse 2 biosikkerhedshætte, medmindre andet er angivet.
- Induktion af 2D neuroektodermale kolonier fra hPSC 2D-kultur (dag -1 til 3)
- Før induktion skal hPSC-kolonierne plades på en hESC-kvalificeret kældermembranmatrix i en 6-brønds plade ved 20% -30% densitet. Opnå denne tæthed ved at passere hPSC-kolonier fra en brønd af en 6-brøndplade ved 60% sammenløb til tre brønde af en 6-brøndplade.
- Til kældermembranmatrixbelægning fortyndes kældermembranmatrixen i et forhold på 1:50 i et almindeligt basalmedium. Aflejr 1 ml /brønd af en 6-brøndplade jævnt, inkuberes i 1 time ved stuetemperatur (RT), og aspirer derefter.
- Vedligehold hPSC-kolonier i 1 dag i 2 ml serumfrit cellekulturmedium inden differentiering.
- På dagen for hPSC-differentiering skal du inspicere hPSC-kolonierne ved hjælp af brightfield-mikroskopi ved 4x til 10x forstørrelse for at sikre sunde kolonier uden påviselig differentiering.
BEMÆRK: Sunde hPSC'er vil danne tætte kantkolonier med celler, der har en stor kerne, meget lille cytoplasma og fremtrædende nukleoler. Differentierede iPSC-kolonier vil udvise klare morfologiske forskelle i forhold til de beskrevne hPSC-kolonier ovenfor, især omkring koloniernes ydre kanter eller i midten. - Der tilsættes reagenser, der er anført i tabel 1 , for at danne det N2-substrat, der kræves til differentiering. Bring dette medium til RT før brug.
- Når det er ved RT, aspireres det serumfrie cellekulturmedium fra hver brønd i 6-brøndpladen og udskiftes med 2 ml N2-medium, der forsigtigt tilsættes med en 5 ml serologisk pipette.
- Tilsæt de dobbelte SMAD-hæmmere, SB-431542 (10 μM) og LDN 193189 (100 nM).
BEMÆRK: SMAD-hæmmerne kan tilsættes til N2-substratet, efter at mediet er anbragt i hver brønd, eller til den krævede mængde N2-medium inden udskiftning af det serumfrie cellekulturmedium. Inhibitorer kan inkorporeres jævnt i mediet ved forsigtigt at hvirvle pladen eller invertere røret indeholdende mediet og hæmmerne 3-4 gange. - Tilsæt friske N2-medier suppleret med SB-431542 (10 μM) og LDN 193189 (100 nM) dagligt til hver brønd i de næste 2 dage.
BEMÆRK: Frisk N2-medium tilsættes for at reducere den langvarige eksponering af celler for DMSO, der bruges til at opløse SB-431542 og LDN 193189 forbindelser og forhindre cytotoksicitet.
- Generering af 3D neuroektodermale sfæroider fra inducerede 2D neuroektodermale kolonier (dag 3 til 7)
- De inducerede neuroektodermale kolonier løftes ved hjælp af dispase i følgende trin 1.2.2-1.2.8.
- Fjern først 2 ml N2-medium fra 6-brøndpladen, og vask 1x med HBSS for at sikre, at hele N2-mediet fjernes.
BEMÆRK: N2-medium kan forstyrre enzymaktiviteten af dispase, hvilket forhindrer tilstrækkelig løsrivelse af neuroektodermale kolonier fra brønden. - Der tilsættes 1 ml 2,4 enhed/ml dispase til hver koloniholdig brønd.
- Inkuber brønden i 20-25 min (maks. 30 min) ved 37 °C. Kontroller regelmæssigt for koloniløsning.
BEMÆRK: Små kolonier kan løsne sig inden for 20 min. Eventuelle kolonier, der sidder fast efter 30 minutter, bør ignoreres. - Efter inkubation tilsættes 1 ml N2-medium til brønden for at stoppe dispaseenzymets aktivitet og overføre kolonierne til et 15 ml rør ved hjælp af en bredboret P1000 pipettespids eller en modificeret P1000 pipettespids skåret med steril saks (hvilket gør det til en bredboret P1000-spids).
- Lad koloniklumperne synke til bunden af røret med tyngdekraften.
BEMÆRK: Denne proces tager ca. 1 minut. - Når klumperne er sunket, skal du forsigtigt fjerne supernatanten med en standard P1000 pipettespids og erstatte den med 1 ml frisk N2-medium. Gentag dette vasketrin tre gange for at sikre fuldstændig fjernelse af dispase.
BEMÆRK: Enhver resterende dispase vil forhindre en ensartet dannelse af neuroektodermale sfæroider og inducere celledød. - Efter vask skal celleklumperne resuspenderes i 3 ml N2-medium og overføres til en brønd på en 6-brøndplade og tilsættes 40 ng / ml bFGF.
BEMÆRK: Hvis et stort antal neuroektodermale kolonier blev løsrevet, kunne disse kolonier belagt over to eller flere brønde i en 6-brøndplade for at forhindre sfæroidfusion. 24 timer efter dispase løsrivelse af kolonierne skal du kontrollere, om sfæroiderne er dannet. - Vedligehold sfæroiderne i de samme medier i de næste 3-4 dage, men tilføj frisk bFGF (40 ng / ml) til hver brønd dagligt for at fremme neuroektodermal celleproliferation, selvorganisering og inducere og udvide neuroepithelia.
BEMÆRK: Hvis sfæroider er blevet belagt med en højere densitet, vil mediet sandsynligvis blive gult og kræve udskiftning hver 2. dag med frisk bFGF (40 ng / ml). Dette anbefales dog ikke, og i stedet bør et lavere antal sfæroider opretholdes i hver brønd for at undgå dette problem. Sfæroider kan indlejres i kældermembranmatrixen efter 3 dage, hvis neuroepithelia er tydelige. Hvis neuroepithelia ikke er tydelig eller ikke ser stærk ud, skal du vedligeholde sfæroiderne i en anden dag og kontrollere igen.
- Kortikal hjerneorganoid differentiering og vedligeholdelse (dag 8)
- Terminaldifferentieringsmediet (DM) fremstilles ved hjælp af de reagenser, der er anført i tabel 2. Bring dette medie til RT.
- Optø 100% hESC-kvalificeret kældermembranmatrix på is.
- Forbered et ark parafilm med fordybninger steriliseret med 70% ethanol i en 10 cm petriskål og læg den på et stereomikroskop under en hætte.
BEMÆRK: En tom bakke med 200 μL pipettespidser kan bruges til at generere et gitter af fordybninger. - Skær enden af en 100 μL pipettespids (for at gøre den bredboret). Dette vil blive brugt til indlejring af neurale sfæroider i kældermatrixen uden at bryde dem.
- Brug et stereomikroskop til at vælge neurale sfæroider af samme størrelse (500 μm) fra 6-brøndpladen og overføre dem til parafilm-fordybningerne ved hjælp af den brede 100 μL pipettespids og placere en enkelt neural sfæroide pr. Fordybning.
- Fjern forsigtigt overskydende medier, og efterlad lige nok til at dække sfæroiderne.
BEMÆRK: Dette er for at opretholde kvaliteten af sfæroiderne, før du tilføjer kældermatrixen og for at sikre, at de ikke tørrer ud. - Tilsæt forsigtigt 18 μL kældermatrix over sfæroidet, og placer sfæroidet i midten af matrixfaldet. Brug enden af en 10 μL pipettespids til at centrere sfæroiderne i matrixen.
BEMÆRK: Prøv at tilføje kældermatrixen så hurtigt som muligt for at undgå, at de overskydende medier omkring sfæroiderne tørrer ud. - Dæk 10 cm petriskålen og overfør den til inkubatoren og inkuber parafilmskålen med kældermatrixindlejrede sfæroider ved 37 ° C i 25 min.
- Efter inkubation skylles de indlejrede sfæroider af i en lav fastgørelsesplade med 24 brønde ved hjælp af en P1000-spids med 0,5 ml DM-mediet, og sørg for, at individuelle indlejrede sfæroider placeres i en brønd hver.
BEMÆRK: Hvis mere end en indlejret sfæroid falder i en brønd, skal du bruge en bredboret P1000-spids til at overføre den anden sfæroid til en ny brønd. - Oprethold de differentierede kortikale hjerneorganoider i DM-medierne i længere perioder, med medieændringer, der forekommer hver 2. dag, når organoiderne bliver større og ældre.
BEMÆRK: I løbet af den første uge med differentiering kan mediet ændres hver 3. dag.
2. Karakterisering af neuronal aldring hos kortikale organoider
- Behandle kortikale organoider til kryosektion:
BEMÆRK: Trinene blev udført i en klasse 2 biosikkerhedshætte.- Forbered 2 ml rør, hver fyldt med 1,5 ml 4% paraformaldehyd (PFA).
- Skær enden af en P1000 pipettespids (for at gøre den til en bredboring), og overfør forsigtigt hver organoid til et af de 2 ml rør, der er fremstillet ovenfor (en organoid pr. Rør).
BEMÆRK: For at forhindre overskydende DM-medier, der blandes med PFA, skal du lade organoiden synke mod åbningen af P1000-pipettespidsen og hvile spidsen lige over toppen af PFA i røret, før organoiden pipetteres ud. Dette vil gøre det muligt for forskeren at overføre kun organoid og meget minimale medier. - Lad fikseringsprocessen finde sted ved 4 ° C i 1 time.
- Brug en uklippet P1000 pipettespids til forsigtigt at opsuge overskydende PFA og tilsæt 1,5 ml kold 1x PBS.
- Overfør rørene til en orbitalryster indstillet til 70 o / min i 10 minutter ved RT.
- Gentag vaskeprocessen med kold 1x PBS tre gange for at sikre, at alle PFA er fjernet grundigt.
BEMÆRK: Bortskaf ikke PFA i almindelige affaldsbeholdere; Forbered i stedet en specifik kemikalieaffaldsbeholder til dette, da PFA er en fare. - Organoiderne nedsænkes i 1x PBS indeholdende 30% saccharose og inkuberes ved 4 °C, indtil alle organoider er sunket til bunden af røret.
BEMÆRK: Den tid, der kræves for at lade organoiderne synke, afhænger af organoidernes størrelse / alder. 3 måneder gamle organoider kan tage op til 5 timer. - Ved hjælp af en skåret, bredboret P1000 pipettespids overføres forsigtigt tre til fem organoider til en monteringsform, der indeholder en monteringsopløsning lavet af 30% saccharose og 100% optimal skæretemperatur (OCT) medium i et forhold på 3: 2.
- Brug en 10 μL pipettespids ved hjælp af et stereomikroskop til at orientere og placere organoider i et gitterlignende mønster.
- Formen anbringes på tøris for at størkne OCT-saccharoseopløsningen, inden der fortsættes med kryosektion (16-20 μm) ved hjælp af en kryostat.
BEMÆRK: For ældningsassocieret beta-galactosidase skal alle væv behandles til sektionering, når de er sunket. Til immunfluorescens kan væv behandles til sektionering den næste dag. Alle dias, der indeholder sektioner, skal opbevares ved -20 °C før efterfølgende immunfluorescens eller beta-galactosidase, hvis de ikke straks farves.
- Proces til analyse af ældning i de kortikale hjerneorganoider:
BEMÆRK: Følgende trin kan udføres på en almindelig laboratoriebænk.- Overfør diasene til en mikroskopglasfarvningsbeholder med låg, og vask det sektionerede organoidvæv tre gange med 1x PBS i 10 minutter ved RT for at fjerne overskydende monteringsopløsning.
- Herefter inkuberes det vaskede væv med frisklavet beta-galactosidase-farvningsopløsning natten over ved 37 °C.
BEMÆRK: Beta-galactosidasefarvningsopløsningen er lavet af phosphatbuffer (for 10 ml phosphatbuffer: 8,15 ml 1 M NaH2PO4, 1,85 ml 1M Na2HPO4) justeret pH = 6, 100 mM kaliumhexacyanoferrat (III), 100 mM kaliumhexacyanoferrat (II) trihydrat, 5 M NaCl, 1 MMgCl2, 20 mg/ml X-Gal. Undgå at bruge en standard cellekulturinkubator indeholdende CO2, da CO2 vil ændre pH i beta-galactosidase-farvningsopløsningen. - Det farvede væv vaskes med 1x PBS tre gange i 10 minutter hver ved RT for at fjerne beta-galactosidaseopløsningen.
- Monter det vaskede væv med et glasantifadebeslag, og lad monteringsopløsningen størkne i 30 minutter ved RT, før den ses under mikroskopet.
Her har vi beskrevet en robust protokol, der gør det muligt for forskere at generere homogene hPSC-afledte kortikale hjerneorganoider, der efterligner den in vivo menneskelige kortikale hjerneregion inden for 1-3 måneders kultur. hPSC-kolonier dyrkes først i differentieringsmedier for at generere neuroektodermale kolonier, som derefter kan bruges til at danne neurale sfæroider. Disse sfæroider indlejres efterfølgende i en kældermembranmatrix og vedligeholdes i længere perioder for at producere organoider, der kan bruges til at modellere neuronal aldring (se figur 1 for en oversigt over protokollen). Det er værd at bemærke, at dyrkning af disse organoider i ultra-ubelagte 24-brøndplader forårsager cellulær stress og fremmer ældningsrelaterede fænotyper over 13 ugers in vitro-kultur . Organoider afledt af denne protokol kan også opretholdes i omrørte bioreaktorer for optimal vækst og differentiering af kortikale pladeneurale celler eller ved luft-væske-grænsefladen.
Til at begynde med dyrkes hPSC-kolonier i 1 dag før neuroektodermal differentiering. Det er afgørende, at disse hPSC-kolonier dyrkes til kun 20% -30% sammenløb og er af den højest mulige kvalitet: et tæt fladt monolag uden differentierede celler, der forurener kolonierne (figur 2A, B). HPSC-koloniernes pluripotens bør bekræftes ved ekspression af markører som NANOG (figur 2C). De validerede hPSC-kolonier udsættes derefter for N2 neuroektodermale differentieringsmedier med SB-431542 og LDN 193189. Efter 3 dages vedligeholdelse i dette medie skulle hPSC-kolonierne have differentieret sig til neuroektodermale kolonier og ikke længere vise den samme stramme flade monolagsmorfologi af hPSC'erne (figur 2B), men snarere vil de blive længere søjleformede celler (figur 2B). Disse celler vil også være negative for pluripotensmarkører såsom NANOG (figur 2C).
Det er på dette stadium, at de neuroektodermale kolonier er enzymatisk løsrevet med dispase, og hver sund og vellykket løsrevet koloni får lov til at organisere sig selv og danne en ung neural sfæroid (figur 2D, supplerende video 1). Kun sunde, rene neuroektodermale kolonier vil løsne sig inden for den tidsramme, der er angivet for dispaseaktivitet; alle andre kolonier bør ignoreres, da de vil resultere i en dårligere kvalitet af sfæroid. Med daglig eksponering for FGF2 i N2-medierne vil de neurale stamceller (SOX2+) i disse sfæroider (figur 2D, dag 1) sprede sig og danne et betydeligt antal neurale rosetter (figur 2D, dag 4). Disse rosetter vil udtrykke den tætte kryds- og epitelmarkør ZO1 i celler placeret inden for midten af rosetterne og langs den ydre kant af sfæroiden, hvilket viser sfæroidens apikal-basale polaritet (figur 2D, dag 4). Metoden til hel 3D-billeddannelse af sfæroider er beskrevet før13. Daglig inspektion af sfæroiderne skal belyse dannelsen af en stram, mørk ydre kant og lys periferi af sfæroider, dette er det neuroepiteliske lag. Dette lag skal være tilstrækkeligt dannet efter 3-4 dage med en omtrentlig diameter på 500 μm, på hvilket tidspunkt sfæroiderne kan indlejres i kældermatrixen. Hvis dette lag ikke er til stede eller kun er svagt dannet, er sfæroiderne ikke tilstrækkeligt udviklede nok til at tage fremad. Det anbefales at vente en anden dag for at observere enhver ændring, men hvis dette ikke overholdes, skal du se bort fra disse sfæroider.
Et repræsentativt brightfieldbillede af sfæroiderne efter 3 dages kultur kan ses i figur 2D. Sfæroider med et stramt neuroepitellag, der ikke er smeltet sammen med andre nabosfæroider, har halvgennemsigtigt væv og demonstrerer neural rosetdannelse, vælges at blive indlejret i kældermatrixen. Når den er indlejret, vil sfæroidet proliferere hurtigt og begynde at spire: knuder af kompakt væv vises og udvides udad fra sfæroidens hoveddel. Dette er tydeligt mellem 1-3 uger i kældermatrixen og kan observeres på tværs af flere cellelinjer (figur 3A). Kvantitativ analyse af de indlejrede sfæroider bekræfter tilstedeværelsen af epitelceller i op til 100% af sfæroider på tværs af tre forskellige cellelinjer, hvilket bekræfter homogeniteten og reproducerbarheden forventet af denne protokol (figur 3B). Kvantificeringen af organoiders diameter under in vitro-differentiering bekræfter yderligere reproducerbarheden på tværs af forskellige linjer af hPSC (figur 3C). Hvis spirende ikke forekommer, udvikler sfæroiderne sig ikke korrekt og bør kasseres. Når sfæroider er blevet indlejret i en matrix, skrider deres udvikling frem, og sfæroiderne kaldes nu organoider. Immunofluorescensfarvning bekræfter også tilstedeværelsen af neurale stamceller (PAX6) samt kortikale lagmarkører farvet med CTIP2 og SATB2 i organoiderne med klar lagdeling (figur 3D, E). Denne lagdeling kan observeres på tværs af forskellige tidspunkter for organoidvedligeholdelse (figur 3D, E). Metoden til immunohistokemi af væv er beskrevet før14.
En mulig anvendelse af disse organoider er at studere, hvordan neuronale aldringsrelaterede processer påvirker hjernen. For at undersøge dette høstes succesfuldt genererede organoider fra flere forskellige tidspunkter til sektionering og farvning for standard molekylære biomarkører for ældning, såsom ældningsassocieret beta-galactosidase og p21. Figur 4A viser et repræsentativt billede af ældningsassocieret beta-galactosidasefarvning af organoider 4 og 13 uger efter indlejring i kældermembranmatrixen. Mellem uge 4 og 13 er der en markant stigning i tilstedeværelsen af ældningsassocieret beta-galactosidase, hvilket tyder på, at cellulær ældning, en anerkendt driver for organismens aldring, har fundet sted i løbet af denne tid i kultur. Immunofluorescensfarvning af organoider i uge 13 bekræftede tilstedeværelsen af en anden ældningsmarkør, p21, sammenmærket med den modne kortikale neuronale markør (CTIP2) og kan ses i figur 4B. Det skal dog bemærkes, at tilstedeværelsen af p21 er en markør for cellecyklusstop og i sig selv ikke er en endelig ældningsmarkør, og påvisning af andre ældningsmarkører såsom p16 og SASP (ældningsassocieret sekretorisk fænotype) faktorer anbefales til endeligt at identificere celler som ældningskræfter.
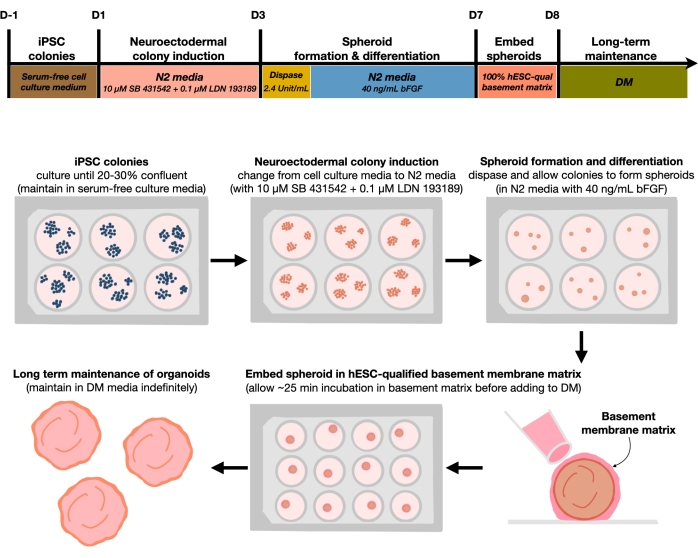
Figur 1: Skematisk diagram til generering af reproducerbare kortikale hjerneorganoider. Skematisk arbejdsgang af den eksperimentelle procedure til generering af kortikale hjerneorganoider fra hPSC'er, der opretholdes i det feederfrie medium. Arbejdsgangen giver et overblik over seks trin, der er involveret for at differentiere 2D-hPSC'erne til 3D-mønstrede kortikale plade humane væv i organoider. Klik her for at se en større version af denne figur.
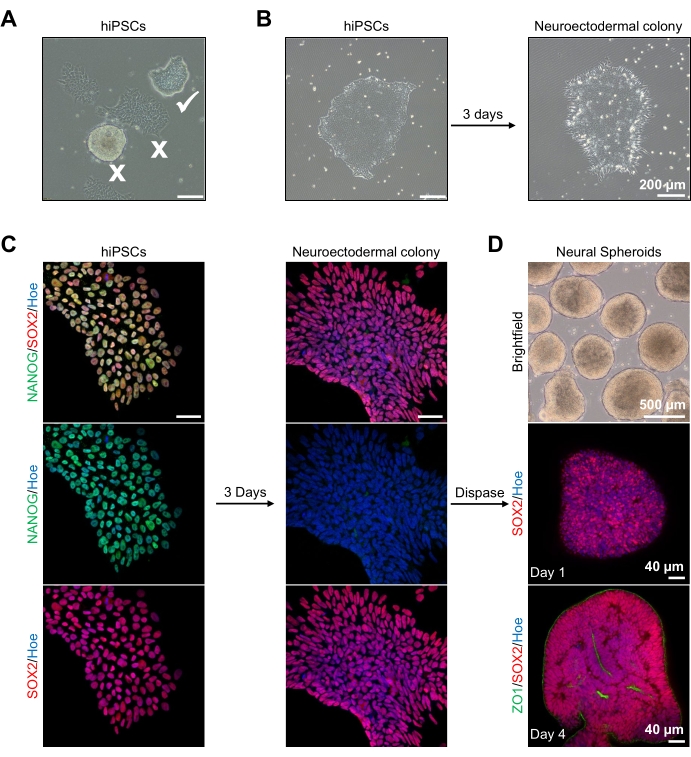
Figur 2: Generering af neurale sfæroider afledt af neuroektodermale kolonier-hPSC'er. (A) Repræsentative billeder af human PSC, der udviser optimal (hvidt kryds) og differentierede kolonier (hvidt kryds). Skalalinje: 200 μm, 4x forstørrelse. (B) Repræsentativt billede af neuroektodermal koloni afledt af hPSC'er efter 3 dages dobbelt SMAD-hæmmerbehandlinger. Skalalinje: 200 μm, 4x forstørrelse. (C) Humane PSC-kolonier blev differentieret mod neuroektodermale kolonier. Billeder repræsenterer farvning af PSC (på dag 1) og neuroektodermale (på dag 3) kolonier med SOX2 (rød), NANOG (grøn), alle kerner blev modvirket med Hoechst 33342 (blå). Skalalinje: 40 μm, 100x forstørrelse. (D) Billeder, der viser udviklingsstadierne af kortikale hjernesfæroider over tid i dyrkning in vitro under brightfield og helmount immunostained med SOX2 (rød) på dag 1 og dobbelt immunsplekteret med SOX2 (rød) og ZO1 (grøn) på dag 4. Skalabjælken for brightfield-billedet er 500 μm, 4x forstørrelse, skalabjælker på de nederste billeder er 40 μm, 20x forstørrelse. Klik her for at se en større version af denne figur.
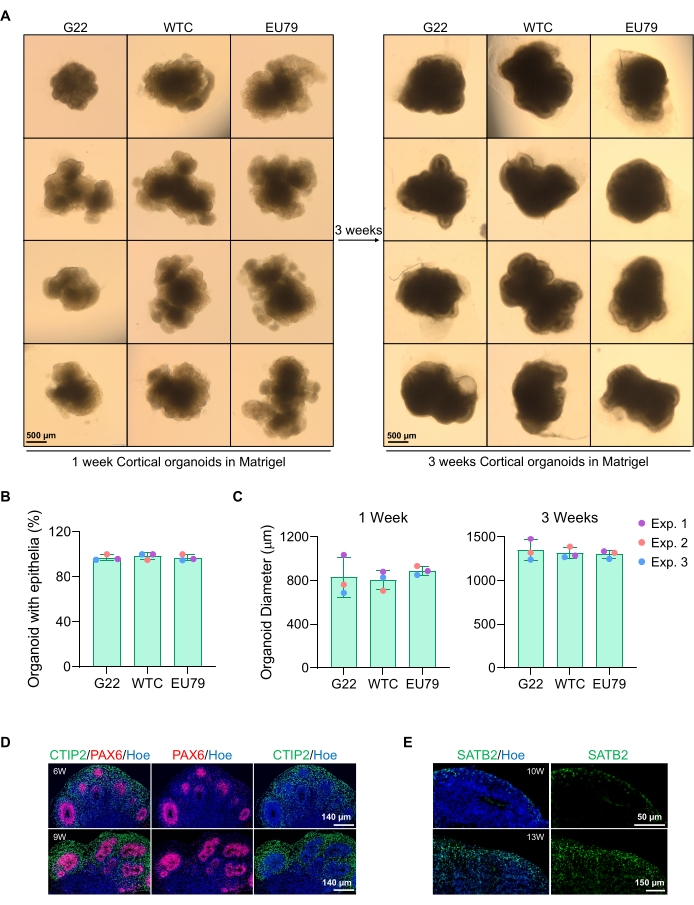
Figur 3: Karakterisering af kortikale hjerneorganoider afledt af forskellige hPSC-linjer. (A) Repræsentative billeder af kortikale hjerneorganoider afledt af G22-, WTC- og EU79 humane iPSC-linjer dyrket over 3 uger in vitro. Skalalinjen for alle billeder er 500 μm, 2x forstørrelse. (B) Procentdele af den vellykkede generation af kortikale hjerneorganoider efter 3 ugers in vitro-differentiering i forskellige hPSC-linjer (G22, WTC og EU79). N = 3. Data præsenteres som middelværdi ± standardafvigelse. (C) Søjlediagrammer, der viser væksten af kortikale hjerneorganoider (baseret på gennemsnitlig diameter) i uge 1 og 3 af in vitro-differentiering i forskellige linjer af humane pluripotente stamcellelinjer (G22, WTC og EU79). N = 3. Data præsenteres som middelværdi ± standardafvigelse. (D) Repræsentative billeder af sektioner af 6-ugers og 9 uger gamle kortikale hjerneorganoider afledt af G22 hPSC'er, immunostained til ventrikelzone PAX6 (rød) og kortikal plade CTIP2 (grøn). Alle sektioner blev imødegået med Hoechst 33342 (blå). Skala bar = 140 μm, 20x forstørrelse. W er uge. (E) Repræsentative billeder af sektioner af 10-ugers og 13-ugers gamle kortikale hjerneorganoider afledt af WTC hPSC'er, immunostained for kortikalt lag IV SATB2 (grøn). Alle sektioner blev imødegået med Hoechst 33342 (blå). 10 ugers billede Skalalinje = 50 μm, 40x forstørrelse. 13 ugers billede Skalalinje = 150 μm, 40x forstørrelse. W er uge. Klik her for at se en større version af denne figur.
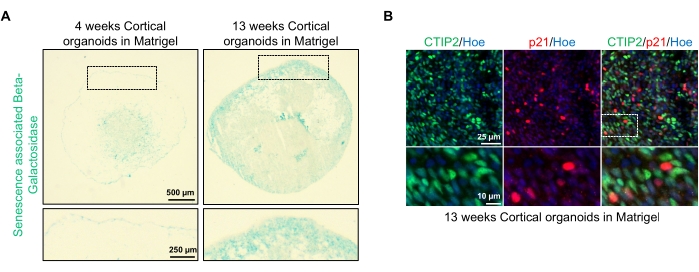
Figur 4: Karakterisering af ældning i kortikale hjerneorganoider afledt af hPSC'er. (A) Repræsentative billeder af sektioner af humane kortikale hjerneorganoider afledt af WTC hPSC'er dyrket i 4 og 13 uger in vitro og farvet med SA-β-gal. Skalabjælke = 500 μm, skalabjælke af zoomede billeder = 250 μm, 4x forstørrelse. Den stiplede boks angiver et forstørret billede. (B) Repræsentative billeder af sektioner af 13 uger gamle kortikale hjerneorganoider afledt af humane EU79 hPSC'er, immunostained for kortikale neuroner CTIP2 (grøn) og p21 (rød). Alle sektionerne blev imødegået med Hoechst 33342 (blå). Skalalinje = 25 μm, skalabjælke af zoomede billeder = 10 μm, 40x forstørrelse. Klik her for at se en større version af denne figur.
| Mediekomponenter | Koncentration |
| DMEM Næringsstof blanding F12 10x 500 ml (DMEM / F-12) | |
| N2 Tillæg 5 ml (100x) | Supplmenteret til 1% |
| B 27 Tillæg 10 ml | Suppleret med 2% |
| MEM ikke-essentielle aminosyrer Opløsning (100x) | Suppleret med 1% |
| Penicillin-Streptomycin (10.000 U/ml) | Suppleret med 1% |
| 2-Mercaptoethanol 50 ml (1000x ) | Suppleret med 0,1% |
Tabel 1: N2 Medium. Tabellen viser de reagenser, der kræves til fremstilling af N2-mediet.
| Mediekomponenter | Koncentration |
| DMEM Næringsstof blanding F12 10x 500 ml (DMEM / F-12) | DM-medier er lavet med 1: 1-forhold mellem DMEM / F12 og Neurobasal-medier |
| Neurobasalt medium | |
| N2 Tillæg 5 ml (100x) | Supplmenteret til 0,5% |
| B 27 Tillæg 10 ml | Suppleret med 1% |
| MEM ikke-essentielle aminosyrer Opløsning (100x) | Suppleret med 1% |
| GlutaMAX Supplement 100x | Suppleret med 1% |
| Penicillin-Streptomycin (10.000 U/ml) | Suppleret med 1% |
| Insulinopløsning Human rekombinant | 12,5 μL til 50 ml medier |
| 2-Mercaptoethanol 50 ml (1000x) | 17,5 μL til 50 ml medier |
Tabel 2: Differentieringsmedium (DM). Tabellen viser de reagenser, der kræves for at forberede differentieringsmediet.
Supplerende video 1. Levende billeddannelse af induceret hNEct 2D ark / koloni konvertering til 3D under behandling af bFGF. Inducerede kolonier af hNEct blev forsigtigt løsnet fra skålen med dispase som beskrevet ovenfor og overført til en lav vedhæftet 6-brønds kulturplade. 2D hNEct-kolonier blev konverteret til 3D hNEct-sfæroider inden for 12 timer. Serielle billeder blev taget hvert 5. minut. Skala bar = 100 μm. Klik her for at downloade denne video.
For at muliggøre brugen af hPSC-afledte hjerneorganoider i lægemiddelscreening og sygdomsmodellering er det afgørende at fremstille organoider efter en replikerbar og pålidelig protokol15. Hjerneorganoider genereres almindeligvis fra embryoide kroppe afledt af hPSC'er, som derefter indlejres i en ekstracellulær matrix, der fremmer vævsudvidelse og neural differentiering. Sammenlignet med sådanne protokoller som Lancasters 1,16,17 og Velasco 18, der begynder fra embryoide kroppe og tillader en standarddifferentieringsvej, der skal følges af de udviklende organoider, har vi fundet ud af, at påbegyndelse af kortikal hjerneorganoiddannelse med humane NEct-celler snarere end med embryoide kroppe forbedrer konsistensen af kortikal hjerneorganoiddannelse. Dette giver derfor også mulighed for den skalering, der kræves til lægemiddel- og fænotypisk screening. Da humane NEct-celler ikke kun kan udvides til betydelige mængder, men også let kan kryopreserveres, forbedrer denne tilgang også replikabiliteten mellem eksperimenter. Det skal også bemærkes, at sammenlignet med andre protokoller, der har vedtaget brugen af bioreaktorer og lignende teknologier, kræves der ikke specialudstyr til denne protokol, hvilket gør den velegnet til ethvert laboratorium6. Endelig reduceres den tid, der kræves for at generere modne organoider, der er positive for kortikale lagmarkører som SATB2, sammenlignet med både Lancaster1- og bioreaktorprotokoller 6,19, hvilket gør den mere velegnet til at studere udviklingsbanen for menneskelig kortikal udvikling inden for sundhed og sygdomme 1,6,16.
I betragtning af den stadigt voksende globale sundhedseffekt af aldringsrelaterede sygdomme som demens, der er forbundet med en stigning i senescente celletyper i hjernen, der bidrager til patogenese, er evnen til at identificere og teste forbindelser, der kan forbedre hjernens aldring, af enorm interesse. På trods af at hPSC'er er kendt for at være epigenetisk forynget under omprogrammeringsprocessen20, finder vi robuste stigninger i senescente celler i kortikale hjerneorganoider dyrket i længere perioder. Dette er en lovende udvikling, der nu muliggør screening af lægemidler, der eliminerer sådanne senescente celler fra hjernen (senolytika), eller som bremser denne proces (senostatika)21. Da humane NEct-afledte kortikale hjerneorganoider er af menneskelig oprindelse, vil denne tilgang sandsynligvis forkorte den traditionelle vej til markedsføring af sådanne nye terapier.
Der er to kritiske trin i denne protokol. Den første er det korrekte niveau af sammenløb af hPSC-kolonierne på differentieringstidspunktet. hPSC-kolonier må højst være 30% sammenløbende for at sikre, at genererede NEct-kolonier ikke smelter sammen med nabokolonier, og at individuelle organoider er klonalt drevet. Det andet kritiske trin involverer korrekt brug af dispase til at løfte NEct-kolonierne og producere de neurale sfæroider. Tidspunktet for inkubation med dispase er afgørende for den eventuelle kvalitet af de neurale sfæroider, der genereres. Dette skyldes, at overeksponering af kolonier med dispase er giftig for cellerne22 og i sidste ende påvirker kvaliteten af genererede organoider. Begrænsningen af denne protokol er, at det er vanskeligt at kontrollere størrelsen af de neurale sfæroider, fordi det afhænger af størrelsen af de oprindelige kolonier, der løftes med dispase. Dette problem kan dog løses ved at vælge neurale sfæroider, der er af samme størrelse, når du fortsætter til indlejringsfasen.
Endelig kan fremtidige anvendelser udvides til at omfatte brugen af disse reproducerbare kortikale organoider i robotanalyse og biofarmaceutiske screeningsmetoder, der typisk anvendes i denne industri. Dette understøttes af foreløbige data fra vores laboratorium, der indikerer, at dannelsen af kortikale hjerneorganoider fra humane NEct-celler let kan automatiseres, hvilket gør det kompatibelt med disse tilgange.
Forfatterne har intet at afsløre.
Dette arbejde støttes af Medical Research Future Fund-Accelerated Research, Leukodystrophy flagskib Massimo's Mission (EPCD000034), Medical Research Future Fund-Stem Cell Mission (APP2007653). Forfattere vil gerne takke Dr. Ju-Hyun Lee (Korea University) for at generere data i Supplerende video 1.
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved