Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
דור חזק וניתן לשחזור של אורגנואידים במוח קליפת המוח למידול סנסנציה עצבית במוח במבחנה
במחקר זה, אנו מספקים טכניקה מפורטת למערכת תרבית אורגנואידים פשוטה אך חזקה בקליפת המוח באמצעות תרביות hPSC סטנדרטיות ללא הזנה. זהו פרוטוקול מהיר, יעיל וניתן לשחזור ליצירת אורגנואידים המדגימים היבטים של סנסנציית המוח במבחנה.
אורגנואידים במוח הם מודלים תלת-ממדיים של המוח האנושי המתפתח ומספקים פלטפורמה משכנעת וחדשנית למידול מחלות ולסינון גנומי ותרופות בקנה מידה גדול. בשל האופי המארגן את עצמו של תאים באורגנואידים במוח והמגוון ההולך וגדל של פרוטוקולים זמינים לדורם, זוהו בעיות עם הטרוגניות ושונות בין אורגנואידים. במאמר פרוטוקול זה אנו מתארים פרוטוקול חזק וניתן לשכפול שמתגבר במידה רבה על בעיות אלה ומייצר אורגנואידים בקליפת המוח מאבות נוירואקטודרמליים תוך חודש אחד, וניתן לשמור עליו במשך יותר משנה. פרוטוקול זה, הניתן לשחזור רב, יכול להתבצע בקלות בחדר תרביות רקמה סטנדרטי ומביא לאורגנואידים עם מגוון עשיר של סוגי תאים המצויים בדרך כלל בקליפת המוח האנושית המתפתחת. למרות ההרכב ההתפתחותי המוקדם שלהם, נוירונים וסוגים אחרים של תאי מוח אנושיים יתחילו להפגין את הסימנים האופייניים של סנסנציה בתאי עצב לאחר תרבית חוץ גופית ממושכת, מה שהופך אותם לפלטפורמה רבת ערך ושימושית לחקר תהליכים עצביים הקשורים להזדקנות. פרוטוקול זה גם מתווה שיטה לאיתור תאים סנסנטיים כאלה באורגנואידים במוח קליפת המוח באמצעות צביעת בטא-גלקטוזידאז הקשורה לסנסנציה.
הידע הנוכחי שלנו על המוח האנושי התבסס במידה רבה על מודלים של בעלי חיים ועל דגימות מוח שלאחר המוות. ביולוגיה של תאי גזע היא תחום מתקדם במהירות המספק תובנות חדשות על הביולוגיה הבסיסית של התפתחות המוח האנושי ועל המניעים הפתולוגיים של הפרעות מוחיות אנושיות. תאי גזע פלוריפוטנטיים אנושיים (hPSCs) הם כלי רב ערך למידול המוח האנושי באמצעות יצירת אורגנואידים, רקמה תלת-ממדית (תלת-ממדית) דמוית איברים, שבדרך כלל משחזרת את המסלולים ההתפתחותיים, את ההרכב התאי ואת הארכיטקטורה של המוח האנושי המתפתח. אורגנואידים במוח מורכבים מעצמם ומורכבים מתאי גזע עצביים, אבות עצביים מוגדרים, נוירונים בוגרים וסוגי תאי גליה. אורגנואידים, אם כן, מספקים הזדמנות ייחודית לחקור את המוח האנושי המוקדם, שלעתים קרובות אינו נגיש לניסויים ישירים אך יש לו גם מגבלות פנימיות כגון היעדר כלי דם ומערכת חיסונית.
מתודולוגיות ליצירת אורגנואידים במוח נקטו בשתי דרכים שונות: התמיינות לא מונחית ומודרכת. שיטות אורגנואידיות מוחיות לא מונחות מסתמכות על יכולות ההתמיינות הפנימיות הספונטניות של תאי הגזע המניעים את מורפוגנזה של רקמות 1,2 ומאפשרות את הופעתן של מגוון זהויות של שושלת תאים, החל מבשר קדמי, מידבריין ואחורי, וכלה במקלעת כורואידית, רשתית ומזודרם. לעומת זאת, שיטות אורגנואידים מונחות במוח דורשות שימוש משמעותי בגורמים חיצוניים כדי להניע HPSCs לעבר התבנית הרצויה של שושלות עצביות המייצגות סוג אחד של אזור במוח, כגון בולטות גנגליונית מדיאלית3, המוח הקדמי4, המוח האמצעי5, ההיפותלמוס6, המוח הקטן7 ומקלעת הכורואידים8. היכולת הזו ליצור אזורי מוח שונים עם שושלות תאים שונות, והפוטנציאל למזג אותם כרצונם, הופכים את האורגנואידים במוח למודל מצוין לחקר התפתחות המוח האנושי ולפענוח המנגנונים הבסיסיים של מחלות הקשורות למוח. למרות ששיטות אלה ליצירת אורגנואידים במוח מציעות פריצת דרך במידול אזורי מוח אנושיים, השונות וההטרוגניות בין האורגנואידים נותרו מגבלה משמעותית למחקרים שיטתיים וכמותיים, כגון בדיקת תרופות.
הפרוטוקול הנוכחי מבוסס על שיטה שפותחה במאמר האחרון שלנו9 וכוללת הבחנה סלקטיבית של מושבות hPSC לעבר זהות נוירואקטודרם (NEct) עם מעכבי SMAD כפולים (SB-431542 ו- LDN 193189), אשר לאחר מכן יש להם את היכולת להתארגן בעצמם תוך 4 ימים לתוך כדוריות נוירו-פיתליום תלת-ממדיות בהשפעת איתות FGF2. כדוריות נוירו-פיתליום אלה יוצרות באופן אמין אורגנואידים הומוגניים בקליפת המוח עם הרכב תאי דמוי in vivo תוך 4 שבועות מההתמיינות. הפרוטוקול המתואר כאן מבוסס על הממצאים הקודמים שלנו המראים כי עיכוב של איתות SMAD כפול (מדכא אמהות נגד דקפנטפלגי) מקדם את ההתמיינות של hPSCs לעבר תאי גזע עצביים רוסטרליים שמקורם באבות נוירוקטודרמליים10 על ידי, בין היתר, עיכוב בחירת גורל של תאים אנדודרמליים, מזודרמליים וטרופיקטודרם11 . יתר על כן, ההטבעה של הספרואידים הנוירו-פיתליום במטריצת קרום המרתף המוסמכת ל-hESC גורמת לניצנים משמעותיים של הנוירו-פיתליה, ויוצרת חדרים עם קוטביות אפיקובסלית. תרבית בקנה מידה גדול הראתה יכולת שכפול והומוגניות של אורגנואידים בקליפת המוח ללא תלות בקווי תאים, שיבוטים או אצוות, ולכן מייצגת מערכת תאי גזע אמינה ויציבה המחקה התפתחות קליפת המוח האנושית המוקדמת בבריאות ובמחלות במבחנה. בנוסף, אנו מתווים פרוטוקול לאיתור סמנים של תאי עצב סנסנטיים באורגנואידים של המוח בקליפת המוח שמקורם ב-HPSCs, אשר עברו תרבית לפרקי זמן ממושכים.
לאחר ציפוי hPSCs בצפיפות זריעה של 20%-30%, התאים מטופלים עם מעכבי SMAD כפולים במשך 3 ימים כדי להבדיל בין מושבות hPSC למושבות נוירואקטודרמליות. מושבות אלה מורמות בעדינות עם דיספוזה ונזרעות לתוך לוחות חיבור נמוכים במיוחד של 6 בארות בתוספת FGF2. המושבות הדו-ממדיות הצפות מתארגנות באופן עצמאי לכדורואידים נוירואקטודרמליים תלת-ממדיים במהלך הלילה ומתוחזקות במשך 4 ימים במדיום N2 בתוספת יומית עם FGF2. לאחר שהספרואידים ביססו את שכבת הנוירו-פיתל, הם יכולים להיות מוטמעים במטריצת קרום המרתף. על ידי הוספה שגרתית של מדיום דיפרנציאציה סופני רענן, החוקרים יבחינו בהתרחבות הדרגתית ובניצנים של נוירואפיתליה באורגנואידים של קליפת המוח. ייתכן שחוקרים ירצו לנתק את האורגנואידים האלה כדי לבצע פרופיל שעתוק ופרוטאומי. בנוסף, הדמיית ברייטפילד מומלצת לניטור איכות האורגנואידים בקליפת המוח. ניתוח יכול להתבצע על ידי קיבוע, cryosection, ו immunostaining. תיאורים ושיטות לטכניקות אלה תוארו בעבר12. בסופו של דבר, פרוטוקול זה מאפשר לחוקרים ליצור במהירות ובחוזקה אורגנואידים הומוגניים של המוח קליפת המוח קליפת המוח של קליפת המוח האנושית המתפתחת, עם עלות נמוכה וציוד מוגבל, ולחקר היבטים של סנסנציה עצבית תאית, כפי שמתואר במאמר זה.
1. יצירת אורגנואידים במוח קליפת המוח
הערה: כל השלבים בסעיף זה של הפרוטוקול יתרחשו במכסה מנוע של בטיחות ביולוגית מסוג Class 2, אלא אם כן צוין אחרת.
- אינדוקציה של מושבות נוירואקטודרמליות דו-ממדיות מתרבות הדו-ממדית hPSC (ימים -1 עד 3)
- לפני האינדוקציה, צלחת את מושבות hPSC על מטריצת קרום מרתף מוסמכת hESC בצלחת 6 בארות בצפיפות של 20%-30%. השג צפיפות זו על ידי העברת מושבות hPSC מבאר אחת של לוחית אחת של 6 בארות במפגש של 60% לשלוש בארות של לוחית של 6 בארות.
- עבור ציפוי מטריצת קרום מרתף, דיללו את מטריצת קרום המרתף ביחס של 1:50 במדיום בסיסי רגיל. הפקדה שווה של 1 מ"ל / באר של צלחת 6 בארות, דגירה למשך שעה אחת בטמפרטורת החדר (RT), ולאחר מכן שאפו.
- שמרו על מושבות hPSC במשך יום אחד ב-2 מ"ל של מדיום תרבית תאים ללא סרום לפני ההתמיינות.
- ביום ההבחנה של hPSC, בדקו את מושבות ה-hPSC באמצעות מיקרוסקופיה בשדה בהיר בהגדלה של פי 4 עד פי 10 כדי להבטיח מושבות בריאות ללא התמיינות ניתנת לזיהוי.
הערה: hPSCs בריאים ייצרו מושבות קצה הדוקות עם תאים בעלי גרעין גדול, ציטופלסמה קטנה מאוד וגרעין בולט. מושבות iPSC מובחנות יציגו הבדלים מורפולוגיים ברורים לאלה של מושבות hPSC המתוארות לעיל, במיוחד סביב הקצוות החיצוניים של המושבות או במרכז. - הוסף ריאגנטים המפורטים בטבלה 1 כדי להרכיב את מדיום N2 הנדרש להבחנה. הביאו את המדיום הזה ל-RT לפני השימוש.
- לאחר שתגיעו ל-RT, שאפו את מדיום תרבית התאים ללא סרום מכל באר של צלחת 6 הקידוחים והחליפו ב-2 מ"ל של מדיום N2 שנוספו בעדינות בפיפטה סרולוגית של 5 מ"ל.
- הוסף את שני מעכבי SMAD, SB-431542 (10 μM) ו- LDN 193189 (100 ננומטר).
הערה: ניתן להוסיף את מעכבי SMAD למדיום N2 לאחר שהמדיום הוצב בכל באר, או לכמות הנדרשת של מדיום N2 לפני החלפת מדיום תרביות התאים ללא סרום. ניתן לשלב מעכבים באופן שווה במדיום על ידי סיבוב עדין של הצלחת או היפוך הצינור המכיל את המדיום והמעכבים 3-4 פעמים. - הוסיפו מדיית N2 טרייה בתוספת SB-431542 (10 μM) ו-LDN 193189 (100 ננומטר) מדי יום לכל באר ביומיים הקרובים.
הערה: מדיום N2 טרי מתווסף כדי להפחית את החשיפה הממושכת של תאים ל- DMSO המשמש להמסת תרכובות SB-431542 ו- LDN 193189 ולמנוע ציטוטוקסיות.
- דור של ספרואידים נוירואקטודרמליים תלת-ממדיים ממושבות נוירואקטודרמליות דו-ממדיות (ימים 3 עד 7)
- הרם את המושבות הנוירוקטודרמליות המושרות באמצעות dispase בעקבות שלבים 1.2.2-1.2.8.
- ראשית, הסר 2 מ"ל של מדיום N2 מהצלחת בעלת 6 הבארות, ושטפו 1x עם HBSS כדי להבטיח שכל מדיום N2 יוסר.
הערה: מדיום N2 יכול להפריע לפעילות האנזים של dispase, ולמנוע ניתוק הולם של מושבות נוירואקטודרמליות מהבאר. - הוסיפו 1 מ"ל של 2.4 יחידות/מ"ל לכל באר המכילה מושבה.
- דגירה של הבאר למשך 20-25 דקות (מקסימום 30 דקות) בטמפרטורה של 37 מעלות צלזיוס. בדוק אם יש ניתוק מושבה באופן קבוע.
הערה: מושבות קטנות עשויות להתנתק תוך 20 דקות. יש להתעלם מכל המושבות שנותרו תקועות לאחר 30 דקות. - לאחר הדגירה, הוסיפו 1 מ"ל של מדיום N2 לבאר כדי לעצור את פעילותו של האנזים הדיספוזי ולהעביר את המושבות לצינור של 15 מ"ל באמצעות קצה פיפטה P1000 רחב או קצה פיפטה P1000 שונה שנחתך עם מספריים סטריליים (מה שהופך אותו לקצה P1000 רחב משעמם).
- אפשרו לגושי המושבה לשקוע לתחתית הצינור בכוח הכבידה.
הערה: תהליך זה ייקח כדקה אחת. - לאחר שהגושים שקעו, הסירו בזהירות את הסופרנאטנט עם קצה פיפטה P1000 סטנדרטי והחליפו אותו ב-1 מ"ל של מדיום N2 טרי. חזור על שלב כביסה זה שלוש פעמים כדי להבטיח הסרה מלאה של dispase.
הערה: כל דיספוזה שנותרה תמנע היווצרות אחידה של כדוריות נוירואקטודרמליות ותגרום למוות של תאים. - לאחר הכביסה, יש לבצע החייאה של גושי התאים ב-3 מ"ל של מדיום N2 ולהעביר לבאר אחת של צלחת בעלת 6 בארות ולהוסיף 40 ננוגרם/מ"ל של bFGF.
הערה: אם מספר גבוה של מושבות נוירואקטודרמליות היו מנותקות, ניתן היה לפות מושבות אלה על פני שתי בארות או יותר של צלחת בת 6 בארות כדי למנוע היתוך של ספרואידים. 24 שעות לאחר ניתוק המושבות, בדוק אם הכדורואידים נוצרו. - שמרו על הספרואידים באותה מדיה במשך 3-4 הימים הבאים, אך הוסיפו bFGF טרי (40 ננוגרם/מ"ל) לכל באר מדי יום כדי לקדם שגשוג תאים נוירואקטודרמליים, ארגון עצמי, ולגרום ולהרחיב את הנוירואפיתליה.
הערה: אם הספרואידים צופו בצפיפות גבוהה יותר, סביר להניח שהתקשורת תהפוך לצהובה ותדרוש החלפה כל יומיים ב-bFGF טרי (40 ננוגרם/מ"ל). עם זאת, זה לא מומלץ, ובמקום זאת, מספר נמוך יותר של spheroids צריך להישמר בכל באר כדי למנוע בעיה זו. ניתן להטמיע כדוריות במטריצת קרום המרתף לאחר 3 ימים אם נוירואפיתליה ניכרת. אם נוירואפיתליה אינם ניכרים או לא נראים חזקים, יש לשמור על הספרואידים ליום נוסף ולבדוק שוב.
- התמיינות ותחזוקה של אורגנואידים במוח קליפת המוח (יום 8)
- הכן את מדיית הבידול של המסוף (DM) באמצעות הריאגנטים המפורטים בטבלה 2. הביאו את המדיה הזו ל-RT.
- להפשיר 100% מטריצת קרום מרתף מוסמכת hESC על קרח.
- מכינים יריעה של פרפילם עם גומות חן מעוקרות עם 70% אתנול בצלחת פטרי 10 ס"מ ומניחים אותה על סטריאומיקרוסקופ מתחת למכסה המנוע.
הערה: ניתן להשתמש במגש ריק של 200 μL טיפים לפיפטה כדי ליצור רשת של גומות חן. - חותכים את הקצה מקצה פיפטה של 100 μL (כדי להפוך אותו לרחב-משעמם). זה ישמש להטבעת כדוריות עצביות במטריצת המרתף מבלי לשבור אותן.
- באמצעות סטריאומיקרוסקופ, בחרו ספרואידים עצביים בגודל דומה (500 מיקרומטר) מהצלחת בעלת 6 הבארות והעברו אותם לגומות-גומות-פרפילם באמצעות קצה הפיפטה רחב-הנשא 100 μL, תוך הצבת ספרואיד עצבי יחיד לכל גומה.
- הסר בעדינות את כל המדיה העודפת, והשאר מספיק כדי לכסות את הספרואידים.
הערה: זה כדי לשמור על איכות הספרואידים לפני הוספת מטריצת המרתף וכדי להבטיח שהם לא יתייבשו. - הוסף בעדינות 18 μL של מטריצת מרתף מעל הספרואיד, תוך מיקום הספרואיד במרכז טיפת המטריצה. השתמש בקצה של קצה פיפטה של 10 μL כדי למרכז את הספרואידים במטריצה.
הערה: נסה להוסיף את מטריצת המרתף מהר ככל האפשר כדי למנוע את התייבשות המדיה העודפת סביב הספרואידים. - מכסים את צלחת הפטרי בגודל 10 ס"מ ומעבירים לאינקובטור ומדגרים את צלחת הפרפילם עם כדוריות משובצות במטריצת מרתף בטמפרטורה של 37 מעלות צלזיוס למשך 25 דקות.
- לאחר הדגירה, שטפו את הספרואידים המוטבעים לתוך צלחת חיבור נמוכה של 24 בארות באמצעות קצה P1000 עם 0.5 מ"ל של מדיית ה-DM, וודאו שהספרואידים המוטבעים בודדים ממוקמים בבאר אחת כל אחד.
הערה: אם יותר מספרואיד מוטבע אחד נופל לתוך באר אחת, השתמש בקצה P1000 בעל נשא רחב כדי להעביר את הספרואיד השני לבאר חדשה. - שמור על האורגנואידים המוחיים המובחנים בקליפת המוח במדיית DM לפרקי זמן ממושכים, כאשר שינויים במדיה מתרחשים כל יומיים כאשר האורגנואידים נעשים גדולים יותר ויותר.
הערה: במהלך השבוע הראשון של הבידול, ניתן לשנות את המדיום כל 3 ימים.
2. אפיון הזדקנות עצבית באורגנואידים קורטיקליים
- תהליך אורגנואידים קליפת המוח עבור cryosections:
הערה: הצעדים בוצעו במכסה אחסון ביולוגי מדרגה 2.- הכינו צינורות 2 מ"ל, שכל אחד מהם מלא ב-1.5 מ"ל של 4% פרפורמלדהיד (PFA).
- חותכים את הקצה של קצה פיפטה P1000 (כדי להפוך אותו לבור רחב) ומעבירים בעדינות כל אורגנואיד לאחד מ-2 צינורות ה-mL שהוכנו למעלה (אורגנואיד אחד לכל שפופרת).
הערה: כדי למנוע ערבוב עודף של מדיית DM עם ה-PFA, אפשרו לאורגנואיד לשקוע לכיוון הפתח של קצה הפיפטה P1000 ולנוח את הקצה ממש מעל החלק העליון של ה-PFA בצינור לפני שהם מוציאים את האורגנואיד החוצה. זה יאפשר לחוקר להעביר רק את האורגנואיד ואת המדיה המינימלית מאוד. - אפשרו לתהליך הקיבוע להתקיים בטמפרטורה של 4 מעלות צלזיוס למשך שעה אחת.
- באמצעות קצה פיפטה P1000 לא חתוך, שאפו בזהירות עודף PFA והוסיפו 1.5 מ"ל של PBS קר 1x.
- העבירו את הצינורות לשייקר מסלולי שנקבע ב-70 סל"ד למשך 10 דקות ב-RT.
- חזור על תהליך הכביסה עם PBS 1x קר שלוש פעמים כדי להבטיח שכל ה- PFA הוסר ביסודיות.
הערה: אין להשליך PFA במכלי פסולת רגילים; במקום זאת, הכינו עבור זה מיכל ספציפי לסילוק פסולת כימית, מכיוון ש-PFA מהווה סכנה. - טבלו את האורגנואידים ב-1x PBS המכילים 30% סוכרוז ודגרו בטמפרטורה של 4 מעלות צלזיוס עד שכל האורגנואידים שקעו לתחתית הצינור.
הערה: הזמן הנדרש כדי לאפשר לאורגנואידים לשקוע תלוי בגודל / בגיל של האורגנואידים. אורגנואידים בני 3 חודשים עשויים להימשך עד 5 שעות. - באמצעות קצה פיפטה P1000 חתך ורחב ידיים, מעבירים בעדינות שלושה עד חמישה אורגנואידים לתבנית הרכבה המכילה תמיסת הרכבה העשויה מ-30% סוכרוז ומתווך טמפרטורת חיתוך אופטימלית (OCT) של 100%, ביחס של 3:2.
- השתמש בקצה פיפטה של 10 μL בעזרת סטריאומיקרוסקופ כדי לכוון ולמקם אורגנואידים בתבנית דמוית רשת.
- מניחים את התבנית על קרח יבש כדי למצק את תמיסת ה-OCT של הסוכרוז לפני שאתם ממשיכים עם חתך קריו (16-20 מיקרומטר) באמצעות קריוסטאט.
הערה: עבור בטא-גלקטוזידאז הקשור לסנסנציה, יש לעבד את כל הרקמות לצורך חתך לאחר ששקעו. עבור immunofluorescence, רקמות ניתן לעבד עבור חתך למחרת. כל השקופיות המכילות חלקים חייבות להיות מאוחסנות בטמפרטורה של -20 מעלות צלזיוס לפני האימונופלואורסצנציה הבאה או בטא-גלקטוזידאז, אם לא מוכתמות מיד.
- תהליך לניתוח של סנסנציה באורגנואידים במוח קליפת המוח:
הערה: ניתן לבצע את השלבים הבאים על ספסל מעבדה רגיל.- מעבירים את השקופיות למיכל צביעת שקופיות במיקרוסקופ עם מכסה ושוטפים את הרקמה האורגנואידית החתוכה שלוש פעמים עם 1x PBS למשך 10 דקות ב-RT כדי להסיר כל תמיסת הרכבה עודפת.
- לאחר מכן, דגירה של הרקמה השטופה עם תמיסת צביעת בטא-גלקטוזידאז טרייה למשך הלילה בטמפרטורה של 37 מעלות צלזיוס.
הערה: תמיסת הכתמת בטא-גלקטוזידאז עשויה ממאגר פוספט (עבור 10 מ"ל של מאגר פוספט: 8.15 מ"ל של 1 M NaH2PO4, 1.85 מ"ל של 1M Na2HPO4) מותאם pH = 6, 100 mM של אשלגן הקסציאנופרט (III), 100 mM של אשלגן הקסציאנופרט (II) טריהידרט, 5 M של NaCl, 1 M של MgCl2, 20 מ"ג/מ"ל של אקס-גל. הימנע משימוש בחממת תרביות תאים סטנדרטית המכילה CO2 מכיוון שה-CO2 ישנה את ה-pH של תמיסת הכתם בטא-גלקטוזידאז. - שטפו את הרקמות המוכתמות עם 1x PBS שלוש פעמים במשך 10 דקות כל אחת ב-RT כדי להסיר את תמיסת הבטא-גלקטוזידאז.
- הרכיבו את הרקמות השטופות עם חומר עילוי מזכוכית ואפשרו לתמיסת ההרכבה להתמצק למשך 30 דקות ב-RT לפני הצפייה מתחת למיקרוסקופ.
כאן תיארנו פרוטוקול חזק המאפשר לחוקרים ליצור אורגנואידים מוחיים הומוגניים שמקורם ב-hPSC בקליפת המוח המחקים את אזור המוח קליפת המוח האנושי in vivo תוך 1-3 חודשים מהתרבית. מושבות hPSC מתורבתות לראשונה במדיית התמיינות כדי ליצור מושבות נוירואקטודרמליות, אשר לאחר מכן ניתן להשתמש בהן ליצירת ספרואידים עצביים. ספרואידים אלה מוטמעים לאחר מכן במטריצת קרום מרתף ונשמרים לפרקי זמן ממושכים כדי לייצר אורגנואידים שניתן להשתמש בהם כדי למדל הזדקנות עצבית (ראו איור 1 לתיאור של הפרוטוקול). ראוי לציין כי התרבות האורגנואידים האלה בצלחות אולטרה-לא מצופות של 24 בארות גורמת ללחץ תאי ומקדמת פנוטיפים הקשורים לסנסנציה במשך 13 שבועות של תרבית חוץ גופית . אורגנואידים הנגזרים מפרוטוקול זה יכולים להישמר גם בביוריאקטורים מעורבבים לצמיחה אופטימלית והתמיינות של תאים עצביים של לוחות קליפת המוח או בממשק אוויר-נוזל.
ראשית, מושבות hPSC מתורבתות במשך יום אחד לפני ההתמיינות הנוירואקטודרמית. חשוב מאוד שמושבות hPSC אלה יתרביתו ל-20%-30% מפגש בלבד, והן באיכות הגבוהה ביותר האפשרית: חד-שכבתית שטוחה הדוקה ללא תאים מתמיינים המזהמת את המושבות (איור 2A,B). הפלוריפוטיות של מושבות hPSC צריכה להיות מאושרת על ידי ביטוי של סמנים כגון NANOG (איור 2C). מושבות ה-hPSC המאומתות נחשפות לאחר מכן למדיית ההתמיינות הנוירואקטודרמלית N2 עם SB-431542 ו-LDN 193189. לאחר 3 ימי תחזוקה במדיה זו, מושבות ה-hPSC היו צריכות להתמיין למושבות נוירואקטודרמליות ולא להראות עוד את אותה מורפולוגיה חד-שכבתית שטוחה הדוקה של ה-hPSCs (איור 2B), אלא הן יהפכו לתאים ארוכים יותר בצורת עמודה (איור 2B). תאים אלה יהיו שליליים גם עבור סמני פלוריפוטנטיות כגון NANOG (איור 2C).
בשלב זה המושבות הנוירו-קטודרמליות מנותקות באופן אנזימטי עם דיספוזה, וכל מושבה בריאה ומנותקת בהצלחה רשאית לארגן את עצמה וליצור ספרואיד עצבי צעיר (איור 2D, סרטון משלים 1). רק מושבות נוירוקטודרמליות בריאות ונקיות יתנתקו במסגרת הזמן שצוינה לפעילות הדיספוזה; יש להתעלם מכל המושבות האחרות מכיוון שהן יביאו לאיכות ירודה יותר של ספרואיד. עם חשיפה יומית ל-FGF2 במדיה N2, תאי הגזע העצביים (SOX2+) בספרואידים האלה (איור 2D, יום 1) יתרבו וייצרו מספר משמעותי של רוזטות עצביות (איור 2D, יום 4). רוזטות אלה יבטאו את הצומת ההדוק ואת סמן האפיתל ZO1 בתאים הממוקמים במרכז הרוזטות ולאורך הקצה החיצוני של הספרואיד, וידגימו את הקוטביות האפיקלית-בסיסית של הספרואיד (איור 2D, יום 4). השיטה להדמיה תלת-ממדית מלאה של ספרואידים תוארה לפני13. בדיקה יומית של הספרואידים אמורה להבהיר את היווצרותם של קצה חיצוני הדוק וכהה ושוליים בהירים של הספרואידים, כלומר שכבת הנוירו-פיתל. שכבה זו צריכה להיווצר מספיק לאחר 3-4 ימים עם קוטר משוער של 500 מיקרומטר, אז ניתן להטמיע את הספרואידים במטריצת המרתף. אם שכבה זו אינה קיימת או נוצרת רק בצורה חלשה, הספרואידים אינם מפותחים מספיק כדי לקחת קדימה. מומלץ להמתין יום נוסף כדי לצפות בכל שינוי, אך אם זה לא נצפה, התעלמו מספרואידים אלה.
תמונה מייצגת של הספרואידים לאחר 3 ימים של תרבית ניתן לראות באיור 2D. ספרואידים עם שכבה נוירו-פיתלית הדוקה שלא התמזגו עם ספרואידים שכנים אחרים, בעלי רקמה שקופה למחצה, ומדגימים היווצרות רוזטה עצבית, נבחרים להיות מוטבעים במטריצת המרתף. לאחר ההטבעה, הספרואיד יתרבה במהירות ויתחיל לניצנים: יופיעו צמתים של רקמה קומפקטית, יתרחבו החוצה מהגוף הראשי של הספרואיד. זה ניכר בין 1-3 שבועות במטריצת המרתף וניתן לראות אותו על פני קווי תאים מרובים (איור 3A). ניתוח כמותי של הספרואידים המשובצים מאשר את נוכחותם של תאי אפיתל בעד 100% מהספרואידים על פני שלושה קווי תאים שונים, ומאשר את ההומוגניות ואת יכולת השכפול הצפויות מפרוטוקול זה (איור 3B). הכימות של קוטר האורגנואידים במהלך התמיינות חוץ גופית מאשר עוד יותר את יכולת השכפול על פני קווים שונים של hPSC (איור 3C). אם ניצנים אינם מתרחשים, הספרואידים אינם מתפתחים כראוי ויש להשליך אותם. לאחר שהספרואידים הוטמעו במטריצה, התפתחותם מתקדמת, והכפורואידים מכונים כיום אורגנואידים. צביעת אימונופלואורסצנציה גם מאשרת את נוכחותם של תאי אב עצביים (PAX6) כמו גם סמני שכבות קליפת המוח המוכתמים ב-CTIP2 וב-SATB2 באורגנואידים עם שכבות שקופות (איור 3D,E). ניתן להבחין בשכבות אלה על פני נקודות זמן שונות של תחזוקה אורגנואידית (איור 3D,E). השיטה של אימונוהיסטוכימיה של רקמות תוארה לפני14.
יישום אפשרי אחד של האורגנואידים האלה הוא לחקור כיצד תהליכים הקשורים להזדקנות עצבית משפיעים על המוח. כדי לחקור זאת, אורגנואידים שנוצרו בהצלחה נקטפים ממספר נקודות זמן שונות לצורך חתך וצביעה עבור סמנים ביולוגיים מולקולריים סטנדרטיים של סנסנציה, כגון בטא-גלקטוזידאז הקשור לסנסנציה ועמ' 21. איור 4A מראה תמונה מייצגת של צביעת בטא-גלקטוזידאז הקשורה לסנסנציה של אורגנואידים 4 ו-13 שבועות לאחר ההטבעה במטריצת קרום המרתף. בין שבועות 4 ל-13 חלה עלייה ניכרת בנוכחות בטא-גלקטוזידאז הקשור לסנסנציה, מה שמרמז על כך שסנסנציה תאית, גורם מוכר להזדקנות אורגניזמית, התרחשה במשך תקופה זו בתרבית. צביעה אימונופלואורסצנטית של אורגנואידים בשבוע 13 אישרה את נוכחותו של סמן סנסנציה אחר, עמ' 21, המסומן במשותף עם הסמן העצבי של קליפת המוח הבוגרת (CTIP2) וניתן לראותו באיור 4B. עם זאת, יש לציין כי נוכחותו של p21 היא סמן של עצירת מחזור התאים והיא כשלעצמה אינה סמן סופי של סנסנציה, וזיהוי סמנים אחרים של סנסנציה כגון p16 ו-SASP (פנוטיפ הפרשה הקשור לסנסנציה) מומלץ לזהות באופן סופי את התאים כסנסנטיים.
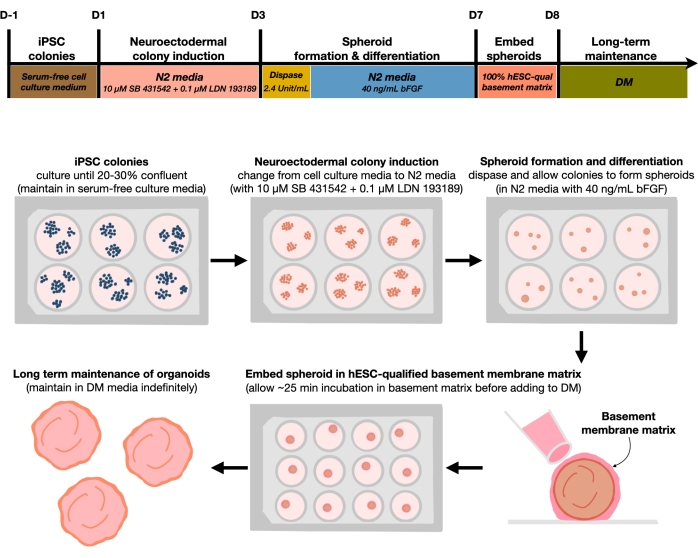
איור 1: דיאגרמה סכמטית ליצירת אורגנואידים במוח קליפת המוח הניתנים לשחזור. זרימת עבודה סכמטית של ההליך הניסויי ליצירת אורגנואידים במוח קליפת המוח מ- hPSCs המתוחזקים במדיום נטול המזין. זרימת העבודה מספקת סקירה כללית של שישה שלבים המעורבים כדי להבדיל את ה-hPSCs הדו-ממדיים לרקמות אנושיות של לוחות קורטיקליים תלת-ממדיים באורגנואידים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
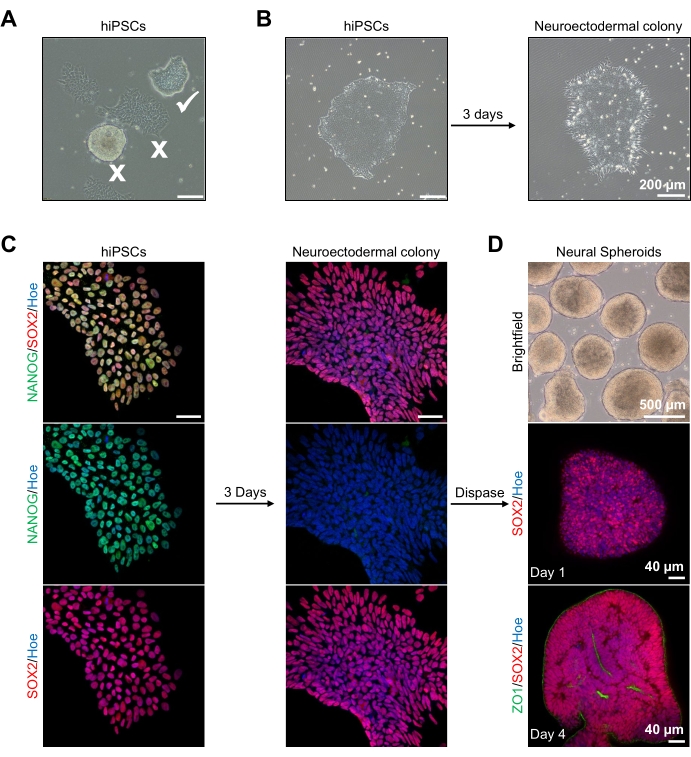
איור 2: יצירת ספרואידים עצביים שמקורם במושבות נוירואקטודרמליות - hPSCs. (A) תמונות מייצגות של PSC אנושי המציגות אופטימום (קרצייה לבנה) ומושבות מובחנות (צלב לבן). סרגל קנה מידה: 200 מיקרומטר, הגדלה של 4x. (B) תמונה מייצגת של מושבה נוירואקטודרמלית שמקורה ב-hPSCs לאחר 3 ימים של טיפולים כפולים במעכבי SMAD. סרגל קנה מידה: 200 מיקרומטר, הגדלה של 4x. (C) מושבות PSC אנושיות נבדלו לכיוון מושבות נוירואקטודרמליות. התמונות מייצגות צביעה של מושבות PSC (ביום 1) ונוירואקטודרמליות (ביום 3) עם SOX2 (אדום), NANOG (ירוק), כל הגרעינים הוכתמו באופן נגדי עם Hoechst 33342 (כחול). סרגל קנה מידה: 40 מיקרומטר, הגדלה של פי 100. (D) תמונות המציגות את השלבים ההתפתחותיים של כדורי מוח קליפת המוח לאורך זמן בתרבית במבחנה תחת ברייטפילד, וחיסון שלם עם SOX2 (אדום) ביום הראשון, וחיסון כפול עם SOX2 (אדום) ו- ZO1 (ירוק) ביום 4. סרגל קנה המידה של תמונת השדה הבהיר הוא 500 מיקרומטר, הגדלה של פי 4, סרגלי קנה המידה של התמונות התחתונות הם 40 מיקרומטר, הגדלה של פי 20. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
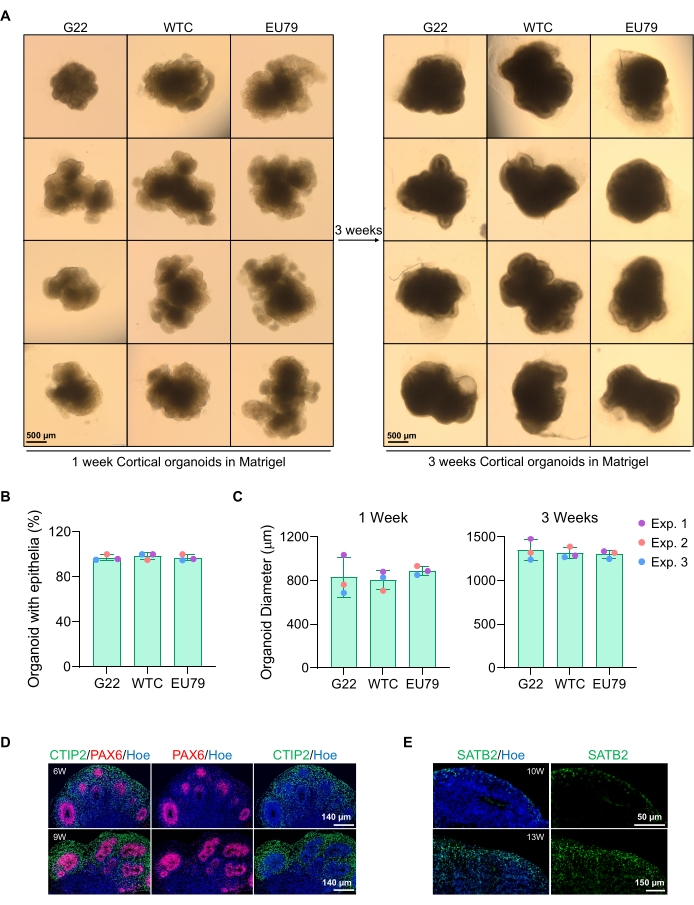
איור 3: אפיון של אורגנואידים במוח קליפת המוח הנגזרים מקווי hPSC שונים. (A) תמונות מייצגות של אורגנואידים במוח קליפת המוח שמקורם בקווי iPSC אנושיים G22, WTC ו-EU79 שעברו תרבית במשך 3 שבועות במבחנה. סרגל קנה המידה של כל התמונות הוא 500 מיקרומטר, הגדלה של פי 2. (B) אחוזים מהדור המוצלח של אורגנואידים במוח קליפת המוח ב-3 שבועות של התמיינות חוץ גופית בקווי hPSC שונים (G22, WTC ו-EU79). N = 3. הנתונים מוצגים כסטיית תקן ממוצעת ±. (C) גרפי עמודות המראים צמיחה של אורגנואידים במוח קליפת המוח (בהתבסס על קוטר ממוצע) בשבועות 1 ו-3 של התמיינות במבחנה בקווים שונים של קווי תאי גזע פלוריפוטנטיים אנושיים (G22, WTC ו-EU79). N = 3. הנתונים מוצגים כסטיית תקן ממוצעת ±. (D) תמונות מייצגות של מקטעים של אורגנואידים מוחיים בקליפת המוח בקליפת המוח בני 6 שבועות ו-9 שבועות שמקורם ב-G22 hPSCs, מוכתמים במערכת החיסון באזור החדר PAX6 (אדום) ובפלטת קליפת המוח CTIP2 (ירוקה). כל הקטעים הוכתמו באופן נגדי עם Hoechst 33342 (כחול). סרגל קנה מידה = 140 מיקרומטר, הגדלה של פי 20. W הוא שבוע. (E) תמונות מייצגות של מקטעים של אורגנואידים מוחיים בקליפת המוח בקליפת המוח בני 10 שבועות ו-13 שבועות שמקורם ב-WTC hPSCs, חיסון לשכבה קליפת המוח IV SATB2 (ירוק). כל הקטעים הוכתמו באופן נגדי עם Hoechst 33342 (כחול). 10 שבועות תמונה סרגל קנה מידה = 50 μm, הגדלה של 40x. 13 שבועות תמונה סרגל קנה מידה = 150 מיקרומטר, הגדלה של פי 40. W הוא שבוע. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
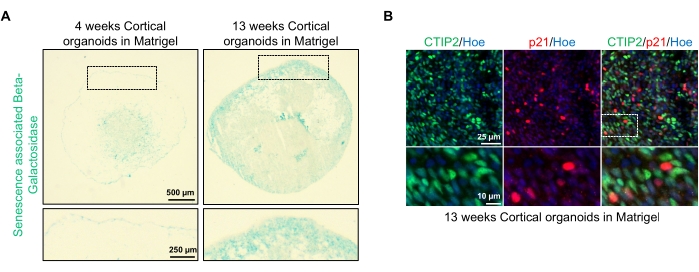
איור 4: אפיון של סנסנציה באורגנואידים של המוח בקליפת המוח שמקורם ב-hPSCs. (A) תמונות מייצגות של מקטעים של אורגנואידים במוח קליפת המוח האנושית שמקורם ב-HPSCs של WTC בתרבית במשך 4 ו-13 שבועות במבחנה ומוכתמים ב-SA-β-gal. סרגל קנה מידה = 500 μm, סרגל קנה מידה של תמונות מוגדלות = 250 μm, הגדלה של פי 4. התיבה המנוקדת מציינת תמונה מוגדלת. (B) תמונות מייצגות של מקטעים של אורגנואידים במוח קליפת המוח בקליפת המוח בני 13 שבועות שמקורם ב-EU79 hPSCs אנושיים, שהוכתמו על ידי תאי עצב בקליפת המוח CTIP2 (ירוק) ועמ' 21 (אדום). כל הקטעים הוכתמו באופן נגדי עם Hoechst 33342 (כחול). סרגל קנה מידה = 25 μm, סרגל קנה מידה של תמונות מוגדלות = 10 μm, הגדלה של פי 40. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| רכיבי מדיה | ריכוז |
| תערובת חומרים מזינים של DMEM F12 10x 500 מ"ל (DMEM/F-12) | |
| תוספת N2 5 מ"ל (100x) | ב-1% |
| B 27 תוספת 10 מ"ל | תוספת של 2% |
| תמיסת חומצות אמינו לא חיוניות MEM (100x) | תוסף ב-1% |
| פניצילין-סטרפטומיצין (10,000 U/mL) | תוסף ב-1% |
| 2-מרקפטואתנול 50 מ"ל(1000x) | תוספת של 0.1% |
טבלה 1: N2 בינוני. הטבלה מפרטת את הריאגנטים הנדרשים להכנת מדיום N2.
| רכיבי מדיה | ריכוז |
| תערובת חומרים מזינים של DMEM F12 10x 500 מ"ל (DMEM/F-12) | מדיית DM מיוצרת ביחס של 1:1 של DMEM/F12 ומדיה נוירובסלית |
| מדיום נוירובאסלי | |
| תוספת N2 5 מ"ל (100x) | ירד ב-0.5% |
| B 27 תוספת 10 מ"ל | תוסף ב-1% |
| תמיסת חומצות אמינו לא חיוניות MEM (100x) | תוסף ב-1% |
| תוסף גלוטמקס 100x | תוסף ב-1% |
| פניצילין-סטרפטומיצין (10,000 U/mL) | תוסף ב-1% |
| תמיסת אינסולין רקומביננטי אנושי | 12.5 μL עבור 50 מ"ל של מדיה |
| 2-מרקפטואתנול 50 מ"ל (1000x ) | 17.5 μL עבור 50 מ"ל של מדיה |
טבלה 2: מדיום הבחנה (DM). הטבלה מפרטת את הריאגנטים הנדרשים להכנת מדיום הבידול.
סרטון משלים 1. הדמיה חיה של המרת גיליון/מושבה דו-ממדית של hNEct 2D המושרה לתלת-ממד תחת טיפול ב-bFGF. מושבות מושרות של hNEct נותקו בעדינות מהתבשיל עם דיספוזה כמתואר לעיל והועברו לצלחת תרבית בעלת חיבור נמוך של 6 בארות. מושבות hNEct דו-ממדיות הומרו לספרואידים תלת-ממדיים hNEct תוך 12 שעות. תמונות סדרתיות צולמו כל 5 דקות. סרגל קנה מידה = 100 μm. אנא לחץ כאן כדי להוריד סרטון זה.
כדי לאפשר שימוש באורגנואידים מוחיים שמקורם ב-hPSC בבדיקת תרופות ובמידול מחלות, חיוני ליצור אורגנואידים בעקבות פרוטוקול15 שניתן לשכפל ואמין. אורגנואידים במוח נוצרים בדרך כלל מגופים עובריים שמקורם ב-hPSCs, אשר מוטמעים לאחר מכן במטריצה חוץ-תאית המקדמת את התפשטות הרקמות ואת ההתמיינות העצבית. בהשוואה לפרוטוקולים כמו1,16,17 של לנקסטר ו-Velasco18, שמתחילים מגופים עובריים ומאפשרים מסלול התמיינות ברירת מחדל בעקבות האורגנואידים המתפתחים, מצאנו שהתחלת יצירת אורגנואידים במוח קליפת המוח עם תאי NEct אנושיים ולא עם גופים עובריים משפרת את העקביות של היווצרות אורגנואידים במוח קליפת המוח. כתוצאה מכך, הדבר מאפשר גם את קנה המידה הנדרש לבדיקות סקר תרופתיות ופנוטיפיות. מכיוון שתאי NEct אנושיים יכולים לא רק להיות מורחבים לכמויות ניכרות, אלא גם ניתן להקפאה בקלות, גישה זו גם משפרת את השכפול בין הניסויים. כמו כן יש לציין כי בהשוואה לפרוטוקולים אחרים שאימצו את השימוש בביוריאקטורים ובטכנולוגיות דומות, אין צורך בציוד מיוחד לפרוטוקול זה, מה שהופך אותו למתאים לכל מעבדה6. לבסוף, הזמן הנדרש ליצירת אורגנואידים בוגרים שהם חיוביים לסמני שכבת קליפת המוח כגון SATB2 מצטמצם בהשוואה הן לפרוטוקולים של לנקסטר1 והן לפרוטוקולים ביוריאקטורים 6,19 מה שהופך אותו למתאים יותר לחקר המסלול ההתפתחותי של התפתחות קליפת המוח האנושית בבריאות ובמחלות 1,6,16.
יתר על כן, בהתחשב בהשפעה ההולכת וגדלה של שירותי הבריאות העולמיים של מחלות הקשורות להזדקנות כגון דמנציה, הקשורות לעלייה בסוגי תאים סנסנטיים במוח התורמים לפתוגנזה, היכולת לזהות ולבדוק תרכובות שיכולות להקל על הזדקנות המוח היא בעלת עניין עצום. למרות שידוע כי hPSCs עוברים התחדשות אפיגנטית במהלך תהליך התכנות מחדש20, אנו מוצאים עליות חזקות בתאי סנסנט באורגנואידים במוח קליפת המוח בתרבית לפרקי זמן ממושכים. זוהי התפתחות מבטיחה המאפשרת כעת הקרנה של תרופות שמסלקות תאים סנסנטיים כאלה מהמוח (סנוליטיקה) או שמאטות את התהליך הזה (סנוסטטיקה)21. מאחר שאורגנואידים במוח קליפת המוח שמקורם ב-NEct הם ממקור אנושי, סביר להניח שגישה זו תקצר את הדרך המסורתית לשיווק טיפולים חדשניים כאלה.
ישנם שני שלבים קריטיים בפרוטוקול זה. הראשון הוא רמת המפגש הנכונה של מושבות hPSC בזמן ההתמיינות. מושבות hPSC חייבות להיות לכל היותר 30% מפגש כדי להבטיח שמושבות NEct שנוצרו לא יתמזגו עם מושבות שכנות ושהאורגנואידים הבודדים מונעים באופן משובט. השלב הקריטי השני כולל שימוש נכון בדיספוזה כדי להרים את מושבות ה-NEct ולייצר את הספרואידים העצביים. התזמון של הדגירה עם dispase הוא קריטי לאיכות הסופית של הספרואידים העצביים שנוצרו. הסיבה לכך היא שחשיפת יתר של מושבות עם דיספוזה רעילה לתאים22 ובסופו של דבר משפיעה על איכות האורגנואידים הנוצרים. המגבלה של פרוטוקול זה היא שקשה לשלוט בגודלם של הספרואידים העצביים משום שהוא תלוי בגודל המושבות הראשוניות שהוסרו עם דיספוזה. עם זאת, ניתן להתגבר על בעיה זו על ידי בחירת ספרואידים עצביים בגודל דומה כאשר ממשיכים לשלב ההטבעה.
לבסוף, יישומים עתידיים עשויים להתרחב לשימוש באורגנואידים קליפת המוח הניתנים לשחזור אלה באנליזה רובוטית ובגישות סינון ביו-פרמצבטיות המשמשות בדרך כלל בתעשייה זו. זה נתמך על ידי נתונים ראשוניים מהמעבדה שלנו המצביעים על כך שהדור של אורגנואידים במוח קליפת המוח מתאי NEct אנושיים יכול להיות אוטומטי בקלות, מה שהופך אותו לתואם לגישות אלה.
למחברים אין מה לחשוף.
עבודה זו נתמכת על ידי מחקר מואץ עתידי של קרן המחקר הרפואי העתידית, ספינת הדגל של Leukodystrophy המשימה של מאסימו (EPCD000034), מחקר רפואי עתידי קרן-משימת תאי גזע (APP2007653). המחברים רוצים להודות לד"ר ג'ו-היון לי (אוניברסיטת קוריאה) על הפקת נתונים בסרטון משלים 1.
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved