Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
체외에서 뇌 신경 노화를 모델링하기위한 피질 뇌 오가노이드의 강력하고 재현 가능한 생성
이 연구에서, 우리는 표준 피더가없는 hPSC 배양물을 사용하여 간단하면서도 견고한 피질 오가노이드 배양 시스템에 대한 상세한 기술을 제공합니다. 이것은 시험관 내에서 뇌 노화의 측면을 모델링하는 오가노이드를 생성하기위한 신속하고 효율적이며 재현 가능한 프로토콜입니다.
뇌 오가노이드는 개발 중인 인간 뇌의 입체 모델이며 질병 모델링 및 대규모 게놈 및 약물 스크리닝을 위한 강력하고 최첨단 플랫폼을 제공합니다. 뇌 오가노이드에서 세포의 자기 조직 특성과 그 생성을위한 사용 가능한 프로토콜의 범위가 증가함에 따라 오가노이드 간의 이질성 및 가변성에 대한 문제가 확인되었습니다. 이 프로토콜 논문에서 우리는 이러한 문제를 크게 극복하고 1 개월 이내에 신경 외배엽 선조로부터 피질 오가노이드를 생성하고 1 년 이상 유지할 수있는 강력하고 복제 가능한 프로토콜을 설명합니다. 이 재현성이 높은 프로토콜은 표준 조직 배양실에서 쉽게 수행 할 수 있으며 개발 중인 인간 피질에서 일반적으로 발견되는 풍부한 다양성의 세포 유형을 가진 오가노이드를 초래합니다. 초기 발달 구성에도 불구하고 뉴런 및 기타 인간 뇌 세포 유형은 장기간 체외 배양 후 신경 세포에서 노화의 전형적인 징후를 나타내기 시작하여 노화 관련 신경 과정을 연구하는 데 유용하고 유용한 플랫폼이됩니다. 이 프로토콜은 또한 노화 관련 베타-갈락토시다제 염색을 사용하여 피질 뇌 오가노이드에서 이러한 노화 세포를 검출하는 방법을 개략적으로 설명한다.
인간의 뇌에 대한 우리의 현재 지식은 주로 동물 모델과 사후 뇌 표본에 기반을두고 있습니다. 줄기 세포 생물학은 인간 뇌 발달의 기본 생물학과 인간 뇌 장애의 병리학 적 동인에 대한 새로운 통찰력을 제공하는 빠르게 발전하는 분야입니다. 인간 다능성 줄기 세포 (hPSCs)는 일반적으로 발달하는 인간 뇌의 발달 궤적, 세포 구성 및 구조를 되풀이하는 오가노이드, 장기 유사 3차원 (3D) 조직의 생성을 통해 인간의 뇌를 모델링하는 데 매우 유용한 도구입니다. 뇌 오가노이드는 자체 조립되어 신경 줄기 세포, 특정 신경 전구 세포, 성숙한 뉴런 및 신경교 세포 유형으로 구성됩니다. 따라서 오가노이드는 초기 인간의 뇌를 연구 할 수있는 독특한 기회를 제공하며, 이는 종종 직접 실험에 접근 할 수 없지만 혈관 구조 및 면역 체계의 부재와 같은 본질적인 한계를 가지고 있습니다.
뇌 오가노이드를 생성하는 방법론은 두 가지 다른 방법으로 추구되었습니다 : 유도되지 않은 분화와 유도 된 분화. 유도되지 않은 뇌 오가노이드 방법은 조직 형태 형성1,2를 구동하는 줄기 세포의 자발적인 고유 분화 능력에 의존하고 전뇌, 중뇌 및 뒷뇌에서 맥락막 신경총, 망막 및 중배엽에 이르기까지 다양한 세포 계보 정체성의 출현을 허용합니다. 대조적으로, 유도 뇌 오가노이드 방법은 내측 신경절 이온성 저명도3, 전뇌4, 중뇌5, 시상 하부6, 소뇌7 및 맥락막 신경총8과 같은 하나의 뇌 영역 유형을 나타내는 신경 계통의 원하는 패터닝을 향해 hPSC를 유도하기 위해 외부 요인의 실질적인 사용을 필요로합니다. 서로 다른 세포 혈통을 가진 다른 뇌 영역을 생성하는 능력과 이들을 마음대로 융합시킬 수있는 잠재력은 뇌 오가노이드를 인간의 뇌 발달을 조사하고 뇌 관련 질병의 기본 메커니즘을 해독하기위한 훌륭한 모델로 만듭니다. 뇌 오가노이드를 생성하는 이러한 방법은 인간의 뇌 영역을 모델링하는 데 획기적인 역할을 하지만, 오가노이드 간의 가변성과 이질성은 약물 스크리닝과 같은 체계적이고 정량적인 연구에 중요한 한계로 남아 있습니다.
현재의 프로토콜은 우리의 최근 논문9 에서 개발 된 방법을 기반으로하며 이중 SMAD 억제제 (SB-431542 및 LDN 193189)와의 신경 외배엽 (NEct) 동일성으로 hPSC 콜로니를 선택적으로 분화시킨 다음 FGF2 신호 전달의 영향으로 3D 신경 상피 구상체로 4 일 이내에 자체 조직 할 수있는 능력을 갖습니다. 이러한 신경상피 구상체는 분화 후 4주 이내에 생체내 유사 세포 조성을 갖는 균질한 피질 오가노이드를 확실하게 생성한다. 여기에 설명된 프로토콜은 이중 SMAD(Decapentaplegic에 대한 어머니의 억제자) 신호전달의 억제가 내피, 중배엽 및 트로피토배엽 세포 운명 선택(11)을 억제함으로써 신경외배엽 전구세포(10 )로부터 유래된 로스트랄 신경 줄기 세포로의 hPSCs의 분화를 촉진한다는 것을 보여주는 우리의 이전 발견에 기초한다(11) . 또한, hESC 인증 기저막 매트릭스에 신경 상피 구상체를 매립하면 신경 상피의 상당한 싹이 트고, 아피코바살 극성을 가진 심실을 형성합니다. 대규모 배양은 세포주, 클론 또는 배치와 무관한 피질 오가노이드의 재현성 및 균질성을 나타냈으며, 따라서 시험관 내에서 건강 및 질병에서 초기 인간 피질 발달을 모방하는 안정적이고 안정한 줄기 세포 시스템을 나타낸다. 우리는 장기간 배양 된 hPSC 유래 피질 뇌 오가노이드에서 노인성 신경 세포 마커를 검출하기위한 프로토콜을 추가로 개략적으로 설명합니다.
hPSCs를 20%-30%의 시딩 밀도로 플레이팅한 후, 세포를 3일 동안 이중 SMAD 억제제로 처리하여 hPSC 콜로니를 신경외배엽 콜로니로 분화시킨다. 그런 다음 이들 콜로니를 디스파아제로 부드럽게 들어 올리고 FGF2로 보충된 초저 부착물 6-웰 플레이트에 시딩한다. 부유 2D 콜로니는 하룻밤 사이에 3D 신경 외배엽 구상체로 자체 조직되고 FGF2로 매일 보충 된 N2 배지에서 4 일 동안 유지됩니다. 일단 구상체가 신경 상피층을 확립하면, 그들은 기저막 매트릭스에 매립 될 수 있습니다. 신선한 말단 분화 배지를 일상적으로 추가함으로써, 연구자들은 피질 오가노이드에서 신경 상피의 점진적 확장과 싹을 관찰 할 것입니다. 연구자들은 전사 및 프로테오믹 프로파일링을 수행하기 위해 이러한 오가노이드를 해리하기를 원할 수 있다. 또한 피질 오가노이드의 품질을 모니터링하기 위해 밝은 필드 이미징이 권장됩니다. 분석은 고정, 냉동 절제술 및 면역 염색에 의해 수행될 수 있다. 이러한 기술들에 대한 설명 및 방법들은 이전에 설명되었다(12). 궁극적으로,이 프로토콜은 연구자가이 논문에 설명 된대로 개발 중인 인간 피질 뇌를 모델링하고 세포 신경 노화의 측면을 연구하기 위해 균질 한 피질 뇌 오가노이드를 신속하고 견고하게 생성 할 수있게합니다.
1. 피질 뇌 오가노이드 생성
참고: 프로토콜의 이 섹션에 있는 모든 단계는 달리 명시되지 않는 한 클래스 2 생물안전 후드에서 발생합니다.
- hPSC 2D 배양물로부터의 2D 신경외배엽 콜로니의 유도 (데이즈-1 내지 3)
- 유도 전에, hPSC 콜로니를 20%-30% 밀도의 6-웰 플레이트 내의 hESC 적격 기저막 매트릭스 상에 플레이트화한다. hPSC 콜로니를 60% 플루언시에서 6-웰 플레이트의 한 웰에서 6-웰 플레이트의 세 웰로 통과시켜 이 밀도를 달성하십시오.
- 기저막 매트릭스 코팅의 경우, 기저막 매트릭스를 일반 기저 매질에서 1:50의 비율로 희석한다. 6-웰 플레이트 1mL/웰을 골고루 침전시키고, 실온(RT)에서 1시간 동안 배양한 다음, 흡인한다.
- hPSC 콜로니를 분화 전에 무혈청 세포 배양 배지 2 mL에 1일 동안 유지한다.
- hPSC 분화 당일, 검출 가능한 분화 없이 건강한 콜로니를 보장하기 위해 4x 내지 10x 배율의 브라이트필드 현미경을 사용하여 hPSC 콜로니를 검사한다.
참고 : 건강한 hPSC는 큰 핵, 매우 작은 세포질 및 눈에 띄는 핵을 가진 세포와 함께 단단한 가장자리 식민지를 형성합니다. 분화된 iPSC 콜로니는 위에서 설명된 hPSC 콜로니의 것, 특히 콜로니의 외부 가장자리 주위 또는 중앙에 대한 명확한 형태학적 차이를 나타낼 것이다. - 표 1에 열거된 시약을 추가하여 분화에 필요한 N2 배지를 구성한다. 사용하기 전에이 매체를 RT로 가져 오십시오.
- RT에 도착하면, 6-웰 플레이트의 각 웰로부터 무혈청 세포 배양 배지를 흡인하고, 5 mL 혈청학적 피펫으로 부드럽게 첨가된 2 mL의 N2 배지로 교체한다.
- 이중 SMAD 억제제인 SB-431542 (10 μM) 및 LDN 193189 (100 nM)을 첨가한다.
참고: SMAD 억제제는 배지가 각 웰에 배치된 후 N2 배지에 첨가될 수 있거나, 무혈청 세포 배양 배지를 교체하기 전에 필요한 양의 N2 배지에 첨가될 수 있다. 억제제는 플레이트를 부드럽게 소용돌이치거나 배지 및 억제제를 함유하는 튜브를 3-4회 뒤집음으로써 배지 내로 고르게 혼입될 수 있다. - SB-431542 (10 μM) 및 LDN 193189 (100 nM)로 보충된 신선한 N2 배지를 다음 2일 동안 매일 각 웰에 첨가하십시오.
참고: SB-431542 및 LDN 193189 화합물을 용해시키고 세포독성을 방지하는 데 사용되는 DMSO에 대한 세포의 장기간 노출을 줄이기 위해 신선한 N2 배지가 첨가됩니다.
- 유도된 2D 신경외배엽 콜로니로부터 3D 신경외배엽 구상체의 생성(제3일 내지 제7일)
- dispase를 사용하여 유도된 신경외배엽 콜로니를 들어 올리고 단계 1.2.2-1.2.8을 따른다.
- 먼저, 6-웰 플레이트로부터 2 mL의 N2 배지를 제거하고, 모든 N2 배지가 제거되도록 HBSS로 1x 세척한다.
참고: N2 배지는 dispase의 효소 활성을 방해하여 우물에서 신경 외배엽 콜로니의 적절한 분리를 방지할 수 있습니다. - 1 mL의 2.4 unit/mL 디스파제를 각 콜로니 함유 웰에 첨가한다.
- 웰을 37°C에서 20-25분(최대 30분) 동안 인큐베이션한다. 식민지 분리를 정기적으로 확인하십시오.
참고: 작은 식민지는 20분 이내에 분리될 수 있습니다. 30 분 후에 붙어있는 식민지는 무시해야합니다. - 인큐베이션 후, 1 mL의 N2 배지를 웰에 첨가하여 디스파아제 효소의 활성을 정지시키고, 멸균 가위로 절단된 넓은 보어 P1000 피펫 팁 또는 변형된 P1000 피펫 팁을 사용하여 콜로니를 15 mL 튜브로 옮깁니다 (넓은 보어 P1000 팁으로 만들기).
- 식민지 덩어리가 중력으로 튜브 바닥으로 가라 앉게하십시오.
참고: 이 프로세스는 약 1분 정도 걸립니다. - 덩어리가 가라 앉으면 표준 P1000 피펫 팁으로 상층액을 조심스럽게 제거하고 1mL의 신선한 N2 배지로 교체하십시오. 이 세척 단계를 세 번 반복하여 디스파제를 완전히 제거하십시오.
참고 : 남아있는 dispase는 신경 외배엽 구상체의 균일 한 형성을 방지하고 세포 사멸을 유도합니다. - 세척 후, 세포 덩어리를 3 mL의 N2 배지에 재현탁시키고 6-웰 플레이트의 한 웰로 옮기고 40 ng/mL의 bFGF를 첨가한다.
참고 : 많은 수의 신경 외배엽 콜로니가 분리 된 경우,이 콜로니는 구상체 융합을 방지하기 위해 6 웰 플레이트의 두 개 이상의 웰에 도금 될 수 있습니다. 콜로니의 분리 효소 분리 후 24 시간 후, 구상체가 형성되었는지 확인하십시오. - 다음 3-4 일 동안 동일한 배지에 구상체를 유지하되 매일 각 웰에 신선한 bFGF (40 ng / mL)를 첨가하여 신경 외배엽 세포 증식을 촉진하고 자체 조직화하며 신경 상피를 유도하고 확장시킵니다.
참고: 구상체가 더 높은 밀도로 도금된 경우 미디어가 노란색으로 변할 수 있으며 2일마다 신선한 bFGF(40ng/mL)로 교체해야 합니다. 그러나 이것은 권장되지 않으며, 대신이 문제를 피하기 위해 각 웰에서 더 적은 수의 구상체를 유지해야합니다. 구상체는 신경 상피가 명백한 경우 3 일 후에 기저막 매트릭스에 매립 될 수 있습니다. 신경 상피가 분명하지 않거나 강하게 보이지 않으면 구상체를 하루 더 유지하고 다시 확인하십시오.
- 피질 뇌 오가노이드 분화 및 유지 (Day 8)
- 표 2에 열거된 시약을 이용하여 말단분화 배지(DM)를 제조하였다. 이 미디어를 RT로 가져옵니다.
- 얼음 위에서 100% hESC 인증 기저막 매트릭스를 해동합니다.
- 10cm 페트리 접시에 70 % 에탄올로 멸균 된 보조개로 파라 필름 시트를 준비하고 후드 아래의 입체 현미경에 놓습니다.
참고: 200μL 피펫 팁의 빈 트레이를 사용하여 딤플 그리드를 생성할 수 있습니다. - 끝을 100 μL 피펫 팁에서 잘라냅니다 (넓은 보어로 만들기 위해). 이것은 신경 구상체를 깨뜨리지 않고 지하실 매트릭스에 내장하는 데 사용됩니다.
- 입체 현미경을 사용하여 6-웰 플레이트에서 유사한 크기의 신경 구상체 (500 μm)를 선택하고 와이드 보어 100 μL 피펫 팁을 사용하여 파라 필름 딤플로 옮기고 딤플 당 단일 신경 스페로이드를 배치합니다.
- 과도한 매체를 부드럽게 제거하고 구상체를 덮을만큼 충분히 남겨 둡니다.
참고 : 이것은 지하실 매트릭스를 추가하기 전에 구상체의 품질을 유지하고 건조하지 않도록하기위한 것입니다. - 18 μL의 지하 매트릭스를 스페로이드 위에 부드럽게 첨가하여 스페로이드를 매트릭스 드롭의 중심 내에 위치시킵니다. 10 μL 피펫 팁의 끝을 사용하여 매트릭스의 구상체를 중앙에 맞춥니다.
참고 : 구상체 주변의 과도한 매체가 마르지 않도록 가능한 한 빨리 지하실 매트릭스를 추가하십시오. - 10 cm 페트리 접시를 덮고 인큐베이터 내로 옮기고, 25분 동안 37°C에서 지하 매트릭스 포매된 구상체와 함께 파라필름 디쉬를 인큐베이션한다.
- 인큐베이션 후, 0.5mL의 DM 배지가 있는 P1000 팁을 사용하여 포매된 구상체를 낮은 부착 24웰 플레이트로 헹구고, 개별 임베디드 구상체가 각각 하나의 웰에 배치되도록 한다.
참고: 둘 이상의 내장된 스페로이드가 하나의 웰에 떨어지는 경우 와이드 보어 P1000 팁을 사용하여 다른 스페로이드를 새 웰로 옮깁니다. - 분화 된 피질 뇌 오가노이드를 DM 배지에서 장기간 유지하며, 오가노이드가 점점 더 커지면 2 일마다 미디어 변화가 발생합니다.
참고 : 분화의 첫 주 동안, 배지는 3 일마다 변경 될 수 있습니다.
2. 피질 오가노이드의 신경 노화의 특성화
- 냉동 절제를위한 피질 오가노이드 처리 :
참고: 상기 단계는 클래스 2 생물안전 후드에서 수행되었다.- 각각 1.5 mL의 4% 파라포름알데히드(PFA)로 채워진 2 mL 튜브를 준비한다.
- P1000 피펫 팁의 끝을 자르고 (넓은 보어로 만들기 위해) 각 오가노이드를 위에서 준비한 2mL 튜브 중 하나 (튜브 당 하나의 오가노이드)로 부드럽게 옮깁니다.
참고: PFA와 과도한 DM 매체가 혼합되는 것을 방지하려면 오가노이드가 P1000 피펫 팁의 개구부 쪽으로 가라앉도록 하고 오가노이드를 피펫팅하기 전에 튜브의 PFA 상단 바로 위에 팁을 놓습니다. 이것은 연구원이 오가노이드와 매우 최소한의 매체 만 전송할 수있게 해줍니다. - 고정 공정이 4°C에서 1시간 동안 진행되도록 합니다.
- 절단되지 않은 P1000 피펫 팁을 사용하여 과량의 PFA를 조심스럽게 흡인하고 차가운 1x PBS 1.5 mL를 첨가하십시오.
- 튜브를 RT에서 10분 동안 70rpm으로 설정된 오비탈 셰이커로 옮깁니다.
- 차가운 1x PBS로 세척 과정을 세 번 반복하여 모든 PFA가 완전히 제거되었는지 확인하십시오.
참고: PFA를 일반 폐기물 용기에 버리지 마십시오. 대신 PFA가 위험하기 때문에 특정 화학 폐기물 처리 용기를 준비하십시오. - 오가노이드를 30% 수크로스를 함유하는 1x PBS에 침지시키고, 모든 오가노이드가 튜브의 바닥에 가라앉을 때까지 4°C에서 인큐베이션한다.
참고 : 오가노이드가 가라 앉을 수 있도록하는 데 필요한 시간은 오가노이드의 크기 / 나이에 따라 다릅니다. 3 개월 된 오가노이드는 최대 5 시간이 걸릴 수 있습니다. - 절단된 와이드 보어 P1000 피펫 팁을 사용하여 3~5개의 오가노이드를 3:2의 비율로 30% 자당과 100% 최적 절삭 온도(OCT) 매체로 만든 장착 용액이 들어있는 장착 몰드로 부드럽게 옮깁니다.
- 입체 현미경의 도움으로 10μL 피펫 팁을 사용하여 오가노이드를 격자 모양의 패턴으로 배향하고 배치하십시오.
- 몰드를 드라이 아이스 위에 놓고 냉동 절편화(16-20 μm)를 진행하기 전에 슈크로스 OCT 용액을 동결 스탯을 사용하여 응고시킨다.
참고: 노화와 관련된 베타-갈락토시다제의 경우, 모든 조직은 일단 가라앉은 후 절편을 위해 처리되어야 합니다. 면역 형광의 경우, 조직은 다음날 절편화를 위해 처리 될 수 있습니다. 절편을 함유하는 모든 슬라이드는 즉시 염색되지 않은 경우 후속 면역형광 또는 베타-갈락토시다제 전에 -20°C에서 보관되어야 한다.
- 피질 뇌 오가노이드의 노화 분석 과정 :
참고: 다음 단계는 일반 랩 벤치에서 수행할 수 있습니다.- 슬라이드를 뚜껑이 있는 현미경 슬라이드 염색 용기에 옮기고 절편된 오가노이드 조직을 RT에서 10분 동안 1x PBS로 세 번 세척하여 임의의 과량의 장착 용액을 제거하였다.
- 이어서, 세척된 조직을 갓 만든 베타갈락토시다제 염색 용액으로 37°C에서 하룻밤 동안 인큐베이션한다.
참고: 베타-갈락토시다제 염색 용액은 인산염 완충액(10 mL의 인산염 완충액에 대해: 8.15 mL의 1 M NaH2PO4, 1.85 mL의 1MNa2HPO4)으로 제조되며,pH = 6, 100 mM의 칼륨 헥사시아노페레이트(III), 100 mM의 칼륨 헥사시아노페레이트(II) 삼수화물, 5 M의 NaCl, 1 M의MgCl2, 20 mg/mL의 X-Gal. CO2로서CO2를 함유하는 표준 세포 배양 배양기를 사용하지 않으면 베타갈락토시다제 염색 용액의 pH가 변화될 것이다. - 염색된 조직을 RT에서 각각 10분 동안 1x PBS로 세 번 세척하여 베타갈락토시다제 용액을 제거하였다.
- 세척된 조직을 유리 페이드 방지 장착제로 장착하고 현미경으로 보기 전에 장착 용액이 RT에서 30분 동안 응고되도록 합니다.
여기서 우리는 연구자들이 배양 후 1-3 개월 이내에 생체 내 인간 피질 뇌 영역을 모방 한 동질적인 hPSC 유래 피질 뇌 오가노이드를 생성 할 수있게 해주는 강력한 프로토콜을 설명했습니다. hPSC 콜로니는 먼저 분화 배지에서 배양되어 신경 외배엽 콜로니를 생성하고, 이는 신경 구상체를 형성하는데 사용될 수 있다. 이들 구상체는 후속적으로 기저막 매트릭스에 매립되고 뉴런 노화를 모델링하는 데 사용될 수 있는 오가노이드를 생산하기 위해 장기간 유지된다(프로토콜의 개요는 도 1 참조). 이러한 오가노이드를 초코팅되지 않은 24웰 플레이트에서 배양하면 세포 스트레스가 유발되고 시험관 내 배양 13주에 걸쳐 노화 관련 표현형이 촉진된다는 점은 주목할 가치가 있습니다. 이러한 프로토콜로부터 유래된 오가노이드는 또한 피질판 신경 세포의 최적 성장 및 분화를 위해 교반된 생물반응기 내에서 또는 공기-액체 계면에서 유지될 수 있다.
시작하기 위해, hPSC 콜로니는 신경외배엽 분화 전에 1일 동안 배양된다. 이러한 hPSC 콜로니는 단지 20%-30% 컨플루언시까지만 배양되고 가능한 최고 품질, 즉 콜로니를 오염시키는 분화된 세포가 없는 타이트한 편평한 단층인 것이 중요하다(그림 2A,B). hPSC 콜로니의 다능성은 NANOG와 같은 마커의 발현에 의해 확인되어야 한다(도 2C). 검증된 hPSC 콜로니는 SB-431542 및 LDN 193189로 N2 신경외배엽 분화 배지에 노출된다. 이 배지에서 3일간 유지한 후, hPSC 콜로니는 신경외배엽 콜로니로 분화되어야 하고, 더 이상 hPSCs의 동일한 타이트한 편평한 단층 형태를 나타내지 않아야 하며(그림 2B), 오히려 그들은 더 긴 기둥 모양의 세포가 될 것이다(도 2B). 이들 세포는 또한 NANOG와 같은 다능성 마커에 대해 음성일 것이다(도 2C).
이 단계에서 신경 외배엽 콜로니는 효소적으로 dispase로 분리되며, 건강하고 성공적으로 분리 된 각 식민지는 스스로 조직하고 젊은 신경 스페로이드를 형성 할 수 있습니다 (그림 2D, 보충 비디오 1). 건강하고 깨끗한 신경 외배엽 콜로니 만이 디스 파제 활성에 지정된 기간 내에 분리됩니다. 다른 모든 식민지는 구상체의 품질이 떨어지기 때문에 무시해야합니다. N2 배지에서 FGF2에 매일 노출되면, 이들 구상체 내의 신경 줄기 세포 (SOX2+) (도 2D, 1일째)는 증식하여 상당한 수의 신경 로제트를 형성한다 (도 2D, 제4일째). 이들 로제트는 로제트의 중심 내에 위치하는 세포에서 그리고 구상체의 외부 가장자리를 따라 위치한 세포에서 타이트한 접합 및 상피 마커 ZO1을 발현하여, 스페로이드의 정점-기저 극성을 입증한다(도 2D, 제4일째). 구상체의 전체 마운트 3D 이미징을 위한 방법은도 13 이전에 기술되었다. 구상체의 매일 검사는 단단하고 어두운 바깥 쪽 가장자리와 구상체의 밝은 둘레의 형성을 밝혀야하며, 이것은 신경 상피층입니다. 이 층은 대략 직경 500 μm로 3-4 일 후에 충분히 형성되어야하며, 이때 구상체가 지하 매트릭스에 매립 될 수 있습니다. 이 층이 존재하지 않거나 약하게 형성되면, 구상체는 앞으로 나아갈 수있을만큼 충분히 발달되지 않습니다. 변화를 관찰하기 위해 다른 날을 기다리는 것이 좋지만, 이것이 관찰되지 않으면 이러한 구상체를 무시하십시오.
배양 3일 후의 구상체의 대표적인 밝은 필드 이미지는 도 2D에서 볼 수 있다. 다른 이웃 구상체와 융합되지 않은 단단한 신경 상피층을 가진 구상체는 반투명 조직을 가지며 신경 로제트 형성을 보여 주며 지하 매트릭스에 매립되도록 선택됩니다. 일단 내장되면, 스페로이드는 빠르게 증식하고 싹을 틔우기 시작할 것입니다 : 컴팩트 한 조직의 노드가 나타나 구상체의 본체에서 바깥쪽으로 확장됩니다. 이것은 기저 매트릭스에서 1-3주 사이에 명백하며 다수의 세포주에 걸쳐 관찰될 수 있다(도 3A). 포매된 구상체의 정량적 분석은 3개의 상이한 세포주에 걸쳐 구상체의 최대 100%에서 상피 세포의 존재를 확인하여, 이 프로토콜로부터 기대되는 동질성 및 재현성을 확인한다(도 3B). 시험관내 분화 동안 오가노이드 직경의 정량화는 hPSC의 상이한 라인에 걸친 재현성을 추가로 확인시켜준다(도 3C). 신진 현상이 발생하지 않으면 구상체가 적절하게 발달하지 않으므로 폐기해야합니다. 일단 구상체가 매트릭스에 매립되면, 그들의 발달은 진행되고, 구상체는 이제 오가노이드로 불린다. 면역 형광 염색은 또한 명확한 층상으로 오가노이드에서 CTIP2 및 SATB2로 염색 된 피질층 마커뿐만 아니라 신경 전구 세포 (PAX6)의 존재를 확인합니다 (그림 3D, E). 이 계층화는 오가노이드 유지 관리의 여러 시점에서 관찰 할 수 있습니다 (그림 3D, E). 조직의 면역조직화학의 방법은14 이전에 기술되었다.
이러한 오가노이드의 한 가지 가능한 적용은 신경 노화 관련 과정이 뇌에 어떻게 영향을 미치는지 연구하는 것입니다. 이를 조사하기 위해, 성공적으로 생성된 오가노이드는 노화-관련 베타-갈락토시다제 및 p21과 같은 노화의 표준 분자 바이오마커에 대한 절편화 및 염색을 위해 다수의 상이한 시점으로부터 수확된다. 도 4A는 기저막 매트릭스에 포매된 후 4 및 13주 후에 오가노이드의 노화 관련 베타-갈락토시다제 염색의 대표적인 이미지를 도시한다. 4 주에서 13 주 사이에, 노화 관련 베타 갈락토시다제의 존재가 현저하게 증가했으며, 이는 유기체 노화의 인식 된 동인 인 세포 노화가 배양에서이 시간에 걸쳐 발생했음을 시사합니다. 13주차에 오가노이드의 면역형광 염색은 성숙 피질 뉴런 마커(CTIP2)로 공동표지된 또 다른 노화 마커 p21의 존재를 확인하고 도 4B에서 확인할 수 있다. 그러나 p21의 존재는 세포 주기 정지의 마커이며 그 자체로 노화의 결정적인 마커가 아니며, p16 및 SASP (노화 관련 분비 표현형) 인자와 같은 노화의 다른 마커의 검출은 세포를 노화로 결정적으로 확인하기 위해 권장됩니다.
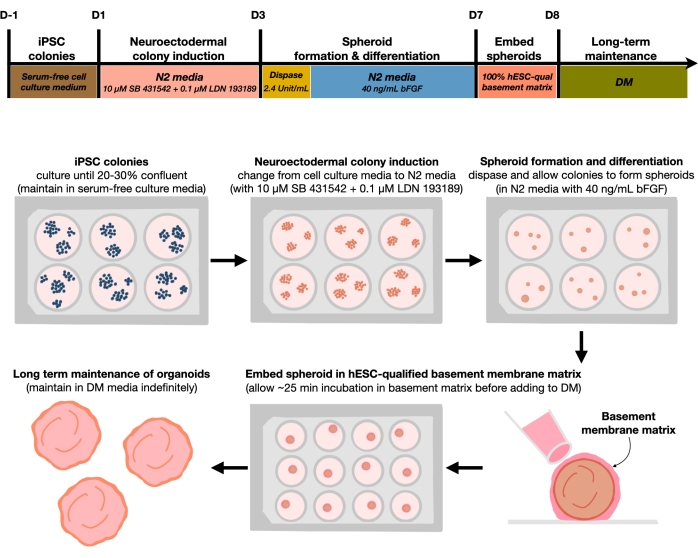
그림 1: 재현 가능한 피질 뇌 오가노이드를 생성하기 위한 개략도. 피더가없는 배지에서 유지되는 hPSCs에서 피질 뇌 오가노이드의 생성을위한 실험 절차의 개략적인 워크 플로우. 워크플로우는 2D hPSC를 오가노이드의 3D 패턴화된 피질판 인간 조직으로 분화하는 데 관련된 여섯 단계에 대한 개요를 제공합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
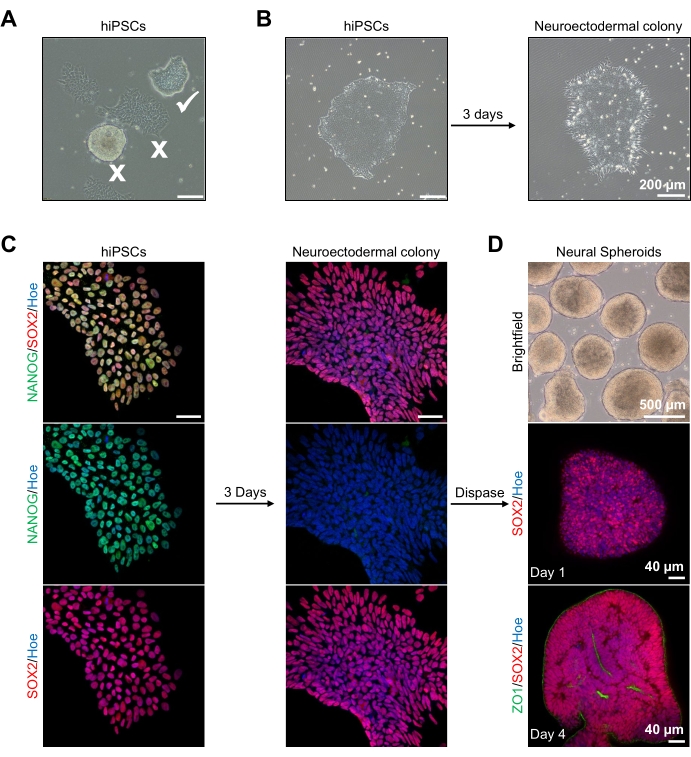
도 2: 신경외배엽 콜로니-hPSCs로부터 유래된 신경 구상체의 생성 . (A) 최적 (백색 진드기) 및 분화된 콜로니 (백색 십자가)를 나타내는 인간 PSC의 대표적인 이미지. 스케일 바: 200 μm, 4x 배율. (b) 이중 SMAD 억제제 처리 3일 후 hPSCs로부터 유래된 신경외배엽 콜로니의 대표적인 이미지. 스케일 바: 200 μm, 4x 배율. (c) 인간 PSC 콜로니는 신경외배엽 콜로니로 분화되었다. 이미지는 PSC (1일째) 및 신경외배엽 (3일째) 콜로니를 SOX2 (적색), NANOG (녹색)로 염색한 것을 나타내며, 모든 핵은 Hoechst 33342 (파란색)로 역염색되었다. 스케일 바: 40 μm, 100x 배율. (d) 브라이트필드 하에서 시험관내 배양하고, 1일째에 SOX2(적색)로 면역염색하고, 4일째에 SOX2(적색) 및 ZO1(녹색)로 이중 면역염색하여 시간에 따른 피질 뇌 구상체의 발달 단계를 보여주는 이미지. 밝은 필드 이미지의 스케일 바는 500 μm, 4x 배율, 하단 이미지의 스케일 바는 40 μm, 배율 20 배율이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
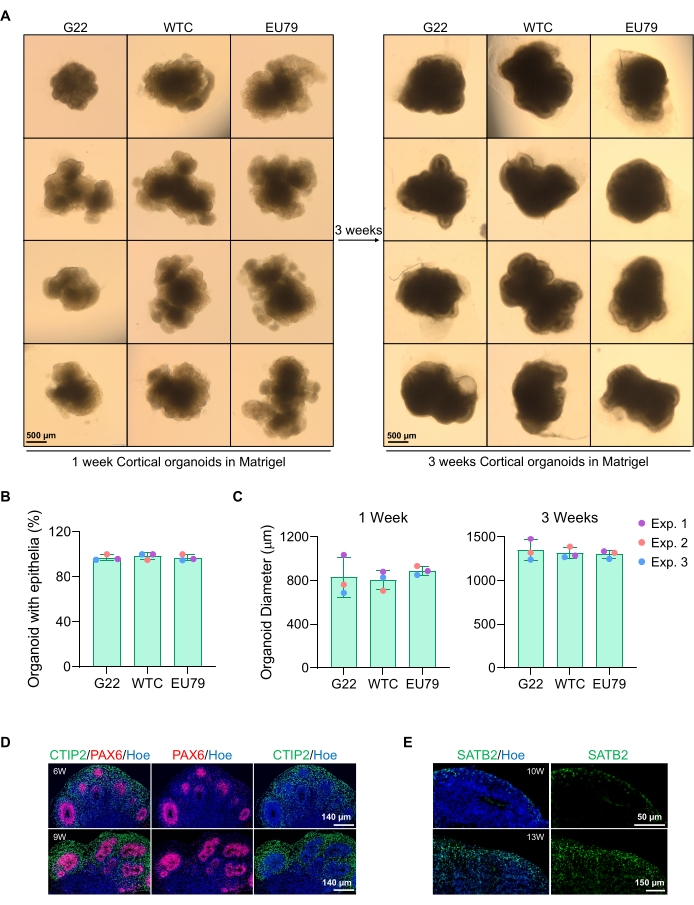
도 3: 상이한 hPSC 라인으로부터 유래된 피질 뇌 오가노이드의 특성화. (A) 시험관내에서 3주에 걸쳐 배양된 G22, WTC 및 EU79 인간 iPSC 라인으로부터 유래된 피질 뇌 오가노이드의 대표적인 이미지. 모든 이미지의 스케일 바는 500 μm, 2x 배율이다. (B) 상이한 hPSC 라인(G22, WTC 및 EU79)에서의 시험관내 분화의 3주째에 피질 뇌 오가노이드의 성공적인 생성의 백분율. N = 3. 데이터는 평균 ± 표준 편차로 표시됩니다. (c) 인간 다능성 줄기 세포주(G22, WTC, 및 EU79)의 상이한 라인에서의 시험관내 분화의 1주 및 3주째에 피질 뇌 오가노이드(평균 직경 기준)의 성장을 보여주는 막대 그래프. N = 3. 데이터는 평균 ± 표준 편차로 표시됩니다. (d) 심실 구역 PAX6 (적색) 및 피질 플레이트 CTIP2 (녹색)에 대해 면역염색된 G22 hPSCs로부터 유래된 6주 및 9주령 피질 뇌 오가노이드의 절편의 대표적인 이미지. 모든 절편은 Hoechst 33342 (파란색)로 역염색하였다. 스케일 바 = 140 μm, 20x 배율. W는 주입니다. (e) 피질층 IV SATB2(녹색)에 대해 면역염색된 WTC hPSCs로부터 유래된 10주 및 13주령의 피질 뇌 오가노이드의 절편의 대표적인 이미지. 모든 절편은 Hoechst 33342 (파란색)로 역염색하였다. 10주 이미지 스케일 바 = 50 μm, 40x 배율. 13주 이미지 스케일 바 = 150 μm, 40x 배율. W는 주입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
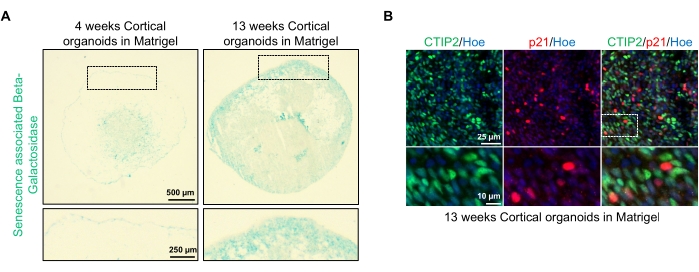
도 4: hPSCs로부터 유래된 피질 뇌 오가노이드에서의 노화의 특성화. (A) 시험관내에서 4 및 13주 동안 배양하고 SA-β-gal로 염색한 WTC hPSCs로부터 유래된 인간 피질 뇌 오가노이드의 절편의 대표적인 이미지. 배율 막대 = 500μm, 확대/축소된 이미지의 배율 막대 = 250μm, 배율 4배율. 점선 상자는 확대된 이미지를 나타냅니다. (B) 피질 뉴런 CTIP2 (녹색) 및 p21 (적색)에 대해 면역염색된 인간 EU79 hPSCs로부터 유래된 13주령 피질 뇌 오가노이드의 절편의 대표적인 이미지. 모든 절편은 Hoechst 33342 (파란색)로 역염색되었다. 배율 막대 = 25μm, 확대/축소된 이미지의 배율 막대 = 10μm, 배율 40배. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 미디어 구성 요소 | 농도 |
| DMEM 영양소 믹스 F12 10x 500 mL (DMEM/F-12) | |
| N2 보충제 5 mL (100x) | 1%로 대체됨 |
| B 27 보충제 10 mL | 2 %로 보충 |
| MEM 비필수 아미노산 용액 (100x) | 1 %로 보충 |
| 페니실린-스트렙토마이신 (10,000 U/mL) | 1 %로 보충 |
| 2- 메르캅토 에탄올 50 mL (1000x) | 0.1 %에서 보충 |
표 1: N2 배지. 표에는 N2 배지를 준비하는 데 필요한 시약이 나열되어 있습니다.
| 미디어 구성 요소 | 농도 |
| DMEM 영양소 믹스 F12 10x 500 mL (DMEM/F-12) | DM 배지는 DMEM/F12 및 뉴로베이스 미디어의 1:1 비율로 만들어집니다. |
| 신경기저 배지 | |
| N2 보충제 5 mL (100x) | 0.5%로 대체됨 |
| B 27 보충제 10 mL | 1 %로 보충 |
| MEM 비필수 아미노산 용액 (100x) | 1 %로 보충 |
| 글루타MAX 보충제 100x | 1 %로 보충 |
| 페니실린-스트렙토마이신 (10,000 U/mL) | 1 %로 보충 |
| 인슐린 용액 인간 재조합 | 50mL의 배지에 대해 12.5μL |
| 2-메르캅토에탄올 50 mL (1000x) | 50mL의 배지에 대해 17.5μL |
표 2: 분화 배지(DM). 표에는 분화 배지를 준비하는 데 필요한 시약이 나열되어 있습니다.
보충 비디오 1. bFGF의 처리하에 유도된 hNEct 2D 시트/콜로니 변환을 3D로 실시간 이미징. hNEct의 유도된 콜로니를 상기 요약된 바와 같이 디스파아제로 디쉬로부터 부드럽게 분리하고, 낮은 부착 6-웰 배양 플레이트로 옮겼다. 2D hNEct 콜로니는 12시간 이내에 3D hNEct 구상체로 전환되었다. 직렬 이미지는 매 5분마다 캡처되었다. 배율 막대 = 100 μm. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
약물 스크리닝 및 질병 모델링에서 hPSC 유래 뇌 오가노이드를 사용할 수 있도록하려면 복제 가능하고 신뢰할 수있는 프로토콜15에 따라 오가노이드를 만드는 것이 중요합니다. 뇌 오가노이드는 일반적으로 hPSCs에서 유래 된 배아체에서 생성되며, 이는 조직 확장 및 신경 분화를 촉진하는 세포 외 매트릭스에 내장됩니다. 랭커스터의 1,16,17 및 Velasco18과 같은 프로토콜과 비교할 때, 배아체에서 시작하여 개발 된 오가노이드가 뒤따르는 기본 분화 경로를 허용함으로써 우리는 배아체가 아닌 인간 NEct 세포로 피질 뇌 오가노이드 생성을 시작하면 피질 뇌 오가노이드 형성의 일관성이 향상된다는 것을 발견했습니다. 이것은 결과적으로 약물 및 표현형 스크리닝에 필요한 스케일링을 허용합니다. 인간 NEct 세포는 상당한 양으로 확장 될 수있을뿐만 아니라 쉽게 동결 보존 될 수 있기 때문에이 접근법은 실험 간의 재현성을 향상시킵니다. 또한 Bioreactors 및 유사한 기술의 사용을 채택 한 다른 프로토콜과 비교할 때이 프로토콜에는 특수 장비가 필요하지 않으므로 모든 실험실6에 적합합니다. 마지막으로, SATB2와 같은 피질층 마커에 양성인 성숙한 오가노이드를 생성하는 데 필요한 시간은 랭커 스터1 및 생물반응기 프로토콜 6,19에 비해 감소되어 건강 및 질병 1,6,16에서 인간 피질 발달의 발달 궤적을 연구하는 데 더 적합합니다.
또한, 병인에 기여하는 뇌의 노화 세포 유형의 증가와 관련된 치매와 같은 노화 관련 질병의 지속적인 글로벌 건강 관리 영향을 감안할 때, 뇌 노화를 개선 할 수있는 화합물을 확인하고 테스트하는 능력은 엄청난 관심사입니다. hPSCs가 리프로그래밍 과정(20) 동안 후성 유전학적으로 젊어지는 것으로 알려져 있음에도 불구하고, 우리는 장기간 배양 된 피질 뇌 오가노이드에서 노인성 세포의 강력한 증가를 발견한다. 이것은 이제 뇌에서 그러한 노화 세포를 제거하는 약물 (senolytics)을 가능하게하거나이 과정을 늦추는 약물 (senostatics)21을 가능하게하는 유망한 개발입니다. 인간 NEct 유래 피질 뇌 오가노이드는 인간 기원이기 때문에,이 접근법은 그러한 새로운 치료제를 시장에 내놓는 전통적인 경로를 단축시킬 것입니다.
이 프로토콜에는 두 가지 중요한 단계가 있습니다. 첫 번째는 분화 당시의 hPSC 콜로니의 정확한 컨플루언시 수준이다. hPSC 콜로니는 생성 된 NEct 식민지가 이웃 식민지와 융합되지 않고 개별 오가노이드가 clonally 구동되도록하기 위해 최대 30 % 합류해야합니다. 두 번째 중요한 단계는 NEct 콜로니를 들어 올리고 신경 구상체를 생성하기 위해 dispase를 올바르게 사용하는 것입니다. dispase로 인큐베이션하는 타이밍은 생성 된 신경 구상체의 최종 품질에 중요합니다. 이는 디스파아제를 사용한 콜로니의 과다 노출이 세포(22 )에 독성이 있고 결국 생성된 오가노이드의 품질에 영향을 미치기 때문이다. 이 프로토콜의 한계는 dispase로 들어 올려지는 초기 콜로니의 크기에 의존하기 때문에 신경 구상체의 크기를 제어하기가 어렵다는 것입니다. 그러나이 문제는 임베딩 단계로 진행할 때 비슷한 크기의 신경 구상체를 선택하여 극복 할 수 있습니다.
마지막으로, 미래의 응용 프로그램은 로봇 분석 및 생물 약제 스크리닝 접근법에서 이러한 재현 가능한 피질 오가노이드의 사용으로 확장 될 수 있습니다. 이것은 인간 NEct 세포에서 피질 뇌 오가노이드의 생성이 쉽게 자동화 될 수 있음을 나타내는 실험실의 예비 데이터에 의해 뒷받침되며, 이러한 접근법과 호환 될 수 있습니다.
저자는 공개 할 것이 없습니다.
이 연구는 의학 연구 미래 기금 가속 연구, 백혈구 이영양증 주력 마시모 사명 (EPCD000034), 의학 연구 미래 기금 - 줄기 세포 임무 (APP2007653)에 의해 지원됩니다. 저자는 보충 비디오 1에서 데이터를 생성 한 이주현 박사 (고려대학교)에게 감사하고 싶습니다.
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved