Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
Robust og svært reproduserbar generering av kortikale hjerneorganoider for modellering av hjernens nevronale senescens in vitro
I denne studien gir vi en detaljert teknikk for et enkelt, men robust kortikalt organoidkultursystem ved bruk av standard materfrie hPSC-kulturer. Dette er en rask, effektiv og reproduserbar protokoll for å generere organoider som modellerer aspekter av hjernens senescens in vitro.
Hjerneorganoider er tredimensjonale modeller av den utviklende menneskelige hjerne og gir en overbevisende, banebrytende plattform for sykdomsmodellering og storskala genomisk og narkotika screening. På grunn av den selvorganiserende naturen til celler i hjerneorganoider og det voksende spekteret av tilgjengelige protokoller for deres generasjon, har problemer med heterogenitet og variabilitet mellom organoider blitt identifisert. I dette protokollpapiret beskriver vi en robust og replikerbar protokoll som i stor grad overvinner disse problemene og genererer kortikale organoider fra nevroektodermale forfedre innen 1 måned, og som kan opprettholdes i mer enn 1 år. Denne svært reproduserbare protokollen kan enkelt utføres i et standard vevskulturrom og resulterer i organoider med et rikt mangfold av celletyper som vanligvis finnes i den utviklende menneskelige cortex. Til tross for deres tidlige utviklingssammensetning, vil nevroner og andre menneskelige hjernecelletyper begynne å vise de typiske tegnene på senescens i nevronceller etter langvarig in vitro-kultur , noe som gjør dem til en verdifull og nyttig plattform for å studere aldringsrelaterte nevronprosesser. Denne protokollen skisserer også en metode for å oppdage slike senescentceller i kortikale hjerneorganoider ved bruk av senescensassosiert beta-galaktosidasefarging.
Vår nåværende kunnskap om den menneskelige hjerne har i stor grad vært basert på dyremodeller og post mortem hjerneprøver. Stamcellebiologi er et raskt fremmende felt som gir ny innsikt i den grunnleggende biologien til menneskelig hjerneutvikling og de patologiske driverne av menneskelige hjernesykdommer. Humane pluripotente stamceller (hPSCs) er et uvurderlig verktøy for modellering av den menneskelige hjerne via generering av organoider, organlignende tredimensjonalt (3D) vev som vanligvis rekapitulerer utviklingsbaner, cellulær sminke og arkitektur av den utviklende menneskelige hjerne. Hjerneorganoider er selvmonterte og sammensatt av nevrale stamceller, spesifiserte nevrale forfedre, modne nevroner og gliacelletyper. Organoider gir derfor en unik mulighet til å studere den tidlige menneskelige hjernen, som ofte er utilgjengelig for direkte eksperimentering, men har også iboende begrensninger som fravær av vaskulatur og immunsystem.
Metoder for å generere hjerneorganoider har blitt forfulgt på to forskjellige måter: unguided og guidet differensiering. Unguided brain organoid metoder stole på spontane indre differensiering kapasiteter av stamceller som driver vev morfogenese 1,2 og tillater fremveksten av en rekke cellelinje identiteter som spenner fra forebrain, midbrain, og hindbrain, til choroid plexus, retina, og mesoderm. I motsetning til dette krever guidede hjerneorganoidmetoder betydelig bruk av eksterne faktorer for å drive hPSCs mot ønsket mønster av nevronlinjer som representerer en hjernegruppetype, for eksempel medial ganglionisk eminense3, forhjerne4, midthjerne5, hypothalamus6, cerebellum7 og choroid plexus8. Denne evnen til å generere forskjellige hjernegrupper med forskjellige cellelinjer, og potensialet til å smelte disse etter ønske, gjør hjerneorganoider til en utmerket modell for å undersøke menneskelig hjerneutvikling og dechiffrere de underliggende mekanismene for hjernerelaterte sykdommer. Selv om disse metodene for å generere hjerneorganoider gir et gjennombrudd i modellering av menneskelige hjernegrupper, er variasjonen og heterogeniteten mellom organoider fortsatt en betydelig begrensning for systematiske og kvantitative studier, for eksempel narkotikascreening.
Den nåværende protokollen er basert på en metode utviklet i vårt siste papir9 og innebærer selektiv differensiering av hPSC-kolonier mot nevroektoderm (NEct) identitet med doble SMAD-hemmere (SB-431542 og LDN 193189), som deretter har evnen til selvorganisering innen 4 dager i 3D neuroepiteliumsfæroider under påvirkning av FGF2-signalering. Disse neuroepitheliumsfæroidene genererer pålitelig homogene kortikale organoider med en in vivo-lignende cellulær sammensetning innen 4 uker etter differensiering. Protokollen beskrevet her er bygget på våre tidligere funn som viser at inhibering av dual SMAD (Suppressor of Mothers Against Decapentaplegic) signalering fremmer differensiering av hPSCs mot rostrale nevrale stamceller avledet fra nevroektodermale stamceller10 ved blant annet å hemme endodermale, mesodermale og tropektodermcelle skjebnevalg11 . Videre utløser innebyggingen av nevroepitelsfæroidene i den hESC-kvalifiserte kjellermembranmatrisen signifikant spirende av nevroepitelia, og danner ventrikler med apikobasal polaritet. Storskalakultur viste reproduserbarhet og homogenitet av kortikale organoider uavhengig av cellelinjer, kloner eller batcher, og representerer dermed et pålitelig og stabilt stamcellesystem for å etterligne tidlig menneskelig kortikal utvikling i helse og sykdom in vitro. Vi skisserer videre en protokoll for å oppdage senescent neuronale cellemarkører i hPSCs-avledede kortikale hjerneorganoider som har blitt dyrket i lengre perioder.
Etter plating hPSCs ved en såtetthet på 20% -30%, behandles cellene med doble SMAD-hemmere i 3 dager for å skille hPSC-kolonier mot nevroektodermale kolonier. Disse koloniene løftes deretter forsiktig med dispase og sås inn i ultralavt feste 6-brønns plater supplert med FGF2. De flytende 2D-koloniene organiserer seg selv i 3D nevroektodermale sfæroider over natten og opprettholdes i 4 dager i N2-medium supplert daglig med FGF2. Når sfæroidene har etablert det nevroepiteliale laget, kan de legges inn i kjellermembranmatrisen. Ved rutinemessig å legge til fersk terminal differensieringsmedium, vil forskerne observere progressiv ekspansjon og spirende av nevroepithelia i kortikale organoider. Forskere kan ønske å dissosiere disse organoidene for å utføre transkripsjonell og proteomisk profilering. I tillegg anbefales brightfield imaging for å overvåke kvaliteten på de kortikale organoider. Analyse kan utføres ved fiksering, kryoseksjon og immunostaining. Beskrivelser og metoder for disse teknikkene er tidligere beskrevet12. Til syvende og sist tillater denne protokollen forskere å raskt og robust generere homogene kortikale hjerneorganoider for modellering av den utviklende menneskelige kortikale hjernen, med lave kostnader og begrenset utstyr, og for å studere aspekter av cellulær nevronal senescens, som beskrevet i dette papiret.
1. Kortikale hjerneorganoider generasjon
MERK: Alle trinnene i denne delen av protokollen vil skje i en klasse 2 biosikkerhetshette, med mindre annet er oppgitt.
- Induksjon av 2D nevroektodermale kolonier fra hPSC 2D-kultur (dag -1 til 3)
- Før induksjon, plate hPSC-koloniene på en hESC-kvalifisert kjellermembranmatrise i en 6-brønns plate med 20% -30% tetthet. Oppnå denne tettheten ved å passere hPSC-kolonier fra en brønn av en 6-brønns plate ved 60% sammenløp i tre brønner av en 6-brønns plate.
- For kjellermembranmatrisebelegg, fortynn kjellermembranmatrisen i et forhold på 1:50 i et vanlig basalmedium. Sett jevnt ut 1 ml/brønn av en 6-brønns plate, inkuber i 1 time ved romtemperatur (RT), og aspirer deretter.
- Oppretthold hPSC-kolonier i 1 dag i 2 ml av et serumfritt cellekulturmedium før differensiering.
- På dagen for hPSC-differensiering, inspiser hPSC-koloniene ved hjelp av lysfeltmikroskopi ved 4x til 10x forstørrelse for å sikre sunne kolonier uten påviselig differensiering.
MERK: Sunn hPSCs vil danne tette kantkolonier med celler som har en stor kjerne, svært liten cytoplasma og fremtredende nukleoler. Differensierte iPSC-kolonier vil vise klare morfologiske forskjeller fra de beskrevne hPSC-koloniene ovenfor, spesielt rundt ytterkantene av koloniene eller i sentrum. - Tilsett reagenser oppført i tabell 1 for å utgjøre N2-mediet som kreves for differensiering. Ta med dette mediet til RT før bruk.
- Når du er ved RT, aspirerer det serumfrie cellekulturmediet fra hver brønn på 6-brønnsplaten og erstatt med 2 ml N2 medium forsiktig tilsatt med en 5 ml serologisk pipette.
- Legg til de doble SMAD-hemmerne, SB-431542 (10 μM) og LDN 193189 (100 nM).
MERK: SMAD-hemmerne kan tilsettes N2-mediet etter at mediet er plassert i hver brønn, eller til den nødvendige mengden N2-medium før det serumfrie cellekulturmediet erstattes. Inhibitorer kan jevnt innlemmes i mediet ved forsiktig å virvle platen eller invertere røret som inneholder mediet og hemmere 3-4 ganger. - Tilsett ferske N2-medier supplert med SB-431542 (10 μM) og LDN 193189 (100 nM) daglig til hver brønn de neste 2 dagene.
MERK: FerskT N2-medium tilsettes for å redusere langvarig eksponering av celler til DMSO som brukes til å oppløse SB-431542 og LDN 193189 forbindelser og forhindre cytotoksisitet.
- Generering av 3D nevroektodermale sfæroider fra induserte 2D nevroektodermale kolonier (dag 3 til 7)
- Løft de induserte nevroektodermale koloniene ved hjelp av dispase etter trinn 1.2.2-1.2.8.
- Fjern først 2 ml N2-medium fra 6-brønnsplaten, og vask 1x med HBSS for å sikre at alt N2-mediet fjernes.
MERK: N2-medium kan forstyrre enzymaktiviteten til dispase, og forhindre tilstrekkelig løsrivelse av nevroektodermale kolonier fra brønnen. - Tilsett 1 ml med 2,4 enheter/ml dispase til hver koloniholdige brønn.
- Inkuber brønnen i 20-25 min (maksimum 30 min) ved 37 °C. Sjekk for koloniløsning regelmessig.
MERK: Små kolonier kan løsne innen 20 minutter. Eventuelle kolonier som forblir fast etter 30 minutter, bør ignoreres. - Etter inkubering, tilsett 1 ml N2-medium til brønnen for å stoppe aktiviteten til dispaseenzymet og overfør koloniene til et 15 ml rør ved hjelp av en bredboret P1000 pipettespiss eller en modifisert P1000 pipettespiss kuttet med steril saks (noe som gjør den til en bredboret P1000-spiss).
- La koloniklumpene synke til bunnen av røret med tyngdekraften.
MERK: Denne prosessen vil ta omtrent 1 min. - Når klumpene har sunket, fjerner du forsiktig supernatanten med en standard P1000 pipettespiss og erstatter den med 1 ml ferskt N2 medium. Gjenta dette vasketrinnet tre ganger for å sikre fullstendig fjerning av dispase.
MERK: Enhver gjenværende dispase vil forhindre en jevn dannelse av nevroektodermale sfæroider og indusere celledød. - Etter vask, resuspenderer celleklumpene i 3 ml N2 medium og overfør til en brønn med en 6-brønns plate og tilsett 40 ng / ml bFGF.
MERK: Hvis et høyt antall nevroektodermale kolonier ble løsrevet, kunne disse koloniene bli belagt over to eller flere brønner av en 6-brønns plate for å forhindre sfæroidfusjon. 24 timer etter dispase løsrivelse av koloniene, sjekk om sfæroidene har dannet seg. - Oppretthold sfæroidene i samme medium de neste 3-4 dagene, men legg til fersk bFGF (40 ng / ml) til hver brønn daglig for å fremme nevroektodermal celleproliferasjon, selvorganisering og indusere og utvide nevroepithelia.
MERK: Hvis sfæroider har blitt belagt med høyere tetthet, vil mediet sannsynligvis bli gult og kreve utskifting hver 2. dag med fersk bFGF (40 ng / ml). Dette anbefales imidlertid ikke, og i stedet bør et lavere antall sfæroider opprettholdes i hver brønn for å unngå dette problemet. Sfæroider kan legges inn i kjellermembranmatrisen etter 3 dager hvis nevroepithelia er tydelig. Hvis neuroepithelia ikke er tydelig eller ikke ser sterk ut, må du opprettholde sfæroider for en annen dag og sjekke igjen.
- Kortikal hjerneorganoid differensiering og vedlikehold (dag 8)
- Klargjør terminaldifferensieringsmediet (DM) ved hjelp av reagensene som er oppført i tabell 2. Bring disse mediene til RT.
- Tine 100 % hESC-kvalifisert kjellermembranmatrise på is.
- Forbered et ark med parafilm med dimples sterilisert med 70% etanol i en 10 cm petriskål og legg den på et stereomikroskop under en hette.
MERK: Et tomt brett med 200 μL pipettespisser kan brukes til å generere et gitter av dimples. - Klipp enden av en 100 μL pipettespiss (for å gjøre den bredboret). Dette vil bli brukt til å legge inn nevrale sfæroider i kjellermatrisen uten å bryte dem.
- Ved hjelp av et stereomikroskop velger du nevrale sfæroider av samme størrelse (500 μm) fra 6-brønnplaten og overfører dem til parafilm-dimples ved hjelp av den brede bore 100 μL pipettespissen, og plasserer en enkelt nevral sfæroid per dimple.
- Fjern forsiktig overflødige medier, og la det være akkurat nok til å dekke sfæroidene.
MERK: Dette er for å opprettholde kvaliteten på sfæroidene før du legger til kjellermatrisen og for å sikre at de ikke tørker ut. - Tilsett forsiktig 18 μL kjellermatrise over sfæroiden, og plasser sfæroiden i midten av matrisefallet. Bruk enden av en 10 μL pipettespiss for å sentrere sfæroidene i matrisen.
MERK: Prøv å legge til kjellermatrisen så raskt som mulig for å unngå at overflødig media rundt sfæroidene tørker ut. - Dekk til 10 cm petriskålen og overfør den inn i inkubatoren og inkuber parafilmskålen med kjellermatriseinnstøpte sfæroider ved 37 °C i 25 minutter.
- Etter inkubering, skyll av de innebygde sfæroidene i en 24-brønns plate med lavt feste ved hjelp av en P1000-spiss med 0,5 ml av DM-mediet, og sørg for at individuelle innebygde sfæroider plasseres i en brønn hver.
MERK: Hvis mer enn en innebygd sfæroid faller inn i en brønn, bruk en bredboret P1000-spiss for å overføre den andre sfæroiden til en ny brønn. - Opprettholde de differensierte kortikale hjerneorganoider i DM-media i lengre perioder, med medieendringer som skjer hver 2. dag når organoider blir større og eldre.
MERK: I løpet av den første uken med differensiering kan mediet endres hver 3.
2. Karakterisering av nevronal aldring i kortikale organoider
- Behandle kortikale organoider for kryoseksjoner:
MERK: Trinnene ble utført i en klasse 2 biosikkerhetshette.- Forbered 2 ml rør, hver fylt med 1,5 ml 4% paraformaldehyd (PFA).
- Klipp enden av en P1000 pipettespiss (for å gjøre den til en bred boring) og overfør forsiktig hver organoid til en av de 2 ml rørene som er fremstilt ovenfor (ett organoid per rør).
MERK: For å forhindre overflødig DM-medieblanding med PFA, la organoiden synke mot åpningen av P1000 pipettespissen og hvil spissen like over toppen av PFA i røret før du pipetterer organoiden ut. Dette vil gjøre det mulig for forskeren å overføre bare organoid og svært minimal media. - La fikseringsprosessen foregå ved 4 °C i 1 time.
- Bruk en uklippet P1000 pipettespiss, aspirer forsiktig overflødig PFA og tilsett 1,5 ml kald 1x PBS.
- Overfør rørene til en orbital shaker satt til 70 rpm i 10 min ved RT.
- Gjenta vaskeprosessen med kald 1x PBS tre ganger for å sikre at all PFA er fjernet grundig.
MERK: Ikke kast PFA i vanlige avfallsbeholdere; Forbered i stedet en spesifikk kjemisk avfallsbeholder for dette, da PFA er en fare. - Senk organoidene i 1x PBS inneholdende 30 % sukrose og inkuber ved 4 °C til alle organoider har sunket til bunnen av slangen.
MERK: Tiden det tar å la organoidene synke, avhenger av organoidenes størrelse/alder. 3 måneder gamle organoider kan ta opptil 5 timer. - Ved hjelp av en kuttet P1000 pipettespiss med bred boring, overfør forsiktig tre til fem organoider til en monteringsform som inneholder en monteringsløsning laget av 30 % sukrose og 100 % optimal skjæretemperatur (OCT) medium, i et forhold på 3:2.
- Bruk en 10 μL pipettespiss ved hjelp av et stereomikroskop for å orientere og plassere organoider i et rutenettlignende mønster.
- Plasser formen på tørris for å størkne sukrose OCT-løsningen før du fortsetter med kryosnitting (16-20 μm) ved hjelp av en kryostat.
MERK: For senescensassosiert beta-galaktosidase må alle vev behandles for snitting når de har sunket. For immunfluorescens kan vev behandles for snitting neste dag. Alle lysbildene som inneholder seksjoner må oppbevares ved -20 °C før påfølgende immunfluorescens eller beta-galaktosidase, hvis de ikke farges umiddelbart.
- Prosess for analyse av senescens i kortikale hjerneorganoider:
MERK: Følgende trinn kan utføres på en vanlig laboratoriebenk.- Overfør lysbildene til en mikroskop lysbildebeholder med lokk og vask det snittede organoidvevet tre ganger med 1x PBS i 10 minutter ved RT for å fjerne overflødig monteringsløsning.
- Etter dette inkuberes det vaskede vevet med nylaget beta-galaktosidasefargingsløsning over natten ved 37 °C.
MERK: Beta-galaktosidase-fargeløsningen er laget av fosfatbuffer (for 10 ml fosfatbuffer: 8,15 ml 1 M NaH2PO4, 1,85 ml 1M Na2HPO4) justert pH = 6, 100 mM kaliumheksacyanoferrat (III), 100 mm kaliumheksacyanoferrat (II) trihydrat, 5 M NaCl, 1 M MgCl2, 20 mg / ml X-Gal. Unngå å bruke en standard cellekulturinkubator som inneholder CO2 , da CO2 vil endre pH i beta-galaktosidasefargingsløsningen. - Vask det fargede vevet med 1x PBS tre ganger i 10 minutter hver ved RT for å fjerne beta-galaktosidaseoppløsningen.
- Monter det vaskede vevet med et antifademonteringsmiddel i glass og la monteringsløsningen størkne i 30 minutter ved RT før du ser under mikroskopet.
Her har vi beskrevet en robust protokoll som gjør det mulig for forskere å generere homogene hPSC-avledede kortikale hjerneorganoider som etterligner den in vivo menneskelige kortikale hjerneregionen innen 1-3 måneders kultur. hPSC-kolonier dyrkes først i differensieringsmedier for å generere nevroektodermale kolonier, som deretter kan brukes til å danne nevrale sfæroider. Disse sfæroidene blir deretter innebygd i en kjellermembranmatrise og vedlikeholdt i lengre perioder for å produsere organoider som kan brukes til å modellere nevronal aldring (se figur 1 for en oversikt over protokollen). Det er verdt å merke seg at dyrking av disse organoider i ultra-ubelagte 24-brønns plater forårsaker cellulær stress og fremmer senescensassosierte fenotyper over 13 uker med in vitro-kultur . Organoider avledet fra denne protokollen kan også opprettholdes i omrørte bioreaktorer for optimal vekst og differensiering av kortikale plate nevrale celler eller ved luft-væske-grensesnittet.
Til å begynne med dyrkes hPSC-kolonier i 1 dag før nevroektodermal differensiering. Det er avgjørende at disse hPSC-koloniene dyrkes til bare 20%-30% samløp og er av høyest mulig kvalitet: et tett flatt monolag uten differensierte celler som forurenser koloniene (figur 2A, B). Pluripotensen til hPSC-koloniene bør bekreftes ved uttrykk av markører som NANOG (figur 2C). De validerte hPSC-koloniene blir deretter eksponert for N2 nevroektodermale differensieringsmedier med SB-431542 og LDN 193189. Etter 3 dagers vedlikehold i dette mediet, burde hPSC-koloniene ha differensiert seg til nevroektodermale kolonier og ikke lenger vise den samme tette flate monolagsmorfologien til hPSC-ene (figur 2B), men de vil heller bli lengre kolonneformede celler (figur 2B). Disse cellene vil også være negative for pluripotensmarkører som NANOG (figur 2C).
Det er på dette stadiet at de nevroektodermale koloniene er enzymatisk løsrevet med dispase, og hver sunn og vellykket frittliggende koloni får lov til å organisere seg selv og danne en ung nevral sfæroid (figur 2D, supplerende video 1). Bare sunne, rene nevroektodermale kolonier vil løsne i tidsrammen som er angitt for dispaseaktivitet; alle andre kolonier bør ignoreres, da de vil resultere i en dårligere kvalitet på sfæroid. Ved daglig eksponering for FGF2 i N2-mediet vil de nevrale stamcellene (SOX2+) i disse sfæroidene (figur 2D, dag 1) spre seg og danne et betydelig antall nevrale rosetter (figur 2D, dag 4). Disse rosettene vil uttrykke det tette krysset og epitelmarkøren ZO1 i celler som ligger i midten av rosettene og langs ytterkanten av sfæroiden, og demonstrerer den apikal-basale polariteten til sfæroiden (figur 2D, dag 4). Metoden for heldekkende 3D-avbildning av sfæroider er beskrevet før13. Daglig inspeksjon av sfæroider bør belyse dannelsen av en tett, mørk ytre kant og lys periferi av sfæroider, dette er det neuroepiteliale laget. Dette laget skal være tilstrekkelig dannet etter 3-4 dager med en omtrentlig diameter på 500 μm, da sfæroidene kan legges inn i kjellermatrisen. Hvis dette laget ikke er tilstede eller bare er svakt dannet, er sfæroidene ikke tilstrekkelig utviklet nok til å ta videre. Det anbefales å vente en annen dag for å observere eventuelle endringer, men hvis dette ikke blir observert, se bort fra disse sfæroider.
Et representativt lysfeltbilde av sfæroidene etter 3 dagers kultur kan ses i figur 2D. Sfæroider med et tett nevroepitelialt lag som ikke har smeltet sammen med andre nærliggende sfæroider, har semi-gjennomsiktig vev og demonstrerer nevral rosettdannelse, er valgt å være innebygd i kjellermatrisen. Når den er innebygd, vil sfæroiden spre seg raskt og begynne å spire: noder av kompaktvev vil dukke opp og ekspandere utover fra sfæroidens hovedkropp. Dette er tydelig mellom 1-3 uker i kjellermatrisen og kan observeres over flere cellelinjer (figur 3A). Kvantitativ analyse av de innebygde sfæroidene bekrefter tilstedeværelsen av epitelceller i opptil 100% av sfæroider over tre forskjellige cellelinjer, og bekrefter homogeniteten og reproduserbarheten som forventes fra denne protokollen (figur 3B). Kvantifiseringen av organoiddiameter under in vitro-differensiering bekrefter videre reproduserbarheten på tvers av forskjellige linjer av hPSC (figur 3C). Hvis spirende ikke forekommer, utvikler sfæroidene seg ikke riktig og bør kastes. Når sfæroidene har blitt innebygd i en matrise, utvikler deres utvikling seg, og sfæroidene blir nå referert til som organoider. Immunfluorescensfarging bekrefter også tilstedeværelsen av nevrale stamceller (PAX6) samt kortikale lagmarkører farget med CTIP2 og SATB2 i organoider med klar lagdeling (Figur 3D, E). Denne lagdelingen kan observeres på tvers av forskjellige tidspunkter for organoid vedlikehold (figur 3D, E). Metoden for immunhistokjemi av vev er beskrevet før14.
En mulig anvendelse av disse organoider er å studere hvordan neuronal aldring-relaterte prosesser påvirker hjernen. For å undersøke dette høstes vellykkede genererte organoider fra flere forskjellige tidspunkter for seksjonering og farging for standard molekylære biomarkører av senescens som senescensassosiert beta-galaktosidase og p21. Figur 4A viser et representativt bilde av senescensassosiert beta-galaktosidasefarging av organoider 4 og 13 uker etter inkorporering i kjellermembranmatrisen. Mellom uke 4 og 13 er det en markert økning i tilstedeværelsen av senescensassosiert beta-galaktosidase, noe som tyder på at cellulær senescens, en anerkjent driver for organismal aldring, har skjedd over denne tiden i kultur. Immunfluorescensfarging av organoider ved uke 13 bekreftet tilstedeværelsen av en annen senescensmarkør, p21, sammerket med den modne kortikale nevronmarkøren (CTIP2) og kan ses i figur 4B. Det skal imidlertid bemerkes at tilstedeværelsen av p21 er en markør for cellesyklusarrest og i seg selv ikke er en definitiv markør for senescens, og påvisning av andre markører for senescens som p16 og SASP (senescensassosiert sekretorisk fenotype) faktorer anbefales for å definitivt identifisere celler som senescent.
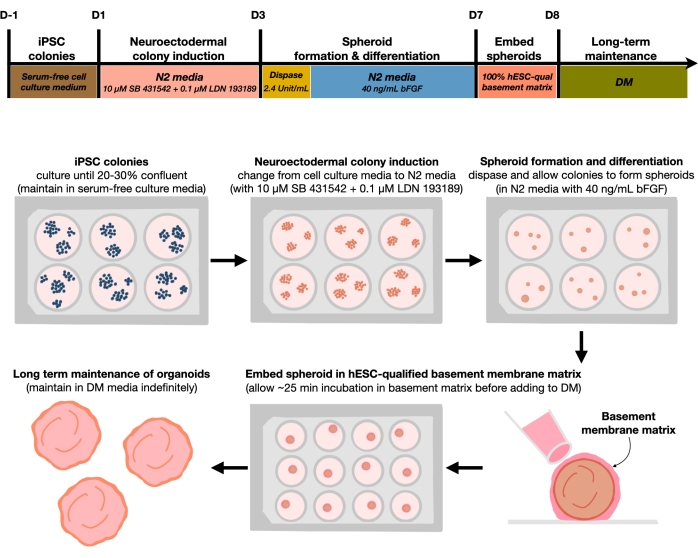
Figur 1: Skjematisk diagram for generering av reproduserbare kortikale hjerneorganoider. Skjematisk arbeidsflyt av eksperimentell prosedyre for generering av kortikale hjerneorganoider fra hPSCs opprettholdt i materfritt medium. Arbeidsflyten gir en oversikt over seks trinn som er involvert for å skille 2D hPSCs i 3D-mønstret kortikal plate menneskelig vev i organoider. Klikk her for å se en større versjon av denne figuren.
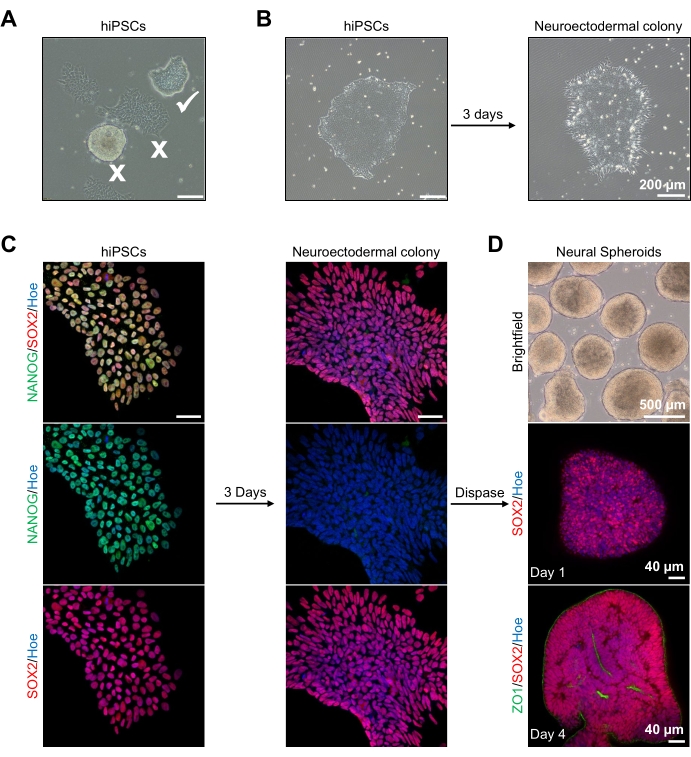
Figur 2: Generering av nevrale sfæroider avledet fra nevroektodermale kolonier-hPSCs. (A) Representative bilder av human PSC som viser optimal (hvit flått) og differensierte kolonier (hvitt kryss). Skala bar: 200 μm, 4x forstørrelse. (B) Representativt bilde av nevroektodermal koloni avledet fra hPSC etter 3 dager med doble SMAD-hemmerbehandlinger. Skala bar: 200 μm, 4x forstørrelse. (C) Humane PSC-kolonier ble differensiert mot nevroektodermale kolonier. Bilder representerer farging av PSC (på dag 1) og nevroektodermale (ved dag 3) kolonier med SOX2 (rød), NANOG (grønn), alle kjerner ble kontrastained med Hoechst 33342 (blå). Skala bar: 40 μm, 100x forstørrelse. (D) Bilder som viser utviklingsstadiene av kortikale hjernesfæroider over tid i kultur in vitro under brightfield, og fullskala immunostained med SOX2 (Rød) på dag 1, og dobbelt immunostained med SOX2 (rød) og ZO1 (Grønn) på dag 4. Skalalinjen til brightfield-bildet er 500 μm, 4x forstørrelse, skalastenger for de nederste bildene er 40 μm, 20x forstørrelse. Klikk her for å se en større versjon av denne figuren.
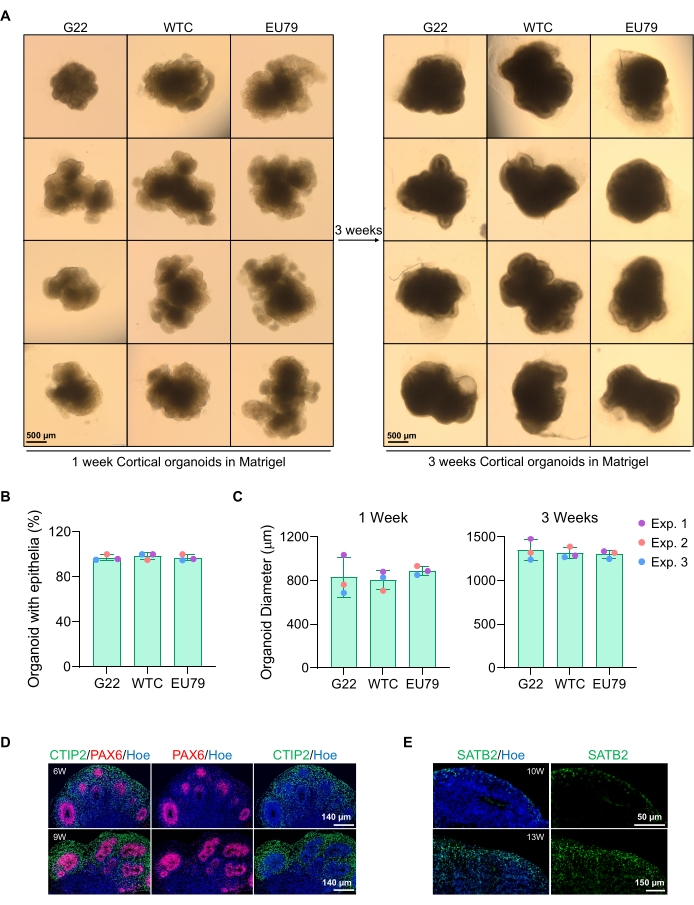
Figur 3: Karakterisering av kortikale hjerneorganoider avledet fra forskjellige hPSC-linjer. (A) Representative bilder av kortikale hjerneorganoider avledet fra G22, WTC og EU79 humane iPSC-linjer dyrket over 3 uker in vitro. Skalalinjen for alle bilder er 500 μm, 2x forstørrelse. (B) Prosentandeler av den vellykkede generasjonen av kortikale hjerneorganoider ved 3 ukers in vitro-differensiering i forskjellige hPSC-linjer (G22, WTC og EU79). N = 3. Data er presentert som gjennomsnitt ± standardavvik. (C) Stolpediagrammer som viser veksten av kortikale hjerneorganoider (basert på gjennomsnittlig diameter) ved uke 1 og 3 av in vitro-differensiering i forskjellige linjer av humane pluripotente stamcellelinjer (G22, WTC og EU79). N = 3. Data er presentert som gjennomsnitt ± standardavvik. (D) Representative bilder av seksjoner av 6-ukers og 9 uker gamle kortikale hjerneorganoider avledet fra G22 hPSCs, immunostained for ventrikkelsone PAX6 (rød) og kortikal plate CTIP2 (grønn). Alle seksjoner ble kontrahert med Hoechst 33342 (blå). Skala bar = 140 μm, 20x forstørrelse. W er uke. (E) Representative bilder av seksjoner av 10-ukers og 13 uker gamle kortikale hjerneorganoider avledet fra WTC hPSCs, immunostained for kortikallag IV SATB2 (grønn). Alle seksjoner ble kontrahert med Hoechst 33342 (blå). 10 ukers bildeskalalinje = 50 μm, 40x forstørrelse. 13 ukers bildeskalalinje = 150 μm, 40x forstørrelse. W er uke. Klikk her for å se en større versjon av denne figuren.
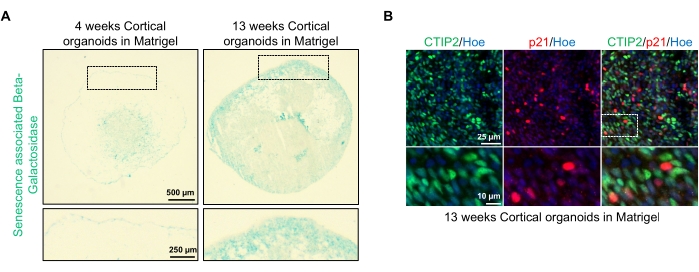
Figur 4: Karakterisering av senescens i kortikale hjerneorganoider avledet fra hPSCs. (A) Representative bilder av seksjoner av humane kortikale hjerneorganoider avledet fra WTC hPSCs dyrket i 4 og 13 uker in vitro og farget med SA-β-gal. Skalalinje = 500 μm, skalalinje for zoomede bilder = 250 μm, 4x forstørrelse. Den stiplede boksen angir et forstørret bilde. (B) Representative bilder av seksjoner av 13 uker gamle kortikale hjerneorganoider avledet fra humane EU79 hPSC-er, immunostained for kortikale nevroner CTIP2 (grønn) og p21 (rød). Alle seksjonene ble kontrahert med Hoechst 33342 (blå). Skalalinje = 25 μm, skalalinje for zoomede bilder = 10 μm, 40x forstørrelse. Klikk her for å se en større versjon av denne figuren.
| Mediekomponenter | Konsentrasjon |
| DMEM Næringsblanding F12 10x 500 ml (DMEM/F-12) | |
| N2 Tillegg 5 ml (100x) | Supplmented på 1% |
| B 27 Tillegg 10 ml | Supplert med 2% |
| MEM ikke-essensiell aminosyreløsning (100x) | Supplert med 1% |
| Penicillin-Streptomycin (10.000 U / ml) | Supplert med 1% |
| 2-merkaptoetanol 50 ml (1000x) | Supplert med 0,1% |
Tabell 1: N2 Medium. Tabellen viser reagensene som kreves for å forberede N2-mediet.
| Mediekomponenter | Konsentrasjon |
| DMEM Næringsblanding F12 10x 500 ml (DMEM/F-12) | DM-medier er laget med 1:1-forhold mellom DMEM/F12 og nevrobasale medier |
| Nevrobasalt medium | |
| N2 Tillegg 5 ml (100x) | Supplmented på 0,5% |
| B 27 Tillegg 10 ml | Supplert med 1% |
| MEM ikke-essensiell aminosyreløsning (100x) | Supplert med 1% |
| GlutaMAX Supplement 100x | Supplert med 1% |
| Penicillin-Streptomycin (10.000 U / ml) | Supplert med 1% |
| Insulinoppløsning human rekombinant | 12,5 μL for 50 ml medier |
| 2-merkaptoetanol 50 ml (1000x) | 17,5 μL for 50 ml medier |
Tabell 2: Differensieringsmedium (DM). Tabellen viser reagensene som kreves for å forberede differensieringsmediet.
Supplerende video 1. Live avbildning av indusert hNEct 2D ark / koloni konvertering til 3D under behandling av bFGF. Induserte kolonier av hNEct ble forsiktig løsnet fra parabolen med dispase som skissert ovenfor og overført til en lav vedlegg 6-brønns kulturplate. 2D hNEct-kolonier ble konvertert til 3D hNEct-sfæroider innen 12 timer. Seriebilder ble tatt hvert 5. minutt. Skala bar = 100 μm. Klikk her for å laste ned denne videoen.
For å muliggjøre bruk av hPSC-avledede hjerneorganoider i narkotikascreening og sykdomsmodellering, er det avgjørende å lage organoider etter en replikerbar og pålitelig protokoll15. Hjerneorganoider genereres vanligvis fra embryoide legemer avledet fra hPSCs, som deretter er innebygd i en ekstracellulær matrise som fremmer vevsutvidelse og nevral differensiering. Sammenlignet med slike protokoller som Lancasters 1,16,17 og Velasco18, som begynner fra embryoide legemer og tillater en standard differensieringsvei som skal følges av de utviklende organoider, har vi funnet ut at oppstart av kortikal hjerneorganoiddannelse med humane NEct-celler i stedet for med embryoide legemer forbedrer konsistensen av kortikal hjerneorganoiddannelse. Dette gir derfor også mulighet for skalering som kreves for legemiddel- og fenotypisk screening. Siden menneskelige NEct-celler ikke bare kan utvides til betydelige mengder, men også lett kan kryopreserveres, forbedrer denne tilnærmingen også replikerbarheten mellom eksperimenter. Det skal også bemerkes at sammenlignet med andre protokoller som har vedtatt bruk av bioreaktorer og lignende teknologier, er det ikke nødvendig med spesialutstyr for denne protokollen, noe som gjør den egnet for ethvert laboratorium6. Til slutt reduseres tiden som kreves for å generere modne organoider som er positive for kortikale lagmarkører som SATB2 sammenlignet med både Lancaster1 og bioreaktorprotokoller 6,19, noe som gjør den mer egnet til å studere utviklingsbanen for menneskelig kortikal utvikling i helse og sykdommer 1,6,16.
Videre, gitt den stadig voksende globale helsevesenets innvirkning av aldringsrelaterte sykdommer som demens, som er forbundet med en økning i senescentcelletyper i hjernen som bidrar til patogenese, er evnen til å identifisere og teste forbindelser som kan forbedre hjernens aldring av enorm interesse. Til tross for at hPSC er kjent for å bli epigenetisk forynget under omprogrammeringsprosessen20, finner vi robuste økninger i senescentceller i kortikale hjerneorganoider dyrket i lengre perioder. Dette er en lovende utvikling som nå muliggjør screening av legemidler som eliminerer slike senescentceller fra hjernen (senolytika) eller som bremser denne prosessen (senostatika)21. Siden menneskelige NEct-avledede kortikale hjerneorganoider er av menneskelig opprinnelse, vil denne tilnærmingen sannsynligvis forkorte den tradisjonelle veien til å markedsføre slike nye terapier.
Det er to kritiske trinn i denne protokollen. Den første er det riktige nivået av sammenløp av hPSC-koloniene på tidspunktet for differensiering. hPSC-kolonier må maksimalt være 30% konfluente for å sikre at genererte nektkolonier ikke smelter sammen med nabokolonier og at individuelle organoider er klonalt drevet. Det andre kritiske trinnet innebærer riktig bruk av dispase for å løfte NEct-koloniene og produsere nevrale sfæroider. Tidspunktet for inkubasjon med dispase er avgjørende for den endelige kvaliteten på de nevrale sfæroider som genereres. Dette skyldes at overeksponering av kolonier med dispase er giftig for cellene22 og til slutt påvirker kvaliteten på genererte organoider. Begrensningen av denne protokollen er at det er vanskelig å kontrollere størrelsen på nevrale sfæroider fordi det er avhengig av størrelsen på de første koloniene som løftes med dispase. Dette problemet kan imidlertid løses ved å velge nevrale sfæroider som er av samme størrelse når du går videre til innebyggingsstadiet.
Endelig kan fremtidige applikasjoner strekke seg til bruk av disse reproduserbare kortikale organoider i robotanalyse og biofarmasøytiske screeningsmetoder som vanligvis brukes i den bransjen. Dette støttes av foreløpige data fra vårt laboratorium som indikerer at genereringen av kortikale hjerneorganoider fra humane NEct-celler lett kan automatiseres, noe som gjør den kompatibel med disse tilnærmingene.
Forfatterne har ingenting å avsløre.
Dette arbeidet støttes av Medical Research Future Fund-Accelerated Research, Leukodystrophy flaggskip Massimo's Mission (EPCD000034), Medical Research Future Fund-Stem Cell Mission (APP2007653). Forfattere vil gjerne takke Dr. Ju-Hyun Lee (Korea University) for å generere data i Supplementary Video 1.
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved