Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
Generación robusta y altamente reproducible de organoides cerebrales corticales para modelar la senescencia neuronal cerebral in vitro
En este estudio, proporcionamos una técnica detallada para un sistema de cultivo de organoides corticales simple pero robusto utilizando cultivos hPSC estándar sin alimentador. Este es un protocolo rápido, eficiente y reproducible para generar organoides que modelan aspectos de la senescencia cerebral in vitro.
Los organoides cerebrales son modelos tridimensionales del cerebro humano en desarrollo y proporcionan una plataforma convincente y de vanguardia para el modelado de enfermedades y la detección genómica y farmacológica a gran escala. Debido a la naturaleza autoorganizada de las células en los organoides cerebrales y la creciente gama de protocolos disponibles para su generación, se han identificado problemas con la heterogeneidad y la variabilidad entre los organoides. En este artículo de protocolo, describimos un protocolo robusto y replicable que supera en gran medida estos problemas y genera organoides corticales a partir de progenitores neuroectodérmicos en 1 mes, y que se puede mantener durante más de 1 año. Este protocolo altamente reproducible se puede llevar a cabo fácilmente en una sala de cultivo de tejidos estándar y da como resultado organoides con una rica diversidad de tipos de células que se encuentran típicamente en la corteza humana en desarrollo. A pesar de su composición temprana del desarrollo, las neuronas y otros tipos de células cerebrales humanas comenzarán a exhibir los signos típicos de senescencia en las células neuronales después de un cultivo in vitro prolongado, lo que las convierte en una plataforma valiosa y útil para estudiar los procesos neuronales relacionados con el envejecimiento. Este protocolo también describe un método para detectar tales células senescentes en organoides cerebrales corticales utilizando la tinción de beta-galactosidasa asociada a la senescencia.
Nuestro conocimiento actual del cerebro humano se ha basado en gran medida en modelos animales y especímenes cerebrales post mortem. La biología de células madre es un campo que avanza rápidamente y proporciona nuevos conocimientos sobre la biología básica del desarrollo del cerebro humano y los impulsores patológicos de los trastornos cerebrales humanos. Las células madre pluripotentes humanas (hPSC) son una herramienta invaluable para modelar el cerebro humano a través de la generación de organoides, tejido tridimensional (3D) similar a un órgano que generalmente recapitula las trayectorias de desarrollo, la composición celular y la arquitectura del cerebro humano en desarrollo. Los organoides cerebrales son autoensamblados y compuestos de células madre neurales, progenitores neurales específicos, neuronas maduras y tipos de células gliales. Los organoides, por lo tanto, brindan una oportunidad única para estudiar el cerebro humano temprano, que a menudo es inaccesible para la experimentación directa, pero también tiene limitaciones intrínsecas, como la ausencia de vasculatura y un sistema inmunológico.
Las metodologías para generar organoides cerebrales se han perseguido de dos maneras diferentes: diferenciación no guiada y guiada. Los métodos organoides cerebrales no guiados se basan en las capacidades de diferenciación intrínseca espontánea de las células madre que impulsan la morfogénesis tisular 1,2 y permiten la aparición de una variedad de identidades de linaje celular que van desde el cerebro anterior, el mesencéfalo y el cerebro posterior, hasta el plexo coroideo, la retina y el mesodermo. En contraste, los métodos organoides cerebrales guiados requieren un uso sustancial de factores externos para conducir las hPSC hacia el patrón deseado de linajes neuronales que representan un tipo de región cerebral, como la eminencia ganglionar medial3, el cerebro anterior4, el mesencéfalo5, el hipotálamo6, el cerebelo7 y el plexo coroideo8. Esta capacidad de generar diferentes regiones cerebrales con diferentes linajes celulares, y el potencial de fusionarlos a voluntad, hace que los organoides cerebrales sean un excelente modelo para investigar el desarrollo del cerebro humano y descifrar los mecanismos subyacentes de las enfermedades relacionadas con el cerebro. Aunque estos métodos para generar organoides cerebrales ofrecen un gran avance en el modelado de regiones cerebrales humanas, la variabilidad y heterogeneidad entre organoides sigue siendo una limitación significativa para los estudios sistemáticos y cuantitativos, como la detección de drogas.
El protocolo actual se basa en un método desarrollado en nuestro reciente artículo9 e implica la diferenciación selectiva de colonias de hPSC hacia la identidad neuroectodermo (NEct) con inhibidores duales de SMAD (SB-431542 y LDN 193189), que luego tienen la capacidad de autoorganizarse dentro de los 4 días en esferoides de neuroepitelio 3D bajo la influencia de la señalización FGF2. Estos esferoides neuroepithelium generan de manera confiable organoides corticales homogéneos con una composición celular in vivo dentro de las 4 semanas posteriores a la diferenciación. El protocolo descrito aquí se basa en nuestros hallazgos previos que muestran que la inhibición de la señalización dual SMAD (Supresor de Madres Contra Decapentapléjicos) promueve la diferenciación de hPSCs hacia células madre neurales rostrales derivadas de progenitores neuroectodérmicos10 mediante, entre otros, la inhibición de la elección del destino de células endodérmicas, mesodérmicas y trofetodermo11 . Además, la incrustación de los esferoides neuroepithelios en la matriz de membrana basal calificada por hESC desencadena una brotación significativa de la neuroepitielia, formando ventrículos con polaridad apicobasal. El cultivo a gran escala mostró reproducibilidad y homogeneidad de organoides corticales independientes de líneas celulares, clones o lotes, y por lo tanto representa un sistema de células madre confiable y estable para imitar el desarrollo cortical humano temprano en salud y enfermedad in vitro. Además, esbozamos un protocolo para detectar marcadores de células neuronales senescentes en organoides cerebrales corticales derivados de hPSC que se han cultivado durante períodos prolongados de tiempo.
Después de emplatar hPSCs a una densidad de siembra de 20% -30%, las células se tratan con inhibidores duales de SMAD durante 3 días para diferenciar las colonias de hPSC hacia colonias neuroectodérmicas. Estas colonias se levantan suavemente con dispasa y se siembran en placas de 6 pocillos de fijación ultra baja complementadas con FGF2. Las colonias 2D flotantes se autoorganizan en esferoides neuroectodérmicos 3D durante la noche y se mantienen durante 4 días en medio N2 suplementado diariamente con FGF2. Una vez que los esferoides han establecido la capa neuroepitelial, pueden incrustarse en la matriz de la membrana basal. Al agregar rutinariamente un medio de diferenciación terminal fresco, los investigadores observarán la expansión progresiva y la brotación de neuroepitielia en organoides corticales. Los investigadores pueden desear disociar estos organoides para realizar perfiles transcripcionales y proteómicos. Además, se recomiendan imágenes de campo brillante para monitorear la calidad de los organoides corticales. El análisis se puede realizar mediante fijación, criosección e inmunotinción. Las descripciones y métodos para estas técnicas han sido descritos previamente12. En última instancia, este protocolo permite a los investigadores generar rápida y robustamente organoides cerebrales corticales homogéneos para modelar el cerebro cortical humano en desarrollo, con equipos limitados y de bajo costo, y para estudiar aspectos de la senescencia neuronal celular, como se describe en este artículo.
1. Generación de organoides cerebrales corticales
NOTA: Todos los pasos de esta sección del protocolo se llevarán a cabo en una campana de bioseguridad de Clase 2, a menos que se indique lo contrario.
- Inducción de colonias neuroectodérmicas 2D a partir del cultivo hPSC 2D (Días -1 a 3)
- Antes de la inducción, coloque las colonias de hPSC en una matriz de membrana basal calificada hESC en una placa de 6 pocillos con una densidad del 20% al 30%. Logre esta densidad pasando colonias de hPSC de un pozo de una placa de 6 pocillos al 60% de confluencia en tres pozos de una placa de 6 pocillos.
- Para el recubrimiento de la matriz de la membrana basal, diluya la matriz de la membrana basal en una proporción de 1:50 en un medio basal simple. Deposite uniformemente 1 ml / pocillo de una placa de 6 pocillos, incube durante 1 h a temperatura ambiente (RT) y luego aspire.
- Mantener las colonias de hPSC durante 1 día en 2 ml de un medio de cultivo celular libre de suero antes de la diferenciación.
- El día de la diferenciación de hPSC, inspeccione las colonias de hPSC utilizando microscopía de campo brillante con un aumento de 4x a 10x para garantizar colonias sanas sin diferenciación detectable.
NOTA: Las hPSC sanas formarán colonias de borde apretado con células que tienen un núcleo grande, citoplasma muy pequeño y nucleolos prominentes. Las colonias iPSC diferenciadas exhibirán claras diferencias morfológicas con las de las colonias hPSC descritas anteriormente, particularmente alrededor de los bordes exteriores de las colonias o en el centro. - Agregue los reactivos enumerados en la Tabla 1 para conformar el medio N2 requerido para la diferenciación. Lleve este medio a RT antes de usarlo.
- Una vez en RT, aspire el medio de cultivo celular libre de suero de cada pocillo de la placa de 6 pocillos y reemplace con 2 ml de medio N2 agregado suavemente con una pipeta serológica de 5 ml.
- Agregue los inhibidores duales de SMAD, SB-431542 (10 μM) y LDN 193189 (100 nM).
NOTA: Los inhibidores de SMAD se pueden agregar al medio N2 después de que el medio se haya colocado en cada pozo, o a la cantidad requerida de medio N2 antes de reemplazar el medio de cultivo celular sin suero. Los inhibidores se pueden incorporar uniformemente al medio girando suavemente la placa o invirtiendo el tubo que contiene el medio y los inhibidores 3-4 veces. - Agregue medios N2 frescos suplementados con SB-431542 (10 μM) y LDN 193189 (100 nM) diariamente a cada pozo durante los próximos 2 días.
NOTA: Se agrega medio N2 fresco para reducir la exposición prolongada de las células al DMSO que se utiliza para disolver los compuestos sb-431542 y LDN 193189 y prevenir la citotoxicidad.
- Generación de esferoides neuroectodérmicos 3D a partir de colonias neuroectodérmicas 2D inducidas (Días 3 a 7)
- Levantar las colonias neuroectodérmicas inducidas utilizando dispasa siguiendo los pasos 1.2.2-1.2.8.
- Primero, retire 2 ml de medio N2 de la placa de 6 pocillos y lave 1x con HBSS para asegurarse de que se elimine todo el medio N2.
NOTA: El medio N2 puede interferir con la actividad enzimática de la dispasa, impidiendo el desprendimiento adecuado de las colonias neuroectodérmicas del pozo. - Agregue 1 ml de 2.4 unidades/ml de dispase a cada pozo que contenga colonias.
- Incubar el pozo durante 20-25 min (máximo 30 min) a 37 °C. Verifique el desprendimiento de colonias regularmente.
NOTA: Las colonias pequeñas pueden desprenderse en 20 minutos. Cualquier colonia que permanezca atascada después de 30 minutos debe ser ignorada. - Después de la incubación, agregue 1 ml de medio N2 al pozo para detener la actividad de la enzima dispasa y transfiera las colonias a un tubo de 15 ml utilizando una punta de pipeta P1000 de diámetro ancho o una punta de pipeta P1000 modificada cortada con tijeras estériles (convirtiéndola en una punta P1000 de diámetro ancho).
- Permita que los grupos de colonias se hundan en el fondo del tubo con gravedad.
NOTA: Este proceso durará aproximadamente 1 minuto. - Una vez que los grupos se hayan hundido, retire cuidadosamente el sobrenadante con una punta de pipeta P1000 estándar y reemplácelo con 1 ml de medio N2 fresco. Repita este paso de lavado tres veces para garantizar la eliminación completa de la dispasa.
NOTA: Cualquier dispasa restante evitará una formación uniforme de esferoides neuroectodérmicos e inducirá la muerte celular. - Después del lavado, vuelva a suspender los grupos celulares en 3 ml de medio N2 y transfiera a un pozo de una placa de 6 pocillos y agregue 40 ng / ml de bFGF.
NOTA: Si se desprendiera un alto número de colonias neuroectodérmicas, estas colonias podrían colocarse en dos o más pocillos de una placa de 6 pocillos para evitar la fusión de esferoides. 24 h después del desprendimiento de las colonias, compruebe si se han formado los esferoides. - Mantenga los esferoides en el mismo medio durante los próximos 3-4 días, pero agregue bFGF fresco (40 ng / ml) a cada pozo diariamente para promover la proliferación de células neuroectodérmicas, la autoorganización e inducir y expandir la neuroepitelia.
NOTA: Si los esferoides han sido chapados a una densidad más alta, es probable que el medio se vuelva amarillo y requiera ser reemplazado cada 2 días con bFGF fresco (40 ng / ml). Sin embargo, esto no se recomienda, y en su lugar, se debe mantener un menor número de esferoides en cada pozo para evitar este problema. Los esferoides se pueden incrustar en la matriz de la membrana basal después de 3 días si la neuroepitelia es evidente. Si la neuroepitelia no es evidente o no se ve fuerte, mantenga los esferoides para otro día y vuelva a verificarlos.
- Diferenciación y mantenimiento organoides del cerebro cortical (Día 8)
- Preparar el medio de diferenciación terminal (DM) utilizando los reactivos enumerados en la Tabla 2. Lleve este medio a RT.
- Descongelar la matriz de membrana basal 100% calificada hESC en hielo.
- Prepare una lámina de parafilm con hoyuelos esterilizados con etanol al 70% en una placa de Petri de 10 cm y colóquela en un estereomicroscopio debajo de una capucha.
NOTA: Se puede utilizar una bandeja vacía de puntas de pipeta de 200 μL para generar una cuadrícula de hoyuelos. - Corte el extremo de una punta de pipeta de 100 μL (para que sea de gran diámetro). Esto se utilizará para incrustar esferoides neurales en la matriz del sótano sin romperlos.
- Usando un estereomicroscopio, seleccione esferoides neurales de tamaño similar (500 μm) de la placa de 6 pocillos y transfiéralos a los hoyuelos de parapelícula utilizando la punta de pipeta de 100 μL de diámetro ancho, colocando un solo esferoide neural por hoyuelo.
- Retire suavemente cualquier exceso de medios, dejando lo suficiente para cubrir los esferoides.
NOTA: Esto es para mantener la calidad de los esferoides antes de agregar la matriz del sótano y para garantizar que no se sequen. - Agregue suavemente 18 μL de matriz basal sobre el esferoide, colocando el esferoide dentro del centro de la gota de la matriz. Use el extremo de una punta de pipeta de 10 μL para centrar los esferoides en la matriz.
NOTA: Trate de agregar la matriz del sótano lo más rápido posible para evitar que el exceso de medios alrededor de los esferoides se seque. - Cubra la placa de Petri de 10 cm y transfiérala a la incubadora e incube la placa de parafilm con esferoides incrustados en la matriz del sótano a 37 ° C durante 25 min.
- Después de la incubación, enjuague los esferoides incrustados en una placa de 24 pocillos de fijación baja con una punta P1000 con 0.5 ml de los medios DM, asegurándose de que los esferoides incrustados individuales se coloquen en un pozo cada uno.
NOTA: Si más de un esferoide incrustado cae en un pozo, use una punta P1000 de diámetro ancho para transferir el otro esferoide a un nuevo pozo. - Mantenga los organoides cerebrales corticales diferenciados en los medios de DM durante períodos prolongados de tiempo, con cambios en los medios que ocurren cada 2 días cuando los organoides se vuelven más grandes y más viejos.
NOTA: Durante la primera semana de diferenciación, el medio se puede cambiar cada 3 días.
2. Caracterización del envejecimiento neuronal en organoides corticales
- Organoides corticales de proceso para criosecciones:
NOTA: Los pasos se realizaron en una campana de bioseguridad Clase 2.- Prepare tubos de 2 ml, cada uno lleno de 1,5 ml de paraformaldehído al 4% (PFA).
- Corte el extremo de la punta de una pipeta P1000 (para que sea de diámetro ancho) y transfiera suavemente cada organoide a uno de los tubos de 2 ml preparados anteriormente (un organoide por tubo).
NOTA: Para evitar que el exceso de medios DM se mezcle con el PFA, permita que el organoide se hunda hacia la abertura de la punta de la pipeta P1000 y descanse la punta justo encima de la parte superior del PFA en el tubo antes de pipetear el organoide. Esto permitirá al investigador transferir solo el organoide y los medios muy mínimos. - Permita que el proceso de fijación tenga lugar a 4 °C durante 1 h.
- Usando una punta de pipeta P1000 sin cortar, aspire cuidadosamente el exceso de PFA y agregue 1.5 ml de PBS frío 1x.
- Transfiera los tubos a un agitador orbital a 70 rpm durante 10 minutos a RT.
- Repita el proceso de lavado con 1x PBS frío tres veces para asegurarse de que todo el PFA se haya eliminado por completo.
NOTA: No deseche el PFA en contenedores de desechos regulares; en su lugar, prepare un contenedor específico de eliminación de desechos químicos para esto, ya que el PFA es un peligro. - Sumergir los organoides en 1x PBS que contenga 30% de sacarosa e incubar a 4 °C hasta que todos los organoides se hayan hundido en la parte inferior del tubo.
NOTA: El tiempo requerido para permitir que los organoides se hundan depende del tamaño / edad de los organoides. Los organoides de 3 meses de edad pueden tardar hasta 5 h. - Usando una punta de pipeta P1000 cortada y de diámetro ancho, transfiera suavemente de tres a cinco organoides a un molde de montaje que contenga una solución de montaje hecha de sacarosa al 30% y un medio de temperatura de corte óptima (OCT) del 100%, en una proporción de 3: 2.
- Use una punta de pipeta de 10 μL con la ayuda de un estereomicroscopio para orientar y posicionar los organoides en un patrón similar a una cuadrícula.
- Coloque el molde sobre hielo seco para solidificar la solución de SACArosa ANTES de proceder con la criosección (16-20 μm) con un criostato.
NOTA: Para la beta-galactosidasa asociada a la senescencia, todos los tejidos deben procesarse para la sección una vez que se han hundido. Para la inmunofluorescencia, los tejidos se pueden procesar para seccionar al día siguiente. Todos los portaobjetos que contengan secciones deben almacenarse a -20 °C antes de la inmunofluorescencia o beta-galactosidasa posteriores, si no se tiñen inmediatamente.
- Proceso para el análisis de la senescencia en los organoides cerebrales corticales:
NOTA: Los siguientes pasos se pueden realizar en un banco de laboratorio normal.- Transfiera los portaobjetos a un recipiente de tinción de portaobjetos de microscopio con una tapa y lave el tejido organoide seccionado tres veces con 1x PBS durante 10 minutos en RT para eliminar cualquier exceso de solución de montaje.
- Después de esto, incube el tejido lavado con una solución de tinción de beta-galactosidasa recién hecha durante la noche a 37 ° C.
NOTA: La solución de tinción de beta-galactosidasa está hecha de tampón de fosfato (para 10 mL de tampón de fosfato: 8.15 mL de 1 M NaH2PO4, 1.85 mL de 1M Na2HPO4) pH ajustado = 6, 100 mM de hexacianoferrato de potasio (III), 100 mM de hexacianoferrato de potasio (II) trihidrato, 5 M de NaCl, 1 M de MgCl2, 20 mg/ml de X-Gal. Evite el uso de una incubadora de cultivo celular estándar que contenga CO2 , ya que el CO2 alterará el pH de la solución de tinción de beta-galactosidasa. - Lave los tejidos teñidos con 1x PBS tres veces durante 10 minutos cada uno en RT para eliminar la solución de beta-galactosidasa.
- Monte los tejidos lavados con un soporte antifade de vidrio y permita que la solución de montaje se solidifique durante 30 minutos en RT antes de verlos bajo el microscopio.
Aquí hemos descrito un protocolo robusto que permite a los investigadores generar organoides cerebrales corticales homogéneos derivados de hPSC que imitan la región del cerebro cortical humano in vivo dentro de 1-3 meses de cultivo. Las colonias de hPSC se cultivan primero en medios de diferenciación para generar colonias neuroectodérmicas, que luego se pueden usar para formar esferoides neurales. Estos esferoides se incrustan posteriormente en una matriz de membrana basal y se mantienen durante períodos prolongados de tiempo para producir organoides que se pueden usar para modelar el envejecimiento neuronal (consulte la Figura 1 para obtener un resumen del protocolo). Vale la pena señalar que el cultivo de estos organoides en placas ultra-no recubiertas de 24 pocillos causa estrés celular y promueve fenotipos asociados a la senescencia durante 13 semanas de cultivo in vitro . Los organoides derivados de este protocolo también se pueden mantener en biorreactores agitados para un crecimiento y diferenciación óptimos de las células neurales de la placa cortical o en la interfaz aire-líquido.
Para empezar, las colonias de hPSC se cultivan durante 1 día antes de la diferenciación neuroectodérmica. Es fundamental que estas colonias de hPSC se cultiven con solo un 20%-30% de confluencia y sean de la más alta calidad posible: una monocapa plana apretada sin células diferenciadas que contaminen las colonias (Figura 2A, B). La pluripotencia de las colonias de hPSC debe confirmarse mediante la expresión de marcadores como NANOG (Figura 2C). Las colonias de hPSC validadas se exponen a los medios de diferenciación neuroectodérmica N2 con SB-431542 y LDN 193189. Después de 3 días de mantenimiento en este medio, las colonias de hPSC deberían haberse diferenciado en colonias neuroectodérmicas y ya no mostrar la misma morfología monocapa plana apretada de las hPSC (Figura 2B), sino que se convertirán en células de forma columnal más largas (Figura 2B). Estas celdas también serán negativas para marcadores de pluripotencia como NANOG (Figura 2C).
Es en esta etapa que las colonias neuroectodérmicas se separan enzimáticamente con dispasa, y a cada colonia sana y separada con éxito se le permite autoorganizarse y formar un esferoide neural joven (Figura 2D, Video complementario 1). Solo las colonias neuroectodérmicas sanas y limpias se desprenderán en el período de tiempo especificado para la actividad de la dispasa; todas las demás colonias deben ser ignoradas, ya que resultarán en una peor calidad de esferoide. Con la exposición diaria a FGF2 en los medios N2, las células madre neurales (SOX2+) en estos esferoides (Figura 2D, día 1) proliferarán y formarán un número significativo de rosetas neurales (Figura 2D, día 4). Estas rosetas expresarán la unión estrecha y el marcador epitelial ZO1 en células ubicadas dentro del centro de las rosetas y a lo largo del borde externo del esferoide, demostrando la polaridad apical-basal del esferoide (Figura 2D, día 4). El método para la obtención de imágenes 3D de montaje completo de esferoides se ha descrito antesdel 13. La inspección diaria de los esferoides debe dilucidar la formación de un borde exterior apretado y oscuro y una periferia brillante de los esferoides, siendo esta la capa neuroepitelial. Esta capa debe estar suficientemente formada después de 3-4 días con un diámetro aproximado de 500 μm, momento en el que los esferoides pueden incrustarse en la matriz del sótano. Si esta capa no está presente o solo está débilmente formada, los esferoides no están lo suficientemente desarrollados como para avanzar. Se recomienda esperar otro día para observar cualquier cambio, pero si esto no se observa, ignorar estos esferoides.
Una imagen representativa de campo brillante de los esferoides después de 3 días de cultivo se puede ver en la Figura 2D. Los esferoides con una capa neuroepitelial apretada que no se han fusionado con otros esferoides vecinos, tienen tejido semitransparente y demuestran la formación de roseta neural, se eligen para incrustarse en la matriz del sótano. Una vez incrustado, el esferoide proliferará rápidamente y comenzará a brotar: aparecerán nodos de tejido compacto, expandiéndose hacia afuera desde el cuerpo principal del esferoide. Esto es evidente entre 1-3 semanas en la matriz del sótano y se puede observar a través de múltiples líneas celulares (Figura 3A). El análisis cuantitativo de los esferoides incrustados confirma la presencia de células epiteliales en hasta el 100% de los esferoides a través de tres líneas celulares diferentes, afirmando la homogeneidad y reproducibilidad esperada de este protocolo (Figura 3B). La cuantificación del diámetro de los organoides durante la diferenciación in vitro confirma aún más la reproducibilidad a través de diferentes líneas de hPSC (Figura 3C). Si no se produce la brotación, los esferoides no se están desarrollando adecuadamente y deben descartarse. Una vez que los esferoides se han incrustado en una matriz, su desarrollo progresa, y los esferoides ahora se conocen como organoides. La tinción por inmunofluorescencia también confirma la presencia de células progenitoras neurales (PAX6), así como marcadores de capa cortical teñidos con CTIP2 y SATB2 en los organoides con capas claras (Figura 3D, E). Esta estratificación es observable a través de diferentes puntos de tiempo de mantenimiento de organoides (Figura 3D, E). El método de inmunohistoquímica de los tejidos se ha descrito antesdel 14.
Una posible aplicación de estos organoides es estudiar cómo los procesos neuronales relacionados con el envejecimiento afectan al cerebro. Para investigar esto, los organoides generados con éxito se extraen de múltiples puntos de tiempo diferentes para seccionar y teñir para biomarcadores moleculares estándar de senescencia, como la beta-galactosidasa asociada a la senescencia y p21. La Figura 4A muestra una imagen representativa de la tinción de beta-galactosidasa asociada a la senescencia de organoides 4 y 13 semanas después de la incrustación en la matriz de la membrana basal. Entre las semanas 4 y 13, hay un marcado aumento en la presencia de beta-galactosidasa asociada a la senescencia, lo que sugiere que la senescencia celular, un impulsor reconocido del envejecimiento del organismo, ha ocurrido durante este tiempo en cultivo. La tinción de inmunofluorescencia de organoides en la semana 13 confirmó la presencia de otro marcador de senescencia, p21, co-marcado con el marcador neuronal cortical maduro (CTIP2) y se puede ver en la Figura 4B. Sin embargo, debe tenerse en cuenta que la presencia de p21 es un marcador de detención del ciclo celular y por sí misma no es un marcador definitivo de senescencia, y se recomienda la detección de otros marcadores de senescencia como p16 y los factores SASP (fenotipo secretor asociado a la senescencia) para identificar definitivamente las células como senescentes.
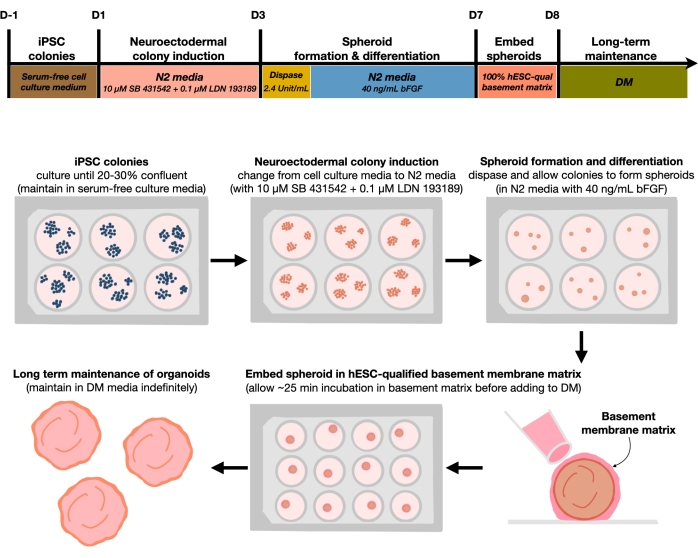
Figura 1: Diagrama esquemático para la generación de organoides cerebrales corticales reproducibles. Flujo de trabajo esquemático del procedimiento experimental para la generación de organoides cerebrales corticales a partir de hPSCs mantenidos en el medio libre de alimentación. El flujo de trabajo proporciona una visión general de seis pasos involucrados para diferenciar las hPSC 2D en tejidos humanos de placa cortical con patrón 3D en organoides. Haga clic aquí para ver una versión más grande de esta figura.
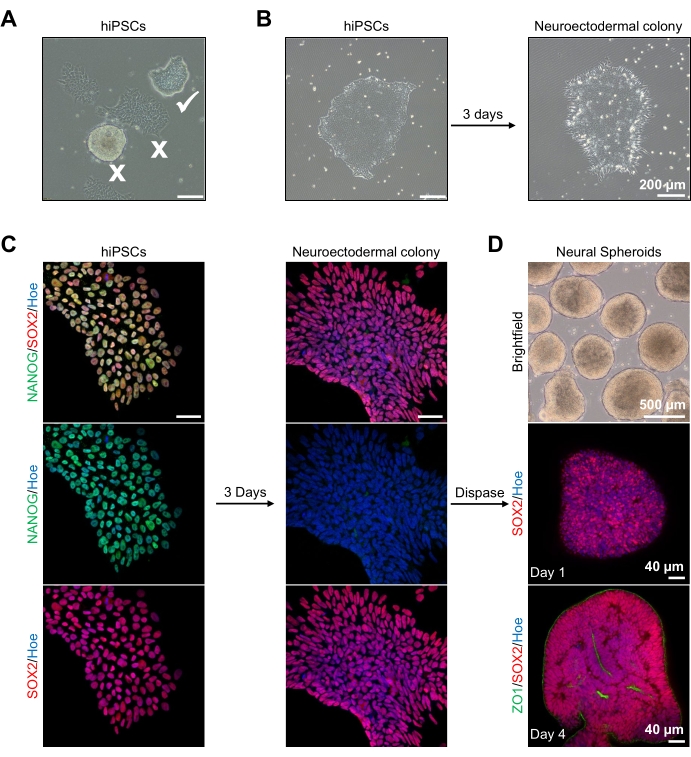
Figura 2: Generación de esferoides neurales derivados de colonias neuroectodérmicas-hPSCs. (A) Imágenes representativas de PSC humano que exhiben colonias óptimas (garrapata blanca) y diferenciadas (cruz blanca). Barra de escala: 200 μm, aumento de 4x. (B) Imagen representativa de colonias neuroectodérmicas derivadas de hPSCs después de 3 días de tratamientos duales con inhibidores de SMAD. Barra de escala: 200 μm, aumento de 4x. (C) Las colonias humanas de PSC se diferenciaron hacia colonias neuroectodérmicas. Las imágenes representan la tinción de colonias de PSC (en el día 1) y neuroectodérmicas (en el día 3) con SOX2 (Rojo), NANOG (Verde), todos los núcleos fueron contrateñidos con Hoechst 33342 (azul). Barra de escala: 40 μm, aumento de 100x. (D) Imágenes que muestran las etapas de desarrollo de los esferoides cerebrales corticales a lo largo del tiempo en cultivo in vitro bajo campo brillante, e inmunoteñidos de montaje completo con SOX2 (rojo) en el día 1, y doble inmunoteñidos con SOX2 (rojo) y ZO1 (verde) en el día 4. La barra de escala de la imagen de campo brillante es de 500 μm, 4x aumento, las barras de escala de las imágenes inferiores son de 40 μm, 20x de aumento. Haga clic aquí para ver una versión más grande de esta figura.
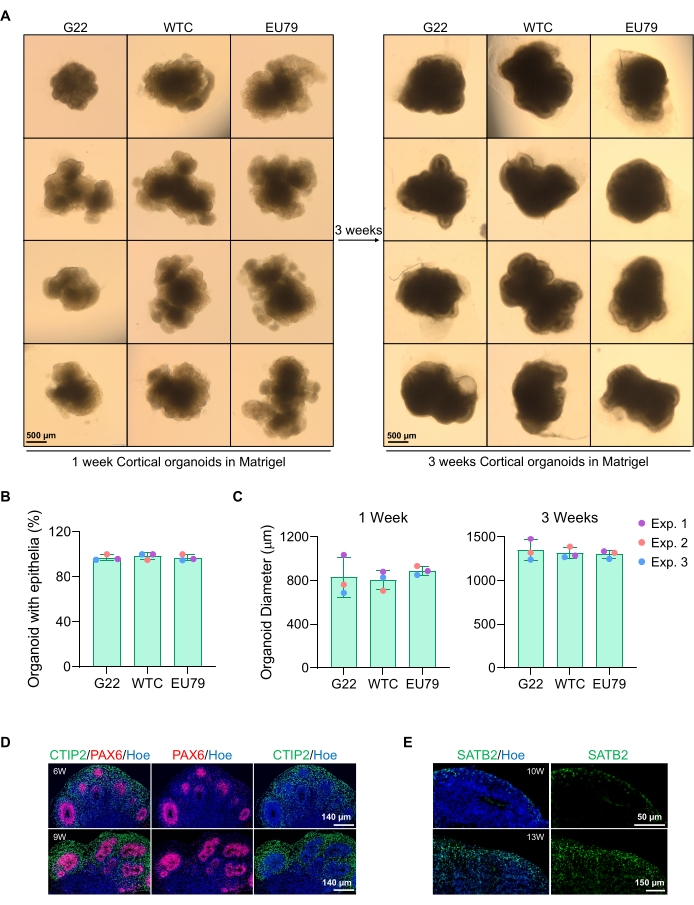
Figura 3: Caracterización de organoides cerebrales corticales derivados de diferentes líneas hPSC. (A) Imágenes representativas de organoides cerebrales corticales derivados de líneas G22, WTC y EU79 iPSC humanas cultivadas durante 3 semanas in vitro. La barra de escala de todas las imágenes es de 500 μm, 2x aumento. (B) Porcentajes de la generación exitosa de organoides cerebrales corticales a las 3 semanas de diferenciación in vitro en diferentes líneas de hPSC (G22, WTC y EU79). N = 3. Los datos se presentan como media ± desviación estándar. (C) Gráficos de barras que muestran el crecimiento de organoides cerebrales corticales (basados en el diámetro promedio) en las semanas 1 y 3 de diferenciación in vitro en diferentes líneas de líneas de células madre pluripotentes humanas (G22, WTC y EU79). N = 3. Los datos se presentan como media ± desviación estándar. (D) Imágenes representativas de secciones de organoides cerebrales corticales de 6 semanas y 9 semanas de edad derivados de G22 hPSCs, inmunoteñidos para la zona del ventrículo PAX6 (rojo) y placa cortical CTIP2 (verde). Todas las secciones fueron contramantadas con Hoechst 33342 (azul). Barra de escala = 140 μm, aumento de 20x. W es semana. (E) Imágenes representativas de secciones de organoides cerebrales corticales de 10 y 13 semanas de edad derivados de hPSC WTC, inmunoteñidos para la capa cortical IV SATB2 (verde). Todas las secciones fueron contramantadas con Hoechst 33342 (azul). 10 semanas de imagen Barra de escala = 50 μm, aumento de 40x. Imagen de 13 semanas Barra de escala = 150 μm, aumento de 40x. W es semana. Haga clic aquí para ver una versión más grande de esta figura.
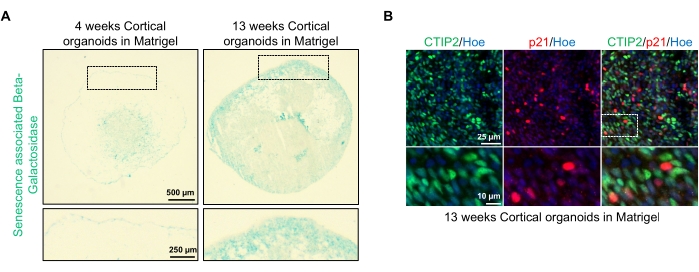
Figura 4: Caracterización de la senescencia en organoides cerebrales corticales derivados de hPSCs. (A) Imágenes representativas de secciones de organoides cerebrales corticales humanos derivados de hPSCs WTC cultivados durante 4 y 13 semanas in vitro y teñidos con SA-β-gal. Barra de escala = 500 μm, barra de escala de imágenes ampliadas = 250 μm, aumento de 4x. El cuadro de puntos indica una imagen ampliada. (B) Imágenes representativas de secciones de organoides cerebrales corticales de 13 semanas de edad derivados de hPSCs humanas EU79, inmunoteñidas para neuronas corticales CTIP2 (verde) y p21 (rojo). Todas las secciones estaban contramantadas con Hoechst 33342 (azul). Barra de escala = 25 μm, barra de escala de imágenes ampliadas = 10 μm, aumento de 40x. Haga clic aquí para ver una versión más grande de esta figura.
| Componentes multimedia | Concentración |
| DMEM Mezcla de nutrientes F12 10x 500 mL (DMEM/F-12) | |
| Suplemento N2 5 mL (100x) | Suplmentado al 1% |
| B 27 Suplemento 10 mL | Suplementado al 2% |
| Solución de aminoácidos no esenciales MEM (100x) | Suplementado al 1% |
| Penicilina-Estreptomicina (10.000 U/mL) | Suplementado al 1% |
| 2-Mercaptoetanol 50 ml (1000x) | Suplementado al 0,1% |
Tabla 1: N2 Medio. La tabla enumera los reactivos necesarios para preparar el medio N2.
| Componentes multimedia | Concentración |
| DMEM Mezcla de nutrientes F12 10x 500 mL (DMEM/F-12) | Los medios DM están hechos con una relación 1: 1 de DMEM / F12 y medios neurobasales |
| Medio neurobasal | |
| Suplemento N2 5 mL (100x) | Suplmentado en 0.5% |
| B 27 Suplemento 10 mL | Suplementado al 1% |
| Solución de aminoácidos no esenciales MEM (100x) | Suplementado al 1% |
| Suplemento GlutaMAX 100x | Suplementado al 1% |
| Penicilina-Estreptomicina (10.000 U/mL) | Suplementado al 1% |
| Solución de insulina humana recombinante | 12,5 μL para 50 ml de medios |
| 2-Mercaptoetanol 50 mL (1000x) | 17,5 μL para 50 ml de medios |
Tabla 2: Medio de diferenciación (DM). La tabla enumera los reactivos necesarios para preparar el medio de diferenciación.
Video complementario 1. Imágenes en vivo de la conversión inducida de láminas/colonias hNEct 2D a 3D bajo el tratamiento de bFGF. Las colonias inducidas de hNEct se separaron suavemente del plato con dispasa como se describió anteriormente y se transfirieron a una placa de cultivo de 6 pocillos de baja fijación. Las colonias 2D hNEct se convirtieron en esferoides hNEct 3D dentro de las 12 h. Las imágenes en serie se capturaron cada 5 minutos. Barra de escala = 100 μm. Haga clic aquí para descargar este video.
Para permitir el uso de organoides cerebrales derivados de hPSC en la detección de fármacos y el modelado de enfermedades, es crucial hacer organoides siguiendo un protocolo replicable y confiable15. Los organoides cerebrales se generan comúnmente a partir de cuerpos embrioides derivados de hPSC, que luego se incrustan en una matriz extracelular que promueve la expansión del tejido y la diferenciación neuronal. En comparación con protocolos comoel 1,16,17 de Lancaster y el Velasco 18, que comienzan a partir de cuerpos embrioides y permiten una vía de diferenciación predeterminada que debe seguir los organoides en desarrollo, hemos encontrado que comenzar la creación de organoides cerebrales corticales con células NEct humanas en lugar de con cuerpos embrionarios mejora la consistencia de la formación de organoides cerebrales corticales. En consecuencia, esto también permite la escala requerida para la detección de drogas y fenotípicas. Dado que las células NEct humanas no solo se pueden expandir en cantidades considerables, sino que también se pueden criopreservar fácilmente, este enfoque también mejora la replicabilidad entre experimentos. También cabe señalar que, en comparación con otros protocolos que han adoptado el uso de Biorreactores y tecnologías similares, no se requiere ningún equipo especializado para este protocolo, por lo que es adecuado para cualquier laboratorio6. Finalmente, el tiempo requerido para generar organoides maduros que son positivos para marcadores de capa cortical como SATB2 se reduce en comparación con los protocolos Lancaster1 y biorreactor 6,19, lo que lo hace más adecuado para estudiar la trayectoria de desarrollo del desarrollo cortical humano en salud y enfermedades 1,6,16.
Además, dado el impacto en continuo crecimiento de las enfermedades relacionadas con el envejecimiento, como la demencia, que se asocian con un aumento en los tipos de células senescentes en el cerebro que contribuye a la patogénesis, la capacidad de identificar y probar compuestos que pueden mejorar el envejecimiento cerebral es de enorme interés. A pesar de que se sabe que las hPSC se rejuvenecen epigenéticamente durante el proceso de reprogramación20, encontramos aumentos robustos en las células senescentes en organoides cerebrales corticales cultivados durante períodos prolongados de tiempo. Este es un desarrollo prometedor que ahora permite la detección de fármacos que eliminan dichas células senescentes del cerebro (senolíticos) o que ralentizan este proceso (senostáticos)21. Dado que los organoides cerebrales corticales derivados de NEct humano son de origen humano, este enfoque probablemente acortará el camino tradicional para comercializar tales terapias novedosas.
Hay dos pasos críticos en este protocolo. El primero es el nivel correcto de confluencia de las colonias de hPSC en el momento de la diferenciación. Las colonias de hPSC deben ser como máximo confluentes en un 30% para garantizar que las colonias de NEct generadas no se fusionen con colonias vecinas y que los organoides individuales sean impulsados clonalmente. El segundo paso crítico implica el uso correcto de la dispasa para levantar las colonias de NEct y producir los esferoides neurales. El momento de la incubación con dispasa es crítico para la calidad final de los esferoides neuronales generados. Esto se debe a que la sobreexposición de colonias con dispasa es tóxica para las células22 y eventualmente afecta la calidad de los organoides generados. La limitación de este protocolo es que es difícil controlar el tamaño de los esferoides neurales porque depende del tamaño de las colonias iniciales que se levantan con dispasa. Sin embargo, este problema se puede superar seleccionando esferoides neuronales que son de un tamaño similar al pasar a la etapa de incrustación.
Finalmente, las aplicaciones futuras podrían extenderse al uso de estos organoides corticales reproducibles en el análisis robótico y los enfoques de detección biofarmacéutica típicamente utilizados en esa industria. Esto está respaldado por datos preliminares de nuestro laboratorio que indican que la generación de organoides cerebrales corticales a partir de células NEct humanas se puede automatizar fácilmente, lo que la hace compatible con estos enfoques.
Los autores no tienen nada que revelar.
Este trabajo cuenta con el apoyo del Medical Research Future Fund-Accelerated Research, leucodystrophy flagship Massimo's Mission (EPCD000034), Medical Research Future Fund-Stem Cell Mission (APP2007653). Los autores desean agradecer al Dr. Ju-Hyun Lee (Universidad de Corea) por generar datos en el Video Suplementario 1.
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved