Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
Beyin Nöronal Yaşlanmasını Modellemek için Kortikal Beyin Organoidlerinin Sağlam ve Yüksek Oranda Yeniden Üretilebilir Üretimi In Vitro
Bu çalışmada, standart besleyicisiz hPSC kültürlerini kullanarak basit ama sağlam bir kortikal organoid kültür sistemi için ayrıntılı bir teknik sunuyoruz. Bu, in vitro beyin yaşlanmasının yönlerini modelleyen organoidler üretmek için hızlı, verimli ve tekrarlanabilir bir protokoldür.
Beyin organoidleri, gelişmekte olan insan beyninin üç boyutlu modelleridir ve hastalık modellemesi ve büyük ölçekli genomik ve ilaç taraması için zorlayıcı, son teknoloji bir platform sağlar. Beyin organoidlerindeki hücrelerin kendi kendini organize eden doğası ve nesilleri için mevcut protokollerin artan yelpazesi nedeniyle, organoidler arasındaki heterojenlik ve değişkenlik ile ilgili sorunlar tespit edilmiştir. Bu protokol makalesinde, bu sorunların büyük ölçüde üstesinden gelen ve 1 ay içinde nöroektodermal progenitörlerden kortikal organoidler üreten ve 1 yıldan fazla bir süre boyunca korunabilen sağlam ve tekrarlanabilir bir protokolü tanımlamaktayız. Bu yüksek oranda tekrarlanabilir protokol, standart bir doku kültürü odasında kolayca gerçekleştirilebilir ve tipik olarak gelişmekte olan insan korteksinde bulunan zengin bir hücre tipi çeşitliliğine sahip organoidlerle sonuçlanır. Erken gelişimsel yapılarına rağmen, nöronlar ve diğer insan beyin hücresi tipleri, uzun süreli in vitro kültürden sonra nöronal hücrelerde tipik yaşlanma belirtileri göstermeye başlayacak ve bu da onları yaşlanma ile ilgili nöronal süreçleri incelemek için değerli ve yararlı bir platform haline getirecektir. Bu protokol ayrıca, yaşlanma ile ilişkili beta-galaktosidaz boyamasını kullanarak kortikal beyin organoidlerinde bu tür yaşlanan hücreleri tespit etmek için bir yöntem özetlemektedir.
İnsan beyni hakkındaki mevcut bilgimiz büyük ölçüde hayvan modellerine ve ölüm sonrası beyin örneklerine dayanmaktadır. Kök hücre biyolojisi, insan beyni gelişiminin temel biyolojisine ve insan beyin bozukluklarının patolojik sürücülerine yeni bakış açıları sağlayan hızla ilerleyen bir alandır. İnsan pluripotent kök hücreleri (hPSC'ler), insan beynini organoidlerin oluşumu, tipik olarak gelişimsel yörüngeleri, hücresel yapıyı ve gelişmekte olan insan beyninin mimarisini özetleyen organ benzeri üç boyutlu (3D) doku yoluyla modellemek için paha biçilmez bir araçtır. Beyin organoidleri kendi kendine monte edilir ve nöral kök hücrelerden, belirtilen nöral progenitörlerden, olgun nöronlardan ve glial hücre tiplerinden oluşur. Bu nedenle organoidler, doğrudan deney için genellikle erişilemeyen ancak aynı zamanda vaskülatür ve bağışıklık sisteminin yokluğu gibi içsel sınırlamaları olan erken insan beynini incelemek için eşsiz bir fırsat sunar.
Beyin organoidleri üretme metodolojileri iki farklı şekilde takip edilmiştir: rehbersiz ve rehberli farklılaşma. Yönlendirilmemiş beyin organoid yöntemleri, doku morfogenezi 1,2'yi yönlendiren kök hücrelerin spontan içsel farklılaşma kapasitelerine dayanır ve ön beyin, orta beyin ve arka beyinden koroid pleksus, retina ve mezoderme kadar çeşitli hücre soy kimliklerinin ortaya çıkmasına izin verir. Buna karşılık, yönlendirilmiş beyin organoid yöntemleri, hPSC'leri medial gangliyonik eminans3, ön beyin4, orta beyin5, hipotalamus6, beyincik7 ve koroid pleksus8 gibi bir beyin bölgesi tipini temsil eden nöronal soyların istenen modeline yönlendirmek için dış faktörlerin önemli ölçüde kullanılmasını gerektirir. Farklı hücre soylarına sahip farklı beyin bölgeleri üretme yeteneği ve bunları istediği zaman birleştirme potansiyeli, beyin organoidlerini insan beyni gelişimini araştırmak ve beyinle ilgili hastalıkların altında yatan mekanizmaları deşifre etmek için mükemmel bir model haline getirir. Beyin organoidleri üretmek için bu yöntemler insan beyni bölgelerinin modellenmesinde bir atılım sunsa da, organoidler arasındaki değişkenlik ve heterojenlik, ilaç taraması gibi sistematik ve nicel çalışmalar için önemli bir sınırlama olmaya devam etmektedir.
Mevcut protokol, son makalemiz9'da geliştirilen bir yönteme dayanmaktadır ve hPSC kolonilerinin, FGF2 sinyallemesinin etkisi altında 3D nöroepitel sferoidlerine 4 gün içinde kendi kendini organize etme yeteneğine sahip olan çift SMAD inhibitörleri (SB-431542 ve LDN 193189) ile nöroektoderm (NEct) kimliğine doğru seçici farklılaşmasını içerir. Bu nöroepitel sferoidleri, farklılaşmadan sonraki 4 hafta içinde in vivo benzeri bir hücresel bileşime sahip homojen kortikal organoidleri güvenilir bir şekilde üretir. Burada açıklanan protokol, ikili SMAD (Dekapentaplejik'e Karşı Annelerin Baskılayıcısı) sinyallemesinin inhibisyonunun, hPSC'lerin nöroektodermal progenitörlerden türetilen rostral nöral kök hücrelere doğru farklılaşmasını teşvik ettiğini gösteren önceki bulgularımız üzerine inşa edilmiştir10 , diğerlerinin yanı sıra, endodermal, mezodermal ve trofektoderm hücre kaderi seçimini inhibe ederek11 . Ayrıca, nöroepitel sferoidlerinin hESC nitelikli bazal membran matrisine gömülmesi, nöroepitelinin önemli ölçüde tomurcuklanmasını tetikleyerek apikobazal polariteli ventriküller oluşturur. Büyük ölçekli kültür, kortikal organoidlerin hücre hatlarından, klonlardan veya partilerden bağımsız olarak tekrarlanabilirliğini ve homojenliğini gösterdi ve böylece in vitro sağlık ve hastalıkta erken insan kortikal gelişimini taklit etmek için güvenilir ve istikrarlı bir kök hücre sistemini temsil etti. Ayrıca, uzun süre kültürlenmiş olan hPSC'lerden türetilmiş kortikal beyin organoidlerinde yaşlanan nöronal hücre belirteçlerini tespit etmek için bir protokol hazırladık.
hPSC'leri% 20-30'luk bir tohumlama yoğunluğunda kapladıktan sonra, hücreler hPSC kolonilerini nöroektodermal kolonilere doğru ayırt etmek için 3 gün boyunca çift SMAD inhibitörleri ile muamele edilir. Bu koloniler daha sonra dispase ile nazikçe kaldırılır ve FGF2 ile desteklenmiş ultra düşük ataşman 6 delikli plakalara ekilir. Yüzen 2D koloniler, bir gecede 3D nöroektodermal sferoidlere kendi kendini organize eder ve günlük olarak FGF2 ile desteklenen N2 ortamında 4 gün boyunca korunur. Sferoidler nöroepitelyal tabakayı kurduktan sonra, bazal membran matrisine gömülebilirler. Rutin olarak taze terminal farklılaşma ortamı ekleyerek, araştırmacılar kortikal organoidlerde nöroepitelinin ilerleyici genişlemesini ve tomurcuklanmasını gözlemleyeceklerdir. Araştırmacılar, transkripsiyonel ve proteomik profilleme yapmak için bu organoidleri ayırmak isteyebilirler. Ek olarak, kortikal organoidlerin kalitesini izlemek için parlak alan görüntüleme önerilir. Analiz fiksasyon, kriyoseksiyon ve immün boyama ile yapılabilir. Bu teknikler için açıklamalar ve yöntemler daha önce tanımlanmıştır12. Nihayetinde, bu protokol, araştırmacıların gelişmekte olan insan kortikal beynini modellemek için, düşük maliyetli ve sınırlı ekipmanla homojen kortikal beyin organoidlerini hızlı ve sağlam bir şekilde üretmelerini ve bu makalede belirtildiği gibi hücresel nöronal yaşlanmanın yönlerini incelemelerini sağlar.
1. Kortikal beyin organoidleri üretimi
NOT: Protokolün bu bölümündeki tüm adımlar, aksi belirtilmedikçe, Sınıf 2 biyogüvenlik başlığında gerçekleşecektir.
- hPSC 2D kültüründen 2D nöroektodermal kolonilerin indüksiyonu (Gün -1 ila 3)
- İndüksiyondan önce, hPSC kolonilerini hESC nitelikli bir bazal membran matrisi üzerinde% 20 -% 30 yoğunlukta 6 delikli bir plakada plakalayın. Bu yoğunluğa, hPSC kolonilerini %60 akıcılıkta 6 delikli bir plakanın bir kuyucuğundan 6 delikli bir plakanın üç kuyucuğuna geçirerek elde edin.
- Bodrum membran matris kaplaması için, bazal membran matrisini düz bir bazal ortamda 1:50 oranında seyreltin. 6 delikli bir plakanın 1 mL / kuyucuğunu eşit olarak biriktirin, oda sıcaklığında (RT) 1 saat inkübe edin ve sonra aspire edin.
- Farklılaşmadan önce hPSC kolonilerini 2 mL'lik serumsuz bir hücre kültürü ortamında 1 gün boyunca koruyun.
- hPSC farklılaşması gününde, tespit edilebilir farklılaşma olmadan sağlıklı koloniler sağlamak için 4x ila 10x büyütmede parlak alan mikroskobu kullanarak hPSC kolonilerini inceleyin.
NOT: Sağlıklı hPSC'ler, büyük bir çekirdeğe, çok küçük sitoplazmaya ve belirgin nükleollere sahip hücrelerle sıkı kenar kolonileri oluşturacaktır. Farklılaşmış iPSC kolonileri, yukarıda tarif edilen hPSC kolonilerininkine göre, özellikle kolonilerin dış kenarlarında veya merkezde açık morfolojik farklılıklar sergileyecektir. - Farklılaştırma için gereken N2 ortamını oluşturmak üzere Tablo 1'de listelenen reaktifleri ekleyin. Kullanmadan önce bu ortamı RT'ye getirin.
- RT'ye girdikten sonra, 6 delikli plakanın her bir kuyucuğundan serumsuz hücre kültürü ortamını aspire edin ve 5 mL'lik bir serolojik pipetle hafifçe eklenen 2 mL N2 ortamı ile değiştirin.
- Çift SMAD inhibitörlerini, SB-431542 (10 μM) ve LDN 193189 (100 nM) ekleyin.
NOT: SMAD inhibitörleri, ortam her bir oyuğa yerleştirildikten sonra N2 ortamına veya serumsuz hücre kültürü ortamının değiştirilmesinden önce gerekli miktarda N2 ortamına eklenebilir. İnhibitörler, plakayı hafifçe döndürerek veya ortamı ve inhibitörleri içeren tüpü 3-4 kez ters çevirerek ortama eşit olarak dahil edilebilir. - Sonraki 2 gün boyunca her bir kuyucuğa SB-431542 (10 μM) ve LDN 193189 (100 nM) ile desteklenmiş taze N2 ortamı ekleyin.
NOT: SB-431542 ve LDN 193189 bileşiklerini çözmek ve sitotoksisiteyi önlemek için kullanılan DMSO'ya hücrelerin uzun süre maruz kalmasını azaltmak için taze N2 ortamı eklenir.
- İndüklenmiş 2D nöroektodermal kolonilerden 3D nöroektodermal sferoidlerin üretimi (Gün 3 ila 7)
- İndüklenmiş nöroektodermal kolonileri, 1.2.2-1.2.8 adımlarını izleyerek dispase kullanarak kaldırın.
- İlk olarak, 6 delikli plakadan 2 mL N2 ortamını çıkarın ve N2 ortamının tamamının çıkarıldığından emin olmak için 1x'i HBSS ile yıkayın.
NOT: N2 ortamı, dispazın enzim aktivitesine müdahale edebilir ve nöroektodermal kolonilerin kuyudan yeterli şekilde ayrılmasını önleyebilir. - Koloni içeren her kuyuya 1 mL 2.4 birim / mL dispase ekleyin.
- Kuyuyu 37 ° C'de 20-25 dakika (maksimum 30 dakika) kuluçkaya yatırın. Koloni dekolmanı düzenli olarak kontrol edin.
NOT: Küçük koloniler 20 dakika içinde ayrılabilir. 30 dakika sonra sıkışıp kalan koloniler göz ardı edilmelidir. - Kuluçkadan sonra, dispaz enziminin aktivitesini durdurmak için kuyucuğa 1 mL N2 orta ekleyin ve geniş delikli bir P1000 pipet ucu veya steril makasla kesilmiş modifiye edilmiş bir P1000 pipet ucu kullanarak kolonileri 15 mL'lik bir tüpe aktarın (geniş delikli bir P1000 ucu yapar).
- Koloni kümelerinin yerçekimi ile tüpün dibine batmasına izin verin.
NOT: Bu işlem yaklaşık 1 dakika sürecektir. - Kümeler battıktan sonra, süpernatantı standart bir P1000 pipet ucu ile dikkatlice çıkarın ve 1 mL taze N2 ortamı ile değiştirin. Dispasın tamamen giderilmesini sağlamak için bu yıkama adımını üç kez tekrarlayın.
NOT: Kalan herhangi bir dispas, nöroektodermal sferoidlerin düzgün bir şekilde oluşumunu önleyecek ve hücre ölümüne neden olacaktır. - Yıkadıktan sonra, hücre kümelerini 3 mL N2 ortamında yeniden askıya alın ve 6 delikli bir plakanın bir kuyucuğuna aktarın ve 40 ng / mL bFGF ekleyin.
NOT: Çok sayıda nöroektodermal koloni ayrılmışsa, bu koloniler sferoidlerin füzyonunu önlemek için 6 delikli bir plakanın iki veya daha fazla kuyucuğu boyunca kaplanabilir. Kolonilerin ayrılmasından 24 saat sonra, sferoidlerin oluşup oluşmadığını kontrol edin. - Sferoidleri önümüzdeki 3-4 gün boyunca aynı ortamda tutun, ancak nöroektodermal hücre proliferasyonunu teşvik etmek, kendi kendini organize etmek ve nöroepiteliyi indüklemek ve genişletmek için her bir kuyucuğa günlük taze bFGF (40 ng / mL) ekleyin.
NOT: Sferoidler daha yüksek yoğunlukta kaplanmışsa, ortamın sararması muhtemeldir ve her 2 günde bir taze bFGF (40 ng / mL) ile değiştirilmesi gerekir. Bununla birlikte, bu önerilmez ve bunun yerine, bu sorunu önlemek için her kuyucukta daha az sayıda sferoid bulundurulmalıdır. Sferoidler, nöroepitelya belirginse 3 gün sonra bazal membran matrisine gömülebilir. Nöroepithelia belirgin değilse veya güçlü görünmüyorsa, sferoidleri başka bir gün boyunca saklayın ve tekrar kontrol edin.
- Kortikal beyin organoid farklılaşması ve bakımı (Gün 8)
- Terminal farklılaştırma ortamını (DM) Tablo 2'de listelenen reaktifleri kullanarak hazırlayın. Bu medyayı RT'ye getirin.
- Buz üzerinde %100 hESC nitelikli bazal membran matrisini çözün.
- 10 cm'lik bir Petri kabında% 70 etanol ile sterilize edilmiş gamzeli bir parafilm tabakası hazırlayın ve bir kaputun altındaki bir stereomikroskop üzerine yerleştirin.
NOT: Bir gamze ızgarası oluşturmak için 200 μL pipet uçlarından oluşan boş bir tepsi kullanılabilir. - 100 μL'lik pipet ucunun ucunu kesin (geniş delikli hale getirmek için). Bu, nöral sferoidleri bodrum matrisine kırmadan gömmek için kullanılacaktır.
- Bir stereomikroskop kullanarak, 6 delikli plakadan benzer boyutlu nöral sferoidleri (500 μm) seçin ve bunları geniş delikli 100 μL pipet ucunu kullanarak parafilm gamzelerine aktarın ve gamze başına tek bir nöral sferoid yerleştirin.
- Fazla medyayı nazikçe çıkarın, sferoidleri örtecek kadar bırakın.
NOT: Bu, bodrum matrisini eklemeden önce sferoidlerin kalitesini korumak ve kurumadıklarından emin olmak içindir. - Sferoid üzerine yavaşça 18 μL bodrum matrisi ekleyin ve sferoidi matris damlasının merkezine yerleştirin. Matristeki sferoidleri ortalamak için 10 μL pipet ucunun ucunu kullanın.
NOT: Sferoidlerin etrafındaki fazla ortamın kurumasını önlemek için bodrum matrisini mümkün olduğunca çabuk eklemeye çalışın. - 10 cm'lik Petri kabını örtün ve inkübatöre aktarın ve parafilm kabını 25 dakika boyunca 37 ° C'de bodrum matrisi gömülü sferoidlerle inkübe edin.
- Kuluçkadan sonra, gömülü sferoidleri, 0,5 mL DM ortamına sahip bir P1000 ucu kullanarak düşük ataşmanlı 24 delikli bir plakaya durulayın, böylece gömülü sferoidlerin her birinin bir kuyucuğuna yerleştirildiğinden emin olun.
NOT: Birden fazla gömülü sferoid bir kuyucuğa düşerse, diğer sferoidi yeni bir kuyuya aktarmak için geniş delikli bir P1000 ucu kullanın. - DM ortamındaki farklılaşmış kortikal beyin organoidlerini uzun süre koruyun, organoidler büyüdükçe ve yaşlandığında her 2 günde bir medya değişiklikleri meydana gelir.
NOT: Farklılaşmanın ilk haftasında, ortam her 3 günde bir değiştirilebilir.
2. Kortikal organoidlerde nöronal yaşlanmanın karakterizasyonu
- Kriyoseksiyonlar için kortikal organoidleri işleyin:
NOT: Adımlar Sınıf 2 biyogüvenlik başlığında gerçekleştirilmiştir.- Her biri 1,5 mL% 4 paraformaldehit (PFA) ile doldurulmuş 2 mL tüp hazırlayın.
- P1000 pipet ucunun ucunu kesin (geniş delikli hale getirmek için) ve her organoidi yukarıda hazırlanan 2 mL tüplerden birine (tüp başına bir organoid) yavaşça aktarın.
NOT: PFA ile aşırı DM ortamının karışmasını önlemek için, organoidin P1000 pipet ucunun açılmasına doğru batmasına izin verin ve organoidi pipetlemeden önce ucu PFA'nın hemen üst kısmının hemen üstünde tüpün içinde dinlendirin. Bu, araştırmacının sadece organoid ve çok az medya aktarmasını sağlayacaktır. - Fiksasyon işleminin 1 saat boyunca 4°C'de gerçekleşmesine izin verin.
- Kesilmemiş bir P1000 pipet ucu kullanarak fazla PFA'yı dikkatlice aspire edin ve 1,5 mL soğuk 1x PBS ekleyin.
- Tüpleri RT'de 10 dakika boyunca 70 rpm'de ayarlanmış bir yörüngesel çalkalayıcıya aktarın.
- Tüm PFA'nın iyice çıkarıldığından emin olmak için yıkama işlemini soğuk 1x PBS ile üç kez tekrarlayın.
NOT: PFA'yı normal atık konteynerlerine atmayın; Bunun yerine, PFA bir tehlike oluşturduğundan, bunun için belirli bir kimyasal atık bertaraf kabı hazırlayın. - Organoidleri% 30 sakkaroz içeren 1x PBS'ye batırın ve tüm organoidler tüpün dibine batana kadar 4 ° C'de inkübe edin.
NOT: Organoidlerin batmasına izin vermek için gereken süre, organoidlerin büyüklüğüne / yaşına bağlıdır. 3 aylık organoidler 5 saate kadar sürebilir. - Kesilmiş, geniş delikli bir P1000 pipet ucu kullanarak, üç ila beş organoidi, %30 sakkaroz ve %100 optimum kesme sıcaklığı (OCT) ortamından yapılmış bir montaj çözeltisi içeren bir montaj kalıbına 3:2 oranında nazikçe aktarın.
- Organoidleri ızgara benzeri bir düzende yönlendirmek ve konumlandırmak için stereomikroskop yardımıyla 10 μL'lik bir pipet ucu kullanın.
- Bir kriyostat kullanarak kriyoseksiyona (16-20 μm) devam etmeden önce sakkaroz OCT çözeltisini katılaştırmak için kalıbı kuru buz üzerine yerleştirin.
NOT: Yaşlanma ile ilişkili beta-galaktosidaz için, tüm dokular battıktan sonra kesitleme için işlenmelidir. İmmünofloresan için, dokular ertesi gün kesitleme için işlenebilir. Kesitleri içeren tüm slaytlar, hemen lekelenmezse, sonraki immünofloresan veya beta-galaktosidaz öncesi -20 ° C'de saklanmalıdır.
- Kortikal beyin organoidlerinde yaşlanma analizi süreci:
NOT: Aşağıdaki adımlar normal bir laboratuvar tezgahında gerçekleştirilebilir.- Slaytları kapaklı bir mikroskop slayt boyama kabına aktarın ve fazla montaj solüsyonunu çıkarmak için kesitli organoid dokuyu RT'de 10 dakika boyunca 1x PBS ile üç kez yıkayın.
- Bunu takiben, yıkanmış dokuyu 37 ° C'de gece boyunca taze yapılmış beta-galaktosidaz boyama çözeltisi ile inkübe edin.
NOT: Beta-galaktosidaz boyama çözeltisi fosfat tamponundan (10 mL fosfat tamponu için: 8.15 mL 1 M NaH 2 PO 4, 1.85 mL 1M Na 2 HPO4) ayarlanmış pH = 6.100 mM potasyum hekzasiyanoferat (III), 100 mM potasyum hekzasiyanoferrat (II) trihidrat, 5 M NaCl, 1 M MgCl2'denyapılmıştır. 20 mg / mL X-Gal. CO2 içeren standart bir hücre kültürü inkübatörü kullanmaktan kaçının, çünkü CO2 beta-galaktosidaz boyama çözeltisinin pH'ını değiştirecektir. - Beta-galaktosidaz çözeltisini çıkarmak için lekeli dokuları RT'de her biri 10 dakika boyunca üç kez 1x PBS ile yıkayın.
- Yıkanmış dokuları bir cam antifade mountant ile monte edin ve mikroskop altında görüntülemeden önce montaj çözeltisinin RT'de 30 dakika boyunca katılaşmasını sağlayın.
Burada, araştırmacıların kültürden sonraki 1-3 ay içinde in vivo insan kortikal beyin bölgesini taklit eden homojen hPSC türevi kortikal beyin organoidleri üretmelerini sağlayan sağlam bir protokol tanımladık. hPSC kolonileri ilk önce nöroektodermal koloniler üretmek için farklılaşma ortamlarında kültürlenir, bu daha sonra nöral sferoidler oluşturmak için kullanılabilir. Bu sferoidler daha sonra bir bazal membran matrisine gömülür ve nöronal yaşlanmayı modellemek için kullanılabilecek organoidler üretmek için uzun süre korunur (protokolün bir taslağı için Şekil 1'e bakınız). Bu organoidlerin ultra kaplamasız 24 kuyucuklu plakalarda kültürlenmesinin hücresel strese neden olduğunu ve 13 haftalık in vitro kültür boyunca yaşlanma ile ilişkili fenotipleri teşvik ettiğini belirtmek gerekir. Bu protokolden türetilen organoidler, kortikal plaka sinir hücrelerinin optimum büyümesi ve farklılaşması için karıştırılmış biyoreaktörlerde veya hava-sıvı arayüzünde de muhafaza edilebilir.
Başlamak için, hPSC kolonileri nöroektodermal farklılaşmadan 1 gün önce kültürlenir. Bu hPSC kolonilerinin sadece% 20-30 oranında kültürlenmesi ve mümkün olan en yüksek kalitede olması çok önemlidir: kolonileri kirleten farklılaşmış hücrelere sahip olmayan sıkı düz bir tek katmanlı (Şekil 2A, B). hPSC kolonilerinin pluripotensi, NANOG gibi belirteçlerin ekspresyonu ile doğrulanmalıdır (Şekil 2C). Doğrulanmış hPSC kolonileri daha sonra SB-431542 ve LDN 193189 ile N2 nöroektodermal farklılaşma ortamına maruz bırakılır. Bu ortamda 3 günlük bakımdan sonra, hPSC kolonileri nöroektodermal kolonilere farklılaşmış olmalı ve artık hPSC'lerin aynı sıkı düz tek katmanlı morfolojisini göstermemelidir (Şekil 2B), bunun yerine daha uzun sütunlu şekilli hücreler haline gelecektir (Şekil 2B). Bu hücreler ayrıca NANOG gibi pluripotens belirteçleri için negatif olacaktır (Şekil 2C).
Bu aşamada, nöroektodermal koloniler enzimatik olarak dispase ile ayrılır ve her sağlıklı ve başarılı bir şekilde ayrılmış koloninin kendi kendini organize etmesine ve genç bir nöral sferoid oluşturmasına izin verilir (Şekil 2D, Ek Video 1). Sadece sağlıklı, temiz nöroektodermal koloniler, dispase aktivitesi için belirtilen zaman diliminde ayrılacaktır; diğer tüm koloniler, daha düşük kalitede bir sferoid ile sonuçlanacakları için göz ardı edilmelidir. N2 ortamında FGF2'ye günlük maruz kalma ile, bu sferoidlerdeki nöral kök hücreler (SOX2 +) (Şekil 2D, gün 1) çoğalacak ve önemli sayıda nöral rozet oluşturacaktır (Şekil 2D, gün 4). Bu rozetler, rozetlerin merkezinde ve sferoidin dış kenarı boyunca bulunan hücrelerdeki sıkı birleşme ve epitel belirteci ZO1'i ifade edecek ve sferoidin apikal-bazal polaritesini gösterecektir (Şekil 2D, gün 4). Sferoidlerin bütünsel 3D görüntüleme yöntemi13'ten önce tanımlanmıştır. Sferoidlerin günlük muayenesi, sferoidlerin sıkı, karanlık bir dış kenarının ve parlak çevresinin oluşumunu aydınlatmalıdır, bu nöroepitelyal tabakadır. Bu tabaka 3-4 gün sonra yaklaşık 500 μm çapında yeterince oluşturulmalıdır, bu sırada sferoidler bodrum matrisine gömülebilir. Bu tabaka mevcut değilse veya sadece zayıf bir şekilde oluşmuşsa, sferoidler ileri atılacak kadar gelişmemiştir. Herhangi bir değişikliği gözlemlemek için bir gün daha beklemeniz önerilir, ancak bu gözlenmezse, bu sferoidleri göz ardı edin.
3 günlük kültürden sonra sferoidlerin temsili bir parlak alan görüntüsü Şekil 2D'de görülebilir. Diğer komşu sferoidlerle kaynaşmamış, yarı saydam dokuya sahip ve nöral rozet oluşumu gösteren sıkı bir nöroepitelyal tabakaya sahip sferoidler, bodrum matrisine gömülmek üzere seçilir. Gömüldükten sonra, küresel hızla çoğalacak ve tomurcuklanmaya başlayacaktır: sferoidin ana gövdesinden dışa doğru genişleyen kompakt doku düğümleri ortaya çıkacaktır. Bu, bodrum matrisinde 1-3 hafta arasında belirgindir ve çoklu hücre hatlarında gözlenebilir (Şekil 3A). Gömülü sferoidlerin kantitatif analizi, üç farklı hücre hattındaki sferoidlerin% 100'üne kadar epitel hücrelerinin varlığını doğrulayarak, bu protokolden beklenen homojenliği ve tekrarlanabilirliği doğrulamaktadır (Şekil 3B). İn vitro farklılaşma sırasında organoid çapının nicelleştirilmesi, farklı hPSC hatları boyunca tekrarlanabilirliği daha da doğrulamaktadır (Şekil 3C). Tomurcuklanma meydana gelmezse, sferoidler uygun şekilde gelişmez ve atılmalıdır. Sferoidler bir matrise gömüldükten sonra, gelişimleri ilerler ve sferoidler şimdi organoidler olarak adlandırılır. İmmünofloresan boyama aynı zamanda nöral progenitör hücrelerin (PAX6) yanı sıra berrak tabakalı organoidlerde CTIP2 ve SATB2 ile boyanmış kortikal tabaka belirteçlerinin varlığını da doğrular (Şekil 3D,E). Bu katmanlama, organoid bakımının farklı zaman noktalarında gözlemlenebilir (Şekil 3D, E). Dokuların immünohistokimya yöntemi14'ten önce tanımlanmıştır.
Bu organoidlerin olası bir uygulaması, nöronal yaşlanma ile ilgili süreçlerin beyni nasıl etkilediğini incelemektir. Bunu araştırmak için, başarılı bir şekilde üretilen organoidler, yaşlanma ile ilişkili beta-galaktosidaz ve p21 gibi yaşlanmanın standart moleküler biyobelirteçleri için bölümleme ve boyama için birçok farklı zaman noktasından toplanır. Şekil 4A, bazal membran matrisine gömüldükten 4 ve 13 hafta sonra organoidlerin yaşlanma ile ilişkili beta-galaktosidaz boyanmasının temsili bir görüntüsünü göstermektedir. 4 ila 13. haftalar arasında, yaşlanma ile ilişkili beta-galaktosidaz varlığında belirgin bir artış vardır, bu da organizma yaşlanmasının tanınmış bir sürücüsü olan hücresel yaşlanmanın kültürde bu süre zarfında meydana geldiğini düşündürmektedir. 13. haftada organoidlerin immünofloresan boyaması, olgun kortikal nöronal belirteç (CTIP2) ile birlikte etiketlenmiş ve Şekil 4B'de görülebilen başka bir yaşlanma belirteci olan p21'in varlığını doğruladı. Bununla birlikte, p21'in varlığının hücre döngüsü durmasının bir belirteci olduğu ve kendi başına yaşlanmanın kesin bir belirteci olmadığı ve p16 ve SASP (yaşlılıkla ilişkili sekretuar fenotip) faktörleri gibi diğer yaşlanma belirteçlerinin saptanmasının hücreleri yaşlanan olarak kesin olarak tanımlamak için önerildiği belirtilmelidir.
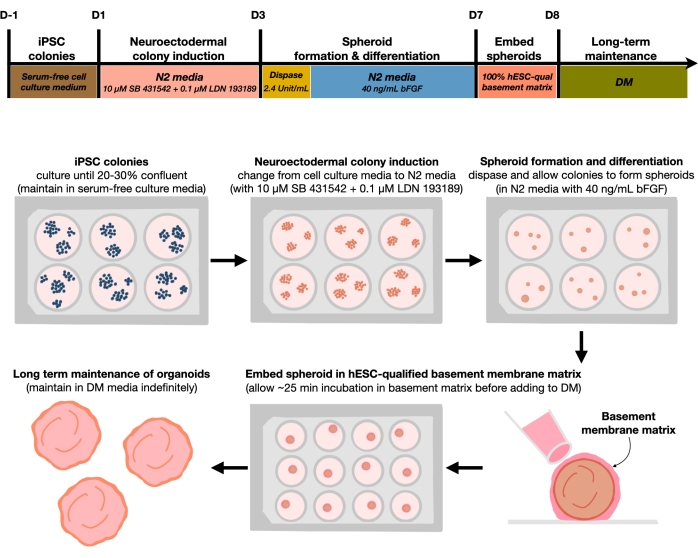
Şekil 1: Tekrarlanabilir kortikal beyin organoidleri üretmek için şematik diyagram. Besleyicisiz ortamda tutulan hPSC'lerden kortikal beyin organoidlerinin üretilmesi için deneysel prosedürün şematik iş akışı. İş akışı, 2D hPSC'leri organoidlerdeki 3D desenli kortikal plaka insan dokularına ayırmak için altı adıma genel bir bakış sağlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
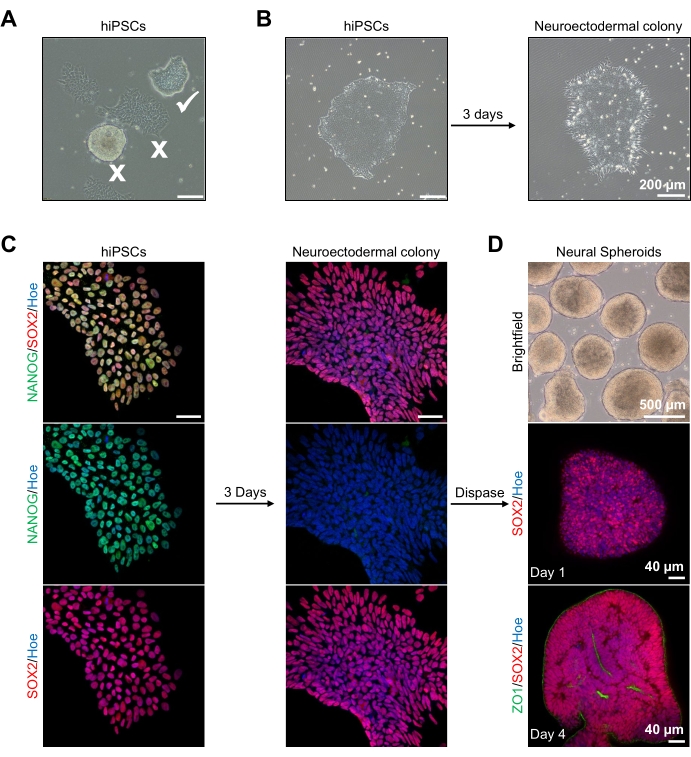
Şekil 2: Nöroektodermal koloniler-hPSC'lerden türetilen nöral sferoidlerin oluşumu . (A) Optimum (beyaz kene) ve farklılaşmış koloniler (beyaz haç) sergileyen insan PSC'sinin temsili görüntüleri. Ölçek çubuğu: 200 μm, 4x büyütme. (B) 3 günlük ikili SMAD inhibitörü tedavilerinden sonra hPSC'lerden türetilen nöroektodermal koloninin temsili görüntüsü. Ölçek çubuğu: 200 μm, 4x büyütme. (C) İnsan PSC kolonileri nöroektodermal kolonilere doğru farklılaştı. Görüntüler, PSC (1. günde) ve nöroektodermal (3. günde) kolonilerin SOX2 (Kırmızı), NANOG (Yeşil) ile boyanmasını temsil ediyor, tüm çekirdekler Hoechst 33342 (mavi) ile karşı boyandı. Ölçek çubuğu: 40 μm, 100x büyütme. (D) Kortikal beyin sferoidlerinin zaman içinde gelişimsel aşamalarını parlak alan altında in vitro kültürde gösteren görüntüler ve 1. günde SOX2 (Kırmızı) ile boyanmış ve 4. günde SOX2 (kırmızı) ve ZO1 (Yeşil) ile çift immünoboyalı bütün. Parlak alan görüntüsünün ölçek çubuğu 500 μm, 4x büyütme, alt görüntülerin ölçek çubukları 40 μm, 20x büyütmedir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
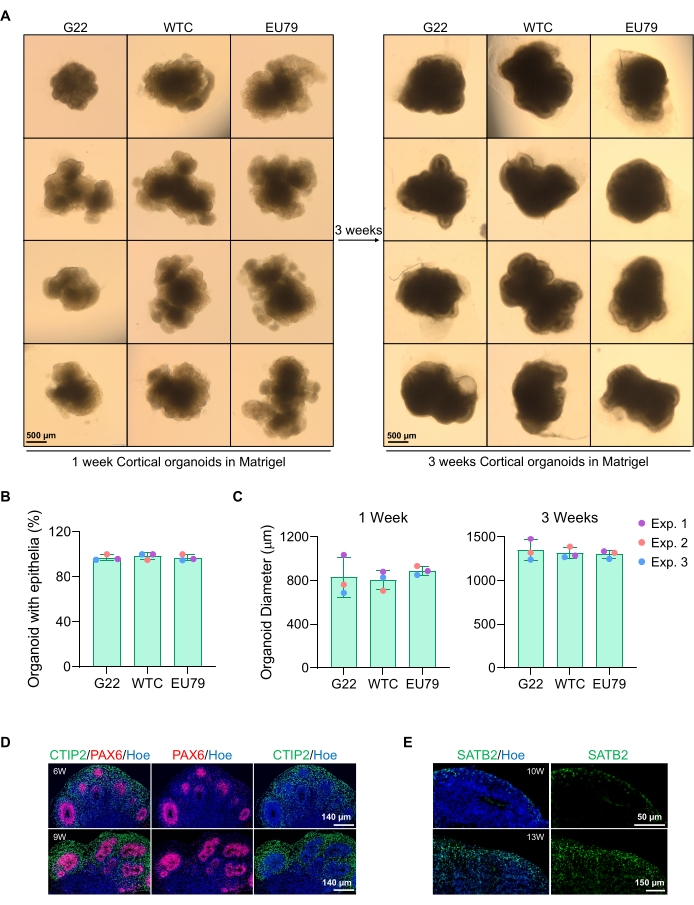
Şekil 3: Farklı hPSC hatlarından türetilen kortikal beyin organoidlerinin karakterizasyonu. (A) G22, WTC ve EU79 insan iPSC hatlarından türetilen kortikal beyin organoidlerinin in vitro 3 hafta boyunca kültürlenmiş temsili görüntüleri. Tüm görüntülerin ölçek çubuğu 500 μm, 2x büyütmedir. (B) Farklı hPSC hatlarında (G22, WTC ve EU79) 3 haftalık in vitro farklılaşmada kortikal beyin organoidlerinin başarılı üretim yüzdeleri. N = 3. Veriler ortalama ± standart sapma olarak sunulmuştur. (C) Kortikal beyin organoidlerinin büyümesini gösteren çubuk grafikler (ortalama çapa dayanarak), insan pluripotent kök hücre hatlarının farklı hatlarında (G22, WTC ve EU79) in vitro farklılaşmanın 1. ve 3. haftalarında. N = 3. Veriler ortalama ± standart sapma olarak sunulmuştur. (D) G22 hPSC'lerden türetilen, ventrikül bölgesi PAX6 (kırmızı) ve kortikal plaka CTIP2 (yeşil) için immünoboyalı 6 haftalık ve 9 haftalık kortikal beyin organoidlerinin bölümlerinin temsili görüntüleri. Tüm bölümler Hoechst 33342 (mavi) ile karşı lekelenmiştir. Ölçek çubuğu = 140 μm, 20x büyütme. W haftadır. (E) WTC hPSC'lerden türetilen, kortikal tabaka IV SATB2 (yeşil) için immünoboyalı 10 haftalık ve 13 haftalık kortikal beyin organoidlerinin bölümlerinin temsili görüntüleri. Tüm bölümler Hoechst 33342 (mavi) ile karşı lekelenmiştir. 10 haftalık görüntü Ölçek çubuğu = 50 μm, 40x büyütme. 13 haftalık görüntü Ölçek çubuğu = 150 μm, 40x büyütme. W haftadır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
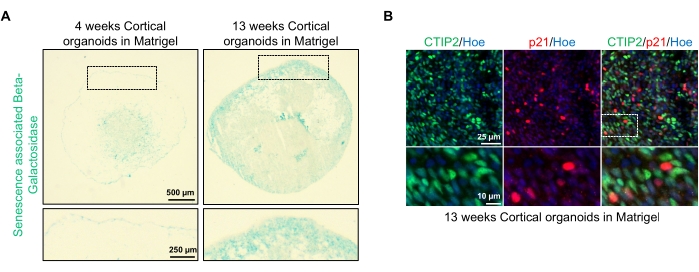
Şekil 4: hPSC'lerden türetilen kortikal beyin organoidlerinde yaşlanmanın karakterizasyonu. (A) WTC hPSC'lerinden türetilen insan kortikal beyin organoidlerinin bölümlerinin temsili görüntüleri, in vitro olarak 4 ve 13 hafta boyunca kültürlenmiş ve SA-β-gal ile boyanmıştır. Ölçek çubuğu = 500 μm, yakınlaştırılmış görüntülerin ölçek çubuğu = 250 μm, 4x büyütme. Noktalı kutu büyütülmüş bir görüntüyü gösterir. (B) İnsan EU79 hPSC'lerinden türetilen, kortikal nöronlar CTIP2 (yeşil) ve p21 (kırmızı) için immünoboyalı 13 haftalık kortikal beyin organoidlerinin bölümlerinin temsili görüntüleri. Tüm bölümler Hoechst 33342 (mavi) ile karşı lekelenmiştir. Ölçek çubuğu = 25 μm, yakınlaştırılmış görüntülerin ölçek çubuğu = 10 μm, 40x büyütme. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Medya bileşenleri | Konsantrasyon |
| DMEM Besin karışımı F12 10x 500 mL (DMEM/F-12) | |
| N2 Eki 5 mL (100x) | %1 oranında desteklendi |
| B 27 Ek 10 mL | %2 oranında desteklenir |
| MEM Esansiyel Olmayan Amino Asitler Çözeltisi (100x) | % 1 oranında desteklenir |
| Penisilin-Streptomisin (10.000 U/mL) | % 1 oranında desteklenir |
| 2-Merkaptoetanol 50 mL (1000x) | % 0.1 oranında desteklenir |
Tablo 1: N2 Orta. Tabloda, N2 ortamını hazırlamak için gereken reaktifler listelenmiştir.
| Medya bileşenleri | Konsantrasyon |
| DMEM Besin karışımı F12 10x 500 mL (DMEM/F-12) | DM medyası, DMEM / F12 ve Nörobazal ortamın 1: 1 oranı ile yapılır |
| Nörobazal Orta | |
| N2 Eki 5 mL (100x) | %0,5 oranında artış gösterdi |
| B 27 Ek 10 mL | % 1 oranında desteklenir |
| MEM Esansiyel Olmayan Amino Asitler Çözeltisi (100x) | % 1 oranında desteklenir |
| GlutaMAX Takviyesi 100x | % 1 oranında desteklenir |
| Penisilin-Streptomisin (10.000 U/mL) | % 1 oranında desteklenir |
| İnsülin Çözeltisi İnsan Rekombinant | 50 mL ortam için 12,5 μL |
| 2-Merkaptoetanol 50 mL (1000x) | 50 mL ortam için 17,5 μL |
Tablo 2: Farklılaşma ortamı (DM). Tabloda, farklılaşma ortamını hazırlamak için gereken reaktifler listelenmektedir.
Ek Video 1. bFGF tedavisi altında indüklenmiş hNEct 2D tabaka/koloni dönüşümünün 3D'ye canlı görüntülenmesi. İndüklenen hNEct kolonileri, yukarıda belirtildiği gibi dispase ile çanaktan yavaşça ayrıldı ve düşük ataşmanlı 6 kuyucuklu bir kültür plakasına aktarıldı. 2D hNEct kolonileri 12 saat içinde 3D hNEct sferoidlerine dönüştürüldü. Seri görüntüler her 5 dakikada bir yakalandı. Ölçek çubuğu = 100 μm. Bu videoyu indirmek için lütfen buraya tıklayın.
İlaç taraması ve hastalık modellemesinde hPSC türevi beyin organoidlerinin kullanılmasını sağlamak için, tekrarlanabilir ve güvenilir bir protokol15'i izleyerek organoidler yapmak çok önemlidir. Beyin organoidleri genellikle hPSC'lerden türetilen embriyoid cisimlerden üretilir ve daha sonra doku genişlemesini ve sinirsel farklılaşmayı destekleyen hücre dışı bir matrise gömülür. Lancaster'ın 1,16,17 ve Velasco18 gibi embriyoid cisimlerden başlayan ve gelişmekte olan organoidler tarafından varsayılan bir farklılaşma yolunun izlenmesine izin veren protokollerle karşılaştırıldığında, kortikal beyin organoid oluşumunun embriyoid cisimleri yerine insan NEct hücreleri ile başlamasının kortikal beyin organoid oluşumunun tutarlılığını artırdığını bulduk. Sonuç olarak, ilaç ve fenotipik tarama için gerekli ölçeklemeye de izin verir. İnsan NEct hücreleri sadece önemli miktarlara genişletilebildiği için değil, aynı zamanda kolayca kriyoprezerve edilebildiği için, bu yaklaşım deneyler arasında tekrarlanabilirliği de geliştirir. Ayrıca, Biyoreaktörlerin ve benzer teknolojilerin kullanımını benimseyen diğer protokollerle karşılaştırıldığında, bu protokol için özel bir ekipman gerekmediği ve bu da onu herhangi bir laboratuvar6 için uygun hale getirdiği belirtilmelidir. Son olarak, SATB2 gibi kortikal tabaka belirteçleri için pozitif olan olgun organoidler üretmek için gereken süre, hem Lancaster 1 hem de biyoreaktör protokolleri 6,19'a kıyasla azaltılmıştır ve bu da onu sağlık ve hastalıklarda insan kortikal gelişiminin gelişimsel yörüngesini incelemek için daha uygun hale getirmektedir 1,6,16.
Ayrıca, beyinde patogeneze katkıda bulunan yaşlanan hücre tiplerindeki artışla ilişkili olan demans gibi yaşlanmaya bağlı hastalıkların sürekli büyüyen küresel sağlık hizmetleri etkisi göz önüne alındığında, beyin yaşlanmasını iyileştirebilecek bileşikleri tanımlama ve test etme yeteneği büyük ilgi çekicidir. hPSC'lerin yeniden programlama süreci20 sırasında epigenetik olarak gençleştirildiği bilinmesine rağmen, uzun süre kültürlenen kortikal beyin organoidlerinde yaşlanan hücrelerde sağlam artışlar buluyoruz. Bu, şimdi bu tür yaşlanan hücreleri beyinden (senolitik bilimler) ortadan kaldıran veya bu süreci yavaşlatan (senostatikler) ilaçların taranmasını sağlayan umut verici bir gelişmedir.21. İnsan NEct kaynaklı kortikal beyin organoidleri insan kökenli olduğundan, bu yaklaşım muhtemelen bu tür yeni terapötikleri pazarlamanın geleneksel yolunu kısaltacaktır.
Bu protokolde iki kritik adım vardır. Birincisi, farklılaşma sırasında hPSC kolonilerinin doğru akıcılık seviyesidir. hPSC kolonileri, üretilen NEct kolonilerinin komşu kolonilerle kaynaşmamasını ve bireysel organoidlerin klonal olarak yönlendirilmesini sağlamak için en fazla% 30 oranında kaynaşmalıdır. İkinci kritik adım, NEct kolonilerini kaldırmak ve nöral sferoidleri üretmek için dispasın doğru kullanımını içerir. Dispase ile inkübasyonun zamanlaması, üretilen nöral sferoidlerin nihai kalitesi için kritik öneme sahiptir. Bunun nedeni, dispaslı kolonilerin aşırı maruz kalmasının hücreler için toksik olmasıdır22 ve sonunda üretilen organoidlerin kalitesini etkiler. Bu protokolün sınırlaması, nöral sferoidlerin boyutunu kontrol etmenin zor olmasıdır, çünkü dispase ile kaldırılan ilk kolonilerin büyüklüğüne bağlıdır. Bununla birlikte, bu sorun, gömme aşamasına geçerken benzer boyutta olan nöral sferoidler seçilerek aşılabilir.
Son olarak, gelecekteki uygulamalar, bu tekrarlanabilir kortikal organoidlerin robotik analizde ve tipik olarak bu endüstride kullanılan biyofarmasötik tarama yaklaşımlarında kullanılmasına kadar uzanabilir. Bu, laboratuvarımızdan elde edilen ve insan NEct hücrelerinden kortikal beyin organoidlerinin üretilmesinin kolayca otomatikleştirilebileceğini ve bu yaklaşımlarla uyumlu hale getirilebileceğini gösteren ön verilerle desteklenmektedir.
Yazarların açıklayacak hiçbir şeyleri yoktur.
Bu çalışma, Tıbbi Araştırma Gelecek Fonu Hızlandırılmış Araştırma, Lökodistrofi amiral gemisi Massimo'nun Misyonu (EPCD000034), Tıbbi Araştırma Gelecek Fonu-Kök Hücre Misyonu (APP2007653) tarafından desteklenmektedir. Yazarlar, Ek Video 1'de veri ürettiği için Dr. Ju-Hyun Lee'ye (Kore Üniversitesi) teşekkür eder.
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved