Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biochemistry
التجميع الذاتي لل Tactoids microtubule
تقدم هذه المقالة بروتوكولا لتشكيل تجمعات الأنابيب الدقيقة على شكل تاكتويد باستخدام MAP65 ، وهو رابط متقاطع للأنابيب الدقيقة نباتي ، و PEG كعامل ازدحام.
الهيكل الخلوي هو المسؤول عن التنظيم الداخلي الرئيسي وإعادة التنظيم داخل الخلية ، وكل ذلك بدون مدير لتوجيه التغييرات. هذا هو الحال بشكل خاص أثناء الانقسام أو الانقسام الاختزالي ، حيث تشكل الأنابيب الدقيقة المغزل أثناء انقسام الخلايا. المغزل هو الآلية المستخدمة لفصل المواد الوراثية أثناء انقسام الخلايا. نحو إنشاء مغزل ذاتي التنظيم في المختبر ، قمنا مؤخرا بتطوير تقنية لإعادة تشكيل الأنابيب الدقيقة في مجموعات تشبه المغزل مع الحد الأدنى من البروتينات المرتبطة بالأنابيب الدقيقة وعوامل الازدحام. على وجه التحديد ، تم استخدام MAP65 ، وهو رابط متقاطع مضاد للأنابيب الدقيقة من النباتات ، وهو تجانس Ase1 من الخميرة و PRC1 من الكائنات الحية الثدييات. يقوم هذا الوصلة المتقاطعة بتنظيم الأنابيب الدقيقة ذاتيا في مجموعات طويلة ورقيقة تشبه المغزل ذاتية التنظيم للأنابيب الدقيقة. تشبه هذه التجميعات أيضا اللباقات البلورية السائلة ، ويمكن استخدام الأنابيب الدقيقة كميزوجينات متوسطة الحجم. هنا ، يتم تقديم بروتوكولات لإنشاء هذه اللباقات microtubule ، وكذلك لتوصيف شكل التجميعات باستخدام الفحص المجهري الفلوري وحركة المكونات باستخدام استرداد التألق بعد التبييض الضوئي.
انقسام الخلايا عن طريق الانقسام هو واحد من أهم العمليات البيولوجية للحفاظ على الحياة. خيوط الأنابيب الدقيقة ، التي تتكون من ديمرات توبولين ، هي عناصر هيكلية أساسية لهذه العملية. تسمى الآلية العابرة التي تم إنشاؤها في مرحلة ما قبل الطور عندما تكون الكروموسومات محاذاة في مركز الخلية المغزل الانقسامي بسبب شكله ، والذي يشبه مغزل نول مغطى بخيوط (الشكل 1A). من الثابت عبر العديد من الكائنات الحية أن الأنابيب الدقيقة تستخدم في الطور الفوقي لدفع وسحب الكروموسومات المكثفة إلى وسط الخلية ، ومحاذاتها وربطها بالأنابيب الدقيقة التي ستسحبها بعيدا في الطور (الشكل 1B ، C). يتشكل المغزل في كل من الانقسام الاختزالي (الشكل 1B) والانقسام (الشكل 1C) ، الذي تم إنشاؤه من العديد من الأنابيب الدقيقة المتداخلة غير الملفوفة حول المحور المركزي مثل الخيط ولكنها تعمل بالتوازي مع الواجهة. يتطلب إنشاء هذه الهياكل القائمة على الأنابيب الدقيقة بروتينات مرتبطة ترتبط بالإنزيمات المرتبطة بها والإنزيمات المرتبطة بها والتي يمكن أن تعمل كمحركات للمساعدة في دفع وسحب الكروموسومات1.
أظهرت الدراسات التي أجريت على المغزل الوسيط أن الأنابيب الدقيقة قصيرة وديناميكية ومتداخلة في المصفوفات المتقاطعة2،3،4،5،6 (الشكل 1Di). نظرا للتنظيم الفيزيائي لهذه الأنابيب الدقيقة القصيرة ، فإن المغزل meiotic يشبه تاكتويد الكريستال السائل (الشكل 1E). في الواقع ، ثبت أن المغزل يتجمع ويندمج ، كما يتوقع المرء من اللباقة البلورية السائلة5.
استخدمت العديد من الدراسات التي يعود تاريخها إلى 1960s التثبيت ، والمقاطع التسلسلية ، والمجهر الإلكتروني لتحديد أن هناك نوعين من الأنابيب الدقيقة داخل المغزل الانقسامي7،8،9،10. النوع الأول يسمى الأنابيب الدقيقة kinetochore ، والتي تربط قطب المغزل ب kinetochore. النوع الثاني يسمى الأنابيب الدقيقة بين الأقطاب أو القطبية ، والتي تنمو بعد الكروموسومات وتتداخل في المنطقة الوسطى (الشكل 1Dii)8,9,10. وهناك نوع ثالث يسمى الأنابيب الدقيقة النجمية ، والتي تقع خارج المغزل وتربط القطبين بحافة الخلية. منظمات الأنابيب الدقيقة هذه خارج نطاق المناقشة الحالية. كانت هناك دراسات حديثة حول التفاعل بين الأوجمين6 ومجمع حلقة غاما توبولين الذي يؤثر على مراكز التنوي للأنابيب الدقيقة ، مما أدى إلى مغزل انقسامي مع أنابيب دقيقة أقصر كما هو الحال في الشكل 1D.
نظرا لأن الأنابيب الدقيقة أطول من عرضها ، مع نسبة عرض إلى ارتفاع عالية وصلابة عالية ، فهي تشبه الإصدارات الموسعة من جزيئات الكريستال السائل. في فيزياء المادة اللينة، تم تقريب الذرات والجزيئات باستخدام الحد الأدنى من التفاعلات لاستنتاج الآليات الفيزيائية لانتقالات الطور، بما في ذلك النوى وذوبان البلورات11. وبالمثل ، فإن الأنابيب الدقيقة هي أجسام متوسطة الحجم هي نسخ موسعة من جزيئات البلورات السائلة ، مما يعطي نظرة ثاقبة لفيزياء ديناميكيات البلورات السائلة ، بما في ذلك نواة ونمو المراحل الخيطية من تلك المتساوية الخواص. علاوة على ذلك ، كما نوقش أعلاه ، يعرض المغزل meiotic خصائص مثل خصائص tactoid البلورية السائلة ، وهي حالة نيماتية تنوي وتنمو من الحالة المتساوية لجزيئات الكريستال السائل 3,4,5. بالنسبة لل tactoids ، فإن النوى والنمو يشبهان نمو البلورات الأخرى (أي تتطلب تركيزا عاليا نسبيا من الميزوجينات [الجزيئات التي تشكل بلورات سائلة]). يأتي شكل "المغزل" الفريد من نوعه للتاكتويد من المحاذاة المحلية للميزوجينات البلورية السائلة التي تتماشى مع الطور الخيطي (الشكل 1E). لا يمكنهم تشكيل بلورة مستديرة لأن الجزيئات غير متماثلة للغاية. بالنظر إلى طبيعة الأنابيب الدقيقة ، ربما ليس من المستغرب أن تكون آلات المغزل الانقسامية المصنوعة من تركيز محلي عال من الأنابيب الدقيقة هي أيضا من نفس الشكل ، سواء كانت تسمى tactoid أو المغزل. يمكن أن تكون اللباقات ثنائية القطب ، مع أقطاب في النهايات المدببة (الشكل 1Ei) ، أو متجانسة ، مع أقطاب فعالة في اللانهاية (الشكل 1Eii).
نظرا لأهمية تكوين المغزل ، كانت الجهود جارية نحو تكوين المغزل المنظم ذاتيا في المختبر من خلال إظهار تكثيف الأنابيب الدقيقة في حزم عبر الأنواع الأيونية 12,13 ، وعوامل الازدحام التي تخلق تفاعلات النضوب 14,15 ، وبروتينات محددة متقاطعة للأنابيب الدقيقة13,16,17,18,19 ، 21. من المثير للدهشة أنه على الرغم من أن هذه العوامل تعمل جميعها على زيادة التركيز المحلي للأنابيب الدقيقة ، إلا أنها غالبا ما تؤدي إلى حزم طويلة من الأنابيب الدقيقة ولكن ليس اللباقات. قد يكون أحد الأسباب التي تجعل هذه الحزم طويلة هو أن الأنابيب الدقيقة التي تتكون منها طويلة أيضا. كما أفادت الأعمال الأخيرة التي استخدمت الأنابيب الدقيقة الأقصر عن حزم أطول غير مدببة في نهاية15؛ في هذه الحالة ، يتم الاحتفاظ بالحزم مع البروتينات الحركية التي تسبب امتداد الحزم ، وبالتالي تجعلها أطول. هناك حاجة إلى أنابيب دقيقة قصيرة مع وصلات متقاطعة غير قابلة للتمدد للتجميعات المدببة التي تشبه المغزل ، كما هو موضح هنا.
في الآونة الأخيرة ، قمنا بتطوير تقنية لتمكين إنشاء tactoids microtubule باستخدام crosslinker المضادة للتوازي ، MAP65 ، في وجود microtubules22 المستقرة النووية. يجب أن تكون الأنابيب الدقيقة قصيرة ، ولكن القليل من المنظمين المعروفين لطول الأنابيب الدقيقة يمكنهم الحد من الأنابيب الدقيقة ضد عدم الاستقرار الديناميكي أو التلدين من طرف إلى طرف. بدلا من ذلك ، تم استخدام GMPCPP لنواة واستقرار الخيوط بعد النمو. سمح هذا بإنشاء كثافة عالية من الأنابيب الدقيقة القصيرة التي يمكن أن تنظم نفسها في اللباقة. كانت هذه اللباقات متجانسة عند النظر إليها تحت الانكسار المزدوج. بالإضافة إلى الأنابيب الدقيقة القصيرة ، تم استخدام رابط متقاطع محدد مضاد للتوازي ، MAP65 ، لتشكيل tactoids (الشكل 2). MAP65 هو بروتين مرتبط بالأنابيب الدقيقة النباتية في عائلة PRC1 / Ase1 من الروابط المتقاطعة الانقسامية23. يوجد MAP65 كخافت ، مع تقارب قوي للارتباط بنفسه وكذلك الأنابيب الدقيقة24. على عكس المغزل الوسيط و tactoids التي لوحظت مع خيوط الأكتين25،26،27 ، والتي هي ثنائية القطب ولها خصائص تشبه السائل من البلورات السائلة ، وقد لوحظ أن tactoids microtubule تشبه الصلبة22,28.
هنا ، يتم تقديم بروتوكولات لإنشاء tactoids microtubule وتوصيف شكل التجمعات وحركة المكونات باستخدام التقنيات القائمة على التألق.
ملاحظة: ما لم ينص على خلاف ذلك، يمكن إجراء أجزاء من التجربة على مقعد المختبر أثناء ارتداء معدات الحماية المناسبة (القفازات).
1. سيلانات الانزلاق
ملاحظة: يجب أن تكون الأغطية مصفاة لاستخدامها مع طلاء فرشاة البوليمر المستخدمة في هذه التجارب. هذا هو علاج سيلانة مسعور يسمح للبوليمر المشترك كتلة مع كتلة مركزية مسعورة لربط وإنشاء فرشاة البوليمر. يجب تنفيذ الخطوات التالية في غطاء الدخان لمنع التعرض للأبخرة السامة أثناء ارتداء القفازات. ثنائي ميثيل ديكلورولسيلان شديد السمية ويجب التعامل معه بعناية فائقة.
- اشطف الأغطية باستخدام ddH 2 O و 70٪ إيثانول و ddH2O بالترتيب. جففها بمناديل مخبرية خالية من الوبر بين كل شطف. هذا يزيل الغبار والجسيمات القابلة للذوبان في الماء أو العضوية من السطح قبل المعالجة.
- ضع أغطية الغطاء في رف معدني مثبت بالغطاء وانقل الحامل إلى آلة الأوزون بالأشعة فوق البنفسجية (UVO). قم بتشعيع الأغطية باستخدام UVO لمدة 20 دقيقة لإزالة أي تألق خلفي. يمكن استخدام غرفة البلازما بدلا من UVO.
- باستخدام ملاقط ، انقل الأغطية من الرف المعدني المستخدم في معالجة الأشعة فوق البنفسجية إلى رف معدني مختلف يستخدم للصلابة. لا تستخدم نفس الرفوف لكليهما ، لأنها ستسبب مستويات عالية من الأكسدة عند تطبيق UVO. قم بتنظيف الرفوف مسبقا بالماء والإيثانول بحيث لا تبقى أي مواد كيميائية متبقية من الاستخدامات السابقة.
- اغمر الحامل مع الأغطية في وعاء به أسيتون 100٪ لمدة ساعة واحدة. شطف الحاوية 3x بماء الصنبور ثم 3x مع ddH2O لإزالة كل الأسيتون.
- اغمري الرف مع الأغطية في الإيثانول بنسبة 100٪ لمدة 10 دقائق. شطف الحاوية 3x بماء الصنبور ثم 3x مع ddH2O لإزالة كل الإيثانول.
- اغمر الرف مع الأغطية 3x في ddH2O لمدة 5 دقائق لكل منها.
- اغمر الحامل مع الأغطية في 0.1 M KOH (50 مل من 1 M KOH في 450 مل من ddH2O) لمدة 15 دقيقة. شطف الحاوية 3x بماء الصنبور ثم 3x مع ddH2O لإزالة كل KOH.
- اغمر الحامل بأغطية 3x في DDH2O لمدة 5 دقائق لكل منها.
- جفف الرف في الهواء باستخدام الأغطية طوال الليل في غطاء الدخان أو غطاء التدفق الرقائقي.
- بعد تجفيف الرف والأغطية بالكامل ، اغمرها لمدة 5 دقائق في 2٪ dimethyldichlorosilane (DDS) المأخوذة في حاوية مختلفة تستخدم خصيصا للسيلان. لا تدع أي شيء غير جاف يتلامس مع السيلان.
- اغمر الحامل والغطاء 2x في وعاء به إيثانول 100٪ لمدة 5 دقائق. شطف الحاوية 3x بماء الصنبور ثم 3x مع ddH2O.
- اغمر الرف وأغطية الأغطية 3x في ddH2O لمدة 5 دقائق لكل منهما.
- جفف الرف في الهواء باستخدام الأغطية طوال الليل في غطاء الدخان أو غطاء التدفق الرقائقي.
- بعد خطوة التجفيف النهائية هذه ، انقل الأغطية مرة أخرى إلى صناديق الغطاء باستخدام ملاقط. يمكن استخدام هذه الأغطية في الأشهر 1-2 القادمة. ستبدأ الأغطية القديمة في فقدان طلائها ويجب التخلص منها.
2. إعداد توبولين
ملاحظة: يأتي التوبولين الذي تم شراؤه كمسحوق مجفف بالتجميد إما غير مصنف أو ملصق بالفلوروفورات. يتم تخزين توبولين المجفف بالتجميد في ثلاجة -80 درجة مئوية. يستخدم الإجراء التالي لخلط التوبولين غير المسمى مع التوبولين المسمى بنسبة جيدة للتصور.
- أزل من الفريزر -80 درجة مئوية أليكوت واحد من التوبولين غير المسمى الذي يحتوي على 1 ملغ من مسحوق التوبولين المجفف بالتجميد واحتفظ به على الجليد. أضف 200 ميكرولتر من PEM-80 البارد إلى الأنبوب ليصل تركيز التوبولين إلى 5 ملغم / مل. احتفظ به على الجليد لمدة 10 دقائق لإذابة كل الليثوفيلات.
- أزل من الفريزر -80 درجة مئوية أليكوت واحد من التوبولين المسمى بالرودامين يحتوي على 20 ميكروغرام من مسحوق التوبولين المجفف بالتجميد واحتفظ به على الجليد. أضف 4 ميكرولتر من PEM-80 البارد إلى الأنبوب ليصل تركيز التوبولين إلى 5 ملغم / مل. احتفظ به على الجليد لمدة 10 دقائق لإذابة المحبة لليفيلات بالكامل.
- بمجرد إذابته ، أضف 100 ميكرولتر من محلول التوبولين المعاد تعليقه غير المسمى إلى محلول 4 ميكرولتر من التوبولين المسمى بالرودامين. ماصة 6x-7x ببطء شديد للخلط. إذا كانت الركام مرئية ، فقم بالطرد المركزي للتوبولين المذاب لمدة 10 دقائق عند 90000 × g لإزالة الركام عن طريق التخلص من الكريات والاحتفاظ بالمادة الفائقة. سيؤدي مزيج التوبولين هذا إلى ~ 4٪ من التوبولين المسمى بالتوبولين.
- قم بتجميد 100 ميكرولتر المتبقية من التوبولين غير المسمى إلى نيتروجين سائل (LN2) وتخزينها عند -80 درجة مئوية لاستخدامها في خلطات توبولين إضافية.
- خذ مزيج التوبولين المسمى و aliquot في سبعة أنابيب مع 15 ميكرولتر لكل منهما. يمكن استخدام كل أليكوت لغرفة تجريبية واحدة. قم بتجميد الأليكوتات المتبقية وتخزينها عند -80 درجة مئوية للتجارب المستقبلية.
3. MAP65 تنقية
ملاحظة: MAP65 غير متوفر تجاريا ، وبالتالي ، يحتاج إلى تنقية لهذا العمل. وقد تم وضع البروتوكول سابقا في العديد من المنشورات23،29.
- قم بتحويل بلازميد MAP65 وبلازميد GFP-MAP65 إلى سلالة بكتيريا BL21 للتعبير عن البروتين.
- تنمو بكتيريا BL21 إلى كثافة بصرية من 0.6-1 عند 600 نانومتر. تحفيز إنتاج البروتين باستخدام مشغل lac وتنمو البكتيريا بين عشية وضحاها.
- بيليه الثقافات وتحلل البكتيريا.
- جمع الليزات بعد الطرد المركزي واحتضانها مع الخرز الذي يحتوي على أيون النيكل المتاحة لربط علامة 6x-histidine.
- قم بالتخلص من البروتين باستخدام إيميدازول وقم بتحلية الملح.
- إسقاط تجميد البروتين مع النيتروجين السائل وتخزينه في -80 درجة مئوية للاستخدام في غضون 1 سنة.
4. تجميع غرف التدفق
ملاحظة: يتم إجراء التجارب في غرف تدفق مصنوعة من شريحة زجاجية وزجاج غطاء سيلان (الشكل 3).
- خذ شريحة زجاجية وقم بتنظيفها باستخدام ddH2 O والإيثانول و ddH2O بالترتيب. يجف بمنديل مخبري خال من الوبر بين كل شطف.
- استخدم قطعة من الشريط على الوجهين لإنشاء مسار تدفق. باستخدام أيدي القفازات ، قم بقص الشريط إلى ~ 25-30 مم في الطول. قم بتقسيم الشريط بالطول لإنشاء شريطين أرق. ضع شريطي الشريط على الشريحة مع حوالي 5-8 مم بينهما.
ملاحظة: نظرا لأن سمك الشريط موحد إلى حوالي 80-100 ميكرومتر ، فإن عرض المسار بين قطع الشريط سيحدد الحجم في الغرفة. - ضع الأغطية المائلة أعلى مسار التدفق. أغلق الشريحة وانزلق الغطاء إلى شرائط الشريط على الوجهين عن طريق الضغط برفق على منطقة الشريط بظهر قلم. تأكد من الحصول على ختم جيد على المنطقة بأكملها ؛ يجب أن يتحول الشريط من شفاف إلى واضح عندما يكون الختم مصنوعا جيدا.
- قم بإزالة الشريط الإضافي على الحواف ، مع ترك 1 مم فقط من مدخل غرفة التدفق عن طريق قطع الشريط بشفرة حلاقة.
- قم بتسمية الغرفة بمعلومات حول المعلمات التجريبية ، حسب الحاجة.
5. تجارب اللباقة
ملاحظة: بمجرد إنشاء جميع الكواشف والإمدادات ، يمكن استخدامها لنواة وبلمرة تاكتويد الأنابيب الدقيقة في غرفة التدفق.
- جمع جميع الكواشف لاستخدامها. قم بإذابتها على الجليد وتخزينها على الجليد أثناء العمل. اصنع عدة غرف تدفق للتجارب.
- استخدم غرفة تدفق واحدة لكل تجربة. قم بتغطية أسطح غرفة التدفق بفرشاة بوليمر عن طريق التدفق في 20 ميكرولتر من 5٪ من الفاعل بالسطح غير الأيوني للبوليمر المشترك (جدول المواد) المذاب في PEM-80 ، مع قطرات صغيرة في طرفي الغرفة لمنع تكوين فقاعات الهواء في الداخل. احتفظ به في غرفة رطبة (أي طبق بتري مع منديل مخبري مبلل خال من الوبر) حتى يصبح جاهزا للاستخدام (5-7 دقائق على الأقل).
- في أنبوب معقم ، امزج ما يلي لإنشاء مزيج Tubulin-MAP: 9.5 ميكرولتر من PEM-80 ؛ 4 ميكرولتر من 10 mM GMPCPP ؛ 4 ميكرولتر من 5 ٪ Pluronic-F127 ؛ 1 ميكرولتر من 1M DTT ؛ 1 ميكرولتر من الجلوكوز. 2 ميكرولتر من البولي إيثيلين جلايكول (PEG) ؛ 12 ميكرولتر من مزيج توبولين 5 ملغم / مل (التركيز النهائي 13.6 ميكرومتر) من الخطوة 2.5 ؛ و 5.5 ميكرولتر من مخزون العمل من MAP65 حيث 10٪ هو GFP-MAP65 للتصور. حافظ على الثلج أثناء الخلط.
ملاحظة: يوصى باستخدام ماصة إزاحة إيجابية للتعامل مع محلول PEG اللزج. يمكن استخدام الماصات العادية بعد قطع الطرف لجعل الفتحة أكبر ؛ ومع ذلك ، فإن هذه الطريقة أقل دقة. - امزج 5x-6x عن طريق السحب.
- قبل الإضافة إلى الغرفة مباشرة ، أضف 1 ميكرولتر من محلول مخلوط مسبقا من أوكسيديز الجلوكوز (0.5 مجم / مل) والكاتالاز (0.15 مجم / مل) (Deoxy) إلى مزيج Tubulin-MAP وامزج 7x-8x. قسم الحجم الكلي للمحلول (40 ميكرولتر) إلى قسمين لاستخدامهما في غرف منفصلة.
- تدفق مزيج Tubulin-MAP إلى غرف. نظرا لأن الغرف تحتوي بالفعل على خافض للتوتر السطحي غير الأيوني من البوليمر المشترك فيها ، فلا يمكن إضافة المزيد من السائل دون إزالة السائل القديم. للقيام بذلك ، استخدم قطعة من ورق الترشيح أو مسحة مخبرية خالية من الوبر في الطرف الآخر من الغرفة لإزالة السائل عن طريق العمل الشعري.
- بمجرد أن تكون العينة داخل الغرفة بالكامل ، قم بإغلاق طرفي الغرفة باستخدام الإيبوكسي لمدة 5 دقائق واحتفظ بها عند 37 درجة مئوية لمدة 30 دقيقة تقريبا لنواة ونمو تاكتويد الأنابيب الدقيقة.
6. المجهر الفلوري
- استخدم مجهر التألق لتصوير اللباقات.
ملاحظة: يعد إجمالي المجهر الفلوري للانعكاس الداخلي أو المجهر البؤري للقرص الدوار جيدا لإزالة التألق في الخلفية من التوبولين الحر ، ولكن اللباقة مرئية أيضا عن طريق التألق الفائق المنتظم وحتى المجهر الضوئي المنقول بمجرد تشكيلها ، مما يجعل هذا الإجراء متاحا بدون معدات متخصصة. - استخدم هدف فتحة العددية (NA) البالغ 1.2 NA أو أعلى مع تكبير 60x أو أعلى لجمع ما يكفي من الضوء في التألق. غالبا ما تتطلب هذه الأهداف الانغماس في ddH2O أو الزيت.
- تسجيل الصور باستخدام كاميرا CMOS أو CCD. استخدم حجم بكسل فعال على الكاميرا يبلغ 108 نانومتر.
ملاحظة: يعتمد حجم البكسل على الكاميرا والتكبير المستخدم، والذي كان في هذه الحالة 60x أو 100x مع فتحة عدسة رقمية عالية (1.2 أو 1.49 NA). يمكن استخدام موسعات صور إضافية قبل الكاميرا لتحقيق حجم البكسل المطلوب. - احتفظ بالعينة عند 37 درجة مئوية باستخدام غرفة بيئية مضبوطة على درجة الحرارة هذه. بدلا من ذلك ، استخدم سخانات المرحلة الأخرى بما في ذلك سخانات مرحلة الهواء الساخن والياقات الموضوعية التي يتم التحكم في درجة حرارتها مع الماء الدافئ المتداول.
- استخدم مصادر الإثارة الصحيحة للتألق المطلوب. بالنسبة لتوبولين الرودامين ، استخدم ليزر 561 نانومتر مع ما لا يقل عن 1 ميجاوات من الطاقة في العينة ، وبالنسبة ل GFP-MAP65 ، استخدم ليزر 488 نانومتر مع ما لا يقل عن 1 ميجاوات من الطاقة في العينة.
ملاحظة: في حالة استخدام الفحص المجهري الفائق التألق واسع المجال ، استخدم مكعب مرشح رودامين مع الإثارة: 540 ± 12.5 نانومتر ، ثنائي الكروم: 545 نانومتر ± 12.5 نانومتر قطع ، وانبعاثات: 575 نانومتر تمريرة طويلة ، ومكعب مرشح GFP مع الإثارة: 480 ± 15 نانومتر ، ثنائي الكروم: 505 نانومتر ± 15 نانومتر قطع ، وانبعاثات: 515 نانومتر تمريرة طويلة. - التقط ما لا يقل عن 10 صور لمناطق مختلفة لتصوير أكثر من 100 تاكتويد. التقط صورا في كل من القناتين الحمراء والخضراء واحفظها كصور 16 بت لتحليلها. تأكد من أن قوة الإضاءة وأوقات التعرض للضوء بحيث لا يكون مقياس كثافة الكاميرا مشبعا.
7. استعادة التألق بعد التبييض الضوئي (FRAP)
ملاحظة: لدراسة حركة المكونات الداخلية لل tactoids ، تم استخدام FRAP. يعمل FRAP عن طريق التبييض الضوئي لجزء محدد من التوبولين المسمى بالرودامين و MAP65 tactoid المسمى GFP ثم مراقبة استعادة التألق مع مرور الوقت في تلك المنطقة. يعتمد معدل الاسترداد على دوران الأنواع التي يتم تبييضها ضوئيا. يمكن أن يعتمد معدل الدوران هذا على الانتشار وردود الفعل الملزمة. بالنسبة ل MAP65 المرتبط ب tactoids ، يمكن تقدير أسعار الصرف الملزمة. يتم تنفيذ FRAP باستخدام نظام ليزر إضافي 405 نانومتر يمكنه مسح الليزر بأي شكل. هناك العديد من الاحتمالات لأداء FRAP ، بما في ذلك استخدام المصباح المرسل والفتحة لتصوير منطقة محلية14.
- حدد تاكتويد معزول في الغرفة لإنشاء منطقة اهتمام (ROI) تغطي أجزاء من اللباقة والمحلول المحيط بها.
- استخدم المجهر مع ليزر إضافي 405 نانومتر ل FRAP لتبييض كل من tubulin و MAP65 في وقت واحد. بدلا من ذلك ، يمكن استخدام مصباح ساطع من خلال المحطة الميدانية للقزحية14. اضبط الكثافة المحددة لأنظمة التبييض الضوئي تجريبيا لتجنب إتلاف البروتينات أثناء التبييض.
- سجل التاكتويد كفيلم سلسلة زمنية لمدة 30-60 ثانية قبل التبييض الضوئي للحصول على معلومات حول الكثافة قبل التبييض. سجل كل من القنوات الحمراء والخضراء.
- Photobleach التاكتويدي عن طريق تعريض عائد الاستثمار إما إما بالليزر أو المصباح طالما كان ذلك ضروريا للتبييض الضوئي دون الإضرار ب tactoid. تحديد الكثافة والوقت تجريبيا.
- استمر في تسجيل الفيلم في كلتا القناتين الملونتين لمدة 5-10 دقائق بعد التبييض الضوئي أو حتى يبدو أن الاسترداد قد وصل إلى التوازن.
- افحص قناة GFP-MAP65 بصريا للاسترداد.
8. تحليل البيانات
ملاحظة: تم إجراء تحليل كمي لصور اللباقات للتعرف على آثار التغيرات البيئية المفروضة عبر عوامل الازدحام المختلفة والظروف الأيونية وإضافة عوامل أخرى.
- توصيف شكل تاكتويد
- حدد طول وعرض اللباقات من الصور الحمراء والخضراء التي تم التقاطها باستخدام المجهر البؤري.
- افتح الصور باستخدام FIJI/ImageJ.
- إذا تم أخذ البيانات الخام في 16 بت، فاضبط السطوع والتباين إذا لزم الأمر. حدد Image > ضبط > السطوع والتباين لضبط الصورة لتتمكن من رؤية اللباقة بوضوح. اضبط السطوع والتباين دون تطبيق الإعداد حتى لا تغير بيانات الكثافة عن طريق الخطأ.
- بمجرد أن تكون اللباقات مرئية بوضوح ، حدد اللباقات الجيدة لقياسها (الشكل 4Bi). تأكد من أن اللباقات مرئية بوضوح دون أي تداخل مع أي تاكتويد أو مجاميع أخرى وليست منحنية أو منحنية لتكون قادرة على استخدام أدوات قياس الخط المستقيم.
- بعد ذلك ، تحقق من تعيين حجم البكسل الصحيح للصور. تأتي صور المجهر مع بيانات وصفية حول حجم البكسل. عند استخدام كاميرا مختلفة لا تحتوي على بيانات وصفية أو أنظمة توسيع صور خارجية يمكنها تغيير حجم البكسل الفعال المتوقع، اضبط حجم البكسل يدويا. في FIJI/ImageJ، انتقل إلى مقياس تحليل > لتعيين تحويل البكسل الصحيح.
- باستخدام أداة الخط المستقيم من شريط الأدوات في FIJI/ImageJ، انقر على أحد طرفي التاكتويد واسحب المؤشر إلى الطرف الآخر من التاكتويد (الشكل 4Bi). بمجرد تحديد عائد استثمار الخط، حدد تحليل > قياس لقياس الطول. إذا لم يتم قياس الطول بشكل افتراضي، فتأكد من تعيين القياس لتضمين الطول في شاشة تحليل > تعيين القياسات .
ملاحظة: عادة ، عند القياس باستخدام أداة الخط المستقيم ، سيعطي طول وزاوية الخط المرسوم. على سبيل المثال، يوضح الشكل 4Bii خطا مستقيما مرسوما إلى جانب اللباقة لجعل الأخير مرئيا ولكن جعل القياس مباشرة على اللباقة. - بعد إجراء القياس، استخدم أداة النص في شريط الأدوات لتسمية tactoid. قم بإنشاء مربع نص، وأضف تسمية رقم، وحدد تحرير > رسم لإصلاح التسمية في الصورة. احفظ الصورة كملف عائد استثمار منفصل.
ملاحظة: يسمح وضع العلامات على هذا الملف وحفظه للمحقق بمعرفة القياس الذي يتوافق مع أي تاكتويد من البيانات الأولية. تأكد من قياس كل تاكتويد مرة واحدة. - بعد قياس tactoids للصورة بأكملها، احفظ البيانات في نافذة النتائج في ملف نصي محدد بفواصل أو علامة تبويب (باستخدام ملف > حفظ باسم) وافتح البيانات في برنامج جدول بيانات لتحليل البيانات إلى أرقام. اجمع جميع البيانات معا (بيانات الصورة الخام وصورة عائد الاستثمار وملف النتائج النصي) في مجلد مع اصطلاح تسمية مناسب للحفاظ على تنظيم كل شيء.
ملاحظة: على الرغم من أن قياسات الطول اللاكتويد يتم إجراؤها يدويا، نظرا لأن عروض التاكتود ضيقة، فمن الأفضل استخدام طريقة مختلفة لقياس عرض التاكتود (انظر أدناه) لتقليل خطأ القياس. - باستخدام ImageJ/FIJI، ارسم منطقة خط باستخدام أداة الخط المستقيم . ارسم الخط كقطاع ثنائي عمودي على المحور الطويل اللثوي (الشكل 4Bii).
- حدد تحليل > ملف تعريف المؤامرة لإنشاء ملف تعريف كثافة القطاع الثنائي الخطي (الشكل 4Biii). ستظهر مؤامرة. لاسترداد البيانات وحفظها من المؤامرة ، حدد زر القائمة في أسفل اليسار ؛ يؤدي ذلك إلى إنشاء قائمة ملفات نصية لبيانات الكثافة على طول الخط المرسوم. احفظ الملف النصي كملف .csv أو .txt.
- افتح الملف النصي في برنامج مناسب مثل MatLab أو Python (sciPy) أو برامج أخرى. تناسب بيانات الكثافة مع دالة غاوسية للنموذج:
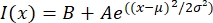 ، حيث I(x) هي قيمة التدرج الرمادي على طول الطول ، x ؛ B هو مستوى الخلفية. A هو سعة الغاوسية. μ هو الوسط أو المركز الغاوسي. σ هو الانحراف المعياري للغاوسي.
، حيث I(x) هي قيمة التدرج الرمادي على طول الطول ، x ؛ B هو مستوى الخلفية. A هو سعة الغاوسية. μ هو الوسط أو المركز الغاوسي. σ هو الانحراف المعياري للغاوسي. - التقرير 2σ كعرض tactoid. تقدير شدة الأنابيب الدقيقة في التاكتويد عن طريق حساب المساحة تحت Gaussian (وليس بما في ذلك الخلفية).
ملاحظة: إذا كانت الصور ضمن نطاق الكثافة الخطية للكاميرا وتم التقاطها بنفس وقت التعرض وشدة الإثارة، فيمكن مقارنة الكثافات المتكاملة لتقدير العدد النسبي للأنابيب الدقيقة في اللباقة.
- تحليل FRAP
ملاحظة: استخدمت التجارب لاختبار حركة الأنابيب الدقيقة و MAP65 FRAP لتسجيل التبييض الضوئي المحدد واستعادة الكثافة بسبب الحركة الجزيئية (الشكل 5A). تم تحديد البيانات كميا من بيانات السلاسل الزمنية للصور باستخدام ImageJ/FIJI.- استخدم ImageJ/FIJI لفتح بيانات الفيلم.
- قم بتسجيل المكدسات (بيانات السلاسل الزمنية) بمرور الوقت لإزالة الانجراف. استخدم المكون الإضافي StackReg مع المكون الإضافي TurboReg الإضافي ؛ للحصول على إرشادات حول استخدام المكونات الإضافية، راجع روابط الويب الواردة في جدول المواد. حدد الترجمة لتغيير موضع الإطارات وبالتالي تسجيل الصور.
- بمجرد تسجيل الصور لإزالة الانجراف، قم بتدوير الصورة بحيث يكون اللباقة إما رأسيا أو أفقيا في الإطار عن طريق تحديد صورة > تحويل > تدوير. حدد الزاوية المراد تدويرها واستخدم المعاينة لتحديد ما إذا كان التاكتويد قد تم تدويره بما فيه الكفاية. عندما تظهر المعاينة أن التاكتويد إما رأسي أو أفقي، حدد موافق لتدوير كل الصور في الفيلم.
- استخدم أداة تحديد المستطيل في شريط الأدوات لإنشاء مقطع مستطيل فوق المنطقة المبيضة ضوئيا من اللباقة. سجل الكثافة المدمجة لمنطقة عائد الاستثمار لكل إطار باستخدام مكدسات الصور > > Measure Stack. اضبط نوع القياس على الكثافة المتكاملة باستخدام تحليل > تعيين القياسات. احفظ بيانات الكثافة التي تم تحليلها والمعروضة في نافذة النتائج كملف نصي بتنسيق .csv أو .txt عن طريق تحديد ملف > حفظ باسم.
ملاحظة: يوضح الشكل 5B مثالا على بيانات كثافة 16 بت الخام المقاسة لقنوات الأنابيب الدقيقة وقنوات GFP-MAP65 في منطقة التبييض. - نظرا لأن الكثافة الإجمالية للصور ستتلاشى بمرور الوقت على مستوى العالم بسبب التبييض الضوئي الناجم عن التصوير ، يجب تصحيح هذا التبييض الضوئي العالمي. للقيام بذلك، استخدم نفس حجم عائد الاستثمار (الخطوة 8.2.4)، وانقله إلى منطقة في خلفية الصورة حيث لا توجد أنابيب دقيقة أو MAP65 مرئية. قم بقياس الكثافة المتكاملة للمكدس كما هو موضح في الخطوة 8.2.4. احفظ النتائج كملف نصي ثان.
ملاحظة: يوضح الشكل 5B مثالا على بيانات كثافة 16 بت الخام المقاسة لقنوات الأنابيب الدقيقة وقنوات GFP-MAP65 في منطقة الخلفية. - لتصحيح تلاشي الخلفية، قسم شدة الإشارة على التاكتويد على شدة الخلفية لنفس النقطة الزمنية. احسب أننيقمت بتصحيح (t) على النحو التالي:
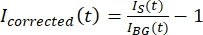 ، حيث I S (t) (الإشارة) هو القياس الذي تم إجراؤه على المنطقة المبيضة و IBG (t) (الضوضاء) هو القياس الذي تم إجراؤه على منطقة الخلفية (الشكل 5C). هذا يحسب نسبة الإشارة إلى الضوضاء لكل إطار ويطرح الضوضاء أيضا.
، حيث I S (t) (الإشارة) هو القياس الذي تم إجراؤه على المنطقة المبيضة و IBG (t) (الضوضاء) هو القياس الذي تم إجراؤه على منطقة الخلفية (الشكل 5C). هذا يحسب نسبة الإشارة إلى الضوضاء لكل إطار ويطرح الضوضاء أيضا. - بعد ذلك ، أعد قياس البيانات لتتراوح بين صفر وواحد باستخدام
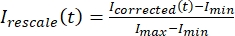 ، حيث يشير I min و Imax ، على التوالي ، إلى الحد الأدنى العالمي والحد الأقصى للبيانات التي قمت بتصحيحها طوال الوقت (الشكل 5C).
، حيث يشير I min و Imax ، على التوالي ، إلى الحد الأدنى العالمي والحد الأقصى للبيانات التي قمت بتصحيحها طوال الوقت (الشكل 5C). - قم بملاءمة هذه البيانات مع أس متحللة للنموذج:
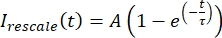 ، حيث A هو سعة الاسترداد و τ هو الجدول الزمني للاسترداد (الشكل 5C).
، حيث A هو سعة الاسترداد و τ هو الجدول الزمني للاسترداد (الشكل 5C).
مع وجود عدد قليل فقط من المكونات ، و tubulin dimers ، و microtubule crosslinkers ، يمكن أن تتشكل tactoids microtubule (الشكل 2A). على الرغم من أن هذا البروتوكول يصف الحضانة للنوى وتنمو الأنابيب الدقيقة في الحاضنة ، إلا أنه يمكن ملاحظة النوى والنمو مباشرة تحت المجهر (والتي تكتمل في غضون 30 دقيقة) (الشكل 2B). يتم الاحتفاظ بتركيز التوبولين ثابتا عند 13.6 ميكرومتر وربط MAP65-MT عند 10٪.
ويمثل الشكل 4 بيانات ناجحة. يجب أن تكون اللباقات مرئية مع كل من ليزر 561 نانومتر في قناة توبولين و 488 نانومتر في قناة MAP65 ، والتي تتداخل تماما مع بعضها البعض (الشكل 4A). كان أحد ألغاز النظام هو أن عرض اللباقات لا يبدو أنه يختلف في ظل مجموعة متنوعة من التغييرات التجريبية ، بما في ذلك تغيير أطوال الأنابيب الدقيقة ، وتركيز MAP65 ، وعوامل الازدحام (الشكل 4B) 22,28. الطول أكثر تغيرا بكثير ويعتمد على كل من أطوال الأنابيب الدقيقة وتركيز MAP65 (الشكل 4B)22,28.
عند إجراء FRAP ، لوحظ أن إشارة MAP65 تتعافى ، لكن إشارة microtubule لا تتعافى (الشكل 5). يرجع الانتعاش في FRAP إلى حركة وحركة الكائنات الموسومة والمبيضة ضوئيا. في حالة MAP65 ، تنفصل الجزيئات المظلمة وتبتعد عن الأنابيب الدقيقة وتنتقل جزيئات جديدة إلى المنطقة (الشكل 5). يكون ربط MAP65 في حالة توازن ، وبالتالي فإن معدل الربط وغير الارتباط متساو (يقاس بالجزيئات في الثانية). بالنسبة للأنابيب الدقيقة ، لم يلاحظ أي استرداد مما يعني أن الأنابيب الدقيقة غير قادرة على مغادرة التاكتويد (الشكل 5A ، Bi ، C). علاوة على ذلك ، لم يلاحظ أي انتشار للمنطقة المظلمة ، مما يشير إلى أن الأنابيب الدقيقة غير متحركة محليا وليست سائلا داخل الشكل اللمسي.
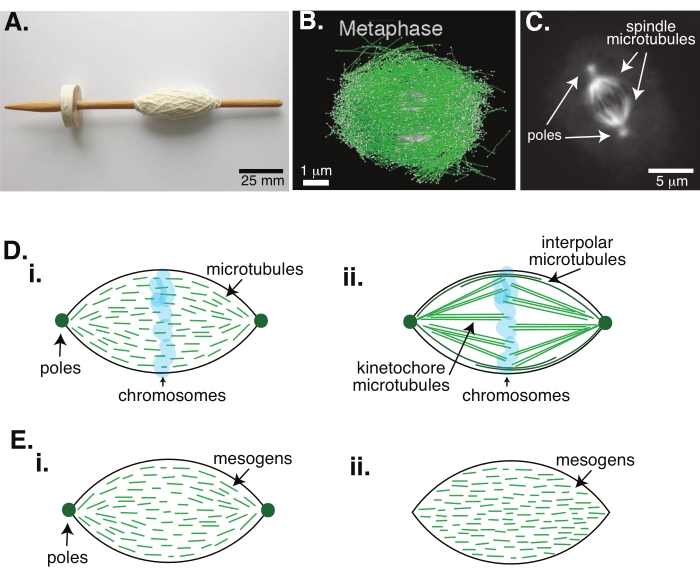
الشكل 1: نماذج مختلفة من تشكيل المغزل. المغزل الانقسامي هو آلة مصنوعة من الأنابيب الدقيقة والبروتينات والإنزيمات المرتبطة بها التي تحاذي وتفصل الكروموسومات إلى خليتين ابنتين جديدتين أثناء انقسام الخلايا. (أ) صورة لنسخة طبق الأصل من مغزل الإسقاط في أوائل العصور الوسطى مع خيوط دقيقة من هولندا. تم تعديل هذا الرقم من صورة ويكيميديا بواسطة بيتر فان دير سلويجس30. (ب) إعادة البناء ثلاثي الأبعاد للأنابيب الدقيقة في مراحل مختلفة من الانقسام الاختزالي البري الثاني. تظهر الأنابيب الدقيقة باللون الأخضر ، وتظهر الكروموسومات باللون الرمادي. شريط المقياس = 1 ميكرومتر. وقد عدل هذا الرقم من Lantzsch et al.31. (ج) صورة مجهرية للأنابيب الدقيقة في مغزل انقسامي لخلية Sf9 المنقسمة. يتم تصنيف أقطاب المغزل والأنابيب الدقيقة للمغزل ببروتين فلورسنت أخضر. شريط المقياس = 5 ميكرومتر. وقد عدل هذا الرقم من Advani et al.32. (د) نماذج مختلفة لكيفية تنظيم الأنابيب الدقيقة المغزل الانقسامية والانقسامية. (ط) لوحظ سابقا بالنسبة للمغزل الوسيط المصنوع من مستخلصات بيض زينوبوس، أن الأنابيب الدقيقة (الخضراء) كانت قصيرة وديناميكية في جميع أنحاء المغزل. هذا مشابه لتنظيم تاكتويد ثنائي القطب داخل بلورة سائلة. (ii) يحتوي النموذج القانوني لتنظيم الأنابيب الدقيقة داخل المغزل الانقسامي على نوعين من الأنابيب الدقيقة: الأنابيب الدقيقة بين الأقطاب أو القطبية (الأخضر الداكن) التي تتقاطع في المنطقة الوسطى حول الكروموسومات والأنابيب الدقيقة الحركية (الأخضر الفاتح) التي يتم تجميعها وتمتد من القطب إلى الكينيتوخور لدفع وسحب الكروموسومات. في جميع الصور ، تظهر الكروموسومات باللون الأزرق الشفاف ، ويتم تمثيل أقطاب المغزل باللون الأخضر الداكن. (ه) مخططات الميزوجينات (الخطوط الخضراء) في تاكتويد بلورة سائلة ل (i) ثنائي القطب و (ii) tactoids متجانسة. تحتوي اللباقات ثنائية القطب على قطبين في نهاية اللباقة ، وتعيد الميزوجينات توجيهها للإشارة إلى هذين القطبين. تحتوي اللباقات المتجانسة على أقطاب عند ما لا نهاية ، ولا تغير الميزوجينات اتجاهها على طول اللباقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
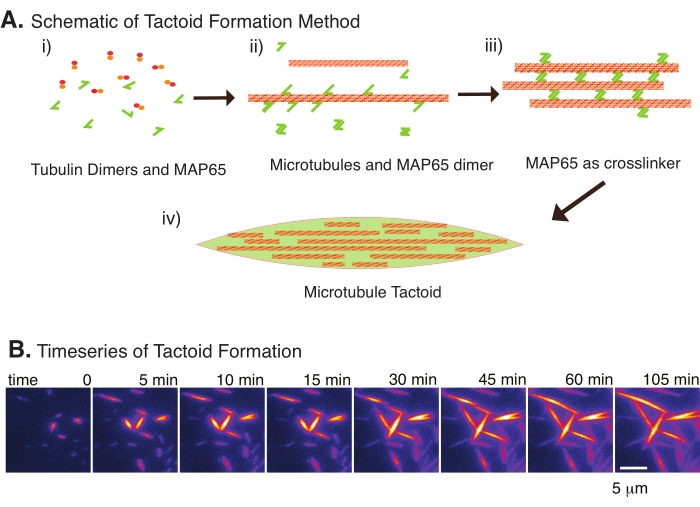
الشكل 2: تكثيف الأنابيب الدقيقة . (أ) يمكن تجميع الأنابيب الدقيقة وترابطها بمجموعة متنوعة من الطرق بما في ذلك الأنواع الأيونية ، وقوى النضوب الناجمة عن عوامل الازدحام ، والروابط المتقاطعة المحددة للأنابيب الدقيقة ، مثل MAP65. (ط) يتم خلط بروتينات توبولين دايمرات وبروتينات MAP65 لنواة وزراعة الأنابيب الدقيقة. (ii) تنوي الأنابيب الدقيقة وتنمو من التوبولين ، ويرتبط MAP65 على الفور بالأنابيب الدقيقة ، أو مونومر MAP65 آخر ، أو كليهما ويسبب التجميع. (iii) الأنابيب الدقيقة في الحزم المتقاطعة نواة وتنمو. (iv) التكوين النهائي هو tactoid microtubule مماثلة للمغزل. (ب) السلاسل الزمنية لكتل الأنابيب الدقيقة التي تنوي وتنمو أكثر من 105 دقائق. شريط المقياس = 5 ميكرومتر. () الشكل مقتبس من Edozie et al.22. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
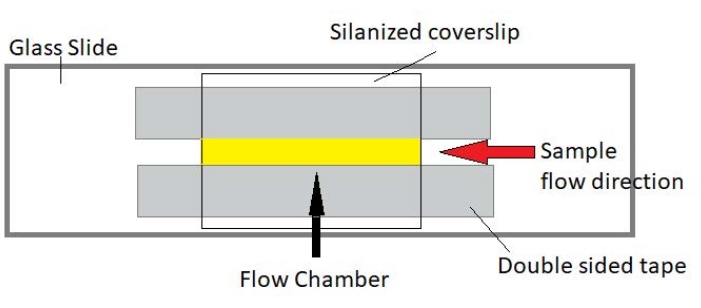
الشكل 3: تجميع غرفة التدفق. تصنع غرفة التدفق باستخدام شريحة زجاجية وزجاج غطاء مائل وشريط دائم على الوجهين. المنطقة الصفراء المميزة هي مسار التدفق حيث يتم تدفق العينة ومراقبتها. حجم غرفة التدفق هو ~ 20 ميكرولتر. تم استخدام الإيبوكسي لإغلاق نهايات الغرفة لمنع العينة من التبخر أثناء التصوير على المدى الطويل على مدى عدة ساعات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
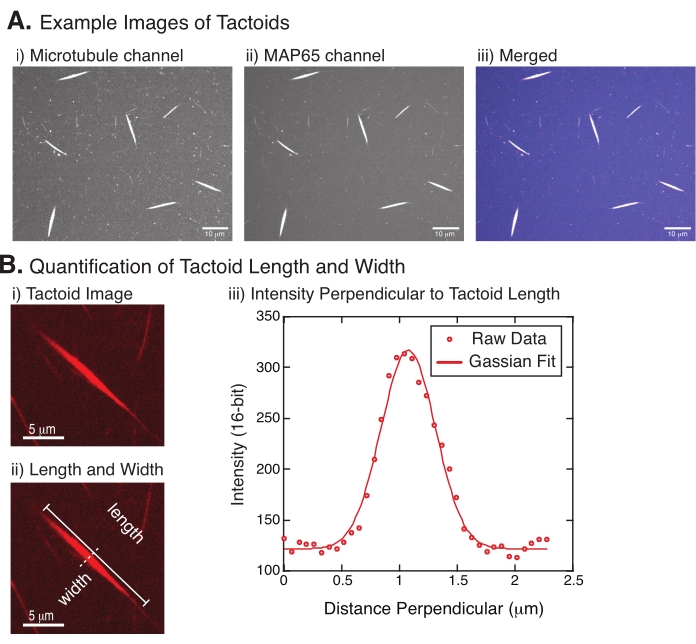
الشكل 4: الصور اللصيقة وتحليل الطول والعرض. (أ) مثال على بيانات اللكتل التي تشكلت على النحو الموصوف والمصور باستخدام قرص دوار متحد البؤرة يظهر (i) قناة microtubule تصوير التوبولين المسمى بالرودامين باستخدام ليزر 561 نانومتر ، (ii) قناة GFP-MAP65 التي تصور GFP باستخدام ليزر 488 نانومتر ، و (iii) صورة تراكب مدمجة من قناة microtubule (أرجواني) وقناة GFP-MAP65 (سماوية). يتم عرض مناطق التداخل باللون الأبيض وتوضح أن الأنابيب الدقيقة و MAP65 تتداخل بالضبط. شريط المقياس = 10 ميكرومتر لجميع الصور في (A). (ب) التحديد الكمي لطول وعرض التاكتويد. (ط) صورة لأداة تاكتويد ليتم تحليلها بدون تسميات. شريط المقياس = 5 ميكرومتر (ii) نفس الصورة كما في (i) ، حيث يتم الإشارة إلى قياسات الطول (الخط الصلب مع أغطية الخط) والعرض (الخط المتقطع). شريط المقياس = 5 ميكرومتر (iii) تم قياس العرض عن طريق أخذ ملف تعريف الشدة عبر التاكتويد عند القطاع الثنائي العمودي (الخط المتقطع) المشار إليه في (ii). كان ملف تعريف الكثافة مناسبا لدالة غاوسية للكشف عن سعة وعرض اللباقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
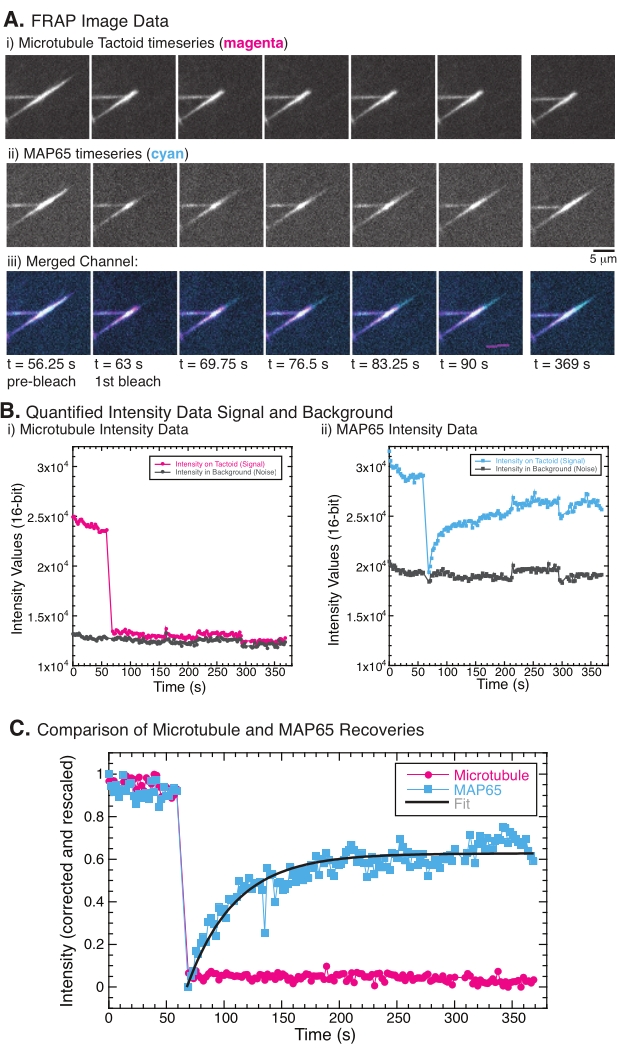
الشكل 5: بيانات وتحليل FRAP التمثيلي. (أ) بيانات السلاسل الزمنية للمجهر ل (i) tactoid microtubule و (ii) GFP-MAP65 ، و (iii) صورة تراكب لكلتا القناتين مع microtubules باللون الأرجواني و GFP-MAP65 باللون السماوي التي تم تبييضها ضوئيا في الوقت 63 s ولوحظت لمدة 5 دقائق إضافية (B) كثافة كميا ل (i ) قناة الأنابيب الدقيقة في المنطقة المبيضة (الدوائر الأرجوانية) والخلفية (الدوائر الرمادية الداكنة) و (ii) قناة GFP-MAP65 في المنطقة المبيضة (المربعات السماوية) والخلفية (المربعات الرمادية الداكنة). (ج) تم تصحيح البيانات لضوضاء الخلفية وإعادة قياسها لقناة الأنابيب الدقيقة (الدوائر الأرجوانية) وقناة GFP-MAP65 (المربعات السماوية). لا تتعافى الأنابيب الدقيقة ، لكن GFP-MAP65 يفعل ويمكن أن يكون مناسبا (الخط الرمادي الداكن) للاضمحلال الأسي المتزايد للعثور على سعة وجدول زمني للاسترداد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم استخدام الطرق الموضحة هنا في العديد من الأوراق لإنشاء تاكتويدات الأنابيب الدقيقة (الشكل 2) 22,28. هذه التجارب ذات صلة بيولوجية للمساعدة في الكشف عن المبادئ التنظيمية التي تتحكم في شكل واستقرار المغزل الانقسامي أو الوسيط في معظم أنواع الخلايا. بالإضافة إلى ذلك ، فإن الأنابيب الدقيقة هي نموذج للميسوجينات البلورية السائلة التي يمكن أن تساعد في معرفة المزيد حول كيفية نواة البلورات السائلة ونمو المراحل الخيطية من المراحل متساوي الخواص.
الإجراء الموضح هنا له العديد من المزايا لاستكشاف التنظيم الذاتي للأنابيب الدقيقة. أولا ، إنه قابل للتكرار بشكل كبير ، حيث تم إجراؤه في المختبر من قبل العديد من الطلاب ، بما في ذلك طلاب المدارس الثانوية ، مع القليل من المعرفة المسبقة أو التدريب قبل البدء في المختبر. اللباقات ثنائية الانعكاس22 ، مما يسمح برؤيتها في الضوء المنقول بالإضافة إلى الفحص المجهري الفلوري ، مما يجعل هذه الطريقة في متناول العديد من المختبرات وهذا الإجراء التجريبي قابل للتكيف مع الأغراض التعليمية ، بالإضافة إلى الأبحاث الراقية. وأخيرا، تفتح هذه العملية آفاقا لمواصلة فهم الأنظمة البيولوجية والتحقيق فيها في نهج مختزل وتجريدي، مما يسمح للمرء بفهم كيف يمكن لكل حالة إضافية أو بروتين أو مادة مضافة أن تغير التنظيم الذاتي لللباقات، وربما في نهاية المطاف، المغزل. تشمل أهداف المحاكاة الحيوية الأفضل النشاط والسيولة وفرز قطبية الخيوط.
يمكن أن يكون هناك العديد من العوامل التي تؤثر على التجربة مما يعطي نتائج غير متوقعة. على سبيل المثال ، إذا لم تتشكل اللباقات (الشكل 2) ولكن لوحظت أنماط تشبه المروحة ، فمن المحتمل ألا يكون MAP65 موجودا أو غير ملزم بالأنابيب الدقيقة22,28. يجب أن يكون هذا واضحا في قناة التألق MAP65 أيضا لأن GFP-MAP65 لن يكون مرتبطا بالأنابيب الدقيقة.
إذا لم تتشكل اللباقات وظهرت الخلفية كبقع على الزجاج ، فقد يكون هذا بسبب طلاء السطح. بمجرد القيام به ، يستمر silanization فقط 1 شهر على coverslips. عندما يزول ، سيكون التوبولين قادرا على الارتباط بالسطح المكشوف بشكل غير محدد. سيحدث هذا الربط في أنماط غريبة.
إذا لم تتشكل اللباقات ولوحظ التوبولين في مجاميع من مختلف الأشكال والأحجام ، فقد يكون هذا بسبب التوبولين ذي الجودة الرديئة. يمكن طرد التوبولين مركزيا لإزالة المجاميع الأولية التي يمكن أن تدفع هذا التجميع خارج المسار بدلا من بلمرة الأنابيب الدقيقة. إذا كان السطح مرتبطا بالتوبولين ، فيمكنه أيضا استنفاد التوبولين في المحلول. يمكن أن تؤدي التركيزات المنخفضة من التوبولين ، أقل من التركيز الحرج لبلمرة الأنابيب الدقيقة ، إلى مجاميع.
في تجارب FRAP ، إذا لم تظهر قناة MAP65 أي استرداد (الشكل 5) ، فمن المحتمل أن يكون التبييض الضوئي قد ألحق الضرر الضوئي بالأنابيب الدقيقة. يتسبب الضرر الضوئي في التدمير الموضعي للخيوط. يمكن التحقق من ذلك عن طريق الفحص في القناة المرسلة. يمكن رؤية اللباقات ذات الأنابيب الدقيقة في القناة المنقولة من خلال مؤشر مرتفع لعدم تطابق الانكسار مع الماء المحيط. سيظهر الضرر الضوئي الناجم عن الضوء كعلامة حرق أو فقدان التباين في التصوير الضوئي المنقول في موقع عائد الاستثمار الخاضع للتبييض الضوئي. إذا حدث هذا ، يجب تقليل طاقة الليزر أو الضوء لمنع التلف الضوئي للبروتينات.
وكانت هناك العديد من التحديات التي تمت مواجهتها في هذا الإجراء والنهج. إحدى المشكلات هي أن قياسات الطول يتم تنفيذها حاليا يدويا بالنقر فوق الصورة. هذه الطريقة ، على الرغم من أنها واضحة ، يمكن أن تؤدي إلى درجة عالية من عدم اليقين. يعد قياس العرض الذي يستخدم المقطع العرضي والملائم للغاوسي طريقة أفضل لقياس الحجم. ويمكن استخدام طريقة مماثلة للطول. القضية الثانية هي أنه في بعض الأحيان ، يمكن أن تنحني اللباقة ، لأنها طويلة ورقيقة جدا. هذا يجعل تحديد الطول أكثر صعوبة. يمكن تحديد طول الكفاف كميا باستخدام خط مجزأ ، ولكن هناك عدم يقين إضافي في كل مرة تتم فيها إضافة مقطع.
من منظور علمي ، يواجه هذا النهج بعض التحديات الأخرى لاستخدامه كنموذج للبلورات السائلة أو المغزل. كان التحدي الأول هو الشكل الطويل والرقيق للكتل التي تخلقها الأنابيب الدقيقة (الشكل 3 والشكل 4). وكما لوحظ في المنشورات السابقة22 ، فإن تاكتويد الأنابيب الدقيقة هي تاكتويد متجانسة ، وليست ثنائية القطب. هذا يعني أن الأنابيب الدقيقة التي تشكل الشكل لا تعيد التوجيه للإشارة إلى أطراف الهيكل. بدلا من ذلك ، تكون جميع الأنابيب الدقيقة موازية للمحور الطويل وتقع "القطبين" في ما لا نهاية. هذا يختلف اختلافا كبيرا عن tactoids التي لوحظت للبلورات السائلة الجزيئية أو حتى للأكتين أو الحمض النووي التي يمكن أن تعمل أيضا كميسوجينات بلورية سائلة. في هذه الأنظمة الأخرى ، تكون اللباقة ثنائية القطب ، وعندما ينظر إليها في المستقطبات المتقاطعة ، فإنها تظهر علامات منبهة لإعادة توجيه القضبان.
التحدي الرئيسي الثاني في هذا النظام هو أن الأنابيب الدقيقة غير متحركة داخل اللباقة. هذا واضح من تجارب وتحليل FRAP لأن استعادة الأنابيب الدقيقة منخفضة للغاية. طبيعتها الشبيهة بالصلبة تجعل تاكتويدات الأنابيب الدقيقة أقل قيمة مثل نظائرها البلورية السائلة واسعة النطاق. يجب أن يكون للمرحلة الخيطية للبلورة السائلة خصائص سائلة (سائلة) وبلورية (منظمة). على الرغم من أن الشكل يبدو مناسبا للمغزل ، إلا أن الجمود يجعل النظام أقل إثارة كمغزل ميتوتيكي نموذجي. من ناحية أخرى ، توفر هذه المشكلة فرصا للتحقيق في كيفية تعديل التجارب لخلق المزيد من السيولة في النظام.
توفر هذه التحديات العلمية فرصا مثيرة من شأنها أن تسمح بمعرفة جديدة حول النظام. لجعل tactoids microtubule أكثر ثنائية القطب ، يمكن للمرء استخدام microtubules أقصر. ومع ذلك ، هناك تحد إضافي ، لأن الأنابيب الدقيقة لا تحتوي على العديد من بروتينات السد المميزة جيدا للتحكم في الطول كما يفعل الأكتين. يتطلب استخدام النوى والنمو استخدام تركيزات عالية جدا من التوبولين و GMPCPP لصنع أنابيب دقيقة قصيرة. ينتج عن تركيز التوبولين العالي عدد أكبر من الخيوط في النظام ، مما يجعل من الصعب فصل اللباقة عن بعضها البعض. قد تساعد إضافة أغطية الأنابيب الدقيقة الجديدة ، مثل DARPin33 ، في هذا الموقف. يمكن التخفيف من المشكلة الثانية المتمثلة في أن الأنابيب الدقيقة غير متحركة عن طريق إضافة البروتينات الحركية ، مثل kinesin-534 ، والتي هي رباعيات المحركات المستخدمة في الانقسام الخيطي. بدلا من ذلك ، يمكن استخدام dimers الاصطناعية من dimeric kinesin-115.
هناك طريقة أخرى لإضافة المزيد من السيولة تتمثل في السماح للأنابيب الدقيقة بأداء عدم استقرارها الديناميكي ، ونمو وتقلص الأنابيب الدقيقة. حاليا ، الأنابيب الدقيقة التي يتم زرعها بخيوط GMPCPP مستقرة ثم تخضع لعدم الاستقرار الديناميكي أطول بكثير من المطلوب لتشكيل مغزل أو لباقة ، مما قد يؤدي إلى منظمات طويلة جدا مثل المراوح أو الحزم. لذلك ، يجب إضافة عدم الاستقرار الديناميكي للأنابيب الدقيقة بعناية للحفاظ على شكل التاكتويد. إضافة البروتينات والإنزيمات المرتبطة التي يمكن أن تتحكم في الطول قد تخفف من هذه المشكلة. على سبيل المثال ، من المحتمل أن تكون هناك حاجة إلى إزالة البلمرة من الكينيسين ، مثل كينيسين-13 35 ، أو قطع الإنزيمات ، مثل الكاتانين36. هذه التجارب معقدة وصعبة ، على الرغم من أنها ستكون ثاقبة للغاية بغض النظر عما تكشفه النتائج. أيا كان الاتجاه الذي تتخذه التجارب المستقبلية ، فإن المنصة التي تم تطويرها هنا لإنشاء tactoids microtubule يمكن أن تكشف عن معلومات جديدة على الأساس المادي لتنظيم microtubule.
ويعلن صاحبا البلاغ أنه ليس لديهما مصالح مالية منافسة.
يود المؤلفون أن يشكروا جميع أعضاء مختبر روس لصيف 2021 ، وخاصة K. Alice Lindsay ، على مساعدتهم. تم دعم هذا العمل من خلال منحة من NSF BIO-2134215 التي دعمت S. Sahu و N. Goodbee و H.B. Lee و J.L. Ross. منحة من مؤسسة KECK (راي أندرسون ، دولار أمريكي ، PI الرئيسي) دعمت جزئيا R. Branch و P. Chauhan
| Name | Company | Catalog Number | Comments |
| 2% Dichlorodimethylsilane | GE Healthcare | 118945 | A hydrophobic silane surface treatment. This can be resused upto three times and kept at room temperature for one year. |
| 5-minute epoxy | Bob Smith Industries | For sealing experimental chambers | |
| Acetone | Fisher | 32900HPLC | 100% |
| BL21 cells | Bio Labs | C2527I | Competent bacterial cells used to express MAP65 |
| Catalase | Sigma | C30-500MG | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C for upto one year. |
| Coverslips (22 mm x 22 mm or 22 mm x 30 mm) | Fisher | 12544-AP | For experimental chambers |
| Dithiothreitol | Sigma | 43815-5G | A small molecule that is used to break disulfide bonds and scavenge oxygen. A 1 M stock is made from powder (Sigma) in ddH2O. The solution is aliquoted and stored at -20C for upto one year. The aliquots are used 7-8 times then discarded. |
| EGTA | Sigma | E3889-10G | Tubulin buffer base ingredient |
| Eppendorf 0.5 ml tubes | Eppendorf | 05 402 18 | For holding experimental solutions |
| Ethanol | Fisher | 111000200 | 200 proof |
| Filter paper | Whatman | 1004-110 | For cleaning and for pulling solutions through experimental chambers |
| Fluorescence microscope with high NA objectives | Nikon | Ti-E, W2 Confocal | For imaging experiments |
| Freezer -20°C | Fisherbrand | 13986148 | For storing reagents |
| Freezer -80°C | Thermo scientific | 328223H01-C | For storing proteins. |
| Glass containers for silanization | Michaels | For preparing experimental chambers - treating cover glasses | |
| Glass slides | Fisher | 12544-4 | For experimental chambers |
| Glucose | Sigma | G7528-250G | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C. |
| Glucose oxidase | Sigma | G2133-250KU | Part of the oxygen scavenging system. This is stored at 4°C for upto one year. |
| GMPCPP | Jenna Bioscience | NU-4055 | Slowly hydrolyzable analog of GTP used to polymerize and stabilize the microtubules by reducing the dynamic instability and spontaneous critical concentration for microtubule nucleation to get a consistent length. We purchase a 10 mM stock from Jena Biosciences and store it at -20°C for upto one year. |
| Heating element for microscope | Okolab stage top incubator | For imaging experiments | |
| Imidizole | Sigma | I2399 | Used to elute MAP65 protein from Nickel beads to purify MAP65 |
| Kimwipes | Fisher | 34155 | For cleaning and for pulling solutions through experimental chambers. |
| KOH | Sigma | P250-500 | 1 M in ddH2O, made fresh to prevent acidification over time. |
| Liquid Nitrogen | Airgas | NI 230LT22 | To drop freeze aliquots. This can also be used for storage (not recommended) |
| MAP65 protein | Ram Dixit | A microtubule-associated protein (MAP) with a molecular weight of 65 kD that is an antiparallel microtubule crosslinker. We have purified an unlabeled and GFP-labeled version of MAP65-1 from Arabidopsis thaliana. We mix the GFP-MAP65 with the unlabeled MAP65 such that 10% of the protein is labeled. The working stock is a 10.8 μM solution. This working solution is stored at 4°C and remade fresh every week. The protocol for purifying the MAP65 and GFP-MAP65 is given in our prior methods chapter (26). | |
| MgSO4 | Sigma | MKCJ940 | Tubulin buffer ingredient |
| NTA-Nickel beads | Qiagen | 30210 | Beads required to purify 6xHis tagged MAP65 proteins |
| Optomicroscan | Nikon | 405 nm laser system which can focus the laser in any desired shape of region of interest | |
| PEM80 | Neutral tubulin polymerizing base buffer for solution made from 80 mM K-PIPES, pH 6.8, 1 mM MgSO4, 1 mM EGTA, stored at 4°C for upto one year. | ||
| Permanent double-sided tape | 3M - Scotch | 34-8724-5691-7 | For experimental chambers |
| Petri dish | Fisher | FB0875713 | For humid chamber |
| PIPES | Sigma | P7643-100G | Tubulin buffer base ingredient |
| Pluronic-F127 | Sigma | P2443-250G | A block-copolymer with two hydrophilic polyethylene oxide (PEO) blocks on the ends and a hydrophobic center block of polyphenylene oxide (PPO) hydrophobic surface coating we use to prevent protein binding to the surface. Pluronic-F127 is purchased as a powder (Sigma) and dissolved to a 5% (w/v) solution in ddH2O overnight. Once dissolved, the solution can be stored at room temperature for upto one year. |
| Polyethylene Glycol | Affymetrix Inc | 19966 500 GM | A crowding agent used to create depletion forces to bring tactoids to the surface and help to organize microtubules. We create a 5% (w/v) solution of 100 kDa PEG in PEM80. The solution is stored in 4°C for upto one year and placed on the rocker before use. It is viscous, so we recommend using a positive displacement pipette to work with it. |
| Positive displacement pipette | Eppendorf | For pipetting viscous liquids | |
| Racks for coverslips | Electron Microscopy Sciences | 72240 | For preparing experimental chambers - treating cover glasses |
| Refrigerator 4°C | Fisherbrand | For storing reagents | |
| Tubulin Labeled | Cytoskeleton | TL590M | lyophilized rhodamine-labeled tubulin from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| Tubulin protein | Cytoskeleton | T240 | lyophilized tubulin 99% pure unlabeled from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| UV-Ozone | Jelight | Model 342 | For preparing experimental chambers - treating cover glasses |
| Stackreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/stackreg/ | plugin for registering time series data to remove drift |
| Turboreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/turboreg/ | plugin for registering time series data to remove drift |
- Bodakuntla, S., Jijumon, A. S., Villablanca, C., Gonzalez-Billault, C., Janke, C. Microtubule-associated proteins: structuring the cytoskeleton. Trends in Cell Biology. 29 (10), 804-819 (2019).
- Severson, A. F., von Dassow, G., Bowerman, B. Oocyte meiotic spindle assembly and function. Current Topics in Developmental Biology. 116, 65-98 (2016).
- Brugués, J., Needleman, D. Physical basis of spindle self-organization. Proceedings of the National Academy of Sciences of the United States of America. 111 (52), 18496-18500 (2014).
- Brugués, J., Nuzzo, V., Mazur, E., Needleman, D. J. Nucleation and transport organize microtubules in metaphase spindles. Cell. 149 (3), 554-564 (2012).
- Gatlin, J. C., et al. Spindle fusion requires dynein-mediated sliding of oppositely oriented microtubules. Current Biology. 19 (4), 287-296 (2009).
- Goshima, G., Mayer, M., Zhang, N., Stuurman, N., Vale, R. D. Augmin: A protein complex required for centrosome-independent microtubule generation within the spindle. Journal of Cell Biology. 181 (3), 421-429 (2008).
- Inoue, S., Sato, H. Cell motility by labile association of the nature of mitotic spindle fibers and their role in chromosome movement molecules. Journal of General Physiology. 50 (6), 259-292 (1967).
- Allenspach, A. L., Roth, L. E. Structural variations during mitosis in the chick embryo. Journal of Cell Biology. 33 (1), 179-196 (1967).
- Theg, D. E. Cytoplasmic microtubules in different animal cells. Journal of Cell Biology. 23 (2), 265-275 (1964).
- Mcdonald, K., Pickett-Heaps, J. D., Mcintosh, J. R., Tippit, D. H. On the mechanism of anaphase spindle elongation in Diatoma vulgare. Journal of Cell Biology. 9, 377-388 (1977).
- Chaikin, P. M., Lubensky, T. C. . Principles of Condensed Matter Physics. , (1995).
- Hamon, L., Savarin, P., Curmi, P. A., Pastré, D. Rapid assembly and collective behavior of microtubule bundles in the presence of polyamines. Biophysical Journal. 101 (1), 205 (2011).
- Needleman, D. J., et al. Higher-order assembly of microtubules by counterions: From hexagonal bundles to living necklaces. Proceedings of the National Academy of Sciences. 101 (46), 16099-16103 (2004).
- Ross, J. L., Fygenson, D. K. Mobility of taxol in microtubule bundles. Biophysical Journal. 84, 3959-3967 (2003).
- Sanchez, T., Welch, D., Nicastro, D., Dogic, Z. Cilia-like beating of active microtubule bundles. Science. 333 (6041), 456-459 (2011).
- Brandt, R., Lee, G. Functional organization of microtubule-associated protein tau. Identification of regions which affect microtubule growth, nucleation, and bundle formation in vitro. Journal of Biological Chemistry. 268 (5), 3414-3419 (1993).
- Hirokawa, N. Microtubule organization and dynamics dependent on microtubule-associated proteins. Current Opinion in Cell Biology. 6 (1), 74-81 (1994).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. The Journal of Cell Biology. 109 (3), 1173 (1989).
- MacRae, T. H. Microtubule organization by cross-linking and bundling proteins. Biochimica et Biophysica Acta (BBA). Protein Structure and Molecular Enzymology. 1160 (2), 145-155 (1992).
- She, Z. Y., Wei, Y. L., Lin, Y., Li, Y. L., Lu, M. H. Mechanisms of the Ase1/PRC1/MAP65 family in central spindle assembly. Biological Reviews. 94 (6), 2033-2048 (2019).
- Walczak, C. E., Shaw, S. L. A MAP for Bundling Microtubules. Cell. 142 (3), 364-367 (2010).
- Edozie, B., et al. Self-organization of spindle-like microtubule structures. Soft Matter. 15 (24), 4797-4807 (2019).
- Tulin, A., McClerklin, S., Huang, Y., Dixit, R. Single-molecule analysis of the microtubule cross-linking protein MAP65-1 reveals a molecular mechanism for contact-angle-dependent microtubule bundling. Biophysical Journal. 102 (4), 802-809 (2012).
- Chan, J., Jensen, C. G., Jensen, L. C. W., Bush, M., Lloyd, C. W. The 65-kDa carrot microtubule-associated protein forms regularly arranged filamentous cross-bridges between microtubules. Proceedings of the National Academy of Sciences of the United States of America. 96 (26), 14931-14936 (1999).
- Scheff, D. R., et al. Tuning shape and internal structure of protein droplets via biopolymer filaments. Soft Matter. 16 (24), 5659-5668 (2020).
- Weirich, K. L., et al. Liquid behavior of cross-linked actin bundles. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2131-2136 (2017).
- Weirich, K. L., Dasbiswas, K., Witten, T. A., Vaikuntanathan, S., Gardel, M. L. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences of the United States of America. 166 (23), 11125-11130 (2019).
- Sahu, S., Herbst, L., Quinn, R., Ross, J. L. Crowder and surface effects on self-organization of microtubules. Physical Review E. 103 (6), 062408 (2021).
- Stanhope, K. T., Ross, J. L. Microtubules, MAPs, and motor patterns. Methods in Cell Biology. 128, 23-38 (2015).
- Early Middle Ages drop single.jpg. Wikimedia Commons Available from: https://commons.wikimedia.org/wiki/File:Early_middle_ages_drop_spingle.jpg (2022)
- Lantzsch, I., et al. Microtubule reorganization during female meiosis in c. Elegans. eLife. 10, 58903 (2021).
- Advani, S., Maresca, T. J., Ross, J. L. Creation and testing of a new, local microtubule-disruption tool based on the microtubule-severing enzyme, katanin p60. Cytoskeleton. 75 (12), 531-544 (2018).
- Pecqueur, L., et al. A designed ankyrin repeat protein selected to bind to tubulin caps the microtubule plus end. Proceedings of the National Academy of Sciences of the United States of America. 109 (30), 12011-12016 (2012).
- Valentine, M. T., Fordyce, P. M., Krzysiak, T. C., Gilbert, S. P., Block, S. M. Individual dimers of the mitotic kinesin motor Eg5 step processively and support substantial loads in vitro. Nature Cell Biology. 8 (5), 470-476 (2006).
- Wagenbach, M., Domnitz, S., Wordeman, L., Cooper, J. A kinesin-13 mutant catalytically depolymerizes microtubules in ADP. Journal of Cell Biology. 183 (4), 617-623 (2008).
- McNally, F. J., Vale, R. D. Identification of katanin, an ATPase that severs and disassembles stable microtubules. Cell. 75 (3), 419-429 (1993).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved