Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biochemistry
Zelfassemblage van Microtubule Tactoids
Dit artikel presenteert een protocol voor de vorming van microtubule-assemblages in de vorm van tactoïden met behulp van MAP65, een plantaardige microtubule crosslinker, en PEG als een crowding agent.
Het cytoskelet is verantwoordelijk voor grote interne organisatie en reorganisatie binnen de cel, allemaal zonder een manager om de veranderingen te sturen. Dit is vooral het geval tijdens mitose of meiose, waarbij de microtubuli de spil vormen tijdens de celdeling. De spil is de machinerie die wordt gebruikt om genetisch materiaal te scheiden tijdens celdeling. Om zelfgeorganiseerde spindels in vitro te creëren, hebben we onlangs een techniek ontwikkeld om microtubuli te reconstitueren tot spindelachtige assemblages met een minimale set microtubuli-geassocieerde eiwitten en verdringingsmiddelen. Specifiek werd MAP65 gebruikt, een antiparallel microtubule crosslinker van planten, een homoloog van Ase1 van gist en PRC1 van zoogdierorganismen. Deze crosslinker organiseert zelf microtubuli in lange, dunne, spindelachtige microtubuli zelfgeorganiseerde assemblages. Deze assemblages zijn ook vergelijkbaar met vloeibare kristal tactoïden, en microtubuli kunnen worden gebruikt als mesoschaal mesogenen. Hier worden protocollen gepresenteerd voor het maken van deze microtubule tactoïden, evenals voor het karakteriseren van de vorm van de assemblages met behulp van fluorescentiemicroscopie en de mobiliteit van de bestanddelen met behulp van fluorescentieherstel na fotobleaching.
Celdeling via mitose is een van de belangrijkste biologische processen om het leven in stand te houden. De microtubule filamenten, samengesteld uit tubuline dimeren, zijn essentiële structurele elementen van dit proces. De voorbijgaande machinerie die in de metafase wordt gecreëerd wanneer de chromosomen in het celcentrum worden uitgelijnd, wordt de mitotische spindel genoemd vanwege zijn vorm, die lijkt op een spindel van een weefgetouw bedekt met draden (figuur 1A). Het is bij veel organismen goed ingeburgerd dat microtubuli in de metafase worden gebruikt om gecondenseerde chromosomen in het midden van de cel te duwen en te trekken, ze uit te lijnen en ze aan te sluiten op microtubuli die ze in de anafase uit elkaar zullen trekken (figuur 1B, C). De spindel vormt zich in zowel meiose (figuur 1B) als mitose (figuur 1C), ontstaan uit vele overlappende microtubuli die niet als draad om de centrale as zijn gewikkeld, maar parallel aan de interface lopen. Het creëren van deze op microtubuli gebaseerde structuren vereist geassocieerde eiwitten die crosslinken en geassocieerde enzymen die kunnen fungeren als motoren om de chromosomen te duwen en te trekken1.
Studies van meiotische spindels hebben aangetoond dat de microtubuli kort, dynamisch en overlappend zijn in crosslinked arrays 2,3,4,5,6 (Figuur 1Di). Door de fysische organisatie van deze korte microtubuli is de meiotische spindel vergelijkbaar met een vloeibaar kristal tactoïde (figuur 1E). Van spindels is inderdaad aangetoond dat ze samensmelten en samensmelten, zoals men zou verwachten van vloeibare kristaltatoïden5.
Veel studies die dateren uit de jaren 1960 hebben fixatie, seriële secties en elektronenmicroscopie gebruikt om te bepalen dat er twee soorten microtubuli in de mitotische spindel 7,8,9,10 zijn. Het eerste type wordt de kinetochore microtubuli genoemd, die de spindelpool verbinden met het kinetochore. Het tweede type wordt de interpolaire of polaire microtubuli genoemd, die voorbij de chromosomen groeien en elkaar overlappen in de midzone (figuur 1Dii)8,9,10. Een derde type wordt de astrale microtubuli genoemd, die zich buiten de spil bevinden en de polen verbinden met de celrand; deze microtubuliorganisaties vallen buiten het bestek van de huidige discussie. Er zijn recente studies geweest naar de interactie tussen augmin6 en gamma-tubuline ringcomplex dat nucleatiecentra voor microtubuli beïnvloedt, wat resulteert in een mitotische spindel met kortere microtubuli zoals in figuur 1D.
Omdat microtubuli langer zijn dan ze breed zijn, met een hoge beeldverhouding en hoge stijfheid, zijn ze als opgeschaalde versies van vloeibare kristalmoleculen. In de fysica van zachte materie zijn atomen en moleculen benaderd met behulp van minimale interacties om de fysische mechanismen van faseovergangen af te leiden, waaronder nucleatie en het smelten van kristallen11. Evenzo zijn microtubuli mesoschaalobjecten die opgeschaalde versies zijn van vloeibare kristalmoleculen, die inzicht geven in de fysica van vloeibare kristaldynamica, inclusief de nucleatie en groei van de nematische fasen van isotrope fasen. Verder, zoals hierboven besproken, vertoont de meiotische spindel eigenschappen zoals die van een vloeibaar kristal tactoïde, een nematische toestand die nucleeert en groeit uit de isotrope toestand van vloeibare kristalmoleculen 3,4,5. Voor tactoïden zijn nucleatie en groei vergelijkbaar met die van andere kristallen (d.w.z. een relatief hoge concentratie mesogenen vereisen [de moleculen die vloeibare kristallen vormen]). De unieke "spindel" vorm van de tactoïde komt van de lokale uitlijning van de vloeibare kristal mesogenen die uitlijnen in de nematische fase (figuur 1E). Ze kunnen geen afgerond kristal vormen omdat de moleculen zeer asymmetrisch zijn. Gezien de aard van de microtubuli is het misschien niet verwonderlijk dat de mitotische spindelmachinerie gemaakt van een hoge lokale concentratie microtubuli ook dezelfde vorm heeft, of het nu een tactoïde of een spindel wordt genoemd. Tactoïden kunnen bipolair zijn, met polen aan de taps toelopende uiteinden (figuur 1Ei), of homogeen, met polen effectief op oneindig (figuur 1Eii).
Gezien het belang van spindelvorming, zijn er inspanningen geleverd voor zelfgeorganiseerde spindelvorming in vitro door microtubulecondensatie in bundels aan te tonen via ionische soorten12,13, verdringingsmiddelen die uitputtingsinteracties creëren14,15, en specifieke microtubule crosslinking eiwitten 13,16,17,18,19, 21. Verrassend genoeg, hoewel deze middelen allemaal werken om de lokale concentratie van microtubuli te verhogen, resulteren ze vaak in lange microtubulibundels, maar niet in tactoïden. Een reden waarom deze bundels lang zijn, zou kunnen zijn dat de microtubuli waaruit ze bestaan ook lang zijn. Recent werk met kortere microtubuli meldde ook langere bundels die aan het einde niet taps toelopend zijn15; in dit geval worden de bundels bij elkaar gehouden met motoreiwitten die verlenging van de bundels veroorzaken en daardoor langer maken. Korte microtubuli met niet-extensiele crosslinkers zijn nodig voor taps toelopende, spindelachtige assemblages, zoals hier beschreven.
Onlangs hebben we een techniek ontwikkeld om de creatie van microtubule tactoïden mogelijk te maken met behulp van de antiparallel crosslinker, MAP65, in de aanwezigheid van nucleating stabiele microtubules22. De microtubuli moesten kort zijn, maar weinig bekende regulatoren van microtubulilengte kunnen microtubuli afdekken tegen dynamische instabiliteit of end-to-end gloeien. In plaats daarvan werd GMPCPP gebruikt om de filamenten na groei te nucleeren en te stabiliseren. Dit maakte het mogelijk om een hoge dichtheid van korte microtubuli te creëren die zichzelf konden organiseren in tactoïden. Deze tactoïden waren homogeen wanneer ze onder birefringence werden bekeken. Naast korte microtubuli werd een specifieke antiparallel crosslinker, MAP65, gebruikt om de tactoïden te vormen (figuur 2). MAP65 is een plantaardig microtubule-geassocieerd eiwit in de PRC1/Ase1 familie van mitotische crosslinkers23. MAP65 bestaat als een dimeer, met een sterke affiniteit om aan zichzelf te binden, evenals de microtubuli24. In tegenstelling tot de meiotische spindel en tactoïden waargenomen met actinefilamenten 25,26,27, die bipolair zijn en de vloeistofachtige eigenschappen van vloeibare kristallen hebben, zijn microtubuli tactoïden waargenomen als vast-achtig22,28.
Hier worden protocollen gepresenteerd voor het maken van de microtubule tactoïden en het karakteriseren van de vorm van de assemblages en de mobiliteit van de bestanddelen met behulp van op fluorescentie gebaseerde technieken.
OPMERKING: Tenzij anders vermeld, kunnen delen van het experiment worden uitgevoerd op een laboratoriumbank met de juiste beschermingsmiddelen (handschoenen).
1. Coverslip silanisatie
OPMERKING: Coverslips moeten worden gesiliciseerd om te worden gebruikt met de polymeerborstelcoating die in deze experimenten wordt gebruikt. Dit is een hydrofobe silanisatiebehandeling waarmee een blokcopolymeer met een hydrofoob centraal blok kan binden en een polymeerborstel kan maken. De volgende stappen moeten worden uitgevoerd in een zuurkast om blootstelling aan giftige dampen tijdens het dragen van handschoenen te voorkomen. Dimethyldichlorolsilaan is zeer giftig en moet met de grootste zorg worden behandeld.
- Spoel de coverslips in volgorde af met ddH2O, 70% ethanol en ddH2O. Droog ze tussen elke spoeling af met pluisvrije laboratoriumdoekjes. Dit verwijdert stof en in water oplosbare of organische deeltjes van het oppervlak voor de behandeling.
- Plaats de coverslips in een metalen coverslip-holding rack en breng het rack over naar een UV-Ozone (UVO) machine. Bestraal de coverslips met UVO gedurende 20 minuten om eventuele achtergrondfluorescentie te verwijderen. Een plasmakamer kan worden gebruikt in plaats van UVO.
- Breng met een pincet de coverslips over van het metalen rek dat wordt gebruikt voor UVO-behandeling naar een ander metalen rek dat wordt gebruikt voor silanisatie. Gebruik niet dezelfde rekken voor beide, omdat dit hoge niveaus van oxidatie zal veroorzaken wanneer UVO wordt toegepast. Reinig de rekken vooraf met water en ethanol, zodat er geen restchemicaliën overblijven van eerder gebruik.
- Dompel het rek met de coverslips gedurende 1 uur onder in een container met 100% aceton. Spoel de container 3x af met kraanwater en vervolgens 3x met ddH2O om alle aceton te verwijderen.
- Dompel het rek met de coverslips gedurende 10 minuten onder in 100% ethanol. Spoel de container 3x af met kraanwater en vervolgens 3x met ddH2O om alle ethanol te verwijderen.
- Dompel het rek met de coverslips 3x onder in ddH2O gedurende 5 minuten per stuk.
- Dompel het rek met de coverslips onder in 0,1 M KOH (50 ml 1 M KOH in 450 ml ddH2O) gedurende 15 minuten. Spoel de container 3x af met kraanwater en vervolgens 3x met ddH2O om alle KOH te verwijderen.
- Dompel het rek met coverslips 3x onder in ddH2O gedurende 5 minuten elk.
- Droog het rek met de coverslips een nacht aan de lucht in een zuurkast of laminaire stromingskap.
- Nadat u het rek en de coverslips volledig hebt gedroogd, dompelt u ze gedurende 5 minuten onder in 2% dimethyldichlorosilane (DDS) in een andere container die specifiek voor silaan wordt gebruikt. Laat niets wat niet droog is in contact komen met het silaan.
- Dompel het rek en de coverslips 2x onder in een container met 100% ethanol gedurende 5 min. Spoel de container 3x af met kraanwater en daarna 3x met ddH2O.
- Dompel het rek en de coverslips 3x onder in ddH2O gedurende 5 minuten elk.
- Droog het rek met de coverslips een nacht aan de lucht in een zuurkast of laminaire stromingskap.
- Breng na deze laatste droogstap de coverslips met een pincet terug in coverslip-dozen. Deze coverslips kunnen in de komende 1-2 maanden worden gebruikt. Oude coverslips beginnen hun coating te verliezen en moeten worden weggegooid.
2. Tubuline bereiding
OPMERKING: De gekochte tubuline wordt geleverd als een gelyofiliseerd poeder dat niet is geëtiketteerd of is geëtiketteerd met fluoroforen. Gelyofiliseerde tubuline wordt bewaard in een -80 °C vriezer. De volgende procedure wordt gebruikt om ongelabelde tubuline te mengen met gelabeld tubuline in een verhouding die goed is voor visualisatie.
- Verwijder uit de -80 °C vriezer één aliquot ongelabelde tubuline die 1 mg gelyofiliseerd tubulinepoeder bevat en bewaar deze op ijs. Voeg 200 μL koude PEM-80 toe aan de buis om de tubulineconcentratie op 5 mg / ml te brengen. Houd het 10 minuten op ijs om al het lyofiel op te lossen.
- Verwijder uit de -80 °C vriezer één aliquot rhodamine-gelabelde tubuline die 20 μg gelyofiliseerd tubulinepoeder bevat en bewaar het op ijs. Voeg 4 μL koude PEM-80 toe aan de buis om de tubulineconcentratie op 5 mg / ml te brengen. Houd het 10 minuten op ijs om het lyofiel volledig op te lossen.
- Voeg, eenmaal opgelost, 100 μL ongelabelde geresuspendeerde tubuline-oplossing toe aan de 4 μL-oplossing van rhodamine-gelabelde tubuline. Pipetteer 6x-7x heel langzaam om te mengen. Als aggregaten zichtbaar zijn, centrifugeer dan de opgeloste tubuline gedurende 10 minuten bij 90.000 x g om aggregaten te verwijderen door de pellet weg te gooien en het supernatant vast te houden. Deze tubulinemix resulteert in ~4% gelabeld tubuline.
- Vries de resterende 100 μL ongelabelde tubuline in vloeibare stikstof (LN2) en bewaar deze bij −80 °C voor gebruik voor extra tubulinemengsels.
- Neem het gelabelde tubulinenmengsel en aliquot in zeven buisjes met elk 15 μL. Elke aliquot kan worden gebruikt voor een enkele experimentele kamer. Vries de resterende aliquots in en bewaar ze bij −80 °C voor toekomstige experimenten.
3. MAP65 zuivering
OPMERKING: MAP65 is niet in de handel verkrijgbaar en moet daarom worden gezuiverd voor dit werk. Het protocol is eerder uitgewerkt in verschillende publicaties23,29.
- Transformeer het MAP65 plasmide en GFP-MAP65 plasmide in BL21 bacteriestam voor eiwitexpressie.
- Kweek BL21-bacteriën tot een optische dichtheid van 0,6-1 bij 600 nm. Induceer eiwitproductie met behulp van de lac-operator en laat de bacteriën 's nachts groeien.
- Pelleteer de culturen en lyseer de bacteriën.
- Verzamel het lysaat na centrifugatie en incubeer het met kralen die een nikkelion beschikbaar hebben om de 6x-histidine-tag te binden.
- Eluteer het eiwit met behulp van imidazool en ontzout het.
- Bevries het eiwit met vloeibare stikstof en bewaar het bij −80 °C voor gebruik binnen 1 jaar.
4. Montage van stroomkamers
OPMERKING: Experimenten worden uitgevoerd in stroomkamers gemaakt van een glazen dia en gesiliciseerd afdekglas (figuur 3).
- Neem een glasschuif en maak deze schoon met ddH2O, ethanol en ddH2O in volgorde. Droog met een pluisvrij laboratoriumdoekje tussen elke spoeling.
- Gebruik een stuk dubbelzijdige tape om een stroompad te maken. Snijd de tape met gehandschoende handen tot ~25-30 mm lang. Splits de tape in de lengte om twee dunnere stroken te maken. Plaats de twee tapestrips op de dia met ongeveer 5-8 mm ertussen.
OPMERKING: Aangezien de dikte van de tape gestandaardiseerd is tot ongeveer 80-100 μm, bepaalt de breedte van het pad tussen de stukjes tape het volume in de kamer. - Plaats de gesiliceerde coverslips bovenop het stroompad. Sluit de schuif en de afdekplaat af op de dubbelzijdige tapestrips door zachtjes met de achterkant van een pen op het tapegebied te drukken. Zorg ervoor dat je een goede afdichting over het hele gebied krijgt; de tape moet van doorschijnend naar helder worden wanneer de afdichting goed is gemaakt.
- Verwijder de extra tape aan de randen en laat slechts 1 mm van de ingang van de stroomkamer over door de tape met een scheermesje te snijden.
- Label de kamer met informatie over de experimentele parameters, indien nodig.
5. Tactoïde experimenten
OPMERKING: Zodra alle reagentia en benodigdheden zijn gegenereerd, kunnen ze worden gebruikt om microtubuli tactoïden in de stroomkamer te nucleeren en te polymeriseren.
- Verzamel alle te gebruiken reagentia. Ontdooi ze op ijs en bewaar ze op ijs tijdens het werken. Maak verschillende stroomkamers voor de experimenten.
- Gebruik één stroomkamer voor elk experiment. Bedek de oppervlakken van de stromingskamer met een polymeerborstel door 20 μL van 5% niet-ionische blok co-polymeer oppervlakteactieve stof (Tabel van Materialen) opgelost in PEM-80, met kleine druppels aan beide uiteinden van de kamer om de vorming van luchtbellen binnenin te voorkomen. Bewaar dit in een vochtige kamer (d.w.z. petrischaal met een nat pluisvrij laboratoriumdoekje) totdat het klaar is voor gebruik (ten minste 5-7 minuten).
- Meng in een steriele buis het volgende om de Tubulin-MAP-mix te maken: 9,5 μL PEM-80; 4 μL van 10 mM GMPCPP; 4 μL van 5% Pluronic-F127; 1 μL 1M DTT; 1 μL glucose; 2 μL polyethyleenglycol (PEG); 12 μL van 5 mg/ml tubulinemengsel (13,6 μM eindconcentratie) vanaf stap 2.5. en 5,5 μL werkvoorraad van MAP65 waarbij 10% GFP-MAP65 is voor visualisatie. Blijf op ijs tijdens het mixen.
OPMERKING: Het wordt aanbevolen om een pipet met positieve verplaatsing te gebruiken voor het hanteren van de viskeuze PEG-oplossing. Gewone pipetten kunnen worden gebruikt na het snijden van de punt om de opening groter te maken; deze methode is echter minder nauwkeurig. - Meng 5x-6x door te pipetteren.
- Voeg vlak voor het toevoegen aan de kamer 1 μL van een voorgemengde oplossing van glucoseoxidase (0,5 mg / ml) en catalase (0, 15 mg / ml) (deoxy) toe aan de Tubulin-MAP-mix en meng 7x-8x. Verdeel het totale volume van de oplossing (40 μL) in twee porties voor gebruik in afzonderlijke kamers.
- Laat de Tubulin-MAP mix in kamers stromen. Omdat de kamers al niet-ionische blok co-polymeer oppervlakteactieve stof bevatten, kan er niet meer vloeistof worden toegevoegd zonder de oude vloeistof te verwijderen. Gebruik hiervoor een stuk filterpapier of een pluisvrij laboratoriumdoekje aan de andere kant van de kamer om vloeistof via capillaire werking te verwijderen.
- Zodra het monster volledig in de kamer is, sluit u de twee uiteinden van de kamer af met epoxy van 5 minuten en houdt u het gedurende ~ 30 minuten op 37 °C om te nucleeren en microtubuli tactoïden te laten groeien.
6. Fluorescentiemicroscopie
- Gebruik een fluorescentiemicroscoop voor het in beeld brengen van de tactoïden.
OPMERKING: Totale interne reflectie fluorescentiemicroscopie of spinning disc confocale microscopie zijn goed om achtergrondfluorescentie uit vrije tubuline te verwijderen, maar tactoïden zijn ook zichtbaar door regelmatige epifluorescentie en zelfs doorgelaten lichtmicroscopie zodra ze zijn gevormd, waardoor deze procedure toegankelijk is zonder gespecialiseerde apparatuur. - Gebruik een numeriek diafragma (NA) objectief van 1,2 NA of hoger met een vergroting van 60x of hoger om voldoende licht in fluorescentie te verzamelen. Deze doelen vereisen vaak onderdompeling in ddH2O of olie.
- Neem beelden op met CMOS- of CCD-camera. Gebruik een effectieve pixelgrootte op de camera van 108 nm.
OPMERKING: De pixelgrootte is afhankelijk van de camera en de gebruikte vergroting, die in dit geval 60x of 100x was met een hoog numeriek diafragma (1,2 of 1,49 NA). Extra beelduitbreidingen kunnen vóór de camera worden gebruikt om de benodigde pixelgrootte te bereiken. - Houd het monster op 37 °C met behulp van een omgevingskamer die op deze temperatuur is ingesteld. U kunt ook andere podiumverwarmers gebruiken, waaronder heteluchttrapverwarmers en objectieve temperatuurgecontroleerde kragen met circulerend warm water.
- Gebruik excitatiebronnen die correct zijn voor de benodigde fluorescentie. Gebruik voor rhodamine tubuline een 561 nm-laser met ten minste 1 mW vermogen in het monster en voor GFP-MAP65 een 488 nm-laser met ten minste 1 mW vermogen in het monster.
OPMERKING: Als u breedveld epifluorescentiemicroscopie gebruikt, gebruik dan een rhodaminefilterkubus met excitatie: 540 ± 12,5 nm, dichroïsch: 545 nm ± 12,5 nm cut-off, en emissie: 575 nm lange doorgang, en een GFP-filterkubus met excitatie: 480 ± 15 nm, dichroïsch: 505 nm ± 15 nm cut-off, en emissie: 515 nm lange pass. - Maak ten minste 10 afbeeldingen van verschillende gebieden om meer dan 100 tactoïden in beeld te brengen. Maak afbeeldingen in zowel de rode als de groene kanalen en sla ze op als 16-bits tiff-afbeeldingen voor analyse. Zorg ervoor dat het verlichtingsvermogen en de belichtingstijden zodanig zijn dat de intensiteitsschaal voor de camera niet verzadigd is.
7. Fluorescentieherstel na fotobleaching (FRAP)
OPMERKING: Om de mobiliteit van de interne bestanddelen van de tactoïden te bestuderen, werd FRAP gebruikt. FRAP werkt door een geselecteerd deel van rhodamine-gelabelde tubuline en GFP-gelabelde MAP65 tactoïde te fotobleachen en vervolgens het herstel van de fluorescentie met de tijd in dat gebied te observeren. De snelheid van herstel hangt af van de omzet van de soort die wordt gefotobleacheerd. Deze omloopsnelheid kan afhankelijk zijn van diffusie- en bindingsreacties. Voor MAP65-binding aan de tactoïden kunnen bindende wisselkoersen worden geschat. FRAP wordt uitgevoerd met behulp van een extra 405 nm lasersysteem dat de laser in elke vorm kan scannen. Er zijn veel mogelijkheden voor het uitvoeren van FRAP, waaronder het gebruik van de verzonden lamp en het diafragma om een lokaal gebiedte fotograferen 14.
- Selecteer een geïsoleerde tactoïde in de kamer om een interessante regio (ROI) te maken die delen van de tactoïden en de omliggende oplossing bedekt.
- Gebruik een microscoop met een extra 405 nm laser voor FRAP om zowel de tubuline als de MAP65 tegelijkertijd te fotograferen. Als alternatief kan een heldere lamp worden gebruikt via de veldstop van de iris14. Pas de specifieke intensiteit van de fotobleachingsystemen empirisch aan om beschadiging van de eiwitten tijdens het bleken te voorkomen.
- Neem de tactoid op als een tijdreeksfilm gedurende 30-60 s voordat je fotobleacht om informatie te krijgen over de intensiteit voorafgaand aan het bleekmiddel. Neem zowel de rode als de groene kanalen op.
- Photobleach de tactoid door de ROI bloot te stellen met de lasers of de lamp zolang als nodig is om te fotobleachen zonder de tactoid te beschadigen. Bepaal de intensiteit en tijd empirisch.
- Blijf de film opnemen in beide kleurkanalen gedurende 5-10 minuten na fotobleaching of totdat het herstel een evenwicht lijkt te hebben bereikt.
- Inspecteer visueel het GFP-MAP65-kanaal voor herstel.
8. Data-analyse
OPMERKING: Kwantitatieve analyse van de beelden van tactoïden werd uitgevoerd om meer te weten te komen over de effecten van omgevingsveranderingen die worden opgelegd via verschillende verdringingsmiddelen, ionische omstandigheden en de toevoeging van andere factoren.
- Tactoïde vormkarakterisering
- Kwantificeer de lengte en breedte van de tactoïden uit de rode en groene beelden die zijn gemaakt met confocale microscopie.
- Open de afbeeldingen met FIJI/ImageJ.
- Als onbewerkte gegevens in 16-bits worden genomen, past u indien nodig de helderheid en het contrast aan. Selecteer Afbeelding > helderheid en contrast aanpassen > om de afbeelding aan te passen om de tactoïde duidelijk te kunnen zien. Pas de helderheid en het contrast aan zonder de instelling toe te passen om de intensiteitsgegevens niet per ongeluk te wijzigen.
- Zodra de tactoïden duidelijk zichtbaar zijn, selecteert u goede tactoïden om te meten (figuur 4Bi). Zorg ervoor dat de tactoïden duidelijk zichtbaar zijn zonder overlap met andere tactoïden of aggregaten en niet gekromd of gebogen zijn om rechtlijnige meetinstrumenten te kunnen gebruiken.
- Controleer vervolgens of de juiste pixelgrootte is ingesteld voor de afbeeldingen. De microscoopafbeeldingen worden geleverd met metadata over de pixelgrootte. Wanneer u een andere camera gebruikt die geen metagegevens of externe beelduitbreidingssystemen heeft die de verwachte effectieve pixelgrootte kunnen wijzigen, past u de pixelgrootte handmatig aan. Ga in FIJI/ImageJ naar de > Schaal instellen om de juiste pixelconversie in te stellen.
- Gebruik het gereedschap Rechte lijn van de werkbalk in FIJI/ImageJ, klik op het ene uiteinde van het tactoïde en sleep de cursor naar het andere uiteinde van het tactoïde (figuur 4Bii). Zodra de roi van de regel is geselecteerd, selecteert u Analyseren > meten om de lengte te meten. Als de lengte niet standaard wordt gemeten, moet u de meting zo instellen dat de lengte wordt opgenomen in het dialoogvenster Analyseren > Metingen instellen .
OPMERKING: Meestal geeft het bij het meten met het gereedschap Rechte lijn de lengte en hoek van de getekende lijn weer. Figuur 4Bii toont bijvoorbeeld een rechte lijn die naar de zijkant van de tactoïde is getrokken om de laatste zichtbaar te maken, maar de meting direct op de tactoïde te doen. - Nadat u de meting hebt uitgevoerd, gebruikt u het gereedschap Tekst op de werkbalk om de tactoïde te labelen. Maak een tekstvak, voeg een cijferlabel toe en selecteer Bewerken > tekenen om het label in de afbeelding te corrigeren. Sla de afbeelding op als een afzonderlijk ROI-bestand.
OPMERKING: Door dit bestand te labelen en op te slaan, kan de onderzoeker weten welke meting overeenkomt met welke tactoïde uit de onbewerkte gegevens. Zorg ervoor dat je elke tactoïde één keer meet. - Nadat de tactoïden voor de hele afbeelding zijn gemeten, slaat u de gegevens in het venster Resultaten op in een door komma's of tabs gescheiden tekstbestand (met bestand > Opslaan als) en opent u de gegevens in een spreadsheetprogramma om de gegevens in getallen te parseren. Verzamel alle gegevens samen (onbewerkte afbeeldingsgegevens, ROI-afbeelding en tekstbestand met resultaten) in een map met een geschikte naamgevingsconventie om alles georganiseerd te houden.
OPMERKING: Hoewel tactoïde lengtemetingen met de hand worden uitgevoerd, gezien het feit dat de tactoïde breedtes smal zijn, is het beter om een andere methode te gebruiken voor het meten van tactoïde breedte (zie hieronder) om meetfouten te verminderen. - Teken met ImageJ/FIJI een lijngebied met het gereedschap Rechte lijn . Teken de lijn als een loodrechte bisector naar de tactoïde lange as (figuur 4Bii).
- Selecteer Analyseren > plotprofiel om het intensiteitsprofiel van de lineaire bisector te maken (figuur 4Biii). Er verschijnt een plot. Om de gegevens uit de plot op te halen en op te slaan, selecteert u de knop Lijst linksonder; hiermee wordt de tekstbestandlijst met de intensiteitsgegevens over de lengte van de getekende regel gegenereerd. Sla het tekstbestand op als een .csv of .txt bestand.
- Open het tekstbestand in een passend programma zoals MatLab, Python (sciPy) of andere programma's. Pas de intensiteitsgegevens aan met een Gaussiaanse functie van de vorm:
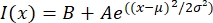 , waarbij I(x) de grijswaardenwaarde is langs de lengte, x; B is het achtergrondniveau; A is de amplitude van de Gauss; μ is het gemiddelde of centrum van de Gauss; en σ is de standaarddeviatie van de Gauss.
, waarbij I(x) de grijswaardenwaarde is langs de lengte, x; B is het achtergrondniveau; A is de amplitude van de Gauss; μ is het gemiddelde of centrum van de Gauss; en σ is de standaarddeviatie van de Gauss. - Rapport 2σ als de breedte van de tactoïde. Schat de intensiteit van de microtubuli in de tactoïde door het gebied onder de Gauss te berekenen (exclusief de achtergrond).
OPMERKING: Als de beelden zich binnen het lineaire intensiteitsbereik van de camera bevinden en met dezelfde belichtingstijd en excitatie-intensiteit zijn genomen, kunnen geïntegreerde intensiteiten worden vergeleken om het relatieve aantal microtubuli in de tactoïde te schatten.
- FRAP-analyse
OPMERKING: Experimenten om de mobiliteit van de microtubuli te testen en de MAP65 gebruikten FRAP om de specifieke fotobleaching en het herstel van intensiteit als gevolg van moleculaire beweging vast te leggen (figuur 5A). De gegevens werden gekwantificeerd uit de beeldtijdreeksgegevens met behulp van ImageJ / FIJI.- Gebruik ImageJ/FIJI om de filmgegevens te openen.
- Registreer de stapels (tijdreeksgegevens) in de loop van de tijd om drift te verwijderen. Gebruik de StackReg-plug-in samen met de aanvullende TurboReg-plug-in ; voor instructies over het gebruik van de plug-ins, raadpleegt u de weblinks in de materiaaltabel. Selecteer vertaling om de positie van de frames te verschuiven en zo de afbeeldingen te registreren.
- Zodra de afbeeldingen zijn geregistreerd om drift te verwijderen, roteert u de afbeelding zodat de tactoïde verticaal of horizontaal in het frame staat door Afbeelding > Transformeren > Roteren te selecteren. Selecteer de hoek die u wilt roteren en gebruik Voorvertoning om te bepalen of de tactoïde voldoende is gedraaid. Wanneer in het voorbeeld wordt aangegeven dat de tactoïde verticaal of horizontaal is, selecteert u OK om alle afbeeldingen in de film te roteren.
- Gebruik het gereedschap Rechthoekselectie op de werkbalk om een rechthoekige sectie te maken over het fotobleekte gebied van de tactoïde. Noteer de geïntegreerde intensiteit van het ROI-gebied voor elk frame met behulp van Image > Stacks > Measure Stack. Stel het meettype in op Geïntegreerde dichtheid met behulp van metingen analyseren > instellen. Sla de geanalyseerde intensiteitsgegevens die in het venster Resultaten worden weergegeven op als een tekstbestand in .csv- of .txt-indeling door Bestand > Opslaan als te selecteren.
OPMERKING: Figuur 5B toont een voorbeeld van de ruwe 16-bits intensiteitsgegevens gemeten voor de microtubule- en GFP-MAP65-kanalen in het bleekgebied. - Aangezien de algehele intensiteit van de beelden in de loop van de tijd wereldwijd zal vervagen als gevolg van fotobleaching veroorzaakt door beeldvorming, moet deze wereldwijde fotobleaching worden gecorrigeerd. Gebruik hiervoor dezelfde ROI-grootte (stap 8.2.4.) en verplaats deze naar een gebied op de achtergrond van de afbeelding waar geen microtubuli of MAP65 zichtbaar zijn. Meet de geïntegreerde intensiteit van de stack zoals beschreven in stap 8.2.4. Sla de resultaten op als een tweede tekstbestand.
OPMERKING: Figuur 5B toont een voorbeeld van de onbewerkte 16-bits intensiteitsgegevens die zijn gemeten voor de microtubule- en GFP-MAP65-kanalen in het achtergrondgebied. - Om de achtergrondvervaging te corrigeren, deelt u de signaalintensiteit op de tactoïde door de achtergrondintensiteit voor hetzelfde tijdstip. Bereken Igecorrigeerd (t) als:
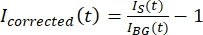 , waarbij IS (t) (het signaal) de meting is die is uitgevoerd op het gebleekte gebied en IBG (t) (de ruis) de meting is die is uitgevoerd op het achtergrondgebied (figuur 5C). Deze berekent de signaal-ruisverhouding voor elk frame en trekt ook de ruis af.
, waarbij IS (t) (het signaal) de meting is die is uitgevoerd op het gebleekte gebied en IBG (t) (de ruis) de meting is die is uitgevoerd op het achtergrondgebied (figuur 5C). Deze berekent de signaal-ruisverhouding voor elk frame en trekt ook de ruis af. - Schaal vervolgens de gegevens opnieuw naar een bereik tussen nul en één met behulp van
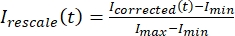 , waarbij Imin en Imax respectievelijk het globale minimum en maximum van de Igecorrigeerde gegevens over de hele tijd aangeven (figuur 5C).
, waarbij Imin en Imax respectievelijk het globale minimum en maximum van de Igecorrigeerde gegevens over de hele tijd aangeven (figuur 5C). - Pas deze gegevens toe aan een vervallen exponentiële van de vorm:
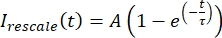 , waarbij A de amplitude van het herstel is en τ de tijdschaal van het herstel (figuur 5C).
, waarbij A de amplitude van het herstel is en τ de tijdschaal van het herstel (figuur 5C).
Met slechts een klein aantal componenten, tubulinedimeer en microtubule crosslinkers kunnen microtubule tactoïden ontstaan (figuur 2A). Hoewel dit protocol incubatie beschrijft om te nucleeren en microtubuli te laten groeien in een incubator, kunnen de nucleatie en groei direct onder de microscoop worden waargenomen (die binnen 30 minuten voltooid zijn) (figuur 2B). De concentratie tubuline wordt constant gehouden op 13,6 μm en MAP65-MT binding op 10%.
Figuur 4 vertegenwoordigt succesvolle gegevens. De tactoïden moeten zichtbaar zijn met zowel een 561 nm laser in het tubulinekanaal als 488 nm in het MAP65-kanaal, die elkaar perfect overlappen (figuur 4A). Een mysterie van het systeem is dat de breedte van de tactoïden niet lijkt te variëren onder een verscheidenheid aan experimentele veranderingen, waaronder het veranderen van de microtubulilengtes, de MAP65-concentratie en de verdringingsmiddelen (figuur 4B) 22,28. De lengte is veel variabeler en hangt af van zowel de microtubulilengtes als de MAP65-concentratie (figuur 4B)22,28.
Bij het uitvoeren van FRAP is waargenomen dat het MAP65-signaal herstelt, maar het microtubule-signaal herstelt niet (figuur 5). Het herstel in FRAP is te danken aan de mobiliteit en beweging van de gelabelde en fotobleached objecten. In het geval van de MAP65 dissociëren de verduisterde moleculen zich van de microtubuli en verplaatsen nieuwe zich naar het gebied (figuur 5). De MAP65-binding is in evenwicht, dus de snelheid van binden en ontkoppelen is gelijk (gemeten in moleculen per seconde). Voor de microtubuli werd geen herstel gezien, wat impliceert dat de microtubuli niet in staat zijn om het tactoïde te verlaten (figuur 5A, Bi, C). Verder werd geen verspreiding van het verduisterde gebied gezien, wat suggereert dat de microtubuli lokaal onbeweeglijk zijn en geen vloeistof in de tactoïde vorm.
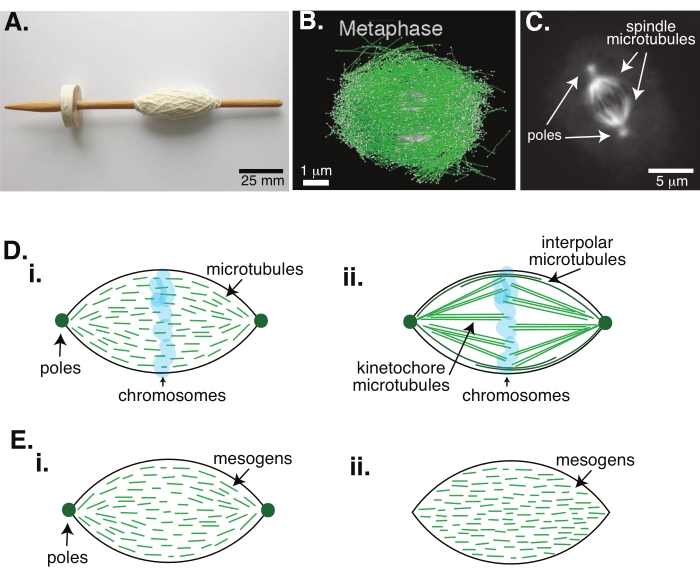
Figuur 1: Verschillende modellen van spindelvorming. Een mitotische spindel is een machine gemaakt van microtubuli en de bijbehorende eiwitten en enzymen die de chromosomen uitlijnt en scheidt in de twee nieuwe dochtercellen tijdens de celdeling. (A) Afbeelding van een vroege middeleeuwen drop spindel replica met fijn garen uit Nederland. Deze figuur is aangepast van een Wikimedia-afbeelding door Peter van der Sluijs30. (B) Driedimensionale reconstructie van microtubuli in verschillende stadia van wild-type meiose II. Microtubuli worden in het groen weergegeven en chromosomen worden in grijs weergegeven. Schaalbalk = 1 μm. Dit cijfer is aangepast van Lantzsch et al.31. (C) Microscopiebeeld van de microtubuli in een mitotische spil van een delende Sf9-cel. De spindelpolen en de microtubuli van de spil zijn gelabeld met een groen fluorescerend eiwit. Schaalbalk = 5 μm. Dit cijfer is aangepast van Advani et al.32. (D) Verschillende modellen van hoe mitotische en meiotische spindelmicrotubuli zijn georganiseerd. (i) Eerder waargenomen voor meiotische spindels gemaakt van Xenopus-ei-extracten, werden de microtubuli (groen) afgeleid als kort en dynamisch in de hele spil. Dit is vergelijkbaar met een bipolaire tactoïde organisatie in een vloeibaar kristal. (ii) Het canonieke model voor microtubule-organisatie in een mitotische spindel heeft twee soorten microtubuli: interpolaire of polaire microtubuli (donkergroen) die crosslinken in de middenzone rond de chromosomen en kinetochore microtubuli (lichtgroen) die worden gebundeld en uitgerekt van de pool naar het kinetochore om de chromosomen te duwen en te trekken. Op alle afbeeldingen worden chromosomen weergegeven in transparant blauw en spindelpolen in donkergroen. (E) Schema's van mesogenen (groene lijnen) in een vloeibaar kristal tactoïde voor (i) bipolaire en (ii) homogene tactoïden. Bipolaire tactoïden hebben twee polen aan het einde van de tactoïde, en de mesogenen heroriënteren zich om naar die polen te wijzen. Homogene tactoïden hebben polen op oneindig en de mesogenen veranderen niet van oriëntatie langs de lengte van het tactoïde. Klik hier om een grotere versie van deze figuur te bekijken.
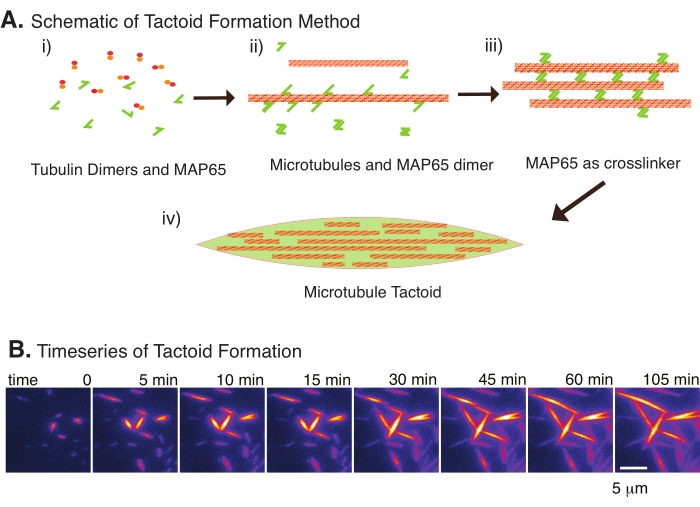
Figuur 2: Microtubule condensatie. (A) Microtubuli kunnen worden gebundeld en verknoopt door een verscheidenheid aan methoden, waaronder ionische soorten, uitputtingskrachten veroorzaakt door verdringingsmiddelen en specifieke microtubule crosslinkers, zoals MAP65. (i) Tubulinedimmeren en MAP65-eiwitten worden gemengd tot nucleate en groeien microtubuli. (ii) Microtubuli nucleeren en groeien uit de tubuline, en MAP65 bindt onmiddellijk aan microtubuli, een ander MAP65-monomeer, of beide en veroorzaakt bundeling. (iii) Microtubuli in de verknoopte bundels nucleeren en groeien. (iv) De uiteindelijke configuratie is een microtubuli tactoïde vergelijkbaar met een spindel. (B) Tijdreeksen van microtubuli tactoïden die gedurende 105 minuten nucleeren en groeien. Schaalbalk = 5 μm. Figuur aangepast van Edozie et al.22. Klik hier om een grotere versie van deze figuur te bekijken.
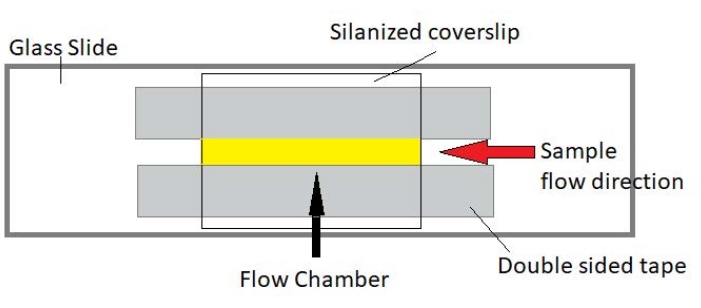
Figuur 3: Stromingskamerassemblage. De stromingskamer is gemaakt met behulp van een glazen schuif, gesiliciseerd afdekglas en permanente dubbelzijdige tape. Het geel gemarkeerde gebied is het stroompad waar het monster wordt gestroomd en waargenomen. Het volume van de stroomkamer is ~ 20 μL. Epoxy werd gebruikt om de uiteinden van de kamer af te dichten om te voorkomen dat het monster verdampt tijdens langdurige beeldvorming gedurende enkele uren. Klik hier om een grotere versie van deze figuur te bekijken.
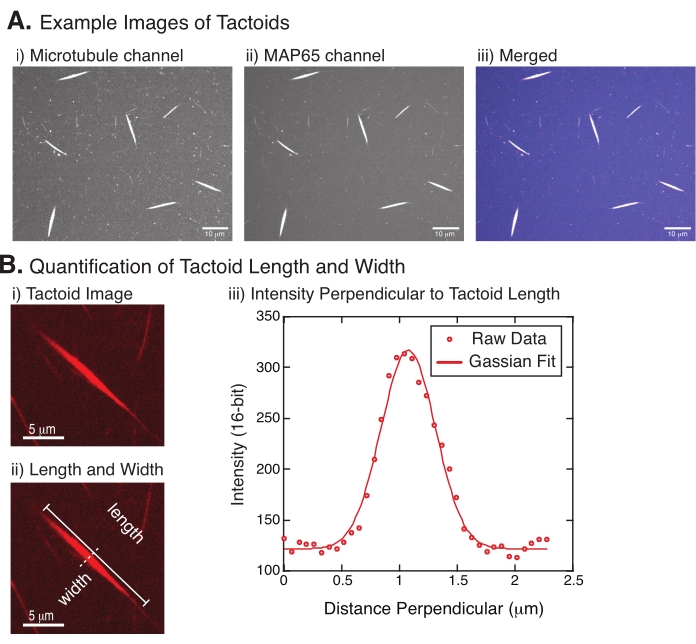
Figuur 4: Tactoïde afbeeldingen en lengte- en breedteanalyse. (A) Voorbeeldgegevens van tactoïden gevormd zoals beschreven en afgebeeld met behulp van draaiende schijf confocale tonen (i) microtubule kanaal beeldvorming rhodamine-gelabelde tubuline met behulp van een 561 nm laser, (ii) GFP-MAP65 kanaal imaging van de GFP met behulp van een 488 nm laser, en (iii) samengevoegde overlay beeld van de microtubuli kanaal (magenta) en GFP-MAP65 kanaal (cyaan). Overlapgebieden worden weergegeven als wit en tonen aan dat de microtubuli en MAP65 precies colocaliseren. Schaalbalk = 10 μm voor alle afbeeldingen in (A). (B) Kwantificering van de tactoïde lengte en breedte. (i) Afbeelding van een tactoïde die zonder labels moet worden geanalyseerd. Schaalbalk = 5 μm. (ii) Dezelfde afbeelding als in (i), waarbij de lengte (ononderbroken lijn met lijnkappen) en breedte (stippellijn) metingen worden aangegeven. Schaalbalk = 5 μm. (iii) De breedte werd gemeten door het intensiteitsprofiel over het tactoïde te nemen op de loodrechte bisector (stippellijn) aangegeven in (ii). Het intensiteitsprofiel was geschikt voor een Gaussische functie om de amplitude en breedte van het tactoïde te onthullen. Klik hier om een grotere versie van deze figuur te bekijken.
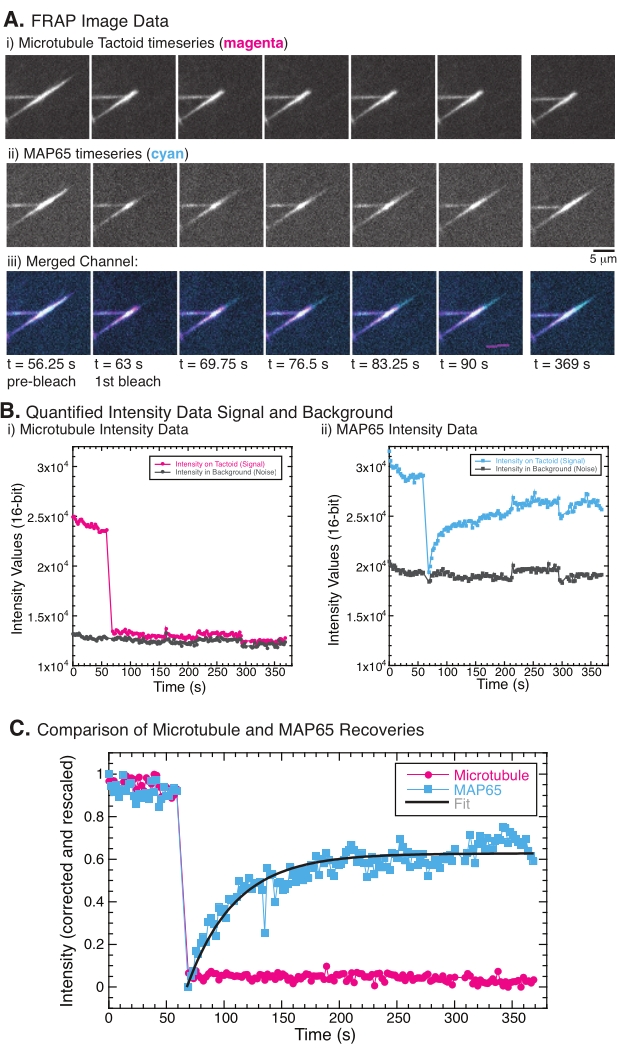
Figuur 5: Representatieve FRAP-gegevens en -analyse. (A) Microscopietijdreeksgegevens van (i) microtubule tactoïde en (ii) GFP-MAP65, en (iii) overlaybeeld van beide kanalen met microtubuli in magenta en GFP-MAP65 in cyaan die werden gefotobleacheerd op tijd 63 s en waargenomen gedurende nog eens 5 minuten. (B) Gekwantificeerde intensiteit van de (i ) microtubulikanaal in het gebleekte gebied (magentacirkels) en de achtergrond (donkergrijze cirkels) en (ii) GFP-MAP65-kanaal in het gebleekte gebied (cyaanvierkanten) en de achtergrond (donkergrijze vierkanten). (C) De gegevens werden gecorrigeerd voor de achtergrondruis en opnieuw geschaald voor het microtubulikanaal (magentacirkels) en het GFP-MAP65-kanaal (cyaanvierkanten). De microtubuli herstellen zich niet, maar de GFP-MAP65 wel en kan worden aangepast (donkergrijze lijn) aan een stijgend exponentieel verval om de amplitude en de tijdschaal van herstel te vinden. Klik hier om een grotere versie van deze figuur te bekijken.
De hier beschreven methoden zijn in verschillende artikelen gebruikt om microtubuli tactoïden te maken (figuur 2)22,28. Deze experimenten zijn biologisch relevant om de organisatieprincipes te helpen ontdekken die de vorm en stabiliteit van de mitotische of meiotische spindel in de meeste celtypen beheersen. Bovendien zijn microtubuli model vloeibare kristal mesogenen die kunnen helpen bij het leren van meer over hoe vloeibare kristallen nucleate en groeien nematische fasen uit isotrope fasen.
De hier beschreven procedure heeft verschillende voordelen voor het verkennen van microtubule zelforganisatie. Ten eerste is het zeer reproduceerbaar, omdat het in het lab is uitgevoerd door veel studenten, waaronder middelbare scholieren, met weinig voorkennis of training voordat ze in het lab begonnen. De tactoïden zijn birefringent22, waardoor ze naast fluorescentiemicroscopie ook in doorgelaten licht kunnen worden bekeken, waardoor deze methode toegankelijk is voor veel laboratoria en deze experimentele procedure kan worden aangepast aan educatieve doeleinden, naast hoogwaardig onderzoek. Ten slotte opent dit proces wegen om biologische systemen te blijven begrijpen en onderzoeken in een uitgeklede, reductionistische benadering, waardoor men kan begrijpen hoe elke aanvullende aandoening, eiwit of additief de zelforganisatie van tactoïden en, misschien, uiteindelijk, de spil kan veranderen. Doelen voor betere biomimicry zijn activiteit, vloeibaarheid en filamentpolariteitssortering.
Er kunnen verschillende factoren zijn die van invloed zijn op het experiment en onverwachte resultaten opleveren. Als de tactoïden zich bijvoorbeeld niet vormen (figuur 2) maar waaierachtige patronen worden waargenomen, is de MAP65 waarschijnlijk niet aanwezig of niet bindend aan de microtubuli22,28. Dit zou ook duidelijk moeten zijn in het MAP65-fluorescentiekanaal, omdat de GFP-MAP65 niet gebonden is aan de microtubuli.
Als de tactoïden zich niet vormen en de achtergrond als spikkels op het glas verschijnt, kan dit te wijten zijn aan de oppervlaktecoating. Eenmaal uitgevoerd, duurt de silanisatie slechts 1 maand op coverslips. Wanneer het slijt, kan de tubuline zich niet-specifiek aan het blootgestelde oppervlak binden. Deze binding zal in vreemde patronen plaatsvinden.
Als de tactoïden zich niet vormen en de tubuline wordt waargenomen in aggregaten van verschillende vormen en maten, kan dit te wijten zijn aan tubuline van slechte kwaliteit. Tubuline kan worden gecentrifugeerd om initiële aggregaten te verwijderen die deze off-pathway aggregatie kunnen aansturen in plaats van microtubule polymerisatie. Als het oppervlak zich aan de tubuline bindt, kan het ook de tubuline in de oplossing uitputten. Lage concentraties tubuline, onder de kritische concentratie voor het polymeriseren van microtubuli, kunnen resulteren in aggregaten.
In FRAP-experimenten, als het MAP65-kanaal geen herstel vertoont (figuur 5), is het mogelijk dat de fotobleaching de microtubuli fotode. Fotoschade veroorzaakt de gelokaliseerde vernietiging van de filamenten. Dit kan worden gecontroleerd door onderzoek in het zendkanaal. Microtubule tactoïden zijn zichtbaar in het overgedragen kanaal door een hoge brekingsindex die niet overeenkomt met het omringende water. Door licht geïnduceerde fotoschade zal verschijnen als een brandmerk of verlies van contrast in doorgelaten lichtbeeldvorming op de locatie van de ROI die wordt blootgesteld aan fotobleaching. Als dit gebeurt, moet de laser- of lichtkracht worden verminderd om de fotoschade van de eiwitten te remmen.
Er waren verschillende uitdagingen in deze procedure en aanpak. Een probleem is dat de lengtemetingen momenteel met de hand worden uitgevoerd door op de afbeelding te klikken. Deze methode, hoewel eenvoudig, kan leiden tot grote onzekerheid. De breedtemeting die de doorsnede gebruikt en past bij een Gauss is een betere methode om de grootte te kwantificeren. Een vergelijkbare methode zou kunnen worden gebruikt voor de lengte. Een tweede probleem is dat de tactoïden, omdat ze zo lang en dun zijn, soms kunnen buigen. Dit maakt het kwantificeren van de lengte moeilijker. De contourlengte kan worden gekwantificeerd met behulp van een gesegmenteerde lijn, maar er is extra onzekerheid telkens wanneer een segment wordt toegevoegd.
Vanuit een wetenschappelijk perspectief heeft deze benadering enkele andere uitdagingen voor het gebruik ervan als model voor vloeibare kristallen of spindels. De eerste uitdaging was de lange, dunne vorm van de tactoïden die microtubuli creëren (figuur 3 en figuur 4). Zoals opgemerkt in eerdere publicaties22, zijn microtubule tactoïden homogene tactoïden, niet bipolair. Dit betekent dat de microtubuli waaruit de vorm bestaat, zich niet heroriënteren om naar de uiteinden van de structuur te wijzen. In plaats daarvan zijn alle microtubuli evenwijdig aan de lange as en bevinden de "polen" zich op oneindig. Dit is heel anders dan de tactoïden die worden waargenomen voor moleculaire vloeibare kristallen of zelfs voor actine of DNA dat ook kan fungeren als vloeibare kristal mesogenen. In deze andere systemen zijn de tactoïden bipolair en, wanneer ze worden bekeken in gekruiste polarisatoren, vertonen ze de veelbetekenende tekenen van heroriëntatie van de staven.
Een tweede grote uitdaging in dit systeem is dat de microtubuli onbeweeglijk zijn in de tactoïde. Dit blijkt duidelijk uit FRAP-experimenten en -analyse omdat het herstel van de microtubuli zeer laag is. Hun vaste aard maakt microtubuli tactoïden minder waardevol dan grootschalige vloeibare kristalanalogen. De nematische fase van een vloeibaar kristal moet zowel vloeibare (vloeistof) als kristal (georganiseerde) eigenschappen hebben. Hoewel de vorm goed lijkt voor de spindel, maakt de immobiliteit het systeem minder opwindend als een model mitotische spindel. Aan de andere kant biedt dit probleem mogelijkheden om te onderzoeken hoe men de experimenten kan aanpassen om meer vloeibaarheid in het systeem te creëren.
Deze wetenschappelijke uitdagingen bieden spannende kansen die nieuwe kennis over het systeem mogelijk maken. Om de microtubuli tactoïden meer bipolair te maken, zou men kortere microtubuli kunnen gebruiken. Er is echter een extra uitdaging, omdat microtubuli niet veel goed gekarakteriseerde capping-eiwitten hebben om de lengte te beheersen zoals actine dat doet. Het gebruik van nucleatie en groei vereist het gebruik van zeer hoge concentraties tubuline en GMPCPP om korte microtubuli te maken. De hoge tubulineconcentratie resulteert in een groter aantal filamenten in het systeem, waardoor het moeilijker wordt om tactoïden van elkaar te scheiden. De toevoeging van nieuwe microtubule cappers, zoals DARPin33, kan helpen bij deze situatie. Het tweede probleem dat de microtubuli onbeweeglijk zijn, kan worden verzacht door de toevoeging van motoreiwitten, zoals kinesine-534, tetrameren van motoren die bij mitose worden gebruikt. Als alternatief kunnen kunstmatige dimeren van dimerische kinesine-1 worden gebruikt15.
Een andere manier om meer vloeibaarheid toe te voegen, zou zijn om de microtubuli hun dynamische instabiliteit te laten uitvoeren, het groeien en krimpen van microtubuli. Momenteel zijn microtubuli die worden bezaaid met stabiele GMPCPP-filamenten en vervolgens dynamische instabiliteit ondergaan, veel langer dan gewenst om een spindel of tactoïde te vormen, wat zou resulteren in zeer lange organisaties zoals fans of bundels. Het toevoegen van microtubule dynamische instabiliteit zou dus zorgvuldig moeten worden gedaan om de tactoïde vorm te behouden. De toevoeging van geassocieerde eiwitten en enzymen die de lengte kunnen regelen, kan dit probleem verminderen. Bijvoorbeeld, het depolymeriseren van kinesines, zoals kinesine-1335, of het scheiden van enzymen, zoals katanine36, zou waarschijnlijk nodig zijn. Deze experimenten zijn complex en moeilijk, hoewel ze zeer inzichtelijk zouden zijn, ongeacht wat de resultaten onthullen. Welke richting toekomstige experimenten ook opgaan, het hier ontwikkelde platform voor het maken van microtubule tactoïden kan nieuwe informatie blootleggen op de fysieke basis van microtubule organisatie.
De auteurs verklaren dat zij geen concurrerende financiële belangen hebben.
De auteurs willen alle leden van het Ross Lab in de zomer van 2021, in het bijzonder K. Alice Lindsay, bedanken voor hun hulp. Dit werk werd ondersteund door een subsidie van NSF BIO-2134215 die S. Sahu, N. Goodbee, H.B. Lee en J.L. Ross ondersteunde. Een subsidie van de KECK Foundation (Rae Anderson, USD, lead PI) ondersteunde R. Branch en P. Chauhan gedeeltelijk
| Name | Company | Catalog Number | Comments |
| 2% Dichlorodimethylsilane | GE Healthcare | 118945 | A hydrophobic silane surface treatment. This can be resused upto three times and kept at room temperature for one year. |
| 5-minute epoxy | Bob Smith Industries | For sealing experimental chambers | |
| Acetone | Fisher | 32900HPLC | 100% |
| BL21 cells | Bio Labs | C2527I | Competent bacterial cells used to express MAP65 |
| Catalase | Sigma | C30-500MG | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C for upto one year. |
| Coverslips (22 mm x 22 mm or 22 mm x 30 mm) | Fisher | 12544-AP | For experimental chambers |
| Dithiothreitol | Sigma | 43815-5G | A small molecule that is used to break disulfide bonds and scavenge oxygen. A 1 M stock is made from powder (Sigma) in ddH2O. The solution is aliquoted and stored at -20C for upto one year. The aliquots are used 7-8 times then discarded. |
| EGTA | Sigma | E3889-10G | Tubulin buffer base ingredient |
| Eppendorf 0.5 ml tubes | Eppendorf | 05 402 18 | For holding experimental solutions |
| Ethanol | Fisher | 111000200 | 200 proof |
| Filter paper | Whatman | 1004-110 | For cleaning and for pulling solutions through experimental chambers |
| Fluorescence microscope with high NA objectives | Nikon | Ti-E, W2 Confocal | For imaging experiments |
| Freezer -20°C | Fisherbrand | 13986148 | For storing reagents |
| Freezer -80°C | Thermo scientific | 328223H01-C | For storing proteins. |
| Glass containers for silanization | Michaels | For preparing experimental chambers - treating cover glasses | |
| Glass slides | Fisher | 12544-4 | For experimental chambers |
| Glucose | Sigma | G7528-250G | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C. |
| Glucose oxidase | Sigma | G2133-250KU | Part of the oxygen scavenging system. This is stored at 4°C for upto one year. |
| GMPCPP | Jenna Bioscience | NU-4055 | Slowly hydrolyzable analog of GTP used to polymerize and stabilize the microtubules by reducing the dynamic instability and spontaneous critical concentration for microtubule nucleation to get a consistent length. We purchase a 10 mM stock from Jena Biosciences and store it at -20°C for upto one year. |
| Heating element for microscope | Okolab stage top incubator | For imaging experiments | |
| Imidizole | Sigma | I2399 | Used to elute MAP65 protein from Nickel beads to purify MAP65 |
| Kimwipes | Fisher | 34155 | For cleaning and for pulling solutions through experimental chambers. |
| KOH | Sigma | P250-500 | 1 M in ddH2O, made fresh to prevent acidification over time. |
| Liquid Nitrogen | Airgas | NI 230LT22 | To drop freeze aliquots. This can also be used for storage (not recommended) |
| MAP65 protein | Ram Dixit | A microtubule-associated protein (MAP) with a molecular weight of 65 kD that is an antiparallel microtubule crosslinker. We have purified an unlabeled and GFP-labeled version of MAP65-1 from Arabidopsis thaliana. We mix the GFP-MAP65 with the unlabeled MAP65 such that 10% of the protein is labeled. The working stock is a 10.8 μM solution. This working solution is stored at 4°C and remade fresh every week. The protocol for purifying the MAP65 and GFP-MAP65 is given in our prior methods chapter (26). | |
| MgSO4 | Sigma | MKCJ940 | Tubulin buffer ingredient |
| NTA-Nickel beads | Qiagen | 30210 | Beads required to purify 6xHis tagged MAP65 proteins |
| Optomicroscan | Nikon | 405 nm laser system which can focus the laser in any desired shape of region of interest | |
| PEM80 | Neutral tubulin polymerizing base buffer for solution made from 80 mM K-PIPES, pH 6.8, 1 mM MgSO4, 1 mM EGTA, stored at 4°C for upto one year. | ||
| Permanent double-sided tape | 3M - Scotch | 34-8724-5691-7 | For experimental chambers |
| Petri dish | Fisher | FB0875713 | For humid chamber |
| PIPES | Sigma | P7643-100G | Tubulin buffer base ingredient |
| Pluronic-F127 | Sigma | P2443-250G | A block-copolymer with two hydrophilic polyethylene oxide (PEO) blocks on the ends and a hydrophobic center block of polyphenylene oxide (PPO) hydrophobic surface coating we use to prevent protein binding to the surface. Pluronic-F127 is purchased as a powder (Sigma) and dissolved to a 5% (w/v) solution in ddH2O overnight. Once dissolved, the solution can be stored at room temperature for upto one year. |
| Polyethylene Glycol | Affymetrix Inc | 19966 500 GM | A crowding agent used to create depletion forces to bring tactoids to the surface and help to organize microtubules. We create a 5% (w/v) solution of 100 kDa PEG in PEM80. The solution is stored in 4°C for upto one year and placed on the rocker before use. It is viscous, so we recommend using a positive displacement pipette to work with it. |
| Positive displacement pipette | Eppendorf | For pipetting viscous liquids | |
| Racks for coverslips | Electron Microscopy Sciences | 72240 | For preparing experimental chambers - treating cover glasses |
| Refrigerator 4°C | Fisherbrand | For storing reagents | |
| Tubulin Labeled | Cytoskeleton | TL590M | lyophilized rhodamine-labeled tubulin from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| Tubulin protein | Cytoskeleton | T240 | lyophilized tubulin 99% pure unlabeled from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| UV-Ozone | Jelight | Model 342 | For preparing experimental chambers - treating cover glasses |
| Stackreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/stackreg/ | plugin for registering time series data to remove drift |
| Turboreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/turboreg/ | plugin for registering time series data to remove drift |
- Bodakuntla, S., Jijumon, A. S., Villablanca, C., Gonzalez-Billault, C., Janke, C. Microtubule-associated proteins: structuring the cytoskeleton. Trends in Cell Biology. 29 (10), 804-819 (2019).
- Severson, A. F., von Dassow, G., Bowerman, B. Oocyte meiotic spindle assembly and function. Current Topics in Developmental Biology. 116, 65-98 (2016).
- Brugués, J., Needleman, D. Physical basis of spindle self-organization. Proceedings of the National Academy of Sciences of the United States of America. 111 (52), 18496-18500 (2014).
- Brugués, J., Nuzzo, V., Mazur, E., Needleman, D. J. Nucleation and transport organize microtubules in metaphase spindles. Cell. 149 (3), 554-564 (2012).
- Gatlin, J. C., et al. Spindle fusion requires dynein-mediated sliding of oppositely oriented microtubules. Current Biology. 19 (4), 287-296 (2009).
- Goshima, G., Mayer, M., Zhang, N., Stuurman, N., Vale, R. D. Augmin: A protein complex required for centrosome-independent microtubule generation within the spindle. Journal of Cell Biology. 181 (3), 421-429 (2008).
- Inoue, S., Sato, H. Cell motility by labile association of the nature of mitotic spindle fibers and their role in chromosome movement molecules. Journal of General Physiology. 50 (6), 259-292 (1967).
- Allenspach, A. L., Roth, L. E. Structural variations during mitosis in the chick embryo. Journal of Cell Biology. 33 (1), 179-196 (1967).
- Theg, D. E. Cytoplasmic microtubules in different animal cells. Journal of Cell Biology. 23 (2), 265-275 (1964).
- Mcdonald, K., Pickett-Heaps, J. D., Mcintosh, J. R., Tippit, D. H. On the mechanism of anaphase spindle elongation in Diatoma vulgare. Journal of Cell Biology. 9, 377-388 (1977).
- Chaikin, P. M., Lubensky, T. C. . Principles of Condensed Matter Physics. , (1995).
- Hamon, L., Savarin, P., Curmi, P. A., Pastré, D. Rapid assembly and collective behavior of microtubule bundles in the presence of polyamines. Biophysical Journal. 101 (1), 205 (2011).
- Needleman, D. J., et al. Higher-order assembly of microtubules by counterions: From hexagonal bundles to living necklaces. Proceedings of the National Academy of Sciences. 101 (46), 16099-16103 (2004).
- Ross, J. L., Fygenson, D. K. Mobility of taxol in microtubule bundles. Biophysical Journal. 84, 3959-3967 (2003).
- Sanchez, T., Welch, D., Nicastro, D., Dogic, Z. Cilia-like beating of active microtubule bundles. Science. 333 (6041), 456-459 (2011).
- Brandt, R., Lee, G. Functional organization of microtubule-associated protein tau. Identification of regions which affect microtubule growth, nucleation, and bundle formation in vitro. Journal of Biological Chemistry. 268 (5), 3414-3419 (1993).
- Hirokawa, N. Microtubule organization and dynamics dependent on microtubule-associated proteins. Current Opinion in Cell Biology. 6 (1), 74-81 (1994).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. The Journal of Cell Biology. 109 (3), 1173 (1989).
- MacRae, T. H. Microtubule organization by cross-linking and bundling proteins. Biochimica et Biophysica Acta (BBA). Protein Structure and Molecular Enzymology. 1160 (2), 145-155 (1992).
- She, Z. Y., Wei, Y. L., Lin, Y., Li, Y. L., Lu, M. H. Mechanisms of the Ase1/PRC1/MAP65 family in central spindle assembly. Biological Reviews. 94 (6), 2033-2048 (2019).
- Walczak, C. E., Shaw, S. L. A MAP for Bundling Microtubules. Cell. 142 (3), 364-367 (2010).
- Edozie, B., et al. Self-organization of spindle-like microtubule structures. Soft Matter. 15 (24), 4797-4807 (2019).
- Tulin, A., McClerklin, S., Huang, Y., Dixit, R. Single-molecule analysis of the microtubule cross-linking protein MAP65-1 reveals a molecular mechanism for contact-angle-dependent microtubule bundling. Biophysical Journal. 102 (4), 802-809 (2012).
- Chan, J., Jensen, C. G., Jensen, L. C. W., Bush, M., Lloyd, C. W. The 65-kDa carrot microtubule-associated protein forms regularly arranged filamentous cross-bridges between microtubules. Proceedings of the National Academy of Sciences of the United States of America. 96 (26), 14931-14936 (1999).
- Scheff, D. R., et al. Tuning shape and internal structure of protein droplets via biopolymer filaments. Soft Matter. 16 (24), 5659-5668 (2020).
- Weirich, K. L., et al. Liquid behavior of cross-linked actin bundles. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2131-2136 (2017).
- Weirich, K. L., Dasbiswas, K., Witten, T. A., Vaikuntanathan, S., Gardel, M. L. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences of the United States of America. 166 (23), 11125-11130 (2019).
- Sahu, S., Herbst, L., Quinn, R., Ross, J. L. Crowder and surface effects on self-organization of microtubules. Physical Review E. 103 (6), 062408 (2021).
- Stanhope, K. T., Ross, J. L. Microtubules, MAPs, and motor patterns. Methods in Cell Biology. 128, 23-38 (2015).
- Early Middle Ages drop single.jpg. Wikimedia Commons Available from: https://commons.wikimedia.org/wiki/File:Early_middle_ages_drop_spingle.jpg (2022)
- Lantzsch, I., et al. Microtubule reorganization during female meiosis in c. Elegans. eLife. 10, 58903 (2021).
- Advani, S., Maresca, T. J., Ross, J. L. Creation and testing of a new, local microtubule-disruption tool based on the microtubule-severing enzyme, katanin p60. Cytoskeleton. 75 (12), 531-544 (2018).
- Pecqueur, L., et al. A designed ankyrin repeat protein selected to bind to tubulin caps the microtubule plus end. Proceedings of the National Academy of Sciences of the United States of America. 109 (30), 12011-12016 (2012).
- Valentine, M. T., Fordyce, P. M., Krzysiak, T. C., Gilbert, S. P., Block, S. M. Individual dimers of the mitotic kinesin motor Eg5 step processively and support substantial loads in vitro. Nature Cell Biology. 8 (5), 470-476 (2006).
- Wagenbach, M., Domnitz, S., Wordeman, L., Cooper, J. A kinesin-13 mutant catalytically depolymerizes microtubules in ADP. Journal of Cell Biology. 183 (4), 617-623 (2008).
- McNally, F. J., Vale, R. D. Identification of katanin, an ATPase that severs and disassembles stable microtubules. Cell. 75 (3), 419-429 (1993).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved