Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biochemistry
הרכבה עצמית של טקטואידים מיקרוטובולים
מאמר זה מציג פרוטוקול להיווצרות מכלולים של מיקרוטובולים בצורת טקטואידים תוך שימוש ב-MAP65, קרוסלינקר מיקרוטובולים על בסיס צמחי, ו-PEG כסוכן צפיפות.
השלד הציטוסקלטון אחראי על הארגון הפנימי העיקרי ועל הארגון מחדש בתוך התא, כל זאת ללא מנהל שינהל את השינויים. זה במיוחד המקרה במהלך מיטוזה או meiosis, שבו microtubules ליצור את הציר במהלך חלוקת התא. הציר הוא המנגנון המשמש להפרדת חומר גנטי במהלך חלוקת התאים. לקראת יצירת צירים המאורגנים בעצמם במבחנה, פיתחנו לאחרונה טכניקה לשילוב מחדש של מיקרו-טובולים למכלולים דמויי ציר עם קבוצה מינימלית של חלבונים הקשורים למיקרוטובולים וסוכני צפיפות. באופן ספציפי, נעשה שימוש ב- MAP65, שהוא קרוסלינקר מיקרוטובול אנטי-פאראלי מצמחים, הומולוג של Ase1 משמרים ו- PRC1 מאורגניזמים יונקים. לינקר צולב זה מארגן בעצמו מיקרו-טובולים לתוך מכלולים ארוכים, דקים, דמויי צירים, המאורגנים בעצמם. מכלולים אלה דומים גם לטקטואידים של גבישים נוזליים, ומיקרוטובולים יכולים לשמש כמזוגנים מזוקליים. כאן מוצגים פרוטוקולים ליצירת טקטואידים מיקרוטובולים אלה, כמו גם לאפיון צורת המכלולים באמצעות מיקרוסקופיה פלואורסצנטית וניידות המרכיבים באמצעות התאוששות פלואורסצנטית לאחר הפוטו-הלבנה.
חלוקת תאים באמצעות מיטוזה היא אחד התהליכים הביולוגיים החשובים ביותר לקיום חיים. חוטי המיקרוטובול, המורכבים מדימרים של טובולין, הם מרכיבים מבניים חיוניים של תהליך זה. המנגנון הארעי שנוצר במטפאזה כאשר הכרומוזומים מתיישרים במרכז התא נקרא הציר המיטוטי בשל צורתו, שהוא כמו ציר של נול המכוסה בחוטים (איור 1A). באורגניזמים רבים מבוסס היטב שמיקרוטובולים משמשים במטפאז כדי לדחוף ולמשוך כרומוזומים מרוכזים למרכז התא, ליישר אותם ולחבר אותם למיקרוטובולים שימשכו אותם זה מזה באנאפאזה (איור 1B,C). צורות הציר הן במיוזה (איור 1B) והן במיטוזה (איור 1C), שנוצרו ממיקרוטובולים חופפים רבים שאינם עטופים סביב הציר המרכזי כמו חוט אלא פועלים במקביל לממשק. יצירת מבנים מבוססי מיקרו-טובולים אלה דורשת חלבונים קשורים המקשרים קשרים זה לזה ואנזימים נלווים שיכולים לשמש כמנועים כדי לעזור לדחוף ולמשוך את הכרומוזומים1.
מחקרים על צירים מיוטיים הראו שהמיקרוטובולים קצרים, דינמיים וחופפים במערכים מקושרים 2,3,4,5,6 (איור 1Di). בשל הארגון הפיזי של המיקרוטובולים הקצרים האלה, הציר המיוטי דומה לטקטואיד גבישי נוזלי (איור 1E). ואכן, הודגם כי צירים מתלכדים ומתמזגים, כפי שניתן היה לצפות מטקטואידים של גבישים נוזליים5.
מחקרים רבים שראשיתם בשנות ה-60 של המאה ה-20 השתמשו בקיבוע, בקטעים סדרתיים ובמיקרוסקופיית אלקטרונים כדי לקבוע כי ישנם שני סוגים של מיקרוטובולים בתוך הציר המיטוטי 7,8,9,10. הסוג הראשון נקרא מיקרוטובולים קינטוצ'ור, המחברים את מוט הציר לקינטוכור. הסוג השני נקרא מיקרו-טובולים אינטר-קוטביים או קוטביים, שגדלים מעבר לכרומוזומים וחופפים באזור האמצע (איור 1Dii)8,9,10. סוג שלישי נקרא מיקרוטובולים אסטרליים, שנמצאים מחוץ לציר ומחברים את הקטבים לקצה התא; ארגונים מיקרו-טובים אלה נמצאים מחוץ לתחום הדיון הנוכחי. לאחרונה נערכו מחקרים על האינטראקציה בין אוגמין6 לבין קומפלקס טבעות גמא-טובולין המשפיעים על מרכזי נוקלאציה של מיקרוטובולים, וכתוצאה מכך נוצר ציר מיטוטי עם מיקרוטובולים קצרים יותר כמו באיור 1D.
מאחר שמיקרו-טובולים ארוכים יותר מכפי שהם רחבים, עם יחס גובה-רוחב גבוה ונוקשות גבוהה, הם דומים לגרסאות מוגדלות של מולקולות גביש נוזלי. בפיזיקה של חומר רך, אטומים ומולקולות הוערכו באמצעות אינטראקציות מינימליות כדי להסיק את המנגנונים הפיזיקליים של מעברי פאזה, כולל נוקלאציה והמסת גבישים11. באופן דומה, מיקרוטובולים הם עצמים מזוקליים שהם גרסאות מוגדלות של מולקולות גבישיות נוזליות, מה שנותן תובנות על הפיזיקה של הדינמיקה של גבישים נוזליים, כולל נוקלאציה וצמיחה של הפאזות הנמטיות מאלו האיזוטרופיות. יתר על כן, כפי שפורט לעיל, הציר המיוטי מציג תכונות כמו אלה של טקטואיד גבישי נוזלי, מצב נמאטי שנובע וצומח מהמצב האיזוטרופי של מולקולות גבישיות נוזליות 3,4,5. עבור טקטואידים, נוקלאציה וצמיחה הם כמו של גבישים אחרים (כלומר, דורשים ריכוז גבוה יחסית של מזוגנים [המולקולות היוצרות גבישים נוזליים]). צורת ה"ציר" הייחודית של הטקטואיד מגיעה מהיישור המקומי של מזוגני הגביש הנוזלי שמתיישרים לפאזה הנמטית (איור 1E). הם אינם יכולים ליצור גביש מעוגל מכיוון שהמולקולות הן מאוד אסימטריות. בהתחשב באופיים של המיקרוטובולים, זה אולי לא מפתיע שמכונות הציר המיטוטיות העשויות מריכוז מקומי גבוה של מיקרוטובולים הן גם בעלות אותה צורה, בין אם הן נקראות טקטואיד או ציר. טקטואידים יכולים להיות דו-קוטביים, עם קטבים בקצוות המחודדים (איור 1Ei), או הומוגניים, עם קטבים ביעילות באינסוף (איור 1Eii).
בהתחשב בחשיבות של היווצרות צירים, נעשו מאמצים לקראת היווצרות צירים מאורגנת עצמית במבחנה על ידי הדגמת עיבוי מיקרוטובולים לתוך צרורות באמצעות מינים יוניים12,13, סוכני צפיפות היוצרים אינטראקציות דלדול14,15, וחלבוני קישור צולבים ספציפיים של מיקרוטובולים 13,16,17,18,19, 21. באופן מפתיע, למרות שסוכנים אלה כולם פועלים כדי להגדיל את הריכוז המקומי של מיקרוטובולים, לעתים קרובות הם גורמים לחבילות מיקרוטובולים ארוכים אך לא לטקטואידים. אחת הסיבות לכך שצרורות אלה ארוכים יכולה להיות שגם המיקרוטובולים המרכיבים אותם ארוכים. עבודות אחרונות באמצעות מיקרוטובולים קצרים יותר דיווחו גם על צרורות ארוכים יותר שאינם מחודדים בסוף15; במקרה זה, הצרורות מוחזקים יחד עם חלבונים מוטוריים הגורמים להרחבה של הצרורות, ובכך הופכים אותם לארוכים יותר. מיקרוטובולים קצרים עם קרוסלינקרים שאינם מורחבים נחוצים למכלולים מחודדים דמויי ציר, כפי שמתואר כאן.
לאחרונה, פיתחנו טכניקה המאפשרת יצירת טקטואידים של מיקרוטובולים באמצעות ה-crosslinker האנטי-פאראלי, MAP65, בנוכחות מיקרו-טובולים יציבים22. המיקרוטובולים היו צריכים להיות קצרים, אך מעטים הרגולטורים הידועים באורך המיקרוטובולים שיכולים להכביד על מיקרוטובולים מפני חוסר יציבות דינמית או חישול מקצה לקצה. במקום זאת, GMPCPP שימש לגרעין וייצוב החוטים לאחר הגדילה. זה איפשר ליצור צפיפות גבוהה של מיקרוטובולים קצרים שיכולים להתארגן בעצמם לטקטואידים. טקטואידים אלה היו הומוגניים כאשר צפו בהם תחת דו-פרצופיות. בנוסף למיקרו-טובולים קצרים, נעשה שימוש ב-crosslinker אנטי-פאראלי ספציפי, MAP65, כדי ליצור את הטקטואידים (איור 2). MAP65 הוא חלבון הקשור למיקרוטובולים צמחיים במשפחת ה-PRC1/Ase1 של קרוסלינקרים מיטוטיים23. MAP65 קיים כדימר, עם זיקה חזקה להיקשר לעצמו כמו גם למיקרוטובולים24. שלא כמו הציר המיוטי והטקואידים שנצפו עם חוטי אקטין 25,26,27, שהם דו קוטביים ובעלי תכונות דמויות נוזל של גבישים נוזליים, טקטואידים מיקרוטובולים נצפו כמוצקים כמו 22,28.
כאן, מוצגים פרוטוקולים ליצירת טקטואידים microtubule ואפיון צורת המכלולים ואת הניידות של המרכיבים באמצעות טכניקות מבוססות פלואורסצנציה.
הערה: אלא אם כן צוין אחרת, חלקים מהניסוי יכולים להתבצע על ספסל מעבדה תוך לבישת ציוד מגן מתאים (כפפות).
1. סילאניזציה של כסות
הערה: יש לערוך סילאניזציה של כיסויים כדי להשתמש בהם עם ציפוי מברשת הפולימרים המשמש בניסויים אלה. זהו טיפול סילאניזציה הידרופובי המאפשר לקופולימר בלוק עם בלוק מרכזי הידרופובי להיקשר וליצור מברשת פולימר. הצעדים הבאים צריכים להתבצע במכסה אדים כדי למנוע חשיפה לאדים רעילים בעת לבישת כפפות. דימתילדיכלורולסילן הוא רעיל ביותר ויש לטפל בו בזהירות מרבית.
- יש לשטוף את הכיסויים עם ddH2O, 70% אתנול ו-ddH2O לפי הסדר. מייבשים אותם במגבונים מעבדתיים ללא מוך בין כל שטיפה. זה מסיר אבק וחלקיקים מסיסים במים או אורגניים מפני השטח לפני הטיפול.
- הניחו את הכיסויים במדף המחזיק כיסויי מתכת והעבירו את המדף למכונת UV-Ozone (UVO). הקרינו את הכיסויים עם UVO למשך 20 דקות כדי להסיר כל פלואורסצנציה ברקע. ניתן להשתמש בתא פלזמה במקום UVO.
- באמצעות פינצטה, העבר את הכיסויים ממתלה המתכת המשמש לטיפול UVO אל מתלה מתכת אחר המשמש לסילאניזציה. אל תשתמש באותם מדפים עבור שניהם, מכיוון שזה יגרום לרמות גבוהות של חמצון כאשר UVO מוחל. נקו מראש את המדפים עם מים ואתנול, כך שלא יישארו שאריות כימיקלים משימושים קודמים.
- טבלו את המדף עם הכיסויים במיכל עם 100% אצטון למשך שעה אחת. יש לשטוף את המיכל 3x במי ברז ולאחר מכן 3x עם ddH2O כדי להסיר את כל האצטון.
- יש לטבול את המדף עם הכיסויים ב-100% אתנול למשך 10 דקות. יש לשטוף את המיכל 3x במי ברז ולאחר מכן 3x עם ddH2O כדי להסיר את כל האתנול.
- טבלו את המדף עם הכיסויים 3x ב-ddH2O למשך 5 דקות כל אחד.
- טבלו את המדף עם הכיסויים ב-0.1 M KOH (50 מ"ל של 1 M KOH ב-450 מ"ל של ddH2O) למשך 15 דקות. יש לשטוף את המיכל 3x במי ברז ולאחר מכן 3x עם ddH2O כדי להסיר את כל KOH.
- טבלו את המדף עם כיסויים 3x ב- ddH2O למשך 5 דקות כל אחד.
- יש לייבש את המדף באוויר עם הכיסויים למשך הלילה במכסה אדים או במכסה גלימה למינרי.
- לאחר ייבוש מוחלט של המדף והכיסויים, טבלו אותם במשך 5 דקות ב-2% דימתילדיכלורוסילן (DDS) שנלקחו במיכל אחר המשמש במיוחד לסילאן. אל תתנו לשום דבר שאינו יבש לבוא במגע עם הסילאן.
- לטבול את המדף ולכסות 2x במיכל עם 100% אתנול למשך 5 דקות. יש לשטוף את המיכל 3x במי ברז ולאחר מכן 3x עם ddH2O.
- טבלו את המדף וכיסויים 3x ב-ddH2O למשך 5 דקות כל אחד.
- יש לייבש את המדף באוויר עם הכיסויים למשך הלילה במכסה אדים או במכסה גלימה למינרי.
- לאחר שלב ייבוש אחרון זה, העבירו את הכיסויים בחזרה לקופסאות כיסוי באמצעות פינצטה. ניתן להשתמש בכיסויים אלה ב-1-2 החודשים הקרובים. כיסויים ישנים יתחילו לאבד את הציפוי שלהם ויש להשליך אותם.
2. הכנת טובולין
הערה: הטובולין שנרכש מגיע כאבקה ליופילית שאינה מתויגת או מסומנת בפלואורופורים. טובולין ליופילי מאוחסן במקפיא של −80 מעלות צלזיוס. ההליך הבא משמש כדי לערבב טובולין ללא תווית עם טובולין מסומן ביחס כי הוא טוב להדמיה.
- מוציאים מהמקפיא −80 מעלות צלזיוס אליקוט אחד של טובולין ללא תווית המכיל 1 מ"ג של אבקת טובולין ליופילית ושומרים אותה על קרח. הוסיפו 200 μL של PEM-80 קר לצינור כדי להביא את ריכוז הטובולין ל-5 מ"ג/מ"ל. שמור אותו על קרח במשך 10 דקות כדי להמיס את כל הליופילט.
- מוציאים מהמקפיא −80 מעלות צלזיוס אליקווט אחד של טובולין מסומן ברודמין המכיל 20 מיקרוגרם של אבקת טובולין ליופילית ושומרים אותה על קרח. הוסיפו 4 μL של PEM-80 קר לצינור כדי להביא את ריכוז הצינורולין ל-5 מ"ג/מ"ל. שמור אותו על קרח במשך 10 דקות כדי להמיס את הליופילט במלואו.
- לאחר ההמסה, יש להוסיף 100 μL של תמיסת טובולין ללא תווית לתמיסת 4 μL של טובולין המסומן ברודמין. פיפט 6x-7x לאט מאוד לערבב. אם אגרגטים נראים לעין, צנטריפוגה של הצינורולין הסולוביאלי למשך 10 דקות ב-90,000 x g כדי להסיר אגרגטים על ידי השלכת הכדור ושמירה על הסופרנאטנט. תערובת טובולין זו תגרום לכ-4% עם תווית טובולין.
- מקפיאים את 100 ה-μL הנותרים של טובולין ללא תווית לחנקן נוזלי (LN2) ומאחסנים אותו ב-−80 מעלות צלזיוס כדי שישמשו לתערובות טובולין נוספות.
- קחו את תערובת טובולין המסומנת ואליקוטים לשבעה צינורות עם 15 μL כל אחד. ניתן להשתמש בכל אליקוט עבור תא ניסוי יחיד. הקפיאו את האליקוטים הנותרים ואחסנו אותם בטמפרטורה של −80 מעלות צלזיוס לניסויים עתידיים.
3. טיהור MAP65
הערה: MAP65 אינו זמין מסחרית, ולכן יש לטהר אותו עבור עבודה זו. הפרוטוקול הורחב בעבר במספר פרסומים23,29.
- הפוך את הפלסמיד MAP65 ואת הפלסמיד GFP-MAP65 לזן חיידקי BL21 לביטוי חלבונים.
- לגדל חיידקי BL21 לצפיפות אופטית של 0.6-1 ב-600 ננומטר. לגרום לייצור חלבונים באמצעות מפעיל ה-lac ולגדל את החיידקים במהלך הלילה.
- מטילים את התרביות ומשקרים את החיידקים.
- אספו את הליזאט לאחר הצנטריפוגה ודגרו אותו עם חרוזים שיש להם יון ניקל זמין כדי לקשור את תג 6x-histidine.
- יש לאלף את החלבון באמצעות אימידזול ולהתפלותו.
- מקפיאים את החלבון בחנקן נוזלי ומאחסנים אותו בטמפרטורה של −80 מעלות צלזיוס לשימוש תוך שנה.
4. הרכבה של תאי זרימה
הערה: ניסויים מבוצעים בתאי זרימה העשויים ממגלשת זכוכית ומזכוכית כיסוי סילונית (איור 3).
- קח מגלשת זכוכית ונקה אותה באמצעות ddH2O, אתנול, ו- ddH2O לפי הסדר. יש לייבש עם מגבון מעבדה ללא מוך בין כל שטיפה.
- השתמש בפיסת סרט הדבקה דו-צדדי כדי ליצור נתיב זרימה. באמצעות ידיים עם כפפות, חתכו את הקלטת לאורך של כ-25-30 מ"מ. פצל את הקלטת לאורך כדי ליצור שתי רצועות דקות יותר. הניחו את שתי רצועות הטייפ על המגלשה עם כ-5-8 מ"מ ביניהן.
הערה: מכיוון שעובי הקלטת מתוקנן לכ-80-100 מיקרומטר, רוחב הנתיב בין פיסות הקלטת יקבע את עוצמת הקול בתא. - הניחו את הכיסויים הסלאניים על גבי נתיב הזרימה. אטמו את המגלשה והכיסוי לרצועות הטייפ הדו-צדדיות על ידי לחיצה עדינה על אזור הקלטת בגב העט. הקפידו לקבל חותם טוב על כל האזור; הקלטת צריכה להפוך משקיפות לבהירה כאשר החותם נעשה היטב.
- הסר את הקלטת הנוספת בקצוות, והשאר רק 1 מ"מ מהכניסה לתא הזרימה על ידי חיתוך הסרט עם סכין גילוח.
- תייג את התא במידע על הפרמטרים הניסיוניים, לפי הצורך.
5. ניסויים טקטואידיים
הערה : לאחר שנוצרים כל הריאגנטים והאספקה, ניתן להשתמש בהם כדי לגרום ולפלמל טקטואידים של מיקרוטובולים בתא הזרימה.
- אסוף את כל הריאגנטים לשימוש. להפשיר אותם על קרח ולאחסן אותם על קרח תוך כדי עבודה. הכינו מספר תאי זרימה לניסויים.
- השתמש בתא זרימה אחד עבור כל ניסוי. מצפים את משטחי תא הזרימה במברשת פולימר על ידי זרימה ב-20 μL של 5% חומרים פעילי שטח קו-פולימריים שאינם יוניים (טבלת חומרים) המומסים ב-PEM-80, עם טיפות קטנות בשני קצות התא כדי למנוע היווצרות של בועות אוויר בפנים. שמרו את זה בתא לח (כלומר, צלחת פטרי עם מגבון מעבדה רטוב ללא מוך) עד שיהיה מוכן לשימוש (לפחות 5-7 דקות).
- בצינור סטרילי, ערבבו את הדברים הבאים כדי ליצור את תערובת Tubulin-MAP: 9.5 μL של PEM-80; 4 μL של 10 mM GMPCPP; 4 μL של 5% פלורוני-F127; 1 μL של 1M DTT; 1 μL של גלוקוז; 2 μL של פוליאתילן גליקול (PEG); 12 μL של תערובת טובולין של 5 מ"ג/מ"ל (ריכוז סופי של 13.6 μM) משלב 2.5.; ו-5.5 μL של מלאי עבודה של MAP65 כאשר 10% הוא GFP-MAP65 להדמיה. המשיכו לרכוב על קרח תוך כדי ערבוב.
הערה: מומלץ להשתמש בפיפטת תזוזה חיובית לטיפול בתמיסת PEG הצמיגית. ניתן להשתמש בפיפטות רגילות לאחר חיתוך הקצה כדי להגדיל את הפתח; עם זאת, שיטה זו פחות מדויקת. - מערבבים 5x-6x על ידי צנרת.
- רגע לפני שמוסיפים לתא, מוסיפים 1 μL של תמיסה מעורבת מראש של גלוקוז אוקסידאז (0.5 מ"ג/מ"ל) וקטלאז (0.15 מ"ג/מ"ל) (דאוקסי) לתערובת Tubulin-MAP ומערבבים 7x-8x. חלקו את הנפח הכולל של התמיסה (40 μL) לשני חלקים שישמשו בתאים נפרדים.
- הזרימו את תערובת טובולין-MAP לתוך התאים. מכיוון שלתאים כבר יש חומר פעילי שטח קו-פולימרי שאינו יוני, לא ניתן להוסיף יותר נוזלים מבלי להסיר את הנוזל הישן. לשם כך, השתמש בפיסת נייר סינון או במנגב מעבדה ללא מוך בקצה השני של התא כדי להסיר נוזל באמצעות פעולה נימית.
- לאחר שהדגימה נמצאת במלואה בתוך החדר, אטמו את שני הקצוות של התא באמצעות אפוקסי של 5 דקות ושמרו אותה בטמפרטורה של 37 מעלות צלזיוס למשך כ-30 דקות כדי לגרום ולגדל טקטואידים של מיקרוטובולים.
6. מיקרוסקופיה פלואורסצנטית
- השתמש במיקרוסקופ פלואורסצנטי להדמיית הטקטואידים.
הערה: מיקרוסקופיה פלואורסצנטית כוללת של השתקפות פנימית או מיקרוסקופיה קונפוקלית של דיסק מסתובב טובות להסרת פלואורסצנציה ברקע מטובולין חופשי, אך טקטואידים נראים גם על ידי אפי-פלואורסצנציה רגילה ואפילו מיקרוסקופיית אור מועברת ברגע שהם נוצרים, מה שהופך את ההליך הזה לנגיש ללא ציוד מיוחד. - השתמש במטרה של מפתח צמצם מספרי (NA) של 1.2 NA ומעלה עם הגדלה של פי 60 ומעלה כדי לאסוף מספיק אור בפלואורסצנציה. מטרות אלה דורשות לעתים קרובות טבילה ב- ddH2O או בשמן.
- הקלט תמונות באמצעות CMOS או מצלמת CCD. השתמש בגודל פיקסל יעיל במצלמה של 108 ננומטר.
הערה: גודל הפיקסל תלוי במצלמה ובהגדלה שבה נעשה שימוש, שבמקרה זה הייתה פי 60 או 100x עם מפתח צמצם מספרי גבוה (1.2 או 1.49 NA). ניתן להשתמש במרחיבי תמונה נוספים לפני המצלמה כדי להשיג את גודל הפיקסלים הדרוש. - שמור את הדגימה על 37 °C (74 °F) באמצעות תא סביבתי המוגדר לטמפרטורה זו. לחלופין, השתמשו בתנורי חימום שלבים אחרים, כולל מחממי שלב אוויר חם וצווארונים אובייקטיביים מבוקרי טמפרטורה עם מים חמים במחזור.
- השתמש במקורות עירור המתאימים לפלואורסצנציה הדרושה. עבור רודמין טובולין, השתמש בלייזר של 561 ננומטר עם הספק של לפחות 1 mW בדגימה, ועבור GFP-MAP65, השתמש בלייזר של 488 ננומטר עם לפחות 1 mW של הספק בדגימה.
הערה: אם אתה משתמש במיקרוסקופיה אפי-פלואורסצנטית רחבת-שדה, השתמש בקוביית מסנן רודמין עם עירור: 540 ± 12.5 ננומטר, דיכרואי: 545 ננומטר ± ניתוק של 12.5 ננומטר, ופליטה: מעבר באורך 575 ננומטר, וקוביית מסנן GFP עם עירור: 480 ± 15 ננומטר, דיכרואית: 505 ננומטר ± ניתוק של 15 ננומטר, ופליטה: מעבר באורך 515 ננומטר. - צלם לפחות 10 תמונות של אזורים שונים כדי לצלם מעל 100 טקטואידים. צלם תמונות בערוצים האדומים והירוקים ושמור אותן כתמונות tiff של 16 סיביות לניתוח. ודא שעוצמת התאורה וזמני החשיפה הם כאלה שקנה המידה של העוצמה של המצלמה אינו רווי.
7. התאוששות פלואורסצנטית לאחר הלבנת תמונות (FRAP)
הערה: כדי לחקור את הניידות של המרכיבים הפנימיים של הטקטואידים, נעשה שימוש ב-FRAP. FRAP עובד על ידי הלבנת תמונות של חלק נבחר של טובולין מסומן ברודמין וטקטואיד MAP65 המסומן ב-GFP ולאחר מכן התבוננות בהתאוששות הפלואורסצנציה עם הזמן באזור זה. קצב ההתאוששות תלוי בתחלופה של המינים המצולמים. קצב תחלופה זה יכול להיות תלוי בתגובות דיפוזיה וקשירה. עבור MAP65 מחייב את הטקטואידים, ניתן להעריך את שערי החליפין המחייבים. FRAP מבוצע באמצעות מערכת לייזר נוספת של 405 ננומטר שיכולה לסרוק את הלייזר בכל צורה שהיא. ישנן אפשרויות רבות לביצוע FRAP, כולל שימוש במנורה ובצמצם המועברים כדי להלבין תמונה של אזור מקומי14.
- בחר טקטואיד מבודד בתא כדי ליצור אזור עניין (ROI) המכסה חלקים מהטקטואידים והפתרון שמסביב.
- השתמש במיקרוסקופ עם לייזר נוסף של 405 ננומטר עבור FRAP כדי להלבין גם את הטובולין וגם את MAP65 בו זמנית. לחלופין, ניתן להשתמש במנורה בהירה דרך תחנת השדה של הקשתית14. התאם את העוצמה הספציפית של מערכות ההלבנה הפוטו-הלבנה באופן אמפירי כדי למנוע פגיעה בחלבונים במהלך ההלבנה.
- הקלט את הטקטואיד כסרט סדרת זמן במשך 30-60 שניות לפני ההלבנה כדי לקבל מידע על העוצמה שלפני האקונומיקה. הקלט גם את הערוצים האדומים וגם את הערוצים הירוקים.
- פוטו-אקונומיקה את הטקטואיד על-ידי חשיפת ההחזר על ההשקעה עם הלייזרים או עם המנורה למשך זמן רב ככל שנדרש כדי לצלם אקונומיקה מבלי לפגוע בטקטואיד. לקבוע את העוצמה והזמן באופן אמפירי.
- המשך להקליט את הסרט בשני ערוצי הצבעים במשך 5-10 דקות לאחר הלבנת תמונות או עד שנראה כי ההתאוששות הגיעה לשיווי משקל.
- בדוק באופן חזותי את ערוץ GFP-MAP65 לשחזור.
8. ניתוח נתונים
הערה: ניתוח כמותי של תמונות הטקטואידים בוצע כדי ללמוד על ההשפעות של שינויים סביבתיים המוטלים באמצעות סוכני צפיפות שונים, תנאים יוניים והוספת גורמים אחרים.
- אפיון צורה טקטואידית
- לכמת את האורך והרוחב של הטקטואידים מהתמונות האדומות והירוקות שצולמו במיקרוסקופיה קונפוקלית.
- פתחו את התמונות באמצעות FIJI/ImageJ.
- אם נתונים גולמיים נלקחים ב- 16 סיביות, התאם את הבהירות והניגודיות במידת הצורך. בחר תמונה > התאם > הבהירות והניגודיות כדי להתאים את התמונה כך שתוכל לראות את הטקטואיד בבירור. התאם את הבהירות והניגודיות מבלי להחיל את ההגדרה כדי לא לשנות בטעות את נתוני העוצמה.
- לאחר שהטקטואידים נראים בבירור, בחרו טקטואידים טובים למדידה (איור 4Bi). ודא שהטקואידים נראים בבירור ללא חפיפה עם טקטואידים או אגרגטים אחרים ואינם מעוקלים או כפופים כדי להיות מסוגלים להשתמש בכלי מדידה בקו ישר.
- לאחר מכן, ודא שגודל הפיקסל הנכון מוגדר עבור התמונות. תמונות המיקרוסקופ מגיעות עם מטא נתונים על גודל הפיקסל. בעת שימוש במצלמה אחרת שאין לה מטה-נתונים או מערכות חיצוניות להרחבת תמונה שיכולות לשנות את גודל הפיקסלים האפקטיבי הצפוי, התאם את גודל הפיקסל באופן ידני. ב- FIJI/ImageJ, עבור אל ניתוח > הגדר קנה מידה כדי להגדיר את המרת הפיקסלים הנכונה.
- באמצעות הכלי 'קו ישר' מסרגל הכלים ב-FIJI/ImageJ, לחצו על קצה אחד של הטקטואיד וגררו את הסמן לקצה השני של הטקטואיד (איור 4Bii). לאחר בחירת החזר ההשקעה של השורה, בחר נתח > מדידה למדידת האורך. אם האורך אינו נמדד כברירת מחדל, הקפד להגדיר את המדידה כך שתכלול אורך בתיבת הדו-שיח ניתוח > הגדרת מדידות .
הערה: בדרך כלל, בעת מדידה באמצעות הכלי קו ישר , הוא ייתן את האורך והזווית של הקו שצויר. כדוגמה, איור 4Bii מראה קו ישר שנמשך לצד הטקטואיד כדי להפוך את האחרון לנראה לעין, אך לבצע את המדידה ישירות על הטקטואיד. - לאחר ביצוע המדידה, השתמש בכלי טקסט בסרגל הכלים כדי לתייג את הטקטואיד. צור תיבת טקסט, הוסף תווית מספר ובחר ערוך > ציור כדי לתקן את התווית בתמונה. שמור את התמונה כקובץ ROI נפרד.
הערה: תיוג ושמירה של קובץ זה מאפשרת לחוקר לדעת איזו מדידה מתאימה לאיזה טקטואיד מהנתונים הגולמיים. הקפידו למדוד כל טקטואיד פעם אחת. - לאחר מדידת הטקטואידים עבור התמונה כולה, שמור את הנתונים בחלון התוצאות בקובץ טקסט מופרד בפסיקים או בטאבים (באמצעות קובץ > שמור בשם) ופתח את הנתונים בתוכנית גיליון אלקטרוני כדי לנתח את הנתונים למספרים. אסוף את כל הנתונים יחד (נתוני תמונה גולמיים, תמונת ROI וקובץ טקסט של תוצאות) לתיקיה עם מוסכמה מתאימה למתן שמות כדי לשמור על הכל מאורגן.
הערה: למרות שמדידות אורך טקטואיד מבוצעות ביד, בהתחשב בכך שרוחב הטקטואידים צר, עדיף להשתמש בשיטה שונה למדידת רוחב טקטואיד (ראה להלן) כדי להפחית את שגיאת המדידה. - באמצעות ImageJ/FIJI, צייר אזור קו באמצעות הכלי קו ישר . ציירו את הקו כביסקטור מאונך לציר הארוך הטקטואידי (איור 4Bii).
- בחר נתח את פרופיל העלילה > כדי ליצור את פרופיל העוצמה של הביזקטור הליניארי (איור 4Biii). עלילה תופיע. כדי לאחזר ולשמור את הנתונים מהחלקה, בחר בלחצן רשימה בפינה השמאלית התחתונה; פעולה זו יוצרת את רשימת קבצי הטקסט של נתוני העוצמה לאורך הקו שצויר. שמור את קובץ הטקסט כקובץ .csv או .txt.
- פתח את קובץ הטקסט בתוכנית מתאימה כגון MatLab, Python (sciPy) או תוכניות אחרות. התאם את נתוני העוצמה עם פונקציית גאוס של הצורה:
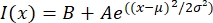 , כאשר I(x) הוא ערך גווני האפור לאורך, x; B היא רמת הרקע; A היא המשרעת של הגאוס; μ הוא הממוצע או המרכז של הגאוס; σ היא סטיית התקן של הגאוס.
, כאשר I(x) הוא ערך גווני האפור לאורך, x; B היא רמת הרקע; A היא המשרעת של הגאוס; μ הוא הממוצע או המרכז של הגאוס; σ היא סטיית התקן של הגאוס. - דו"ח 2σ כרוחב הטקטואיד. להעריך את עוצמת המיקרוטובולים בטקטואיד על ידי חישוב השטח שמתחת לגאוס (לא כולל הרקע).
הערה: אם התמונות נמצאות בטווח העוצמה הליניארית של המצלמה והן מצולמות עם אותו זמן חשיפה ועוצמת עירור, ניתן להשוות עוצמות משולבות כדי להעריך את המספר היחסי של מיקרוטובולים בטקטואיד.
- ניתוח FRAP
הערה: ניסויים לבדיקת הניידות של המיקרו-טובולים וה-MAP65 השתמשו ב-FRAP כדי לתעד את ההלבנה הספציפית ואת ההתאוששות של העוצמה כתוצאה מתנועה מולקולרית (איור 5A). הנתונים כומתו מנתוני סדרת זמן התמונה באמצעות ImageJ/FIJI.- השתמש ב-ImageJ/FIJI כדי לפתוח את נתוני הסרט.
- רשום את הערימות (נתוני סדרות זמן) לאורך זמן כדי להסיר סחף. השתמש בתוסף StackReg יחד עם תוסף TurboReg הנלווה; לקבלת הוראות לשימוש בתוספים, עיין בקישורי האינטרנט המופיעים בטבלת החומרים. בחר תרגום כדי לשנות את מיקום המסגרות ובכך לרשום את התמונות.
- לאחר שהתמונות נרשמות להסרת סחף, סובב את התמונה כך שהטקואיד יהיה אנכי או אופקי במסגרת על-ידי בחירה באפשרות תמונה > שינוי צורה > סיבוב. בחר את הזווית לסיבוב והשתמש בתצוגה מקדימה כדי לקבוע אם הטקטואיד מסובב מספיק. כאשר התצוגה המקדימה מראה שהטקואיד הוא אנכי או אופקי, בחר אישור כדי לסובב את כל התמונות בסרט.
- השתמש בכלי בחירת מלבן בסרגל הכלים כדי ליצור מקטע מלבני מעל האזור המצולמן של הטקטואיד. תעד את העוצמה המשולבת של אזור ההחזר על ההשקעה עבור כל מסגרת באמצעות ערימות > תמונה > מחסנית מדידה. הגדר את סוג המדידה לצפיפות משולבת באמצעות ניתוח > הגדרת מדידות. שמור את נתוני העוצמה המנותחים המוצגים בחלון תוצאות כקובץ טקסט בתבנית .csv או .txt על-ידי בחירה בקובץ > שמור בשם.
הערה: איור 5B מציג דוגמה לנתוני העוצמה הגולמיים של 16 סיביות שנמדדו עבור ערוצי המיקרו-טובול וה-GFP-MAP65 באזור האקונומיקה. - מכיוון שהעוצמה הכוללת של התמונות תדעך עם הזמן באופן גלובלי עקב הלבנת תמונות הנגרמת על ידי הדמיה, יש לתקן את ההלבנה הגלובלית הזו. לשם כך, השתמש באותו גודל ROI (שלב 8.2.4.), והעביר אותו לאזור ברקע התמונה שבו לא נראים מיקרו-טובולים או MAP65. מדוד את העוצמה המשולבת של הערימה כמתואר בשלב 8.2.4. שמור את התוצאות כקובץ טקסט שני.
הערה: איור 5B מציג דוגמה לנתוני העוצמה הגולמיים של 16 סיביות שנמדדו עבור ערוצי המיקרו-טובול וה-GFP-MAP65 באזור הרקע. - כדי לתקן את דעיכת הרקע, חלקו את עוצמת האות על הטקטואיד בעוצמת הרקע לאותה נקודת זמן. חשב שתיקנתי (t) כ:
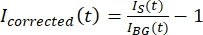 , כאשר IS (t) (האות) הוא המדידה שנעשתה על האזור המולבן ו- IBG (t) (הרעש) הוא המדידה שנעשתה באזור הרקע (איור 5C). פעולה זו מחשבת את יחס האות לרעש עבור כל מסגרת ומחסרה גם את הרעש.
, כאשר IS (t) (האות) הוא המדידה שנעשתה על האזור המולבן ו- IBG (t) (הרעש) הוא המדידה שנעשתה באזור הרקע (איור 5C). פעולה זו מחשבת את יחס האות לרעש עבור כל מסגרת ומחסרה גם את הרעש. - לאחר מכן, שנה את קנה המידה של הנתונים כך שינוע בין אפס לאחד באמצעות
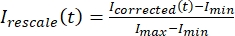 , כאשר אנימציין ו- Iמקסימום מציינים, בהתאמה, את המינימום והמקסימום הגלובליים של הנתונים שתיקנתי לאורך כל הזמן (איור 5C).
, כאשר אנימציין ו- Iמקסימום מציינים, בהתאמה, את המינימום והמקסימום הגלובליים של הנתונים שתיקנתי לאורך כל הזמן (איור 5C). - התאימו את הנתונים האלה לאקספוננציאל מתפורר של הצורה:
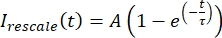 , כאשר A היא המשרעת של ההתאוששות ו-τ הוא ציר הזמן של ההתאוששות (איור 5C).
, כאשר A היא המשרעת של ההתאוששות ו-τ הוא ציר הזמן של ההתאוששות (איור 5C).
עם מספר קטן בלבד של רכיבים, דימרים של טובולין וקישורים צולבים של מיקרוטובולים, טקטואידים של מיקרוטובולים יכולים להיווצר (איור 2A). אף על פי שפרוטוקול זה מתאר דגירה לגרעין ולגידול מיקרוטובולים באינקובטור, ניתן לצפות בגרעין ובצמיחה ישירות מתחת למיקרוסקופ (שהם שלמים תוך 30 דקות) (איור 2B). ריכוז טובולין נשמר קבוע ב-13.6 מיקרומטר וקשירת MAP65-MT ב-10%.
איור 4 מייצג נתונים מוצלחים. הטקטואידים צריכים להיות גלויים הן עם לייזר של 561 ננומטר בתעלת טובולין והן עם 488 ננומטר בתעלת MAP65, החופפים באופן מושלם זה לזה (איור 4A). אחת התעלומות של המערכת הייתה שנראה שרוחב הטקטואידים אינו משתנה תחת מגוון שינויים ניסיוניים, כולל שינוי אורכי המיקרוטובולים, ריכוז MAP65 וחומרי הצפיפות (איור 4B)22,28. האורך משתנה הרבה יותר ותלוי הן באורכי המיקרוטובולים והן בריכוז MAP65 (איור 4B)22,28.
בעת ביצוע FRAP, נצפה כי האות MAP65 מתאושש, אך אות המיקרוטובול אינו מתאושש (איור 5). ההתאוששות ב-FRAP נובעת מהניידות והתנועה של העצמים המסומנים והמצולמנים. במקרה של MAP65, המולקולות המוכהות מתנתקות ומתרחקות מהמיקרוטובול, והמולקולות החדשות עוברות לאזור (איור 5). קשירת MAP65 נמצאת בשיווי משקל, כך שקצב הקשירה וההתנתקות שווה (נמדד במולקולות לשנייה). עבור המיקרוטובולים, לא נצפתה התאוששות המרמזת על כך שהמיקרוטובולים אינם מסוגלים לעזוב את הטקטואיד (איור 5A, Bi, C). יתר על כן, לא נראתה התפשטות של האזור הכהה, מה שמרמז על כך שהמיקרוטובולים הם חסרי תנועה מקומית ולא נוזלים בתוך הצורה הטקטואידית.
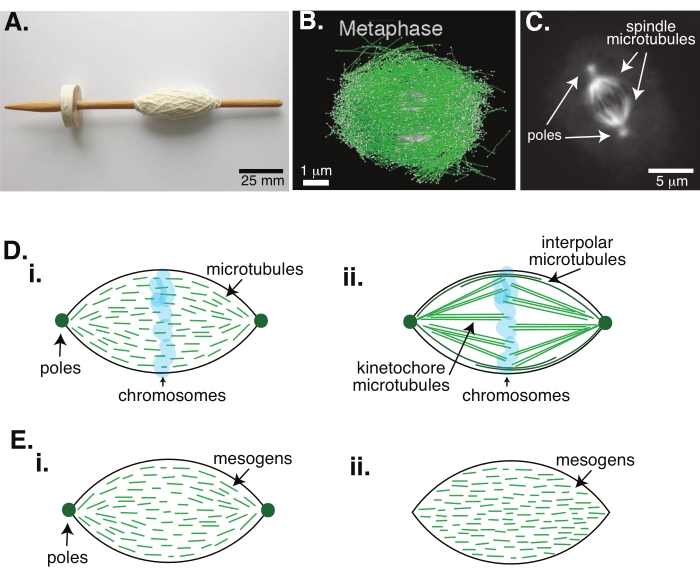
איור 1: מודלים שונים של היווצרות צירים. ציר מיטוטי הוא מכונה העשויה ממיקרוטובולים ומהחלבונים והאנזימים הקשורים אליהם, אשר מיישרת ומפרידה את הכרומוזומים לשני תאי הבת החדשים במהלך חלוקת התאים. (A) תמונה של העתק ציר טיפה מימי הביניים המוקדמים עם חוט דק מהולנד. נתון זה שונה מתמונת ויקימדיה על ידי פיטר ואן דר סלויס30. (B) שחזור תלת-ממדי של מיקרו-טובולים בשלבים שונים של מיוזה מסוג בר II. מיקרוטובולים מוצגים בירוק, וכרומוזומים מוצגים באפור. סרגל קנה מידה = 1 מיקרומטר. נתון זה שונה מ-Lantzsch et al.31. (C) תמונת מיקרוסקופיה של המיקרוטובולים בציר מיטוטי של תא Sf9 מתפצל. מוטות הציר והמיקרוטובולים של הציר מסומנים בחלבון פלואורסצנטי ירוק. סרגל קנה מידה = 5 מיקרומטר. נתון זה שונה מ-Advani et al.32. (D) מודלים שונים של האופן שבו מיקרוטובולים של צירים מיטוטיים ומיוטיים מאורגנים. (i) המיקרוטובולים (הירוקים) שנצפו בעבר עבור צירים מיוטיים שנוצרו מתמציות ביצים של קסנופוס, הוסקו כקצרים ודינמיים לאורך כל הציר. זה דומה לארגון טקטואידי דו קוטבי בתוך גביש נוזלי. (ii) המודל הקנוני לארגון מיקרוטובולים בתוך ציר מיטוטי כולל שני סוגים של מיקרוטובולים: מיקרוטובולים אינטרפולריים או קוטביים (ירוק כהה) המתחברים לאזור האמצע סביב הכרומוזומים ומיקרוטובולים קינטוצ'ור (ירוק בהיר) אשר מקובצים ונמתחים מהקוטב לקינטוכור כדי לדחוף ולמשוך את הכרומוזומים. בכל התמונות, הכרומוזומים מוצגים בכחול שקוף, וקטבים ציריים מיוצגים בירוק כהה. (E) סכמות של מזוגנים (קווים ירוקים) בטקטואיד גבישי נוזלי עבור (i) טקטואידים דו קוטביים ו-(ii) טקטואידים הומוגניים. לטקטואידים דו קוטביים יש שני קטבים בקצה הטקטואיד, והמזוגנים מכוונים מחדש כדי להצביע על הקטבים האלה. לטקטואידים הומוגניים יש קטבים באינסוף, והמזוגנים אינם משנים כיוון לאורך הטקטואיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
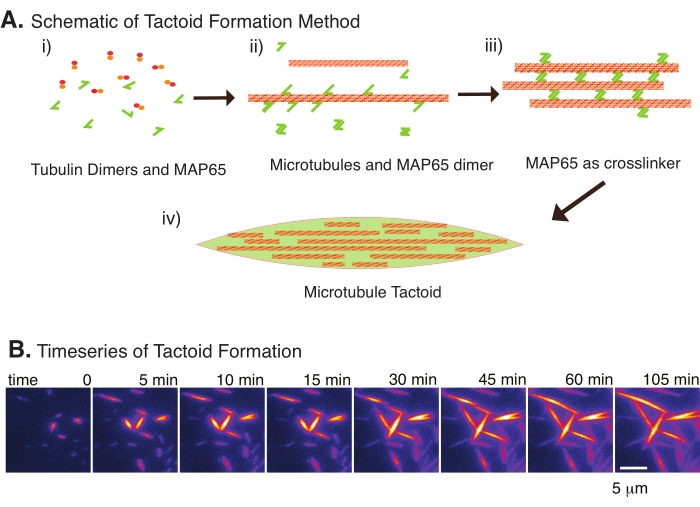
איור 2: עיבוי מיקרו-טובולים. (A) מיקרו-טובולים יכולים להיות ארוזים ומוצלבים על-ידי מגוון שיטות, כולל מינים יוניים, כוחות דלדול הנגרמים על-ידי סוכני צפיפות, וקישורים צולבים ספציפיים של מיקרוטובולים, כגון MAP65. (i) דימרים של טובולין וחלבוני MAP65 מעורבבים כדי לגרום ולגדל מיקרוטובולים. (ii) מיקרו-טובולים מתפרקים וצומחים מהטובולין, ו-MAP65 נקשר מיד למיקרוטובולים, למונומר MAP65 נוסף, או לשניהם וגורם לאגד. (3) מיקרוטובולים בצרורות המקושרים צולבים מגרגרים וגדלים. (iv) התצורה הסופית היא טקטואיד מיקרוטובול הדומה לציר. (B) סדרת זמן של טקטואידים מיקרוטובולים מתנודדים וגדלים במשך 105 דקות. סרגל קנה מידה = 5 מיקרומטר. האיור הותאם מתוך Edozie et al.22. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
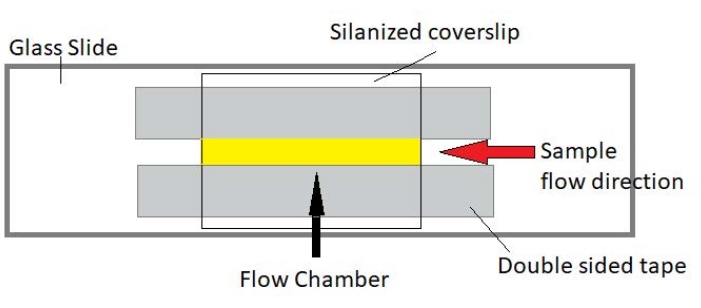
איור 3: מכלול תא זרימה. תא הזרימה נעשה באמצעות מגלשת זכוכית, זכוכית כיסוי סילאנית וסרט הדבקה דו-צדדי קבוע. האזור המסומן הצהוב הוא נתיב הזרימה שבו הדגימה זורמת ונצפית. נפח תא הזרימה הוא ~ 20 μL. אפוקסי שימש לאטום את קצות התא כדי למנוע מהדגימה להתאדות במהלך הדמיה ארוכת טווח במשך מספר שעות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
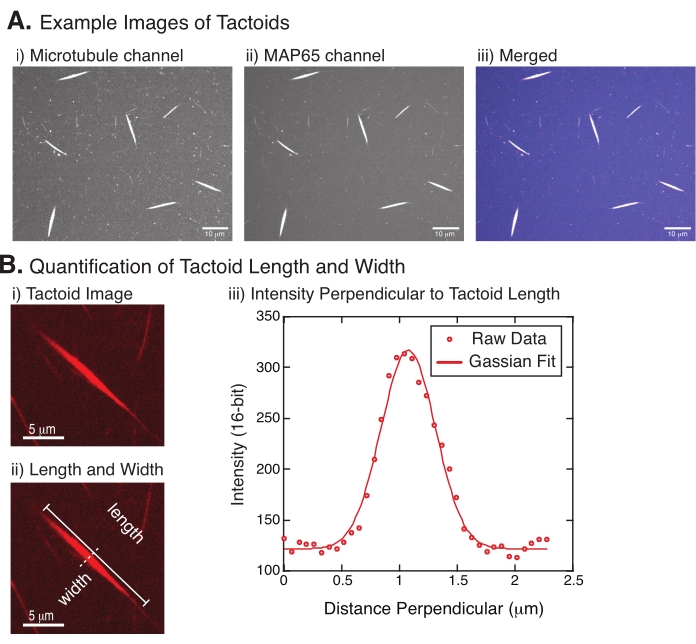
איור 4: תמונות טקטואידיות וניתוח אורך ורוחב. (A) נתונים לדוגמה של טקטואידים שנוצרו כמתואר ומצולמים באמצעות קונפוקל דיסק מסתובב המציג (i) הדמיית תעלות מיקרוטובול הדמיה של טובולין המסומן ברודמין באמצעות לייזר של 561 ננומטר, (ii) הדמיית ערוץ GFP-MAP65 של ה-GFP באמצעות לייזר של 488 ננומטר, ו-(iii) תמונת שכבה ממוזגת מערוץ המיקרוטובול (magenta) וערוץ GFP-MAP65 (ציאן). אזורי חפיפה מוצגים כלבנים ומדגימים שהמיקרוטובולים וה-MAP65 מתמזגים בדיוק. סרגל קנה מידה = 10 מיקרומטר עבור כל התמונות ב- (A). (B) כימות של אורך ורוחב טקטואידים. (i) תמונה של טקטואיד שיש לנתח ללא תוויות. סרגל קנה מידה = 5 μm. (ii) אותה תמונה כמו ב- (i), שבה מסומנות מדידות האורך (קו אחיד עם מכסי קו) והרוחב (קו מקווקו). סרגל קנה מידה = 5 μm. (iii) הרוחב נמדד על ידי לקיחת פרופיל העוצמה על פני הטקטואיד בביסקטור הניצב (קו מקווקו) המסומן ב- (ii). פרופיל העוצמה התאים לתפקוד גאוס כדי לחשוף את המשרעת והרוחב של הטקטואיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
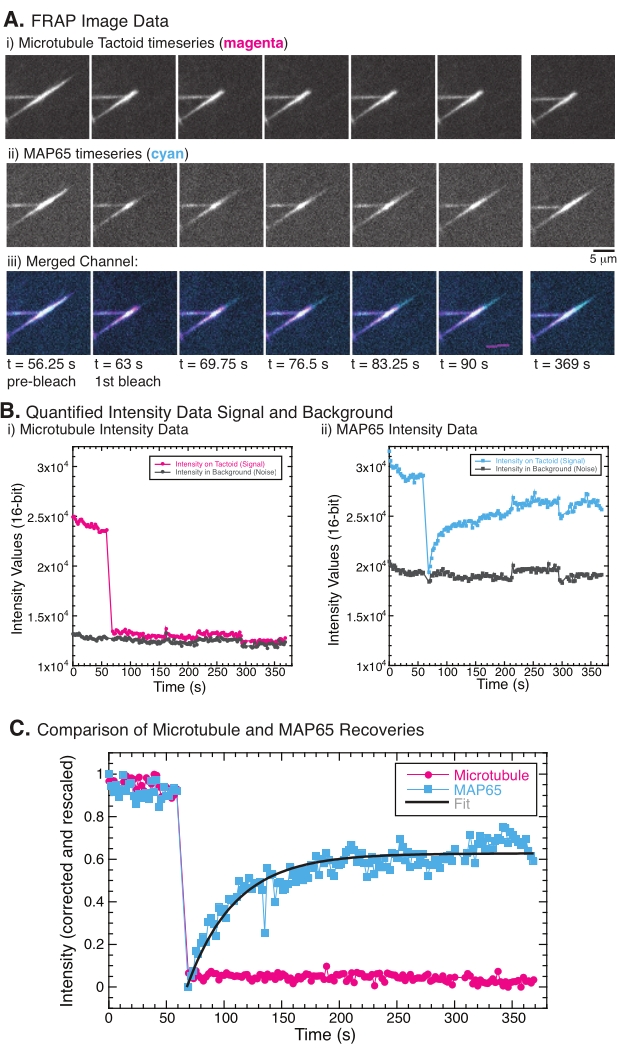
איור 5: נתונים וניתוחים מייצגים של FRAP. (A) נתוני סדרת זמן מיקרוסקופיה של (i) טקטואיד מיקרוטובולים ו-(ii) GFP-MAP65, ו-(iii) תמונת שכבה של שני הערוצים עם מיקרוטובולים במג'נטה וב-GFP-MAP65 בציאן שהולבנו בזמן 63 שניות ונצפו במשך 5 דקות נוספות. ) תעלת מיקרוטובול באזור הלבנה (מעגלי מג'נטה) והרקע (עיגולים אפורים כהים) ו-(ii) ערוץ GFP-MAP65 באזור המולבן (ריבועי ציאן) והרקע (ריבועים אפורים כהים). (C) הנתונים תוקנו עבור רעשי הרקע והורחבו מחדש עבור ערוץ המיקרוטובולים (מעגלי מג'נטה) וערוץ GFP-MAP65 (ריבועי ציאן). המיקרוטובולים אינם מתאוששים, אך ה-GFP-MAP65 כן יכול להתאים (קו אפור כהה) לדעיכה מעריכית עולה כדי למצוא את המשרעת ואת ציר הזמן של ההתאוששות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
השיטות המתוארות כאן שימשו בכמה מאמרים ליצירת טקטואידים של מיקרוטובולים (איור 2)22,28. ניסויים אלה רלוונטיים מבחינה ביולוגית כדי לסייע בחשיפת העקרונות הארגוניים השולטים בצורה וביציבות של הציר המיטוטי או המיוטי ברוב סוגי התאים. בנוסף, מיקרוטובולים הם מזוגנים של גבישים נוזליים לדוגמה שיכולים לסייע בלמידה נוספת על האופן שבו גבישים נוזליים מגרגרים ומגדלים פאזות נמטיות משלבים איזוטרופיים.
להליך המתואר כאן יש מספר יתרונות לחקר ארגון עצמי של מיקרוטובולים. ראשית, הוא ניתן לשחזור רב, לאחר שבוצע במעבדה על ידי תלמידים רבים, כולל תלמידי תיכון, עם מעט ידע או הכשרה לפני תחילתו במעבדה. הטקטואידים הם דו-פרצופיים22, מה שמאפשר לצפות בהם באור מועבר בנוסף למיקרוסקופיה פלואורסצנטית, מה שהופך את השיטה הזו לנגישה למעבדות רבות ולהליך הניסויי הזה הניתן להתאמה למטרות חינוכיות, בנוסף למחקר מתקדם. לבסוף, תהליך זה פותח אפיקים להמשיך להבין ולחקור מערכות ביולוגיות בגישה רדוקציוניסטית מופשטת, ומאפשר להבין כיצד כל מצב, חלבון או תוסף נוסף יכול לשנות את הארגון העצמי של הטקטואידים, ואולי, בסופו של דבר, את הציר. מטרות לביומימיקריה טובה יותר כוללות פעילות, נזילות ומיון קוטביות נימה.
יכולים להיות מספר גורמים המשפיעים על הניסוי ומעניקים תוצאות בלתי צפויות. לדוגמה, אם הטקטואידים אינם נוצרים (איור 2) אך נצפים דפוסים דמויי מניפה, סביר להניח שה-MAP65 אינו קיים או אינו נקשר למיקרו-טובולים22,28. זה צריך להיות ברור גם בערוץ הפלואורסצנטי MAP65 מכיוון שה-GFP-MAP65 לא יהיה קשור למיקרוטובולים.
אם הטקטואידים לא נוצרים והרקע מופיע ככתמים על הזכוכית, זה יכול להיות בגלל ציפוי פני השטח. לאחר ביצועו, הסילאניזציה נמשכת חודש אחד בלבד על כיסויים. כאשר הוא מתפוגג, הטובולין יוכל להיקשר למשטח החשוף באופן לא ספציפי. כריכה זו תתרחש בדפוסים מוזרים.
אם הטקטואידים אינם נוצרים והטובולין נצפה באגרגטים של צורות וגדלים שונים, זה יכול להיות בגלל טובולין באיכות ירודה. טובולין יכול להיות צנטריפוגה כדי להסיר אגרגטים ראשוניים שיכולים להניע את הצבירה הזו מחוץ למסלול במקום פילמור מיקרוטובולים. אם המשטח נקשר לטובולין, הוא יכול גם לרוקן את הטובולין בתמיסה. ריכוזים נמוכים של טובולין, מתחת לריכוז הקריטי לפולימריזציה של מיקרוטובולים, עלולים לגרום לאגרגטים.
בניסויי FRAP, אם ערוץ MAP65 אינו מראה התאוששות כלשהי (איור 5), ייתכן שהלבנת הצילום צילמה את המיקרו-טובולים. Photodamage גורם להרס מקומי של החוטים. ניתן לבדוק זאת על ידי בדיקה בערוץ המועבר. טקטואידים של מיקרוטובולים נראים בתעלה המועברת דרך אינדקס גבוה של אי התאמה של אי-התאמה לשבירה עם המים שמסביב. פוטו-דמה המושרה על-ידי אור יופיע כסימן צריבה או אובדן ניגודיות בהדמיית אור מועברת במיקום ההחזר על ההשקעה הנתונה להלבנת תמונות. אם זה קורה, יש להפחית את כוח הלייזר או האור כדי לעכב את הפוטו-דמה של החלבונים.
היו מספר אתגרים שנתקלו בהם בהליך ובגישה זו. בעיה אחת היא שמדדי האורך מבוצעים כעת ביד על ידי לחיצה על התמונה. שיטה זו, למרות שהיא פשוטה, עלולה לגרום לאי-ודאות גבוהה. מדידת הרוחב המשתמשת בחתך הרוחב ומתאימה לגאוס היא שיטה טובה יותר לכימות הגודל. ניתן להשתמש בשיטה דומה לאורך. בעיה שנייה היא שלפעמים, הטקטואידים, בגלל שהם כל כך ארוכים ודקים, יכולים להתכופף. זה הופך את כימות האורך לקשה יותר. ניתן לכמת את אורך קווי המתאר באמצעות קו מקוטע, אך יש אי-ודאות נוספת בכל פעם שמוסיפים מקטע.
מנקודת מבט מדעית, לגישה זו יש כמה אתגרים אחרים לשימוש בה כמודל לגבישים נוזליים או צירים. האתגר הראשון היה הצורה הארוכה והדקה של הטקטואידים שהמיקרוטובולים יוצרים (איור 3 ואיור 4). כפי שצוין בפרסומים קודמים22, טקטואידים מיקרוטובולים הם טקטואידים הומוגניים, לא דו קוטביים. משמעות הדבר היא שהמיקרוטובולים המרכיבים את הצורה אינם מכוונים מחדש כדי להצביע לעבר קצות המבנה. במקום זאת, כל המיקרוטובולים מקבילים לציר הארוך וה"קטבים" ממוקמים באינסוף. זה שונה מאוד מהטקטואידים שנצפו לגבישים נוזליים מולקולריים או אפילו לאקטין או דנ"א שיכולים לשמש גם כמזוזנים גבישיים נוזליים. במערכות אחרות אלה, הטקטואידים הם דו קוטביים, וכאשר מסתכלים עליהם בקטבים חצויים, הם מראים את הסימנים המובהקים של כיוון מחדש של המוטות.
אתגר מרכזי נוסף במערכת זו הוא שהמיקרוטובולים אינם משותקים בתוך הטקטואיד. זה ברור מניסויים וניתוחים של FRAP מכיוון שההתאוששות של המיקרוטובולים נמוכה מאוד. האופי המוצק שלהם הופך את הטקטואידים של המיקרוטובולים לפחות בעלי ערך כמו אנלוגים של גבישים נוזליים בקנה מידה גדול. הפאזה הנמטית של גביש נוזלי צריכה להיות בעלת תכונות נוזליות (נוזל) וקריסטליות (מאורגנות). למרות שהצורה נראית מתאימה לציר, חוסר התנועה הופך את המערכת לפחות מרגשת כציר מיטוטי מדגם. מצד שני, בעיה זו מספקת הזדמנויות לחקור כיצד ניתן לשנות את הניסויים כדי ליצור נזילות רבה יותר במערכת.
אתגרים מדעיים אלה מציעים הזדמנויות מרגשות שיאפשרו ידע חדש על המערכת. כדי להפוך את הטקטואידים המיקרו-טובולים לדו-קוטביים יותר, אפשר להשתמש במיקרו-טובולים קצרים יותר. עם זאת, יש אתגר נוסף, מכיוון שלמיקרוטובולים אין הרבה חלבוני מכסה מאופיינים היטב כדי לשלוט באורך כפי שעושה אקטין. השימוש בגרעין ובצמיחה דורש שימוש בריכוזים גבוהים מאוד של טובולין ו- GMPCPP כדי ליצור מיקרוטובולים קצרים. ריכוז טובולין גבוה גורם למספר גדול יותר של חוטים במערכת, מה שמקשה על הפרדת טקטואידים זה מזה. התוספת של כובעי מיקרוטובול חדשים, כגון DARPin33, עשויה לסייע במצב זה. את הבעיה השנייה של המיקרוטובולים להיות חסרי תנועה ניתן למתן על ידי תוספת של חלבונים מוטוריים, כגון kinesin-534, שהם טטרמרים של מנועים המשמשים מיטוזה. לחלופין, ניתן להשתמש בדמרים מלאכותיים של קינזין-1 דימרי15.
דרך נוספת להוסיף נזילות נוספת תהיה לאפשר למיקרוטובולים לבצע את חוסר היציבות הדינמית שלהם, את הגידול וההתכווצות של המיקרוטובולים. נכון לעכשיו, מיקרוטובולים שנזרעים עם חוטי GMPCPP יציבים ולאחר מכן עוברים חוסר יציבות דינמית הם הרבה יותר ארוכים מהרצוי כדי ליצור ציר או טקטואיד, מה שיגרום לארגונים ארוכים מאוד כמו מאווררים או חבילות. לכן, הוספת חוסר יציבות דינמית של מיקרוטובולים תצטרך להיעשות בזהירות כדי לשמור על הצורה הטקטואידית. תוספת של חלבונים ואנזימים נלווים שיכולים לשלוט באורך עשויה למתן בעיה זו. לדוגמה, סביר להניח שיהיה צורך בדה-פולימריזציה של קינזינים, כגון קינזין-1335, או ניתוק אנזימים, כמו קטנין36. ניסויים אלה מורכבים וקשים, אם כי הם יהיו בעלי תובנה רבה לא משנה מה התוצאות יחשפו. לא משנה לאיזה כיוון ילכו הניסויים העתידיים, הפלטפורמה שפותחה כאן ליצירת טקטואידים של מיקרוטובולים יכולה לחשוף מידע חדש על בסיס פיזיקלי של ארגון מיקרוטובולים.
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
המחברים רוצים להודות לכל חברי מעבדת רוס בקיץ 2021, במיוחד ק. אליס לינדזי, על עזרתם. עבודה זו נתמכה על ידי מענק מ- NSF BIO-2134215 שתמך בס 'סאהו, נ' גודבי, ה.ב. לי וג'.ל. רוס. מענק מקרן KECK (ריי אנדרסון, USD, lead PI) תמך באופן חלקי בר' סניף וב-P. Chauhan
| Name | Company | Catalog Number | Comments |
| 2% Dichlorodimethylsilane | GE Healthcare | 118945 | A hydrophobic silane surface treatment. This can be resused upto three times and kept at room temperature for one year. |
| 5-minute epoxy | Bob Smith Industries | For sealing experimental chambers | |
| Acetone | Fisher | 32900HPLC | 100% |
| BL21 cells | Bio Labs | C2527I | Competent bacterial cells used to express MAP65 |
| Catalase | Sigma | C30-500MG | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C for upto one year. |
| Coverslips (22 mm x 22 mm or 22 mm x 30 mm) | Fisher | 12544-AP | For experimental chambers |
| Dithiothreitol | Sigma | 43815-5G | A small molecule that is used to break disulfide bonds and scavenge oxygen. A 1 M stock is made from powder (Sigma) in ddH2O. The solution is aliquoted and stored at -20C for upto one year. The aliquots are used 7-8 times then discarded. |
| EGTA | Sigma | E3889-10G | Tubulin buffer base ingredient |
| Eppendorf 0.5 ml tubes | Eppendorf | 05 402 18 | For holding experimental solutions |
| Ethanol | Fisher | 111000200 | 200 proof |
| Filter paper | Whatman | 1004-110 | For cleaning and for pulling solutions through experimental chambers |
| Fluorescence microscope with high NA objectives | Nikon | Ti-E, W2 Confocal | For imaging experiments |
| Freezer -20°C | Fisherbrand | 13986148 | For storing reagents |
| Freezer -80°C | Thermo scientific | 328223H01-C | For storing proteins. |
| Glass containers for silanization | Michaels | For preparing experimental chambers - treating cover glasses | |
| Glass slides | Fisher | 12544-4 | For experimental chambers |
| Glucose | Sigma | G7528-250G | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C. |
| Glucose oxidase | Sigma | G2133-250KU | Part of the oxygen scavenging system. This is stored at 4°C for upto one year. |
| GMPCPP | Jenna Bioscience | NU-4055 | Slowly hydrolyzable analog of GTP used to polymerize and stabilize the microtubules by reducing the dynamic instability and spontaneous critical concentration for microtubule nucleation to get a consistent length. We purchase a 10 mM stock from Jena Biosciences and store it at -20°C for upto one year. |
| Heating element for microscope | Okolab stage top incubator | For imaging experiments | |
| Imidizole | Sigma | I2399 | Used to elute MAP65 protein from Nickel beads to purify MAP65 |
| Kimwipes | Fisher | 34155 | For cleaning and for pulling solutions through experimental chambers. |
| KOH | Sigma | P250-500 | 1 M in ddH2O, made fresh to prevent acidification over time. |
| Liquid Nitrogen | Airgas | NI 230LT22 | To drop freeze aliquots. This can also be used for storage (not recommended) |
| MAP65 protein | Ram Dixit | A microtubule-associated protein (MAP) with a molecular weight of 65 kD that is an antiparallel microtubule crosslinker. We have purified an unlabeled and GFP-labeled version of MAP65-1 from Arabidopsis thaliana. We mix the GFP-MAP65 with the unlabeled MAP65 such that 10% of the protein is labeled. The working stock is a 10.8 μM solution. This working solution is stored at 4°C and remade fresh every week. The protocol for purifying the MAP65 and GFP-MAP65 is given in our prior methods chapter (26). | |
| MgSO4 | Sigma | MKCJ940 | Tubulin buffer ingredient |
| NTA-Nickel beads | Qiagen | 30210 | Beads required to purify 6xHis tagged MAP65 proteins |
| Optomicroscan | Nikon | 405 nm laser system which can focus the laser in any desired shape of region of interest | |
| PEM80 | Neutral tubulin polymerizing base buffer for solution made from 80 mM K-PIPES, pH 6.8, 1 mM MgSO4, 1 mM EGTA, stored at 4°C for upto one year. | ||
| Permanent double-sided tape | 3M - Scotch | 34-8724-5691-7 | For experimental chambers |
| Petri dish | Fisher | FB0875713 | For humid chamber |
| PIPES | Sigma | P7643-100G | Tubulin buffer base ingredient |
| Pluronic-F127 | Sigma | P2443-250G | A block-copolymer with two hydrophilic polyethylene oxide (PEO) blocks on the ends and a hydrophobic center block of polyphenylene oxide (PPO) hydrophobic surface coating we use to prevent protein binding to the surface. Pluronic-F127 is purchased as a powder (Sigma) and dissolved to a 5% (w/v) solution in ddH2O overnight. Once dissolved, the solution can be stored at room temperature for upto one year. |
| Polyethylene Glycol | Affymetrix Inc | 19966 500 GM | A crowding agent used to create depletion forces to bring tactoids to the surface and help to organize microtubules. We create a 5% (w/v) solution of 100 kDa PEG in PEM80. The solution is stored in 4°C for upto one year and placed on the rocker before use. It is viscous, so we recommend using a positive displacement pipette to work with it. |
| Positive displacement pipette | Eppendorf | For pipetting viscous liquids | |
| Racks for coverslips | Electron Microscopy Sciences | 72240 | For preparing experimental chambers - treating cover glasses |
| Refrigerator 4°C | Fisherbrand | For storing reagents | |
| Tubulin Labeled | Cytoskeleton | TL590M | lyophilized rhodamine-labeled tubulin from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| Tubulin protein | Cytoskeleton | T240 | lyophilized tubulin 99% pure unlabeled from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| UV-Ozone | Jelight | Model 342 | For preparing experimental chambers - treating cover glasses |
| Stackreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/stackreg/ | plugin for registering time series data to remove drift |
| Turboreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/turboreg/ | plugin for registering time series data to remove drift |
- Bodakuntla, S., Jijumon, A. S., Villablanca, C., Gonzalez-Billault, C., Janke, C. Microtubule-associated proteins: structuring the cytoskeleton. Trends in Cell Biology. 29 (10), 804-819 (2019).
- Severson, A. F., von Dassow, G., Bowerman, B. Oocyte meiotic spindle assembly and function. Current Topics in Developmental Biology. 116, 65-98 (2016).
- Brugués, J., Needleman, D. Physical basis of spindle self-organization. Proceedings of the National Academy of Sciences of the United States of America. 111 (52), 18496-18500 (2014).
- Brugués, J., Nuzzo, V., Mazur, E., Needleman, D. J. Nucleation and transport organize microtubules in metaphase spindles. Cell. 149 (3), 554-564 (2012).
- Gatlin, J. C., et al. Spindle fusion requires dynein-mediated sliding of oppositely oriented microtubules. Current Biology. 19 (4), 287-296 (2009).
- Goshima, G., Mayer, M., Zhang, N., Stuurman, N., Vale, R. D. Augmin: A protein complex required for centrosome-independent microtubule generation within the spindle. Journal of Cell Biology. 181 (3), 421-429 (2008).
- Inoue, S., Sato, H. Cell motility by labile association of the nature of mitotic spindle fibers and their role in chromosome movement molecules. Journal of General Physiology. 50 (6), 259-292 (1967).
- Allenspach, A. L., Roth, L. E. Structural variations during mitosis in the chick embryo. Journal of Cell Biology. 33 (1), 179-196 (1967).
- Theg, D. E. Cytoplasmic microtubules in different animal cells. Journal of Cell Biology. 23 (2), 265-275 (1964).
- Mcdonald, K., Pickett-Heaps, J. D., Mcintosh, J. R., Tippit, D. H. On the mechanism of anaphase spindle elongation in Diatoma vulgare. Journal of Cell Biology. 9, 377-388 (1977).
- Chaikin, P. M., Lubensky, T. C. . Principles of Condensed Matter Physics. , (1995).
- Hamon, L., Savarin, P., Curmi, P. A., Pastré, D. Rapid assembly and collective behavior of microtubule bundles in the presence of polyamines. Biophysical Journal. 101 (1), 205 (2011).
- Needleman, D. J., et al. Higher-order assembly of microtubules by counterions: From hexagonal bundles to living necklaces. Proceedings of the National Academy of Sciences. 101 (46), 16099-16103 (2004).
- Ross, J. L., Fygenson, D. K. Mobility of taxol in microtubule bundles. Biophysical Journal. 84, 3959-3967 (2003).
- Sanchez, T., Welch, D., Nicastro, D., Dogic, Z. Cilia-like beating of active microtubule bundles. Science. 333 (6041), 456-459 (2011).
- Brandt, R., Lee, G. Functional organization of microtubule-associated protein tau. Identification of regions which affect microtubule growth, nucleation, and bundle formation in vitro. Journal of Biological Chemistry. 268 (5), 3414-3419 (1993).
- Hirokawa, N. Microtubule organization and dynamics dependent on microtubule-associated proteins. Current Opinion in Cell Biology. 6 (1), 74-81 (1994).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. The Journal of Cell Biology. 109 (3), 1173 (1989).
- MacRae, T. H. Microtubule organization by cross-linking and bundling proteins. Biochimica et Biophysica Acta (BBA). Protein Structure and Molecular Enzymology. 1160 (2), 145-155 (1992).
- She, Z. Y., Wei, Y. L., Lin, Y., Li, Y. L., Lu, M. H. Mechanisms of the Ase1/PRC1/MAP65 family in central spindle assembly. Biological Reviews. 94 (6), 2033-2048 (2019).
- Walczak, C. E., Shaw, S. L. A MAP for Bundling Microtubules. Cell. 142 (3), 364-367 (2010).
- Edozie, B., et al. Self-organization of spindle-like microtubule structures. Soft Matter. 15 (24), 4797-4807 (2019).
- Tulin, A., McClerklin, S., Huang, Y., Dixit, R. Single-molecule analysis of the microtubule cross-linking protein MAP65-1 reveals a molecular mechanism for contact-angle-dependent microtubule bundling. Biophysical Journal. 102 (4), 802-809 (2012).
- Chan, J., Jensen, C. G., Jensen, L. C. W., Bush, M., Lloyd, C. W. The 65-kDa carrot microtubule-associated protein forms regularly arranged filamentous cross-bridges between microtubules. Proceedings of the National Academy of Sciences of the United States of America. 96 (26), 14931-14936 (1999).
- Scheff, D. R., et al. Tuning shape and internal structure of protein droplets via biopolymer filaments. Soft Matter. 16 (24), 5659-5668 (2020).
- Weirich, K. L., et al. Liquid behavior of cross-linked actin bundles. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2131-2136 (2017).
- Weirich, K. L., Dasbiswas, K., Witten, T. A., Vaikuntanathan, S., Gardel, M. L. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences of the United States of America. 166 (23), 11125-11130 (2019).
- Sahu, S., Herbst, L., Quinn, R., Ross, J. L. Crowder and surface effects on self-organization of microtubules. Physical Review E. 103 (6), 062408 (2021).
- Stanhope, K. T., Ross, J. L. Microtubules, MAPs, and motor patterns. Methods in Cell Biology. 128, 23-38 (2015).
- Early Middle Ages drop single.jpg. Wikimedia Commons Available from: https://commons.wikimedia.org/wiki/File:Early_middle_ages_drop_spingle.jpg (2022)
- Lantzsch, I., et al. Microtubule reorganization during female meiosis in c. Elegans. eLife. 10, 58903 (2021).
- Advani, S., Maresca, T. J., Ross, J. L. Creation and testing of a new, local microtubule-disruption tool based on the microtubule-severing enzyme, katanin p60. Cytoskeleton. 75 (12), 531-544 (2018).
- Pecqueur, L., et al. A designed ankyrin repeat protein selected to bind to tubulin caps the microtubule plus end. Proceedings of the National Academy of Sciences of the United States of America. 109 (30), 12011-12016 (2012).
- Valentine, M. T., Fordyce, P. M., Krzysiak, T. C., Gilbert, S. P., Block, S. M. Individual dimers of the mitotic kinesin motor Eg5 step processively and support substantial loads in vitro. Nature Cell Biology. 8 (5), 470-476 (2006).
- Wagenbach, M., Domnitz, S., Wordeman, L., Cooper, J. A kinesin-13 mutant catalytically depolymerizes microtubules in ADP. Journal of Cell Biology. 183 (4), 617-623 (2008).
- McNally, F. J., Vale, R. D. Identification of katanin, an ATPase that severs and disassembles stable microtubules. Cell. 75 (3), 419-429 (1993).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved