Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biochemistry
सूक्ष्मनलिकाएं टैक्टोइड्स की स्व-असेंबली
यह लेख एमएपी 65, एक पौधे आधारित सूक्ष्मनलिका क्रॉसलिंकर और खूंटी को भीड़ एजेंट के रूप में उपयोग करके टैक्टोइड्स के आकार में सूक्ष्मनलिकाएं असेंबली के गठन के लिए एक प्रोटोकॉल प्रस्तुत करता है।
साइटोस्केलेटन सेल के भीतर प्रमुख आंतरिक संगठन और पुन: संगठन के लिए जिम्मेदार है, सभी परिवर्तनों को निर्देशित करने के लिए प्रबंधक के बिना। यह विशेष रूप से माइटोसिस या अर्धसूत्रीविभाजन के दौरान होता है, जहां सूक्ष्मनलिकाएं कोशिका विभाजन के दौरान धुरी बनाती हैं। धुरी कोशिका विभाजन के दौरान आनुवंशिक सामग्री को अलग करने के लिए उपयोग की जाने वाली मशीनरी है। कृत्रिम परिवेशीय में स्व-संगठित स्पिंडल बनाने की दिशा में, हमने हाल ही में सूक्ष्मनलिकाएं से जुड़े प्रोटीन और भीड़ एजेंटों के न्यूनतम सेट के साथ धुरी जैसी विधानसभाओं में सूक्ष्मनलिकाएं पुनर्गठित करने के लिए एक तकनीक विकसित की है। विशेष रूप से, एमएपी 65 का उपयोग किया गया था, जो पौधों से एक एंटीपैरेलल माइक्रोट्यूब्यूल क्रॉसलिंकर है, खमीर से एएसई 1 का एक होमोलॉग और स्तनधारी जीवों से पीआरसी 1 है। यह क्रॉसलिंकर सूक्ष्मनलिकाएं को लंबे, पतले, धुरी जैसी सूक्ष्मनलिकाएं स्व-संगठित विधानसभाओं में व्यवस्थित करता है। ये असेंबली लिक्विड क्रिस्टल टैक्टोइड्स के समान हैं, और सूक्ष्मनलिकाएं मेसोस्केल मेसोजेन के रूप में इस्तेमाल की जा सकती हैं। यहां, प्रोटोकॉल इन सूक्ष्मनलिकाएं टैक्टोइड्स बनाने के साथ-साथ प्रतिदीप्ति माइक्रोस्कोपी का उपयोग करके विधानसभाओं के आकार और फोटोब्लीचिंग के बाद प्रतिदीप्ति वसूली का उपयोग करके घटकों की गतिशीलता की विशेषता के लिए प्रस्तुत किए जाते हैं।
माइटोसिस के माध्यम से कोशिका विभाजन जीवन को बनाए रखने के लिए सबसे महत्वपूर्ण जैविक प्रक्रियाओं में से एक है। ट्यूबुलिन डिमर्स से बने सूक्ष्मनलिका फिलामेंट्स, इस प्रक्रिया के आवश्यक संरचनात्मक तत्व हैं। मेटाफ़ेज़ में बनाई गई क्षणिक मशीनरी जब गुणसूत्र कोशिका केंद्र में संरेखित होते हैं, तो इसके आकार के कारण माइटोटिक स्पिंडल कहा जाता है, जो धागे (चित्रा 1 ए) में कवर किए गए करघे के धुरी की तरह है। यह कई जीवों में अच्छी तरह से स्थापित है कि सूक्ष्मनलिकाएं मेटाफ़ेज़ में संघनित गुणसूत्रों को कोशिका के केंद्र में धकेलने और खींचने के लिए उपयोग की जाती हैं, उन्हें संरेखित करती हैं और उन्हें सूक्ष्मनलिकाएं तक हुक करती हैं जो उन्हें एनाफ़ेज़ (चित्रा 1 बी, सी) में अलग कर देगी। अर्धसूत्रीविभाजन (चित्रा 1 बी) और माइटोसिस (चित्रा 1 सी) दोनों में स्पिंडल रूपों, कई अतिव्यापी सूक्ष्मनलिकाएं धागे की तरह केंद्रीय अक्ष के चारों ओर लिपटे नहीं बल्कि इंटरफ़ेस के समानांतर चल रहे हैं। इन सूक्ष्मनलिका-आधारित संरचनाओं को बनाने के लिए संबंधित प्रोटीन की आवश्यकता होती है जो क्रॉसलिंक और संबंधित एंजाइम जो गुणसूत्रों को धक्का देने और खींचने में मदद करने के लिए मोटर्स के रूप में कार्य कर सकते हैं1.
अर्धसूत्रीविभाजन स्पिंडल के अध्ययन से पता चला है कि सूक्ष्मनलिकाएं क्रॉसलिंक्ड सरणियों 2,3,4,5,6 (चित्रा 1डीआई) में छोटी, गतिशील और अतिव्यापी हैं। इन छोटे सूक्ष्मनलिकाएं के भौतिक संगठन के कारण, अर्धसूत्रीविभाजन धुरी एक तरल क्रिस्टल टैक्टोइड (चित्रा 1 ई) के समान है। दरअसल, स्पिंडल को एकजुट करने और विलय करने के लिए दिखाया गया है, जैसा कि कोई तरल क्रिस्टलटैक्टोइड्स 5 से उम्मीद करेगा।
1960 के दशक में वापस डेटिंग करने वाले कई अध्ययनों ने निर्धारण, धारावाहिक वर्गों और इलेक्ट्रॉन माइक्रोस्कोपी का उपयोग यह निर्धारित करने के लिए किया है कि माइटोटिकस्पिंडल 7,8,9,10 के अंदर दो प्रकार के सूक्ष्मनलिकाएं हैं। पहले प्रकार को किनेटोकोर सूक्ष्मनलिकाएं कहा जाता है, जो स्पिंडल ध्रुव को कीनेटोकोर से जोड़ता है। दूसरे प्रकार को इंटरपोलर या ध्रुवीय सूक्ष्मनलिकाएं कहा जाता है, जो गुणसूत्रों से आगे बढ़ते हैं और मिडज़ोन (चित्रा 1 डीआईआई) 8,9,10 पर ओवरलैप होते हैं। एक तीसरे प्रकार को सूक्ष्म सूक्ष्मनलिकाएं कहा जाता है, जो धुरी के बाहर होते हैं और ध्रुवों को सेल किनारे से जोड़ते हैं; ये सूक्ष्मनलिका संगठन वर्तमान चर्चा के दायरे से बाहर हैं। सूक्ष्मनलिकाएं के लिए न्यूक्लिएशन केंद्रों को प्रभावित करने वाले ऑगमिन6 और गामा-ट्यूबुलिन रिंग कॉम्प्लेक्स के बीच बातचीत पर हालिया अध्ययन हुए हैं, जिसके परिणामस्वरूप चित्रा 1 डी की तरह छोटे सूक्ष्मनलिकाएं के साथ एक माइटोटिक स्पिंडल होता है।
चूंकि सूक्ष्मनलिकाएं चौड़ी होने की तुलना में लंबी होती हैं, उच्च पहलू अनुपात और उच्च कठोरता के साथ, वे तरल क्रिस्टल अणुओं के स्केल-अप संस्करणों की तरह होते हैं। नरम पदार्थ भौतिकी में, परमाणुओं और अणुओं को न्यूक्लिएशन और क्रिस्टल के पिघलने सहित चरण संक्रमण के भौतिक तंत्र को कम करने के लिए न्यूनतम इंटरैक्शन का उपयोग करके अनुमानित किया गया है11. इसी तरह, सूक्ष्मनलिकाएं मेसोस्केल ऑब्जेक्ट्स हैं जो लिक्विड क्रिस्टल अणुओं के स्केल-अप संस्करण हैं, जो लिक्विड क्रिस्टल गतिशीलता के भौतिकी में अंतर्दृष्टि प्रदान करते हैं, जिसमें आइसोट्रोपिक लोगों से नेमेटिक चरणों के न्यूक्लिएशन और विकास शामिल हैं। इसके अलावा, जैसा कि ऊपर चर्चा की गई है, अर्धसूत्रीविभाजन धुरी एक तरल क्रिस्टल टैक्टोइड जैसे गुणों को प्रदर्शित करती है, एक नेमेटिक अवस्था जो तरल क्रिस्टल अणुओं 3,4,5 के आइसोट्रोपिक राज्य से न्यूक्लिएट और बढ़ती है। टैक्टोइड्स के लिए, न्यूक्लिएशन और विकास अन्य क्रिस्टल की तरह होते हैं (यानी, मेसोजेन की अपेक्षाकृत उच्च सांद्रता की आवश्यकता होती है [अणु जो तरल क्रिस्टल बनाते हैं])। टैक्टॉइड का अद्वितीय "स्पिंडल" आकार तरल क्रिस्टल मेसोजेन के स्थानीय संरेखण से आता है जो नेमेटिक चरण (चित्रा 1 ई) में संरेखित होता है। वे एक गोल क्रिस्टल नहीं बना सकते क्योंकि अणु अत्यधिक असममित होते हैं। सूक्ष्मनलिकाएं की प्रकृति को देखते हुए, यह शायद आश्चर्य की बात नहीं है कि सूक्ष्मनलिकाएं की उच्च स्थानीय एकाग्रता से बनी माइटोटिक स्पिंडल-मशीनरी भी उसी आकार की है, चाहे उसे टैक्टोइड या स्पिंडल कहा जाता हो। टैक्टोइड द्विध्रुवी हो सकते हैं, पतला सिरों पर ध्रुवों के साथ (चित्रा 1 ईआई), या सजातीय, अनंत (चित्रा 1ईआईआई) पर प्रभावी ढंग से ध्रुवों के साथ।
स्पिंडल गठन के महत्व को देखते हुए, आयनिक प्रजातियों12,13 के माध्यम से बंडलों में सूक्ष्मनलिका संक्षेपण का प्रदर्शन करके कृत्रिम परिवेशीय में स्व-संगठित स्पिंडल गठन की दिशा में प्रयास चल रहे हैं, भीड़ एजेंट जो कमी इंटरैक्शन14,15 बनाते हैं, और विशिष्ट सूक्ष्मनलिकाएं क्रॉसलिंकिंग प्रोटीन 13,16,17,18,19, 21. हैरानी की बात है, हालांकि ये एजेंट सूक्ष्मनलिकाएं की स्थानीय एकाग्रता को बढ़ाने के लिए काम करते हैं, वे अक्सर लंबे सूक्ष्मनलिकाएं बंडलों का परिणाम देते हैं लेकिन टैक्टोइड नहीं। इन बंडलों के लंबे होने का एक कारण यह हो सकता है कि इनमें शामिल सूक्ष्मनलिकाएं भी लंबी होती हैं। छोटे सूक्ष्मनलिकाएं का उपयोग करके हाल के काम ने लंबे बंडलों की भी सूचना दी जो अंतमें पतला नहीं हैं 15; इस मामले में, बंडलों को मोटर प्रोटीन के साथ एक साथ रखा जाता है जो बंडलों के विस्तार का कारण बनता है और इस तरह, उन्हें लंबा बनाता है। गैर-एक्सटेंसाइल क्रॉसलिंकर के साथ लघु सूक्ष्मनलिकाएं पतला, धुरी जैसी असेंबली के लिए आवश्यक हैं, जैसा कि यहां वर्णित है।
हाल ही में, हमने स्थिर सूक्ष्मनलिकाएं22 की उपस्थिति में एंटीपैरेलल क्रॉसलिंकर, एमएपी 65 का उपयोग करके सूक्ष्मनलिकाएं टैक्टोइड्स के निर्माण को सक्षम करने के लिए एक तकनीक विकसित की है। सूक्ष्मनलिकाएं छोटी होनी चाहिए, फिर भी सूक्ष्मनलिकाएं लंबाई के कुछ ज्ञात नियामक गतिशील अस्थिरता या एंड-टू-एंड एनीलिंग के खिलाफ सूक्ष्मनलिकाएं कैप कर सकते हैं। इसके बजाय, जीएमपीसीपीपी का उपयोग विकास के बाद फिलामेंट्स को न्यूक्लिएट और स्थिर करने के लिए किया गया था। इसने लघु सूक्ष्मनलिकाएं का एक उच्च घनत्व बनाने की अनुमति दी जो टैक्टोइड्स में स्व-व्यवस्थित हो सकते थे। बिरेफ्रिंजेंस के तहत देखे जाने पर ये टैक्टोइड सजातीय थे। लघु सूक्ष्मनलिकाएं के अलावा, एक विशिष्ट एंटीपैरेलल क्रॉसलिंकर, एमएपी 65, को टैक्टोइड्स (चित्रा 2) बनाने के लिए नियोजित किया गया था। एमएपी 65 माइटोटिक क्रॉसलिंकर्स23 के पीआरसी 1 / एएसई 1 परिवार में एक पौधे सूक्ष्मनलिका से जुड़ा प्रोटीन है। एमएपी 65 एक डिमर के रूप में मौजूद है, जिसमें खुद के साथ-साथ सूक्ष्मनलिकाएं24 को बांधने के लिए एक मजबूत आत्मीयता है। एक्टिन फिलामेंट्स25,26,27 के साथ देखे गए अर्धसूत्रीविभाजन स्पिंडल और टैक्टोइड्स के विपरीत, जो द्विध्रुवी हैं और तरल क्रिस्टल के तरल जैसे गुण हैं, सूक्ष्मनलिकाएं टैक्टोइड्स को ठोस जैसे22,28 देखा गया है।
यहां, प्रोटोकॉल सूक्ष्मनलिकाएं टैक्टोइड बनाने और असेंबली के आकार और प्रतिदीप्ति-आधारित तकनीकों का उपयोग करके घटकों की गतिशीलता की विशेषता के लिए प्रस्तुत किए जाते हैं।
नोट: जब तक अन्यथा नहीं कहा जाता है, प्रयोग के कुछ हिस्सों को उचित सुरक्षात्मक उपकरण (दस्ताने) पहने हुए प्रयोगशाला बेंच पर किया जा सकता है।
1. कवरस्लिप सिलानाइजेशन
नोट: कवरलिप्स को इन प्रयोगों में नियोजित बहुलक ब्रश कोटिंग के साथ उपयोग करने के लिए सिलेनाइज्ड किया जाना चाहिए। यह एक हाइड्रोफोबिक सिलेनाइजेशन उपचार है जो हाइड्रोफोबिक केंद्रीय ब्लॉक के साथ एक ब्लॉक कॉपोलिमर को बहुलक ब्रश को बांधने और बनाने की अनुमति देता है। दस्ताने पहनते समय विषाक्त वाष्पों के संपर्क को रोकने के लिए एक धूआं हुड में निम्नलिखित चरणों का प्रदर्शन किया जाना चाहिए। डाइमिथाइलडिक्लोरोलसिलेन अत्यधिक विषाक्त है और इसे अत्यंत सावधानी से संभाला जाना चाहिए।
- आदेश में डीडीएच2ओ, 70% इथेनॉल, और डीडीएच2ओ के साथ कवरलिप्स कुल्ला। प्रत्येक कुल्ला के बीच लिंट-मुक्त प्रयोगशाला पोंछे के साथ उन्हें सुखाएं। यह उपचार से पहले सतह से धूल और पानी में घुलनशील या कार्बनिक कणों को हटा देता है।
- एक धातु कवरस्लिप-होल्डिंग रैक में कवरलिप्स रखें और रैक को यूवी-ओजोन (यूवीओ) मशीन में स्थानांतरित करें। किसी भी पृष्ठभूमि प्रतिदीप्ति को हटाने के लिए 20 मिनट के लिए यूवीओ के साथ कवरलिप्स को विकिरणित करें। यूवीओ के बजाय प्लाज्मा चैंबर का उपयोग किया जा सकता है।
- चिमटी का उपयोग करके, यूवीओ उपचार के लिए उपयोग किए जाने वाले धातु रैक से कवरलिप्स को सिलानाइजेशन के लिए उपयोग किए जाने वाले एक अलग धातु रैक में स्थानांतरित करें। दोनों के लिए एक ही रैक का उपयोग न करें, क्योंकि यूवीओ लागू होने पर यह ऑक्सीकरण के उच्च स्तर का कारण होगा। रैक को पानी और इथेनॉल के साथ पूर्व-साफ करें ताकि पिछले उपयोगों से कोई अवशिष्ट रसायन न रहे।
- 1 घंटे के लिए 100% एसीटोन के साथ एक कंटेनर में कवरलिप्स के साथ रैक विसर्जित करें। सभी एसीटोन को हटाने के लिए कंटेनर 3एक्स को नल के पानी से कुल्लाएं और फिर डीडीएच2ओ के साथ 3एक्स कुल्लाएं।
- 10 मिनट के लिए 100% इथेनॉल में कवरलिप्स के साथ रैक विसर्जित करें। नल के पानी के साथ कंटेनर 3x कुल्ला और फिर सभी इथेनॉल को हटाने के लिए डीडीएच2ओ के साथ 3x।
- प्रत्येक 5 मिनट के लिए डीडीएच2ओ में कवरलिप्स 3 एक्स के साथ रैक विसर्जित करें।
- 15 मिनट के लिए 0.1 एम केओएच (डीडीएच2ओ के 450 एमएल में 1 एम केओएच के 50 एमएल) में कवरलिप्स के साथ रैक विसर्जित करें। नल के पानी के साथ कंटेनर 3 एक्स कुल्ला और फिर सभी केओएच को हटाने के लिए डीडीएच2ओ के साथ 3 एक्स।
- प्रत्येक 5 मिनट के लिए डीडीएच2ओ में कवरलिप्स 3 एक्स के साथ रैक विसर्जित करें।
- एक धूआं हुड या लामिना प्रवाह हुड में रात भर कवरलिप्स के साथ रैक को हवा से सुखाएं।
- रैक और कवरलिप्स को पूरी तरह से सुखाने के बाद, उन्हें 2% डाइमिथाइलडिक्लोरोसिलेन (डीडीएस) में 5 मिनट के लिए विसर्जित करें, जो विशेष रूप से सिलेन के लिए उपयोग किया जाता है। जो कुछ भी सूखा नहीं है उसे सिलेन के संपर्क में न आने दें।
- रैक विसर्जित और कवर 2x 5 मिनट के लिए 100% इथेनॉल के साथ एक कंटेनर में। नल के पानी के साथ कंटेनर 3 एक्स और फिर डीडीएच2ओ के साथ 3 एक्स कुल्ला।
- रैक विसर्जित और कवर 3x डीडीएच2ओ में 5 मिनट प्रत्येक के लिए।
- एक धूआं हुड या लामिना प्रवाह हुड में रात भर कवरलिप्स के साथ रैक को हवा से सुखाएं।
- इस अंतिम सुखाने के चरण के बाद, कवरलिप्स को चिमटी का उपयोग करके कवरस्लिप बॉक्स में वापस स्थानांतरित करें। इन कवरलिप्स का इस्तेमाल अगले 1-2 महीनों में किया जा सकता है। पुराने कवरलिप्स अपनी कोटिंग खोना शुरू कर देंगे और उन्हें त्याग दिया जाना चाहिए।
2. ट्यूबुलिन की तैयारी
नोट: खरीदा ट्यूबुलिन एक लियोफिलाइज्ड पाउडर के रूप में आता है जो या तो अनलेबल या फ्लोरोफोरस के साथ लेबल किया जाता है। लियोफिलाइज्ड ट्यूबुलिन को -80 डिग्री सेल्सियस फ्रीजर में संग्रहीत किया जाता है। निम्नलिखित प्रक्रिया का उपयोग लेबल वाले ट्यूबुलिन के साथ बिना लेबल वाले ट्यूबुलिन को एक अनुपात में मिलाने के लिए किया जाता है जो विज़ुअलाइज़ेशन के लिए अच्छा है।
- -80 डिग्री सेल्सियस फ्रीजर से 1 मिलीग्राम लियोफिलाइज्ड ट्यूबुलिन पाउडर युक्त बिना लेबल वाले ट्यूबुलिन के एक विभाज्य को हटा दें और इसे बर्फ पर रखें। ट्यूबुलिन एकाग्रता को 5 मिलीग्राम / एमएल तक लाने के लिए ट्यूब में ठंडे पीईएम -80 के 200 μL जोड़ें। सभी लियोफिलेट को भंग करने के लिए इसे 10 मिनट के लिए बर्फ पर रखें।
- -80 डिग्री सेल्सियस फ्रीजर से रोडामाइन-लेबल वाले ट्यूबुलिन के एक विभाज्य को हटा दें जिसमें लियोफिलाइज्ड ट्यूबुलिन पाउडर के 20 μg होते हैं और इसे बर्फ पर रखें। ट्यूबुलिन एकाग्रता को 5 मिलीग्राम / एमएल तक लाने के लिए ट्यूब में ठंडे पीईएम -80 के 4 μL जोड़ें। लियोफिलेट को पूरी तरह से भंग करने के लिए इसे 10 मिनट के लिए बर्फ पर रखें।
- एक बार भंग हो जाने के बाद, रोडामाइन-लेबल वाले ट्यूबुलिन के 4 μL समाधान में बिना लेबल वाले पुन: निलंबित ट्यूबुलिन समाधान के 100 μL जोड़ें। पिपेट 6x-7x मिश्रण करने के लिए बहुत धीरे-धीरे। यदि समुच्चय दिखाई दे रहे हैं, तो गोली को त्यागकर और सतह पर तैरनेवाला को बनाए रखने के द्वारा समुच्चय को हटाने के लिए 90,000 एक्स जी पर 10 मिनट के लिए घुलनशील ट्यूबुलिन को अपकेंद्रित्र करें। इस ट्यूबुलिन मिश्रण के परिणामस्वरूप ~ 4% लेबल ट्यूबुलिन होगा।
- तरल नाइट्रोजन (एलएन2) में बिना लेबल वाले ट्यूबुलिन के शेष 100 μL को ड्रॉप-फ्रीज करें और इसे अतिरिक्त ट्यूबुलिन मिक्स के लिए उपयोग करने के लिए -80 डिग्री सेल्सियस पर स्टोर करें।
- लेबल ट्यूबुलिन मिश्रण और विभाज्य प्रत्येक 15 μL के साथ सात ट्यूबों में ले लो। प्रत्येक विभाज्य का उपयोग एक एकल प्रयोगात्मक कक्ष के लिए किया जा सकता है। शेष विभाज्य को ड्रॉप-फ्रीज करें और भविष्य के प्रयोगों के लिए उन्हें -80 डिग्री सेल्सियस पर स्टोर करें।
3. एमएपी 65 शुद्धिकरण
नोट: MAP65 व्यावसायिक रूप से उपलब्ध नहीं है और इस प्रकार, इस काम के लिए शुद्ध करने की आवश्यकता है। प्रोटोकॉल को पहले कई प्रकाशनों23,29 में विस्तृत किया गया है।
- प्रोटीन अभिव्यक्ति के लिए एमएपी 65 प्लास्मिड और जीएफपी-एमएपी 65 प्लास्मिड को बीएल 21 बैक्टीरिया तनाव में बदलें।
- बीएल 21 बैक्टीरिया को 600 एनएम पर 0.6-1 के ऑप्टिकल घनत्व में बढ़ाएं। लाख ऑपरेटर का उपयोग करके प्रोटीन उत्पादन को प्रेरित करें और रात भर बैक्टीरिया को बढ़ाएं।
- संस्कृतियों को गोली मारो और बैक्टीरिया को लाइज करें।
- सेंट्रीफ्यूजेशन के बाद लाइसेट को इकट्ठा करें और इसे मोतियों के साथ सेते हैं जिनमें 6 एक्स-हिस्टिडीन टैग को बांधने के लिए निकल आयन उपलब्ध है।
- इमिडाज़ोल का उपयोग करके प्रोटीन को एल्यूट करें और इसे डीसाल्ट करें।
- तरल नाइट्रोजन के साथ प्रोटीन को ड्रॉप-फ्रीज करें और इसे 1 वर्ष के भीतर उपयोग के लिए -80 डिग्री सेल्सियस पर स्टोर करें।
4. प्रवाह कक्षों की विधानसभा
नोट: प्रयोगों एक ग्लास स्लाइड और सिलानाइज्ड कवर ग्लास (चित्रा 3) से बने प्रवाह कक्षों में प्रदर्शन कर रहे हैं।
- एक ग्लास स्लाइड लें और इसे क्रम में डीडीएच2ओ, इथेनॉल और डीडीएच2ओ का उपयोग करके साफ करें। प्रत्येक कुल्ला के बीच एक लिंट मुक्त प्रयोगशाला पोंछ के साथ सूखी।
- एक प्रवाह पथ बनाने के लिए डबल-पक्षीय टेप के एक टुकड़े का उपयोग करें। दस्ताने वाले हाथों का उपयोग करके, टेप को लंबाई में ~ 25-30 मिमी तक काट लें। दो पतली स्ट्रिप्स बनाने के लिए टेप को लंबाई में विभाजित करें। उनके बीच लगभग 5-8 मिमी के साथ स्लाइड पर दो टेप स्ट्रिप्स रखें।
नोट: चूंकि टेप की मोटाई लगभग 80-100 μm तक मानकीकृत है, टेप के टुकड़ों के बीच पथ की चौड़ाई कक्ष में मात्रा निर्धारित करेगी। - प्रवाह पथ के शीर्ष पर सिलेनाइज्ड कवरलिप्स रखें। स्लाइड को सील करें और पेन के पीछे टेप क्षेत्र पर धीरे-धीरे दबाकर डबल-पक्षीय टेप स्ट्रिप्स पर कवरस्लिप करें। पूरे क्षेत्र पर एक अच्छी मुहर प्राप्त करना सुनिश्चित करें; सील को अच्छी तरह से बनाए जाने पर टेप पारदर्शी से स्पष्ट करने के लिए मुड़ना चाहिए।
- किनारों पर अतिरिक्त टेप निकालें, एक रेजर ब्लेड के साथ टेप को काटकर प्रवाह कक्ष प्रवेश द्वार से केवल 1 मिमी छोड़ दें।
- आवश्यकतानुसार प्रायोगिक मापदंडों पर जानकारी के साथ कक्ष को लेबल करें।
5. टैक्टॉइड प्रयोग
नोट: एक बार जब सभी अभिकर्मकों और आपूर्ति उत्पन्न हो जाती है, तो उनका उपयोग प्रवाह कक्ष में सूक्ष्मनलिकाएं टैक्टोइड्स को न्यूक्लिएट और पॉलीमराइज़ करने के लिए किया जा सकता है।
- उपयोग किए जाने वाले सभी अभिकर्मकों को इकट्ठा करें। उन्हें बर्फ पर पिघलाएं और काम करते समय बर्फ पर स्टोर करें। प्रयोगों के लिए कई प्रवाह कक्षों बनाओ.
- प्रत्येक प्रयोग के लिए एक प्रवाह कक्ष का प्रयोग करें। पीईएम -80 में भंग 5% गैर-आयनिक ब्लॉक सह-बहुलक सर्फैक्टेंट (सामग्री की तालिका) के 20 μL में बहकर बहुलक ब्रश के साथ प्रवाह कक्ष सतहों को कोट करें, कक्ष के दोनों सिरों पर छोटी बूंदों के साथ अंदर हवा के बुलबुले के गठन को रोकने के लिए। उपयोग करने के लिए तैयार होने तक इसे एक आर्द्र कक्ष (यानी, गीले लिंट-मुक्त प्रयोगशाला पोंछने के साथ पेट्री डिश) में रखें (कम से कम 5-7 मिनट)।
- एक बाँझ ट्यूब में, ट्यूबुलिन-एमएपी मिश्रण बनाने के लिए निम्नलिखित मिश्रण करें: पीईएम -80 के 9.5 μL; 10 एमएम जीएमपीसीपीपी के 4 μL; 5% प्लूरोनिक-एफ 127 के 4 μL; 1 एम डीटीटी का 1 μL; ग्लूकोज के 1 μL; पॉलीथीन ग्लाइकॉल (खूंटी) के 2 μL; चरण 2.5 से 5 मिलीग्राम /एमएल ट्यूबुलिन मिश्रण (13.6 μM अंतिम एकाग्रता) के 12 μL.; और एमएपी 65 के कामकाजी स्टॉक का 5.5 μL जहां 10% विज़ुअलाइज़ेशन के लिए जीएफपी-एमएपी 65 है। मिश्रण करते समय बर्फ पर रखें।
नोट: चिपचिपा खूंटी समाधान से निपटने के लिए एक सकारात्मक विस्थापन विंदुक का उपयोग करने की सिफारिश की जाती है। उद्घाटन को बड़ा बनाने के लिए टिप काटने के बाद नियमित पिपेट का उपयोग किया जा सकता है; हालाँकि, यह विधि कम सटीक है। - पाइपिंग द्वारा 5x-6x मिलाएं।
- कक्ष में जोड़ने से ठीक पहले, ट्यूबुलिन-एमएपी मिश्रण में ग्लूकोज ऑक्सीडेज (0.5 मिलीग्राम / एमएल) और कैटालेज (0.15 मिलीग्राम / एमएल) (डीऑक्सी) के पूर्व-मिश्रित समाधान के 1 μL जोड़ें और 7x-8x मिलाएं। समाधान (40 μL) की कुल मात्रा को अलग-अलग कक्षों में उपयोग करने के लिए दो भागों में विभाजित करें।
- कक्षों में ट्यूबुलिन-एमएपी मिश्रण प्रवाह। चूंकि कक्षों में पहले से ही गैर-आयनिक ब्लॉक सह-बहुलक सर्फैक्टेंट है, इसलिए पुराने तरल को हटाए बिना अधिक तरल नहीं जोड़ा जा सकता है। ऐसा करने के लिए, केशिका कार्रवाई के माध्यम से तरल को हटाने के लिए कक्ष के दूसरे छोर पर फिल्टर पेपर या लिंट-मुक्त प्रयोगशाला पोंछे के एक टुकड़े का उपयोग करें।
- एक बार नमूना पूरी तरह से कक्ष के अंदर है, 5 मिनट एपॉक्सी का उपयोग कर कक्ष के दो सिरों सील और न्यूक्लिएट और सूक्ष्मनलिका टैक्टोइड ्स बढ़ने के लिए ~ 30 मिनट के लिए 37 डिग्री सेल्सियस पर रखें।
6. प्रतिदीप्ति माइक्रोस्कोपी
- टैक्टोइड्स इमेजिंग के लिए प्रतिदीप्ति माइक्रोस्कोप का उपयोग करें।
नोट: कुल आंतरिक प्रतिबिंब प्रतिदीप्ति माइक्रोस्कोपी या कताई डिस्क कंफोकल माइक्रोस्कोपी मुक्त ट्यूबुलिन से पृष्ठभूमि प्रतिदीप्ति को हटाने के लिए अच्छा है, लेकिन टैक्टोइड नियमित रूप से एपीआई-प्रतिदीप्ति द्वारा भी दिखाई देते हैं और यहां तक कि एक बार बनने के बाद प्रकाश माइक्रोस्कोपी भी प्रेषित होते हैं, जिससे यह प्रक्रिया विशेष उपकरणों के बिना सुलभ हो जाती है। - प्रतिदीप्ति में पर्याप्त प्रकाश इकट्ठा करने के लिए 60x या उच्चतर के आवर्धन के साथ 1.2 एनए या उच्चतर के संख्यात्मक एपर्चर (एनए) उद्देश्य का उपयोग करें। इन उद्देश्यों को अक्सर डीडीएच2ओ या तेल में विसर्जन की आवश्यकता होती है।
- सीएमओएस या सीसीडी कैमरे के साथ छवियों को रिकॉर्ड करें। 108 एनएम के कैमरे पर एक प्रभावी पिक्सेल आकार का उपयोग करें।
नोट: पिक्सेल आकार कैमरे और उपयोग किए गए आवर्धन पर निर्भर करता है, जो इस मामले में उच्च संख्यात्मक एपर्चर (1.2 या 1.49 एनए) के साथ 60x या 100x था। आवश्यक पिक्सेल आकार प्राप्त करने के लिए कैमरे से पहले अतिरिक्त छवि विस्तारक का उपयोग किया जा सकता है। - इस तापमान पर सेट एक पर्यावरण कक्ष का उपयोग करके नमूने को 37 डिग्री सेल्सियस पर रखें। वैकल्पिक रूप से, गर्म हवा के चरण हीटर और परिसंचारी गर्म पानी के साथ उद्देश्य तापमान-नियंत्रित कॉलर सहित अन्य चरण हीटर को नियोजित करें।
- उत्तेजना स्रोतों का उपयोग करें जो आवश्यक प्रतिदीप्ति के लिए सही हैं। रोडामाइन ट्यूबुलिन के लिए, नमूने में कम से कम 1 मेगावाट बिजली के साथ 561 एनएम लेजर का उपयोग करें, और जीएफपी-एमएपी 65 के लिए, नमूने में कम से कम 1 मेगावाट शक्ति के साथ 488 एनएम लेजर का उपयोग करें।
नोट: यदि व्यापक क्षेत्र एपीआई प्रतिदीप्ति माइक्रोस्कोपी का उपयोग कर रहे हैं, तो उत्तेजना के साथ रोडामाइन फिल्टर क्यूब का उपयोग करें: 540 ± 12.5 एनएम, डाइक्रोइक: 545 एनएम ± 12.5 एनएम कट-ऑफ, और उत्सर्जन: 575 एनएम लंबा पास, और उत्तेजना के साथ एक जीएफपी फिल्टर घन: 480 ± 15 एनएम, डाइक्रोइक: 505 एनएम ± 15 एनएम कट-ऑफ, और उत्सर्जन: 515 एनएम कट-ऑफ, और उत्सर्जन: 515 एनएम लंबे समय तक। - 100 से अधिक टैक्टोइड्स की छवि के लिए विभिन्न क्षेत्रों की कम से कम 10 छवियां लें। लाल और हरे दोनों चैनलों में छवियों को लें और उन्हें विश्लेषण के लिए 16-बिट टिफ छवियों के रूप में सहेजें। सुनिश्चित करें कि रोशनी शक्ति और एक्सपोज़र समय ऐसे हैं कि कैमरे के लिए तीव्रता पैमाने संतृप्त नहीं है।
7. फोटोब्लीचिंग (एफआरएपी) के बाद प्रतिदीप्ति वसूली
नोट: टैक्टोइड्स के आंतरिक घटकों की गतिशीलता का अध्ययन करने के लिए, एफआरएपी का उपयोग किया गया था। एफआरएपी रोडामाइन-लेबल वाले ट्यूबुलिन और जीएफपी-लेबल वाले एमएपी 65 टैक्टॉइड के एक चयनित हिस्से को फोटोब्लीच करके और फिर उस क्षेत्र में समय के साथ प्रतिदीप्ति की वसूली का अवलोकन करके काम करता है। वसूली की दर फोटोब्लीच की जा रही प्रजातियों के कारोबार पर निर्भर करती है। यह टर्नओवर दर प्रसार और बाध्यकारी प्रतिक्रियाओं पर निर्भर कर सकती है। टैक्टोइड्स के लिए एमएपी 65 बाध्यकारी के लिए, बाध्यकारी विनिमय दरों का अनुमान लगाया जा सकता है। एफआरएपी एक अतिरिक्त 405 एनएम लेजर सिस्टम का उपयोग करके किया जाता है जो लेजर को किसी भी आकार में स्कैन कर सकता है। एफआरएपी करने के लिए कई संभावनाएं हैं, जिसमें स्थानीय क्षेत्र14 को फोटोब्लीच करने के लिए प्रेषित दीपक और एपर्चर का उपयोग करना शामिल है।
- कक्ष में एक पृथक टैक्टॉइड का चयन करें ताकि टैक्टोइड्स और आसपास के समाधान के कुछ हिस्सों को कवर करने वाले ब्याज (आरओआई) का एक क्षेत्र बनाया जा सके।
- ट्यूबुलिन और एमएपी 65 दोनों को एक साथ फोटोब्लीच करने के लिए एफआरएपी के लिए अतिरिक्त 405 एनएम लेजर के साथ एक माइक्रोस्कोप का उपयोग करें। वैकल्पिक रूप से, आईरिस14 के फील्ड स्टॉप के माध्यम से एक उज्ज्वल दीपक का उपयोग किया जा सकता है। विरंजन के दौरान प्रोटीन को नुकसान पहुंचाने से बचने के लिए अनुभवजन्य रूप से फोटोब्लीचिंग सिस्टम की विशिष्ट तीव्रता को समायोजित करें।
- ब्लीच से पहले तीव्रता के बारे में जानकारी प्राप्त करने के लिए फोटोब्लीचिंग से पहले 30-60 एस के लिए एक समय श्रृंखला फिल्म के रूप में टैक्टॉइड रिकॉर्ड करें। लाल और हरे दोनों चैनलों को रिकॉर्ड करें।
- फोटोब्लीच या तो लेजर या दीपक के साथ आरओआई को उजागर करके तब तक टैक्टॉइड को फोटोब्लीच करें जब तक कि टैक्टॉइड को नुकसान पहुंचाए बिना फोटोब्लीच की आवश्यकता हो। तीव्रता और समय अनुभवजन्य रूप से निर्धारित करें।
- 5-10 मिनट के बाद फोटोब्लीचिंग के लिए या वसूली संतुलन तक पहुंचने तक दोनों रंग चैनलों में फिल्म रिकॉर्ड करना जारी रखें।
- नेत्रहीन वसूली के लिए जीएफपी-एमएपी 65 चैनल का निरीक्षण करें।
8. डेटा विश्लेषण
नोट: विभिन्न भीड़ एजेंटों, आयनिक स्थितियों और अन्य कारकों के अलावा के माध्यम से लगाए गए पर्यावरणीय परिवर्तनों के प्रभावों के बारे में जानने के लिए टैक्टोइड्स की छवियों का मात्रात्मक विश्लेषण किया गया था।
- टैक्टोइड आकार लक्षण वर्णन
- कॉन्फोकल माइक्रोस्कोपी के साथ ली गई लाल और हरे रंग की छवियों से टैक्टोइड्स की लंबाई और चौड़ाई की मात्रा निर्धारित करें।
- फ़िजी / इमेजजे का उपयोग करके छवियों को खोलें।
- यदि कच्चा डेटा 16-बिट में लिया जाता है, तो यदि आवश्यक हो तो चमक और कंट्रास्ट समायोजित करें। छवि का चयन करें > टैक्टॉइड को स्पष्ट रूप से देखने में सक्षम होने के लिए छवि को समायोजित करने के लिए चमक और कंट्रास्ट > समायोजित करें। सेटिंग को लागू किए बिना चमक और कंट्रास्ट समायोजित करें ताकि गलती से तीव्रता डेटा को न बदलें।
- एक बार जब टैक्टोइड स्पष्ट रूप से दिखाई देते हैं, तो मापने के लिए अच्छे टैक्टोइड्स का चयन करें (चित्रा 4 बीआई)। सुनिश्चित करें कि टैक्टोइड किसी भी अन्य टैक्टॉइड या समुच्चय के साथ ओवरलैप के साथ स्पष्ट रूप से दिखाई देते हैं और सीधी रेखा माप उपकरण का उपयोग करने में सक्षम होने के लिए घुमावदार या मुड़े हुए नहीं हैं।
- अगला, जांचें कि छवियों के लिए सही पिक्सेल आकार सेट किया गया है। माइक्रोस्कोप छवियां पिक्सेल आकार के बारे में मेटाडेटा के साथ आती हैं। मेटाडेटा या बाह्य छवि विस्तार सिस्टम नहीं है जो अपेक्षित प्रभावी पिक्सेल आकार परिवर्तित कर सकते हैं जो किसी भिन्न कैमरे का उपयोग करते समय, पिक्सेल आकार मैन्युअल रूप से समायोजित करें। FIJI/ImageJ में, सही पिक्सेल रूपांतरण सेट करने के लिए विश्लेषण > सेट स्केल पर जाएँ।
- इमेजजे में टूलबार से स्ट्रेट लाइन टूल का उपयोग करके, टैक्टॉइड के एक छोर पर क्लिक करें और कर्सर को टैक्टॉइड (चित्रा 4बीआईआई) के दूसरे छोर पर खींचें। एक बार लाइन आरओआई का चयन हो जाने के बाद, लंबाई को मापने के लिए विश्लेषण > माप का चयन करें। यदि लंबाई डिफ़ॉल्ट रूप से मापा नहीं जाता है, तो माप का विश्लेषण करें > सेट करें संवाद बॉक्स में लंबाई शामिल करने के लिए माप सेट करना सुनिश्चित करें।
नोट: आमतौर पर, सीधी रेखा उपकरण का उपयोग करके मापते समय, यह खींची गई रेखा की लंबाई और कोण देगा। एक उदाहरण के रूप में, चित्रा 4बीबीआई उत्तरार्द्ध को दृश्यमान बनाने के लिए टैक्टोइड के किनारे खींची गई एक सीधी रेखा दिखाता है लेकिन सीधे टैक्टॉइड पर माप करता है। - माप करने के बाद, टैक्टॉइड को लेबल करने के लिए टूलबार में टेक्स्ट टूल का उपयोग करें। कोई पाठ बॉक्स बनाएँ, कोई संख्या लेबल जोड़ें, और छवि में लेबल को ठीक करने के लिए आरेखित > संपादित करें का चयन करें. छवि को एक अलग आरओआई फ़ाइल के रूप में सहेजें।
नोट: इस फ़ाइल को लेबलिंग और सहेजने से अन्वेषक को यह जानने की अनुमति मिलती है कि कौन सा माप कच्चे डेटा से किस टैक्टॉइड से मेल खाता है। प्रत्येक टैक्टॉइड को एक बार मापना सुनिश्चित करें। - संपूर्ण छवि के लिए टैक्टोइड्स को मापने के बाद, परिणाम विंडो में डेटा को अल्पविराम- या टैब-सीमांकित टेक्स्ट फ़ाइल ( फ़ाइल > इस रूप में सहेजें) में सहेजें और डेटा को संख्याओं में पार्स करने के लिए स्प्रेडशीट प्रोग्राम में डेटा खोलें। सब कुछ व्यवस्थित रखने के लिए एक उपयुक्त नामकरण सम्मेलन के साथ एक फ़ोल्डर में सभी डेटा (कच्ची छवि डेटा, आरओआई छवि और परिणामों की पाठ फ़ाइल) एकत्र करें।
नोट: यद्यपि टैक्टॉइड लंबाई माप हाथ से किए जाते हैं, यह देखते हुए कि टैक्टॉइड चौड़ाई संकीर्ण है, माप त्रुटि को कम करने के लिए टैक्टोइड चौड़ाई (नीचे देखें) को मापने के लिए एक अलग विधि को नियोजित करना बेहतर है। - फिजी का उपयोग करके, स्ट्रेट लाइन टूल का उपयोग करके एक रेखा क्षेत्र खींचें। टैक्टॉइड लंबी धुरी (चित्रा 4बीआई) के लिए एक लंबवत द्विभाजक के रूप में रेखा खींचें।
- रैखिक द्विभाजक (चित्रा 4बीआईआई) की तीव्रता प्रोफ़ाइल बनाने के लिए विश्लेषण > प्लॉट प्रोफाइल का चयन करें। एक प्लॉट दिखाई देगा। प्लॉट से डेटा पुनर्प्राप्त करने और सहेजने के लिए, निचले बाईं ओर सूची बटन का चयन करें; यह खींची गई रेखा की लंबाई के साथ तीव्रता डेटा की पाठ फ़ाइल सूची उत्पन्न करता है। पाठ फ़ाइल को किसी .csv या .txt फ़ाइल के रूप में सहेजें.
- पाठ फ़ाइल को किसी फिटिंग प्रोग्राम जैसे मैटलैब, पायथन (एससीआईपीआई), या अन्य प्रोग्राम में खोलें। फॉर्म के गाऊसी फ़ंक्शन के साथ तीव्रता डेटा फिट करें:
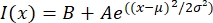 , जहां मैं (एक्स) लंबाई के साथ ग्रेस्केल मान है, एक्स; बी पृष्ठभूमि स्तर है; ए गाऊसी का आयाम है; μ गाऊसी का माध्य या केंद्र है; और σ गाऊसी का मानक विचलन है।
, जहां मैं (एक्स) लंबाई के साथ ग्रेस्केल मान है, एक्स; बी पृष्ठभूमि स्तर है; ए गाऊसी का आयाम है; μ गाऊसी का माध्य या केंद्र है; और σ गाऊसी का मानक विचलन है। - रिपोर्ट 2σ टैक्टॉइड की चौड़ाई के रूप में। गाऊसी (पृष्ठभूमि सहित नहीं) के तहत क्षेत्र की गणना करके टैक्टोइड में सूक्ष्मनलिकाएं की तीव्रता का अनुमान लगाएं।
नोट: यदि छवियां कैमरे की रैखिक तीव्रता सीमा के भीतर हैं और एक ही एक्सपोजर समय और उत्तेजना तीव्रता के साथ ली जाती हैं, तो एकीकृत तीव्रता की तुलना टैक्टॉइड में सूक्ष्मनलिकाएं की सापेक्ष संख्या का अनुमान लगाने के लिए की जा सकती है।
- एफआरएपी विश्लेषण
नोट: सूक्ष्मनलिकाएं और एमएपी 65 की गतिशीलता का परीक्षण करने के लिए प्रयोगों ने आणविक गति (चित्रा 5 ए) के कारण विशिष्ट फोटोब्लीचिंग और तीव्रता की वसूली को रिकॉर्ड करने के लिए एफआरएपी का उपयोग किया। फिजी का उपयोग करके छवि समय श्रृंखला डेटा से डेटा की मात्रा निर्धारित की गई थी।- चलचित्र डेटा खोलने के लिए इमेजजे/फिजी का उपयोग करें।
- बहाव को हटाने के लिए समय के साथ ढेर (समय श्रृंखला डेटा) पंजीकृत करें। सहायक टर्बोरेग प्लगइन के साथ स्टैकरेग प्लगइन का उपयोग करें; प्लगइन्स का उपयोग करने के निर्देशों के लिए, सामग्री की तालिका में दिए गए वेबलिंक देखें। फ्रेम की स्थिति को स्थानांतरित करने के लिए अनुवाद का चयन करें और इस प्रकार छवियों को पंजीकृत करें।
- एक बार जब छवियों को बहाव को हटाने के लिए पंजीकृत किया जाता है, तो छवि को घुमाएं ताकि छवि > ट्रांसफॉर्म > रोटेट का चयन करके स्पर्श फ्रेम में ऊर्ध्वाधर या क्षैतिज हो। घुमाने के लिए कोण का चयन करें और यह निर्धारित करने के लिए पूर्वावलोकन का उपयोग करें कि क्या टैक्टॉइड पर्याप्त घुमाया गया है। जब पूर्वावलोकन दिखाता है कि टैक्टॉइड या तो ऊर्ध्वाधर या क्षैतिज है, तो फिल्म में सभी छवियों को घुमाने के लिए ठीक का चयन करें।
- टैक्टॉइड के फोटोब्लीच्ड क्षेत्र पर एक आयताकार अनुभाग बनाने के लिए टूलबार में आयत चयन उपकरण का उपयोग करें। छवि > स्टैक > माप स्टैक का उपयोग करके प्रत्येक फ्रेम के लिए आरओआई क्षेत्र की एकीकृत तीव्रता रिकॉर्ड करें। विश्लेषण > सेट माप का उपयोग करके एकीकृत घनत्व के लिए माप प्रकार सेट करें। परिणाम विंडो में दिखाए गए विश्लेषण किए गए तीव्रता डेटा को फ़ाइल > इस रूप में सहेजें का चयन करके .csv या .txt स्वरूप में पाठ फ़ाइल के रूप में सहेजें।
नोट: चित्रा 5 बी ब्लीच क्षेत्र में सूक्ष्मनलिकाएं और जीएफपी-एमएपी 65 चैनलों के लिए मापा कच्चे 16-बिट तीव्रता डेटा का एक उदाहरण दिखाता है। - इमेजिंग के कारण फोटोब्लीचिंग के कारण विश्व स्तर पर समय के साथ छवियों की समग्र तीव्रता फीकी हो जाएगी, इस वैश्विक फोटोब्लीचिंग को ठीक किया जाना चाहिए। ऐसा करने के लिए, एक ही आरओआई आकार (चरण 8.2.4.) का उपयोग करें, और इसे छवि की पृष्ठभूमि में एक ऐसे क्षेत्र में ले जाएं जहां कोई सूक्ष्मनलिकाएं या एमएपी 65 दिखाई नहीं दे रहे हैं। चरण 8.2.4 में वर्णित स्टैक की एकीकृत तीव्रता को मापें। परिणामों को दूसरी पाठ फ़ाइल के रूप में सहेजें.
नोट: चित्रा 5 बी पृष्ठभूमि क्षेत्र में सूक्ष्मनलिकाएं और जीएफपी-एमएपी 65 चैनलों के लिए मापा कच्चे 16-बिट तीव्रता डेटा का एक उदाहरण दिखाता है। - पृष्ठभूमि लुप्त होती को सही करने के लिए, एक ही समय बिंदु के लिए पृष्ठभूमि तीव्रता से टैक्टोइड पर सिग्नल तीव्रता को विभाजित करें। गणना मैंने (टी) को ठीक किया:
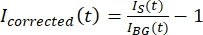 , जहां मैंएस (टी) (सिग्नल) प्रक्षालित क्षेत्र पर किया गया माप है और मैंबीजी (टी) (शोर) पृष्ठभूमि क्षेत्र (चित्रा 5 सी) पर किया गया माप है। यह प्रत्येक फ्रेम के लिए सिग्नल-टू-शोर अनुपात की गणना करता है और शोर को भी घटाता है।
, जहां मैंएस (टी) (सिग्नल) प्रक्षालित क्षेत्र पर किया गया माप है और मैंबीजी (टी) (शोर) पृष्ठभूमि क्षेत्र (चित्रा 5 सी) पर किया गया माप है। यह प्रत्येक फ्रेम के लिए सिग्नल-टू-शोर अनुपात की गणना करता है और शोर को भी घटाता है। - फिर, डेटा को शून्य और एक के बीच रेंज करने के लिए रीस्केल करें
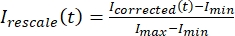 , जहां मैंन्यूनतम और मैंअधिकतम क्रमशः, पूरे समय (चित्रा 5 सी) में मैंने डेटाको सही किया, वैश्विक न्यूनतम और अधिकतम निरूपित करता हूं।
, जहां मैंन्यूनतम और मैंअधिकतम क्रमशः, पूरे समय (चित्रा 5 सी) में मैंने डेटाको सही किया, वैश्विक न्यूनतम और अधिकतम निरूपित करता हूं। - इस डेटा को फॉर्म के क्षयकारी घातीय में फिट करें:
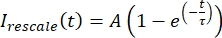 , जहां ए वसूली का आयाम है और ω वसूली का टाइमस्केल है (चित्रा 5 सी)।
, जहां ए वसूली का आयाम है और ω वसूली का टाइमस्केल है (चित्रा 5 सी)।
घटकों, ट्यूबुलिन डिमर्स, और सूक्ष्मनलिकाएं क्रॉसलिंकर्स की केवल एक छोटी संख्या के साथ, सूक्ष्मनलिकाएं टैक्टोइड (चित्रा 2 ए) बना सकते हैं। यद्यपि यह प्रोटोकॉल एक इनक्यूबेटर में सूक्ष्मनलिकाएं बढ़ाने और बढ़ने के लिए इनक्यूबेशन का वर्णन करता है, न्यूक्लिएशन और विकास सीधे माइक्रोस्कोप (जो 30 मिनट के भीतर पूरा हो गया है) (चित्रा 2 बी) के तहत देखा जा सकता है। ट्यूबुलिन की एकाग्रता 13.6 μm और MAP65-MT बाध्यकारी 10% पर स्थिर रखी जाती है।
चित्रा 4 सफल डेटा का प्रतिनिधित्व करता है। टैक्टोइडट्यूबुलिन चैनल में 561 एनएम लेजर और एमएपी 65 चैनल में 488 एनएम दोनों के साथ दिखाई देना चाहिए, जो पूरी तरह से एक दूसरे के साथ ओवरलैप होते हैं (चित्रा 4 ए)। प्रणाली का एक रहस्य यह रहा है कि टैक्टोइड्स की चौड़ाई विभिन्न प्रकार के प्रयोगात्मक परिवर्तनों के तहत भिन्न नहीं होती है, जिसमें सूक्ष्मनलिका लंबाई, एमएपी 65 एकाग्रता और भीड़ एजेंटों (चित्रा 4 बी) 22,28 को बदलना शामिल है। लंबाई बहुत अधिक परिवर्तनशील है और सूक्ष्मनलिका लंबाई और एमएपी 65 एकाग्रता (चित्रा 4 बी) 22,28 दोनों पर निर्भर करती है।
एफआरएपी करते समय, यह देखा गया है कि एमएपी 65 सिग्नल ठीक हो जाता है, लेकिन सूक्ष्मनलिका संकेत ठीक नहीं होता है (चित्रा 5)। एफआरएपी में वसूली लेबल और फोटोब्लीच्ड ऑब्जेक्ट्स की गतिशीलता और आंदोलन के कारण होती है। एमएपी 65 के मामले में, अंधेरे अणु अलग हो जाते हैं और सूक्ष्मनलिकाओं से दूर चले जाते हैं और नए क्षेत्र (चित्रा 5) में चले जाते हैं। एमएपी 65 बाध्यकारी संतुलन में है, इसलिए बाध्यकारी और अनबाइंडिंग की दर बराबर है (प्रति सेकंड अणुओं में मापा जाता है)। सूक्ष्मनलिकाएं के लिए, कोई वसूली नहीं देखी गई थी जिसका अर्थ है कि सूक्ष्मनलिकाएं टैक्टोइड (चित्रा 5 ए, बीआई, सी) छोड़ने में सक्षम नहीं हैं। इसके अलावा, अंधेरे क्षेत्र का कोई प्रसार नहीं देखा गया था, यह सुझाव देते हुए कि सूक्ष्मनलिकाएं स्थानीय रूप से स्थिर हैं और टैक्टोइड आकार के भीतर तरल पदार्थ नहीं हैं।
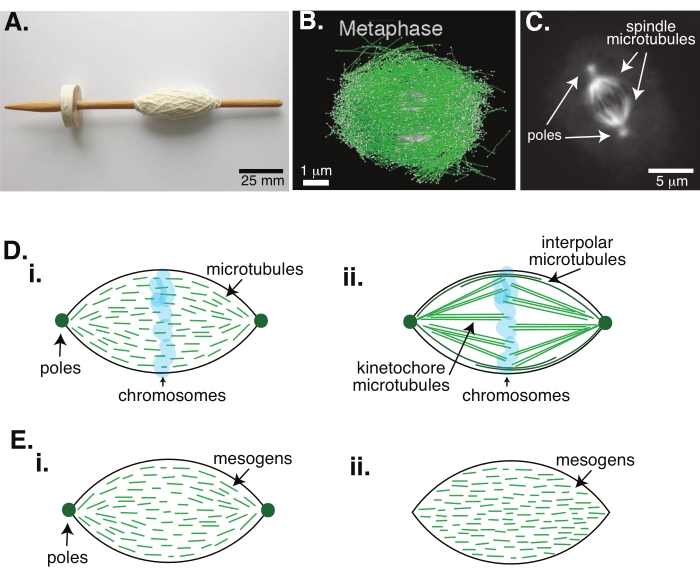
चित्रा 1: धुरी गठन के विभिन्न मॉडल। माइटोटिक स्पिंडल सूक्ष्मनलिकाएं और उनके संबंधित प्रोटीन और एंजाइमों से बनी एक मशीन है जो कोशिका विभाजन के दौरान गुणसूत्रों को दो नई बेटी कोशिकाओं में संरेखित और अलग करती है। (ए) नीदरलैंड से ठीक यार्न के साथ प्रारंभिक मध्य युग ड्रॉप स्पिंडल प्रतिकृति की छवि। इस आंकड़े को पीटर वैन डेर स्लुइज30 द्वारा विकिमीडिया छवि से संशोधित किया गया है। (बी) जंगली प्रकार अर्धसूत्रीविभाजन द्वितीय के विभिन्न चरणों में सूक्ष्मनलिकाएं का त्रि-आयामी पुनर्निर्माण। सूक्ष्मनलिकाएं हरे रंग में दिखाई जाती हैं, और गुणसूत्रों को ग्रे में दिखाया जाता है। स्केल बार = 1 μm। इस आंकड़े को लैंट्ज़श एट अल .31 से संशोधित किया गया है। (सी) एक विभाजित एसएफ 9 सेल के माइटोटिक स्पिंडल में सूक्ष्मनलिकाएं की माइक्रोस्कोपी छवि। धुरी ध्रुवों और धुरी के सूक्ष्मनलिकाएं को हरे फ्लोरोसेंट प्रोटीन के साथ लेबल किया जाता है। स्केल बार = 5 μm। इस आंकड़े को आडवाणी एट अल.32 से संशोधित किया गया है। (डी) माइटोटिक और अर्धसूत्रीविभाजन स्पिंडल सूक्ष्मनलिकाएं कैसे व्यवस्थित की जाती हैं, इसके विभिन्न मॉडल। (i) पहले ज़ेनोपस अंडे के अर्क से बनाए गए अर्धसूत्रीविभाजन स्पिंडल के लिए मनाया गया था, सूक्ष्मनलिकाएं (हरा) पूरे धुरी में छोटा और गतिशील होने का अनुमान लगाया गया था। यह एक तरल क्रिस्टल के अंदर एक द्विध्रुवी टैक्टॉइड संगठन के समान है। (ii) माइटोटिक स्पिंडल के अंदर सूक्ष्मनलिकाएं संगठन के लिए विहित मॉडल में दो प्रकार के सूक्ष्मनलिकाएं होती हैं: इंटरपोलर या ध्रुवीय सूक्ष्मनलिकाएं (गहरे हरे रंग की) जो गुणसूत्रों के चारों ओर मिडज़ोन पर क्रॉसलिंक करती हैं और कीनेटोकोर सूक्ष्मनलिकाएं (हल्के हरे रंग की) जो गुणसूत्रों को धक्का देने और खींचने के लिए ध्रुव से कीनेटोकोर तक बंडल और फैली होती हैं। सभी छवियों में, गुणसूत्रों को पारदर्शी नीले रंग में दिखाया गया है, और धुरी ध्रुवों को गहरे हरे रंग में दर्शाया गया है। (ई) (i) द्विध्रुवी और (ii) सजातीय टैक्टोइड के लिए एक तरल क्रिस्टल टैक्टोइड में मेसोजेन्स (हरी रेखाओं) की योजनाबद्धता। द्विध्रुवी टैक्टोइड्स में टैक्टॉइड के अंत में दो ध्रुव होते हैं, और मेसोजेन उन ध्रुवों को इंगित करने के लिए फिर से उन्मुख होते हैं। सजातीय टैक्टोइड्स में अनंत पर ध्रुव होते हैं, और मेसोजेन टैक्टॉइड की लंबाई के साथ अभिविन्यास नहीं बदलते हैं। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
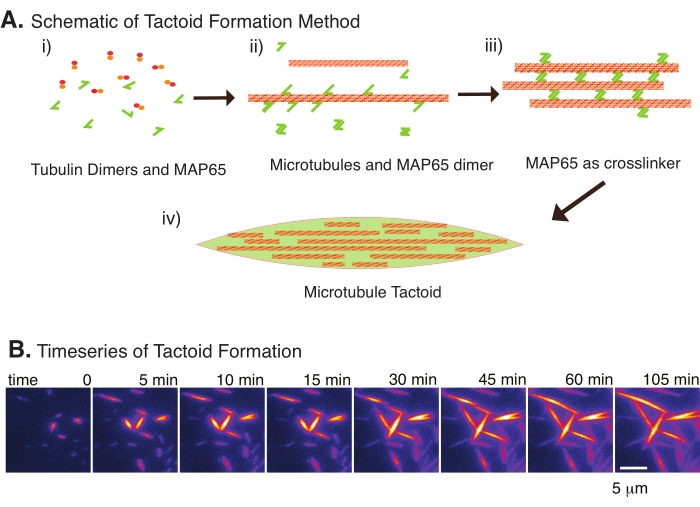
चित्रा 2: सूक्ष्मनलिकाएं संक्षेपण (ए) सूक्ष्मनलिकाएं आयनिक प्रजातियों, भीड़ एजेंटों के कारण कमी बलों और विशिष्ट सूक्ष्मनलिकाएं क्रॉसलिंकर, जैसे एमएपी 65 सहित विभिन्न तरीकों से बंडल और क्रॉसलिंक की जा सकती हैं। (i) सूक्ष्मनलिकाएं उगाने और बढ़ाने के लिए ट्यूबुलिन डिमर और एमएपी65 प्रोटीनों को मिलाया जाता है। (ii) सूक्ष्मनलिकाएं ट्यूबुलिन से न्यूक्लिएट और बढ़ती हैं, और एमएपी 65 तुरंत सूक्ष्मनलिकाएं, एक और एमएपी 65 मोनोमर, या दोनों को बांधता है और बंडलिंग का कारण बनता है। (iii) क्रॉसलिंक किए गए बंडलों में सूक्ष्मनलिकाएं न्यूक्लिएट और बढ़ती हैं। (iv) अंतिम विन्यास एक धुरी के समान एक सूक्ष्मनलिका टैक्टॉइड है। (बी) सूक्ष्मनलिकाएं टैक्टोइड्स की समय श्रृंखला न्यूक्लिएटिंग और 105 मिनट से अधिक बढ़ रही है। स्केल बार = 5 μm। एडोज़ी एट अल .22 से अनुकूलित चित्रा। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
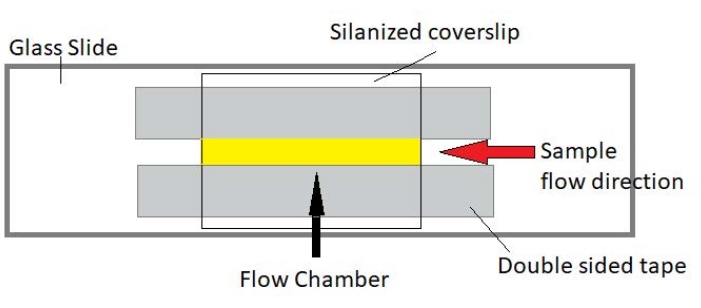
चित्रा 3: प्रवाह कक्ष विधानसभा। प्रवाह कक्ष एक ग्लास स्लाइड, सिलेनाइज्ड कवर ग्लास और स्थायी डबल-पक्षीय टेप का उपयोग करके बनाया गया है। पीला हाइलाइट किया गया क्षेत्र प्रवाह पथ है जहां नमूना प्रवाहित और मनाया जाता है। प्रवाह कक्ष की मात्रा ~ 20 μL है एपॉक्सी का उपयोग कक्ष के सिरों को सील करने के लिए किया गया था ताकि नमूने को कई घंटों में दीर्घकालिक इमेजिंग के दौरान वाष्पित होने से बचाया जा सके। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
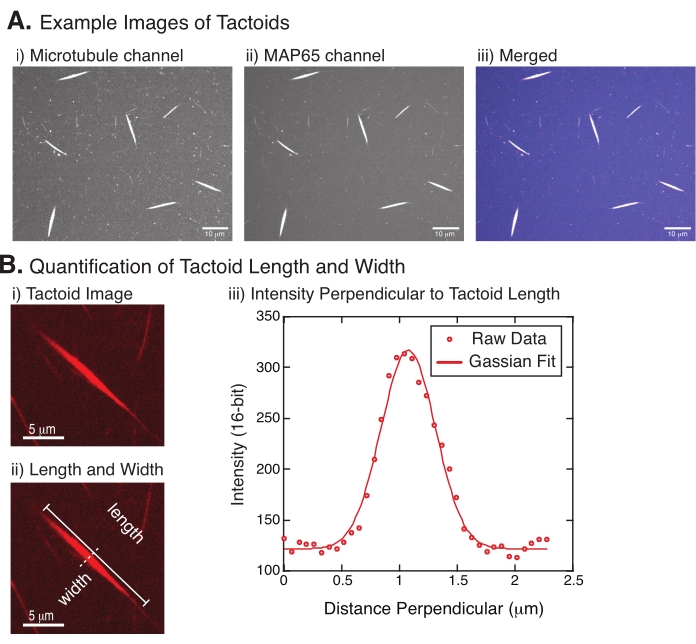
चित्रा 4: टैक्टॉइड छवियां और लंबाई और चौड़ाई विश्लेषण। (ए) कताई डिस्क कॉन्फोकल शो (i) सूक्ष्मनलिका चैनल इमेजिंग रोडामाइन-लेबल ट्यूबुलिन का उपयोग करके वर्णित और इमेज किए गए टैक्टोइड्स के उदाहरण डेटा 561 एनएम लेजर का उपयोग करके, (ii) जीएफपी-एमएपी 65 चैनल इमेजिंग 488 एनएम लेजर का उपयोग करके जीएफपी, और (iii) सूक्ष्मनलिका चैनल (मैजेंटा) और जीएफपी-एमएपी 65 चैनल (सियान) से विलय ओवरले छवि। ओवरलैप क्षेत्रों को सफेद के रूप में प्रदर्शित किया जाता है और प्रदर्शित करता है कि सूक्ष्मनलिकाएं और एमएपी 65 बिल्कुल कोलोकलाइज़ करते हैं। स्केल बार = (ए) में सभी छवियों के लिए 10 μm। (बी) टैक्टॉइड लंबाई और चौड़ाई का परिमाणीकरण। (i) लेबल के बिना विश्लेषण किए जाने वाले एकैक्टॉइड की छवि। स्केल बार = 5 μm. (ii) (i) के समान छवि, जहां लंबाई (लाइन कैप के साथ ठोस रेखा) और चौड़ाई (धराशायी रेखा) माप को दर्शाया जाता है। स्केल बार = 5 μm. (iii) चौड़ाई को (ii) में दर्शाए गए लंबवत द्विभाजक (धराशायी रेखा) पर टैक्टॉइड के पार तीव्रता प्रोफ़ाइल लेकर मापा गया था। तीव्रता प्रोफ़ाइल टैक्टॉइड के आयाम और चौड़ाई को प्रकट करने के लिए एक गाऊसी फ़ंक्शन के लिए फिट थी। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
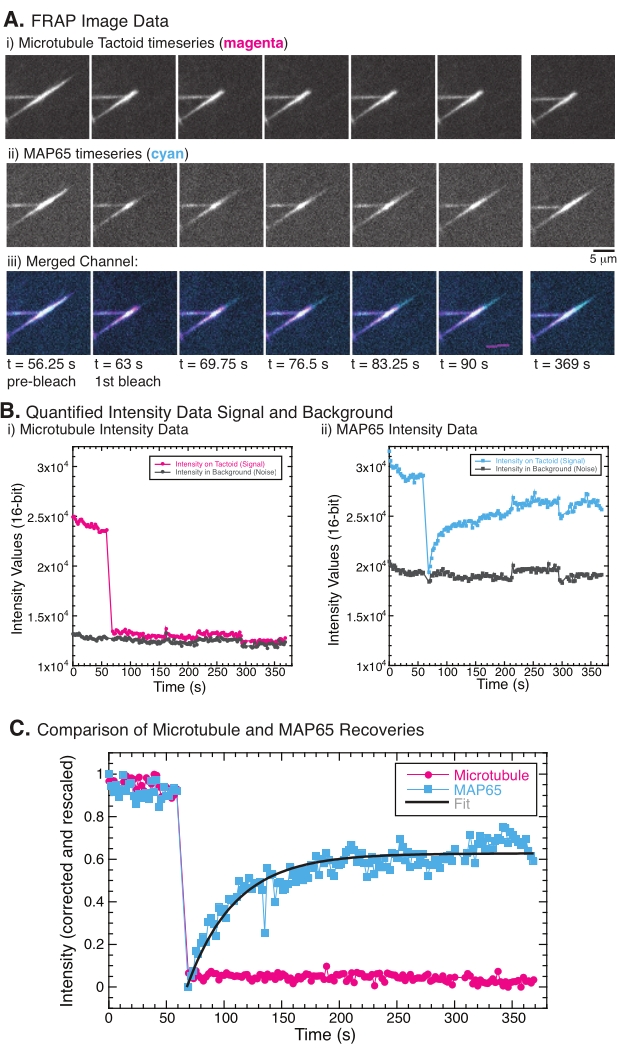
चित्रा 5: प्रतिनिधि एफआरएपी डेटा और विश्लेषण( ए) माइक्रोस्कोपी समय श्रृंखला डेटा (i) सूक्ष्मनलिकाएं टैक्टोइड और (ii) जीएफपी-एमएपी 65, और (iii) मैजेंटा में सूक्ष्मनलिकाएं और सियान में जीएफपी-एमएपी 65 के साथ दोनों चैनलों की ओवरले छवि जो 63 एस समय पर फोटोब्लीच किए गए थे और अतिरिक्त 5 मिनट के लिए मनाया गया था। ) प्रक्षालित क्षेत्र (मैजेंटा सर्कल) और पृष्ठभूमि (गहरे भूरे रंग के घेरे) में सूक्ष्मनलिका चैनल और (ii) प्रक्षालित क्षेत्र (सियान वर्ग) और पृष्ठभूमि (गहरे भूरे रंग के वर्ग) में जीएफपी-एमएपी 65 चैनल। (सी) डेटा को पृष्ठभूमि शोर के लिए सही किया गया था और सूक्ष्मनलिका चैनल (मैजेंटा सर्कल) और जीएफपी-एमएपी 65 चैनल (सियान वर्ग) के लिए रीस्केल किया गया था। सूक्ष्मनलिकाएं ठीक नहीं होती हैं, लेकिन जीएफपी-एमएपी 65 करता है और आयाम और वसूली के टाइमस्केल को खोजने के लिए बढ़ते घातीय क्षय के लिए फिट (गहरे भूरे रंग की रेखा) हो सकता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
यहां वर्णित विधियों का उपयोग सूक्ष्मनलिकाएं टैक्टोइड्स (चित्रा 2)22,28 बनाने के लिए कई पत्रों में किया गया है। ये प्रयोग संगठनात्मक सिद्धांतों को उजागर करने में मदद करने के लिए जैविक रूप से प्रासंगिक हैं जो अधिकांश सेल प्रकारों में माइटोटिक या अर्धसूत्रीविभाजन स्पिंडल के आकार और स्थिरता को नियंत्रित करते हैं। इसके अलावा, सूक्ष्मनलिकाएं मॉडल लिक्विड क्रिस्टल मेसोजेन हैं जो इस बारे में अधिक जानने में मदद कर सकती हैं कि लिक्विड क्रिस्टल आइसोट्रोपिक चरणों से नेमैटिक चरणों को कैसे न्यूक्लिएट और विकसित करते हैं।
यहां उल्लिखित प्रक्रिया में सूक्ष्मनलिका स्व-संगठन की खोज के लिए कई फायदे हैं। सबसे पहले, यह अत्यधिक प्रतिलिपि प्रस्तुत करने योग्य है, प्रयोगशाला में शुरू होने से पहले बहुत कम पूर्वज्ञान या प्रशिक्षण के साथ हाई स्कूल के छात्रों सहित कई छात्रों द्वारा प्रयोगशाला में प्रदर्शन किया गया है। टैक्टोइड्स बिरेफ्रिंजेंट22 हैं, जिससे उन्हें प्रतिदीप्ति माइक्रोस्कोपी के अलावा प्रेषित प्रकाश में देखा जा सकता है, जिससे यह विधि कई प्रयोगशालाओं के लिए सुलभ हो जाती है और यह प्रयोगात्मक प्रक्रिया उच्च अंत अनुसंधान के अलावा शैक्षिक उद्देश्यों के अनुकूल होती है। अंत में, यह प्रक्रिया एक छीन-डाउन, न्यूनीकरणवादी दृष्टिकोण में जैविक प्रणालियों को समझने और जांच करने के लिए रास्ते खोलती है, जिससे कोई यह समझने की अनुमति देता है कि प्रत्येक अतिरिक्त स्थिति, प्रोटीन या योजक टैक्टोइड्स के आत्म-संगठन को कैसे बदल सकता है और, शायद, अंततः, स्पिंडल। बेहतर बायोमिमिक्री के लक्ष्यों में गतिविधि, तरलता और फिलामेंट ध्रुवीयता छंटाई शामिल हैं।
अप्रत्याशित परिणाम देने वाले प्रयोग को प्रभावित करने वाले कई कारक हो सकते हैं। उदाहरण के लिए, यदि टैक्टोइड्स नहीं बनते हैं (चित्रा 2) लेकिन प्रशंसक जैसे पैटर्न देखे जाते हैं, तो एमएपी 65 संभवतः सूक्ष्मनलिकाएं22,28 के लिए मौजूद नहीं है या बाध्यकारी नहीं है। यह एमएपी 65 प्रतिदीप्ति चैनल में भी स्पष्ट होना चाहिए क्योंकि जीएफपी-एमएपी 65 सूक्ष्मनलिकाएं से बंधा नहीं होगा।
यदि टैक्टोइड नहीं बनते हैं और पृष्ठभूमि कांच पर धब्बे के रूप में दिखाई देती है, तो यह सतह कोटिंग के कारण हो सकता है। एक बार प्रदर्शन करने के बाद, सिलेनाइजेशन कवरलिप्स पर केवल 1 महीने तक रहता है। जब यह पहनता है, तो ट्यूबुलिन उजागर सतह को गैर-विशेष रूप से बांधने में सक्षम होगा। यह बाध्यकारी विषम पैटर्न में होगी।
यदि टैक्टोइड नहीं बनते हैं और ट्यूबुलिन को विभिन्न आकृतियों और आकारों के समुच्चय में देखा जाता है, तो यह खराब गुणवत्ता वाले ट्यूबुलिन के कारण हो सकता है। ट्यूबुलिन को प्रारंभिक समुच्चय को हटाने के लिए सेंट्रीफ्यूज किया जा सकता है जो सूक्ष्मनलिका पोलीमराइजेशन के बजाय इस ऑफ-पाथवे एकत्रीकरण को चला सकता है। यदि सतह ट्यूबुलिन के लिए बाध्यकारी है, तो यह समाधान में ट्यूबुलिन को भी कम कर सकती है। ट्यूबुलिन की कम सांद्रता, सूक्ष्मनलिकाएं पोलीमराइज़ करने के लिए महत्वपूर्ण एकाग्रता के नीचे, समुच्चय में परिणाम कर सकते हैं।
एफआरएपी प्रयोगों में, यदि एमएपी 65 चैनल किसी भी वसूली (चित्रा 5) को नहीं दिखाता है, तो यह संभव है कि फोटोब्लीचिंग सूक्ष्मनलिकाएं फोटोडैमिंग कर रही थी। फोटोडैमेज फिलामेंट्स के स्थानीयकृत विनाश का कारण बनता है। प्रेषित चैनल में परीक्षा द्वारा इसकी जाँच की जा सकती है। सूक्ष्मनलिकाएं टैक्टोइड आसपास के पानी के साथ अपवर्तन बेमेल के उच्च सूचकांक के माध्यम से प्रेषित चैनल में दिखाई देते हैं। प्रकाश-प्रेरित फोटोडैमेज फोटोब्लीचिंग के अधीन आरओआई के स्थान पर प्रेषित प्रकाश इमेजिंग में जलने के निशान या इसके विपरीत नुकसान के रूप में दिखाई देगा। यदि ऐसा होता है, तो प्रोटीन के फोटोडैमेज को बाधित करने के लिए लेजर या प्रकाश शक्ति को कम किया जाना चाहिए।
इस प्रक्रिया और दृष्टिकोण में कई चुनौतियों का सामना करना पड़ा। एक मुद्दा यह है कि लंबाई के उपाय वर्तमान में छवि पर क्लिक करके हाथ से किए जाते हैं। यह विधि, जबकि सीधी है, उच्च अनिश्चितता में परिणाम कर सकते हैं। चौड़ाई माप जो क्रॉस-सेक्शन का उपयोग करता है और गाऊसी के लिए फिटिंग आकार को मापने के लिए एक बेहतर तरीका है। लंबाई के लिए एक समान विधि नियोजित की जा सकती है। एक दूसरा मुद्दा यह है कि, कभी-कभी, टैक्टोइड्स, क्योंकि वे इतने लंबे और पतले होते हैं, झुक सकते हैं। इससे लंबाई को निर्धारित करना अधिक कठिन हो जाता है। समोच्च लंबाई को खंडित रेखा का उपयोग करके परिमाणित किया जा सकता है, लेकिन हर बार एक खंड जोड़े जाने पर अतिरिक्त अनिश्चितता होती है।
वैज्ञानिक दृष्टिकोण से, इस दृष्टिकोण में तरल क्रिस्टल या स्पिंडल के लिए एक मॉडल के रूप में इसके उपयोग के लिए कुछ अन्य चुनौतियां हैं। पहली चुनौती टैक्टोइड्स का लंबा, पतला आकार रहा है जो सूक्ष्मनलिकाएं बनाते हैं (चित्रा 3 और चित्रा 4)। जैसा कि पूर्व प्रकाशनों22 में उल्लेख किया गया है, सूक्ष्मनलिकाएं टैक्टोइड सजातीय टैक्टोइड हैं, द्विध्रुवी नहीं। इसका मतलब यह है कि आकृति बनाने वाले सूक्ष्मनलिकाएं संरचना की युक्तियों की ओर इशारा करने के लिए पुन: उन्मुख नहीं होती हैं। इसके बजाय, सभी सूक्ष्मनलिकाएं लंबी धुरी के समानांतर हैं और "ध्रुव" अनंत पर स्थित हैं। यह आणविक तरल क्रिस्टल या यहां तक कि एक्टिन या डीएनए के लिए देखे गए टैक्टोइड्स से बहुत अलग है जो तरल क्रिस्टल मेसोजेन के रूप में भी कार्य कर सकते हैं। इन अन्य प्रणालियों में, टैक्टोइड द्विध्रुवी होते हैं और, जब पार किए गए ध्रुवीकरण में देखा जाता है, तो वे छड़ के पुन: अभिविन्यास के गप्पी संकेत दिखाते हैं।
इस प्रणाली में एक दूसरी बड़ी चुनौती यह है कि सूक्ष्मनलिकाएं टैक्टोइड के अंदर स्थिर होती हैं। यह एफआरएपी प्रयोगों और विश्लेषण से स्पष्ट है क्योंकि सूक्ष्मनलिकाएं की वसूली बहुत कम है। उनकी ठोस जैसी प्रकृति सूक्ष्मनलिकाएं टैक्टोइड्स को बड़े पैमाने पर तरल क्रिस्टल एनालॉग्स के रूप में कम मूल्यवान बनाती है। एक तरल क्रिस्टल के नेमेटिक चरण में तरल (द्रव) और क्रिस्टल (संगठित) दोनों गुण होने चाहिए। यद्यपि आकार धुरी के लिए सही लगता है, गतिहीनता सिस्टम को मॉडल माइटोटिक स्पिंडल के रूप में कम रोमांचक बनाती है। दूसरी ओर, यह मुद्दा यह जांचने के अवसर प्रदान करता है कि सिस्टम में अधिक तरलता बनाने के लिए प्रयोगों को कैसे संशोधित किया जा सकता है।
ये वैज्ञानिक चुनौतियां रोमांचक अवसर प्रदान करती हैं जो सिस्टम के बारे में नए ज्ञान की अनुमति देंगी। सूक्ष्मनलिकाएं टैक्टोइड्स को अधिक द्विध्रुवी बनाने के लिए, कोई भी छोटे सूक्ष्मनलिकाएं का उपयोग कर सकता है। हालांकि, एक अतिरिक्त चुनौती है, क्योंकि सूक्ष्मनलिकाएं में एक्टिन के रूप में लंबाई को नियंत्रित करने के लिए कई अच्छी तरह से विशेषता कैपिंग प्रोटीन नहीं होते हैं। न्यूक्लिएशन और विकास के उपयोग के लिए छोटे सूक्ष्मनलिकाएं बनाने के लिए ट्यूबुलिन और जीएमपीसीपीपी की बहुत अधिक सांद्रता के उपयोग की आवश्यकता होती है। उच्च ट्यूबुलिन एकाग्रता के परिणामस्वरूप सिस्टम में बड़ी संख्या में फिलामेंट्स होते हैं, जिससे एक दूसरे से टैक्टोइड को अलग करना अधिक कठिन हो जाता है। नए सूक्ष्मनलिका कैपर, जैसे कि डारपिन33 के अलावा, इस स्थिति में मदद मिल सकती है। सूक्ष्मनलिकाएं स्थिर होने के दूसरे मुद्दे को मोटर प्रोटीन के अलावा कम किया जा सकता है, जैसे कि किनेसिन -534, जो माइटोसिस में उपयोग किए जाने वाले मोटर्स के टेट्रामर हैं। वैकल्पिक रूप से, डिमेरिक किन्सिन -1 के कृत्रिम डिमर्स का उपयोग15 किया जा सकता है।
अधिक तरलता जोड़ने का एक और तरीका सूक्ष्मनलिकाएं अपनी गतिशील अस्थिरता, सूक्ष्मनलिकाएं के बढ़ने और सिकुड़ने की अनुमति देना होगा। वर्तमान में, सूक्ष्मनलिकाएं जो स्थिर जीएमपीसीपीपी फिलामेंट्स के साथ वरीयता प्राप्त होती हैं और फिर गतिशील अस्थिरता से गुजरती हैं, एक स्पिंडल या टैक्टॉइड बनाने के लिए वांछित से कहीं अधिक लंबी होती हैं, जिसके परिणामस्वरूप प्रशंसकों या बंडलों जैसे बहुत लंबे संगठन होंगे। इसलिए, सूक्ष्मनलिका गतिशील अस्थिरता को जोड़ने के लिए टैक्टोइड आकार को संरक्षित करने के लिए सावधानीपूर्वक किया जाना चाहिए। संबंधित प्रोटीन और एंजाइमों के अलावा जो लंबाई को नियंत्रित कर सकते हैं, इस मुद्दे को कम कर सकते हैं। उदाहरण के लिए, किन्सिन -1335 जैसे किनेसिन को डीपॉलिमराइज करना, या कटानिन36 जैसे अलग-अलग एंजाइमों की आवश्यकता होगी। ये प्रयोग जटिल और कठिन हैं, हालांकि वे बहुत व्यावहारिक होंगे, इससे कोई फर्क नहीं पड़ता कि परिणाम क्या प्रकट करते हैं। भविष्य के प्रयोग जो भी दिशा लेते हैं, सूक्ष्मनलिकाएं बनाने के लिए यहां विकसित मंच सूक्ष्मनलिका संगठन के भौतिक आधार पर नई जानकारी का पर्दाफाश कर सकता है।
लेखकों ने घोषणा की है कि उनके पास कोई प्रतिस्पर्धी वित्तीय हित नहीं हैं।
लेखक सभी ग्रीष्मकालीन 2021 रॉस लैब सदस्यों, विशेष रूप से के एलिस लिंडसे को उनकी मदद के लिए धन्यवाद देना चाहते हैं। इस काम को एनएसएफ बीआईओ -2134215 के अनुदान द्वारा समर्थित किया गया था जिसने एस साहू, एन गुडबी, एचबी ली और जेएल रॉस का समर्थन किया था। केईसीके फाउंडेशन (राय एंडरसन, यूएसडी, लीड पीआई) से अनुदान आंशिक रूप से समर्थित आर शाखा और पी चौहान
| Name | Company | Catalog Number | Comments |
| 2% Dichlorodimethylsilane | GE Healthcare | 118945 | A hydrophobic silane surface treatment. This can be resused upto three times and kept at room temperature for one year. |
| 5-minute epoxy | Bob Smith Industries | For sealing experimental chambers | |
| Acetone | Fisher | 32900HPLC | 100% |
| BL21 cells | Bio Labs | C2527I | Competent bacterial cells used to express MAP65 |
| Catalase | Sigma | C30-500MG | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C for upto one year. |
| Coverslips (22 mm x 22 mm or 22 mm x 30 mm) | Fisher | 12544-AP | For experimental chambers |
| Dithiothreitol | Sigma | 43815-5G | A small molecule that is used to break disulfide bonds and scavenge oxygen. A 1 M stock is made from powder (Sigma) in ddH2O. The solution is aliquoted and stored at -20C for upto one year. The aliquots are used 7-8 times then discarded. |
| EGTA | Sigma | E3889-10G | Tubulin buffer base ingredient |
| Eppendorf 0.5 ml tubes | Eppendorf | 05 402 18 | For holding experimental solutions |
| Ethanol | Fisher | 111000200 | 200 proof |
| Filter paper | Whatman | 1004-110 | For cleaning and for pulling solutions through experimental chambers |
| Fluorescence microscope with high NA objectives | Nikon | Ti-E, W2 Confocal | For imaging experiments |
| Freezer -20°C | Fisherbrand | 13986148 | For storing reagents |
| Freezer -80°C | Thermo scientific | 328223H01-C | For storing proteins. |
| Glass containers for silanization | Michaels | For preparing experimental chambers - treating cover glasses | |
| Glass slides | Fisher | 12544-4 | For experimental chambers |
| Glucose | Sigma | G7528-250G | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C. |
| Glucose oxidase | Sigma | G2133-250KU | Part of the oxygen scavenging system. This is stored at 4°C for upto one year. |
| GMPCPP | Jenna Bioscience | NU-4055 | Slowly hydrolyzable analog of GTP used to polymerize and stabilize the microtubules by reducing the dynamic instability and spontaneous critical concentration for microtubule nucleation to get a consistent length. We purchase a 10 mM stock from Jena Biosciences and store it at -20°C for upto one year. |
| Heating element for microscope | Okolab stage top incubator | For imaging experiments | |
| Imidizole | Sigma | I2399 | Used to elute MAP65 protein from Nickel beads to purify MAP65 |
| Kimwipes | Fisher | 34155 | For cleaning and for pulling solutions through experimental chambers. |
| KOH | Sigma | P250-500 | 1 M in ddH2O, made fresh to prevent acidification over time. |
| Liquid Nitrogen | Airgas | NI 230LT22 | To drop freeze aliquots. This can also be used for storage (not recommended) |
| MAP65 protein | Ram Dixit | A microtubule-associated protein (MAP) with a molecular weight of 65 kD that is an antiparallel microtubule crosslinker. We have purified an unlabeled and GFP-labeled version of MAP65-1 from Arabidopsis thaliana. We mix the GFP-MAP65 with the unlabeled MAP65 such that 10% of the protein is labeled. The working stock is a 10.8 μM solution. This working solution is stored at 4°C and remade fresh every week. The protocol for purifying the MAP65 and GFP-MAP65 is given in our prior methods chapter (26). | |
| MgSO4 | Sigma | MKCJ940 | Tubulin buffer ingredient |
| NTA-Nickel beads | Qiagen | 30210 | Beads required to purify 6xHis tagged MAP65 proteins |
| Optomicroscan | Nikon | 405 nm laser system which can focus the laser in any desired shape of region of interest | |
| PEM80 | Neutral tubulin polymerizing base buffer for solution made from 80 mM K-PIPES, pH 6.8, 1 mM MgSO4, 1 mM EGTA, stored at 4°C for upto one year. | ||
| Permanent double-sided tape | 3M - Scotch | 34-8724-5691-7 | For experimental chambers |
| Petri dish | Fisher | FB0875713 | For humid chamber |
| PIPES | Sigma | P7643-100G | Tubulin buffer base ingredient |
| Pluronic-F127 | Sigma | P2443-250G | A block-copolymer with two hydrophilic polyethylene oxide (PEO) blocks on the ends and a hydrophobic center block of polyphenylene oxide (PPO) hydrophobic surface coating we use to prevent protein binding to the surface. Pluronic-F127 is purchased as a powder (Sigma) and dissolved to a 5% (w/v) solution in ddH2O overnight. Once dissolved, the solution can be stored at room temperature for upto one year. |
| Polyethylene Glycol | Affymetrix Inc | 19966 500 GM | A crowding agent used to create depletion forces to bring tactoids to the surface and help to organize microtubules. We create a 5% (w/v) solution of 100 kDa PEG in PEM80. The solution is stored in 4°C for upto one year and placed on the rocker before use. It is viscous, so we recommend using a positive displacement pipette to work with it. |
| Positive displacement pipette | Eppendorf | For pipetting viscous liquids | |
| Racks for coverslips | Electron Microscopy Sciences | 72240 | For preparing experimental chambers - treating cover glasses |
| Refrigerator 4°C | Fisherbrand | For storing reagents | |
| Tubulin Labeled | Cytoskeleton | TL590M | lyophilized rhodamine-labeled tubulin from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| Tubulin protein | Cytoskeleton | T240 | lyophilized tubulin 99% pure unlabeled from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| UV-Ozone | Jelight | Model 342 | For preparing experimental chambers - treating cover glasses |
| Stackreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/stackreg/ | plugin for registering time series data to remove drift |
| Turboreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/turboreg/ | plugin for registering time series data to remove drift |
- Bodakuntla, S., Jijumon, A. S., Villablanca, C., Gonzalez-Billault, C., Janke, C. Microtubule-associated proteins: structuring the cytoskeleton. Trends in Cell Biology. 29 (10), 804-819 (2019).
- Severson, A. F., von Dassow, G., Bowerman, B. Oocyte meiotic spindle assembly and function. Current Topics in Developmental Biology. 116, 65-98 (2016).
- Brugués, J., Needleman, D. Physical basis of spindle self-organization. Proceedings of the National Academy of Sciences of the United States of America. 111 (52), 18496-18500 (2014).
- Brugués, J., Nuzzo, V., Mazur, E., Needleman, D. J. Nucleation and transport organize microtubules in metaphase spindles. Cell. 149 (3), 554-564 (2012).
- Gatlin, J. C., et al. Spindle fusion requires dynein-mediated sliding of oppositely oriented microtubules. Current Biology. 19 (4), 287-296 (2009).
- Goshima, G., Mayer, M., Zhang, N., Stuurman, N., Vale, R. D. Augmin: A protein complex required for centrosome-independent microtubule generation within the spindle. Journal of Cell Biology. 181 (3), 421-429 (2008).
- Inoue, S., Sato, H. Cell motility by labile association of the nature of mitotic spindle fibers and their role in chromosome movement molecules. Journal of General Physiology. 50 (6), 259-292 (1967).
- Allenspach, A. L., Roth, L. E. Structural variations during mitosis in the chick embryo. Journal of Cell Biology. 33 (1), 179-196 (1967).
- Theg, D. E. Cytoplasmic microtubules in different animal cells. Journal of Cell Biology. 23 (2), 265-275 (1964).
- Mcdonald, K., Pickett-Heaps, J. D., Mcintosh, J. R., Tippit, D. H. On the mechanism of anaphase spindle elongation in Diatoma vulgare. Journal of Cell Biology. 9, 377-388 (1977).
- Chaikin, P. M., Lubensky, T. C. . Principles of Condensed Matter Physics. , (1995).
- Hamon, L., Savarin, P., Curmi, P. A., Pastré, D. Rapid assembly and collective behavior of microtubule bundles in the presence of polyamines. Biophysical Journal. 101 (1), 205 (2011).
- Needleman, D. J., et al. Higher-order assembly of microtubules by counterions: From hexagonal bundles to living necklaces. Proceedings of the National Academy of Sciences. 101 (46), 16099-16103 (2004).
- Ross, J. L., Fygenson, D. K. Mobility of taxol in microtubule bundles. Biophysical Journal. 84, 3959-3967 (2003).
- Sanchez, T., Welch, D., Nicastro, D., Dogic, Z. Cilia-like beating of active microtubule bundles. Science. 333 (6041), 456-459 (2011).
- Brandt, R., Lee, G. Functional organization of microtubule-associated protein tau. Identification of regions which affect microtubule growth, nucleation, and bundle formation in vitro. Journal of Biological Chemistry. 268 (5), 3414-3419 (1993).
- Hirokawa, N. Microtubule organization and dynamics dependent on microtubule-associated proteins. Current Opinion in Cell Biology. 6 (1), 74-81 (1994).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. The Journal of Cell Biology. 109 (3), 1173 (1989).
- MacRae, T. H. Microtubule organization by cross-linking and bundling proteins. Biochimica et Biophysica Acta (BBA). Protein Structure and Molecular Enzymology. 1160 (2), 145-155 (1992).
- She, Z. Y., Wei, Y. L., Lin, Y., Li, Y. L., Lu, M. H. Mechanisms of the Ase1/PRC1/MAP65 family in central spindle assembly. Biological Reviews. 94 (6), 2033-2048 (2019).
- Walczak, C. E., Shaw, S. L. A MAP for Bundling Microtubules. Cell. 142 (3), 364-367 (2010).
- Edozie, B., et al. Self-organization of spindle-like microtubule structures. Soft Matter. 15 (24), 4797-4807 (2019).
- Tulin, A., McClerklin, S., Huang, Y., Dixit, R. Single-molecule analysis of the microtubule cross-linking protein MAP65-1 reveals a molecular mechanism for contact-angle-dependent microtubule bundling. Biophysical Journal. 102 (4), 802-809 (2012).
- Chan, J., Jensen, C. G., Jensen, L. C. W., Bush, M., Lloyd, C. W. The 65-kDa carrot microtubule-associated protein forms regularly arranged filamentous cross-bridges between microtubules. Proceedings of the National Academy of Sciences of the United States of America. 96 (26), 14931-14936 (1999).
- Scheff, D. R., et al. Tuning shape and internal structure of protein droplets via biopolymer filaments. Soft Matter. 16 (24), 5659-5668 (2020).
- Weirich, K. L., et al. Liquid behavior of cross-linked actin bundles. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2131-2136 (2017).
- Weirich, K. L., Dasbiswas, K., Witten, T. A., Vaikuntanathan, S., Gardel, M. L. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences of the United States of America. 166 (23), 11125-11130 (2019).
- Sahu, S., Herbst, L., Quinn, R., Ross, J. L. Crowder and surface effects on self-organization of microtubules. Physical Review E. 103 (6), 062408 (2021).
- Stanhope, K. T., Ross, J. L. Microtubules, MAPs, and motor patterns. Methods in Cell Biology. 128, 23-38 (2015).
- Early Middle Ages drop single.jpg. Wikimedia Commons Available from: https://commons.wikimedia.org/wiki/File:Early_middle_ages_drop_spingle.jpg (2022)
- Lantzsch, I., et al. Microtubule reorganization during female meiosis in c. Elegans. eLife. 10, 58903 (2021).
- Advani, S., Maresca, T. J., Ross, J. L. Creation and testing of a new, local microtubule-disruption tool based on the microtubule-severing enzyme, katanin p60. Cytoskeleton. 75 (12), 531-544 (2018).
- Pecqueur, L., et al. A designed ankyrin repeat protein selected to bind to tubulin caps the microtubule plus end. Proceedings of the National Academy of Sciences of the United States of America. 109 (30), 12011-12016 (2012).
- Valentine, M. T., Fordyce, P. M., Krzysiak, T. C., Gilbert, S. P., Block, S. M. Individual dimers of the mitotic kinesin motor Eg5 step processively and support substantial loads in vitro. Nature Cell Biology. 8 (5), 470-476 (2006).
- Wagenbach, M., Domnitz, S., Wordeman, L., Cooper, J. A kinesin-13 mutant catalytically depolymerizes microtubules in ADP. Journal of Cell Biology. 183 (4), 617-623 (2008).
- McNally, F. J., Vale, R. D. Identification of katanin, an ATPase that severs and disassembles stable microtubules. Cell. 75 (3), 419-429 (1993).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved