Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biochemistry
Mikrotübül taktoidlerinin kendi kendine montajı
Bu makalede, bitki bazlı bir mikrotübül çapraz bağlayıcısı olan MAP65 ve kalabalıklaştırıcı ajan olarak PEG kullanılarak taktoidler şeklinde mikrotübül montajlarının oluşumu için bir protokol sunulmaktadır.
Hücre iskeleti, değişiklikleri yönlendirecek bir yönetici olmadan, hücre içindeki büyük iç organizasyondan ve yeniden yapılanmadan sorumludur. Bu, özellikle mikrotübüllerin hücre bölünmesi sırasında mili oluşturduğu mitoz veya mayoz sırasında geçerlidir. İş mili, hücre bölünmesi sırasında genetik materyali ayırmak için kullanılan makinedir. In vitro olarak kendi kendini organize eden iğler oluşturmaya doğru, yakın zamanda mikrotübülleri, minimum mikrotübül ile ilişkili protein seti ve kalabalıklaştırıcı ajanlarla iğ benzeri montajlara dönüştürmek için bir teknik geliştirdik. Spesifik olarak, bitkilerden bir antiparalel mikrotübül çapraz bağlayıcısı, mayadan Ase1 homologu ve memeli organizmalardan PRC1 olan MAP65 kullanılmıştır. Bu çapraz bağlayıcı, mikrotübülleri uzun, ince, iğ benzeri mikrotübül kendi kendini organize eden montajlar halinde kendi kendine organize eder. Bu düzenekler ayrıca sıvı kristal taktoidlere benzer ve mikrotübüller mezojenler olarak kullanılabilir. Burada, bu mikrotübül taktoidlerini oluşturmak ve ayrıca floresan mikroskobu kullanarak montajların şeklini ve fotobeyazlatma sonrası floresan geri kazanımı kullanarak bileşenlerin hareketliliğini karakterize etmek için protokoller sunulmaktadır.
Mitoz yoluyla hücre bölünmesi, yaşamı sürdürmek için en önemli biyolojik süreçlerden biridir. Tübülin dimerlerinden oluşan mikrotübül filamentleri, bu işlemin temel yapısal elemanlarıdır. Kromozomlar hücre merkezinde hizalandığında metafazda oluşturulan geçici makineye, ipliklerle kaplı bir tezgahın mili gibi olan şekli nedeniyle mitotik iğ denir (Şekil 1A). Birçok organizmada, mikrotübüllerin metafazda yoğunlaştırılmış kromozomları hücrenin merkezine itmek ve çekmek, hizalamak ve anafazda onları ayıracak mikrotübüllere bağlamak için kullanıldığı iyi bilinmektedir (Şekil 1B, C). İş mili hem mayoz (Şekil 1B) hem de mitozda (Şekil 1C) oluşur, iplik gibi merkezi eksenin etrafına sarılmamış, ancak arayüze paralel çalışan birçok üst üste binen mikrotübülden yaratılmıştır. Bu mikrotübül bazlı yapıların oluşturulması, çapraz bağlanan ilişkili proteinleri ve kromozomları itmeye ve çekmeye yardımcı olmak için motor görevi görebilen ilişkili enzimleri gerektirir1.
Mayotik iğler üzerine yapılan çalışmalar, mikrotübüllerin kısa, dinamik olduğunu ve çapraz bağlı dizilerde 2,3,4,5,6 üst üste bindiğini göstermiştir (Şekil 1Di). Bu kısa mikrotübüllerin fiziksel organizasyonu nedeniyle, mayotik iş mili bir sıvı kristal taktoide benzer (Şekil 1E). Gerçekten de, iğlerin sıvı kristal taktoidlerden bekleneceği gibi birleştiği ve birleştiği gösterilmiştir5.
1960'lı yıllara dayanan birçok çalışma, mitotik iş mili 7,8,9,10 içinde iki tip mikrotübül olduğunu belirlemek için fiksasyon, seri bölümler ve elektron mikroskobu kullanmıştır. İlk tip, iş mili direğini kinetochore'a bağlayan kinetochore mikrotübülleri olarak adlandırılır. İkinci tip, kromozomları geçerek büyüyen ve orta bölgede üst üste binen polar veya polar mikrotübüller olarak adlandırılır (Şekil 1Dii)8,9,10. Üçüncü bir tip, iğin dışında bulunan ve kutupları hücre kenarına bağlayan astral mikrotübüller olarak adlandırılır; Bu mikrotübül örgütleri mevcut tartışmanın kapsamı dışındadır. Mikrotübüller için nükleasyon merkezlerini etkileyen augmin6 ve gama-tübülin halka kompleksi arasındaki etkileşim üzerine son zamanlarda yapılan çalışmalar yapılmıştır, bu da Şekil 1D'deki gibi daha kısa mikrotübüllere sahip mitotik bir iğle sonuçlanır.
Mikrotübüller geniş olduklarından daha uzun olduklarından, yüksek en-boy oranına ve yüksek sertliğe sahip olduklarından, sıvı kristal moleküllerinin ölçeklendirilmiş versiyonları gibidirler. Yumuşak madde fiziğinde, atomlar ve moleküller, çekirdeklenme ve kristallerin erimesi de dahil olmak üzere faz geçişlerinin fiziksel mekanizmalarını çıkarmak için minimum etkileşimler kullanılarak yaklaştırılmıştır11. Benzer şekilde, mikrotübüller, sıvı kristal moleküllerinin ölçeklendirilmiş versiyonları olan mezo ölçekli nesnelerdir ve nematik fazların izotropik olanlardan çekirdeklenmesi ve büyümesi de dahil olmak üzere sıvı kristal dinamiğinin fiziği hakkında fikir verir. Ayrıca, yukarıda tartışıldığı gibi, mayotik iğ, sıvıkristal moleküllerinin izotropik durumundan 3,4,5 çekirdeklenen ve büyüyen nematik bir durum olan sıvı kristal taktoidinki gibi özellikler gösterir. Taktoidler için, çekirdeklenme ve büyüme diğer kristallerinki gibidir (yani, nispeten yüksek konsantrasyonda mezojen [sıvı kristalleri oluşturan moleküller] gerektirir). Taktoidin benzersiz "iğ" şekli, nematik faza hizalanan sıvı kristal mezojenlerinin lokal hizalamasından gelir (Şekil 1E). Yuvarlak bir kristal oluşturamazlar çünkü moleküller oldukça asimetriktir. Mikrotübüllerin doğası göz önüne alındığında, yüksek yerel mikrotübül konsantrasyonundan yapılan mitotik iğ makinelerinin, taktoid veya iğ olarak adlandırılıp adlandırılmadığına bakılmaksızın aynı şekle sahip olması şaşırtıcı değildir. Taktoitler, konik uçlarda kutuplarla (Şekil 1Ei) bipolar veya homojen olabilir, kutuplar sonsuzlukta etkili bir şekilde (Şekil 1Eii).
İş mili oluşumunun önemi göz önüne alındığında, iyonik türler 12,13, tükenme etkileşimleri yaratan kalabalık ajanlar 14,15 ve spesifik mikrotübül çaprazbağlama proteinleri 13,16,17,18,19 yoluyla demetler halinde mikrotübül yoğuşmasını göstererek in vitro olarak kendi kendini organize eden iğ oluşumuna yönelik çabalar devam etmektedir. 21. Şaşırtıcı bir şekilde, bu ajanların hepsi mikrotübüllerin lokal konsantrasyonunu arttırmak için çalışsa da, genellikle uzun mikrotübül demetleriyle sonuçlanırlar, ancak taktoidlerle sonuçlanmazlar. Bu demetlerin uzun olmasının bir nedeni, onları oluşturan mikrotübüllerin de uzun olması olabilir. Daha kısa mikrotübüller kullanan son çalışmalar,15'in sonunda konik olmayan daha uzun demetler de bildirmiştir; Bu durumda, demetler, demetlerin genişlemesine neden olan motor proteinleri ile bir arada tutulur ve böylece onları daha uzun hale getirir. Burada açıklandığı gibi, konik, iş mili benzeri montajlar için ekstansiyon olmayan çapraz bağlayıcılara sahip kısa mikrotübüllere ihtiyaç vardır.
Son zamanlarda, çekirdeklendirici stabil mikrotübüllerin varlığında antiparalel çapraz bağlayıcı MAP65 kullanılarak mikrotübül taktoidlerinin oluşturulmasını sağlamak için bir teknik geliştirdik22. Mikrotübüllerin kısa olması gerekiyordu, ancak mikrotübül uzunluğundaki bilinen birkaç düzenleyici, mikrotübülleri dinamik kararsızlığa veya uçtan uca tavlamaya karşı kapatabilir. Bunun yerine, büyümeden sonra filamentleri çekirdeklendirmek ve stabilize etmek için GMPCPP kullanıldı. Bu, taktoidlere kendi kendini organize edebilen yüksek yoğunluklu kısa mikrotübüller oluşturmaya izin verdi. Bu taktoidler birefringans altında bakıldığında homojendi. Kısa mikrotübüllere ek olarak, taktoidleri oluşturmak için spesifik bir antiparalel çapraz bağlayıcı olan MAP65 kullanılmıştır (Şekil 2). MAP65, PRC1 / Ase1 mitotik çapraz bağlayıcılar ailesinde bitki mikrotübül ile ilişkili bir proteindir23. MAP65, kendisine ve mikrotübüllere bağlanmak için güçlü bir afiniteye sahip bir dimer olarak bulunur24. Aktin filamentleri 25,26,27 ile gözlenen, bipolar olan ve sıvı kristallerin sıvı benzeri özelliklerine sahip olan mayotik iğ ve taktoidlerin aksine, mikrotübül taktoidlerinin katı benzeri22,28 olduğu gözlenmiştir.
Burada, mikrotübül taktoidlerinin oluşturulması ve montajların şeklini ve floresan bazlı teknikler kullanılarak bileşenlerin hareketliliğini karakterize etmek için protokoller sunulmaktadır.
NOT: Aksi belirtilmedikçe, deneyin bazı kısımları uygun koruyucu ekipman (eldivenler) giyilirken bir laboratuvar tezgahında gerçekleştirilebilir.
1. Coverslip silanizasyonu
NOT: Kapak kaymaları, bu deneylerde kullanılan polimer fırça kaplaması ile kullanılmak üzere silanjmanize edilmelidir. Bu, hidrofobik merkezi bloklu bir blok kopolimerin bir polimer fırçayı bağlamasına ve oluşturmasına izin veren hidrofobik bir silanizasyon işlemidir. Eldiven giyerken toksik buharlara maruz kalmayı önlemek için aşağıdaki adımlar bir duman başlığında yapılmalıdır. Dimetildiklorolsilan oldukça toksiktir ve azami dikkatle kullanılmalıdır.
- Kapak fişlerini sırasıyla ddH 2 O, %70 etanol ve ddH2O ile durulayın. Her durulama arasında tüy bırakmayan laboratuvar mendilleri ile kurulayın. Bu, işlemden önce toz ve suda çözünür veya organik parçacıkları yüzeyden uzaklaştırır.
- Kapak fişlerini metal bir kapak tutma rafına yerleştirin ve rafı bir UV-Ozon (UVO) makinesine aktarın. Arka plan floresansını gidermek için kapak kapaklarını 20 dakika boyunca UVO ile ışınlayın. UVO yerine bir plazma odası kullanılabilir.
- Cımbız kullanarak, kapak kapaklarını UVO işlemi için kullanılan metal raftan silanizasyon için kullanılan farklı bir metal rafa aktarın. Her ikisi için de aynı rafları kullanmayın, çünkü UVO uygulandığında yüksek oksidasyona neden olur. Rafları su ve etanol ile önceden temizleyin, böylece önceki kullanımlardan kalan kimyasallar kalmaz.
- Kapak kapakları ile rafı 1 saat boyunca% 100 asetonlu bir kaba batırın. Tüm asetonu çıkarmak için kabı musluk suyuyla 3x ve ardından ddH2O ile 3x durulayın.
- Kapak kapaklarıyla rafı 10 dakika boyunca %100 etanol içine daldırın. Tüm etanolleri çıkarmak için kabı musluk suyuyla 3x ve ardından ddH2O ile 3x durulayın.
- Rafı, her biri 5 dakika boyunca ddH2O'da 3 kat kapak fişleriyle daldırın.
- Kapak kapaklarıyla 15 dakika boyunca kapak kapaklarıyla 0,1 M KOH'a (450 mL ddH2O'da 50 mL 1 M KOH) daldırın. Tüm KOH'yi çıkarmak için kabı musluk suyuyla 3x ve ardından ddH2O ile 3x durulayın.
- Rafı, her biri 5 dakika boyunca ddH2O'da 3 kat kapak kapaklarıyla daldırın.
- Kapak kapaklarıyla rafı gece boyunca bir duman davlumbazında veya laminer akışlı davlumbazda hava ile kurulayın.
- Rafı ve kapak kapaklarını tamamen kuruttuktan sonra, özellikle silan için kullanılan farklı bir kapta alınan% 2 dimetildiklorosilane (DDS) içine 5 dakika batırın. Kuru olmayan hiçbir şeyin silan ile temas etmesine izin vermeyin.
- Rafı ve kapakları 2 kat daha fazla 5 dakika boyunca %100 etanol içeren bir kaba daldırın. Kabı musluk suyuyla 3x, ddH 2 O ile3xdurulayın.
- Rafı ve kapakları her biri 5 dakika boyunca ddH2O'da 3 kat daldırın.
- Kapak kapaklarıyla rafı gece boyunca bir duman davlumbazında veya laminer akışlı davlumbazda hava ile kurulayın.
- Bu son kurutma adımından sonra, cımbız kullanarak kapak kapaklarını tekrar kapak kaydırma kutularına aktarın. Bu coverslipler önümüzdeki 1-2 ay içerisinde kullanılabilir. Eski kapaklar kaplamalarını kaybetmeye başlayacak ve atılmalıdır.
2. Tubulin hazırlığı
NOT: Satın alınan tübülin, etiketlenmemiş veya floroforlarla etiketlenmiş liyofilize bir toz olarak gelir. Liyofilize tübülin -80 °C dondurucuda saklanır. Aşağıdaki prosedür, etiketlenmemiş tübülini etiketli tübülinle görselleştirme için iyi bir oranda karıştırmak için kullanılır.
- -80 °C dondurucudan 1 mg liyofilize tübülin tozu içeren etiketsiz tübülinin bir alikotunu çıkarın ve buz üzerinde tutun. Tübülin konsantrasyonunu 5 mg / mL'ye getirmek için tüpe 200 μL soğuk PEM-80 ekleyin. Tüm liyofilatı çözmek için 10 dakika boyunca buz üzerinde tutun.
- −80 °C dondurucudan, 20 μg liyofilize tübülin tozu içeren rodamin etiketli tübülinin bir alikotunu çıkarın ve buz üzerinde tutun. Tübülin konsantrasyonunu 5 mg / mL'ye getirmek için tüpe 4 μL soğuk PEM-80 ekleyin. Liyofilatı tamamen çözmek için 10 dakika boyunca buz üzerinde tutun.
- Çözüldükten sonra, rodamin etiketli tübülinin 4 μL çözeltisine 100 μL etiketsiz yeniden askıya alınmış tübülin çözeltisi ekleyin. Pipet 6x-7x çok yavaş karıştırılır. Agregalar görülebiliyorsa, pelet atarak ve süpernatanı koruyarak agregaları çıkarmak için çözünürize tübülini 90.000 x g'de 10 dakika boyunca santrifüj edin. Bu tübülin karışımı ~% 4 etiketli tübülin ile sonuçlanacaktır.
- Kalan 100 μL etiketsiz tübülini sıvı azota (LN2) damlatarak dondurun ve ek tübülin karışımları için kullanılmak üzere -80 ° C'de saklayın.
- Etiketli tübülin karışımını ve aliquot'u her biri 15 μL olan yedi tüpe alın. Her aliquot tek bir deney odası için kullanılabilir. Kalan alikotları damla dondurun ve gelecekteki deneyler için -80 ° C'de saklayın.
3. MAP65 saflaştırma
NOT: MAP65 ticari olarak temin edilemez ve bu nedenle bu iş için saflaştırılması gerekir. Protokol daha önce çeşitli yayınlarda detaylandırılmıştır23,29.
- MAP65 plazmidini ve GFP-MAP65 plazmidini protein ekspresyonu için BL21 bakteri suşuna dönüştürün.
- BL21 bakterilerini 600 nm'de 0.6-1 optik yoğunluğa kadar büyütün. Lac operatörünü kullanarak protein üretimini teşvik edin ve bakterileri gece boyunca büyütün.
- Kültürleri toplayın ve bakterileri lize edin.
- Santrifüjlemeden sonra lizatı toplayın ve 6x-histidin etiketini bağlamak için mevcut bir nikel iyonuna sahip boncuklarla inkübe edin.
- Proteini imidazol kullanarak süzün ve tuzunu çözün.
- Proteini sıvı azotla dondurun ve 1 yıl içinde kullanmak üzere -80 ° C'de saklayın.
4. Akış odalarının montajı
NOT: Deneyler, cam sürgü ve silanjörlü kapak camından yapılmış akış odalarında gerçekleştirilir (Şekil 3).
- Bir cam slayt alın ve sırayla ddH 2 O, etanol ve ddH2O kullanarak temizleyin. Her durulama arasında tüy bırakmayan laboratuvar mendili ile kurulayın.
- Bir akış yolu oluşturmak için bir çift taraflı bant parçası kullanın. Eldivenli elleri kullanarak, bandı ~ 25-30 mm uzunluğa kadar kesin. İki ince şerit oluşturmak için bandı uzunlamasına bölün. İki bant şeridini, aralarında yaklaşık 5-8 mm olacak şekilde slayda yerleştirin.
NOT: Bandın kalınlığı yaklaşık 80-100 μm'ye standartlaştırıldığından, bant parçaları arasındaki yolun genişliği odadaki hacmi belirleyecektir. - Silanize kapak fişlerini akış yolunun üzerine yerleştirin. Kalemin arkasıyla bant bölgesine hafifçe bastırarak slaytı ve kapağı çift taraflı bant şeritlerine kapatın. Tüm alan üzerinde iyi bir sızdırmazlık aldığınızdan emin olun; Conta iyi yapıldığında bant yarı saydamdan temizlemeye dönmelidir.
- Bandı bir tıraş bıçağı ile keserek akış odası girişinden sadece 1 mm uzakta bırakarak kenarlardaki ekstra bandı çıkarın.
- Odayı, gerektiğinde deneysel parametreler hakkında bilgi ile etiketleyin.
5. Taktoid deneyleri
NOT : Tüm reaktifler ve malzemeler üretildikten sonra, akış odasındaki mikrotübül taktoidlerini çekirdeklendirmek ve polimerize etmek için kullanılabilirler.
- Kullanılacak tüm reaktifleri toplayın. Onları buz üzerinde çözün ve çalışırken buz üzerinde saklayın. Deneyler için birkaç akış odası yapın.
- Her deney için bir akış odası kullanın. PEM-80'de çözünmüş %5 iyonik olmayan blok kopolimer yüzey aktif maddenin (Malzeme Tablosu) 20 μL'lik kısmında, içinde hava kabarcıklarının oluşmasını önlemek için odanın her iki ucunda küçük damlalarla akarak akış odası yüzeylerini bir polimer fırça ile kaplayın. Bunu kullanıma hazır olana kadar (en az 5-7 dakika) nemli bir odada (yani, ıslak tüy bırakmayan bir laboratuvar mendili ile Petri kabında) saklayın.
- Steril bir tüpte, Tubulin-MAP karışımını oluşturmak için aşağıdakileri karıştırın: 9,5 μL PEM-80; 10 mM GMPCPP'nin 4 μL'si; 4 μL% 5 Pluronik-F127; 1 μL 1M DTT; 1 μL glikoz; 2 μL polietilen glikol (PEG); Adım 2.5'ten itibaren 12 μL 5 mg / mL tübülin karışımı (13.6 μM nihai konsantrasyon); ve MAP65'in 5,5 μL çalışma stoğu, görselleştirme için% 10'u GFP-MAP65'tir. Karıştırırken buz üzerinde tutun.
NOT: Viskoz PEG çözeltisini işlemek için pozitif yer değiştirmeli pipet kullanılması önerilir. Açıklığı büyütmek için ucu kestikten sonra normal pipetler kullanılabilir; ancak, bu yöntem daha az doğrudur. - Pipetleme ile 5x-6x karıştırın.
- Odaya eklemeden hemen önce, Tubulin-MAP karışımına önceden karıştırılmış bir glikoz oksidaz (0.5 mg / mL) ve katalaz (0.15 mg / mL) (Deoksi) çözeltisinden 1 μL ekleyin ve 7x-8x'i karıştırın. Çözeltinin toplam hacmini (40 μL) ayrı odalarda kullanılmak üzere iki bölüme bölün.
- Tubulin-MAP karışımını odalara aktarın. Odalarda zaten iyonik olmayan blok ko-polimer yüzey aktif maddesi bulunduğundan, eski sıvı çıkarılmadan daha fazla sıvı eklenemez. Bunu yapmak için, kılcal hareketle sıvıyı çıkarmak için odanın diğer ucunda bir parça filtre kağıdı veya tüy bırakmayan bir laboratuvar mendili kullanın.
- Numune odanın içine tamamen girdikten sonra, odanın iki ucunu 5 dakikalık epoksi kullanarak kapatın ve mikrotübül taktoidlerini çekirdeklendirmek ve büyütmek için ~ 30 dakika boyunca 37 ° C'de tutun.
6. Floresan mikroskobu
- Taktoidleri görüntülemek için bir floresan mikroskobu kullanın.
NOT: Toplam iç yansıma floresan mikroskobu veya dönen disk konfokal mikroskopisi, arka plan floresansını serbest tübülinden çıkarmak için iyidir, ancak taktoidler düzenli epi-floresan ve hatta oluşturulduktan sonra iletilen ışık mikroskobu ile de görülebilir, bu da bu prosedürü özel ekipman olmadan erişilebilir kılar. - Floresanda yeterli ışık toplamak için 60x veya daha yüksek bir büyütme ile 1,2 NA veya daha yüksek sayısal diyafram açıklığı (NA) hedefi kullanın. Bu hedefler genellikle ddH2O veya yağa daldırılmasını gerektirir.
- CMOS veya CCD kamera ile görüntüleri kaydedin. Fotoğraf makinesinde 108 nm etkin bir piksel boyutu kullanın.
NOT: Piksel boyutu fotoğraf makinesine ve kullanılan büyütmeye bağlıdır, bu durumda yüksek sayısal diyafram açıklığına (1,2 veya 1,49 NA) sahip 60x veya 100x idi. Gerekli piksel boyutunu elde etmek için kameradan önce ek görüntü genişleticiler kullanılabilir. - Bu sıcaklığa ayarlanmış bir çevre odası kullanarak numuneyi 37 °C'de tutun. Alternatif olarak, sıcak hava sahne ısıtıcıları ve dolaşımdaki ılık su ile objektif sıcaklık kontrollü yakalar dahil olmak üzere diğer sahne ısıtıcılarını kullanın.
- Gerekli floresan için doğru uyarma kaynaklarını kullanın. Rodamin tübülin için, numunede en az 1 mW güce sahip 561 nm lazer kullanın ve GFP-MAP65 için, numunede en az 1 mW güce sahip 488 nm lazer kullanın.
NOT: Geniş alan epi-floresan mikroskobu kullanıyorsanız, uyarma özellikli bir rodamin filtre küpü kullanın: 540 ± 12,5 nm, dikroik: 545 nm ± 12,5 nm kesme ve emisyon: 575 nm uzun geçiş ve uyarma özellikli bir GFP filtre küpü: 480 ± 15 nm, dikroik: 505 nm ± 15 nm kesme ve emisyon: 515 nm uzun geçiş. - 100'den fazla taktoidi görüntülemek için farklı alanların en az 10 görüntüsünü alın. Hem kırmızı hem de yeşil kanallarda görüntüler çekin ve analiz için 16 bit tiff görüntüler olarak kaydedin. Aydınlatma gücünün ve pozlama sürelerinin, kameranın yoğunluk ölçeği doygun olmayacak şekilde olduğundan emin olun.
7. Fotobeyazlatma sonrası floresan geri kazanımı (FRAP)
NOT: Taktoidlerin iç bileşenlerinin hareketliliğini incelemek için FRAP kullanılmıştır. FRAP, rodamin etiketli tübülin ve GFP etiketli MAP65 taktoidin seçilmiş bir kısmını fotobeyazlatarak ve daha sonra o bölgede zamanla floresanın geri kazanımını gözlemleyerek çalışır. Geri kazanım oranı, fotobeyazlatılan türlerin cirosuna bağlıdır. Bu devir hızı, difüzyon ve bağlanma reaksiyonlarına bağlı olabilir. Taktoidlere bağlanan MAP65 için, bağlayıcı döviz kurları tahmin edilebilir. FRAP, lazeri herhangi bir şekilde tarayabilen ek bir 405 nm lazer sistemi kullanılarak gerçekleştirilir. Yerel bir alanı fotobeyazlatmak için iletilen lambayı ve diyaframı kullanmak da dahil olmak üzere FRAP yapmak için birçok olasılık vardır14.
- Taktoidlerin parçalarını ve çevresindeki çözeltiyi kapsayan bir ilgi alanı (ROI) oluşturmak için haznede izole edilmiş bir taktoid seçin.
- FRAP için hem tübülini hem de MAP65'i aynı anda fotobeyazlatmak için ek bir 405 nm lazerli bir mikroskop kullanın. Alternatif olarak, iris14'ün alan durağından parlak bir lamba kullanılabilir. Ağartma sırasında proteinlere zarar vermemek için fotobeyazlatma sistemlerinin spesifik yoğunluğunu ampirik olarak ayarlayın.
- Ağartmadan önceki yoğunluk hakkında bilgi almak için fotobeyazlatmadan önce taktoidi 30-60 sn boyunca bir zaman serisi filmi olarak kaydedin. Hem kırmızı hem de yeşil kanalları kaydedin.
- Taktoide zarar vermeden fotobeyazlatmak için ROI'yi lazerlerle veya lambayla gerektiği kadar maruz bırakarak taktoidi fotobeyazlatın. Yoğunluğu ve zamanı ampirik olarak belirleyin.
- Fotobeyazlatma sonrası 5-10 dakika boyunca veya iyileşme dengeye ulaşana kadar filmi her iki renk kanalında da kaydetmeye devam edin.
- Kurtarma için GFP-MAP65 kanalını görsel olarak inceleyin.
8. Veri analizi
NOT: Farklı kalabalıklaşma ajanları, iyonik koşullar ve diğer faktörlerin eklenmesiyle uygulanan çevresel değişikliklerin etkilerini öğrenmek için taktoidlerin görüntülerinin nicel analizi yapılmıştır.
- Dokuntoid şekil karakterizasyonu
- Konfokal mikroskopi ile çekilen kırmızı ve yeşil görüntülerden taktoidlerin uzunluğunu ve genişliğini ölçün.
- FIJI/ImageJ kullanarak görüntüleri açın.
- Ham veriler 16 bit olarak alınıyorsa, gerekirse parlaklığı ve kontrastı ayarlayın. Görüntü > Görüntüyü dokuntoidi net bir şekilde görebilmek üzere ayarlamak için > Parlaklığını ve Kontrastını Ayarla'yı seçin. Yoğunluk verilerini yanlışlıkla değiştirmemek için ayarı uygulamadan parlaklığı ve kontrastı ayarlayın.
- Taktoidler açıkça görülebildiğinde, ölçmek için iyi taktoidleri seçin (Şekil 4Bi). Taktoidlerin diğer dokuntoid veya agregalarla örtüşmeden açıkça görülebildiğinden ve düz çizgi ölçüm araçlarını kullanabilmek için kavisli veya bükülmüş olmadığından emin olun.
- Ardından, görüntüler için doğru piksel boyutunun ayarlandığından emin olun. Mikroskop görüntüleri, piksel boyutuyla ilgili meta verilerle birlikte gelir. Meta verileri olmayan veya beklenen etkili piksel boyutunu değiştirebilen harici görüntü genişletme sistemlerine sahip olmayan farklı bir kamera kullanırken, piksel boyutunu manuel olarak ayarlayın. FIJI/ImageJ'de, doğru piksel dönüşümünü ayarlamak için Analiz > Ölçek Ayarla'ya gidin.
- FIJI/ ImageJ araç çubuğundaki Düz Çizgi aracını kullanarak, taktoidin bir ucuna tıklayın ve imleci dokuntoidin diğer ucuna sürükleyin (Şekil 4Bii). Çizgi YG seçildikten sonra, uzunluğu ölçmek için Analiz > Ölçü'yü seçin. Uzunluk varsayılan olarak ölçülmüyorsa, Ölçümleri Analiz Et > Ayarla iletişim kutusunda ölçümü uzunluğu içerecek şekilde ayarladığınızdan emin olun.
NOT: Tipik olarak, Düz Çizgi aracını kullanarak ölçüm yaparken, çizilen çizginin uzunluğunu ve açısını verir. Örnek olarak, Şekil 4Bii , taktoidi görünür kılmak için taktoidin yanına çizilmiş düz bir çizgi gösterir, ancak ölçümü doğrudan taktoid üzerinde yapar. - Ölçümü yaptıktan sonra, taktoidi etiketlemek için araç çubuğundaki Metin aracını kullanın. Bir metin kutusu oluşturun, bir sayı etiketi ekleyin ve etiketi görüntüye sabitlemek için Düzenle > Çiz'i seçin. Görüntüyü ayrı bir yatırım getirisi dosyası olarak kaydedin.
NOT: Bu dosyanın etiketlenmesi ve kaydedilmesi, araştırmacının ham verilerden hangi ölçümün hangi taktoide karşılık geldiğini bilmesini sağlar. Her dokuntoidi bir kez ölçtüğünüzden emin olun. - Tüm görüntünün taktoidleri ölçüldükten sonra, Sonuçlar penceresindeki verileri virgülle veya sekmeyle ayrılmış bir metin dosyasına kaydedin ( Dosya > Farklı Kaydet'i kullanarak) ve verileri sayılara ayrıştırmak için bir elektronik tablo programında açın. Tüm verileri (ham görüntü verileri, yatırım getirisi görüntüsü ve sonuçların metin dosyası) her şeyi düzenli tutmak için uygun bir adlandırma kuralına sahip bir klasörde toplayın.
NOT: Dokuntoid uzunluk ölçümleri elle yapılsa da, dokuntoid genişliklerin dar olduğu göz önüne alındığında, ölçüm hatasını azaltmak için dokuntoid genişliğini ölçmek için farklı bir yöntem kullanmak daha iyidir (aşağıya bakınız). - ImageJ/FIJI kullanarak, Düz Çizgi aracını kullanarak bir çizgi bölgesi çizin. Çizgiyi taktoid uzun eksene dik bir bisektör olarak çizin (Şekil 4Bii).
- Doğrusal bisektörün yoğunluk profilini oluşturmak için Analiz > Grafik Profili'ni seçin (Şekil 4Biii). Bir arsa görünecektir. Verileri grafikten almak ve kaydetmek için, sol alttaki Liste düğmesini seçin; bu, çizilen çizginin uzunluğu boyunca yoğunluk verilerinin metin dosyası listesini oluşturur. Metin dosyasını .csv veya .txt dosyası olarak kaydedin.
- Metin dosyasını MatLab, Python (sciPy) veya diğer programlar gibi uygun bir programda açın. Yoğunluk verilerini formun Gauss fonksiyonuyla eşleştirin:
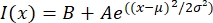 , burada I(x) uzunluk boyunca gri tonlamalı değerdir, x; B arka plan seviyesidir; A, Gaussian'ın genliğidir; μ, Gaussian'ın ortalaması veya merkezidir; ve σ Gaussian'ın standart sapmasıdır.
, burada I(x) uzunluk boyunca gri tonlamalı değerdir, x; B arka plan seviyesidir; A, Gaussian'ın genliğidir; μ, Gaussian'ın ortalaması veya merkezidir; ve σ Gaussian'ın standart sapmasıdır. - Rapor 2, taktoidin genişliği olarakσ . Gaussian'ın altındaki alanı hesaplayarak taktoiddeki mikrotübüllerin yoğunluğunu tahmin edin (arka plan hariç).
NOT: Görüntüler kameranın doğrusal yoğunluk aralığındaysa ve aynı pozlama süresi ve uyarma yoğunluğu ile çekilmişse, taktoiddeki mikrotübüllerin göreceli sayısını tahmin etmek için entegre yoğunluklar karşılaştırılabilir.
- FRAP analizi
NOT: Mikrotübüllerin ve MAP65'in hareketliliğini test etmek için yapılan deneyler, moleküler hareket nedeniyle spesifik fotobeyazlatma ve yoğunluğun geri kazanımını kaydetmek için FRAP'yi kullandı (Şekil 5A). Veriler, ImageJ/FIJI kullanılarak görüntü zaman serisi verilerinden ölçülmüştür.- Film verilerini açmak için ImageJ/FIJI kullanın.
- Sürüklenmeyi kaldırmak için yığınları (zaman serisi verileri) zaman içinde kaydedin. StackReg eklentisini yardımcı TurboReg eklentisiyle birlikte kullanın; eklentileri kullanma talimatları için, Malzeme Tablosunda verilen web bağlantılarına bakın. Çerçevelerin konumunu değiştirmek için çeviriyi seçin ve böylece görüntüleri kaydedin.
- Sürüklenmeyi kaldırmak için görüntüler kaydedildikten sonra, Görüntü > Dönüştür veya Döndür'ü seçerek görüntüyü dokuntoid çerçevede dikey veya yatay olacak > döndürün. Döndürülecek açıyı seçin ve dokuntoidin yeterince döndürülüp döndürülmediğini belirlemek için Önizleme'yi kullanın. Önizleme, taktoidin dikey veya yatay olduğunu gösterdiğinde, filmdeki tüm görüntüleri döndürmek için Tamam'ı seçin.
- Taktoidin fotobeyazlatılmış bölgesi üzerinde dikdörtgen bir bölüm oluşturmak için araç çubuğundaki Dikdörtgen seçim aracını kullanın. Görüntü > Yığınları > Ölçüm Yığını'nı kullanarak her kare için yatırım getirisi alanının entegre yoğunluğunu kaydedin. Analiz Et > Ölçümleri Ayarla'yı kullanarak ölçüm türünü Entegre Yoğunluk olarak ayarlayın. Sonuçlar penceresinde gösterilen analiz edilen yoğunluk verilerini, Dosya .csv Farklı Kaydet'i seçerek .txt veya > biçiminde metin dosyası olarak kaydedin.
NOT: Şekil 5B, ağartıcı bölgesindeki mikrotübül ve GFP-MAP65 kanalları için ölçülen ham 16 bit yoğunluk verilerinin bir örneğini göstermektedir. - Görüntülemenin neden olduğu fotobeyazlatma nedeniyle görüntülerin genel yoğunluğu küresel olarak zamanla azalacağından, bu küresel fotobeyazlatma düzeltilmelidir. Bunu yapmak için, aynı yatırım getirisi boyutunu kullanın (Adım 8.2.4.) ve görüntünün arka planında mikrotübüllerin veya MAP65'in görünmediği bir bölgeye taşıyın. Adım 8.2.4'te açıklandığı gibi yığının tümleşik yoğunluğunu ölçün. Sonuçları ikinci bir metin dosyası olarak kaydedin.
NOT: Şekil 5B , arka plan bölgesindeki mikrotübül ve GFP-MAP65 kanalları için ölçülen ham 16 bit yoğunluk verilerinin bir örneğini göstermektedir. - Arka plandaki solma durumunu düzeltmek için, taktoiddeki sinyal yoğunluğunu aynı zaman noktası için arka plan yoğunluğuna bölün. Düzelttiğim (t)'yi şu şekilde hesaplayın:
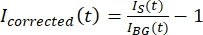 , burada I S (t) (sinyal) ağartılmış bölgede yapılan ölçümdür ve I BG (t) (gürültü) arka plan bölgesinde yapılan ölçümdür (Şekil 5C). Bu, her kare için sinyal-gürültü oranını hesaplar ve gürültüyü de çıkarır.
, burada I S (t) (sinyal) ağartılmış bölgede yapılan ölçümdür ve I BG (t) (gürültü) arka plan bölgesinde yapılan ölçümdür (Şekil 5C). Bu, her kare için sinyal-gürültü oranını hesaplar ve gürültüyü de çıkarır. - Ardından, verileri kullanarak verileri sıfır ile bir
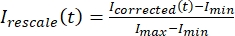 arasında olacak şekilde yeniden ölçeklendirin , burada minimum ve Imax, tüm zaman boyunca düzeltilmiş verilerin genel minimum ve maksimum değerlerini sırasıyla gösterir (Şekil 5C).
arasında olacak şekilde yeniden ölçeklendirin , burada minimum ve Imax, tüm zaman boyunca düzeltilmiş verilerin genel minimum ve maksimum değerlerini sırasıyla gösterir (Şekil 5C). - Bu verileri formun çürüyen bir üstel değerine sığdırın:
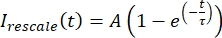 , burada A , kurtarmanın genliğidir ve τ, kurtarmanın zaman ölçeğidir (Şekil 5C).
, burada A , kurtarmanın genliğidir ve τ, kurtarmanın zaman ölçeğidir (Şekil 5C).
Sadece az sayıda bileşen, tübülin dimerleri ve mikrotübül çapraz bağlayıcıları ile mikrotübül taktoidleri oluşabilir (Şekil 2A). Bu protokol, bir inkübatörde mikrotübülleri çekirdeklendirmek ve büyütmek için inkübasyonu tanımlasa da, çekirdeklenme ve büyüme doğrudan mikroskop altında (30 dakika içinde tamamlanan) gözlemlenebilir (Şekil 2B). Tübülin konsantrasyonu 13.6 μm'de sabit tutulur ve MAP65-MT bağlanması% 10'da tutulur.
Şekil 4 başarılı verileri temsil eder. Taktoidler hem tübülin kanalında 561 nm lazer hem de MAP65 kanalında 488 nm lazer ile görülebilmelidir ve bu da birbirleriyle mükemmel bir şekilde örtüşmektedir (Şekil 4A). Sistemin bir gizemi, taktoidlerin genişliğinin, mikrotübül uzunluklarını, MAP65 konsantrasyonunu ve kalabalıklaşma ajanlarını değiştirmek de dahil olmak üzere çeşitli deneysel değişiklikler altında değişmediğidir (Şekil 4B) 22,28. Uzunluk çok daha değişkendir ve hem mikrotübül uzunluklarına hem de MAP65 konsantrasyonuna bağlıdır (Şekil 4B)22,28.
FRAP yapılırken, MAP65 sinyalinin iyileştiği, ancak mikrotübül sinyalinin iyileşmediği gözlenmiştir (Şekil 5). FRAP'taki iyileşme, etiketli ve fotobeyazlatılmış nesnelerin hareketliliği ve hareketinden kaynaklanmaktadır. MAP65 durumunda, kararmış moleküller ayrışır ve mikrotübülden uzaklaşır ve yenileri bölgeye taşınır (Şekil 5). MAP65 bağlanması dengededir, bu nedenle bağlanma ve bağlanmama oranı eşittir (saniyede molekül cinsinden ölçülür). Mikrotübüller için, mikrotübüllerin taktoidi terk edemediğini ima eden bir iyileşme görülmemiştir (Şekil 5A, Bi, C). Ayrıca, karanlık bölgenin yayılması görülmedi, bu da mikrotübüllerin lokal olarak hareketsiz olduğunu ve dokunaç şekli içinde bir sıvı olmadığını düşündürdü.
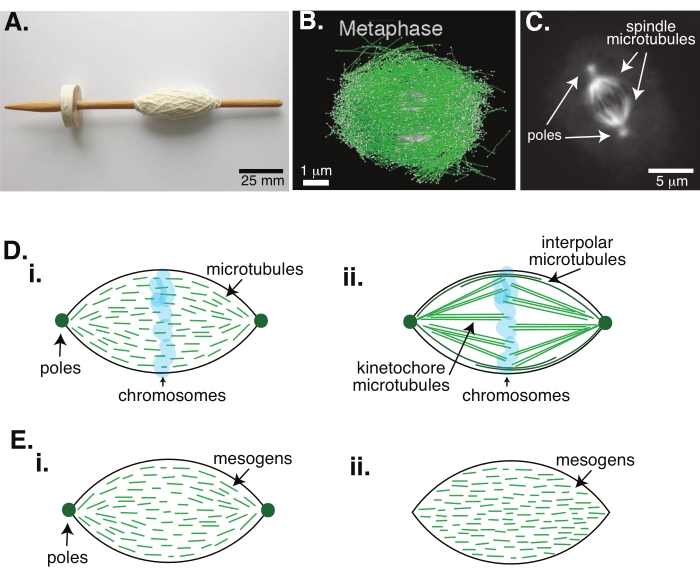
Resim 1: Farklı iş mili oluşum modelleri. Mitotik bir iğ, hücre bölünmesi sırasında kromozomları iki yeni yavru hücreye hizalayan ve ayıran mikrotübüllerden ve bunlarla ilişkili proteinlerden ve enzimlerden yapılmış bir makinedir. (A) Hollanda'dan ince iplikli erken bir Orta Çağ damla mili kopyasının görüntüsü. Bu rakam Peter van der Sluijs30 tarafından Wikimedia görüntüsünden değiştirilmiştir. (B) Vahşi tip mayoz II'nin farklı aşamalarında mikrotübüllerin üç boyutlu rekonstrüksiyonu. Mikrotübüller yeşil renkte, kromozomlar gri renkte gösterilir. Ölçek çubuğu = 1 μm. Bu rakam Lantzsch ve ark.31'den değiştirilmiştir. (C) Bölünen bir Sf9 hücresinin mitotik bir milindeki mikrotübüllerin mikroskopi görüntüsü. İş mili kutupları ve iş milinin mikrotübülleri yeşil bir floresan proteini ile etiketlenmiştir. Ölçek çubuğu = 5 μm. Bu rakam Advani ve ark.32'den değiştirilmiştir. (D) Mitotik ve mayotik iğ mikrotübüllerinin nasıl organize edildiğine dair farklı modeller. (i) Daha önce Xenopus yumurta ekstraktlarından oluşturulan mayotik iğler için gözlemlenen mikrotübüllerin (yeşil) iş mili boyunca kısa ve dinamik olduğu sonucuna varılmıştır. Bu, sıvı kristal içindeki bipolar taktoid organizasyona benzer. (ii) Mitotik bir iğ içindeki mikrotübül organizasyonu için kanonik modelin iki tür mikrotübül vardır: kromozomların etrafındaki orta bölgede çapraz bağlanan polarlar arası veya polar mikrotübüller (koyu yeşil) ve kromozomları itmek ve çekmek için kutuptan kinetochore'a paketlenen ve uzatılan kinetochore mikrotübülleri (açık yeşil). Tüm görüntülerde, kromozomlar şeffaf mavi renkte gösterilir ve iğ kutupları koyu yeşil renkte temsil edilir. (E) (i) bipolar ve (ii) homojen taktoidler için sıvı kristal taktoiddeki mezojenlerin (yeşil çizgiler) şemaları. Bipolar taktoidlerin taktoidin sonunda iki kutbu vardır ve mezojenler bu kutuplara işaret etmek için yeniden yönlendirilir. Homojen taktoidlerin sonsuzlukta kutupları vardır ve mezojenler taktoidin uzunluğu boyunca oryantasyon değiştirmez. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
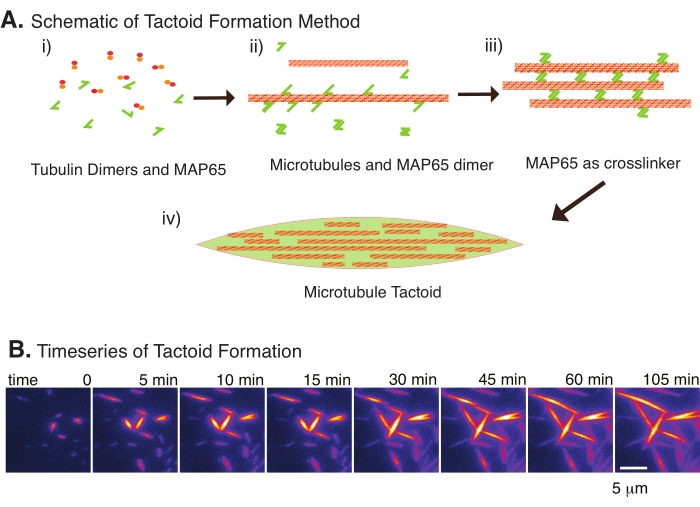
Şekil 2: Mikrotübül yoğuşması . (A) Mikrotübüller, iyonik türler, kalabalıklaşma ajanlarının neden olduğu tükenme kuvvetleri ve MAP65 gibi spesifik mikrotübül çapraz bağlayıcıları dahil olmak üzere çeşitli yöntemlerle paketlenebilir ve çapraz bağlanabilir. (i) Tübülin dimerleri ve MAP65 proteinleri, mikrotübülleri çekirdeklendirmek ve büyütmek için karıştırılır. (ii) Mikrotübüller tübülinden çekirdeklenir ve büyür ve MAP65 derhal mikrotübüllere, başka bir MAP65 monomerine veya her ikisine de bağlanır ve demetlenmeye neden olur. (iii) Çapraz bağlı demetlerdeki mikrotübüller çekirdeklenir ve büyür. (iv) Son konfigürasyon, bir iğe benzer bir mikrotübül taktoididir. (B) 105 dakikadan fazla çekirdeklenen ve büyüyen mikrotübül taktoidlerinin zaman serisi. Ölçek çubuğu = 5 μm. Şekil Edozie et al.22'den uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
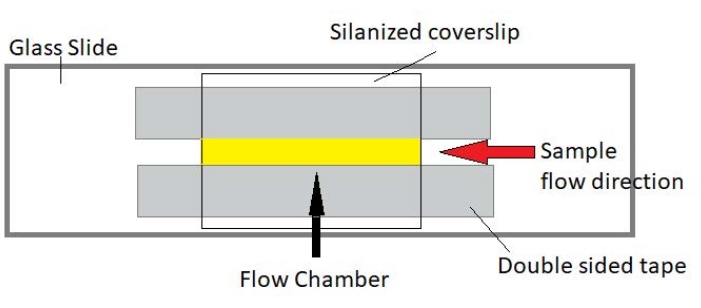
Resim 3: Akış odası tertibatı. Akış odası, bir cam slayt, silanized kapak camı ve kalıcı çift taraflı bant kullanılarak yapılır. Sarı vurgulanan bölge, numunenin aktığı ve gözlemlendiği akış yoludur. Akış odasının hacmi ~ 20 μL'dir. Epoksi, numunenin birkaç saat boyunca uzun süreli görüntüleme sırasında buharlaşmasını önlemek için odanın uçlarını kapatmak için kullanıldı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
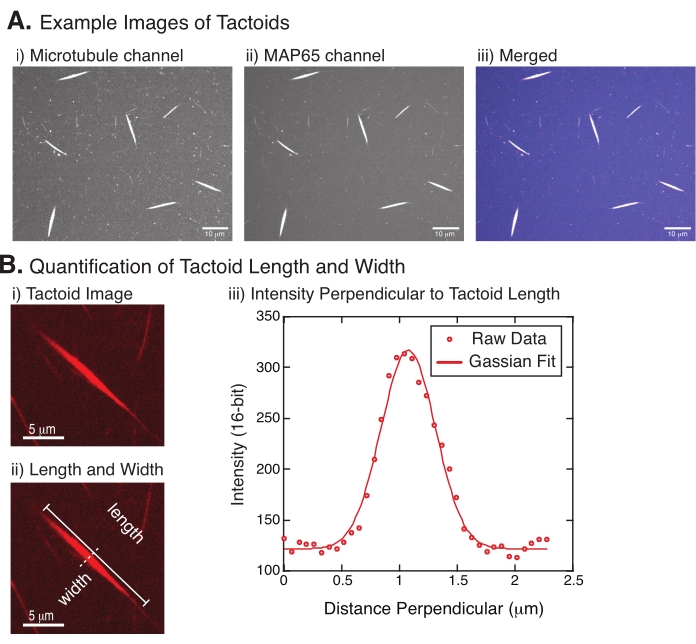
Şekil 4: Dokunsal görüntüler ile uzunluk ve genişlik analizi. (A) (i) 561 nm lazer kullanarak rodamin etiketli tübüleni görüntüleyen mikrotübül kanalı görüntüleme, (ii) GFP-MAP65 kanalı GFP'yi 488 nm lazer kullanarak görüntüleme ve (iii) mikrotübül kanalından (macenta) ve GFP-MAP65 kanalından (camgöbeği) birleştirilmiş bindirme görüntüsünü gösteren dönen disk konfokal kullanılarak tanımlandığı ve görüntülendiği gibi oluşturulan taktoidlerin örnek verileri. Örtüşen bölgeler beyaz olarak görüntülenir ve mikrotübüllerin ve MAP65'in tam olarak kolokalize olduğunu gösterir. Ölçek çubuğu = (A) içindeki tüm görüntüler için 10 μm. (B) Dokuntoid uzunluk ve genişliğinin ölçülmesi. (i) Etiketsiz analiz edilecek bir taktoidin görüntüsü. Ölçek çubuğu = 5 μm. (ii) Uzunluk (çizgi kapaklı düz çizgi) ve genişlik (kesikli çizgi) ölçümlerinin gösterildiği (i) ile aynı görüntü. Ölçek çubuğu = 5 μm. (iii) Genişlik, (ii)'de belirtilen dik bisektörel (kesikli çizgi) dokuntoid boyunca yoğunluk profili alınarak ölçülmüştür. Yoğunluk profili, taktoidin genliğini ve genişliğini ortaya çıkarmak için bir Gauss fonksiyonuna uyuyordu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
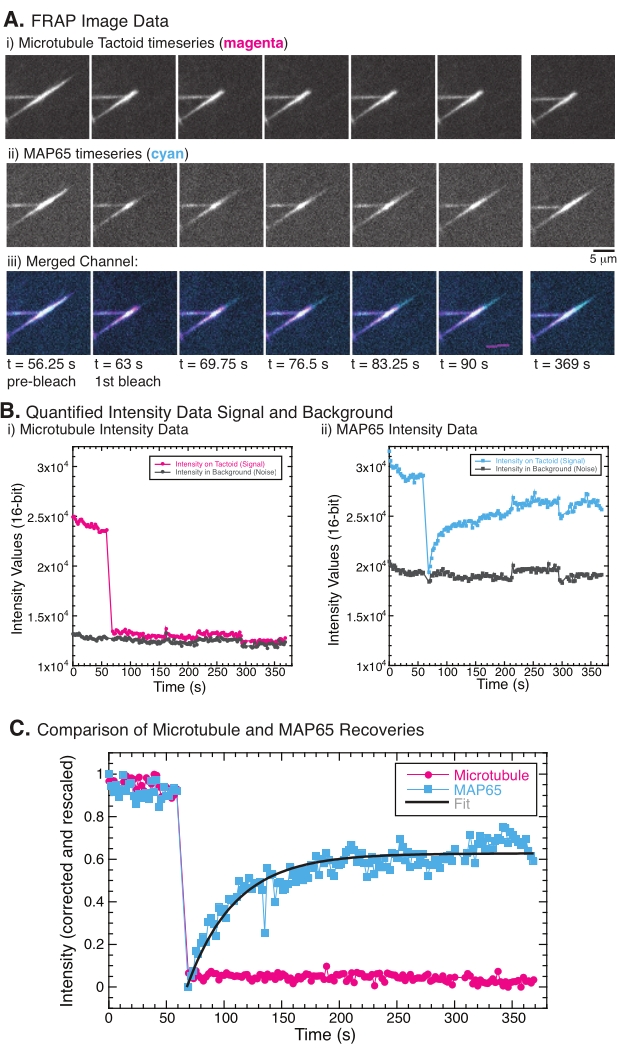
Şekil 5: Temsili FRAP verileri ve analizi. (A) (i) mikrotübül taktoidi ve (ii) GFP-MAP65'in mikroskopi zaman serisi verileri ve (iii) her iki kanalın macentadaki mikrotübüller ve camgöbeğindeki GFP-MAP65 ile örtüşen görüntüsü, 63 s zamanında fotobeyazlatılmış ve ilave 5 dakika boyunca gözlemlenmiştir. (B) (i) Niceliklendirilmiş yoğunluğu ) ağartılmış bölgedeki mikrotübül kanalı (macenta daireler) ve arka plan (koyu gri daireler) ve (ii) ağartılmış bölgedeki GFP-MAP65 kanalı (camgöbeği kareleri) ve arka plan (koyu gri kareler). (C) Veriler arka plan gürültüsü için düzeltildi ve mikrotübül kanalı (macenta daireleri) ve GFP-MAP65 kanalı (camgöbeği kareleri) için yeniden ölçeklendirildi. Mikrotübüller iyileşmez, ancak GFP-MAP65, genliği ve iyileşme zaman ölçeğini bulmak için yükselen üstel bozunmaya (koyu gri çizgi) sığar ve sığdırılabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Burada açıklanan yöntemler mikrotübül taktoidleri oluşturmak için çeşitli makalelerde kullanılmıştır (Şekil 2)22,28. Bu deneyler, çoğu hücre tipinde mitotik veya mayotik iğin şeklini ve stabilitesini kontrol eden örgütsel ilkeleri ortaya çıkarmaya yardımcı olmak için biyolojik olarak ilgilidir. Ek olarak, mikrotübüller, sıvı kristallerin izotropik fazlardan nematik fazları nasıl çekirdeklendirdiği ve büyüttüğü hakkında daha fazla bilgi edinmede yardımcı olabilecek model sıvı kristal mezojenleridir.
Burada özetlenen prosedür, mikrotübül kendi kendine organizasyonu keşfetmek için çeşitli avantajlara sahiptir. İlk olarak, laboratuvara başlamadan önce lise öğrencileri de dahil olmak üzere birçok öğrenci tarafından laboratuvarda çok az ön bilgi veya eğitim ile gerçekleştirilmiş olan oldukça tekrarlanabilir. Taktoidler çift refringent22'dir, floresan mikroskobuna ek olarak iletilen ışıkta görüntülenmelerini sağlar, bu yöntemi birçok laboratuvar için erişilebilir kılar ve bu deneysel prosedür, üst düzey araştırmalara ek olarak eğitim amaçlarına uyarlanabilir. Son olarak, bu süreç biyolojik sistemleri soyulmuş, indirgemeci bir yaklaşımla anlamaya ve araştırmaya devam etmek için yollar açarak, her bir ek koşulun, proteinin veya katkı maddesinin taktoidlerin ve belki de nihayetinde iğin kendi kendine organizasyonunu nasıl değiştirebileceğini anlamasını sağlar. Daha iyi biyomimikri için hedefler arasında aktivite, akışkanlık ve filament polarite sıralaması bulunur.
Deneyi etkileyen ve beklenmedik sonuçlar veren birkaç faktör olabilir. Örneğin, taktoidler oluşmuyorsa (Şekil 2) ancak fan benzeri desenler gözlenirse, MAP65 muhtemelen mevcut değildir veya mikrotübüllere bağlanmaz22,28. Bu, MAP65 floresan kanalında da belirgin olmalıdır, çünkü GFP-MAP65 mikrotübüllere bağlı olmayacaktır.
Taktoidler oluşmazsa ve arka plan cam üzerinde lekeler olarak görünüyorsa, bunun nedeni yüzey kaplaması olabilir. Bir kez gerçekleştirildikten sonra, silanizasyon kapaklarda sadece 1 ay sürer. Yıprandığında, tübülin spesifik olmayan bir şekilde maruz kalan yüzeye bağlanabilecektir. Bu bağlanma garip desenlerde gerçekleşecektir.
Taktoidler oluşmazsa ve tübülin çeşitli şekil ve boyutlardaki agregalarda gözlenirse, bunun nedeni düşük kaliteli tübülin olabilir. Tubulin, mikrotübül polimerizasyonu yerine bu yol dışı agregasyonu yönlendirebilecek ilk agregaları çıkarmak için santrifüj edilebilir. Yüzey tübüline bağlanıyorsa, çözeltideki tübülü de tüketebilir. Mikrotübüllerin polimerizasyonu için kritik konsantrasyonun altındaki düşük tübülin konsantrasyonları, agregalara neden olabilir.
FRAP deneylerinde, MAP65 kanalı herhangi bir iyileşme göstermiyorsa (Şekil 5), fotobeyazlatmanın mikrotübüllere fotozarar vermiş olması mümkündür. Fotohasar, filamentlerin lokalize tahribatına neden olur. Bu, iletilen kanalda muayene ile kontrol edilebilir. Mikrotübül taktoidleri, iletilen kanalda, çevredeki su ile yüksek indeksli kırılma uyumsuzluğu yoluyla görülebilir. Işık kaynaklı fotohasar, fotobeyazlatmaya tabi tutulan ROI'nin bulunduğu yerde iletilen ışık görüntülemede yanık izi veya kontrast kaybı olarak görünecektir. Bu meydana gelirse, proteinlerin fotohasarını inhibe etmek için lazer veya ışık gücü azaltılmalıdır.
Bu prosedür ve yaklaşımda karşılaşılan çeşitli zorluklar vardı. Bir sorun, uzunluk ölçümlerinin şu anda resme tıklanarak elle gerçekleştirilmesidir. Bu yöntem, basit olsa da, yüksek belirsizliğe neden olabilir. Enine kesiti kullanan ve bir Gaussian'a uyan genişlik ölçümü, boyutu ölçmek için daha iyi bir yöntemdir. Uzunluk için benzer bir yöntem kullanılabilir. İkinci bir sorun, bazen, taktoidlerin, çok uzun ve ince oldukları için bükülebilmeleridir. Bu, uzunluğu ölçmeyi daha zor hale getirir. Kontur uzunluğu, parçalı bir çizgi kullanılarak ölçülebilir, ancak bir segment her eklendiğinde belirsizlik eklenir.
Bilimsel bir bakış açısına göre, bu yaklaşımın sıvı kristaller veya iğler için bir model olarak kullanımı için başka zorlukları da vardır. İlk zorluk, mikrotübüllerin oluşturduğu taktoidlerin uzun, ince şekli olmuştur (Şekil 3 ve Şekil 4). Önceki yayınlarda belirtildiği gibi22, mikrotübül taktoidleri bipolar değil, homojen taktoidlerdir. Bu, şekli oluşturan mikrotübüllerin, yapının uçlarına işaret edecek şekilde yeniden yönlendirilmediği anlamına gelir. Bunun yerine, tüm mikrotübüller uzun eksene paraleldir ve "kutuplar" sonsuzlukta bulunur. Bu, moleküler sıvı kristaller veya hatta sıvı kristal mezojenler olarak da işlev görebilen aktin veya DNA için gözlemlenen taktoidlerden çok farklıdır. Bu diğer sistemlerde, taktoidler bipolar ve çapraz polarizörlerde bakıldığında, çubukların yeniden yönlendirilmesinin belirgin işaretlerini gösterirler.
Bu sistemdeki ikinci büyük zorluk, mikrotübüllerin taktoid içinde hareketsiz olmasıdır. Bu, mikrotübüllerin geri kazanımı çok düşük olduğu için FRAP deneylerinden ve analizlerinden açıktır. Katı benzeri yapıları, mikrotübül taktoidlerini büyük ölçekli sıvı kristal analogları kadar az değerli kılar. Bir sıvı kristalin nematik fazı hem sıvı (sıvı) hem de kristal (organize) özelliklere sahip olmalıdır. Şekil iş mili için doğru gibi görünse de, hareketsizlik sistemi model bir mitotik iş mili olarak daha az heyecan verici hale getirir. Öte yandan, bu konu, sistemde daha fazla akışkanlık yaratmak için deneylerin nasıl değiştirilebileceğini araştırmak için fırsatlar sunmaktadır.
Bu bilimsel zorluklar, sistem hakkında yeni bilgilere izin verecek heyecan verici fırsatlar sunmaktadır. Mikrotübül taktoidlerini daha bipolar hale getirmek için, daha kısa mikrotübüller kullanılabilir. Bununla birlikte, mikrotübüllerin aktinin yaptığı gibi uzunluğu kontrol etmek için çok iyi karakterize edilmiş kapak proteinlerine sahip olmadıkları için ek bir zorluk vardır. Çekirdeklenme ve büyüme kullanımı, kısa mikrotübüller yapmak için çok yüksek konsantrasyonlarda tübülin ve GMPCPP kullanılmasını gerektirir. Yüksek tübülin konsantrasyonu, sistemde daha fazla sayıda filamentle sonuçlanır, bu da taktoidleri birbirinden ayırmayı zorlaştırır. DARPin33 gibi yeni mikrotübül kapasitörlerinin eklenmesi bu duruma yardımcı olabilir. Mikrotübüllerin hareketsiz olmasının ikinci sorunu, mitozda kullanılan motorların tetramerleri olan kinesin-534 gibi motor proteinlerinin eklenmesiyle hafifletilebilir. Alternatif olarak, dimerik kinezin-1'in yapay dimerleri kullanılabilir15.
Daha fazla akışkanlık eklemenin bir başka yolu, mikrotübüllerin dinamik kararsızlıklarını, mikrotübüllerin büyümesini ve küçülmesini gerçekleştirmelerine izin vermektir. Şu anda, kararlı GMPCPP filamentleri ile tohumlanan ve daha sonra dinamik kararsızlığa uğrayan mikrotübüller, bir iğ veya taktoid oluşturmak için istenenden çok daha uzundur, bu da fanlar veya demetler gibi çok uzun organizasyonlara neden olur. Bu nedenle, mikrotübül dinamik kararsızlığının eklenmesi, dokuntoid şeklini korumak için dikkatli bir şekilde yapılmalıdır. Uzunluğu kontrol edebilen ilişkili proteinlerin ve enzimlerin eklenmesi bu sorunu hafifletebilir. Örneğin, kinezin-1335 gibi kinezinlerin depolimerize edilmesi veya katanin36 gibi enzimlerin kesilmesi muhtemelen gerekli olacaktır. Bu deneyler karmaşık ve zordur, ancak sonuçlar ne ortaya çıkarsa çıksın çok anlayışlı olacaktır. Gelecekteki deneyler hangi yöne giderse gitsin, mikrotübül taktoidleri oluşturmak için burada geliştirilen platform, mikrotübül organizasyonunun fiziksel temeli hakkında yeni bilgiler ortaya çıkarabilir.
Yazarlar, rekabet eden finansal çıkarları olmadığını beyan ederler.
Yazarlar, tüm yaz 2021 Ross Lab üyelerine, özellikle de K. Alice Lindsay'e yardımları için teşekkür eder. Bu çalışma, NSF BIO-2134215'ten S. Sahu, N. Goodbee, H.B. Lee ve J.L. Ross'u destekleyen bir hibe ile desteklendi. KECK Vakfı'ndan (Rae Anderson, USD, kurşun PI) gelen bir hibe, R. Branch ve P. Chauhan'ı kısmen destekledi.
| Name | Company | Catalog Number | Comments |
| 2% Dichlorodimethylsilane | GE Healthcare | 118945 | A hydrophobic silane surface treatment. This can be resused upto three times and kept at room temperature for one year. |
| 5-minute epoxy | Bob Smith Industries | For sealing experimental chambers | |
| Acetone | Fisher | 32900HPLC | 100% |
| BL21 cells | Bio Labs | C2527I | Competent bacterial cells used to express MAP65 |
| Catalase | Sigma | C30-500MG | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C for upto one year. |
| Coverslips (22 mm x 22 mm or 22 mm x 30 mm) | Fisher | 12544-AP | For experimental chambers |
| Dithiothreitol | Sigma | 43815-5G | A small molecule that is used to break disulfide bonds and scavenge oxygen. A 1 M stock is made from powder (Sigma) in ddH2O. The solution is aliquoted and stored at -20C for upto one year. The aliquots are used 7-8 times then discarded. |
| EGTA | Sigma | E3889-10G | Tubulin buffer base ingredient |
| Eppendorf 0.5 ml tubes | Eppendorf | 05 402 18 | For holding experimental solutions |
| Ethanol | Fisher | 111000200 | 200 proof |
| Filter paper | Whatman | 1004-110 | For cleaning and for pulling solutions through experimental chambers |
| Fluorescence microscope with high NA objectives | Nikon | Ti-E, W2 Confocal | For imaging experiments |
| Freezer -20°C | Fisherbrand | 13986148 | For storing reagents |
| Freezer -80°C | Thermo scientific | 328223H01-C | For storing proteins. |
| Glass containers for silanization | Michaels | For preparing experimental chambers - treating cover glasses | |
| Glass slides | Fisher | 12544-4 | For experimental chambers |
| Glucose | Sigma | G7528-250G | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C. |
| Glucose oxidase | Sigma | G2133-250KU | Part of the oxygen scavenging system. This is stored at 4°C for upto one year. |
| GMPCPP | Jenna Bioscience | NU-4055 | Slowly hydrolyzable analog of GTP used to polymerize and stabilize the microtubules by reducing the dynamic instability and spontaneous critical concentration for microtubule nucleation to get a consistent length. We purchase a 10 mM stock from Jena Biosciences and store it at -20°C for upto one year. |
| Heating element for microscope | Okolab stage top incubator | For imaging experiments | |
| Imidizole | Sigma | I2399 | Used to elute MAP65 protein from Nickel beads to purify MAP65 |
| Kimwipes | Fisher | 34155 | For cleaning and for pulling solutions through experimental chambers. |
| KOH | Sigma | P250-500 | 1 M in ddH2O, made fresh to prevent acidification over time. |
| Liquid Nitrogen | Airgas | NI 230LT22 | To drop freeze aliquots. This can also be used for storage (not recommended) |
| MAP65 protein | Ram Dixit | A microtubule-associated protein (MAP) with a molecular weight of 65 kD that is an antiparallel microtubule crosslinker. We have purified an unlabeled and GFP-labeled version of MAP65-1 from Arabidopsis thaliana. We mix the GFP-MAP65 with the unlabeled MAP65 such that 10% of the protein is labeled. The working stock is a 10.8 μM solution. This working solution is stored at 4°C and remade fresh every week. The protocol for purifying the MAP65 and GFP-MAP65 is given in our prior methods chapter (26). | |
| MgSO4 | Sigma | MKCJ940 | Tubulin buffer ingredient |
| NTA-Nickel beads | Qiagen | 30210 | Beads required to purify 6xHis tagged MAP65 proteins |
| Optomicroscan | Nikon | 405 nm laser system which can focus the laser in any desired shape of region of interest | |
| PEM80 | Neutral tubulin polymerizing base buffer for solution made from 80 mM K-PIPES, pH 6.8, 1 mM MgSO4, 1 mM EGTA, stored at 4°C for upto one year. | ||
| Permanent double-sided tape | 3M - Scotch | 34-8724-5691-7 | For experimental chambers |
| Petri dish | Fisher | FB0875713 | For humid chamber |
| PIPES | Sigma | P7643-100G | Tubulin buffer base ingredient |
| Pluronic-F127 | Sigma | P2443-250G | A block-copolymer with two hydrophilic polyethylene oxide (PEO) blocks on the ends and a hydrophobic center block of polyphenylene oxide (PPO) hydrophobic surface coating we use to prevent protein binding to the surface. Pluronic-F127 is purchased as a powder (Sigma) and dissolved to a 5% (w/v) solution in ddH2O overnight. Once dissolved, the solution can be stored at room temperature for upto one year. |
| Polyethylene Glycol | Affymetrix Inc | 19966 500 GM | A crowding agent used to create depletion forces to bring tactoids to the surface and help to organize microtubules. We create a 5% (w/v) solution of 100 kDa PEG in PEM80. The solution is stored in 4°C for upto one year and placed on the rocker before use. It is viscous, so we recommend using a positive displacement pipette to work with it. |
| Positive displacement pipette | Eppendorf | For pipetting viscous liquids | |
| Racks for coverslips | Electron Microscopy Sciences | 72240 | For preparing experimental chambers - treating cover glasses |
| Refrigerator 4°C | Fisherbrand | For storing reagents | |
| Tubulin Labeled | Cytoskeleton | TL590M | lyophilized rhodamine-labeled tubulin from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| Tubulin protein | Cytoskeleton | T240 | lyophilized tubulin 99% pure unlabeled from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| UV-Ozone | Jelight | Model 342 | For preparing experimental chambers - treating cover glasses |
| Stackreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/stackreg/ | plugin for registering time series data to remove drift |
| Turboreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/turboreg/ | plugin for registering time series data to remove drift |
- Bodakuntla, S., Jijumon, A. S., Villablanca, C., Gonzalez-Billault, C., Janke, C. Microtubule-associated proteins: structuring the cytoskeleton. Trends in Cell Biology. 29 (10), 804-819 (2019).
- Severson, A. F., von Dassow, G., Bowerman, B. Oocyte meiotic spindle assembly and function. Current Topics in Developmental Biology. 116, 65-98 (2016).
- Brugués, J., Needleman, D. Physical basis of spindle self-organization. Proceedings of the National Academy of Sciences of the United States of America. 111 (52), 18496-18500 (2014).
- Brugués, J., Nuzzo, V., Mazur, E., Needleman, D. J. Nucleation and transport organize microtubules in metaphase spindles. Cell. 149 (3), 554-564 (2012).
- Gatlin, J. C., et al. Spindle fusion requires dynein-mediated sliding of oppositely oriented microtubules. Current Biology. 19 (4), 287-296 (2009).
- Goshima, G., Mayer, M., Zhang, N., Stuurman, N., Vale, R. D. Augmin: A protein complex required for centrosome-independent microtubule generation within the spindle. Journal of Cell Biology. 181 (3), 421-429 (2008).
- Inoue, S., Sato, H. Cell motility by labile association of the nature of mitotic spindle fibers and their role in chromosome movement molecules. Journal of General Physiology. 50 (6), 259-292 (1967).
- Allenspach, A. L., Roth, L. E. Structural variations during mitosis in the chick embryo. Journal of Cell Biology. 33 (1), 179-196 (1967).
- Theg, D. E. Cytoplasmic microtubules in different animal cells. Journal of Cell Biology. 23 (2), 265-275 (1964).
- Mcdonald, K., Pickett-Heaps, J. D., Mcintosh, J. R., Tippit, D. H. On the mechanism of anaphase spindle elongation in Diatoma vulgare. Journal of Cell Biology. 9, 377-388 (1977).
- Chaikin, P. M., Lubensky, T. C. . Principles of Condensed Matter Physics. , (1995).
- Hamon, L., Savarin, P., Curmi, P. A., Pastré, D. Rapid assembly and collective behavior of microtubule bundles in the presence of polyamines. Biophysical Journal. 101 (1), 205 (2011).
- Needleman, D. J., et al. Higher-order assembly of microtubules by counterions: From hexagonal bundles to living necklaces. Proceedings of the National Academy of Sciences. 101 (46), 16099-16103 (2004).
- Ross, J. L., Fygenson, D. K. Mobility of taxol in microtubule bundles. Biophysical Journal. 84, 3959-3967 (2003).
- Sanchez, T., Welch, D., Nicastro, D., Dogic, Z. Cilia-like beating of active microtubule bundles. Science. 333 (6041), 456-459 (2011).
- Brandt, R., Lee, G. Functional organization of microtubule-associated protein tau. Identification of regions which affect microtubule growth, nucleation, and bundle formation in vitro. Journal of Biological Chemistry. 268 (5), 3414-3419 (1993).
- Hirokawa, N. Microtubule organization and dynamics dependent on microtubule-associated proteins. Current Opinion in Cell Biology. 6 (1), 74-81 (1994).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. The Journal of Cell Biology. 109 (3), 1173 (1989).
- MacRae, T. H. Microtubule organization by cross-linking and bundling proteins. Biochimica et Biophysica Acta (BBA). Protein Structure and Molecular Enzymology. 1160 (2), 145-155 (1992).
- She, Z. Y., Wei, Y. L., Lin, Y., Li, Y. L., Lu, M. H. Mechanisms of the Ase1/PRC1/MAP65 family in central spindle assembly. Biological Reviews. 94 (6), 2033-2048 (2019).
- Walczak, C. E., Shaw, S. L. A MAP for Bundling Microtubules. Cell. 142 (3), 364-367 (2010).
- Edozie, B., et al. Self-organization of spindle-like microtubule structures. Soft Matter. 15 (24), 4797-4807 (2019).
- Tulin, A., McClerklin, S., Huang, Y., Dixit, R. Single-molecule analysis of the microtubule cross-linking protein MAP65-1 reveals a molecular mechanism for contact-angle-dependent microtubule bundling. Biophysical Journal. 102 (4), 802-809 (2012).
- Chan, J., Jensen, C. G., Jensen, L. C. W., Bush, M., Lloyd, C. W. The 65-kDa carrot microtubule-associated protein forms regularly arranged filamentous cross-bridges between microtubules. Proceedings of the National Academy of Sciences of the United States of America. 96 (26), 14931-14936 (1999).
- Scheff, D. R., et al. Tuning shape and internal structure of protein droplets via biopolymer filaments. Soft Matter. 16 (24), 5659-5668 (2020).
- Weirich, K. L., et al. Liquid behavior of cross-linked actin bundles. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2131-2136 (2017).
- Weirich, K. L., Dasbiswas, K., Witten, T. A., Vaikuntanathan, S., Gardel, M. L. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences of the United States of America. 166 (23), 11125-11130 (2019).
- Sahu, S., Herbst, L., Quinn, R., Ross, J. L. Crowder and surface effects on self-organization of microtubules. Physical Review E. 103 (6), 062408 (2021).
- Stanhope, K. T., Ross, J. L. Microtubules, MAPs, and motor patterns. Methods in Cell Biology. 128, 23-38 (2015).
- Early Middle Ages drop single.jpg. Wikimedia Commons Available from: https://commons.wikimedia.org/wiki/File:Early_middle_ages_drop_spingle.jpg (2022)
- Lantzsch, I., et al. Microtubule reorganization during female meiosis in c. Elegans. eLife. 10, 58903 (2021).
- Advani, S., Maresca, T. J., Ross, J. L. Creation and testing of a new, local microtubule-disruption tool based on the microtubule-severing enzyme, katanin p60. Cytoskeleton. 75 (12), 531-544 (2018).
- Pecqueur, L., et al. A designed ankyrin repeat protein selected to bind to tubulin caps the microtubule plus end. Proceedings of the National Academy of Sciences of the United States of America. 109 (30), 12011-12016 (2012).
- Valentine, M. T., Fordyce, P. M., Krzysiak, T. C., Gilbert, S. P., Block, S. M. Individual dimers of the mitotic kinesin motor Eg5 step processively and support substantial loads in vitro. Nature Cell Biology. 8 (5), 470-476 (2006).
- Wagenbach, M., Domnitz, S., Wordeman, L., Cooper, J. A kinesin-13 mutant catalytically depolymerizes microtubules in ADP. Journal of Cell Biology. 183 (4), 617-623 (2008).
- McNally, F. J., Vale, R. D. Identification of katanin, an ATPase that severs and disassembles stable microtubules. Cell. 75 (3), 419-429 (1993).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved