종양 구상체의 반 높은 처리량 분석을 위한 신속한 광학 클리어링
요약
종양 구상체는 종양 세포-미세환경 상호작용 및 치료 반응을 평가하기 위해 점점 더 활용되고 있다. 본 프로토콜은 신속한 광학 클리어링을 사용하여 3D 종양 구상체의 반고처리량 이미징을 위한 견고하지만 간단한 방법을 기술한다.
초록
종양 구상체는 기본적인 암 연구 및 약물 개발에서 빠르게 보편화되고 있습니다. 세포 수준에서 스페로이드 내 단백질 발현에 관한 데이터를 얻는 것은 분석에 중요하지만, 기존 기술은 종종 비싸고, 힘들며, 비표준 장비를 사용하거나, 상당한 크기 왜곡을 일으키거나, 상대적으로 작은 구상체로 제한됩니다. 이 프로토콜은 구상체의 내부 구조에 대한 공초점 분석을 허용하면서 이러한 문제를 해결하는 구상체를 장착 및 제거하는 새로운 방법을 제시합니다. 기존의 접근 방식과는 달리, 이 프로토콜은 표준 장비 및 실험실 소모품을 사용하여 많은 수의 구상체를 신속하게 장착하고 제거할 수 있도록 합니다. 굴절률 매칭 클리어링 용액을 도입하기 전에 pH-중성 아가로스-PBS 겔 용액에 스페로이드를 장착하면 다른 유사한 기술에 공통적인 크기 왜곡이 최소화됩니다. 이를 통해 크기 측정의 정확도가 가장 중요한 상세한 정량 및 통계 분석이 가능합니다. 또한, 액체 클리어링 솔루션과 비교하여, 아가로스 겔 기술은 구상체를 제자리에 고정시켜 3차원(3D) 공초점 이미지를 수집할 수 있게 합니다. 이 기사에서는 이 방법이 셀 간 가변성 및 내부 스페로이드 구조에 대한 정보를 제공하는 고품질 두 개 및 3D 이미지를 생성하는 방법에 대해 자세히 설명합니다.
서문
구상체와 같은 3차원(3D) 세포 배양물은 집합체 세포 성장(1,2)의 생물학적으로 현실적이고 재현 가능한 모델을 제공한다. 이러한 모델은 약물 효능을 확인하기 위해 치료 사이에 스페로이드 크기와 구조의 차이를 조사하는 기본 연구 및 약물 개발 모두에서 빠르게 보편화되고 있습니다 3,4. 이러한 맥락에서, 많은 수의 구상체로부터 상세한 정보를 수집하는 능력은 통계적 힘의 관점에서 그리고 여러 치료에 걸쳐 세포 거동을 신속하게 평가할 수 있도록 하는 매우 유리하다.
스페로이드 구조의 상세한 현미경 이미지를 얻기 위해 일반적으로 사용되는 기술은 시간이 많이 걸리거나 비용이 많이 들거나 스페로이드 크기 4,5와 같은 주요 정량적 기능을 유지하지 않는 저품질 이미지를 생성합니다. 예를 들어, 냉동 절제술에 기초한 조직학적 기술은 고품질 이미지를 제공할 수 있지만, 종종 시간이 많이 걸리고, 숙련된 노동력이 필요하며, 종종 단면화 인공물(6,7)을 생성하는 반면, 단일 평면 조명 현미경(SPIM)8 및 다중 광자 현미경(multiphoton microscopy)9와 같은 우아한 기술은 쉽게 구할 수 없는 특수 현미경을 필요로 한다. 현대 현미경 기술은 최근에 구상체가 굴절률과 일치하는 클리어링 용액 내에 배치되고 공초점 현미경 4,5를 사용하여 이미지를 얻는 소위 광학 단면화를 가능하게했습니다. 이러한 기술은 높은 수율을 생성 할 수있는 잠재력을 가지고 있지만, 일반적인 문제는 이미징 중 스페로이드 이동, 지우기 중 크기 왜곡 및 독점적 인 클리어링 솔루션의 높은 비용을 포함합니다. 더욱이, 많은 기존 프로토콜은 직경이 300 μm 미만이거나 깊이가 최대 100 μm인 비교적 작은 구상체에만 적용되어, 이 기술을 종양 성장의 초기 단계인 5,10,11로 제한한다.
본 프로토콜은 전체 기관 클리어링 절차(12,13)로부터 유도된 저비용 굴절률-매칭 클리어링 솔루션을 사용하여 상세한 스페로이드 이미지의 반-고처리량, 고수율 수집을 허용한다. 이미징 중 스페로이드 이동을 방지하고 크기 왜곡을 줄이기 위한 구조적 지지대를 제공하기 위해 스페로이드는 24웰 #1.5 유리 바닥판의 agarose-PBS 젤에 장착됩니다. 이 기술을 통해 24웰 플레이트의 각 웰에 여러 개의 스페로이드를 장착할 수 있기 때문에 다양한 실험 조건에서 최대 360개의 스페로이드(15개의 스페로이드/웰)를 신속하게 장착하고 이미징할 수 있습니다. 쉽게 구할 수 있는 소모품으로 구성된 굴절률 일치 클리어링 솔루션은 장착된 구상체와 주변 젤을 광학적으로 제거하는 데 사용됩니다. 24시간의 침전 기간 후에, 이 프로토콜은 2% 미만의 크기 왜곡으로 비교적 큰 구상체(직경 약 700μm)에 대해서도 스페로이드 구조의 고품질 2D 및 3D 이미지를 제공합니다.
프로토콜
이 프로토콜은 웰 당 200 μL의 아가로스 겔 및 웰 당 500 μL의 클리어링 용액에서 하나의 24-웰 플레이트 (약 240-360 스페로이드 또는 10-15 스페로이드 / 웰)를 장착하기에 충분한 양의 종양 구상체의 제조를 설명합니다. 전체 절차는 그림 1에 나와 있습니다.
1. 2% 아가로스-PBS 겔 제제
- 유리 병에 저융점 아가로스 0.5g( 물차표 참조)을 싣고 인산완충식염수(PBS) 25mL를 첨가한다.
- 뚜껑을 닫지 않고 밀봉하지 않고 일정한 소용돌이로 30-60 초 동안 전자 레인지에서 용액을 끓여서 아가로스를 녹입니다. 아가로스가 완전히 용해되고 용액이 끓지 않도록하십시오.
참고 : 젤은 실온에서 보관할 수 있습니다. 증발을 설명하기 위해 사용하기 전에 볼륨을 확인하십시오. 사용하기 전에 액체 상태 (전자 레인지, 소용돌이 치는 20-60 초)로 가져 오십시오.
2. 청산액의 제조
- 무게는 9g의 N,N,N',N'-테트라키스(2-하이드록시프로필) 에틸렌디아민, 22g의 요소, 44g의 수크로오스, 0.1g의 트리톤 X-100 및 24.9g의 탈이온수를 계량한다(물차표 참조).
참고 : N,N,N',N'-Tetrakis (2- 히드 록시 프로필) 에틸렌 디아민의 대략적인 양을 측정하고 원하는 농도를 얻기 위해 다른 성분의 무게를 조정하는 것이 더 쉽습니다. - 용액을 일정한 혼합으로 56°C 수조에서 가열하고 모든 결정이 용해될 때까지 계속한다.
- 혼합 중에 형성된 기포가 표면으로 상승 할 수 있도록 용액을 실온에서 휴식시킵니다. 용액은 실온에서 최대 2 개월 동안 안정적입니다.
3. 스페로이드 준비
- 앞서 기술한바와 같이 아가로스 오버레이 방법을 사용하여 구상체를 생성한다 1,3,14.
참고: 다른 방법으로 생성된 스페로이드도 이 이미징 프로토콜과 호환됩니다. - 오리피스를 확대하기 위해 메스를 사용하여 1 mL 피펫 팁의 팁을 자릅니다.
참고: 모든 구상체는 절단 팁이 있는 1 mL 또는 200 μL 피펫으로 처리하였다. - 피펫을 사용하여 웰에서 구상체를 흡인하여 명확한 1.5mL 원뿔형 튜브로 옮깁니다. 동일한 조건의 여러 구상체를 동일한 튜브에 결합 할 수 있습니다.
참고 : 항상 구상체가 튜브 바닥에 정착하여 매체를 흡인하도록하십시오. - 구상체를 PBS 1 mL로 두 번 세척하고, 중성 4% 예열 파라포름알데히드(PFA) 용액을 첨가하고, 37°C에서 20분 동안 구상체를 인큐베이션한다.
- PFA 용액을 제거하고 PBS 1 mL로 구상체를 두 번 세척하였다.
4. 스페로이드 염색
- 피펫을 사용하여 최대 15개의 구상체를 200 μL PCR 튜브로 옮깁니다.
참고: 깨지기 쉬운 구상체의 경우, 계속하기 전에 구상체를 젤에 장착하십시오 (5.1-5.4 단계). - PBS 중의 0.5% 트리톤 X-100의 200 μL를 사용하여 세포를 투과시킨다. PCR 튜브를 50 mL 스크류-캡 튜브 내부에 위치시키고, 온화한 교반으로 실온에서 2시간 동안 구상체를 인큐베이션한다.
참고: 모든 인큐베이션은 달리 명시되지 않는 한 로터, 롤러 또는 쉐이커( 재료 표 참조)에서 교반을 통해 수행됩니다. 이것은 균일 한 염색을 달성하는 데 중요합니다. PBS의 고정 구상체는 때때로 피펫 팁의 측면에 달라 붙을 수 있습니다. 0.5 % Triton X-100으로 팁을 헹구면 구상체가 팁에 달라 붙는 것을 최소화합니다. - 용액 (단계 4.2)을 200 μL의 항체 희석 완충액 (ABDIL)15 로 교체하고 실온에서 밤새 인큐베이션한다.
- ABDIL을 제거하고, 75 μL의 일차 항체를 ABDIL에 첨가하고, 4°C에서 2.5일 동안 인큐베이션한다.
- 상청액을 제거하고 200 μL의 PBS로 0.1% 트윈 및 0.1% 트리톤 X-100 (PBS-TT)으로 2회 세척하고 실온에서 4시간 동안 200 μL의 PBS-TT와 함께 인큐베이션한다.
- PBS-TT를 제거하고, 100 μL의 이차 항체를 ABDIL에 첨가하고, 4°C에서 2.5일 동안 인큐베이션한다.
참고 : DAPI 또는 다른 핵 염료는이 단계에서 첨가 될 수 있습니다. 대부분의 염료는 항체보다 더 적은 배양 시간을 필요로합니다. - 상층액을 제거하고 200 μL의 PBS-TT로 2회 세척하고 200 μL의 PBS-TT와 함께 4시간 동안 인큐베이션한다. 구상체는 장착 할 준비가되었습니다.
5. 장착
- 200 μL 피펫을 사용하여, 고정 및 염색된 구상체를 조건당 하나의 튜브(대략 10-15개의 구상체)에서 500 μL PCR 튜브로 옮긴다.
- 용액을 200 μL의 2 % (w / v) 액체 아가로스 겔로 교체하고 실온에서 30 초 동안 빠른 스핀 (고정 된 최대 속도로, 재료 표 참조)에서 원심 분리하십시오.
주: 즉시 장착하지 않는 한, 겔 경화를 피하기 위해 50°C의 가열 블록에 두십시오. - 구상체를 ∼50 μL 액체 아가로스 겔에 흡인하고, 24-웰 유리 바닥 플레이트의 웰에 분배한다.
- 젤이 경화되기 전에 주변 젤의 피펫 팁을 사용하여 구상체를 분리하고 구상체가 젤로 덮여 있는지 확인하십시오. 선택적으로, 플레이트를 얼음 위에 놓아 겔을 빠르게 세팅한다.
참고 : 우물 당 구상체의 수는 구상체의 크기에 따라 다릅니다. 구상체는 서로 멀리 떨어져 배치되어 이미징하는 동안 하나의 스페로이드 만 시야에 들어갑니다. 이는 자동화된 이미지 처리에 중요합니다. - 웰 당 500 μL의 클리어링 용액 (단계 2)을 첨가하여 겔이 침수되도록 한다. RT에서 최소 24시간 동안 인큐베이션하고 클리어링 용액에서 구상체를 이미지화합니다. 구상체는 실온에서 최대 한 달 동안이 용액에서 안정하며 증발로부터 보호 될 때 안정적입니다.
6. 이미징
- 선박에 스페로이드의 장착 높이를 포함하여 전체 구상체를 포괄 할만큼 충분히 긴 작동 거리의 목표를 선택하십시오.
참고: 작동 거리가 3mm 이상인 물체는 구상체의 적도 평면을 이미지화하는 데 필요합니다. 더 높은 NA를 갖는 더 높은 배율 목표는 더 나은 해상도를 허용할 수 있지만, 구상체가 이미지화될 수 있는 최대 깊이를 제한할 것이다. - 적도 평면을 식별하려면 XY 평면에서 가장 큰 표면적에 도달할 때까지 초점을 조정하고 필요한 레이저 출력 백분율, 검출기 전압, 게인 및 오프셋 설정을 사용하여 이미지를 제공합니다.
참고: 레이저 출력 백분율, 검출기 전압, 이득 및 오프셋은 형광단, 염색 강도, 레이저 강도, 검출기 감도 등에 따라 크게 달라집니다. - 3D 이미지의 경우 구상체의 시작과 끝을 설정하고 이미징 전에 z 강도 보정 설정을 사용하여 다양한 z-깊이에서 적절한 신호 강도를 선택합니다.
참고: 최상의 이미지 해상도를 얻으려면 x, y 및 z에 대해 나이퀴스트 샘플링 속도를 사용하십시오(자세한 내용은 참조16 참조).
결과
고품질 이차원 및 3차원 이미지를 제공하는 이러한 클리어링 방법의 능력을 입증하기 위해, 직경이 300-600 μm인 구상체를 F루오레센트 U바이퀴틴화 기반 Cell Cycle Indicator (FUCCI) 형질도입된 흑색종 세포주 FUCCI-WM164 및 FUCCI-WM983b 9,17로부터 성장시켰다. 이는 Gap1에 있을 때 단량체성 쿠사비라 오렌지2(mKO2) 및 단량체성 아자미그린(mAG) 단백질을 발현하고, 세포 주기의 초기 S-페이즈/갭2/유사분열 단계는 각각 단계 31,3,14에 제공된 절차에 따라 발현한다. 이어서, 구상체를 37°C에서 4% 포름알데히드 용액으로 고정시키고, 투과시키고, 항-p27kip1/항토끼 알렉사 플루오르 647 항-피모니다졸/항-마우스 알렉사 플루오르 647, DAPI, 또는 DRAQ7(물질의 표 참조)로 염색하였다(도 2). 모든 현미경 파일은 GitHub 리포지토리(https://github.com/ap-browning/SpheroidMounting)에 업로드됩니다. PBS 장착형 구상체와 비교하여 클리어링 솔루션은 크기 왜곡을 최소화하면서 고선명도 이미지를 제공합니다(그림 2A). 이 프로토콜은 조직학적 단면화 없이 구상체 깊숙이 세포 수준 디테일의 고해상도 이미징을 허용하며, 바느질 없이 4096 x 4096px의 해상도로 20x 공기 목표(0.7NA)로부터 단면 이미지를 얻을 수 있습니다(그림 2B). 더 긴 작동 거리를 갖는 더 낮은 배율과 더 낮은 수치 조리개 목표를 사용하여, 적어도 200μm의 깊이에서 셀 레벨 디테일을 제공하는 3D 공초점 이미지를 얻을 수 있다(그림 2C). 스페로이드는 또한 Spoerri et al.4에 의해 프로토콜에 따라 동결절제되고 염색되었고, 전체 스페로이드 염색과 비교되었다(도 2D, E). 도 2D는 피모니다졸에 의해 염색된 스페로이드의 저산소 영역을 나타내고, 도 2E는 세포 주기 정지(황색) 및 DAPI 핵 염색(회색)을 표시하는 p27kip1 염색을 보여준다. 단백질 국소화 및 염색 패턴은 냉동 절제와 클리어링 사이에서 유사하므로 이 클리어링 방법의 영향을 받지 않습니다.
z에서의 신호 강도 보정은 전체 구상체의 이미징을 허용합니다. 그러나, 괴사 코어로 인한 광산란은 구상체의 먼 쪽을 이미지화하는 능력을 제한한다. DRAQ7 핵 염색과 같은 원적색 형광단의 더 깊은 침투와 더 적은 산란은 더욱 향상된 3D 스페로이드 구조 표현을 가능하게 합니다(그림 3). 영화 1은 DRAQ7로 염색된 FUCCI 구상체의 3D 렌더링을 보여줍니다. 더 얇은 z-슬라이스는 더 나은 z-해상도를 허용할 수 있지만, 이것은 형광단의 이미징 시간과 광표백을 상당히 증가시킨다.
클리어링 용액이 크기 왜곡을 야기하는지 여부를 결정하기 위해, 2% 아가로스-PBS 겔 중의 12개의 구상체를 클리어링 용액의 도입 후 6 h, 12 h, 24 h, 72 h 및 168 h에서 이미징하였다. 이미지는 스페로이드와 동일한 단면적 영역을 갖는 구체를 기반으로 정의된 구상체의 직경을 결정함으로써 요약되었다(도 4A). 구상체가 처음 6 h에 걸쳐 크기가 약간 증가하는 것으로 관찰되는 반면, 2 %와 6 % 사이의 직경 접이식 변화로 나타 났으며 (그림 4B), 24 h 내지 72 h 후에, 구상체는 PBS 후 PFA 고정에서 상응하는 크기와 거의 동일한 크기로 복귀한다 (도 4C).
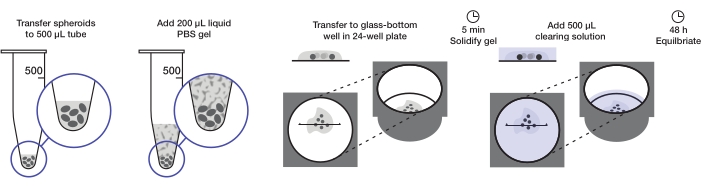
그림 1: 스페로이드 장착 및 지우기 프로토콜 그림 고정되고 염색된 구상체는 500 μL 튜브로 이송되고; 과량의 유체는 200 μL 아가로스-PBS 겔로 대체되고 원심분리된다. 그런 다음 구상체는 24 웰 플레이트의 유리 바닥 우물로 옮겨집니다. 겔이 응고되도록 허용된 후에, 500 μL 청산 용액이 첨가되고, 구상체가 평형화되도록 허용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
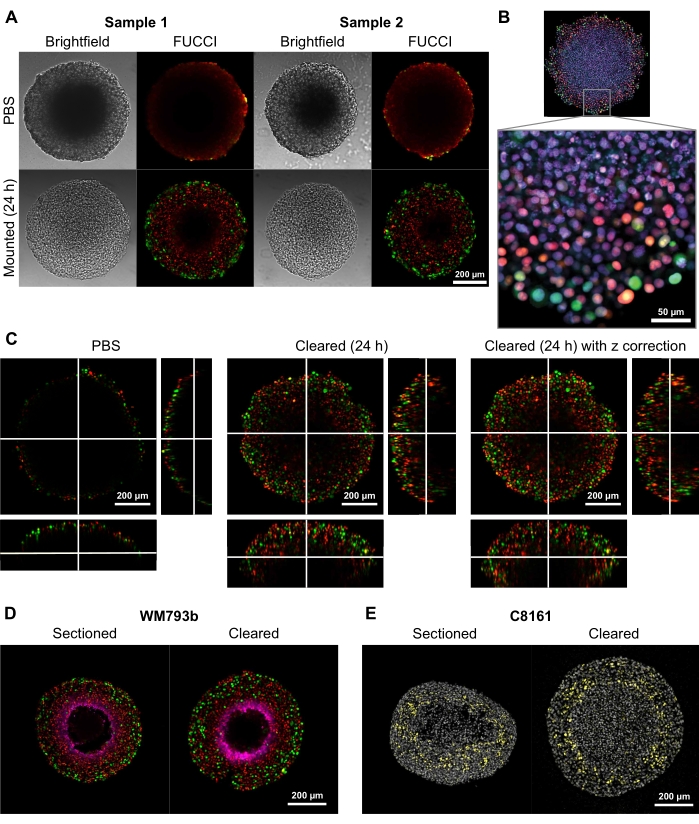
그림 2: FUCCI 인간 흑색종 구상체 및 비클리어의 비교. 착색은 mKO2 (적색)에 대해 양성인 세포 핵을 나타내며, 이는 갭 1의 세포를 나타내고; 및 갭 2에서 세포를 나타내는 mAG (녹색)에 대해 세포 핵을 양성으로 나타낸다. (A) 5000 FUCCI-WM983b 세포로부터 성장한 스페로이드는 10일째에 수확하고, 클리어링 용액 첨가 후 24시간 후에 아가로스-PBS 겔에서 이미지화한다. 클리어링 솔루션 전후의 밝은 필드와 공초점 이미지를 비교하면 크기 왜곡이 최소화되고 선명도가 크게 향상됩니다. 이미지는 10x 목표를 사용하여 수득된다. (B) FUCCI-WM164 세포로부터 성장한 스페로이드는 트리톤 X-100을 사용하여 투과화되고 DRAQ7로 염색되어 모든 세포 핵을 염색한다. 이미지는 20x 대물(0.75 NA)을 사용하여 얻어지며, 클리어링 용액이 세포 레벨 디테일의 고해상도 이미징을 가능하게 함을 입증한다. (C) 3D 이미지(10x, 0.4 NA)는 PBS 중의 FUCCI-WM164 구상체를 수득하였고, 24시간 후에 클리어링 용액을 첨가하였다. 서로 다른 z-평면에서 레이저 전력, 전압 및 오프셋을 조정하면 구상체 내부 깊숙한 곳에서 이미징 할 수 있습니다. (D,E) 냉동 절제술과 피모니다졸 및 p27kip1에 대해 염색된 클리어 전체 스페로이드 사이의 비교. (d) 마젠타에서의 피모니다졸 염색은 구상체에서의 저산소 영역을 나타낸다. 빨간색과 녹색은 FUCCI를 나타냅니다. (E) DAPI (회색) 및 p27kip1 (노란색)을 보여주는 Cryosection 및 클리어 스페로이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
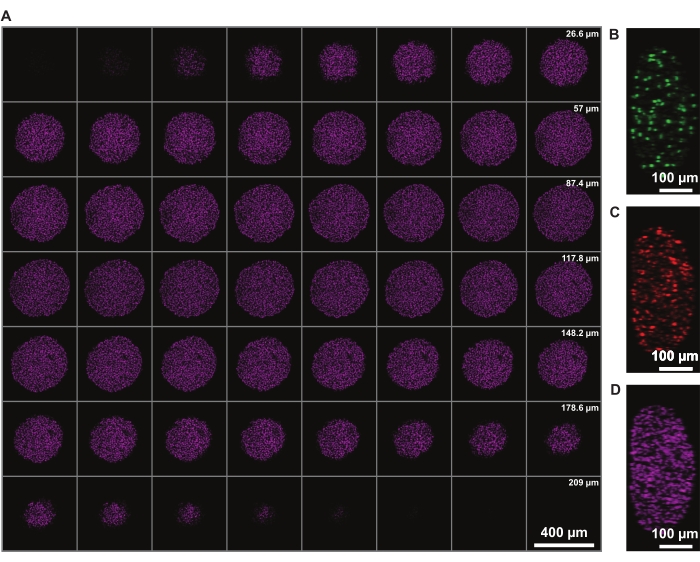
그림 3: 클리어링을 통해 광 손실을 최소화하면서 스페로이드 깊숙이 이미징할 수 있습니다. FUCCI 인간 흑색종 스페로이드의 공초점 현미경 이미지를 10x 배율 및 더 낮은 NA(0.4)에서 촬영하여 최소한의 신호 손실로 더 높은 z-깊이에서 이미징할 수 있습니다. (A) DRAQ7로 염색된 스페로이드 핵의 3.88μm 조각. (B-D) y/z-해상도는 각각 488(mAG), 568(mKO2) 및 647nm(DRAQ7) 채널에서 측정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
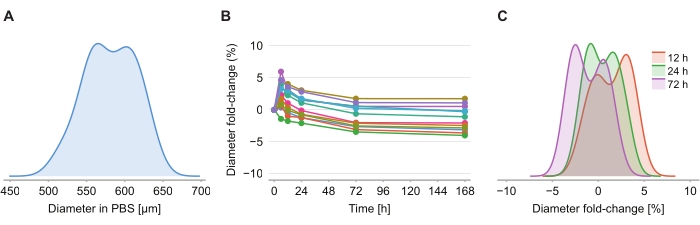
그림 4: 클리어링 솔루션은 스페로이드 크기에 미치는 영향을 최소화합니다. (A) PBS 겔에서의 초기 스페로이드 크기(등가 직경)의 분포(n =12 구상체). (B) 직경 폴드-클리어링 용액의 첨가 이후 시간에 따른 변화. 0 h에서, 구상체는 PBS 겔에만 있습니다. (C) 직경 접힘 변화의 분포 12 h, 24 h 및 72 h에서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 1: DRAQ7로 염색된 FUCCI 스페로이드의 3D 렌더링. 이 영화를 다운로드하려면 여기를 클릭하십시오.
토론
종양 구상체의 고품질 이차원 및 입체 이미지를 얻기 위한 프로토콜이 여기에 제시된다. CLARITY, See deep brain (SeeDB) 및 ScaleS와 같은 기존 방법은 종종 최대 30 %까지 크기 왜곡을 일으키는 반면, 벤질 알코올 / 벤질 벤조에이트 (BABB) 및 용매 제거 된 기관의 3D 이미징 (3DISCO)과 같은 기술은 형광 단백질(18)을 급냉시킬 수 있습니다. 이들 방법들 중 다수는 구조적 완전성을 갖는 조직을 클리어링하고 구상체(18)에 적용될 때 크기 및 구조를 왜곡하도록 설계된다. 상업적으로 이용 가능한 고가의 클리어링 솔루션을 사용하는 다른 프로토콜과는 달리, 이 프로토콜은 광학 선명도와 내인성 형광을 유지하고 크기 왜곡을 최소화하면서 쉽게 사용할 수 있는 소모품을 사용합니다. 아가로스-PBS 겔에 구상체를 내장하면 구상체에 대한 구조적 지지가 제공되며 클리어링 용액이 첨가될 때 삼투압 충격을 최소화할 수 있습니다. 이것은 약물 치료 후 깨지기 쉬운 구상체를 이미징 할 때 중요합니다. 이 광학 클리어링 방법은 이 프로토콜이 전체 조직 클리어링으로부터 적응되기 때문에 임의의 방법에 의해 형성된 구상체에 적합하다고 가정된다. 가정은 상이한 스페로이드 형성 방법에 의해 수득된 구상체에서의 유사성에 기초한다. 고정제의 선택은 스페로이드 크기뿐만 아니라 내인성 형광에도 영향을 줄 수 있습니다. 이 클리어링 방법은 중성 4% PFA 용액으로 고정된 구상체에 적합합니다. 다른 고정 장치와의 호환성을 확인하기 위해서는 추가 테스트가 필요합니다.
이 기술을 통해 다중 스페로이드를 다중 웰 플레이트에 동시에 장착할 수 있다는 점을 감안할 때, 24웰 플레이트당 최대 360개의 스페로이드 구조 정보가 필요한 정량적 분석 파이프라인에 매우 적합합니다. 자동화된 스테이지 및 플레이트 매핑 기능을 갖춘 현미경은 이미징을 덜 수동으로 만들 수 있습니다. 이 방법은 단면화보다 빠르고 쉽지만 현재 완전한 자동화에는 적합하지 않습니다. 그러나, 이 방법에 의해 획득된 이미지들은 자동화된 이미지 프로세싱(4,19)에 적합하며, 이 프로토콜을 사용하여 스페로이드가 장착될 수 있는 속도는 스페로이드 내부 구조(20,21,22)의 정량적 분석에 도움이 된다.
전체 구상체를 염색하기 위해, 항체 농도, 부피 및 인큐베이션 시간은 모든 항체에 대해 최적화되어야 한다. 가이드로서 튜브 당 구상체 수에 따라 권장되는 2D 면역 형광 항체 농도의 2.5x 및 항체 100-200 μL를 사용하십시오. 로터에있을 때 모든 구상체가 염색 용액으로 덮여 있는지 확인하십시오. 인큐베이션 시간은 구상체 및 항체의 크기 및 밀도를 포함하는 많은 인자에 의존하며, 16-72 h의 범위일 수 있다. 구상체 내에서 더 깊은 신호 검출을 허용하는 방법에도 불구하고, UV에 의해 여기된 형광단은 상당한 광 산란을 일으켜 낮은 신호 대 잡음비를 초래한다. 표적 단백질을 시각화하기 위해 형광단을 선택할 때는주의를 기울여야합니다. 예를 들어, 더 긴 파장의 형광단과 더 풍부한 단백질 또는 핵 염색을 더 짧은 파장의 형광단으로 덜 풍부하고 구조적인 단백질을 염색하면 최상의 결과를 얻을 수 있습니다. 마지막으로, 클리어 된 구상체는 괴사 성 코어의 산란으로 인한 광 손실을 여전히 보여 주며, 600 μm 구상체로 얻은 이미지의 y / z 차원에서 분명합니다 (그림 2C).
더 높은 NA 목표를 가진 더 높은 배율 이미징은이 프로토콜을 사용하여 구상체를 장착하고 클리어하면 가능하지만 목표의 작동 거리는 이미징 깊이를 제한합니다. 오일 침지 렌즈의 경우 최상의 결과를 얻으려면 RI가 1.51인 오일을 사용하는 것이 중요합니다.
요약하면, 아가로스-PBS 겔 임베디드 클리어링 방법은 일반적으로 이용가능한 소모품을 사용하여 구상체 내부 깊숙한 곳의 세포를 시각화할 수 있게 한다. 이 방법을 사용하여 장착 및 클리어된 스페로이드는 최소한의 크기 왜곡을 거치며 구조적 무결성을 유지하므로 내부 스페로이드 구조 및 후속 자동 정량화와 관련된 고품질 데이터를 수집할 수 있습니다.
공개
올림푸스는 출판 비용에 기여했습니다.
감사의 말
이 연구는 Translational Research Institute (TRI), Woolloongabba, QLD에서 수행되었습니다. TRI는 호주 정부의 보조금으로 지원됩니다. 뛰어난 기술 지원에 대해 TRI의 현미경 검사 핵심 시설의 직원들에게 감사드립니다. FUCCI 구축물을 제공해주신 일본 와코시 리켄 아츠시 미야와키 교수님, Meenhard Herlyn 교수님과 펜실베이니아 주 필라델피아 위스타 연구소의 패트리샤 브래포드 여사에게 세포주를 제공해 주신 것에 감사드립니다. C8161 냉동 절제 이미지를 제공해 주신 Loredana Spoerri 박사님께 감사드립니다.
이 작업은 N.K.H.: Australian Research Council (DP200100177) 및 Meehan Project Grant (021174 2017002565)에 대한 프로젝트 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
참고문헌
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유