Быстрая оптическая очистка для полувысокопроизводительного анализа сфероидов опухолей
В этой статье
Резюме
Сфероиды опухолей все чаще используются для оценки взаимодействия опухолевых клеток и микроокружения и ответа на терапию. Настоящий протокол описывает надежный, но простой метод полувысокопроизводительной визуализации 3D-сфероидов опухолей с использованием быстрой оптической очистки.
Аннотация
Сфероиды опухолей быстро становятся обычным явлением в фундаментальных исследованиях рака и разработке лекарств. Получение данных о экспрессии белка в сфероиде на клеточном уровне важно для анализа, однако существующие методы часто являются дорогостоящими, трудоемкими, используют нестандартное оборудование, вызывают значительные искажения размера или ограничены относительно небольшими сфероидами. Этот протокол представляет собой новый метод монтажа и очистки сфероидов, который решает эти проблемы, позволяя проводить конфокальный анализ внутренней структуры сфероидов. В отличие от существующих подходов, данный протокол предусматривает быстрый монтаж и очистку большого количества сфероидов с использованием стандартного оборудования и лабораторных принадлежностей. Установка сфероидов в рН-нейтральный раствор геля агарозы-PBS перед введением раствора для очистки с показателем преломления сводит к минимуму искажение размера, характерное для других подобных методов. Это позволяет проводить детальный количественный и статистический анализ, где точность измерений размеров имеет первостепенное значение. Кроме того, по сравнению с жидкими растворами для очистки, метод агарозного геля удерживает сфероиды фиксированными на месте, что позволяет собирать трехмерные (3D) конфокальные изображения. В настоящей статье подробно рассматривается, как метод дает высококачественные двух- и 3D-изображения, которые предоставляют информацию о межклеточной изменчивости и внутренней сфероидной структуре.
Введение
Трехмерные (3D) клеточные культуры, такие как сфероиды, обеспечивают биологически реалистичные и воспроизводимые модели совокупного роста клеток 1,2. Эти модели быстро становятся обычным явлением как в фундаментальных исследованиях, так и в разработке лекарств, где различия в размере и структуре сфероидов исследуются между методами лечения для определения эффективности препарата 3,4. В этих контекстах способность собирать подробную информацию из большого количества сфероидов очень выгодна, как с точки зрения статистической мощности, так и для быстрой оценки поведения клеток в нескольких методах лечения.
Широко используемые методы получения подробных микроскопических изображений сфероидной структуры либо трудоемки, либо дороги, либо дают изображения низкого качества, которые не сохраняют ключевых количественных характеристик, таких как размер сфероида 4,5. Например, гистологические методы, основанные на криосечении, могут обеспечить высококачественные изображения, но часто отнимают много времени, требуют квалифицированной рабочей силы и часто создают артефакты секционирования 6,7, в то время как элегантные технологии, такие как одноплоскостная микроскопия освещения (SPIM)8 и многофотонная микроскопия9, требуют специализированных микроскопов, которые недоступны. Современные технологии микроскопии в последнее время позволяют проводить так называемое оптическое сечение, при котором сфероиды помещаются в клиринговый раствор с показателем преломления, а изображения получаются с помощью конфокальной микроскопии 4,5. Хотя эти методы имеют потенциал для получения высокой производительности, общие проблемы включают движение сфероидов во время визуализации, искажение размера при очистке и высокую стоимость запатентованных решений для очистки. Кроме того, многие существующие протоколы применяются только к относительно небольшим сфероидам диаметром менее 300 мкм или глубиной до 100 мкм, ограничивая технологию ранними стадиями роста опухоли 5,10,11.
Настоящий протокол позволяет осуществлять полупроизводительный и высокопроизводительный сбор подробных сфероидных изображений с использованием недорогого раствора для очистки рефракционных показателей, полученного из процедур очистки всего органа12,13. Чтобы предотвратить движение сфероидов во время визуализации и обеспечить структурную поддержку для уменьшения искажения размера, сфероиды вмонтированы в гель агароза-PBS в 24-луночную стеклянную нижнюю пластину No 1.5. Поскольку этот метод позволяет устанавливать несколько сфероидов в каждой скважине в 24-луночной пластине, до 360 сфероидов (15 сфероидов / скважина) могут быть быстро установлены и отображены в различных экспериментальных условиях. Для опорожнения, соответствующего показателю преломления, изготовленный из легкодоступных расходных материалов, используется для оптической очистки установленных сфероидов и окружающего геля. После периода успокоения в 24 часа этот протокол обеспечивает высококачественные 2D и 3D изображения структуры сфероидов, даже для относительно больших сфероидов (примерно 700 мкм в диаметре), с искажением размера менее 2%.
протокол
Протокол описывает получение достаточного количества сфероидов опухоли для установки одной 24-луночной пластины (приблизительно 240-360 сфероидов или 10-15 сфероидов/лунка) при 200 мкл агарозного геля на лунку и 500 мкл очищающего раствора на лунку. Полная процедура показана на рисунке 1.
1. 2% препарат агарозы-PBS геля
- Взвесьте 0,5 г низкоплавкой агарозы (см. Таблицу материалов) в стеклянной бутылке и добавьте 25 мл фосфат-буферного физиологического раствора (PBS).
- Расплавить агарозу кипятят раствором в микроволновке в течение 30-60 с закрытой, но не герметичной крышкой и с постоянным закручиванием. Убедитесь, что агароза полностью растворена и раствор не закипает.
ПРИМЕЧАНИЕ: Гель можно хранить при комнатной температуре; проверьте объем перед использованием, чтобы учесть испарение. Доведите до жидкого состояния (микроволновая печь; 20-60 с с закручиванием) перед использованием.
2. Приготовление очистительного раствора
- В весе 9 г N,N,N',N'-тетракис(2-гидроксипропил)этилендиамина, 22 г мочевины, 44 г сахарозы, 0,1 г тритона X-100 и 24,9 г деионизированной воды (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Проще взвесить приблизительное количество N,N,N',N'-Тетракис(2-гидроксипропил)этилендиамина и отрегулировать массу других компонентов для получения желаемой концентрации. - Нагрейте раствор на водяной бане при температуре 56 °C с постоянным перемешиванием и продолжайте до тех пор, пока все кристаллы не растворятся.
- Отложите раствор при комнатной температуре, чтобы пузырьки, образовавшиеся при перемешивании, поднялись на поверхность. Раствор стабилен при комнатной температуре до 2 месяцев.
3. Подготовка сфероидов
- Генерация сфероидов с помощью метода наложения агарозы, как описано ранее 1,3,14.
ПРИМЕЧАНИЕ: Сфероиды, генерируемые другими методами, также совместимы с этим протоколом визуализации. - Отрежьте кончик кончика пипетки объемом 1 мл с помощью скальпеля, чтобы увеличить отверстие.
ПРИМЕЧАНИЕ: Все сфероиды обрабатывались пипетками объемом 1 мл или 200 мкл с разрезанными наконечниками. - Используя пипетку, аспирировать сфероиды из скважин и перенести их в прозрачную коническую трубку объемом 1,5 мл. Несколько сфероидов из одних и тех же условий могут быть объединены в одной трубе.
ПРИМЕЧАНИЕ: Всегда позволяйте сфероидам оседать на дно трубки, чтобы аспирировать среду. - Дважды промыть сфероиды в 1 мл PBS, добавить нейтральный 4% предварительно нагретый раствор параформальдегида (PFA) и инкубировать сфероиды при 37 °C в течение 20 мин.
- Удалите раствор PFA и дважды промыть сфероиды 1 мл PBS.
4. Сфероидное окрашивание
- Используя пипетку, переложите до 15 сфероидов в 200 мкл ПЦР-трубку.
ПРИМЕЧАНИЕ: Для хрупких сфероидов установите сфероиды в гель (шаги 5.1-5.4), прежде чем продолжить. - Пермеабилизируйте клетки, используя 200 мкл 0,5% тритона X-100 в PBS. Поместите трубки ПЦР внутрь 50 мл завинчивающихся пробирок и инкубируйте сфероиды в течение 2 ч при комнатной температуре с легким перемешиванием.
ПРИМЕЧАНИЕ: Все инкубации проводятся с перемешиванием на роторе, ролике или шейкере (см. Таблицу материалов), если не указано иное. Это важно для достижения равномерного окрашивания. Фиксированные сфероиды в PBS иногда могут прилипать к бокам наконечника пипетки. Промывка наконечника в 0,5% Triton X-100 сводит к минимуму прилипание сфероидов к наконечникам. - Заменить раствор (стадия 4.2) 200 мкл буфера разбавления антител (ABDIL)15 и инкубировать в течение ночи при комнатной температуре.
- Удалить ABDIL, добавить 75 мкл первичного антитела в ABDIL и инкубировать при 4 °C в течение 2,5 дней.
- Удалить надосадочное вещество и дважды промыть 200 мкл PBS с 0,1% Tween и 0,1% Triton X-100 (PBS-TT) и инкубировать с 200 мкл PBS-TT в течение 4 ч при комнатной температуре.
- Удалить PBS-TT, добавить 100 мкл вторичного антитела в ABDIL и инкубировать при 4 °C в течение 2,5 дней.
ПРИМЕЧАНИЕ: DAPI или другой ядерный краситель может быть добавлен на этом этапе. Большинство красителей требуют меньше времени инкубации, чем антитела. - Вынуть надосадочное вещество и дважды промыть 200 мкл PBS-TT и инкубировать с 200 мкл PBS-TT в течение 4 ч. Сфероиды готовы к монтажу.
5. Монтаж
- Используя пипетку объемом 200 мкл, перенесите неподвижные и окрашенные сфероиды в 500 мкл ПЦР-трубки по одной трубке для каждого состояния (примерно 10-15 сфероидов).
- Заменить раствор 200 мкл 2% (мас./об.) жидким агарозным гелем и центрифугой на быстром отжиме (на фиксированной максимальной скорости, см. Таблицу материалов) при комнатной температуре в течение 30 с.
ПРИМЕЧАНИЕ: Если установка не установлена немедленно, поместите в нагревательный блок при температуре 50 °C, чтобы избежать затвердевания геля. - Аспирировать сфероиды в ~50 мкл жидкого агарозного геля и дозировать в лунке из 24-луночной стеклянной пластины.
- Прежде чем гель затвердеет, отделите сфероиды с помощью кончика пипетки в окружающем геле и убедитесь, что сфероиды покрыты гелем. По желанию поместите пластину на лед, чтобы быстро установить гель.
ПРИМЕЧАНИЕ: Количество сфероидов в лунке зависит от размера сфероидов. Сфероиды размещаются далеко друг от друга так, что только один сфероид попадает в поле зрения во время визуализации. Это важно для автоматизированной обработки изображений. - Добавьте 500 мкл очищающего раствора (стадия 2) на лунку, обеспечивая погружение геля. Инкубируйте в RT в течение не менее 24 ч и визуализируйте сфероиды в очищающем растворе. Сфероиды стабильны в этом растворе до месяца при комнатной температуре и при защите от испарения.
6. Визуализация
- Выберите цель с рабочим расстоянием, достаточно большим, чтобы охватить весь сфероид, включая высоту крепления сфероида в сосуде.
ПРИМЕЧАНИЕ: Объективы с рабочим расстоянием 3 мм или более необходимы для изображения экваториальной плоскости сфероидов. Более высокие цели с более высоким NA могут обеспечить лучшее разрешение, но ограничат максимальную глубину, на которой сфероиды могут быть изображены. - Чтобы идентифицировать экваториальную плоскость, отрегулируйте фокус до тех пор, пока не будет достигнута наибольшая площадь поверхности в плоскости XY и изображение с требуемым процентом мощности лазера, напряжением детектора, коэффициентом усиления и настройками смещения.
ПРИМЕЧАНИЕ: Процент мощности лазера, напряжение детектора, усиление и смещение будут сильно варьироваться в зависимости от флуорофора, интенсивности окрашивания, интенсивности лазера, чувствительности детектора и т. Д. - Для 3D-изображений установите начало и конец сфероидов и выберите соответствующую интенсивность сигнала на различных z-глубинах, используя настройки коррекции интенсивности z перед визуализацией.
ПРИМЕЧАНИЕ: Для наилучшего разрешения изображения используйте частоту дискретизации Найквиста для x, y и z (подробнее см. ссылку16).
Результаты
Чтобы продемонстрировать способность этого метода очистки обеспечивать высококачественные двух- и трехмерные изображения, сфероиды диаметром 300-600 мкм были выращены из Fluorescent Uбикитинации на основе Cell Cycle Indicator (FUCCI) трансдуцированных клеточных линий меланомы FUCCI-WM164 и FUCCI-WM983b 9,17 , которые экспрессируют мономерный Kusabira Orange2 (mKO2) и мономерный белок Azami Green (mAG) при нахождении в Gap1 и раннюю S-фазу/Gap2/фазу митоза клеточного цикла соответственно в соответствии с процедурами, предусмотренными на стадии 3 1,3,14. Затем сфероиды фиксировали 4% раствором формальдегида при 37 °C, пермеабилизировали и окрашивали анти-p27kip1/анти-rabbit Alexa Fluor 647 антипимонидазолом/анти-мышью Alexa Fluor 647, DAPI или DRAQ7 (см. Таблицу материалов) (рисунок 2). Все файлы микроскопии загружаются в репозиторий GitHub (https://github.com/ap-browning/SpheroidMounting). По сравнению со сфероидами, установленными на PBS, решение для очистки обеспечивает высокую четкость изображений с минимальными искажениями размера (рисунок 2A). Протокол позволяет получать изображения с высоким разрешением деталей клеточного уровня глубже в сфероиды без гистологического сечения, а изображение поперечного сечения было получено из 20-кратного воздушного объектива (0,7 NA) с разрешением 4096 x 4096 пикселей без сшивания (рисунок 2B). Используя более низкое увеличение и более низкую числовую диафрагму объектива с большим рабочим расстоянием, можно получить 3D-конфокальные изображения, которые обеспечивают детализацию на клеточном уровне на глубине не менее 200 мкм (рисунок 2C). Сфероиды также подвергались криосекции и окрашиванию в соответствии с протоколом Spoerri et al.4 и сравнивались с целым сфероидным окрашиванием (рисунок 2D, E). На рисунке 2D показана гипоксическая область сфероида, окрашенная пимонидазолом, а на рисунке 2E показано окрашивание p27kip1, которое отмечает остановку клеточного цикла (желтый) и ядерное пятно DAPI (серый). Локализация белка и картина окрашивания похожи между криосекцией и очисткой и, следовательно, не подвержены влиянию этого метода очистки.
Коррекция интенсивности сигнала в z позволяет получить визуализацию всего сфероида. Однако рассеяние света из-за некротического ядра ограничивает способность изображения обратной стороны сфероида. Более глубокое проникновение и меньшее рассеяние дальнего красного флуорофора, такого как ядерное пятно DRAQ7, позволяет еще больше улучшить представление структуры 3D-сфероидов (рисунок 3). В фильме 1 показан 3D-рендеринг сфероидов FUCCI, окрашенных DRAQ7. Более тонкий z-срез может обеспечить лучшее z-разрешение, но это значительно увеличивает время визуализации и фотоотбеливания флуорофоров.
Чтобы определить, вызывает ли очищающий раствор искажение размера, двенадцать сфероидов в 2% агарозно-PBS-геле были изображены через 6 ч, 12 ч, 24 ч, 72 ч и 168 ч после введения очищающего раствора. Изображения были обобщены путем определения диаметра сфероида, определенного на основе сферы с той же площадью поперечного сечения, что и сфероид (рисунок 4A). В то время как наблюдается некоторое увеличение размера сфероидов в течение первых 6 ч, о чем свидетельствует изменение диаметра от 2% до 6% (рисунок 4B), через 24 ч до 72 ч сфероиды возвращаются к размеру, примерно равному соответствующему размеру в PBS после фиксации PFA (рисунок 4C).
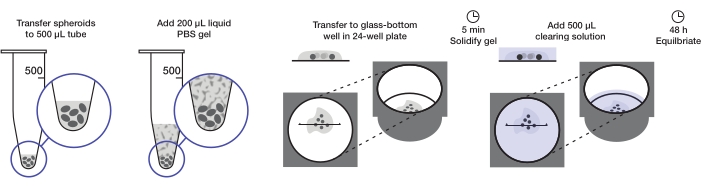
Рисунок 1: Иллюстрация протокола монтажа и очистки сфероидов. Фиксированные и окрашенные сфероиды переносятся в трубку объемом 500 мкл; избыток жидкости замещают 200 мкл агарозно-ПБС-геля и центрифугируют. Затем сфероиды переносятся в скважину со стеклянным дном в 24-луночной пластине. После того, как гелю дают затвердеть, добавляют 500 мкл очищающего раствора, и сфероидам дают уравновеситься. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
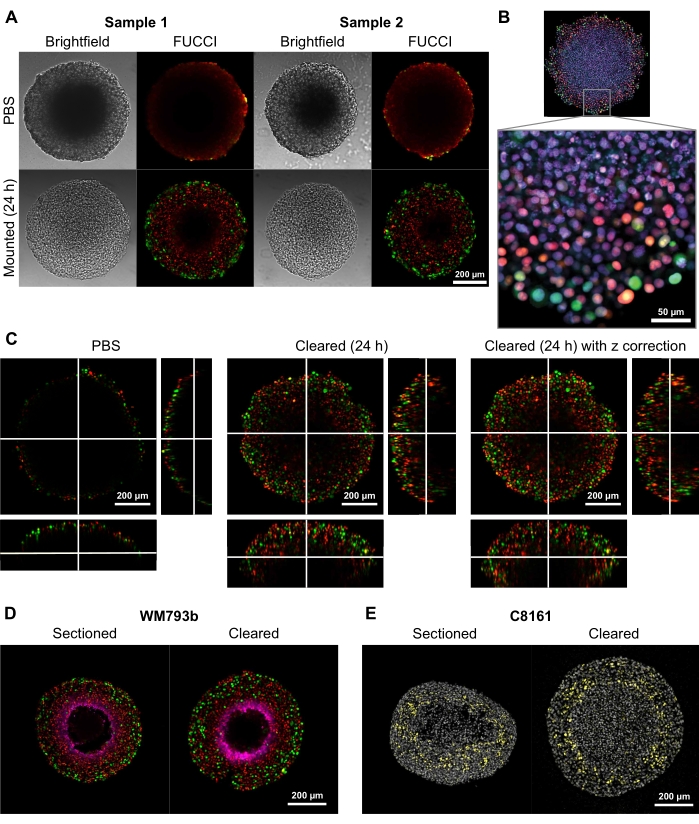
Рисунок 2: Сравнение очищенных и неочищенных сфероидов меланомы человека FUCCI. Окрашивание указывает на клеточные ядра, положительные для mKO2 (красный), что указывает на клетки в промежутке 1; и клеточные ядра, положительные для mAG (зеленый), что указывает на клетки в промежутке 2. (A) Сфероиды, выращенные из 5000 клеток FUCCI-WM983b, собранные на 10-й день и изображенные в агарозе-PBS геле и через 24 ч после добавления очищающего раствора. Сравнение ярких и конфокальных изображений до и после очистки решения показывает минимальное искажение размера и большой прирост четкости. Изображения получены с использованием 10-кратного объектива. (B) Сфероиды, выращенные из клеток FUCCI-WM164, проницаемые с использованием Triton X-100 и окрашенные DRAQ7, окрашивая все ядра клеток. Изображение получено с использованием 20-кратного объектива (0,75 NA), демонстрирующего, что очищающее решение позволяет визуализировать детали на клеточном уровне с высоким разрешением. (C) 3D-изображения (10x, 0,4 NA) были получены сфероидов FUCCI-WM164 в PBS, и через 24 ч после добавления очищающего раствора. Регулировка мощности, напряжения и смещения лазера в разных z-плоскостях позволяет получать изображения глубже внутри сфероида. (Д,Д) Сравнение криосекции и очищенного цельного сфероида, окрашенного для пимонидазола и p27kip1. (D) Окрашивание пимонидазола пурпурным цветом показывает гипоксическую область в сфероидах. Красный и зеленый обозначают FUCCI. (E) Криосекции и очищенный сфероид с изображением DAPI (серый) и p27kip1 (желтый). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
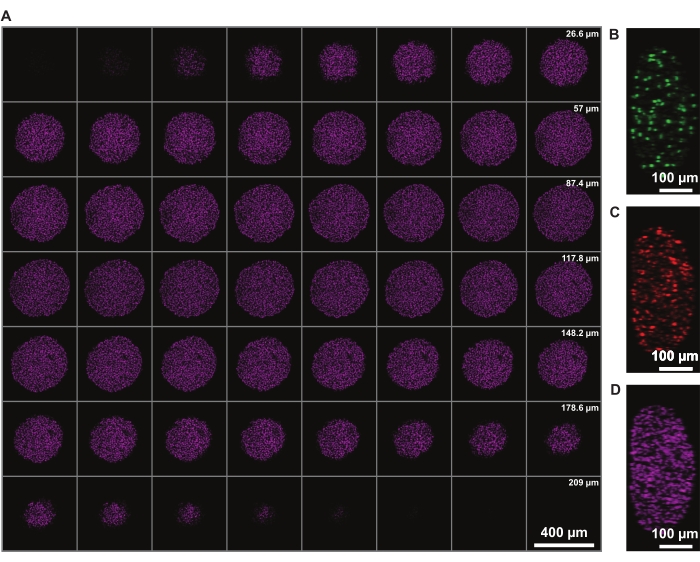
Рисунок 3: Очистка позволяет получать изображения глубже в сфероид с минимальными потерями света. Конфокальные микроскопические изображения сфероида меланомы человека FUCCI с 10-кратным увеличением и более низким NA (0,4), позволяющие получать изображения на более высокой z-глубине с минимальными потерями сигнала. (A) 3,88 мкм срезы сфероидных ядер, окрашенные DRAQ7. (B-D) y / z-разрешение в каналах 488 (mAG), 568 (mKO2) и 647 нм (DRAQ7) соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
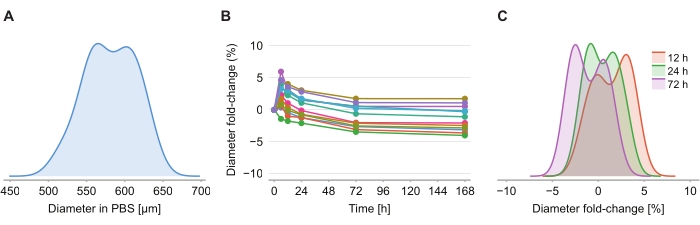
Рисунок 4: Очистное решение оказывает минимальное влияние на размер сфероида. (A) Распределение исходного размера сфероида (эквивалентного диаметра) в геле PBS (n = 12 сфероидов). (B) Изменение диаметра с течением времени с момента добавления очищающего раствора. Через 0 ч сфероиды находятся только в геле PBS. (C) Распределение сдвигов диаметра изменяется через 12 ч, 24 ч и 72 ч. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Фильм 1: 3D-рендеринг сфероида FUCCI, окрашенного DRAQ7. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Обсуждение
Здесь представлен протокол получения качественных двух- и трехмерных изображений сфероидов опухолей. Существующие методы, такие как CLARITY, See deep brain (SeeDB) и ScaleS, часто вызывают искажение размера до 30%, в то время как такие методы, как бензиловый спирт / бензилбензоат (BABB) и 3D-визуализация органов, очищенных растворителем (3DISCO), могут гаснуть флуоресцентный белок18. Многие из этих методов предназначены для очистки тканей со структурной целостностью и искажения размера и структуры при нанесении на сфероиды18. В отличие от других протоколов, которые используют коммерчески доступные дорогостоящие клиринговые решения, этот протокол использует легкодоступные расходные материалы, сохраняя при этом оптическую чистоту и эндогенную флуоресценцию и сводя к минимуму искажения размера. Встраивание сфероидов в гель агароза-PBS обеспечивает структурную поддержку сфероидов и минимизирует осмотический шок при добавлении очищающего раствора. Это имеет решающее значение при визуализации хрупких сфероидов после медикаментозного лечения. Предполагается, что этот метод оптической очистки подходит для сфероидов, образованных любым методом, поскольку этот протокол адаптирован из очистки всей ткани. Предположение основано на сходстве сфероидов, полученном различными методами сфероидного образования. Выбор фиксатора может влиять на размер сфероида, а также на эндогенную флуоресценцию. Этот метод очистки подходит для сфероидов, закрепленных нейтральным 4% раствором PFA. Требуется дальнейшее тестирование, чтобы проверить его совместимость с другими фиксаторами.
Учитывая, что этот метод позволяет одновременно устанавливать несколько сфероидов в многолуночной пластине, он хорошо подходит для трубопроводов количественного анализа, которые требуют информации о структуре сфероидов от 360 сфероидов на 24-луночную пластину. Микроскопы с автоматизированными функциями сценического и пластинчатого картирования могут сделать визуализацию менее ручной. Несмотря на то, что этот метод быстрее и проще, чем секционирование, в настоящее время он не подходит для полной автоматизации. Однако изображения, полученные этим способом, пригодны для автоматизированной обработки изображений 4,19, а скорость, с которой сфероиды могут монтироваться с помощью этого протокола, позволяет проводить количественный анализ внутренней структуры сфероидов 20,21,22.
Для окрашивания целых сфероидов концентрация антител, объем и время инкубации должны быть оптимизированы для каждого антитела. В качестве ориентира используйте 2,5-кратную рекомендуемую концентрацию иммунофлуоресцентных антител 2D и 100-200 мкл антитела в зависимости от количества сфероидов на пробирку. Убедитесь, что все сфероиды покрыты окрашивающим раствором на роторе. Время инкубации зависит от многих факторов, включая размер и плотность сфероидов и антител, и может составлять от 16 до 72 ч. Несмотря на метод, позволяющий обнаруживать сигнал глубже внутри сфероида, флуорофоры, возбуждаемые ультрафиолетовым излучением, вызывают значительное рассеяние света, что приводит к низкому соотношению сигнал/шум. Необходимо соблюдать осторожность при выборе флуорофоров для визуализации целевого белка. Например, окрашивание менее обильных и структурных белков более длинными флуорофорами и более обильными белковыми или ядерными пятнами с более короткими длинами волны флуорофоров позволит достичь наилучшего результата. Наконец, очищенные сфероиды по-прежнему показывают потерю света из-за рассеяния в некротическом ядре, что проявляется в y/z-измерении изображений, полученных из 600 мкм сфероидов (рисунок 2C).
Более высокое увеличение изображения с более высокими объективами NA возможно с сфероидами, установленными и очищенными с использованием этого протокола, но рабочее расстояние объектива ограничивает глубину изображения. Для масляной иммерсионной линзы важно использовать масло, которое имеет RI 1,51 для достижения наилучшего результата.
Подводя итог, можно сказать, что метод встроенной очистки агарозно-PBS gel позволяет визуализировать клетки глубоко внутри сфероидов с использованием общедоступных расходных материалов. Сфероиды, смонтированные и очищенные с помощью этого метода, подвергаются минимальным искажениям размера и сохраняют свою структурную целостность, что позволяет собирать высококачественные данные, касающиеся внутренней структуры сфероида, и последующую автоматическую количественную оценку.
Раскрытие информации
Olympus внес свой вклад в расходы на публикацию.
Благодарности
Это исследование было проведено в Институте трансляционных исследований (TRI), Вуллунгабба, Квинсленд. TRI поддерживается грантом от правительства Австралии. Мы благодарим сотрудников центра микроскопии в TRI за их выдающуюся техническую поддержку. Мы благодарим профессора Ацуси Мияваки, RIKEN, город Вако, Япония, за предоставление конструкций FUCCI, профессора Минхарда Херлина и г-жу Патрисию Браффорд, Институт Вистар, Филадельфия, штат Пенсильвания, за предоставление клеточных линий. Мы благодарим д-ра Лоредану Споэрри за предоставление изображений криосекции C8161.
Эта работа была поддержана проектными грантами N.K.H.: Австралийскому исследовательскому совету (DP200100177) и гранту проекта Meehan (021174 2017002565).
Материалы
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
Ссылки
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены