Tümör Sferoidlerinin Yarı Yüksek Verimli Analizi için Hızlı Optik Temizleme
Bu Makalede
Özet
Tümör sferoidleri, tümör hücresi-mikroçevre etkileşimlerini ve tedavi yanıtını değerlendirmek için giderek daha fazla kullanılmaktadır. Mevcut protokol, hızlı optik temizleme kullanarak 3D tümör sferoidlerinin yarı yüksek verimli görüntülenmesi için sağlam ama basit bir yöntemi tanımlamaktadır.
Özet
Tümör sferoidleri, temel kanser araştırmalarında ve ilaç geliştirmede hızla yaygınlaşmaktadır. Hücresel düzeyde sferoid içindeki protein ekspresyonu ile ilgili verilerin elde edilmesi analiz için önemlidir, ancak mevcut teknikler genellikle pahalıdır, zahmetlidir, standart dışı ekipman kullanır, önemli boyut bozulmasına neden olur veya nispeten küçük sferoidlerle sınırlıdır. Bu protokol, sferoidlerin iç yapısının konfokal analizine izin verirken, bu sorunları ele alan sferoidleri monte etmek ve temizlemek için yeni bir yöntem sunmaktadır. Mevcut yaklaşımların aksine, bu protokol standart ekipman ve laboratuvar malzemeleri kullanılarak çok sayıda sferoidin hızlı bir şekilde monte edilmesini ve temizlenmesini sağlar. Sferoidlerin pH-nötr agaroz-PBS jel çözeltisine monte edilmesi, kırılma indisi ile eşleşen bir temizleme çözeltisi kullanılmadan önce, diğer benzer tekniklerde yaygın olarak görülen boyut bozulmasını en aza indirir. Bu, boyut ölçümlerinin doğruluğunun çok önemli olduğu ayrıntılı nicel ve istatistiksel analizlere olanak tanır. Ayrıca, sıvı temizleme çözeltileriyle karşılaştırıldığında, agaroz jel tekniği sferoidleri yerinde sabit tutar ve üç boyutlu (3D) konfokal görüntülerin toplanmasına izin verir. Bu makale, yöntemin hücreler arası değişkenlik ve iç küresel yapı hakkında bilgi sağlayan yüksek kaliteli iki ve 3D görüntüleri nasıl verdiğini detaylandırmaktadır.
Giriş
Sferoidler gibi üç boyutlu (3B) hücre kültürleri, agrega hücre büyümesinin biyolojik olarak gerçekçi ve tekrarlanabilir modellerini sağlar 1,2. Bu modeller, ilaç etkinliğini belirlemek için tedaviler arasında küresel boyut ve yapıdaki farklılıkların incelendiği hem temel araştırmalarda hem de ilaç geliştirmede hızla yaygınlaşmaktadır 3,4. Bu bağlamlarda, çok sayıda sferoidden ayrıntılı bilgi toplama yeteneği, hem istatistiksel güç perspektifinden hem de çeşitli tedavilerde hücre davranışının hızlı bir şekilde değerlendirilmesine izin vermek için oldukça avantajlıdır.
Küresel yapının ayrıntılı mikroskopi görüntülerini elde etmek için yaygın olarak kullanılan teknikler ya zaman alıcı, pahalıdır ya da küresel boyut 4,5 gibi temel nicel özellikleri korumayan düşük kaliteli görüntüler üretir. Örneğin, kriyoseksiyona dayalı histolojik teknikler yüksek kaliteli görüntüler sağlayabilir, ancak genellikle zaman alıcıdır, vasıflı işgücü gerektirir ve sıklıkla kesitleme eserleri6,7 oluştururken, tek düzlemli aydınlatma mikroskobu (SPIM) 8 ve çoklu foton mikroskobu9 gibi zarif teknolojiler, hazır bulunmayan özel mikroskoplar gerektirir. Modern mikroskopi teknolojileri son zamanlarda, sferoidlerin kırılma indisi uyumlu bir temizleme çözeltisi içine yerleştirildiği ve konfokal mikroskopi 4,5 kullanılarak görüntülerin elde edildiği optik kesitlemeyi mümkün kılmıştır. Bu teknikler yüksek verim üretme potansiyeline sahip olsa da, yaygın sorunlar arasında görüntüleme sırasında küresel hareket, temizleme sırasında boyut bozulması ve tescilli takas çözümlerinin yüksek maliyeti sayılabilir. Ayrıca, mevcut birçok protokol sadece çapı 300 μm'den az olan nispeten küçük sferoidler veya 100 μm'ye kadar derinlik için geçerlidir ve teknolojiyi tümör büyümesinin erken aşamalarıyla sınırlar 5,10,11.
Mevcut protokol, tüm organ temizleme prosedürlerinden türetilen düşük maliyetli kırma indisi ile eşleşen bir temizleme çözeltisi kullanılarak ayrıntılı sferoid görüntülerin yarı yüksek verimli, yüksek verimli toplanmasına izin verir12,13. Görüntüleme sırasında sferoid hareketi önlemek ve boyut bozulmasını azaltmak için yapısal destek sağlamak için, sferoidler agaroz-PBS jeline 24 kuyucuklu #1.5 cam alt plakada monte edilir. Bu teknik, 24 kuyucuklu bir plakada her bir kuyucuğa birden fazla sferoidin monte edilmesine izin verdiğinden, çeşitli deneysel koşullarda 360 adede kadar sferoid (15 sferoid / kuyu) hızla monte edilebilir ve görüntülenebilir. Hazır bulunan sarf malzemelerinden üretilen kırılma indisi uyumlu bir temizleme çözümü, monte edilmiş sferoidleri ve çevresindeki jeli optik olarak temizlemek için kullanılır. 24 saatlik bir çökeltme periyodundan sonra, bu protokol,% 2'den daha az boyut bozulması ile nispeten büyük sferoidler (yaklaşık 700 μm çapında) için bile küresel yapının yüksek kaliteli 2D ve 3D görüntülerini sağlar.
Protokol
Protokol, kuyu başına 200 μL agaroz jeli ve kuyu başına 500 μL temizleme çözeltisinde bir 24 kuyucuklu plaka (yaklaşık 240-360 sferoid veya 10-15 sferoid / kuyu) monte etmek için yeterli miktarda tümör sferoidinin hazırlanmasını açıklar. Prosedürün tamamı Şekil 1'de gösterilmiştir.
1. % 2 agaroz-PBS jel preparatı
- Bir cam şişede 0,5 g düşük erime noktalı agaroz ( Malzeme Tablosuna bakınız) tartın ve 25 mL fosfat tamponlu salin (PBS) ekleyin.
- Agarozu, çözeltiyi bir mikrodalgada 30-60 s kaynatarak, kapak kapalı, ancak kapatılmamış ve sürekli dönerek eritin. Agarozun tamamen çözündüğünden ve çözeltinin kaynamadığından emin olun.
NOT: Jel oda sıcaklığında saklanabilir; buharlaşmayı hesaba katmak için kullanmadan önce hacmi kontrol edin. Kullanmadan önce sıvı duruma getirin (mikrodalga; döner 20-60 sn).
2. Takas çözeltisinin hazırlanması
- 9 g N,N,N′,N′-Tetrakis (2-Hidroksipropil) etilendiamin, 22 g üre, 44 g sakaroz, 0,1 g Triton X-100 ve 24,9 g deiyonize su ağırlığındadır (bkz.
NOT: Yaklaşık N,N,N′,N′-Tetrakis (2-Hidroksipropil) etilendiamin miktarını tartmak ve istenen konsantrasyonu elde etmek için diğer bileşenlerin ağırlığını ayarlamak daha kolaydır. - Çözeltiyi sürekli karıştırarak 56 ° C'lik bir su banyosunda ısıtın ve tüm kristaller çözünene kadar devam edin.
- Karıştırma sırasında oluşan kabarcıkların yüzeye çıkmasına izin vermek için çözeltiyi oda sıcaklığında dinlendirin. Çözelti, oda sıcaklığında 2 aya kadar stabildir.
3. Küresel preparat
- Daha önce açıklandığı gibi agaroz bindirme yöntemini kullanarak sferoidler üretin 1,3,14.
NOT: Diğer yöntemlerle üretilen Sferoidler de bu görüntüleme protokolü ile uyumludur. - Deliği büyütmek için 1 mL'lik pipet ucunun ucunu neşter kullanarak kesin.
NOT: Tüm sferoidler, kesme uçlu 1 mL veya 200 μL pipetlerle işlenmiştir. - Pipetleri kullanarak, sferoidleri kuyucuklardan aspire edin ve bunları net bir 1,5 mL konik tüpe aktarın. Aynı koşullardan birden fazla sferoid aynı tüpte birleştirilebilir.
NOT: Ortamı aspire etmek için her zaman sferoidlerin tüpün dibine yerleşmesine izin verin. - Sferoidleri 1 mL PBS'de iki kez yıkayın, nötr% 4 önceden ısıtılmış paraformaldehit (PFA) çözeltisi ekleyin ve sferoidleri 20 dakika boyunca 37 ° C'de inkübe edin.
- PFA çözeltisini çıkarın ve sferoidleri 1 mL PBS ile iki kez yıkayın.
4. Küresel boyama
- Bir pipet kullanarak, 200 μL PCR tüpüne 15 adede kadar sferoid aktarın.
NOT: Kırılgan sferoidler için, devam etmeden önce sferoidleri jel içine monte edin (adım 5.1-5.4). - PBS'de 200 μL% 0.5 Triton X-100 kullanarak hücreleri geçirgenleştirin. PCR tüplerini 50 mL vidalı kapaklı tüplerin içine yerleştirin ve sferoidleri oda sıcaklığında hafif ajitasyonla 2 saat inkübe edin.
NOT: Tüm inkübasyonlar, aksi belirtilmedikçe, rotor, silindir veya çalkalayıcı üzerinde ajitasyon ile yapılır (bkz. Bu, düzgün boyama elde etmek için önemlidir. PBS'deki sabit sferoidler bazen pipet ucunun yanlarına yapışabilir. Ucun% 0,5 Triton X-100'de durulanması, sferoidlerin uçlara yapışmasını en aza indirir. - Çözeltiyi (adım 4.2) 200 μL Antikor seyreltme tamponu (ABDIL)15 ile değiştirin ve gece boyunca oda sıcaklığında inkübe edin.
- ABDIL'i çıkarın, ABDIL'e 75 μL birincil antikor ekleyin ve 2.5 gün boyunca 4 ° C'de inkübe edin.
- Süpernatantı çıkarın ve iki kez% 0.1 Ara% 0.1 ve % 0.1 Triton X-100 (PBS-TT) ile 200 μL PBS ile yıkayın ve oda sıcaklığında 4 saat boyunca 200 μL PBS-TT ile inkübe edin.
- PBS-TT'yi çıkarın, ABDIL'de 100 μL ikincil antikor ekleyin ve 2.5 gün boyunca 4 ° C'de inkübe edin.
NOT: Bu aşamada DAPI veya başka bir nükleer boya eklenebilir. Çoğu boya, antikorlardan daha az kuluçka süresi gerektirir. - Süpernatantı çıkarın ve iki kez 200 μL PBS-TT ile yıkayın ve 4 saat boyunca 200 μL PBS-TT ile inkübe edin. Sferoidler montaja hazırdır.
5. Montaj
- 200 μL'lik bir pipet kullanarak, sabit ve lekeli sferoidleri durum başına bir tüpte (yaklaşık 10-15 sferoid) 500 μL PCR tüplerine aktarın.
- Çözeltiyi 200 μL %2 (w/v) sıvı agaroz jeli ile değiştirin ve 30 sn boyunca oda sıcaklığında hızlı sıkma (sabit maksimum hızda, Malzeme Tablosuna bakınız) üzerinde santrifüj yapın.
NOT: Hemen monte edilmediği sürece, jel sertleşmesini önlemek için 50 °C'de bir ısıtma bloğuna yerleştirin. - Sferoidleri ~ 50 μL sıvı agaroz jeli içinde aspire edin ve 24 delikli cam tabanlı bir plakanın kuyusuna dağıtın.
- Jel sertleşmeden önce, sferoidleri çevreleyen jelde bir pipet ucu kullanarak ayırın ve sferoidlerin jelle kaplandığından emin olun. İsteğe bağlı olarak, jeli hızlı bir şekilde ayarlamak için plakayı buzun üzerine yerleştirin.
NOT: Kuyu başına sferoid sayısı, sferoidlerin boyutuna bağlıdır. Sferoidler birbirlerinden uzağa yerleştirilir, böylece görüntüleme sırasında görüş alanına sadece bir sferoid girer. Bu, otomatik görüntü işleme için önemlidir. - Kuyucuk başına 500 μL temizleme çözeltisi (adım 2) ekleyerek jelin suya batırılmasını sağlayın. RT'de en az 24 saat boyunca inkübe edin ve temizleme çözeltisindeki sferoidleri görüntüleyin. Sferoidler bu çözeltide oda sıcaklığında ve buharlaşmadan korunduğunda bir aya kadar stabildir.
6. Görüntüleme
- Gemideki sferoidin montaj yüksekliği de dahil olmak üzere tüm sferoidi kapsayacak kadar uzun bir çalışma mesafesine sahip bir hedef seçin.
NOT: Sferoidlerin ekvator düzlemini görüntülemek için 3 mm veya daha uzun çalışma mesafesine sahip hedefler gereklidir. Daha yüksek NA ile daha yüksek büyütme hedefleri daha iyi çözünürlüğe izin verebilir, ancak sferoidlerin görüntülenebileceği maksimum derinliği sınırlayacaktır. - Ekvator düzlemini tanımlamak için, XY düzleminde ve görüntüde gerekli lazer güç yüzdesi, dedektör voltajı, kazanç ve ofset ayarlarıyla en büyük yüzey alanına ulaşılana kadar odağı ayarlayın.
NOT: Lazer güç yüzdesi, dedektör voltajı, kazanç ve ofset, florofora, boyama yoğunluğuna, lazer yoğunluğuna, dedektör hassasiyetine vb. bağlı olarak büyük ölçüde değişecektir. - 3D görüntüler için, sferoidlerin başlangıcını ve bitişini ayarlayın ve görüntülemeden önce z yoğunluğu düzeltme ayarlarını kullanarak çeşitli z derinliğinde uygun sinyal yoğunluğunu seçin.
NOT: En iyi görüntü çözünürlüğü için x, y ve z için Nyquist örnekleme hızını kullanın (ayrıntılar için bkz. referans16).
Sonuçlar
Bu temizleme yönteminin yüksek kaliteli iki ve üç boyutlu görüntüler sağlama yeteneğini göstermek için, Fluorescent Ubiquitination bazlı C ell C ycle Indicator (FUCCI) transdüe melanom hücre hatları FUCCI-WM164 ve FUCCI-WM983b 9,17'den 300-600 μm çapında sferoidler yetiştirilmiştir. , Gap1'deyken monomerik Kusabira Orange2 (mKO2) ve monomerik Azami Yeşil (mAG) proteinini ve hücre döngüsünün erken S-fazı / Gap2 / mitoz fazını, adım 3 1,3,14'te verilen prosedürlere göre sırasıyla eksprese eder. Seroidler daha sonra 37 ° C'de% 4 formaldehit çözeltisi ile sabitlendi, geçirgenleştirildi ve anti-p27kip1 / anti-tavşan Alexa Fluor 647 anti-pimonidazol / anti-fare Alexa Fluor 647, DAPI veya DRAQ7 ile boyandı (bkz. Tüm mikroskopi dosyaları GitHub deposuna (https://github.com/ap-browning/SpheroidMounting) yüklenir. PBS'ye monte edilmiş sferoidlerle karşılaştırıldığında, temizleme çözümü minimum boyut bozulmasıyla yüksek netlikte görüntüler sağlar (Şekil 2A). Protokol, hücre seviyesindeki detayların histolojik kesitleme olmadan sferoidlerin derinliklerine kadar yüksek çözünürlüklü görüntülenmesine izin verir ve kesitsel görüntü, dikiş olmadan 4096 x 4096 piksel çözünürlükte 20x hava hedefinden (0.7 NA) elde edilmiştir (Şekil 2B). Daha uzun bir çalışma mesafesi ile daha düşük bir büyütme ve daha düşük sayısal diyafram hedefi kullanılarak, en az 200 μm derinlikte hücresel düzeyde ayrıntı sağlayan 3D konfokal görüntüler elde edilebilir (Şekil 2C). Sferoidler ayrıca Spoerri ve ark.4 tarafından protokole göre kriyoseksiyonlu ve boyanmış ve tüm sferoid boyama ile karşılaştırılmıştır (Şekil 2D, E). Şekil 2D, pimonidazol tarafından boyanmış sferoidin hipoksik bölgesini gösterir ve Şekil 2E, hücre döngüsü durmasını (sarı) ve DAPI nükleer boyamasını (gri) işaretleyen p27kip1 boyamasını gösterir. Protein lokalizasyonu ve boyama paterni kriyoseksiyon ve temizleme arasında benzerdir ve bu nedenle bu temizleme yönteminden etkilenmez.
Z'deki sinyal yoğunluğu düzeltmesi, tüm sferoidin görüntülenmesini sağlar. Bununla birlikte, nekrotik çekirdek nedeniyle ışık saçılması, sferoidin uzak tarafını görüntüleme yeteneğini sınırlar. DRAQ7 nükleer lekesi gibi çok kırmızı bir floroforun daha derin penetrasyonu ve daha az saçılması, daha da gelişmiş 3D küresel yapı gösterimine izin verir (Şekil 3). Film 1 , DRAQ7 ile boyanmış FUCCI sferoidlerinin 3D görüntüsünü göstermektedir. Daha ince bir z-dilimi daha iyi z-çözünürlüğüne izin verebilir, ancak bu, görüntüleme süresini ve floroforların fotobeyazlatmasını önemli ölçüde artırır.
Temizleme çözeltisinin boyut bozulmasına neden olup olmadığını belirlemek için,% 2 agaroz-PBS jelindeki on iki sferoid, temizleme çözeltisinin piyasaya sürülmesini takiben 6 saat, 12 saat, 24 saat, 72 saat ve 168 saatte görüntülendi. Görüntüler, sferoid ile aynı kesit alanına sahip bir küreye dayanarak tanımlanan sferoidin çapı belirlenerek özetlenmiştir (Şekil 4A). Sferoidlerin ilk 6 saat boyunca% 2 ile% 6 arasında bir çap kıvrım değişimi ile gösterilen boyut olarak hafifçe arttığı gözlenirken (Şekil 4B), 24 saat ila 72 saat sonra, sferoidler PFA sonrası PBS fiksasyonunda karşılık gelen boyuta yaklaşık olarak eşit bir boyuta geri döner (Şekil 4C).
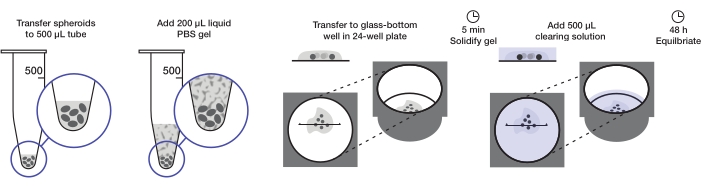
Şekil 1: Küresel montaj ve temizleme protokolünün çizimi. Sabit ve lekeli sferoidler 500 μL'lik bir tüpe aktarılır; fazla sıvı 200 μL agaroz-PBS jel ile değiştirilir ve santrifüj edilir. Sferoidler daha sonra 24 kuyucuklu bir plakada cam tabanlı bir kuyuya aktarılır. Jelin katılaşmasına izin verildikten sonra, 500 μL temizleme çözeltisi eklenir ve sferoidlerin dengelenmesine izin verilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
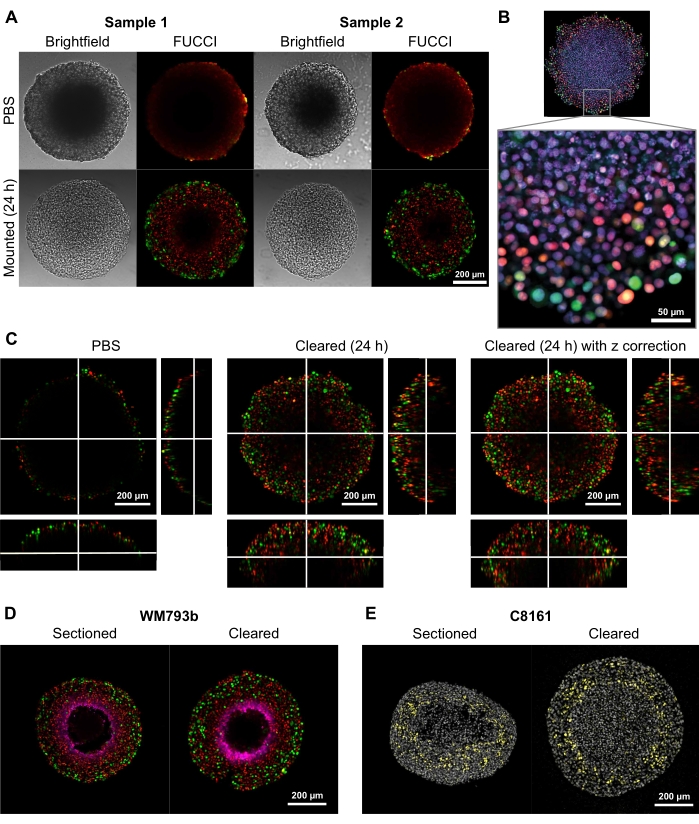
Şekil 2: Temizlenmiş ve temizlenmemiş FUCCI insan melanom sferoidlerinin karşılaştırılması. Renklendirme, boşluk 1'deki hücreleri gösteren mKO2 (kırmızı) için pozitif hücre çekirdeklerini gösterir; ve mAG (yeşil) için pozitif hücre çekirdekleri, boşluktaki hücreleri gösterir 2. (A) 5000 FUCCI-WM983b hücresinden yetiştirilen Sferoidler, 10. günde hasat edilir ve agaroz-PBS jelinde görüntülenir ve temizleme çözeltisinden 24 saat sonra eklenir. Temizleme çözümünden önce ve sonra parlak alan ve konfokal görüntülerin karşılaştırılması, minimum boyut bozulması ve büyük bir netlik kazancı gösterir. Görüntüler 10x objektif kullanılarak elde edilir. (B) FUCCI-WM164 hücrelerinden yetiştirilen Spheroidler, Triton X-100 kullanılarak geçirgenleştirilir ve DRAQ7 ile boyanarak tüm hücre çekirdeklerini boyar. Görüntü, 20x hedefi (0.75 NA) kullanılarak elde edilir, temizleme çözümünün hücre düzeyinde ayrıntıların yüksek çözünürlüklü görüntülenmesine izin verdiğini gösterir. (C) PBS'deki FUCCI-WM164 sferoidlerinden 3D görüntüler (10x, 0.4 NA) ve temizleme çözeltisi eklendikten 24 saat sonra elde edilmiştir. Lazer gücünü, voltajını ve ofsetini farklı z-düzleminde ayarlamak, sferoidin içinde daha derin görüntüleme sağlar. (D,E) Kriyoseksiyon ile pimonidazol ve p27 kip1 için boyanmış temizlenmiş bütünsferoid arasındaki karşılaştırma. (D) Eflatundaki Pimonidazol boyaması, sferoidlerdeki hipoksik bölgeyi gösterir. Kırmızı ve yeşil FUCCI'yi gösterir. (E) DAPI (gri) ve p27 kip1 (sarı) gösteren kriyoseksiyonlar ve temizlenmişsferoid . Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
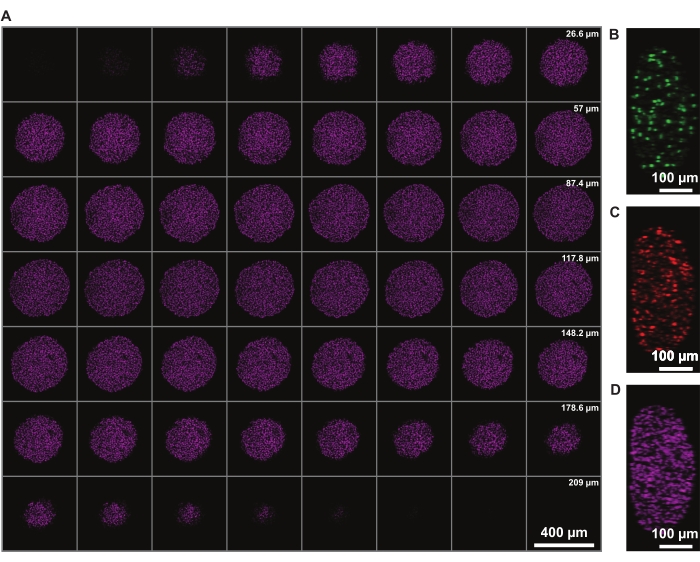
Şekil 3: Temizleme, minimum ışık kaybıyla sferoidin derinliklerinde görüntüleme yapılmasını sağlar. Bir FUCCI insan melanom sferoidinin 10x büyütme ve daha düşük NA (0.4) 'da konfokal mikroskopi görüntüleri, minimum sinyal kaybı ile daha yüksek z derinliğinde görüntülemeye izin verir. (A) DRAQ7 ile boyanmış 3.88 μm küresel çekirdek dilimleri. (B-D) y/z çözünürlükte sırasıyla 488 (mAG), 568 (mKO2) ve 647 nm (DRAQ7) kanallarda. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
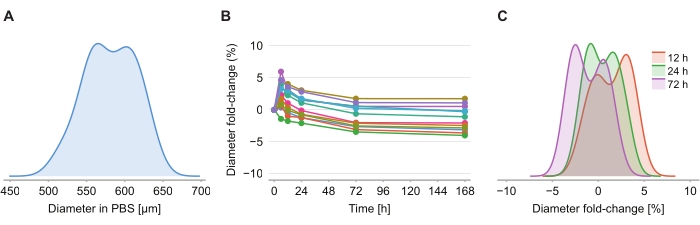
Şekil 4: Takas çözeltisinin küresel boyut üzerinde minimum etkisi vardır. (A) PBS jelinde başlangıç sferoid boyutunun (eşdeğer çap) dağılımı (n = 12 sferoid). (B) Temizleme çözeltisinin eklenmesinden bu yana zaman içinde çap katlanma değişimi. 0 saatte, sferoidler yalnızca PBS jelindedir. (C) Çap kıvrımının dağılımı 12 saat, 24 saat ve 72 saatte değişir.
Film 1: DRAQ7 ile boyanmış bir FUCCI sferoidinin 3D görüntüsü. Bu Filmi indirmek için lütfen tıklayınız.
Tartışmalar
Burada tümör sferoidlerinin yüksek kaliteli iki ve üç boyutlu görüntülerini elde etmek için bir protokol sunulmaktadır. CLARITY, See deep brain (SeeDB) ve ScaleS gibi mevcut yöntemler genellikle %30'a kadar boyut bozulmasına neden olurken, Benzil Alkol/Benzil Benzoat (BABB) ve solventle temizlenmiş organların 3D görüntülenmesi (3DISCO) gibi teknikler floresan protein18'i söndürebilir. Bu yöntemlerin birçoğu dokuyu yapısal bütünlükle temizlemek ve sferoidlere uygulandığında boyutu ve yapıyı bozmak için tasarlanmıştır18. Ticari olarak temin edilebilen pahalı temizleme çözümlerini kullanan diğer protokollerin aksine, bu protokol optik netliği ve endojen floresanı korurken ve boyut bozulmasını en aza indirirken hazır bulunan sarf malzemelerini kullanır. Sferoidlerin agaroz-PBS jeline gömülmesi, sferoidler için yapısal destek sağlar ve temizleme çözeltisi eklendiğinde ozmotik şoku en aza indirir. Bu, ilaç tedavisi sonrası kırılgan sferoidleri görüntülerken çok önemlidir. Bu optik temizleme yönteminin, herhangi bir yöntemle oluşturulan sferoidler için uygun olduğu varsayılmaktadır, çünkü bu protokol tüm doku temizlemeden uyarlanmıştır. Varsayım, farklı sferoid oluşum yöntemleriyle elde edilen sferoidlerdeki benzerliğe dayanmaktadır. Fiksatif seçimi, sferoid boyutu ve endojen floresanı etkileyebilir. Bu temizleme yöntemi, nötr% 4 PFA çözeltisi ile sabitlenmiş sferoidler için uygundur. Diğer fiksatörlerle uyumluluğunu kontrol etmek için daha fazla test yapılması gerekmektedir.
Bu tekniğin birden fazla sferoidin aynı anda çok kuyulu bir plakaya monte edilmesine izin verdiği göz önüne alındığında, 24 kuyucuklu plaka başına 360 sferoide kadar küresel yapı bilgisi gerektiren nicel analiz boru hatları için çok uygundur. Otomatik sahne ve plaka haritalama işlevlerine sahip mikroskoplar, görüntülemeyi daha az manuel hale getirebilir. Bu yöntem bölümlemeden daha hızlı ve kolay olmasına rağmen, şu anda tam otomasyon için uygun değildir. Bununla birlikte, bu yöntemle elde edilen görüntüler otomatik görüntü işleme için uygundur 4,19 ve bu protokol kullanılarak sferoidlerin monte edilebileceği hız, küresel iç yapının kantitatif analizine katkıda bulunur20,21,22.
Bütün sferoidlerin boyanması için, antikor konsantrasyonu, hacmi ve inkübasyon süresinin her antikor için optimize edilmesi gerekir. Bir kılavuz olarak, tüp başına sferoid sayısına bağlı olarak, önerilen 2D immünofloresan antikor konsantrasyonunun 2.5x'ini ve 100-200 μL antikorun kullanın. Rotor üzerindeyken tüm sferoidlerin boyama çözeltisi ile kaplandığından emin olun. Kuluçka süresi, sferoidlerin ve antikorun büyüklüğü ve yoğunluğu da dahil olmak üzere birçok faktöre bağlıdır ve 16-72 saat arasında değişebilir. Sferoid içinde daha derin sinyal algılamaya izin veren yönteme rağmen, UV tarafından uyarılan floroforlar önemli miktarda ışık saçılmasına neden olur ve bu da düşük sinyal-gürültü oranına yol açar. Hedef proteini görselleştirmek için floroforları seçerken dikkatli olunmalıdır. Örneğin, daha az miktarda bulunan ve yapısal proteinlerin daha uzun dalga boylu floroforlarla ve daha bol protein veya nükleer lekelerin daha kısa dalga boylu floroforlarla boyanması en iyi sonucu elde edecektir. Son olarak, temizlenmiş sferoidler, 600 μm sferoidlerden elde edilen görüntülerin y / z boyutunda belirgin olan nekrotik çekirdekteki saçılma nedeniyle hala ışık kaybı göstermektedir (Şekil 2C).
Bu protokol kullanılarak monte edilen ve temizlenen sferoidlerle daha yüksek NA hedefleriyle daha yüksek büyütmeli görüntüleme mümkündür, ancak hedefin çalışma mesafesi görüntüleme derinliğini sınırlar. Bir yağ daldırma lensi için, en iyi sonuç için RI'sı 1,51 olan yağ kullanmak önemlidir.
Özetlemek gerekirse, agaroz-PBS jel gömülü temizleme yöntemi, yaygın olarak bulunan sarf malzemeleri kullanılarak sferoidlerin derinliklerindeki hücrelerin görselleştirilmesine olanak tanır. Bu yöntem kullanılarak monte edilen ve temizlenen sferoidler, minimum boyut bozulmasına maruz kalır ve yapısal bütünlüklerini koruyarak, iç küresel yapı ile ilgili yüksek kaliteli verilerin toplanmasına ve ardından otomatik nicelleştirmeye izin verir.
Açıklamalar
Olympus yayın masraflarına katkıda bulundu.
Teşekkürler
Bu araştırma Translasyonel Araştırma Enstitüsü (TRI), Woolloongabba, QLD'de gerçekleştirilmiştir. TRI, Avustralya Hükümeti'nden bir hibe ile desteklenmektedir. TRI'deki mikroskopi çekirdek tesisindeki personele olağanüstü teknik destekleri için teşekkür ederiz. Prof. Atsushi Miyawaki, RIKEN, Wako-city, Japonya, FUCCI yapılarını sağladıkları için, Prof. Meenhard Herlyn ve Bayan Patricia Brafford, Wistar Enstitüsü, Philadelphia, PA, hücre hatlarını sağladıkları için teşekkür ederiz. Dr. Loredana Spoerri'ye C8161 kriyoseksiyon görüntüleri sağladığı için teşekkür ederiz.
Bu çalışma N.K.H.: Australian Research Council (DP200100177) ve Meehan Project Grant (021174 2017002565) proje hibeleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #1.5 glass bottom 24-well plate | Celvis | P24-1.5H-N | |
| 500 µL clear PCR tubes | Sigma | HS4422 | |
| Alexa Fluor 647 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson Immuno research | 715-605-151 | Dilution used 1:500 |
| Bovine serum albumin | Sigma | A7906 | Final concentration 2% w/v |
| DAPI | Sigma | D9542-10MG | Final concentration 5 µg/mL |
| Deionized water | MILLI Q | ||
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Thermofisher | A-31573 | Dilution used 1:500 |
| DRAQ7 | Thermofisher | D15106 | Dilution used 1:250 |
| Heating block | Ratek | DBH10 | or similar equipment |
| Hypoxyprobe Kits | Hypoxyprobe | HP1-1000Kit | Antibody dilution used 1:500 |
| Low-melting agarose powder | Sigma | A9414 | Final concentration 2% w/v |
| Microwave | Sharp | ||
| N,N,N′,N′-Tetrakis(2-Hydroxypropyl)ethylenediamine | Sigma | 122262 | Final concentration 9% w/w |
| NaCl | Sigma | S9888 | Final concentration 150 mM |
| NaN3 | Sigma | S2002 | Final concentration 0.10% w/v |
| p27 Kip1 (D69C12) XP | Cell Signalling technology | 3686S | Dilution used 1:500 |
| Paraformaldehyde solution | Proscitech | C004 | Final concentration 4% w/v |
| Phosphate Buffered Saline (PBS) | Thermofisher | 18912014 | Final concentration 1x |
| Pipette | Eppendorf | ||
| Quickspin minifuge | or similar equipment | ||
| Roller | Ratek | BTR10-12V | or similar equipment |
| Rotor | Ratek | RSM7DC | or similar equipment |
| Shaker | Ratek | EOM5 | or similar equipment |
| Sucrose | Sigma | S9378 | Final concentration 44% w/w |
| Tris-HCl pH 7.4 | Sigma | T5941 | Final concentration 20 mM |
| Triton X-100 | Sigma | X100 | Final concentration 0.10% v/v |
| Triton X-100 | Sigma | X100 | Final concentration 0.1% v/v |
| Tween 20 | Sigma | P1379 | Final concentration 0.1% v/v |
| Urea | Sigma | U5379 | Final concentration 22% w/w |
Referanslar
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486 (2015).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2008).
- Spoerri, L., Gunasingh, G., Haass, N. K. Fluorescence-based quantitative and spatial analysis of tumour spheroids: A proposed tool to predict patient-specific therapy response. Frontiers in Digital Health. 3, 668390 (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7, 20 (2020).
- Kabadi, P. K., et al. Into the depths: Techniques for in vitro three-dimensional microtissue visualization. BioTechniques. 59 (5), 279-286 (2015).
- Ivanov, D. P., Grabowska, A. M. Spheroid arrays for high-throughput single-cell analysis of spatial patterns and biomarker expression in 3D. Scientific Reports. 7, 41160 (2017).
- Spoerri, L., et al. Phenotypic melanoma heterogeneity is regulated through cell-matrix interaction-dependent changes in tumor microarchitecture. bioRxiv. , (2021).
- Haass, N. K., et al. Real-time cell cycle imaging during melanoma growth, invasion, and drug response. Pigment Cell & Melanoma Research. 27 (5), 764-776 (2014).
- Ahmad, A., et al. Clearing spheroids for 3D fluorescent microscopy: combining safe and soft chemicals with deep convolutional neural network. bioRxiv. , 428996 (2021).
- Villani, T., Rossi, A. E., Sherman, H. Image-based characterization of 3-D cell culture models grown in spheroid microplates. American Laboratory. 50 (6), 12 (2018).
- Lloyd-Lewis, B., et al. Imaging the mammary gland and mammary tumours in 3D: optical tissue clearing and immunofluorescence methods. Breast Cancer Research. 18 (1), 127 (2016).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Spoerri, L., Beaumont, K. A., Anfosso, A., Haass, N. K. Real-time cell cycle imaging in a 3D cell culture model of melanoma. Methods in Molecular Biology. 1612, 401-416 (2017).
- Cold Spring Harbor. Antibody Dilution Buffer (Abdil). Cold Spring Harbor Protocols. , (2018).
- Pawley, J. B., Pawley, J. B. . Handbook Of Biological Confocal Microscopy. , 20-42 (2006).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Browning, A. P., Murphy, R. J. . Zenodo. , (2021).
- Browning, A. P., et al. Quantitative analysis of tumour spheroid structure. eLife. 10, 73020 (2021).
- Klowss, J. J., et al. A stochastic mathematical model of 4D tumour spheroids with real-time fluorescent cell cycle labelling. Journal of The Royal Society Interface. 19 (189), 20210903 (2022).
- Murphy, R. J., Browning, A. P., Gunasingh, G., Haass, N. K., Simpson, M. J. Designing and interpreting 4D tumour spheroid experiments. Communications Biology. 5 (1), 91 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır