Method Article
Aprendizaje asociativo aversivo y formación de la memoria mediante el emparejamiento de dos sustancias químicas en Caenorhabditis elegans
En este artículo
Resumen
Hemos desarrollado previamente protocolos para Caenorhabditis elegans para formar memorias asociativas a corto y largo plazo mediante entrenamiento masivo y espaciado, respectivamente. Aquí, se describen protocolos detallados para el acondicionamiento de C. elegans emparejando 1-propanol y ácido clorhídrico como estímulos condicionados y no condicionados, respectivamente, para formar memoria asociativa aversiva.
Resumen
El nematodo Caenorhabditis elegans es un organismo modelo atractivo para estudiar el aprendizaje y la memoria a nivel molecular y celular debido a la simplicidad de su sistema nervioso, cuyos diagramas de cableado químico y eléctrico fueron completamente reconstruidos a partir de micrografías electrónicas seriadas de secciones delgadas. Aquí, describimos protocolos detallados para el acondicionamiento de C. elegans mediante entrenamiento masivo y espaciado para la formación de memoria a corto plazo (STM) y memoria a largo plazo (LTM), respectivamente. Al emparejar 1-propanol y ácido clorhídrico como estímulos condicionados e incondicionados, respectivamente, C. elegans fue entrenado con éxito para formar STM asociativo aversivo y LTM. Mientras que los animales ingenuos se sentían atraídos por el 1-propanol, los animales entrenados ya no se sentían o muy débilmente atraídos por el 1-propanol. Al igual que en otros organismos como Aplysia y Drosophila, los "genes de aprendizaje y memoria" juegan un papel esencial en la formación de la memoria. En particular, los receptores de glutamato de tipo NMDA, expresados en solo seis pares de interneuronas en C. elegans, son necesarios para la formación de STM y LTM, posiblemente como un factor de coincidencia. Por lo tanto, el rastro de memoria puede residir entre las interneuronas.
Introducción
El aprendizaje y la memoria son vitales para que los animales sobrevivan y se reproduzcan navegando eficientemente por entornos cambiantes. C. elegans es un organismo modelo atractivo para estudiar el aprendizaje y la memoria a nivel molecular y celular debido a la simplicidad de su sistema nervioso, cuyos diagramas de cableado químico y eléctrico fueron completamente reconstruidos a partir de micrografías electrónicas seriadas de secciones delgadas 1,2,3.
C. elegans aprende a asociar la temperatura de cultivo con la inanición y migra lejos de su temperatura de crecimiento con una memoria aversiva que dura varias horas 4,5. El acondicionamiento de C. elegans con cloruro de sodio (NaCl) en ausencia de alimentos conduce a una reducción de la quimiotaxis hacia NaCl 6,7,8. Cuando se combina con alimentos, la atracción de butanona se mejora como resultado del aprendizaje apetitivo 9,10,11. Aunque estos fenómenos son interpretados como aprendizaje asociativo y memoria 10,12, la distinción entre aprendizaje asociativo y sensibilización, habituación y adaptación no asociativa no está clara en el paradigma de aprendizaje y memoria de C. elegans 13,14. De hecho, los animales condicionados con butanona y privación de alimentos (condicionamiento aversivo) mostraron un acoplamiento deprimido de la neurona sensorial de butanona AWC ON para atacar las neuronas mediante señales de insulina de otras neuronas, incluidas las interneuronas AIA, mientras que los animales condicionados con butanona y alimentos (acondicionamiento apetitivo) mostraron un acoplamiento mejorado de AWCON para atacar las neuronas15 . La señalización de la insulina causa cambios en la expresión génica inducidos por EGL-4 nuclear y otros reguladores transcripcionales16,17. Así, este aprendizaje y memoria aversivo y apetitivo tiene analogías con la habituación no asociativa y la sensibilización, respectivamente, de las neuronas sensoriales presinápticas en el reflejo branquial-abstinencia en Aplysia18,19.
Al emparejar dos productos químicos como estímulo condicionado (CS) y estímulo no condicionado (US), nosotros y otros hemos desarrollado protocolos para el condicionamiento de C. elegans para formar aprendizaje asociativo y memoria sin usar alimentos o inanición como los US20,21,22,23. En el presente estudio, los protocolos se modifican para acondicionar animales con 1-propanol y ácido clorhídrico (HCl, pH 4.0) como el CS y US, respectivamente, para el aprendizaje aversivo y la memoria a corto plazo (STM) y la memoria a largo plazo (LTM). El ingenuo C. elegans es atraído por el 1-propanol24 y repelido por el ácido25. Cuando se acondicionó con una mezcla de 1-propanol y HCl (pH 4.0), C. elegans ya no se sintió atraído o muy débilmente por el 1-propanol.
Protocolo
1. Recetas
- Placas de agar NGM (paso 2.1.)
- Para preparar placas NGM de 6 cm, disolver 2,5 g de peptona, 3 g de NaCl y 17 g de agar en 850 mL deH2Odoblemente desionizado (ddH2O). Llevar el volumen total a 972 mL con ddH2O.
- Después del autoclave, enfriar a ~65 °C y añadir 1 mL de 5 mg/ml de colesterol disuelto en etanol, 1 mL de 1 M CaCl2 y 1 MMgSO4, y 25 mL de 1 M de fosfato de potasio (pH 6.0). Después de mezclar bien, dispense 8 ml cada una a 6 cm (de diámetro) de placas de Petri.
- Mantenga las placas con tapas en un banco a temperatura ambiente (RT) durante 1 día, y luego manténgalas en artículos de plástico en una habitación fría hasta que las use.
- Preparar Luria-Bertani (LB) medio (paso 2.1.) disolviendo 10 g de triptona, 5 g de extracto de levadura y 10 g de NaCl en 1 L deddH2O. Ajustar el pH a 7,0 con 5 N NaOH (varias gotas) y esterilizar en autoclave.
- Prepare las placas LB agregando 15 g de agar al medio LB. Después del autoclave, enfriar a ~60 °C y dispensar 12 ml cada una a 9 cm (de diámetro) de placas de Petri. Mantenga los platos en artículos de plástico en una habitación frigorífica hasta que los use.
- Para hacer un colector de animales (paso 2.4.), fije una malla de nylon (tamaño de malla de 30 μm) al fondo de un tubo cilíndrico acrílico transparente (3,5 cm de longitud, 3 cm de diámetro externo, 2 mm de espesor de pared) con pegamento.
- Para obtener una solución acuosa de gelatina al 0,25% (paso 2.4.), disolver 0,25 g de gelatina en 100 ml deddH2O. Esterilizar en autoclave.
- Placas de ensayo de quimiotaxis (paso 5.1.)
- Para hacer placas de agar para el ensayo de quimiotaxis, disolver 15 g de agar en 993 ml deddH2Oen autoclave, y enfriar la solución a ~65 °C.
- Luego, agregue 5 ml de fosfato de potasio 1 M esterilizado en autoclave (pH 6.0), 1 ml de CaCl 1 M 2 y 1 ml de1 M MgSO4 a la solución de agar. Todas estas soluciones se esterilizan por separado mediante autoclave.
- Dispensar 10 ml de la solución mezclada a una placa de Petri de 6 cm. Coloque estos platos con tapas en un banco en RT durante dos días, y luego colóquelos en toallas de papel húmedas en artículos de plástico en RT hasta que los use. Estas placas se pueden utilizar hasta por 10 días.
- Para realizar el tampón del ensayo de quimiotaxis (paso 5.4.), mezclar 5 mL de 1 M de fosfato de potasio (pH 6.0), 1 mL de 1 M CaCl2, 1 mL de 1 MMgSO4 y 993 mL de ddH2 O. Esterilizar por separado todas estas soluciones enautoclave.
- Para obtener una solución de mezcla CS/US de 40 ml (1-propanol acuoso al 1% y HCl [pH 4,0]) (paso 3.1. y paso 4.1.), añadir 0,4 ml de 1-propanol absoluto y 4 μL de HCl 5 M (0,1 mM a concentración final) a 39,6 ml deddH2O. Mantener la solución en RT.
- Para hacer ddH2O, trate el agua del grifo 2x con sistemas de purificación de agua (consulte la Tabla de materiales).
- Preparar un cultivo líquido (OD600 = ~0,7) de Escherichia coli OP50 inoculando una colonia fresca con un palillo en 10 mL de medio LB e incubando a 37 °C durante 7-8 h. Las bacterias cultivadas durante un período más largo pueden afectar el resultado del acondicionamiento, tal vez debido a metabolitos secundarios.
2. Preparación de C sincronizada. elegans
- Utilizando métodos estándar26, cultivar animales en placas NGM de 6 cm (paso 1.1.). Las placas NGM se preparan esparciendo 0,2 ml de un cultivo líquido de E. coli OP50 en medio LB (ver paso 1.9 .) e incubando a RT durante no más de 24 h (las bacterias viejas pueden afectar el resultado del acondicionamiento).
NOTA: El aprendizaje y la memoria de C. elegans son extremadamente sensibles a las tensiones mecánicas, químicas y de temperatura. Por lo tanto, es muy recomendable cultivar animales, mantener todos los reactivos, incluida el agua, y realizar todos los ensayos a RT entre 17 °C y 20 °C. Se debe evitar la estimulación física y mecánica, como el vórtice, el pipeteo brusco y la centrifugación. El 1-propanol fresco debe usarse cada 3 meses como máximo por una razón desconocida. Es importante destacar que los animales deben cultivarse con mucha comida, ya que el hambre puede afectar seriamente el resultado del acondicionamiento. - El día 1, recoja y coloque cinco animales grávidos bien alimentados (ponga más animales mutantes que pongan huevos lentamente) en cada una de las cuatro placas NGM de 6 cm con un recolector de lombrices de platino, y déjelos poner ~ 50 huevos durante 3 h en RT para obtener una población sincronizada de animales adultos. Detenga la puesta de huevos retirando los animales parentales de los platos con un recolector de lombrices de platino.
NOTA: Las placas sembradas deben mantenerse en RT para minimizar el estrés de los animales. - Cultive a los animales en RT durante aproximadamente 5 días, que es el tiempo que tardan los animales en alcanzar su etapa adulta madura, no la etapa adulta joven.
NOTA: El período de cultivo entre 4,5 días y 5,5 días debe ajustarse dependiendo de las condiciones, ya que los animales adultos más jóvenes son más sensibles a los productos químicos utilizados para el acondicionamiento que los animales adultos maduros (Figura suplementaria 1). Después del acondicionamiento, los animales adultos más jóvenes pueden mostrar valores más bajos del índice de quimiotaxis (CI). - Recoja ~200 animales adultos en un recolector de animales (ver paso 1.4.) lavando cada plato con 1 ml de gelatina acuosa al 0,25% (paso 1.4.) Esta gelatina acuosa evita la adhesión de los animales a la superficie de plásticos como las puntas de pipeta.
- Lave los animales en el colector con ddH 2 O (paso 1.8.) moviendo muy suavemente el colector hacia arriba y hacia abajo 2x en ~10 ml de ddH 2 O.Repita este proceso 2 veces más (3x en total) con ~ 10 ml de ddH2O cada uno para evitarla contaminación bacteriana.
NOTA: La contaminación bacteriana afecta seriamente la quimiotaxis de los animales.
3. Formación masiva para el aprendizaje asociativo y la memoria a corto plazo
NOTA: Consulte la figura 1 para el flujo de trabajo de entrenamiento masivo.
- Sumerja suavemente el colector de animales que contiene ~200 animales en 40 ml de una mezcla de 1-propanol al 1% y HCl (pH 4.0 después de mezclar con 1-propanol; ver paso 1.7.) en una placa de cristalización durante ~1 s.
NOTA: Para los animales de control, haga lo mismo pero sumerja solo en 1-propanol acuoso al 1%. Sería mejor tratar a los animales con HCl (pH 4.0) solo como otro control. - Lave los animales en el colector sumergiendo muy suavemente el colector 1x en 10 mL deddH2Oen un pocillo de una placa de cultivo de tejido de 6 pocillos.
NOTA: Este paso de lavado debe ser muy suave y solo debe hacerse 1 vez, ya que el lavado extenso puede impedir el aprendizaje. - Repita los pasos 3.1. y 3.2. 10 veces sin interrupción (intervalo entre ensayos [ITI], 0 min).
NOTA: Utilice ddH2O fresco cada vez en RT. - Coloque el colector en un césped de E. coli OP50 en una placa NGM de 6 cm durante 10 minutos en RT para que los animales descansen.
- Lave los animales en el colector con ddH 2 O moviendo muy suavemente el colector hacia arriba y hacia abajo 2x en ~ 10 ml de ddH 2 O.Repita este proceso 2 veces más (3x en total) con ~ 10 ml de ddH2O cada uno para evitarla contaminación bacteriana.
- Proceda al ensayo de quimiotaxis como se describe a continuación (paso 5).
4. Entrenamiento espaciado para el aprendizaje asociativo y la memoria a largo plazo
NOTA: Consulte la figura 2 para ver el flujo de trabajo de entrenamiento espaciado.
- Sumerja suavemente un colector de animales que contenga ~200 animales en 40 ml de una mezcla de 1-propanol al 1% y HCl (pH 4.0 después de mezclar con 1-propanol; ver paso 1.7.) en un plato de cristalización durante ~1.0 s.
NOTA: Haga lo mismo con 1-propanol acuoso al 1% solo como control. Sería mejor tratar a los animales con HCl (pH 4.0) solo como otro control. - Lave los animales en el colector sumergiendo muy brevemente el colector 1x en 10 ml deddH2Oen un pocillo de una placa de cultivo de tejido de 6 pocillos.
NOTA: Este lavado debe ser muy breve ya que el lavado extenso puede impedir el aprendizaje. - Coloque el colector en un césped de E. coli OP50 en una placa de agar NGM en una placa de Petri de 6 cm (de diámetro) durante 10 minutos en RT para que los animales descansen.
NOTA: Este reposo durante 10 min como ITI es crucial para que los animales consoliden memorias para la formación de LTM. - Repita los pasos 4.1.-4.3. 10x.
- Lave los animales en el colector con ddH 2 O moviendo muy suavemente el colector hacia arriba y hacia abajo 2x en ~ 10 ml de ddH 2 O,que se mantiene en RT. Repita este proceso 2 veces más (3x en total) con ~ 10 ml de ddH2O cada uno para evitarla contaminación bacteriana.
- Proceda al ensayo de quimiotaxis como se describe a continuación (paso 5.).
5. Ensayo de quimiotaxis
- Preparar placas de agar para el ensayo de quimiotaxis en placas de Petri de plástico de 6 cm (ver paso 1.5.).
- Transfiera los animales en el colector (paso 2.5.), que se coloca sobre una superficie plana de la tapa de una placa de Petri de plástico, a un tubo de microcentrífuga de 2 ml con 1 ml de gelatina acuosa al 0,25% utilizando una punta de pipeta recortada con una abertura de >1 mm (diámetro interior).
NOTA: Es importante utilizar una punta de pipeta recortada para minimizar el esfuerzo cortante en los animales. - Retire el sobrenadante del tubo después de que los animales se asienten en el fondo del tubo por gravedad durante ~ 1 minuto (no centrifugar).
- Resuspender suavemente a los animales en 1 ml de tampón de ensayo de quimiotaxis (ver paso 1.6.) y dejar que se asienten por gravedad hasta el fondo del tubo durante ~1 min (no centrifugar). Eliminar la mayor cantidad posible de sobrenadante mediante pipeteo.
- Mientras tanto, en diagonal se localizan 4 μL cada uno de 1-propanol acuoso al 5% en dos lugares y se observan 4 μL deddH2Oen otros dos lugares de la misma manera, como se muestra en la Figura 3A. Para el ensayo de quimiotaxis de mutantes que tienen menor sensibilidad al 1-propanol, detectar concentraciones más altas de 1-propanol acuoso que resulten en valores de ~0.6 índice de quimiotaxis (CI) de mutantes naïve, como se muestra en la Tabla suplementaria 1.
NOTA: Es importante completar los procedimientos de detección lo más rápido posible. Detectar 1-propanol acuoso al 5% ya que el 1-propanol acuoso al 1% es demasiado débil para atraer animales en el ensayo de quimiotaxis. En contraste, use 1-propanol acuoso al 1% para el acondicionamiento, ya que los animales tratados con concentraciones más altas de 1-propanol acuoso que 1% muestran valores de IC más bajos. - Detectar porciones de 6 μL de la suspensión animal en el tampón del ensayo de quimiotaxis (paso 5.4.) que contiene ~60 animales en el centro de tres placas para el ensayo de quimiotaxis utilizando una punta de pipeta recortada con una abertura de ~1,0 mm (diámetro interior). Retire el líquido tanto como sea posible con una mecha de pañuelos de laboratorio sin tocar a los animales y coloque una tapa en el plato.
NOTA: Es importante completar estos procedimientos lo más rápido posible. - Permita que los animales se muevan libremente en la placa durante 10 minutos en RT, y luego transfiera la placa a una placa de Petri de vidrio en hielo durante 3 minutos para detener la quimiotaxis. Luego, mantenga el plato en un refrigerador hasta que cuente la cantidad de animales en el plato.
- Cuente el número de animales en cuatro secciones, excepto los del círculo central, bajo un microscopio estereoscópico y calcule el índice de quimiotaxis (C.I.) utilizando la ecuación que se muestra en la Figura 3B. A partir de los valores de C.I., calcule los valores del índice de aprendizaje (L.I.) como la diferencia entre el valor C.I. de los animales de referencia y el valor C.I. de los animales condicionados (L.I. = C.I.reference- C.I.conditioned).
NOTA: El valor C.I. de los animales de referencia (C.I.referencia) es el valor medio de los valores C.I. de animales condicionados con 1-propanol acuoso al 1% solamente.
Resultados
C. elegans fue condicionado por el entrenamiento masivo para formar memoria asociativa aversiva a corto plazo mediante el emparejamiento de 1% acuoso 1-propanol y HCl (pH 4.0) como el CS y el US, respectivamente. De acuerdo con el protocolo descrito anteriormente, los animales sincronizados se cultivaron en un banco a una RT de 18 °C durante 5 días y se lavaron muy suavemente 2x conddH2Oa una RT de 18 °C. Luego, los animales fueron acondicionados con una mezcla de 1-propanol acuoso al 1% y HCl (pH 4.0) durante 1 s. También entrenamos animales conddH2O solamente, 1% acuoso 1-propanol solamente, y HCl (pH 4.0) solo como referencias. Después del acondicionamiento, los animales fueron lavados 1x conddH2O. Repetimos el acondicionamiento 10x sin interrupción (sin ITIs). El acondicionamiento exitoso se logró repitiendo el procedimiento más de 7 veces hasta 10 veces. Acondicionar más de 10 veces resultó en un aprendizaje menos eficiente21. Después del entrenamiento, los animales descansaron sobre alimentos bacterianos durante 10 minutos a RT (18 °C). Después de ser lavados conddH2O3x, los animales fueron transferidos a un tubo de microcentrífuga suspendiendo en gelatina acuosa al 0,25% y se establecieron en el fondo por gravedad. Después de retirar el sobrenadante tanto como sea posible, los animales fueron resuspendidos suavemente en el tampón de ensayo de quimiotaxis y luego se les permitió que se asentaran en el fondo del tubo por gravedad.
Después de eliminar la mayor cantidad posible de sobrenadante, la suspensión del animal se detectó en el círculo central de una placa de ensayo de quimiotaxis, que se mantuvo a una RT de 18 ° C, y luego se permitió que los animales se movieran libremente en la placa durante 10 minutos a una RT de 18 ° C. Los valores de C.I. se calcularon utilizando la ecuación que se muestra en la Figura 3B. Como se muestra en la Figura 4A, los animales condicionados con la mezcla de 1-propanol al 1% y HCl ya no se sintieron atraídos por el 1-propanol al 5% detectado en placas de agar para el ensayo de quimiotaxis, mientras que los animales ingenuos y de referencia se sintieron atraídos de manera similar por el 5% de 1-propanol. Después del entrenamiento masivo (paso 3.), la memoria ya no se observó dentro de 3 h20. Además, la memoria formada por el entrenamiento masivo era sensible al choque frío20. Estos resultados demuestran que C. elegans formó con éxito STM aversivo mediante entrenamiento masivo.
Los animales también fueron condicionados por un entrenamiento espaciado 10x con un ITI de 10 minutos entre los pasos de entrenamiento (paso 4.). Durante el ITI, el colector con animales se colocó en un césped bacteriano en una placa NGM de 6 cm a una RT de 18 °C. Los animales condicionados por el entrenamiento espaciado con una mezcla de 1-propanol acuoso al 1% y HCl (pH 4.0) ya no se sintieron atraídos por el 1-propanol al 5% en comparación con los animales tratados con 1% 1-propanol solo, HCl (pH 4.0) solamente, o ddH2O solo (Figura 4B). Después del entrenamiento espaciado, los animales conservaron la memoria durante más de 12 h20,21. Además, la memoria no se formó cuando los animales fueron tratados con inhibidores de traducción o transcripción y fue resistente al choque frío20,21. Por lo tanto, C. elegans formó con éxito LTM aversiva mediante entrenamiento espaciado.
También examinamos los efectos de las mutaciones en "genes de aprendizaje y memoria" en la formación de STM y LTM. El gen crh-1 codifica la ubicua proteína de unión al elemento de respuesta cAMP (CREB), glr-1 y nmr-1 codifican las subunidades receptoras de glutamato de tipo α-amino-3-hidroxil-5-metil-4-isoxazolepropiónico (AMPA) y tipo N-metil-D-aspartato (NMDA), respectivamente, y stau-1 codifica la isoforma Staufen de la proteína de unión al ARN bicatenario. Estos genes juegan un papel esencial en el condicionamiento clásico en C. elegans, Drosophila, Aplysia y ratones. Utilizando una mezcla de 1-propanol acuoso al 1% y HCl (pH 4,0), la formación de STM y LTM fue dependiente de todos los genes (Figuras 5A,B).
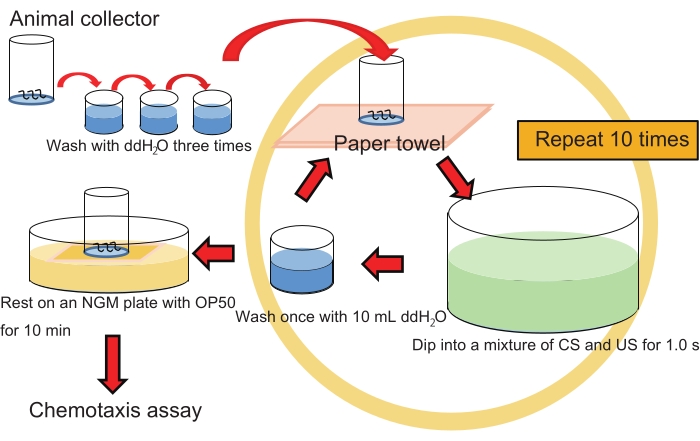
Figura 1: Esquema experimental de entrenamiento masivo. Haga clic aquí para ver una versión más grande de esta figura.
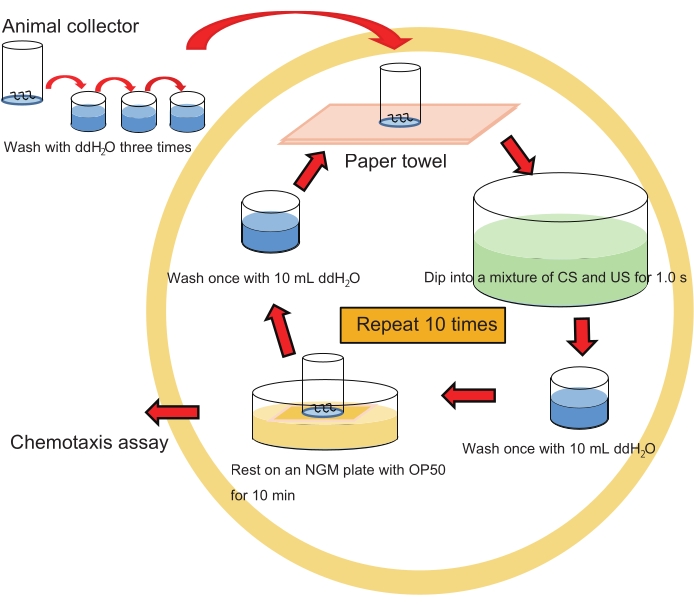
Figura 2: Esquema experimental del entrenamiento espaciado. Haga clic aquí para ver una versión más grande de esta figura.
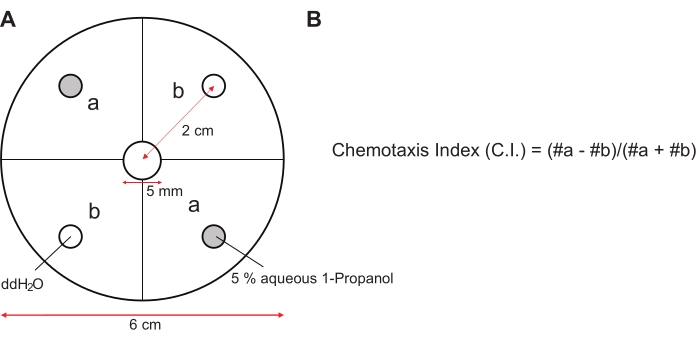
Figura 3: Ensayo de quimiotaxis e índice de quimiotaxis. (A) Representación esquemática de una placa de ensayo de quimiotaxis. Las placas de Petri (6 cm de diámetro) se separaron en cuatro áreas como se muestra, y 4 μL cada una de 1-propanol acuoso al 5% oddH2Ose detectaron diagonalmente en dos lugares cada uno, a 2 cm del centro. (B) Los valores del índice de quimiotaxis se calcularon a partir de la ecuación mostrada contando el número de animales en las áreas "a" y "b" después de la finalización de la quimiotaxis. Haga clic aquí para ver una versión más grande de esta figura.
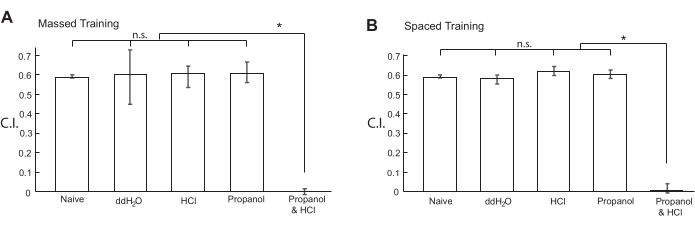
Figura 4: Valores del índice de quimiotaxis de animales acondicionados con productos químicos. Los animales N2 sincronizados de tipo salvaje fueron acondicionados con sustancias químicas indicadas por (A) entrenamiento masivo 10x o (B) entrenamiento espaciado 10x. Los diagramas de flujo de los protocolos de entrenamiento masivos y espaciados utilizados se muestran en la Figura 1 y la Figura 2, respectivamente. Después del acondicionamiento, los animales fueron libres de moverse durante 10 min en una placa de agar de 6 cm para el ensayo de quimiotaxis a una RT de 18 °C. Los valores de C.I. se calcularon utilizando la ecuación que se muestra en la Figura 3B. Los datos para esta figura se proporcionan en la Tabla Suplementaria 1. Los datos de los animales ingenuos se volvieron a trazar en ambos paneles de figuras. El gráfico de barras muestra el 1er cuartil, la mediana y el 3er cuartil. Los asteriscos (*P < 0,05) indican diferencias estadísticamente significativas determinadas por ANOVA unidireccional seguido de la prueba de comparación múltiple de Dunnett. Haga clic aquí para ver una versión más grande de esta figura.
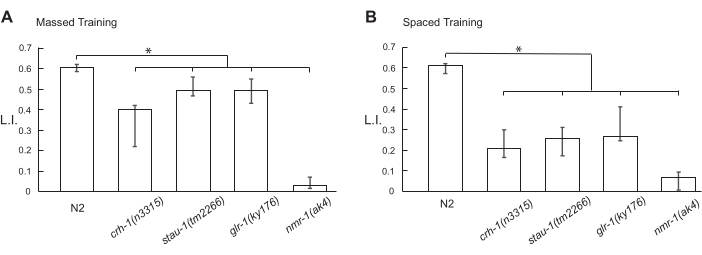
Figura 5: Valores del índice de aprendizaje de animales mutantes condicionados. Los animales N2 y mutantes sincronizados de tipo salvaje indicados fueron acondicionados con una mezcla de 1-propanol acuoso al 1% y HCl (pH 4.0) por (A) entrenamiento masivo 10x o (B) entrenamiento espaciado 10x. Los diagramas de flujo de los protocolos de entrenamiento masivos y espaciados utilizados se muestran en la Figura 1 y la Figura 2, respectivamente. Después del acondicionamiento, los animales fueron libres de moverse durante 10 min en una placa de agar de 6 cm para el ensayo de quimiotaxis a una RT de 18 °C. Los datos para esta cifra se proporcionan en la Tabla Suplementaria 2. El gráfico de barras muestra el 1er cuartil, la mediana y el 3er cuartil. Los asteriscos (*P < 0,05) indican diferencias estadísticamente significativas determinadas por ANOVA unidireccional seguido de la prueba de comparación múltiple de Dunnett. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Los animales adultos jóvenes son sensibles al tratamiento químico. Los animales N2 de tipo salvaje del día 4 y día 5 después de la eclosión fueron entrenados en masa 10 veces con HCl, pH 4.0, sin interrupción y luego se analizaron para quimiotaxis al 5% acuoso 1-propanol. Las barras son medias ± S.E.M. (n = 19). Los asteriscos (*P < 0,05) indican diferencias estadísticamente significativas determinadas por ANOVA bidireccional seguido de la prueba post-hoc de Tukey-Kramer. Haga clic aquí para descargar este archivo.
Cuadro complementario 1: Datos correspondientes a la figura 4. Haga clic aquí para descargar esta tabla.
Cuadro complementario 2: Datos correspondientes a la figura 5. Haga clic aquí para descargar esta tabla.
Discusión
En el presente estudio, todos los reactivos se mantuvieron a un RT de ~ 18 ° C en promedio, y los animales se cultivaron en un banco en el RT para evitar el estrés de los animales. Además, todos los procedimientos experimentales se llevaron a cabo en el RT. Los animales se cultivaron inicialmente en una incubadora a 20 ° C y luego se acondicionaron en un banco a ~ 24 ° C utilizando reactivos en el RT. En estas condiciones, los resultados del acondicionamiento fueron muy variables. En la RT baja, C. elegans crece lentamente y debe cultivarse más de 20 °C hasta que los animales alcancen la etapa adulta madura, ya que los animales adultos más jóvenes son más sensibles a los productos químicos utilizados para el acondicionamiento que los animales adultos maduros y pueden mostrar valores de IC más bajos.
El paso más crítico para un acondicionamiento exitoso es el lavado de los animales conddH2Oinmediatamente después de cada tratamiento químico. Por lo tanto, las tensiones mecánicas y de temperatura deben minimizarse mediante el uso de puntas de pipeta recortadas, manteniendo los reactivos en RT y lavando muy suavemente a los animales moviendo muy lentamente el colector de animales hacia arriba y hacia abajo en ddH2O. El lavado minucioso de los animales cada vez después del acondicionamiento puede afectar el aprendizaje y la memoria. Las condiciones de las placas de ensayo de quimiotaxis también afectan gravemente los resultados. Las placas demasiado secas o demasiado húmedas impiden la locomoción suave de los animales. Las placas se prepararon como se describe en el paso 1.; una buena placa es aquella para la cual las manchas de 4 μL deddH2Oo 1-propanol acuoso al 5% son completamente absorbidas por el agar en aproximadamente 5 minutos después de la mancha. Como se describió anteriormente, las edades de los animales también son críticas para un acondicionamiento exitoso. Los animales adultos jóvenes son sensibles al tratamiento mecánico y químico, lo que resulta en resultados variables, aunque los animales muy envejecidos tampoco pueden ser adecuados para el acondicionamiento.
La vida útil del 1-propanol depende de las marcas y lotes y es inferior a 3 meses en RT. Cuando los valores de C.I. de los animales ingenuos empeoran, se recomienda utilizar 1-propanol fresco para el ensayo de acondicionamiento y quimiotaxis.
La formación de memoria por entrenamiento masivo no fue afectada por el tratamiento de animales con inhibidores de la traducción (cicloheximida y anisomicina) y un inhibidor de la transcripción (actinomicina D), mientras que la formación de memoria por el entrenamiento espaciado fue marcadamente inhibida por los inhibidores20,21. Además, la memoria anterior decayó por choque frío, mientras que la segunda se retuvo durante un período más largo que la primera y fue resistente al choque frío. Estos resultados demuestran que el primero es STM y el segundo es LTM, respectivamente20,21. Sin embargo, la memoria formada por el entrenamiento masivo puede consistir en STM y memoria a mediano plazo (intermedio-término) ya que STM es débilmente dependiente del factor de transcripción CREB (Figura 5A). Esto es consistente con el resultado de que el STM se retuvo durante más de 1 h20,21. La formación de STM y LTM es altamente dependiente de nmr-1, que se expresa solo en seis pares de neuronas (AVA, AVD, AVE, RIM, AVG y PVC) en C. elegans27,28. En estas neuronas, por lo tanto, los receptores NMDA pueden actuar como un detector de coincidencia molecular de 1% de señales acuosas de 1-propanol y HCl (pH 4.0) para la plasticidad sináptica, donde el fortalecimiento sináptico requerido tanto para STM como para LTM puede resultar de la activación coincidente de neuronas pre y postsinápticas 29,30,31,32,33. Por lo tanto, la memoria asociativa aversiva puede formarse entre las interneuronas.
Los métodos descritos en el presente estudio deben ser aplicables para el aprendizaje olfativo apetitivo y la memoria asociativa a corto y largo plazo utilizando 1-nonanol como CS y cloruro de potasio como US21. Es interesante comparar los circuitos neuronales que están involucrados en la formación de recuerdos apetitivos y aversivos.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos a Takashi Murayama, Ei-ichiro Saita, Iou Ven Chang y Hitomi Ohtaki por su asistencia técnica y comentarios sobre el manuscrito. Las cepas fueron proporcionadas por el Centro de Genética Caenorhabditis, que está financiado por el Centro Nacional de Recursos de Investigación (NCRR) de los NIH. Este trabajo fue apoyado por fondos del Instituto de Ciencia y Tecnología de Okinawa Graduate University.
Materiales
| Name | Company | Catalog Number | Comments |
| 500 mL beaker | HARIO | B-500-H32 | |
| 10 µL pipette tips | Thermo Fisher Scientific | H-104-96RS-Q | |
| 0.2 mL pipette tips | Thermo Fisher Scientific | TTW110RS-Q | |
| 1.0 mL pipette tips | Thermo Fisher Scientific | H-111-R100NS-Q | |
| 1.5 mL plastic tubes | Eppendorf | 0030120086 | |
| 2 mL plastic tubes | Eppendorf | 0030120094 | |
| 10 mL Serological pipettes | As One | 2-5237-04 | |
| 50 mL Serological pipettes | As One | 2-5237-06 | |
| 6-well cell culture plate | Costar | 3516 | |
| Aron Alpha (Glue for plastic) | Toagosei | High Speed EX | |
| Autoclave | Tomy Digital Biology | SX-300 | |
| Bacto agar | BD | 214010 | |
| Bacto peptone | BD | 211677 | |
| Bottle top 0.2 µm filter units | Thermo Fisher Scientific | 566-0020 | |
| Bunsen burner | EISCO | SKU CH0089A | |
| Calcium chloride dihydrate | Nacalai Tesque | 06730-15 | |
| C. elegans mutant strains | Caenorhabditis Genetics Center | ||
| Cholesterol | Wako Pure Chemical Industries | 034-03002 | |
| Clear acrylic cylindrical pipe | Asahi Kasei | 3.5 cm (length), 30 mm (external diameter), 2 mm (thickness) | |
| Crystallizing dish | Pyrex | 3140-80 | |
| Dental burner | Phoenix-Dent | APT-3 | |
| Di-potassium hydrogen phosphate | Nacalai Tesque | 28726-05 | |
| E. coli OP50 | Caenorhabditis Genetics Center | ||
| Electric pipetter | Drummond Scientific | 4-000-101 | |
| Gelatin | Wako Pure Chemical Industries | 073-06295 | |
| Glass Petri dishes (10 cm in diameter) | As One | Trade FLAT Mark | |
| Heating magnetic stirrer | Thermo Fisher Scientific | SP131324 | |
| Hydrochloric acid | Nacalai Tesque | 37345-15 | |
| Incubator | SANYO | MIR-553 | |
| Kimwipes S-200 | Nippon Paper Crecia | 62011 | |
| Laboratory coat | TOYO LINT FREE | FH240C | |
| Magnesium sulfate heptahydrate | Nacalai Tesque | 21002-85 | |
| Magnetic stirrer bar | SANSYO | 93-5412 | |
| Metal spatula | FUJIFILM Wako | 647-06531 | |
| Nitrile gloves | Kimberly-Clark | KC100 | |
| Nylon mesh (mesh size: 30 μm) | SEFAR | NY30-HD | |
| P10 pipetman | Gilson | F144802 | |
| P200 pipetman | Gilson | F123600 | |
| P1000 pipetman | Gilson | F123602 | |
| pH meter | HORIBA | Navi F-52 | |
| Plastic Petri dishes (9 cm in diameter) | IWAKI | SH90-15E | |
| Plastic Petri dishes (6 cm in diameter) | SARSTEDT | 82.1194.500 | |
| Plastic weighing boats | As One | 1-5233-01 | |
| Platinum wire for a worm pick | Nilaco | PT-351265 | |
| 1-Propanol | SIGMA-ALDRICH | 279544 | |
| Potassium dihydrogen phosphate | Nacalai Tesque | 28721-55 | |
| Safety goggles | Kimberly-Clark | #25646 | |
| Sodium chloride | Nacalai Tesque | 31320-05 | |
| Stereomicroscope | Olympus | SZX16 | |
| Tooth picks | |||
| Water purification sysytem | Merck | Elix Essential 10 UV | |
| Water urification sysytem | Merck | Milli-Q Synthesis A10 | |
| Weighing balance | METTLER | TOREDO | |
| Wild type C. elegans strain N2 | Caenorhabditis Genetics Center |
Referencias
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Cook, S. J., et al. Whole-animal connectomes of both Caenorhabditis elegans sexes. Nature. 571 (7763), 63-71 (2019).
- Witvliet, D., et al. Connectomes across development reveal principles of brain maturation. Nature. 596, 257-261 (2021).
- Hedgecock, E. M., Russell, R. L. Normal and mutant thermotaxis in the nematode Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 72 (10), 4061-4065 (1975).
- Mohri, A., et al. Genetic control of temperature preference in the nematode Caenorhabditis elegans. Genetics. 169 (3), 1437-1450 (2005).
- Wen, J. Y. M., et al. Mutations that prevent associative learning in C. elegans. Behavioral Neuroscience. 111 (2), 354-368 (1997).
- Saeki, S., Yamamoto, M., Iino, Y. Plasticity of chemotaxis revealed by paired presentation of a chemoattractant and starvation in the nematode Caenorhabditis elegans. Journal of Experimental Biology. 204 (10), 1757-1764 (2001).
- Tomioka, M., et al. The insulin/PI3-kinase pathway regulates salt chemotaxis learning in Caenorhabditis elegans. Neuron. 51 (5), 613-625 (2006).
- Torayama, I., Ishihara, T., Katsura, I. Caenorhabditis elegans integrates the signals of butanone and food to enhance chemotaxis to butanone. Journal of Neuroscience. 27 (4), 741-750 (2007).
- Kaufman, A. L., Ashraf, J. M., Corces-Zimmerman, M. R., Landis, J. N., Murphy, C. T. Insulin signaling and dietary restriction differentially influence the decline of learning and memory with age. PLoS Biology. 8 (5), 1000372 (2010).
- Stein, G. M., Murphy, C. T. C. elegans positive olfactory associative memory is a molecularly conserved behavioral paradigm. Neurobiology of Learning and Memory. 115, 86-94 (2014).
- Rahmani, A., Chew, Y. L. Investigating the molecular mechanisms of learning and memory using Caenorhabditis elegans. Journal of Neurochemistry. 159 (3), 417-451 (2021).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook. 25, 1-29 (2006).
- Gray, J. M., Hill, J. J., Bargmann, C. I. A circuit for navigation in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3184-3191 (2005).
- Cho, C. E., Brueggemann, C., L'Etoile, N. D., Bargmann, C. I. Parallel encoding of sensory history and behavioral preference during Caenorhabditis elegans olfactory learning. eLife. 5, 14000 (2016).
- Juang, B. T., et al. Endogenous nuclear RNAi mediates behavioral adaptation to odor. Cell. 154 (5), 1010-1022 (2013).
- Neal, S. J., et al. Feeding state-dependent regulation of developmental plasticity via CaMKI and neuroendocrine signaling. eLife. 4, 10110 (2015).
- Castellucci, V. F., Kandel, E. R. A quantal analysis of the synaptic depression underlying habituation of the gill-withdrawal reflex in Aplysia. Proceedings of the National Academy of Sciences of the United States of America. 71 (12), 5004-5008 (1974).
- Klein, M., Kandel, E. R. Mechanism of calcium current modulation underlying presynaptic facilitation and behavioral sensitization in Aplysia. Proceedings of the National Academy of Sciences of the United States of America. 77 (11), 6912-6916 (1980).
- Amano, H., Maruyama, I. N. Aversive olfactory learning and associative long-term memory in Caenorhabditis elegans. Learning & Memory. 18 (10), 654-665 (2011).
- Nishijima, S., Maruyama, I. N. Appetitive olfactory learning and long-term associative memory in Caenorhabditis elegans. Frontiers in Behavioral Neuroscience. 11, 80 (2017).
- Morrison, G. E., Wen, J. Y. M., Runciman, S., vander Kooy, D. Olfactory associative learning in Caenorhabditis elegans is impaired in lrn-1 and lrn-2 mutants. Behavioral Neuroscience. 113 (2), 358-367 (1999).
- Morrison, G. E., vander Kooy, D. A mutation in the AMPA-type glutamate receptor, glr-1, blocks olfactory associative and nonassociative learning in Caenorhabditis elegans. Behavioral Neuroscience. 115 (3), 640-649 (2001).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Sambongi, Y., et al. Caenorhabditis elegans senses protons through amphid chemosensory neurons: Proton signals elicit avoidance behavior. Neuroreport. 11 (10), 2229-2232 (2000).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Brockie, P. J., Madsen, D. M., Zheng, Y., Mellem, J., Maricq, A. V. Differential expression of glutamate receptor subunits in the nervous system of Caenorhabditis elegans and their regulation by the homeodomain protein UNC-42. Journal of Neuroscience. 21 (5), 1510-1522 (2001).
- Brockie, P. J., Mellem, J. E., Hills, T., Madsen, D. M., Maricq, A. V. The C. elegans glutamate receptor subunit NMR-1 is required for slow NMDA-activated currents that regulate reversal frequency during locomotion. Neuron. 31 (4), 617-630 (2001).
- Gustafsson, B., Wingstrom, H. Physiological mechanisms underlying long-term potentiation. Trends in Neuroscience. 11 (4), 156-162 (1988).
- Kauer, J. A., Malenka, R. C., Nicoll, R. A. A persistent postsynaptic modification mediates long-term potentiation in the hippocampus. Neuron. 1 (10), 911-917 (1988).
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: Long-term potentiation in the hippocampus. Nature. 361 (6407), 31-39 (1993).
- Bailey, C. H., Giustetto, M., Huang, Y. Y., Hawkins, R. D., Kandel, E. R. Is heterosynaptic modulation essential for stabilizing Hebbian plasticity and memory. Nature Reviews Neuroscience. 1 (1), 11-20 (2000).
- Miyashita, T., et al. Mg2+ block of Drosophila NMDA receptors is required for long-term memory formation and CREB-dependent gene expression. Neuron. 74 (5), 887-898 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados