Method Article
Aprendizagem associativa aversiva e formação de memória emparelhando dois produtos químicos em Caenorhabditis elegans
Neste Artigo
Resumo
Anteriormente, desenvolvemos protocolos para Caenorhabditis elegans para formar memórias associativas de curto e longo prazo por treinamento em massa e espaçado, respectivamente. Aqui, protocolos detalhados são descritos para o condicionamento de C. elegans pelo emparelhamento de 1-propanol e ácido clorídrico como estímulos condicionados e incondicionados, respectivamente, para formar memória associativa aversiva.
Resumo
O nematoide Caenorhabditis elegans é um organismo modelo atraente para estudar a aprendizagem e a memória a nível molecular e celular devido à simplicidade do seu sistema nervoso, cujos diagramas de fiação química e elétrica foram completamente reconstruídos a partir de micrografias eletrônicas seriadas de seções finas. Aqui, descrevemos protocolos detalhados para o condicionamento de C. elegans por treinamento em massa e espaçado para a formação de memória de curto prazo (STM) e memória de longo prazo (LTM), respectivamente. Ao emparelhar o 1-propanol e o ácido clorídrico como estímulos condicionados e incondicionados, respectivamente, C. elegans foi treinado com sucesso para formar STM e LTM associativas aversivas. Enquanto os animais ingênuos foram atraídos pelo 1-propanol, os animais treinados não foram mais ou muito fracamente atraídos pelo 1-propanol. Como em outros organismos, como Aplysia e Drosophila, "genes de aprendizagem e memória" desempenham papéis essenciais na formação da memória. Particularmente, os receptores de glutamato do tipo NMDA, expressos em apenas seis pares de interneurônios em C. elegans, são necessários para a formação de STM e LTM, possivelmente como um fator de coincidência. Portanto, o traço de memória pode residir entre os interneurônios.
Introdução
O aprendizado e a memória são vitais para que os animais sobrevivam e se reproduzam, navegando eficientemente em ambientes em mudança. C. elegans é um organismo modelo atraente para estudar a aprendizagem e a memória nos níveis molecular e celular devido à simplicidade de seu sistema nervoso, cujos diagramas de fiação química e elétrica foram completamente reconstruídos a partir de micrografias eletrônicas seriadas de seções finas 1,2,3.
C. elegans aprende a associar a temperatura de cultivo com a fome e migra para longe de sua temperatura de crescimento com uma memória aversiva que dura várias horas 4,5. O condicionamento de C. elegans com cloreto de sódio (NaCl) na ausência de alimento leva a uma redução da quimiotaxia em direção ao NaCl 6,7,8. Quando emparelhada com alimentos, a atração por butanona é aumentada como resultado da aprendizagem apetitiva 9,10,11. Embora esses fenômenos sejam interpretados como aprendizagem associativa e memória 10,12, a distinção entre aprendizagem associativa e sensibilização, habituação e adaptação não associativa não está clara no paradigma de aprendizagem e memória de C. elegans 13,14. De fato, animais condicionados com butanona e privação de alimentos (condicionamento aversivo) mostraram acoplamento deprimido do neurônio sensorial de butanona AWC ON aos neurônios-alvo por sinais de insulina de outros neurônios, incluindo interneurônios AIA, enquanto animais condicionados combutanona e comida (condicionamento apetitoso) mostraram acoplamento aprimorado de AWCON aos neurônios-alvo15 . A sinalização da insulina causa alterações na expressão gênica induzidas pelo EGL-4 nuclear e outros reguladores transcricionais16,17. Assim, essa aprendizagem e memória aversiva e apetitosa tem analogias com a habituação não associativa e a sensibilização, respectivamente, dos neurônios sensoriais pré-sinápticos no reflexo de retirada da guelra em Aplysia18,19.
Ao emparelhar dois produtos químicos como o estímulo condicionado (SC) e o estímulo incondicionado (US), nós e outros desenvolvemos protocolos para o condicionamento de C. elegans para formar aprendizagem associativa e memória sem usar comida ou fome como os EUA20,21,22,23. No presente estudo, os protocolos são modificados para condicionar animais com 1-propanol e ácido clorídrico (HCl, pH 4,0) como CS e US, respectivamente, para aprendizagem aversiva e memória de curto prazo (STM) e memória de longo prazo (LTM). C. elegans ingênuo é atraído pelo 1-propanol24 e repelido pelo ácido25. Quando condicionado com uma mistura de 1-propanol e HCl (pH 4,0), C. elegans não foi mais ou muito fracamente atraído para 1-propanol.
Protocolo
1. Receitas
- Placas de ágar NGM (passo 2.1.)
- Para preparar placas de NGM de 6 cm, dissolver 2,5 g de peptona, 3 g de NaCl e 17 g de ágar em 850 mL de H 2 O duplamente deionizado (ddH2O). Elevar o volume total para 972 ml com ddH2O.
- Após a autoclavagem, esfriar até ~65 °C e adicionar 1 mL de 5 mg/mL de colesterol dissolvido em etanol, 1 mL cada de 1 M CaCl2 e 1 M MgSO4 e 25 mL de 1 M de fosfato de potássio (pH 6,0). Depois de misturar bem, dispense 8 mL cada a 6 cm (em diâmetro) de placas de Petri.
- Mantenha as placas com tampas em um banco à temperatura ambiente (RT) por 1 dia e, em seguida, mantenha-as em utensílios de plástico em uma câmara fria até o uso.
- Preparar o meio Luria-Bertani (LB) (passo 2.1.) dissolvendo 10 g de triptona, 5 g de extracto de levedura e 10 g de NaCl em 1 L de ddH2O. Ajustar o pH para 7,0 com 5 N NaOH (várias gotas) e esterilizar por autoclavagem.
- Preparar as placas LB adicionando 15 g de ágar ao meio LB. Após a autoclavagem, arrefecer até ~60 °C e dispensar 12 ml cada a 9 cm (em diâmetro) de placas de Petri. Mantenha as placas em utensílios de plástico em uma câmara fria até o uso.
- Para fazer um coletor de animais (passo 2.4.), prenda malha de nylon (malha de 30 μm) ao fundo de um tubo cilíndrico de acrílico transparente (3,5 cm de comprimento, 3 cm de diâmetro externo, 2 mm de espessura da parede) com cola.
- Para fazer solução aquosa de gelatina a 0,25% (passo 2.4.), dissolver 0,25 g de gelatina em 100 mL de ddH2O. Esterilizar por autoclavagem.
- Placas de ensaio de quimiotaxia (passo 5.1.)
- Para fazer placas de ágar para ensaio de quimiotaxia, dissolver 15 g de ágar em 993 mL de ddH2O por autoclave e resfriar a solução a ~65 °C.
- Em seguida, adicione 5 mL de fosfato de potássio 1 M autoclavado (pH 6,0), 1 mL de CaCl2 1 M e 1 mL de 1 M MgSO4 à solução em ágar. Todas essas soluções são esterilizadas separadamente por autoclavagem.
- Dispensar 10 ml da solução mista numa placa de Petri de 6 cm. Coloque essas placas com tampas em um banco na RT por dois dias e, em seguida, coloque-as em toalhas de papel molhadas em artigos de plástico na RT até o uso. Essas placas podem ser usadas por até 10 dias.
- Para fazer o tampão de ensaio de quimiotaxia (etapa 5.4.), misture 5 mL de fosfato de potássio 1 M (pH 6,0), 1 mL de CaCl 2 1 M, 1 mL de 1 M MgSO4 e 993 mL de ddH2O. Esterilize separadamente todas essas soluções por autoclavagem.
- Para fazer uma solução de mistura de 40 mL CS/US (1% aquoso 1-propanol e HCl [pH 4,0]) (etapa 3.1. e etapa 4.1.), adicionar 0,4 mL de 1-propanol absoluto e 4 μL de HCl 5 M (0,1 mM na concentração final) a 39,6 mL de ddH2O. Manter a solução em RT.
- Para fazer ddH2O, trate a água da torneira 2x com sistemas de purificação de água (consulte Tabela de Materiais).
- Preparar uma cultura líquida (OD600 = ~0,7) de Escherichia coli OP50 inoculando uma colónia fresca com um palito de dente em 10 ml de meio LB e incubando a 37 °C durante 7-8 h. Bactérias cultivadas por um período mais longo podem afetar o resultado do condicionamento, talvez devido a metabólitos secundários.
2. Preparação de C sincronizado. elegans |
- Utilizando métodosnormalizados 26, cultivar animais em placas NGM de 6 cm (passo 1.1.). As placas de NGM são preparadas espalhando 0,2 mL de uma cultura líquida de E. coli OP50 em meio LB (ver etapa 1.9 .) e incubando no RT por não mais de 24 h (bactérias antigas podem afetar o resultado do condicionamento).
NOTA: A aprendizagem e a memória de C. elegans são extremamente sensíveis a tensões mecânicas, químicas e de temperatura. Portanto, é altamente recomendável cultivar animais, manter todos os reagentes, incluindo água, e realizar todos os ensaios em RT entre 17 °C e 20 °C. Estímulos físicos e mecânicos, como vórtices, pipetagem áspera e centrifugação, devem ser evitados. 1-propanol fresco deve ser usado a cada 3 meses no mais longo por uma razão desconhecida. É importante ressaltar que os animais devem ser cultivados com abundância de comida, pois a fome pode afetar seriamente o resultado do condicionamento. - No dia 1, escolha e coloque cinco animais gravídicos bem alimentados (coloque mais animais mutantes que põem ovos lentamente) em cada uma das quatro placas NGM de 6 cm com um colhedor de vermes de platina e deixe-os colocar ~ 50 ovos por 3 h no RT para obter uma população sincronizada de animais adultos. Pare de colocar ovos removendo os animais pais das placas com um colhedor de minhocas de platina.
NOTA: As placas semeadas devem ser mantidas em RT para minimizar o estresse para os animais. - Cultive os animais na RT por cerca de 5 dias, que é o tempo que leva para os animais atingirem seu estágio adulto maduro, não o estágio adulto jovem.
NOTA: O período de cultivo entre 4,5 dias e 5,5 dias deve ser ajustado em função das condições, uma vez que os animais adultos mais jovens são mais sensíveis aos produtos químicos utilizados para o condicionamento do que os animais adultos maduros (Figura 1 suplementar). Após o condicionamento, os animais adultos jovens podem apresentar valores mais baixos de índice de quimiotaxia (IC). - Recolher ~200 animais adultos num coletor de animais (ver passo 1.4.) lavando cada placa com 1 ml de gelatina aquosa a 0,25% (passo 1.4.) Esta gelatina aquosa impede a adesão dos animais à superfície de plásticos, como pontas de pipeta.
- Lave os animais no coletor com ddH 2 O (passo 1.8.) movendo muito suavemente o coletor para cima e para baixo 2x em ~10 mL de ddH 2 O. Repitaeste processo 2x mais (3x no total) com ~10 mL de ddH2O cada para evitar a contaminação bacteriana.
NOTA: A contaminação bacteriana afeta seriamente a quimiotaxia dos animais.
3. Treinamento em massa para aprendizagem associativa de curto prazo e memória
NOTA: Consulte a Figura 1 para obter o fluxo de trabalho de treinamento em massa.
- Mergulhe suavemente o coletor de animais contendo ~200 animais em 40 mL de uma mistura de 1% de 1-propanol e HCl (pH 4,0 após a mistura com 1-propanol; ver etapa 1.7.) em um prato cristalizador por ~1 s.
NOTA: Para os animais de controle, faça o mesmo, mas mergulhe apenas em 1% de 1-propanol aquoso. Seria melhor tratar animais com HCl (pH 4,0) apenas como outro controle. - Lave os animais no coletor imergindo muito suavemente o coletor 1x em 10 mL de ddH2O em um poço de uma placa de cultura de tecido de 6 poços.
NOTA: Esta etapa de lavagem deve ser muito suave e só deve ser feita 1x, pois a lavagem extensiva pode impedir o aprendizado. - Repita as etapas 3.1. e 3.2. 10x sem interrupção (intervalo inter-trial [ITI], 0 min).
NOTA: Use ddH2O fresco cada vez em RT. - Coloque o coletor em um gramado de E. coli OP50 em uma placa NGM de 6 cm por 10 min no RT para que os animais descansem.
- Lave os animais no coletor com ddH 2 O movendo suavemente o coletor para cima e para baixo 2x em ~10 mL de ddH 2 O. Repita esteprocesso 2x mais (3x no total) com ~10 mL de ddH2O cada para evitar a contaminação bacteriana.
- Prossiga para o ensaio de quimiotaxia conforme descrito abaixo (etapa 5).
4. Treinamento espaçado para aprendizagem associativa de longo prazo e memória
NOTA: Consulte a Figura 2 para obter o fluxo de trabalho de treinamento espaçado.
- Mergulhe suavemente um coletor de animais contendo ~200 animais em 40 mL de uma mistura de 1% de 1-propanol e HCl (pH 4,0 após a mistura com 1-propanol; ver etapa 1.7.) em um prato de cristalização por ~1,0 s.
NOTA: Faça o mesmo com 1% de 1-propanol aquoso apenas como controle. Seria melhor tratar animais com HCl (pH 4,0) apenas como outro controle. - Lave os animais no coletor imergindo muito brevemente o coletor 1x em 10 mL de ddH2O em um poço de uma placa de cultura de tecido de 6 poços.
NOTA: Esta lavagem deve ser muito breve, pois a lavagem extensiva pode impedir a aprendizagem. - Coloque o coletor em um gramado de E. coli OP50 em uma placa de ágar NGM em uma placa de Petri de 6 cm (em diâmetro) por 10 minutos no RT para que os animais descansem.
NOTA: Este descanso por 10 min como ITI é crucial para que os animais consolidem memórias para a formação de LTM. - Repita as etapas 4.1.-4.3. 10x.
- Lave os animais no coletor com ddH 2 O movendo suavemente o coletor para cima e para baixo 2x em ~10 mL de ddH 2 O, que émantido em RT. Repita este processo 2x mais (3x no total) com ~10 mL de ddH2O cada para evitar a contaminação bacteriana.
- Prossiga para o ensaio de quimiotaxia conforme descrito abaixo (etapa 5.).
5. Ensaio de quimiotaxia
- Preparar placas de ágar para ensaio de quimiotaxia em placas de Petri de plástico de 6 cm (ver passo 1.5.).
- Transferir os animais no coletor (passo 2.5.), que é colocado numa superfície plana de uma tampa de placa de Petri de plástico, para um tubo de microcentrífuga de 2 ml com 1 ml de gelatina aquosa a 0,25% utilizando uma ponta de pipeta serrada com uma abertura de >1 mm (diâmetro interior).
NOTA: É importante usar uma ponta de pipeta serrada para minimizar o estresse de cisalhamento nos animais. - Remova o sobrenadante do tubo depois que os animais se instalarem no fundo do tubo por gravidade por ~ 1 min (não centrifugar).
- Ressuspeite suavemente os animais em 1 ml de tampão de ensaio de quimiotaxia (ver passo 1.6.) e deixe-os acalmar por gravidade até ao fundo do tubo durante ~1 min (não centrifugar). Remova o máximo de sobrenadante possível por pipetagem.
- Enquanto isso, identifique diagonalmente 4 μL cada de 1-propanol aquoso a 5% em dois lugares e marque 4 μL cada de ddH2O em dois outros lugares da mesma maneira, como mostrado na Figura 3A. Para o ensaio de quimiotaxia de mutantes que têm menor sensibilidade ao 1-propanol, detecte concentrações mais altas de 1-propanol aquoso que resultem em valores de ~0,6 índice quimiotaxia (IC) de mutantes ingênuos, conforme mostrado na Tabela Suplementar 1.
NOTA: É importante concluir os procedimentos de detecção o mais rápido possível. Spot 5% aquoso 1-propanol uma vez que 1% aquoso 1-propanol é muito fraco para atrair animais no ensaio de quimiotaxia. Em contraste, use 1% de 1-propanol aquoso para condicionamento, uma vez que os animais tratados com concentrações mais altas de 1-propanol aquoso do que 1% apresentam valores de IC mais baixos. - Colocar 6 μL de porções da suspensão animal em tampão de ensaio de quimiotaxia (passo 5.4.) contendo ~60 animais no centro de três placas para ensaio de quimiotaxia utilizando uma ponta de pipeta serrada com uma abertura de ~1,0 mm (diâmetro interior). Remova o líquido o máximo possível com um pavio de tecido de laboratório sem tocar nos animais e coloque uma tampa no prato.
Observação : é importante concluir esses procedimentos o mais rápido possível. - Permita que os animais se movam livremente na placa por 10 minutos no RT e, em seguida, transfira a placa para uma placa de Petri de vidro no gelo por 3 minutos para parar a quimiotaxia. Em seguida, mantenha o prato em uma geladeira até contar o número de animais no prato.
- Contar o número de animais em quatro secções, com excepção dos do círculo central, sob estereomicroscópio e calcular o índice quimiotaxia (IC) utilizando a equação apresentada na Figura 3B. A partir dos valores de C.I., calcule os valores do índice de aprendizagem (L.I.) como a diferença entre o valor de C.I. dos animais de referência e o valor de C.I. dos animais condicionados (L.I. = C.I.reference- C.I.conditioned).
NOTA: O valor de C.I. dos animais de referência (C.I.reference) é o valor médio dos valores de C.I. de animais condicionados apenas com 1% de 1-propanol aquoso.
Resultados
C. elegans foi condicionada por treinamento em massa para formar memória associativa aversiva de curto prazo, emparelhando 1% de 1-propanol aquoso e HCl (pH 4,0) como CS e US, respectivamente. De acordo com o protocolo descrito acima, os animais sincronizados foram cultivados em uma bancada a um RT de 18 °C por 5 dias e foram lavados com muita delicadeza 2x com ddH2O a um RT de 18 °C. Em seguida, os animais foram condicionados com uma mistura de 1-propanol aquoso a 1% e HCl (pH 4,0) por 1 s. Também foram treinados animais com ddH2O apenas, 1% aquoso 1-propanol apenas, e HCl (pH 4,0) apenas como referências. Após o condicionamento, os animais foram lavados 1x com ddH2O. Repetimos o condicionamento 10x sem interrupção (sem ITIs). O condicionamento bem-sucedido foi alcançado repetindo o procedimento mais de 7x até 10x. Condicionar mais de 10x resultou em aprendizado menos eficiente21. Após o treinamento, os animais descansaram em alimento bacteriano por 10 min a RT (18 °C). Após serem lavados com ddH2O 3x, os animais foram transferidos para um tubo de microcentrífuga por suspensão em gelatina aquosa a 0,25% e acomodados no fundo por gravidade. Depois de remover o sobrenadante, tanto quanto possível, os animais foram suavemente ressuspensos em tampão de ensaio de quimiotaxia e, em seguida, deixados se estabelecer no fundo do tubo por gravidade.
Após a remoção do máximo de sobrenadante possível, a suspensão animal foi avistada no círculo central de uma placa de ensaio de quimiotaxia, que foi mantida a um RT de 18 °C, e então os animais foram autorizados a se mover livremente na placa por 10 min a um RT de 18 °C. Os valores de C.I. foram calculados utilizando-se a equação apresentada na Figura 3B. Como mostrado na Figura 4A, os animais condicionados com a mistura de 1% de 1-propanol e HCl não foram mais atraídos por 5% de 1-propanol manchado em placas de ágar para ensaio de quimiotaxia, enquanto os animais ingênuos e de referência foram igualmente atraídos por 5% de 1-propanol. Após o treinamento em massa (passo 3.), a memória deixou de ser observada em até 3 h20. Além disso, a memória formada pelo treinamento em massa foi sensível ao choque frio20. Esses resultados demonstram que C. elegans formou com sucesso a STM aversiva por treinamento em massa.
Os animais também foram condicionados por treinamento espaçado 10x com ITI de 10 min entre as etapas de treinamento (etapa 4). Durante o ITI, o coletor com os animais foi colocado em um gramado bacteriano sobre uma placa de NGM de 6 cm a um RT de 18 °C. Os animais condicionados pelo treinamento espaçado com uma mistura de 1% aquoso 1-propanol e HCl (pH 4,0) não foram mais atraídos para 5% de 1-propanol em comparação com os animais tratados apenas com 1% de 1-propanol, HCl (pH 4,0) apenas, ou ddH2O apenas (Figura 4B). Após o treinamento espaçado, os animais mantiveram a memória por mais de 12 h20,21. Além disso, a memória não se formou quando os animais foram tratados com inibidores de tradução ou transcrição e foi resistente ao choque frio20,21. Portanto, C. elegans formou com sucesso LTM aversivo por treinamento espaçado.
Também examinamos os efeitos de mutações em "genes de aprendizagem e memória" na formação de STM e LTM. O gene crh-1 codifica o fator de transcrição ubíquo cAMP-response element-binding protein (CREB), glr-1 e nmr-1 codificam subunidades receptoras de glutamato do tipo α-amino-3-hidroxila-5-metil-4-isoxazolpropiônico ácido (AMPA) e N-metil-D-aspartato (NMDA), respectivamente, e stau-1 codifica a isoforma Staufen da proteína de ligação ao RNA de fita dupla. Esses genes desempenham papéis essenciais no condicionamento clássico em C. elegans, Drosophila, Aplysia e camundongos. Utilizando uma mistura de 1% aquoso 1-propanol e HCl (pH 4,0), a formação de STM e LTM foi dependente de todos os genes (Figuras 5A,B).
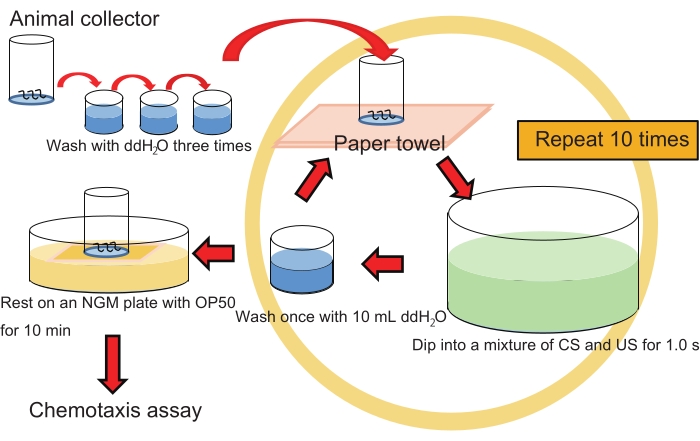
Figura 1: Esquema experimental do treinamento em massa. Clique aqui para ver uma versão maior desta figura.
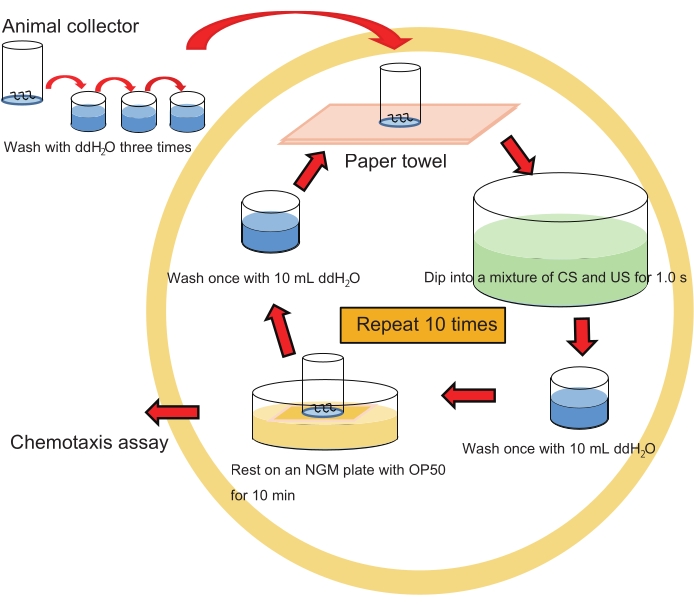
Figura 2: Esquema experimental de treinamento espaçado. Clique aqui para ver uma versão maior desta figura.
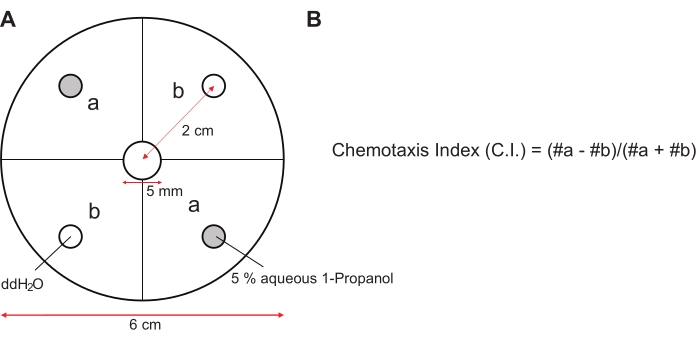
Figura 3: Ensaio de quimiotaxia e índice de quimiotaxia. (A) Representação esquemática de uma placa de ensaio de quimiotaxia. As placas de Petri (6 cm de diâmetro) foram separadas em quatro áreas, como mostrado, e 4 μL cada de 1-propanol aquoso a 5% ou ddH 2 O foram manchados diagonalmente em dois locais cada, a2cm de distância do centro. (B) Os valores do índice de quimiotaxia foram calculados a partir da equação mostrada pela contagem do número de animais nas áreas "a" e "b" após o preenchimento da quimiotaxia. Por favor, clique aqui para ver uma versão maior desta figura.
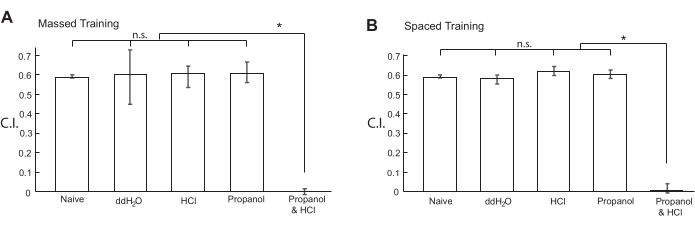
Figura 4: Valores do índice de quimiotaxia de animais condicionados com produtos químicos. Animais N2 sincronizados do tipo selvagem foram condicionados com produtos químicos indicados por (A) treinamento em massa 10x ou (B) treinamento espaçado 10x. Os fluxogramas dos protocolos de treinamento em massa e espaçados utilizados são mostrados na Figura 1 e na Figura 2, respectivamente. Após o condicionamento, os animais ficaram livres para se movimentarem por 10 min em uma placa de ágar de 6 cm para ensaio de quimiotaxia a um RT de 18 °C. Os valores de C.I. foram calculados utilizando-se a equação apresentada na Figura 3B. Os dados relativos a este valor são fornecidos no Quadro Suplementar 1. Os dados dos animais ingênuos foram replotados em ambos os painéis de figuras. O gráfico de barras mostra o 1º quartil, a mediana e o 3º quartil. Os asteriscos (*P < 0,05) indicam diferenças estatisticamente significativas determinadas por ANOVA one-way seguida do teste de comparação múltipla de Dunnett. Por favor, clique aqui para ver uma versão maior desta figura.
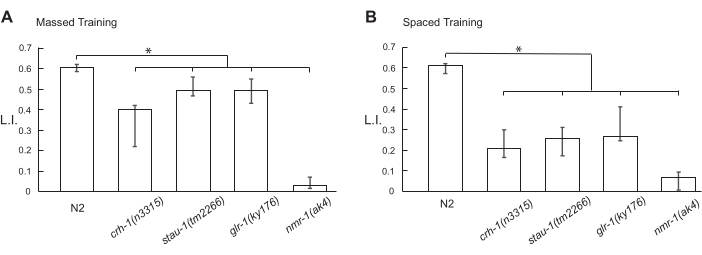
Figura 5: Valores do índice de aprendizagem de animais mutantes condicionados. Os animais N2 sincronizados do tipo selvagem e mutantes indicados foram condicionados com uma mistura de 1% aquoso 1-propanol e HCl (pH 4,0) por (A) treinamento massificado 10x ou (B) treinamento espaçado 10x. Os fluxogramas dos protocolos de treinamento em massa e espaçados utilizados são mostrados na Figura 1 e na Figura 2, respectivamente. Após o condicionamento, os animais ficaram livres para se movimentarem por 10 min em uma placa de ágar de 6 cm para ensaio de quimiotaxia a um RT de 18 °C. Os dados relativos a este valor são fornecidos no Quadro Suplementar 2. O gráfico de barras mostra o 1º quartil, a mediana e o 3º quartil. Os asteriscos (*P < 0,05) indicam diferenças estatisticamente significativas determinadas por ANOVA one-way seguida pelo teste de comparação múltipla de Dunnett. Por favor, clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Animais adultos jovens são sensíveis ao tratamento químico. Os animais N2 do dia 4 e do dia 5 do tipo selvagem após a eclosão foram treinados em massa 10x com HCl, pH 4,0, sem interrupção, e então ensaiados para quimiotaxia a 5% aquosa 1-propanol. Barras são meios ± S.E.M. (n = 19). Os asteriscos (*P < 0,05) indicam diferenças estatisticamente significativas determinadas pela ANOVA two-way seguida do teste post-hoc de Tukey-Kramer. Clique aqui para baixar este arquivo.
Tabela Suplementar 1: Dados correspondentes à Figura 4. Por favor, clique aqui para baixar esta Tabela.
Tabela Suplementar 2: Dados correspondentes à Figura 5. Por favor, clique aqui para baixar esta Tabela.
Discussão
No presente estudo, todos os reagentes foram mantidos a um TR de ~18 °C em média, e os animais foram cultivados em um banco no TR para evitar estresse aos animais. Além disso, todos os procedimentos experimentais foram realizados no RT. Os animais foram inicialmente cultivados em uma incubadora a 20 °C e, em seguida, condicionados em um banco a ~24 °C usando reagentes no RT. Nessas condições, os resultados do condicionamento foram muito variáveis. No baixo RT, C. elegans cresce lentamente e deve ser cultivado por mais de 20 °C até que os animais atinjam o estágio adulto maduro, pois os animais adultos mais jovens são mais sensíveis aos produtos químicos usados para condicionamento do que os animais adultos maduros e podem apresentar valores mais baixos de IC.
O passo mais crítico para o condicionamento bem-sucedido é a lavagem dos animais com ddH2O imediatamente após cada tratamento químico. Portanto, as tensões mecânicas e de temperatura devem ser minimizadas usando pontas de pipeta serradas, mantendo os reagentes no RT e lavando os animais muito suavemente, movendo muito lentamente o coletor de animais para cima e para baixo em ddH2O. A lavagem completa dos animais cada vez após o condicionamento pode afetar o aprendizado e a memória. As condições das placas de ensaio de quimiotaxia também afetam severamente os resultados. Placas muito secas ou muito molhadas impedem a locomoção suave dos animais. As placas foram preparadas conforme descrito na etapa 1.; uma boa placa é aquela para a qual os pontos de 4 μL de ddH2O ou 1-propanol aquoso a 5% são completamente absorvidos pelo ágar em aproximadamente 5 minutos após a mancha. Como descrito acima, as idades dos animais também são críticas para o condicionamento bem-sucedido. Animais adultos jovens são sensíveis ao tratamento mecânico e químico, resultando em desfechos variáveis, embora animais muito envelhecidos também possam não ser adequados para condicionamento.
A vida útil do 1-propanol depende de marcas e lotes e é inferior a 3 meses na RT. Quando os valores de IC de animais ingênuos piorarem, recomenda-se o uso de 1-propanol fresco para o condicionamento e ensaio de quimiotaxia.
A formação da memória pelo treinamento em massa não foi afetada pelo tratamento de animais com inibidores de tradução (cicloheximida e anisomicina) e um inibidor de transcrição (actinomicina D), enquanto a formação de memória pelo treinamento espaçado foi acentuadamente inibida pelos inibidores20,21. Além disso, a primeira memória decaiu por choque frio, enquanto a última foi retida por um período mais longo do que a primeira e foi resistente ao choque frio. Esses resultados demonstram que o primeiro é STM e o segundo é LTM, respectivamente20,21. No entanto, a memória formada pelo treinamento em massa pode consistir em STM e memória de médio prazo (intermediário), uma vez que a STM é fracamente dependente do fator de transcrição CREB (Figura 5A). Isso é consistente com o resultado de que o STM foi mantido por mais de 1 h20,21. A formação de STM e LTM é altamente dependente do nmr-1, que é expresso apenas em seis pares de neurônios (AVA, AVD, AVE, RIM, AVG e PVC) em C. elegans27,28. Nesses neurônios, portanto, os receptores NMDA podem atuar como um detector de coincidência molecular de 1% de sinais aquosos de 1-propanol e HCl (pH 4,0) para plasticidade sináptica, onde o fortalecimento sináptico necessário para STM e LTM pode resultar do disparo coincidente de neurônios pré e pós-sinápticos 29,30,31,32,33. Portanto, a memória associativa aversiva pode se formar entre os interneurônios.
Os métodos descritos no presente estudo devem ser aplicáveis para a aprendizagem olfativa apetitiva e memória associativa de curto e longo prazo utilizando o 1-nonanol como CS e o cloreto de potássio como US21. É interessante comparar os circuitos neuronais que estão envolvidos na formação de memórias apetitivas e aversivas.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Somos gratos a Takashi Murayama, Ei-ichiro Saita, Iou Ven Chang e Hitomi Ohtaki por sua assistência técnica e comentários sobre o manuscrito. As cepas foram fornecidas pelo Caenorhabditis Genetics Center, que é financiado pelo NIH National Center for Research Resources (NCRR). Este trabalho foi apoiado pelo financiamento do Okinawa Institute of Science and Technology Graduate University.
Materiais
| Name | Company | Catalog Number | Comments |
| 500 mL beaker | HARIO | B-500-H32 | |
| 10 µL pipette tips | Thermo Fisher Scientific | H-104-96RS-Q | |
| 0.2 mL pipette tips | Thermo Fisher Scientific | TTW110RS-Q | |
| 1.0 mL pipette tips | Thermo Fisher Scientific | H-111-R100NS-Q | |
| 1.5 mL plastic tubes | Eppendorf | 0030120086 | |
| 2 mL plastic tubes | Eppendorf | 0030120094 | |
| 10 mL Serological pipettes | As One | 2-5237-04 | |
| 50 mL Serological pipettes | As One | 2-5237-06 | |
| 6-well cell culture plate | Costar | 3516 | |
| Aron Alpha (Glue for plastic) | Toagosei | High Speed EX | |
| Autoclave | Tomy Digital Biology | SX-300 | |
| Bacto agar | BD | 214010 | |
| Bacto peptone | BD | 211677 | |
| Bottle top 0.2 µm filter units | Thermo Fisher Scientific | 566-0020 | |
| Bunsen burner | EISCO | SKU CH0089A | |
| Calcium chloride dihydrate | Nacalai Tesque | 06730-15 | |
| C. elegans mutant strains | Caenorhabditis Genetics Center | ||
| Cholesterol | Wako Pure Chemical Industries | 034-03002 | |
| Clear acrylic cylindrical pipe | Asahi Kasei | 3.5 cm (length), 30 mm (external diameter), 2 mm (thickness) | |
| Crystallizing dish | Pyrex | 3140-80 | |
| Dental burner | Phoenix-Dent | APT-3 | |
| Di-potassium hydrogen phosphate | Nacalai Tesque | 28726-05 | |
| E. coli OP50 | Caenorhabditis Genetics Center | ||
| Electric pipetter | Drummond Scientific | 4-000-101 | |
| Gelatin | Wako Pure Chemical Industries | 073-06295 | |
| Glass Petri dishes (10 cm in diameter) | As One | Trade FLAT Mark | |
| Heating magnetic stirrer | Thermo Fisher Scientific | SP131324 | |
| Hydrochloric acid | Nacalai Tesque | 37345-15 | |
| Incubator | SANYO | MIR-553 | |
| Kimwipes S-200 | Nippon Paper Crecia | 62011 | |
| Laboratory coat | TOYO LINT FREE | FH240C | |
| Magnesium sulfate heptahydrate | Nacalai Tesque | 21002-85 | |
| Magnetic stirrer bar | SANSYO | 93-5412 | |
| Metal spatula | FUJIFILM Wako | 647-06531 | |
| Nitrile gloves | Kimberly-Clark | KC100 | |
| Nylon mesh (mesh size: 30 μm) | SEFAR | NY30-HD | |
| P10 pipetman | Gilson | F144802 | |
| P200 pipetman | Gilson | F123600 | |
| P1000 pipetman | Gilson | F123602 | |
| pH meter | HORIBA | Navi F-52 | |
| Plastic Petri dishes (9 cm in diameter) | IWAKI | SH90-15E | |
| Plastic Petri dishes (6 cm in diameter) | SARSTEDT | 82.1194.500 | |
| Plastic weighing boats | As One | 1-5233-01 | |
| Platinum wire for a worm pick | Nilaco | PT-351265 | |
| 1-Propanol | SIGMA-ALDRICH | 279544 | |
| Potassium dihydrogen phosphate | Nacalai Tesque | 28721-55 | |
| Safety goggles | Kimberly-Clark | #25646 | |
| Sodium chloride | Nacalai Tesque | 31320-05 | |
| Stereomicroscope | Olympus | SZX16 | |
| Tooth picks | |||
| Water purification sysytem | Merck | Elix Essential 10 UV | |
| Water urification sysytem | Merck | Milli-Q Synthesis A10 | |
| Weighing balance | METTLER | TOREDO | |
| Wild type C. elegans strain N2 | Caenorhabditis Genetics Center |
Referências
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Cook, S. J., et al. Whole-animal connectomes of both Caenorhabditis elegans sexes. Nature. 571 (7763), 63-71 (2019).
- Witvliet, D., et al. Connectomes across development reveal principles of brain maturation. Nature. 596, 257-261 (2021).
- Hedgecock, E. M., Russell, R. L. Normal and mutant thermotaxis in the nematode Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 72 (10), 4061-4065 (1975).
- Mohri, A., et al. Genetic control of temperature preference in the nematode Caenorhabditis elegans. Genetics. 169 (3), 1437-1450 (2005).
- Wen, J. Y. M., et al. Mutations that prevent associative learning in C. elegans. Behavioral Neuroscience. 111 (2), 354-368 (1997).
- Saeki, S., Yamamoto, M., Iino, Y. Plasticity of chemotaxis revealed by paired presentation of a chemoattractant and starvation in the nematode Caenorhabditis elegans. Journal of Experimental Biology. 204 (10), 1757-1764 (2001).
- Tomioka, M., et al. The insulin/PI3-kinase pathway regulates salt chemotaxis learning in Caenorhabditis elegans. Neuron. 51 (5), 613-625 (2006).
- Torayama, I., Ishihara, T., Katsura, I. Caenorhabditis elegans integrates the signals of butanone and food to enhance chemotaxis to butanone. Journal of Neuroscience. 27 (4), 741-750 (2007).
- Kaufman, A. L., Ashraf, J. M., Corces-Zimmerman, M. R., Landis, J. N., Murphy, C. T. Insulin signaling and dietary restriction differentially influence the decline of learning and memory with age. PLoS Biology. 8 (5), 1000372 (2010).
- Stein, G. M., Murphy, C. T. C. elegans positive olfactory associative memory is a molecularly conserved behavioral paradigm. Neurobiology of Learning and Memory. 115, 86-94 (2014).
- Rahmani, A., Chew, Y. L. Investigating the molecular mechanisms of learning and memory using Caenorhabditis elegans. Journal of Neurochemistry. 159 (3), 417-451 (2021).
- Bargmann, C. I. Chemosensation in C. elegans. WormBook. 25, 1-29 (2006).
- Gray, J. M., Hill, J. J., Bargmann, C. I. A circuit for navigation in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3184-3191 (2005).
- Cho, C. E., Brueggemann, C., L'Etoile, N. D., Bargmann, C. I. Parallel encoding of sensory history and behavioral preference during Caenorhabditis elegans olfactory learning. eLife. 5, 14000 (2016).
- Juang, B. T., et al. Endogenous nuclear RNAi mediates behavioral adaptation to odor. Cell. 154 (5), 1010-1022 (2013).
- Neal, S. J., et al. Feeding state-dependent regulation of developmental plasticity via CaMKI and neuroendocrine signaling. eLife. 4, 10110 (2015).
- Castellucci, V. F., Kandel, E. R. A quantal analysis of the synaptic depression underlying habituation of the gill-withdrawal reflex in Aplysia. Proceedings of the National Academy of Sciences of the United States of America. 71 (12), 5004-5008 (1974).
- Klein, M., Kandel, E. R. Mechanism of calcium current modulation underlying presynaptic facilitation and behavioral sensitization in Aplysia. Proceedings of the National Academy of Sciences of the United States of America. 77 (11), 6912-6916 (1980).
- Amano, H., Maruyama, I. N. Aversive olfactory learning and associative long-term memory in Caenorhabditis elegans. Learning & Memory. 18 (10), 654-665 (2011).
- Nishijima, S., Maruyama, I. N. Appetitive olfactory learning and long-term associative memory in Caenorhabditis elegans. Frontiers in Behavioral Neuroscience. 11, 80 (2017).
- Morrison, G. E., Wen, J. Y. M., Runciman, S., vander Kooy, D. Olfactory associative learning in Caenorhabditis elegans is impaired in lrn-1 and lrn-2 mutants. Behavioral Neuroscience. 113 (2), 358-367 (1999).
- Morrison, G. E., vander Kooy, D. A mutation in the AMPA-type glutamate receptor, glr-1, blocks olfactory associative and nonassociative learning in Caenorhabditis elegans. Behavioral Neuroscience. 115 (3), 640-649 (2001).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Sambongi, Y., et al. Caenorhabditis elegans senses protons through amphid chemosensory neurons: Proton signals elicit avoidance behavior. Neuroreport. 11 (10), 2229-2232 (2000).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Brockie, P. J., Madsen, D. M., Zheng, Y., Mellem, J., Maricq, A. V. Differential expression of glutamate receptor subunits in the nervous system of Caenorhabditis elegans and their regulation by the homeodomain protein UNC-42. Journal of Neuroscience. 21 (5), 1510-1522 (2001).
- Brockie, P. J., Mellem, J. E., Hills, T., Madsen, D. M., Maricq, A. V. The C. elegans glutamate receptor subunit NMR-1 is required for slow NMDA-activated currents that regulate reversal frequency during locomotion. Neuron. 31 (4), 617-630 (2001).
- Gustafsson, B., Wingstrom, H. Physiological mechanisms underlying long-term potentiation. Trends in Neuroscience. 11 (4), 156-162 (1988).
- Kauer, J. A., Malenka, R. C., Nicoll, R. A. A persistent postsynaptic modification mediates long-term potentiation in the hippocampus. Neuron. 1 (10), 911-917 (1988).
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: Long-term potentiation in the hippocampus. Nature. 361 (6407), 31-39 (1993).
- Bailey, C. H., Giustetto, M., Huang, Y. Y., Hawkins, R. D., Kandel, E. R. Is heterosynaptic modulation essential for stabilizing Hebbian plasticity and memory. Nature Reviews Neuroscience. 1 (1), 11-20 (2000).
- Miyashita, T., et al. Mg2+ block of Drosophila NMDA receptors is required for long-term memory formation and CREB-dependent gene expression. Neuron. 74 (5), 887-898 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados