Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Rekonstituering og karakterisering af actin-mikrotubuli kompositter med indstillelig motordrevet dynamik og mekanik
ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …Dette papir præsenterer protokoller til konstruktion og karakterisering af justerbare tredimensionelle sammensatte netværk af sammenfiltrede actinfilamenter og mikrotubuli. Kompositter gennemgår aktiv omstrukturering og ballistisk bevægelse, drevet af myosin II og kinesinmotorer, og er indstillet af de relative koncentrationer af actin, mikrotubuli, motorproteiner og passive tværbindinger.
Det sammensatte cytoskelet, der omfatter interagerende netværk af semifleksible actinfilamenter og stive mikrotubuli, omstrukturerer og genererer kræfter ved hjælp af motorproteiner såsom myosin II og kinesin til at drive nøgleprocesser såsom migration, cytokinese, vedhæftning og mekanosensing. Mens actin-mikrotubulus-interaktioner er nøglen til cytoskelettets alsidighed og tilpasningsevne, er en forståelse af deres samspil med myosin- og kinesinaktivitet stadig spirende. Dette arbejde beskriver, hvordan man konstruerer justerbare tredimensionelle sammensatte netværk af sammenfiltrede actinfilamenter og mikrotubuli, der gennemgår aktiv omstrukturering og ballistisk bevægelse, drevet af myosin II- og kinesinmotorer og er indstillet af de relative koncentrationer af actin, mikrotubuli, motorproteiner og passive tværbindinger. Protokoller til fluorescensmærkning af mikrotubuli og actinfilamenter for mest effektivt at visualisere sammensat omstrukturering og bevægelse ved hjælp af multispektral konfokal billeddannelse er også detaljerede. Endelig præsenteres resultaterne af dataanalysemetoder, der kan bruges til kvantitativt at karakterisere ikke-ligevægtsstruktur, dynamik og mekanik. Genskabelse og undersøgelse af denne justerbare biomimetiske platform giver værdifuld indsigt i, hvordan koblet motoraktivitet, sammensat mekanik og filamentdynamik kan føre til utallige cellulære processer fra mitose til polarisering til mekano-sensation.
Cytoskelettet er et dynamisk sammensat netværk af interagerende biopolymerer, der giver strukturel og mekanisk støtte til celler. Tilknyttede molekylære motorer og bindende proteiner omstrukturerer og tilpasser cytoskelettet for at give celler mulighed for at vokse, ændre form, stivne, bevæge sig og endda selvhelbrede, hvilket muliggør utallige cellulære processer lige fra migration og division til mekanosenserende 1,2. Ud over dets betydning i cellulær biofysik er cytoskelettet også et kendetegnende eksempel på aktivt stof med potentielle materialeanvendelser lige fra sårheling og lægemiddelafgivelse til filtrering og blød robotik 1,3,4,5,6,7,8,9.
De to nøgleegenskaber, der giver cytoskelettet sin unikke strukturelle og mekaniske mangfoldighed og multifunktionalitet, er: 1) dets sammensatte natur, der omfatter flere interagerende proteinfilamenter, såsom semifleksible actinfilamenter og stive mikrotubuli samt deres tilknyttede bindings- og tværbindingsproteiner 3,5,10; og 2) dets evne til kontinuerligt at omstrukturere, bevæge sig, grove og udføre arbejde via energiforbrugende motorer, såsom myosiner og kinesiner, der skubber og trækker i de filamentøse proteiner 1,7,11,12,13. Mens denne elegante kompleksitet gør det muligt for cytoskelettet at formidle processer så forskellige som cellemotilitet, cytokinese og sårheling 3,6,7,11, hæmmer det forskernes evne til at reproducere cytoskelettets signatur in vivo-egenskaber i rekonstituerede in vitro-systemer.
Den nuværende grænserekonstitutionsindsats fokuserer på kompositter af sammenfiltrede og tværbundne actinfilamenter og mikrotubuli 3,10,14,15,16,17, kraftgenererende actomyosinnetværk2,8,18,19,20,21 og aktiv nematik drevet af kinesinmikrotubuli interaktioner 22,23,24,25,26. Steady-state actin-mikrotubulus-kompositter har vist sig at vise nye mekaniske egenskaber15,16,27, såsom forbedret filamentmobilitet og øget stivhed sammenlignet med enkeltkomponentsystemer 27. Undersøgelser af in vitro actomyosinsystemer har rapporteret en bred vifte af strukturelle og dynamiske egenskaber, der afhænger af koncentrationerne af actin, myosin og tværbindinger 28,29,30,31. For eksempel gennemgår actomyosinnetværk med tilstrækkelig tværbinding storskala sammentrækning og grovhed 2,28,30,32,33,34,35,36, mens netværk uden tværbindinger viser hurtig, destabiliserende flow og brister 19,29 . Rekonstitueret mikrotubuli-baseret aktiv nematik, der bruger klynger af kinesinmotorer til tværbinding og træk på mikrotubulusbundter, er rapporteret at udvise langvarige turbulente strømme, forlængelse, spændning, brud og heling 12,22,23,24,25,37,38,39,40,41, 42,43,44,45,46,47.
For nylig har actin-mikrotubuluskompositter drevet af myosin II mini-filamenter vist sig at føre til mere ordnet sammentrækning og netværksintegritet sammenlignet med den uordnede strømning og netværksbrud, som actomyosinnetværk uden tværbindinger udviser 17,26,48. Desuden optimeres kombinationen af sammensat robusthed og kraftgenerering, når actin og mikrotubuli er til stede ved sammenlignelige koncentrationer. Nøgle emergente funktioner i denne region af formuleringsrum omfatter forbedret mekanisk styrke 26, koordineret bevægelse af actin og mikrotubuli26, stabil vedvarende sammentrækning og mesoskala omstrukturering17.
Her beskrives protokoller til at konstruere og indstille sammenfiltrede og tværbundne kompositter af mikrotubuli og actinfilamenter, der skubbes ud af ligevægt af myosin II minifilamenter og kinesinklynger, der virker på henholdsvis actinfilamenter og mikrotubuli (figur 1). Dynamikken, strukturen og mekanikken i denne klasse af kompositter kan indstilles af de relative koncentrationer af filamenter, motorer og tværbindinger for at udvise et rigt faserum med advektiv og turbulent strømning, isotrop sammentrækning, acceleration, deceleration, deblanding, afstivning, afslapning og brud. Fokus for dette arbejde er på at forberede og indstille denne klasse af aktive cytoskeletale kompositter. For at hjælpe forskere med at benchmarke og karakterisere de beskrevne aktive kompositter er effektive billeddannelsesmetoder ved hjælp af multispektral konfokal mikroskopi imidlertid også detaljeret. Endelig præsenteres resultater af centrale beregningsanalysemetoder, der kan bruges til at måle dynamikken, strukturen og mekanikken i kompositterne. Forskere opfordres til at vedtage disse metoder - som omfatter differentiel dynamisk mikroskopi (DDM), rumlig billedautokorrelation (SIA) og partikelbilledvelocimetri (PIV) - da de er optimeret til at karakterisere den komplekse dynamik og strukturelle mangfoldighed af kompositterne 17,26,49.
Trinene beskrevet nedenfor fokuserer på at forberede kompositterne og billeddanne dem ved hjælp af konfokal mikroskopi. Protokoller, der beskriver dataanalyse efter indsamling og optiske pincetmålinger, kan findes i tidligere værker 17,26,48,50 og leveres efter anmodning. Alle materialer er angivet i den medfølgende materialetabel.
1. Forbered silaniserede dækslips og mikroskopglider for at forhindre adsorption af proteiner til kammeroverflader
BEMÆRK: Dette er en 2-dages proces. Silaniserede dias kan fremstilles op til 1 måned før brug.
- Placer nr. 1 dækslips (24 mm x 24 mm) og mikroskopglas (1 in x 3 in) i et udpeget stativ, der passer i plasmarenseren. Placer stativet i plasmarens og kør i 20 min.
- Overfør dæksler og dias til et nyt stativ, der kun er beregnet til brug med silan, og placer stativet i glasbeholderen for at rengøre glassene som beskrevet nedenfor.
- Dyk dækslips og dias i 100% acetone i 1 time. Nedsænk dæksler og dias i 100% ethanol i 10 min.
- Nedsænk dæksler og glider i deioniseret vand (DI) i 5 min. Gentag rengøringstrinnene to gange mere.
- Nedsænk dæksler og rutsjebaner i frisklavet 0,1 M KOH i 15 min. Dyk dæksler og dias i frisk DI i 5 min. Gentag dette trin to gange mere.
- Lufttørre dæksler og rutsjebaner i 10 min. Behandl rensede dæksler og dias med silan for at producere hydrofobe overflader som beskrevet nedenfor.
BEMÆRK: Udfør følgende trin i en røghætte.- Nedsænk tørrede dæksler og dias i 2% silan (opløst i toluen) i 5 min. Brug en tragt til at hælde silan tilbage i den udpegede flaske for at genbruge op til fem gange.
- Nedsænk dæksler og dias i 100% ethanol i 5 min. Udskift ethanol med frisk ethanol. Dyk dækslips og dias i 5 min.
- Dyk dæksler og dias i frisk DI i 5 min. Gentag ethanol- og DI-vasketrinnet to gange mere med frisk ethanol og DI hver gang. Lufttørre dæksler og rutsjebaner i 10 min.
2. Fremstilling af aktiv actin-mikrotubuluskomposit drevet af myosin mini-filamenter
- Fjern inaktiv myosin via actinfilamentbinding og udfør pull-down via ultracentrifugering som beskrevet nedenfor.
- Polymeriser actin i filamenter. Ved hjælp af en præcisionsmikropipette og sterile pipetspidser kombineres i et mikrocentrifugerør: 1,87 μL DI, 1,3 μL 10x G-buffer, 1,3 μL 10x F-buffer, 1,63 μL 4 M KCl, 4,53 μL actin (47,6 μM) og 1,08 μL 100 μM phalloidin.
BEMÆRK: For at sikre tilstrækkelig polymerisation skal actinkoncentrationen og actin: phalloidin molært forhold være henholdsvis 18,4 μM og 2: 1. - Pipet forsigtigt opløsningen op og ned for at blande og sæt derefter på is i mørket i ≥1 time. Afkøles ultracentrifuge til 4 °C. Myosin aliquot fjernes fra -80 °C og lægges på is.
BEMÆRK: Gennemfør trin 2.2 på dette tidspunkt, mens actin polymeriserer. - Efter ≥1 time actinpolymerisation tilsættes 1,3 μL 10 mM ATP og 2 μL 19 μM myosin til det polymeriserede actin.
BEMÆRK: Actin:myosin molære forhold skal være >5 for at sikre tilstrækkelig fjernelse af inaktive myosinmotorer (dvs. døde hoveder). - Pipet forsigtigt opløsningen op og ned for at blande. Overfør til et ultracentrifuge grade rør.
Centrifuge ved 4 °C og 121.968 x g i 30 min.
- Polymeriser actin i filamenter. Ved hjælp af en præcisionsmikropipette og sterile pipetspidser kombineres i et mikrocentrifugerør: 1,87 μL DI, 1,3 μL 10x G-buffer, 1,3 μL 10x F-buffer, 1,63 μL 4 M KCl, 4,53 μL actin (47,6 μM) og 1,08 μL 100 μM phalloidin.
- Forbered co-sammenfiltret sammensat netværk af actinfilamenter og mikrotubuli som beskrevet nedenfor.
BEMÆRK: Begynd 30 min før myosin spin-down (trin 2.1.4).- Indstil en varmeblok til 37 °C. Brug en præcisionsmikropipette og sterile pipetspidser til at tilføje følgende til et mikrocentrifugerør: 13,9 μL PEM, 3 μL 1% Tween20, 1,55 μL 47,6 μM actin, 0,36 μL 34,8 μM R-actin, 0,3 μL 250 mM ATP, 0,87 μL 100 μM phalloidin, 1,91 μL 5-488-tubulin, 0,3 μL 100 mM GTP, og 0,75 μL af 200 μM Taxol, til et samlet volumen på 23 μL.
BEMÆRK: De anførte koncentrationer af actin og tubulin er for en sammensætning med 2,9 μM actin og 2,9 μM tubulin. Total proteinkoncentration er c = cA + c T = 5,8 μM og molær actinfraktion er c A / (c A + cT) = Φ A = 0,5. Se trin 2.5 for at justere disse værdier. - Opløsningen ledes forsigtigt op og ned for at blande og placeres på en 37 °C varmeblok, der er beskyttet mod lys i 1 time.
- Indstil en varmeblok til 37 °C. Brug en præcisionsmikropipette og sterile pipetspidser til at tilføje følgende til et mikrocentrifugerør: 13,9 μL PEM, 3 μL 1% Tween20, 1,55 μL 47,6 μM actin, 0,36 μL 34,8 μM R-actin, 0,3 μL 250 mM ATP, 0,87 μL 100 μM phalloidin, 1,91 μL 5-488-tubulin, 0,3 μL 100 mM GTP, og 0,75 μL af 200 μM Taxol, til et samlet volumen på 23 μL.
- Forbered prøvekamre til konfokale billeddannelseseksperimenter som beskrevet nedenfor.
BEMÆRK: Gennemfør trin 2.1.4 og 2.2.2 i ventetider.- Placer to silaniserede dias side om side på en kogeplade (slukket), læg to strimler termoplastisk tætningsfilm over diasene ~ 3 mm fra hinanden, og læg to silaniserede dæksler over den termoplastiske tætningsfilm for at danne et prøvekammer.
- Drej kogepladen på lav indstilling, indtil dækslen binder sig fast til dias med smeltet termoplastisk tætningsfilm (~ 1-2 min). Tryk ned med jævnt tryk for at sikre limning, mens du opretholder ~ 100 μm afstand mellem de to overflader.
- Fjern kamre og sluk for kogeplade. Etiketkamre med (+) og (-). (+) kammeret vil være til den aktive prøve (med myosin), og (-) kammeret vil være kontrollen (ingen myosin). Sørg for, at hvert kammer kan rumme ≤10 μL væske.
- Forbered prøver til billedet som beskrevet nedenfor.
BEMÆRK: Det er vigtigt at fuldføre dette trin umiddelbart efter, at trin 2.1 og 2.2 er fuldført.- Myosin-actinprøven fjernes forsigtigt fra ultracentrifugen (trin 2.1.4), og der piperes straks de øverste 7,5 μL af supernatanten og overføres til et nyt mikrocentrifugerør.
- Actinmikrotubulusprøven fjernes fra varmeblokken, og der blandes forsigtigt 1,5 μL 10x D-glucose, 1,5 μL 10x GOC og 1,5 μL 1 mM blebbistatin. Opløsningen opdeles i to 13,7 μL alikvoter og mærkes som (+) og (-).
- Der blandes 1,28 μL supernatant fra trin 2.4.1 til (+) aliquot. Bland 1,28 μL DI til (-) aliquoten. Hver opløsning ledes langsomt ind i det tilsvarende kammer (trin 2.3) via kapillær virkning. Pas på ikke at indføre luftbobler i kanalen.
- Forsegl de to åbne ender af hver kanal med hurtigtørrende epoxy eller UV-lim. Sørg for, at klæbemidlet er helt tørt, inden det placeres på mikroskopet. Billede umiddelbart som beskrevet i trin 3.
BEMÆRK: UV-lim er fordelagtigt, fordi det hærder næsten øjeblikkeligt ved UV-eksponering. Men fordi blebbistatin er UV-følsomt, er det vigtigt kun at belyse limen lokalt (ved kanterne af prøvekammeret) ved hjælp af en lille UV-stav for at undgå at deaktivere blebbistatin.
- Valgfrit: Varier proteinkoncentrationerne for at justere kompositternes dynamik og struktur.
BEMÆRK: Følgende trin foreslås ændringer af ovenstående trin for at variere koncentrationerne af actin, mikrotubuli og myosin, hvis det ønskes.- Følg de trin, der er beskrevet ovenfor, bortset fra følgende ændringer i trin 2.2.1 og 2.4.3.
- For at variere koncentrationerne af actin og mikrotubuli og derved justere c og ΦA øges eller formindskes volumenet af actin, R-actin og 5-488-tubulin, der anvendes i trin 2.2.1, som ønsket26. Når du varierer actinkoncentrationen, justeres R-actin og phalloidin molære koncentrationer proportionalt for at opretholde de samme molære forhold med actin. Volumenet af PEM justeres, således at blandingens endelige volumen forbliver 23 μL. Alle andre komponentvolumener og koncentrationer forbliver de samme.
- For at variere myosinkoncentrationen skal du justere volumenet af myosin tilsat til (+) aliquot i trin 2.4.3 efter ønske. Juster DI-volumenet, der er føjet til (-) aliquoten i overensstemmelse hermed. Juster PEM-volumen i trin 2.2.1 for at tage højde for stigningen eller faldet i myosin (+) og DI (-) volumen, hvilket sikrer, at det endelige volumen af hver prøve ((+) og (-)) er 14,98 μL.
3. Billeddannelse og karakterisering af aktive kompositter ved hjælp af konfokal mikroskopi
- For at afbilde actomyosin-mikrotubuluskompositter, der er fremstillet i trin 2, skal du bruge et laserscanningskonfokalmikroskop (LSCM) eller lignende mikroskop med et 60x 1,4 NA olienedsænkningsmål. For samtidig at visualisere actinfilamenter og mikrotubuli i separate fluorescenskanaler skal du bruge en 561 nm laser med 565/591 nm excitations- / emissionsfiltre og en 488 nm laser med 488/525 nm excitation / emissionsfiltre.
- Prøvekammeret anbringes på mikroskopet, således at kontrolkanalen placeres direkte over målet. Sørg for, at der er en oliegrænseflade mellem målet og dækslippet.
- Brug fasekontrolelementerne til at bringe kontrolelementet i fokus, og find derefter begge overflader i prøvekammeret. Flyt z-positionen til midten af prøvekammeret. Kontroller, om der er klare trådformede netværk som vist i figur 2.
- Stadig visualisering af kontrolkammeret justerer intensiteten af hver laser for at muliggøre samtidig visualisering af actinfilamenter og mikrotubuli. Oprethold den lavest mulige laserintensitet for at forhindre fotoblegning (mere udbredt i actinkanalen) og blød igennem (typisk fra mikrotubuli ind i actinkanalen).
- For at karakterisere det inaktive kontroleksempel skal du indsamle tre tidsserier (videoer) på 256 x 256 kvadratpixel (213 μm x 213 μm) billeder ved 2,65 fps i alt ≥1000 billeder. Hver tidsserie samles i et andet område af prøvekammeret adskilt af ≥500 μm. Sørg for, at der er minimal detekterbar bevægelse og ingen strømning eller omstrukturering.
- Luk 488 nm laseren af, og brug scenekontrollerne til at flytte til (+) kammeret.
- Brug 568 nm laseren til at visualisere mikrotubuli i (+) kanalen for at sikre korrekt netværksdannelse (figur 2) og identificere prøvekammerets aksiale centrum (som kan være forskelligt fra kontrolkammerets center z-position).
- Tænd for 488 nm laseren, og gentag trin 3.5 ovenfor med følgende ændringer. Saml tidsserier i op til 45 minutter, og stop anskaffelsen, når prøven enten bevæger sig ud af synsfeltet, brister eller fotobleer. Optag 5-10 tidsserier og hold styr på det tidspunkt, hvor hver tidsserie begynder i forhold til starten af den første tidsserie.
- Analyser data ved hjælp af DDM, SIA og PIV som beskrevet i figur 3, figur 4, figur 5 og tidligere 17,48,50,51.
BEMÆRK: 488 nm laseren aktiverer lokalt myosin ATPase-aktivitet ved at deaktivere blebbistatin, så den skal kun tændes ved starten af dataindsamlingen, således at t = 0 er i starten af tidsserien. Disse anskaffelsesparametre er optimeret til differentiel dynamisk mikroskopi (DDM) analyse som tidligere26.
4. Fremstilling af aktive actin-mikrotubuluskompositter drevet af kinesinmotorer
BEMÆRK: Følgende trin opretter actin-mikrotubulus-kompositter, der drives ud af ligevægt af kinesinmotorer eller en kombination af kinesin og myosin50.
- Forbered kinesin og myosin motorer som beskrevet nedenfor.
- Hvis du inkorporerer myosin, skal du følge trin 2.1.
- For at danne kinesinmotorklynger, der binder og udøver kræfter mellem par mikrotubuli, skal du bruge en mikropipette og sterile pipetspidser til at tilføje følgende til et sterilt 1,5 ml mikrocentrifugerør:1,16 μL PEM, 2,74 μL 8,87 μM kinesin dimers, 7,29 μL 83,3 μM NeutrAvidin, 0,81 μL 2mM DTT . Bland forsigtigt ved at pipettere opløsningen op og ned og inkuberes beskyttet mod lys (brug et sort mikrocentrifugerør eller indpakning i folie) i 30 minutter ved 4 °C.
BEMÆRK: Det molære forhold mellem kinesin dimers og NA er 1:25.
- Følg trin 2.3 for at forberede prøvekamre og lave tre kamre i stedet for to. Udfør dette trin under kinesinkubation (trin 4.1.2) og myosin ultracentrifugering (trin 4.1.1).
- Forbered co-sammenfiltret sammensat netværk af actinfilamenter og mikrotubuli.
- Indstil varmeblokken til 37 °C. Brug en mikropipette og sterile pipetspidser til at tilføje følgende til et sterilt 1,5 ml mikrocentrifugerør: 3,21 μL PEM, 4,5 μL 1% Tween20, 2,18 μL 47,6 μM actin, 3,46 μL 5-R-tubulin, 4,5 μL 100 mM ATP, 4,5 μL 10 mM GTP, 1,13 μL 200 μM Taxol og 1,57 μL 20 μM 488-phalloidin. Sørg for, at det samlede volumen er 25 μL.
- Opløsningen ledes forsigtigt op og ned for at blande og placeres på 37 °C varmeblokken, der er beskyttet mod lys i 1 time. Fjern røret fra varmeblokken, og brug en mikropipette til forsigtigt at blande 0,84 μL 100 μM phalloidin i. Inkuberes i 5-10 minutter ved stuetemperatur, beskyttet mod lys.
BEMÆRK: Tilføjelse af phalloidin på dette trin, snarere end i trin 4.3.1, forbedrer fluorescensmærkningen af actinfilamenter, da 488-phalloidin ikke behøver at konkurrere med umærket phalloidin for actinbindingssteder.
- Forbered aktive kompositter til konfokal billeddannelse.
- Der tilsættes 1,13 μL 200 μM blebbistatin, 1,35 μL 10x Glu og 1,35 μL 10x GOC til opløsningen fra trin 4.3.2 og blandes forsigtigt ved at pipettere op og ned. Opløsningen opdeles i tre 10 μL aliquoter og mærkes som (K), (K+M) og (-).
- Der blandes 2,54 μL myosin fra trin 2.1.4 til (K+M) aliquot. Bland i 2,54 μL PEM til (K) og (-) aliquots.
- Brug en mikropipette og sterile pipetspidser til at tilføje 2,5 μL kinesinklynger fra trin 4.1.2 til (K) og (K+M) aliquoter. Pipet op og ned for at blande. Bland 2,5 μL PEM til (-) ved hjælp af samme teknik.
BEMÆRK: De anførte koncentrationer af actin og tubulin er for en sammensat med 2,32 μM actin og 3,48 μM tubulin. Total proteinkoncentration er c = cA + c T = 5,8 μM og molær actinfraktion er c A / (c A + cT) = Φ A = 0,4. Kinesin- og myosinkoncentrationer er henholdsvis 0,35 μM og 0,47 μM. Se trin 2.5 for generelle retningslinjer for justering af c A, cT, c og ΦA. - Ved hjælp af en mikropipette ledes langsomt hver opløsning ind i den tilsvarende kanal i de forberedte prøvekamre (trin 4.2) via kapillær virkning. Skub meget langsomt og forsigtigt ned på pipetten for ikke at indføre luftbobler i kanalen.
- Forsegl de to åbne ender af hver kanal med hurtigtørrende epoxy eller UV-hærdelig lim. Sørg for, at klæbemidlet er helt tørt, inden det placeres på mikroskopet.
BEMÆRK: Det er vigtigt, at dette trin udføres hurtigt for at minimere den tid, kinesin virker uden at blive overvåget. Af denne grund anbefales epoxy, der hærder på 1 min (i stedet for 5 eller 10 min). UV-hærdelig lim er fordelagtig i denne henseende, fordi den hærder næsten øjeblikkeligt ved UV-eksponering.
- Billede forberedte prøver straks efter trin 3, bortset fra følgende vigtige ændringer. Fordi kinesin ikke styres af lysaktivering, begynder det at virke umiddelbart efter trin 4.4.3, så marker denne gang som t = 0. For at afbilde sammensætningen så tæt på den oprindelige inaktive tilstand (t = 0) som muligt skal du først afbilde kanalerne (K) og (K+M) og notere den tid, der er gået mellem trin 4.4.3 og begyndelsen af dataindsamlingen (trin 3.8). I praksis er denne forløbne tid ~ 5 min.
5. Inkorporering af passive tværbindinger i aktive kompositter
BEMÆRK: Disse trin beskriver, hvordan man bruger biotinylerede actin- og tubulinunderenheder og NeutrAvidin (NA) til passivt at krydse actin til actin (A-A) eller mikrotubuli til mikrotubuli (M-M) i de aktive kompositter beskrevet i trin 4.
- Forbered A-A- eller M-M-tværbindingskomplekser med biotinylerede proteiner (biotin-actin eller biotin-tubulin), NA og biotin i et forhold på 2: 2: 1 biotin-actin / tubulin: biotin: NA. Start denne proces før trin 4 .
- For A-A-tværbindinger skal du bruge en mikropipette og sterile pipetspidser til at tilføje 2 μL 11,6 μM biotin-actin, 1,39 μL 8,33 μM NA, 2,27 μL 1,02 μM biotin og 4,34 μL PEM til et mikrocentrifugerør. Bland forsigtigt ved at pipettere op og ned.
- Til M-M-tværbindinger skal du bruge en mikropipette og sterile pipetspidser til at tilføje 1,86 μL 4,55 μM biotin-tubulin, 1,11 μL 8,33 μM NA, 1,82 μL 1,02 μM biotin og 5,21 μL PEM til et mikrocentrifugerør. Bland forsigtigt ved at pipettere op og ned.
- Røret/rørene fra trin 5.1.1 og/eller 5.1.2 pakkes ind i termoplastisk tætningsfilm for at skabe en vandtæt forsegling. Anbring i en flotationsflåde i et temperaturstyret sonikatorbad indstillet til 4 °C.
- Sonicat i 90 minutter ved 4 °C. I praksis er det bedst at sætte sonikatoren i et koldt rum og tilføje ispakker til sonikeringsbadet for at opretholde lav temperatur.
- Hvis du vil inkorporere tværbindingskomplekser i prøver til billeddannelse, skal du følge trin 4.3 og ændre trin 4.3.1 som beskrevet nedenfor for A-A-tværbinding (trin 5.2.1) eller M-M-tværbinding (trin 5.2.2).
- Til A-A-tværbinding kombineres følgende i et mikrocentrifugerør: 1,94 μL PEM, 4,50 μL 1% Tween20, 2,18 μL 47,6 μM actin, 3,46 μL 45,5 μM 5-R-tubulin, 1,13 μL A-A-tværbindinger (trin 5.1.1), 4,50 μL 100 mM ATP, 4,50 μL 10 mM GTP, 1,13 μL 200 μM Taxol, og 1,57 μL 20 μM 488-phalloidin. Sørg for, at det samlede volumen er 25 μL.
- For M-M-tværbinding kombineres følgende i et mikrocentrifugerør: 1,97 μL PEM, 4,50 μL 1% Tween20, 2,18 μL 47,6 μM actin, 3,76 μL 45,5 μM 5-R-tubulin, 1,13 μL 1:4 fortynding af M-M tværbindinger (trin 5.1.2), 4,50 μL 100 mM ATP, 4,50 μL 10 mM GTP, 1,13 μL 200 μM Taxol, og 1,57 μL 20 μM 488-phalloidin. Sørg for, at det samlede volumen er 25 μL.
- Følg trin 4.3.2-4.5 med de specifikke koncentrationer for et tværbindings-/actinmolarforhold på RA = 0,02 og krydsbinding:tubulin molært forhold på RT = 0,005. Disse R A- og RT-værdier resulterer i lignende længder mellem tværbindinger langs actinfilamenter og mikrotubuli (d A 60 nm og d MT 67 nm), estimeret ved hjælp af d A = I monomer / 2R A
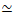 , hvor I-monomer er længden af en actinmonomer, og dMT
, hvor I-monomer er længden af en actinmonomer, og dMT 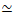 = I ring / 26RT, hvorI-ring er længden af enring på 13 tubuliner 15, 17.
= I ring / 26RT, hvorI-ring er længden af enring på 13 tubuliner 15, 17.
For at bestemme en vellykket forberedelse af aktive kompositter (figur 1) og for at karakterisere deres dynamik og struktur bruges et laserscanningsfluorescensmikroskop med mindst to fluorescenskanaler til at visualisere actinfilamenterne og mikrotubuli samtidigt (figur 2 og figur 6). Alle actinfilamenter og mikrotubuli i kompositterne er sparsomt mærket, snarere end doping i sporstof lyse filamenter, som det ofte gøres i in vitro-undersøgelser . Denne metode sikrer, at den målte dynamik og struktur er repræsentativ for selve kompositten snarere end de sporstoffer, der dannes under andre forhold end kompositterne. Af denne grund kan individuelle actinfilamenter og mikrotubuli typisk ikke løses, snarere skildrer billeder mesoskala netværksstruktur (figur 2 og figur 6).
Denne mærkningsmetode blev optimeret til rumlig billedautokorrelation (SIA) og differentiel dynamisk mikroskopi (DDM) analyser, der undersøger dynamikken og strukturen i det gensidige Fourier-rum (figur 4, figur 5 og figur 8) 52,53,54,55. Partikelbilledvelocimetri (PIV) kan også bruges til at skildre og karakterisere dynamik- og flowfelter (figur 3 og figur 7), men det kræver pixel-binning (lavere rumlig opløsning) og større forsinkelsestidsintervaller (lavere tidsmæssig opløsning) end SIA og DDM for at eliminere fejlagtige vektorer, der opstår fra støj i de tætte billeder med lavt signal. Ikke desto mindre anbefales PIV til kvalitativ undersøgelse af flowfelter og bekræftelse af DDM-resultater (figur 4 og figur 8)26,50.
Prøvekarakterisering af de beskrevne netværk ved hjælp af disse analyser (dvs. DDM, SIA, PIV) leveres for at hjælpe forskere med at vedtage lignende analyser til benchmark og karakterisere deres prøver. Detaljerede beskrivelser af disse teknikker ligger imidlertid uden for rammerne af dette arbejde. For detaljerede beskrivelser af, hvordan man udfører DDM på disse og andre lignende systemer, herunder brugervenlig Python-kode, henvises til tidligere værker 17,26,49,50 og referencerne der indeni. For detaljer om, hvordan man udfører SIA og PIV på de systemer, der er beskrevet her, henvises læseren til tidligere værker17,50.
Flere kontroller, der er beskrevet nedenfor, skal udføres for at sikre, at kompositterne fungerer som forventet. En komposit uden myosin eller kinesin skal i det væsentlige forekomme statisk med minimale termiske udsving eller drift. Actinfilamenter og mikrotubuli skal fremstå sammenfiltrede og homogent fordelt med minimal bundling, aggregering eller faseadskillelse af actin og mikrotubuli i et synsfelt på ~ 200 μm x 200 μm (figur 2, yderst til venstre)17. Man bør forvente et lignende resultat for kompositter, der indeholder myosin, men ikke udsættes for 488 nm lys (for at deaktivere blebbistatin).
Ved inkorporering af myosin og eksponering for 488 nm lys gennemgår kompositterne sammentrækning, der stort set er isotrop og lignende for actin og mikrotubuli, som det ses i mikroskopbilleder taget før og efter myosinaktivitet (figur 2) samt tilsvarende PIV-strømningsfelter for forskellige tidspunkter under aktivitet (figur 3). For at afgøre, om bevægelsen er ballistisk, diffus, subdiffusiv osv., evalueres den karakteristiske dekorrelationstid τ (q) bestemt ud fra DDM som en funktion af bølgevektor (dvs. gensidigt rum). Se som beskrevet detaljeret tidligere 17,26,49. Figur 4 viser også, hvordan man bruger DDM til at karakterisere disse kompositter. Power-law skalering τ (q) ~ 1 / vq β, med β = 1, indikerer ballistisk bevægelse med hastighed v. Til reference repræsenterer β = 2 diffusiv dynamik, hvor v er diffusionskoefficienten. Alle aktive kompositter udviser ballistisk skalering (figur 4A) med hastigheder, der er indstillet af koncentrationerne af actin og myosin (figur 4B), og som kan variere i tid under aktivitet, enten accelererende eller decelererende (figur 4C, D).
Netværksomstrukturering og klyngedannelse, synlig i figur 2 og mere tydelig for højere actin- og myosinkoncentrationer, kan karakteriseres ved hjælp af SIA, som afbildet i figur 5 og beskrevet tidligere 17,48,50. Kort fortalt kan en korrelationslængde ξ, som er et mål for den karakteristiske størrelse af funktioner i et billede, bestemmes ved at tilpasse hver rumlig intensitets autokorrelationskurve g (r) til en eksponentiel funktion af afstanden r mellem pixels. Større g(r)-toppe, der vedvarer i længere afstande, indikerer større strukturelle træk (dvs. bundling, klyngedannelse af de enkelte filamenter). Som vist i figur 5 afspejles signifikant omstrukturering og aggregering for højere actinfraktioner og myosinkoncentrationer i stigningen i ξ over tid.
De viskoelastiske egenskaber og ikke-lineære mekaniske respons af de aktive kompositter kan også måles ved hjælp af optisk pincet mikrorheologi (OTM). Protokoller og repræsentative resultater for disse eksperimenter ligger imidlertid uden for rammerne af dette arbejde. Interesserede læsere henvises til tidligere værker48,56, som grundigt beskriver, hvordan man udfører OTM-målinger og de forventede resultater.
Ved hjælp af det samme program af eksperimentelle og analyseværktøjer, der er beskrevet ovenfor, beskriver det følgende afsnit, hvordan dynamikken og strukturen ændres, når kinesinmotorer og biotin-NA-tværbindinger inkorporeres i kompositterne (figur 6, figur 7 og figur 8). Figur 6 viser repræsentative konfokale billeder af kompositter drevet af enten kun kinesin (K) eller kinesin og myosin (K+M), med og uden passiv tværbinding (XL) af actinfilamenter eller mikrotubuli.
Inkorporering af kinesin i kompositter resulterer oprindeligt i lignende dynamik og omstrukturering som myosindrevne kompositter som vist i øverste række i figur 7 (klasse 1). Dynamikken overgår dog typisk til storskala anisotrop strømning (figur 7 midterste række, klasse 2), acceleration og deceleration (figur 7 nederste række, klasse 3). Disse egenskaber kombineres med mesoskala klyngedannelse og aggregering efter 5-30 min (figur 6 og figur 8B). PIV-genererede flowfelter og tidsmæssige farvekort vist i figur 7 viser eksempler på isotrop omstrukturering (klasse 1, toppanel), rettet flow (klasse 2, midterste paneler) og tovejsacceleration (klasse 3, bundpaneler).
Hastigheder for actin og mikrotubuli på forskellige tidspunkter under aktivitet, bestemt via passer til τ (q) kurver, illustrerer acceleration efterfulgt af deceleration (figur 8), som afhænger af tværbinding. Som også vist i figur 8, når begge motorproteiner inkorporeres, er dynamikken faktisk langsommere end kun kinesin-kompositter, og der er forsinket begyndelse af mesoskala flow. Myosin understøtter også mere homogen interpenetration af actin- og mikrotubulusnetværk i hele aktivitetens varighed samt mindre aggregering og omstrukturering. Disse effekter kan ses på billederne i figur 6 og kvantificeres af de tidsvarierende korrelationslængder beregnet via SIA, som generelt er mindre i nærvær af myosin (figur 8B).
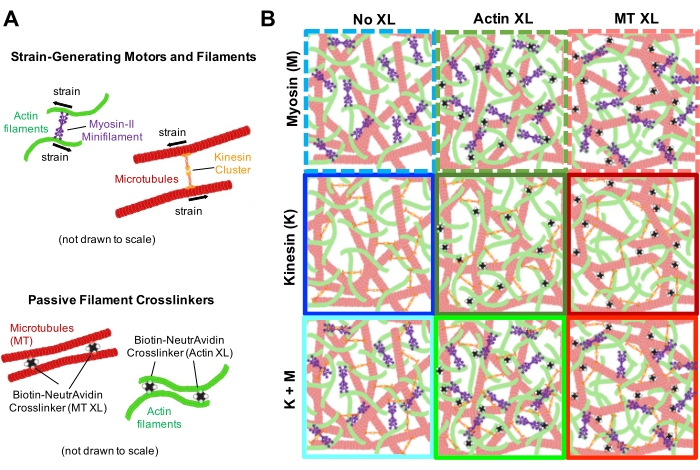
Figur 1. Design og karakterisering af aktive actin-mikrotubuluskompositter med flere kraftgenererende motorer og passive tværbindinger. (A) Actinmonomerer og tubulindimerer co-polymeriseres ved molære koncentrationer c A og c T på 0,73-11,6 μM og molære fraktioner af actin Φ A = c A / (c A + c T) = 0, 0,25, 0,5, 0,75 og 1 for at danne sammenfiltrede netværk af actinfilamenter (grøn) og mikrotubuli (rød). Passiv tværbinding opnås ved hjælp af NA til at forbinde biotinylerede actinfilamenter (Actin XL) eller mikrotubuli (MT XL) ved tværbinding: protein molære forhold på R A = 0,01-0,08 og RMT = 0,001-0,01 for henholdsvis actin og mikrotubuli. Myosin-II minifilamenter (lilla) og kinesinklynger (orange) i koncentrationer på c M = 0,12 - 0,48 μM og cK = 0,2 - 0,7 μM, skub og træk i filamenterne for at drive kompositterne ud af steady state. (B) Skematisk formuleringsrum. Myosin II mini-filamenter (M), kinesinklynger (K) eller begge motorer (K + M) er inkorporeret i kompositter uden passive tværbindinger (No XL), actin-actin tværbindinger (Actin XL) og mikrotubuli-mikrotubuli tværbindinger (MT XL). Alle tegnefilm er ikke tegnet i skala. Klik her for at se en større version af denne figur.
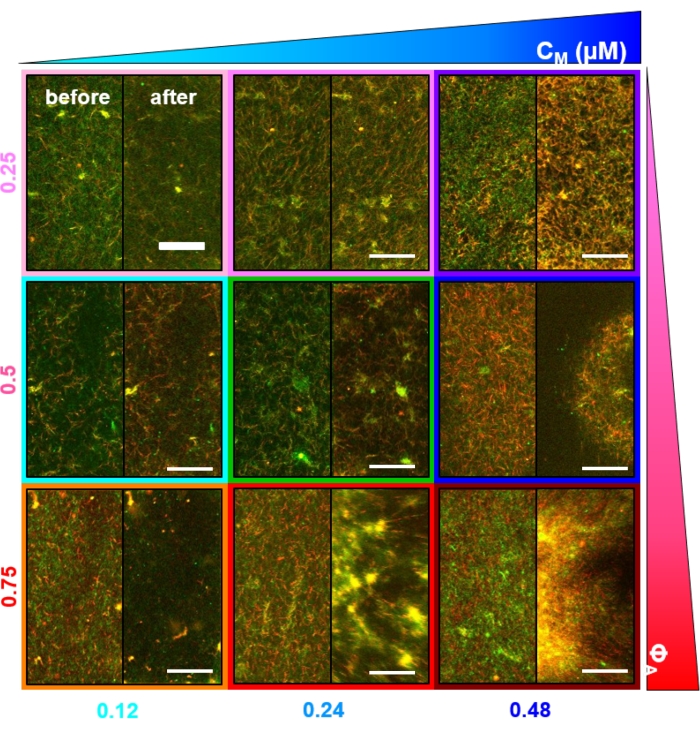
Figur 2. Tofarvet konfokal billeddannelse af myosindrevne cytoskeletkompositter med varierende myosinkoncentrationer cM og molære actinfraktioner ΦA. (A) 256 x 128 kvadratpixel (212 x 106 μm2) tofarvede konfokale mikroskopibilleder viser, hvordan sammensætninger af actinfilamenter (grøn) og mikrotubuli (rød) omarrangeres via myosinmotorisk aktivitet. Ingen kinesinmotorer eller passive tværbindinger er til stede. I hvert panel vises billeder taget i begyndelsen (venstre, før) og slutningen (højre, efter) af 45 minutters myosinaktivering (via belysning med 488 nm lys for at deaktivere blebbistatin). Paneler bestilles ved at øge molær koncentration af myosin (cM), gå fra venstre mod højre og øge molær fraktion af actin (ΦA), der går fra top til bund. Farverne, der skitserer hvert panel, svarer til den farvekodning, der bruges i figur 4 og figur 5. Skalastænger er 50 μM. For bedst at fange dynamik og struktur til analyse bruger vi billedhastigheder på 1-5 fps, ROI'er med 50-250 μm sider og tidsserievarigheder på 5-45 min, afhængigt af hastigheden af sammentrækning og omlejring. Paneler, hvor før- og efterbillederne ligner hinanden, indikerer minimal omstrukturering, som det ses i de lyserøde, magenta- og cyanpaneler. Småskala klyngedannelse, der fremgår af øget heterogenitet og tilstedeværelsen af lyse punkteringsfunktioner, kan ses i de orange, grønne og røde paneler. Storstilet sammentrækning, set som et ensartet krympende netværk, er tydeligt i de blå og lilla paneler. Dette tal er ændret i forhold til reference17. Klik her for at se en større version af denne figur.
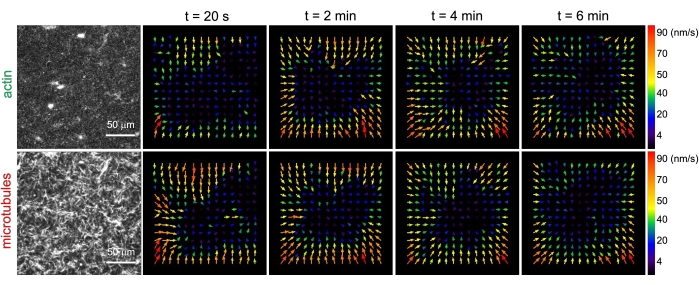
Figur 3. Partikelbilledvelocimetri (PIV) viser, at actomyosinaktivitet udløser koordineret kontraktil dynamik af actin og mikrotubuli i sammenfiltrede kompositter. PIV-flowfelter for actin (øverste række) og mikrotubuli (nederste række) i en myosindrevet komposit med (ΦA, cM) = (0,5, 0,24) på stigende tidspunkter i løbet af en 6 minutters tidsserie. Flowfelter blev genereret ved hjælp af Fiji/ImageJ PIV-pluginet med en forsinkelsestid på 20 s og 2 pixel x 2 pixel binning. Både actin og mikrotubuli viser konsekvent bevægelse rettet mod det midterste område af synsfeltet i hele filmens varighed. Skalabjælker i alle billeder er 50 μm. Forskellige pilefarver svarer til forskellige hastigheder som angivet i farveskalaen til højre for vektorfelter. Dette tal er ændret i forhold til reference26. Klik her for at se en større version af denne figur.
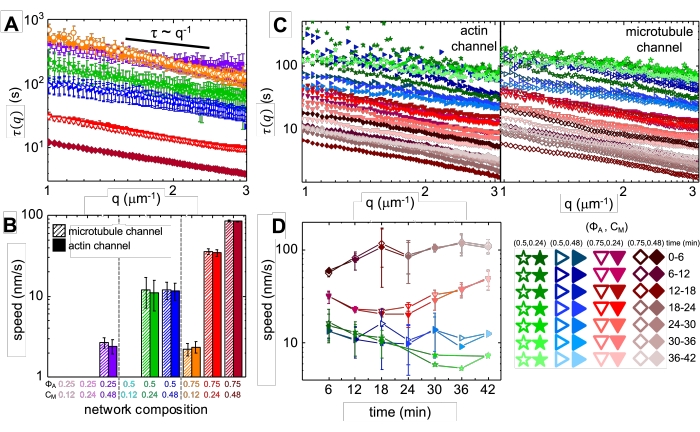
Figur 4. Tidsopløst differentiel dynamisk mikroskopi (DDM) måler hastigheden og typen af bevægelse af actin og mikrotubuli i aktive kompositter. (A) DDM udføres på mikrotubuli (øverste, åbne symboler) og actin (nederste, fyldte symboler) kanaler i tidsserier for at bestemme karakteristiske henfaldstider τ vs bølgetal q for både actin (fyldte symboler) og mikrotubuli (åbne symboler) som beskrevet tidligere17,26. Alle kurver følger τ ~ q-1 skalering, hvilket indikerer ballistisk bevægelse med hastigheder v, der bestemmes via passer til τ (q) = (vq) -1. Hurtigere hastigheder svarer til mindre τ(q)-værdier for et givet q. Symbolfarver og -former svarer til (Φ A, cM) kombinationer vist i B. (B) Sammentrækningshastigheder v bestemmes via passer til τ(q)-kurver vist i A, som er beregnet som gennemsnit over alle forsinkelsestider i løbet af hver 45 minutters tidsserie. (C) Tidsopløst DDM (trDDM) kvantificerer, hvordan dynamikken varierer over tid ved at evaluere τ (q) for actin (fyldte symboler, venstre) og mikrotubuli (åbne symboler, højre) i på hinanden følgende 6 minutters intervaller (betegnet med forskellige nuancer af samme farve) i løbet af 45 minutters aktiveringstid. trDDM udføres for hver (ΦA, cM) kombination (betegnet med forskellige symboler og farver) som beskrevet i forklaringen nederst til højre. τ(q)-kurverne i C følger samme skalering og tendenser som i A, men viser også tidsafhængighed for visse (Φ A, cM) sammensætninger, især for ΦA= 0,75. (D) Sammentrækningshastigheder for actinfilamenter (lukkede symboler) og mikrotubuli (åbne symboler) bestemmes fra passer til tilsvarende τ(q)-kurver. Fejllinjer i alle plots repræsenterer standardfejlen med værdier på tværs af tre til fem replikater. Dette tal er ændret i forhold til reference17. Klik her for at se en større version af denne figur.
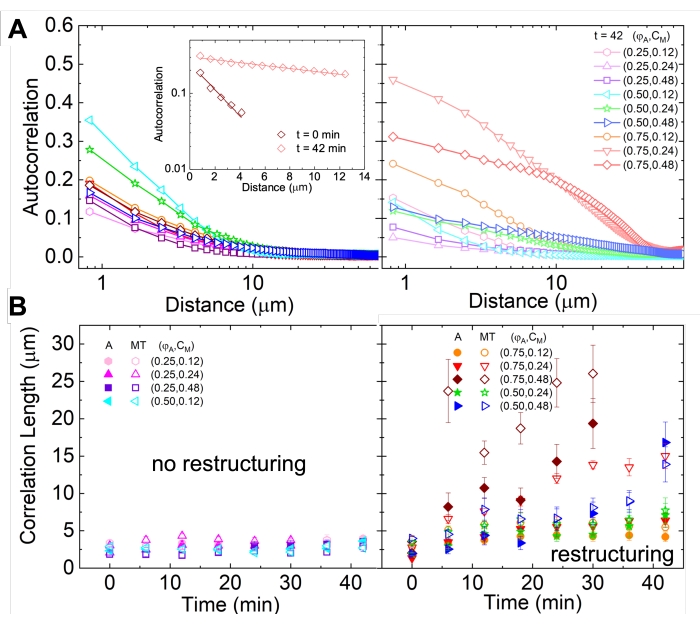
Figur 5. Rumlig billedautokorrelation (SIA) analyse kvantificerer den motordrevne omstrukturering af aktive cytoskeletale kompositter. (A) Autokorrelation g(r) for mikrotubuli i begyndelsen (venstre, t = 0 min, mørke nuancer) og slutningen (højre, t = 42 min, lyse nuancer) af eksperimentet for (ΦA, cM) formuleringer, der er anført i forklaringen. Indsat: eksempel passer af data til 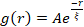 ved begyndelses- og sluttidspunkterne for (ΦA, cM) = (0,75, 0,12). (B) Gennemsnitlige korrelationslængder ξ for actin (lukkede symboler) og mikrotubuli (åbne symboler) for hver (Φ A, cM) bestemt via eksponentielle tilpasninger af hver g(r)-kurve, som vist i indsatsen i A. Data er opdelt i dem, der udviser minimal (venstre) versus væsentlig (højre) omstrukturering. Fejllinjer i A og B repræsenterer standardfejlen på tværs af tre til fem replikater. Dette tal er ændret i forhold til reference17. Klik her for at se en større version af denne figur.
ved begyndelses- og sluttidspunkterne for (ΦA, cM) = (0,75, 0,12). (B) Gennemsnitlige korrelationslængder ξ for actin (lukkede symboler) og mikrotubuli (åbne symboler) for hver (Φ A, cM) bestemt via eksponentielle tilpasninger af hver g(r)-kurve, som vist i indsatsen i A. Data er opdelt i dem, der udviser minimal (venstre) versus væsentlig (højre) omstrukturering. Fejllinjer i A og B repræsenterer standardfejlen på tværs af tre til fem replikater. Dette tal er ændret i forhold til reference17. Klik her for at se en større version af denne figur.
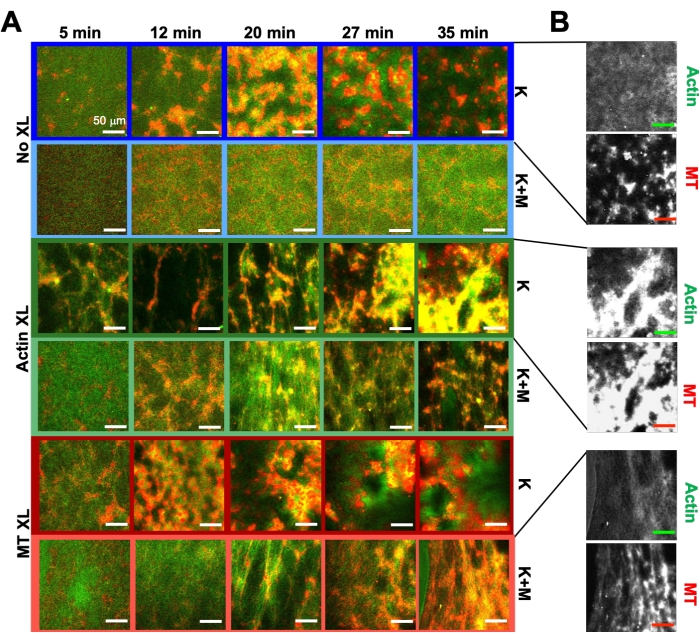
Figur 6. Inkorporering af kinesinmotorer og passive tværbindinger i aktive kompositter for at øge programmerbarheden og udvide faserummet for dynamik og struktur. (A) Tofarvede konfokale billeder af actin (grøn) og mikrotubuli (rød) i aktive kompositter viser kompleks formuleringsafhængig omstrukturering over tid (angivet i min). De fem billeder i hver række svarer til fem rammer i en 2000-rammetidsserie erhvervet til en sammensat drevet af kinesin (K, række 1, 3, 5) eller kinesin og myosin (K + M, række 2, 4, 6) og inkluderer enten ingen passive tværbindinger (nr. XL, række 1, 2), actin-actin tværbindinger (Actin XL, række 3, 4) eller mikrotubuli-mikrotubuli tværbindinger (MT XL, række 5, 6). Vægtstænger er alle 50 μm. Konturfarver matcher farveskemaet i figur 8. (B) Separate actin- og mikrotubulifluorescenskanaler for kinesin-kompositterne viser forskellige strukturer med både actin-MT-co-lokalisering og mikrofaseseparation. De viste billeder er til kompositter med c A = 2,32 μM, c T = 3,48 μM, c K = 0,35 μM, c M = 0,47 μM (række 2, 4, 6), R A = 0,02 (række 3, 4) og RMT = 0,005 (række 5, 6). Alle kompositter begynder med ensartet fordelte interpenetrerende netværk af actin og mikrotubuli (kolonne 1). Kinesindrevne kompositter uden tværbindinger (række 1) danner løst forbundne amorfe klynger, der er MT-rige. Actin co-lokaliserer i centrene af disse aggregater i første omgang, men presses derefter ud af de MT-rige regioner, der fortsætter med at indgå kontrakt og afbryde forbindelsen til hinanden. Actin-actin tværbinding (række 3) hindrer denne mikroskala actin-MT adskillelse, og i stedet er MT-rige aggregater forbundet via lange tråde af actin. Actin-tværbinding muliggør også langsom optagelse af actin i de MT-rige regioner, således at kompositten bliver et forbundet netværk af co-lokaliserede actin- og MT-klynger. Mikrotubuluskrydsbinding (række 5) fører til amorf klyngedannelse af MT'er, der samles over tid, hvilket resulterer i større skala faseadskillelse af actin og MT'er. Uden tværbindinger (række 2) viser kompositter lidt omarrangering i løbet af timer. Tværbinding øger omstrukturering og samlokalisering af actin og mikrotubuli (række 4, 6). Specifikt, når mikrotubuli er tværbundet (række 6), er der betydelig interpenetration og omorganisering i weblignende netværk af fibre. Dette tal er ændret fra reference50. Klik her for at se en større version af denne figur.
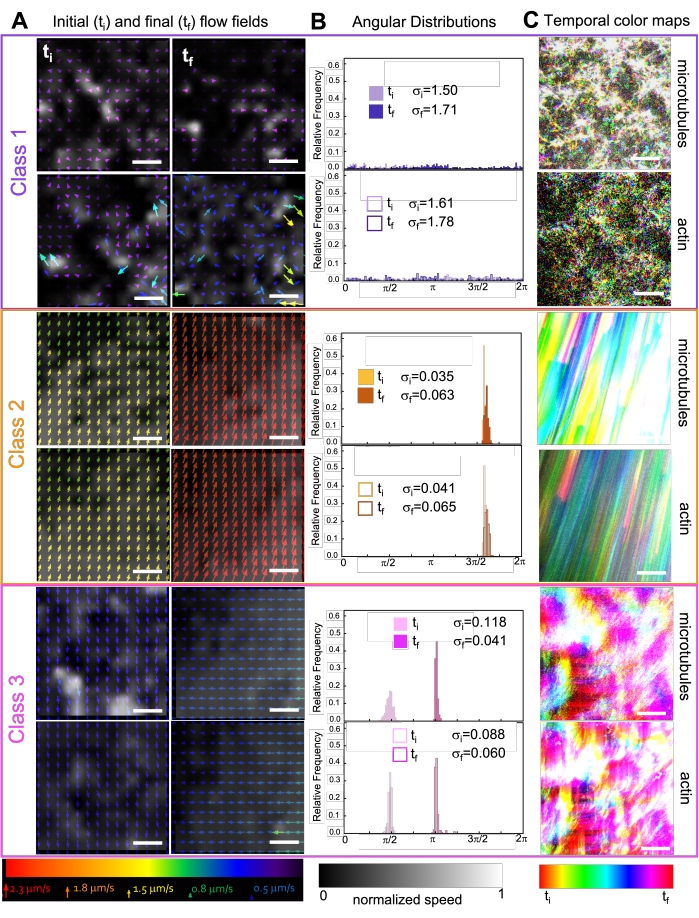
Figur 7. PIV viser, at aktive kompositter udviser tre klasser af spatiotemporalt forskellige strømningsfelter. (A) PIV-flowfelter for de første (t i) og sidste (tf) rammer i tre repræsentative tidsserier, der viser de forskellige dynamiske klasser, som kompositterne vist i figur 6 viser. PIV-flowfelter for mikrotubuli (øverst) og actin (nederst) for klasse 1 (øverst, lilla), klasse 2 (midterste, orange) og klasse 3 (nederst, magenta) eksempelvideoer med pilefarver svarende til den universelle hastighedsskala nederst og gråtonefarvekortet, der viser den rumlige hastighedsfordeling, normaliseret separat for hvert flowfelt i henhold til den skala, der vises nederst. Vægtstænger er alle 50 μM. (B) Vinkelfordelinger af hastighedsvektorer fra A (i radianenheder) med anførte indledende og endelige standardafvigelser σ i og σf. (C) Tidsmæssige farvekort for de videoer, der analyseres i A og B, viser hver pixels ramme-til-ramme-position i forhold til dens udgangspunkt. Klasse 1-kort viser små tilfældige bevægelser; klasse 2-kort viser hurtig ensrettet bevægelse med minimal rumlig eller tidsmæssig variation; Klasse 3-kort udviser funktioner i både klasse 1 og 2. Dette tal er ændret fra reference50. Klik her for at se en større version af denne figur.
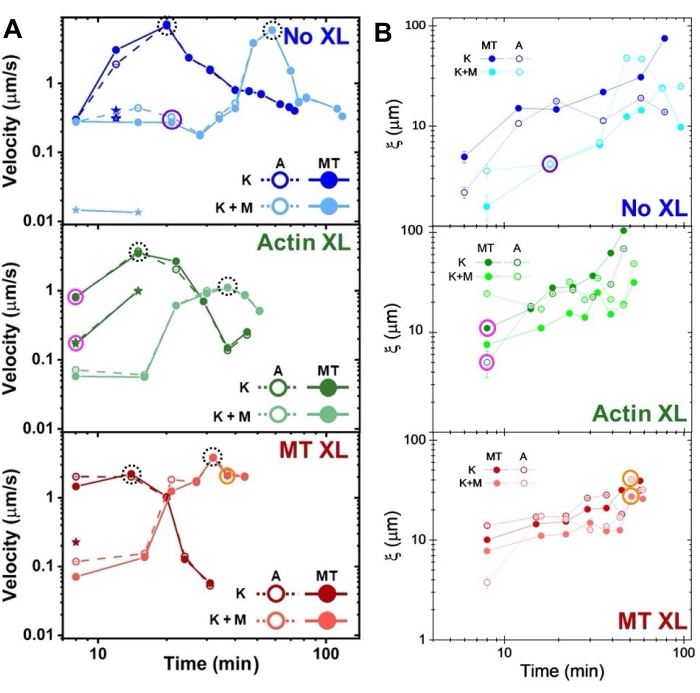
Figur 8. DDM og SIA måler den tidsvarierende dynamik og struktur af tomotoriske actin-mikrotubuluskompositter. (A) Hastigheder for kompositter beskrevet i figur 6 og figur 7, målt via DDM, viser acceleration og deceleration af kompositter, programmeret ved tværbinding og myosinaktivitet. Hastigheder af mikrotubuli (MT, lukkede cirkler) og actin (A, åbne cirkler) afbildes som en funktion af aktivitetstid i kompositter uden tværbinding (top, blå), actin-tværbinding (midt, grøn), mikrotubuluskrydsbinding (bund, rød), uden myosin (K, mørkere nuancer) og med myosin (K + M, lysere nuancer). For klasse 3-tilfælde, der har to hastigheder, er den langsommere hastighed angivet med en stjerne. Datapunkter omgivet af stiplede sorte cirkler svarer til maksimal hastighed vmaxfor hver formulering. Fejlbjælker (de fleste for små til at se) er standardfejlen over power-law fits af den tilsvarende τ (q). (B) Strukturelle korrelationslængder ξ, bestemt via SIA, versus aktivitetstid, for det samme sæt tidsserier evalueret i A. Hvert datapunkt er et gennemsnit af korrelationslængderne bestemt for den første og sidste ramme i den tilsvarende tidsserie. Generelt øges ξ i tid for både actin og mikrotubuli i alle kompositsystemer, og kompositter drevet udelukkende af kinesin har større korrelationslængder end dem, hvor myosin også er til stede. Datapunkter i A og B, der svarer til de tre tidsserier, der analyseres i figur 7, er cirklet i den tilsvarende klassefarve (1 = lilla, 2 = orange, 3 = magenta). Dette tal er ændret fra reference50. Klik her for at se en større version af denne figur.
Et vigtigt fremskridt i det rekonstituerede system, der er beskrevet ovenfor, er dets modularitet og tunabilitet, så brugerne opfordres til at ændre koncentrationerne af proteiner, motorer, tværbindinger osv., Så de passer til deres ønskede resultater, hvad enten det er at efterligne en bestemt cellulær proces eller konstruere et materiale med specifik funktionalitet eller mekaniske egenskaber. Begrænsninger i koncentrationsområdet for actin og tubulin er fastsat til den nedre grænse ved den kritiske koncentration, der er nødvendig for at polymerisere actin (~ 0,2 μM) 57,58,59 og tubulin (~ 3 - 4 μM)60 og ved den øvre grænse ved overgangen til nematisk justering af actinfilamenter (~ 90 μM)61,62 eller mikrotubuli (~ 35 μM)63 . Actinmonomerer og tubulindimere bør polymeriseres til filamenter sammen i stedet for blandet sammen efter polymerisation for at sikre, at de danner homogent interpenetrerende perkolerede netværk, der synergistisk understøtter hinanden. Den nye dynamik, som kompositterne udviser, er afhængig af denne interaktion. Selvom det generelt er vigtigt at følge alle trin som beskrevet i protokollen for at kunne gengive de viste resultater, er nogle trin mere krævende, mens andre har plads til at ændre og justere, så de passer til specifikke behov og tilgængelige ressourcer.
For eksempel er et vigtigt skridt i at sikre reproducerbare resultater korrekt forberedelse og opbevaring af reagenserne i henhold til retningslinjerne i materialetabellen. Cytoskeletale proteiner (actin, tubulin, myosin, kinesin) er labile og bør eliciteres, flashfryses med flydende nitrogen og opbevares ved -80 °C i engangsalikvoter. Når aliquoterne er fjernet fra -80 °C, skal de opbevares på is. Cytoskeletale proteiner bevarer ikke pålideligt funktionen efter yderligere fryse-optøningscyklusser.
Mikrotubuli er mere følsomme over for depolymerisering og denaturering end actin. Når tubulin er fjernet fra -80 °C, skal det opbevares på is før polymerisation og anvendes inden for 12 timer. Når de er polymeriseret, skal mikrotubuli opbevares ved stuetemperatur. Det er også afgørende at stabilisere mikrotubuli med taxol for at forhindre depolymerisering. Phalloidin-stabilisering af actinfilamenter er ligeledes vigtigt for at undertrykke den ATP-forbrugende actin-løbebånd, der konkurrerer med myosin og kinesinaktivitet.
Ultracentrifugering af myosinmotorer er et andet kritisk trin, da det fjerner inaktive myosin døde hoveder. Ikke at fjerne de enzymatisk inaktive monomerer resulterer i passiv tværbinding af actinnetværket og tab af aktivitet. For at forlænge ATPase-aktiviteten af motorer kan et ATP-regenereringssystem såsom kreatinphosphat og kreatinphosphokinase64 inkorporeres.
Endelig kræver opretholdelse af sammensat aktivitet hæmning af adsorption af filamenter og motorer til væggene i prøvekammeret, hvilket kan opnås ved passivering af mikroskopdækslerne og diasene. Motorproteiner er særligt tilbøjelige til adsorption, hvilket resulterer i, at kompositten trækkes til overfladen af prøvekammeret, bevæger sig ud af synsfeltet, kollapser til 2D og ikke længere undergår aktivitet. Silanisering af dækslikkerne og diasene er en effektiv måde at passivere overfladerne på og forhindre adsorption (se trin 1). En alternativ passiveringsmetode, der anvendes effektivt i in vitro cytoskeletforsøg, er at belægge overfladen med et lipiddobbeltlag, svarende til cellemembranen18. Denne metode er fordelagtig, hvis man ønsker at binde proteiner til overfladen eller introducere andre specifikke protein-overflade-interaktioner, fordi dobbeltlaget kan funktionaliseres. For optiske pinceteksperimenter er passivering af mikrosfærerne også kritisk og kan opnås ved at belægge carboxylerede mikrosfærer med BSA eller PEG via carbodimid-tværbindingskemi48.
Der er et par aspekter af de præsenterede protokoller, som forskere kan overveje at ændre, så de passer til deres behov. For det første kan forskere vælge at erstatte ikke-native biotin-NA-crosslinkere med biologiske crosslinkers, såsom alfa-actinin eller MAP65, der tværbinder actin og mikrotubuli henholdsvis 28,65,66. Brugen af ikke-native crosslinkere i de kompositter, der er beskrevet her, er motiveret af deres forbedrede reproducerbarhed, stabilitet og tunabilitet sammenlignet med native crosslinkers. På grund af den stærke biotin-NA-binding kan crosslinkere antages at være permanente, snarere end de fleste indfødte crosslinkers, der forbigående binder med vidtrækkende omsætningshastigheder. Dynamikken i forbigående tværbinding komplicerer analysen af bidragene fra tværbindinger og motorer til dynamikken. Desuden kan biotin-NA-linkere bruges alsidigt til at forbinde både actin og mikrotubuli samt tværbinding actin til mikrotubuli. På denne måde kan der foretages en entydig sammenligning mellem tværbindingsmotiver, der holder alle andre variabler (f.eks. Tværbindingsstørrelse, bindingsaffinitet, støkiometri osv.) faste. Endelig er de reagenser, der er nødvendige for at inkorporere biotin-NA-linkere, bredt kommercielt tilgængelige, velkarakteriserede og almindeligt anvendte i mange biofysiklaboratorier. En af de vigtigste styrker ved in vitro-platformen, der er beskrevet her, er imidlertid dens modularitet, så forskere bør være i stand til problemfrit at erstatte biotin-NA-linkere med native linkere, hvis de vælger det.
For det andet polymeriseres actinmonomerer og tubulinddimerer i den nuværende protokol i filamenter sammen i et centrifugerør, inden de tilsættes til prøvekammeret. Tilstrømning af opløsningen af sammenfiltrede filamentøse proteiner ind i prøvekammeret kan forårsage strømningsjustering, især af mikrotubuli, som bryder den ønskede isotropi og homogenitet af kompositterne. Faktisk var et stort fremskridt i tidligere arbejde med steady-state actin-mikrotubuli kompositter evnen til at co-polymerisere actin og mikrotubuli in situ (i prøvekammeret) for at sikre dannelse af isotrope interpenetrerende netværk af actin og mikrotubuli15,16,27. En udvidelse af denne fremgangsmåde til aktive kompositter vil imidlertid kræve, at motorerne tilsættes til prøven inden actin- og tubulinpolymerisation, og at hele prøven inkuberes sammen ved 37 °C forud for forsøg. Test af denne variation i protokollen har resulteret i reduceret actinpolymerisation og ingen mærkbar motoraktivitet, sandsynligvis på grund af konkurrerende ATPase-aktivitet og den langvarige 37 °C inkubation af motorerne. Heldigvis er der ingen synlig flowjustering af kompositter, når man følger de nuværende protokoller, som det kan ses i figur 2, figur 3 og figur 6. Ikke desto mindre opfordres forskere til at designe protokoller, der giver mulighed for in situ-dannelse af aktive kompositter.
Et andet overvejelsespunkt er fluorescensmærkningsordningen, som indebærer sparsom mærkning af alle actinfilamenter og mikrotubuli i netværket. Denne mærkningsmetode blev optimeret til direkte at visualisere netværkets struktur i stedet for at udlede struktur og dynamik via sporfilamenter eller mikrosfærer. Afvejningen er imidlertid, at individuelle filamenter ikke er lyst mærket og løselige. En tilgang, som forskere kunne tage for både at løse enkeltfilamenter såvel som visualisere netværksstruktur, er at dope i præformede filamenter mærket med en anden fluorophore, så både det omgivende netværk og individuelle filamenter kunne afbildes samtidigt. Men når du bruger mere end to fluorophorer og excitation / emissionskanaler, er blødning mellem kanaler ofte svært at eliminere, så man skal være forsigtig med at vælge fluorophorer, filtre og laserintensiteter.
En relateret begrænsning er manglende evne til at visualisere myosin- eller kinesinmotorerne i kompositterne. De fluorescerende mærkede actinmonomerer og tubulindimere, der anvendes, er kommercielt tilgængelige, mens visualisering af myosin eller kinesin i kompositter kræver intern mærkning. Forskere opfordres til at tage det næste skridt til at mærke motorer, som tidligeregjort 18,67, for at kunne utvetydigt forbinde motoraktivitet og binding til den dynamik og strukturer, som vores kompositter udviser.
Endelig er det vigtigt at bemærke, at i den nuværende protokol kontrolleres kinesinaktivitetens begyndelse og varighed ikke. Fordi myosinaktiviteten styres ved hjælp af fotodeaktivering af blebbistatin, som beskrevet ovenfor, for at opbygge lignende lysaktivering af kinesin, kan man inkorporere lysaktiveret ATP.
For at opbygge kompleksiteten af de designs, der er beskrevet her, for bedre at efterligne cellulære forhold og udvide parameterrummet for dynamisk struktur-funktion, vil det fremtidige arbejde fokusere på at inkorporere mellemliggende filamenter, såsom vimentin68,69, samt andre motorer såsom dynein13,70. Gelsolin vil også blive inkorporeret i forskellige koncentrationer for at kontrollere actinlængde14 samt tau-protein til kontrol af mikrotubulusstivhed.
Sammenfattende beskriver de præsenterede protokoller, hvordan man designer, skaber og karakteriserer dynamikken, strukturen og mekanikken i cytoskelet-inspirerede aktive stofsystemer, der indeholder to separate aktive kraftgenererende komponenter, der virker på forskellige substrater i et enkelt system. Denne justerbare og modulære platform bringer rekonstitutionsindsatsen et vigtigt skridt tættere på at efterligne det cellulære cytoskelet og tilbyder den unikke evne til at programmere dets egenskaber på tværs af et bredt faserum ved uafhængigt at inkorporere, fjerne og indstille de forskellige komponenter. Desuden er alle komponenter i dette alsidige system kommercielt tilgængelige (se Materialetabel), bortset fra kinesin dimers, der renses i Ross Lab, som beskrevet tidligere50, og tilgængelige efter anmodning. Endelig er al analysekode frit tilgængelig via GitHub49 og er baseret på gratis programmeringssprog og software (Python og Fiji). Den gennemsigtige formidling af protokoller til design af disse systemer vil forhåbentlig gøre denne platform mere tilgængelig for en forskelligartet gruppe brugere med forskellig ekspertise, baggrund, institutionelle tilknytninger og forskningsmål.
Forfatterne har intet at afsløre
Vi anerkender Maya Hendija og Dr. Jonathan Michel for hjælp med dataanalyse og Dr. Janet Sheung, Dr. Moumita Das og Dr. Michael Rust for nyttige diskussioner og vejledning. Denne forskning blev støttet af et William M. Keck Foundation Research Grant og NSF DMREF Award (DMR 2119663) tildelt RMRA og JLR og National Institutes of Health R15 Grants (R15GM123420, 2R15GM123420-02) tildelt RMR-A og RJM.
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin Abbreviation used in paper: blebbistatin | Sigma Aldrich | B0560 | Stock Concentration: 200 μM in DMSO Storage: dessicated, in DMSO, -20ºC Stock and Experiment Recipes: dissolve 1 mg of powder to 200 μM in DMSO Storage, Handling, Troubleshooting Notes: limited shelf-life, typically stops functioning reliably after 3-4 months. purchase and prepare new solution every 3 months. |
| 1:20 488-tubulin:tubulin mixture Abbreviation used in paper: 5-488-tubulin | NA | NA | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: mix tubulin and 488-tubulin at a 20:1 ratio, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| 1:20 R-tubulin:tubulin mixture Abbreviation used in paper: 5-R-tubulin | NA | NA | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: mix tubulin and rhodamine tubulin at a 20:1 ratio, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| actin (biotin): skeletal muscle Abbreviation used in paper: biotin-actin | Cytoskeleton | AB07 | Stock Concentration: 1 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: (1) immediately prior to use dilute to 0.5 mg/ml in PEM, (2) once removed from -80ºC, store aliquot on ice at 4ºC for up to 1 week |
| actin (rhodamine): rabbit skeletal muscle Abbreviation used in paper: R-actin | Cytoskeleton | AR05 | Stock Concentration: 1.5 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1.5 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: once removed from -80ºC, store aliquot on ice at 4ºC, can be used for up to 1 week |
| adenosine triphosphate Abbreviation used in paper: ATP | Thermo Fisher Scientific | A1048 | Stock Concentration: 100 mM Storage: in solution (pH 7), -20ºC Stock and Experiment Recipes: reconsitute in DI H20, bring pH to 7 with NaOH Storage, Handling, Troubleshooting Notes: routinely check pH and adjust as needed, hydrolyzes over time, replace every ~6-12 months |
| AlexaFluor488 Phalloidin Abbreviation used in paper: 488-phalloidin | Thermo Fisher Scientific | A12379 | Stock Concentration: 100 μM DMSO Storage: protected from light, dessicated, -20ºC Stock and Experiment Recipes: reconstitute to 100 μM with DMSO Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 20 μM in PEM (1 μL in 4 μL PEM) |
| AlexaFluor488–labeled actin Abbreviation used in paper: 488-actin | Thermo Fisher Scientific | A12373 | Stock Concentration: 1.5 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1.5 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: this item has been discontinued |
| Basic Plasma Cleaner Abbreviation used in paper: plasma cleaner | Harrick Plasma | PDC-32G | |
| Bemis Parafilm M Laboratory Wrapping Film Abbreviation used in paper: transparent film | Thermo Fisher Scientific | 13-374-5 | |
| D-(+)-Glucose Abbreviation used in paper: | Thermo Fisher Scientific | A1682836 | Stock Concentration: 100x Storage: store at stock concentration (100x) or 10x concentration, dessicated, at -20ºC Stock and Experiment Recipes: reconstitute powder to 4.5 mg/ml in DI H20 Storage, Handling, Troubleshooting Notes: final concentration in solution should 45 μg/mL |
| D-Biotin Abbreviation used in paper: biotin | Fisher Scientific | BP232-1 | Stock Concentration: 1.02 mM in PEM Storage: dessicated, 4ºC |
| deionized nanopure water Abbreviation used in paper: DI | |||
| Dimethyldichlorosilane Abbreviation used in paper: silane | Thermo Fisher Scientific | D/3820/PB05 | Stock Concentration: 2% dissolved in Toulene |
| Dithiothreitol Abbreviation used in paper: DTT | Thermo Fisher Scientific | R0861 | Stock Concentration: 1 M in DMSO Storage: dessicated, -20ºC Stock and Experiment Recipes: dilute to 2 mM in PEM immediately before each experiment |
| DMSO Anhydrous Abbreviation used in paper: DMSO | Thermo Fisher Scientific | D12345 | |
| F-Buffer Abbreviation used in paper: F-buffer | NA | NA | Stock Concentration: 10x Storage: dessicated, -20ºC Stock and Experiment Recipes: 10 mM Imidazole (pH 7.0), 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 0.2 mM ATP |
| G-Buffer Abbreviation used in paper: G-buffer | NA | NA | Stock Concentration: 10x Storage: dessicated, -20ºC Stock and Experiment Recipes: 2.0 mM Tris (pH 8), 0.2 mM ATP, 0.5 mM DTT, 0.1 mM CaCl2. Store at -20°C. |
| glass microscope slide Abbreviation used in paper: slide | Thermo Fisher Scientific | 22-310397 | |
| Glucose oxidase + catalase + β-mercaptoethanol Abbreviation used in paper: GOC | Sigma Aldrich | G2133-250KU, C1345, 63689 | Stock Concentration: 100x Storage: store at stock concentration (100x) or 10x concentration, dessicated, at -20ºC Stock and Experiment Recipes: For 100x: 4.3 mg/ml glucose oxidase, 0.7 mg/ml catalase, 0.5% v/v β-mercaptoethanol in DI H20 Storage, Handling, Troubleshooting Notes: final concentration in solution should be: 0.005% β-mercaptoethanol, 43 μg/mL glucose oxidase, 7 μg/mL catalase |
| glu-GOC oxygen scavenging system Abbreviation used in paper: glu-GOC | NA | NA | Stock Concentration: 100x Storage: prepare fresh each time Stock and Experiment Recipes: mix equal parts Glu and GOC and add at 1/100 final sample volume immediately before imaging Storage, Handling, Troubleshooting Notes: prepare from Glu and GOC immediately before imaging |
| Guanosine triphosphate Abbreviation used in paper: GTP | Thermo Fisher Scientific | R0461 | Stock Concentration: 100 mM Storage: 100 μL aliquots at -20ºC |
| Instant Mix 1-minute epoxy Abbreviation used in paper: epoxy | Loctite | 1366072 | |
| Kinesin-1 401 BIO 6x HIS Abbreviation used in paper: kinesin | Prepared in JL Ross Lab at Syracuse University | NA | Stock Concentration: 8.87 μM in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Storage, Handling, Troubleshooting Notes: biotinylated dimers form kinesin clusters, each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| NeutrAvidin Abbreviation used in paper: NA | Thermo Fisher Scientific | 31000 | Stock Concentration: 5 mg/ml in PEM Storage: dessicated, -20ºC Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM |
| No 1. glass coverslips (24 mm x 24 mm) Abbreviation used in paper: coverslip | Thermo Fisher Scientific | 12-548-CP | |
| Paclitaxel Abbreviation used in paper: Taxol | Thermo Fisher Scientific | P3456 | Stock Concentration: 2 mM in DMSO Storage: protected from light, dessicated, -20ºC Stock and Experiment Recipes: reconstitute to 2 mM with DMSO Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 200 μM in DMSO (0.4 μL in 3.6 μL DMSO) |
| PEM-100 Abbreviation used in paper: PEM | NA | NA | Stock Concentration: 1x Storage: room temperature (RT) Stock and Experiment Recipes: 100 mM K-PIPES (pH 6.8), 2 mM EGTA, 2 mM MgCl2 Storage, Handling, Troubleshooting Notes: use KOH to adjust pH to 6.8, recheck pH often and adjust accordingly |
| phalloidin Abbreviation used in paper: phalloidin | Thermo Fisher Scientific | P3457 | Stock Concentration: 100 μM in DMSO Storage: protected from light, dessicated, -20ºC, adhere closely to storage/handling conditions Stock and Experiment Recipes: reconstitute to 100 μM with DMSO Storage, Handling, Troubleshooting Notes: susceptible to impurities in its preparation and denaturing, identifiable as large amorphous aggregates of actin in samples |
| porcine brain tubulin Abbreviation used in paper: tubulin | Cytoskeleton | T240 | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| Potassium Chloride Abbreviation used in paper: KCl | Thermo Fisher Scientific | AM9640G | Stock Concentration: 4 M Storage: RT |
| Rabbit skeletal actin Abbreviation used in paper: actin | Cytoskeleton | AKL99 | Stock Concentration: 2 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 2 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: once removed from -80ºC, store aliquot on ice at 4ºC, can be used for up to 1 week |
| Rabbit skeletal myosin II Abbreviation used in paper: myosin | Cytoskeleton | MY02 | Stock Concentration: 10 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 10 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: monomers form minifilaments at low KCl, each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| Tubulin (biotin): porcine brain Abbreviation used in paper: biotin-tubulin | Cytoskeleton | T333P | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 0.5 mg/ml in PEM |
| Tubulin (fluorescent HiLyte 488): porcine brain Abbreviation used in paper: 488-tubulin | Cytoskeleton | TL488M | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| tubulin (rhodamine): porcine brain Abbreviation used in paper: R-tubulin | Cytoskeleton | TL590M | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| Tween 20 Abbreviation used in paper: Tween20 | Thermo Fisher Scientific | J20605.AP | Stock Concentration: 1% v/v in DI H20 Storage: RT |
| ultracentrifuge grade microtubes Abbreviation used in paper: Beckman-Coulter Optima Max XP | Beckman Coultier | 343776 | Storage, Handling, Troubleshooting Notes: 8x34 mm PC |
| UV light curing glue Abbreviation used in paper: UV glue | Pharda | SKG-2869 |
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463 (7280), 485-492 (2010).
- Koenderink, G. H., Paluch, E. K. Architecture shapes contractility in actomyosin networks. Current Opinion in Cell Biology. 50, 79-85 (2018).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Burla, F., Mulla, Y., Vos, B. E., Aufderhorst-Roberts, A., Koenderink, G. H. From mechanical resilience to active material properties in biopolymer networks. Nature Reviews Physics. 1 (4), 249-263 (2019).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State and Materials Science. 15 (5), 177-182 (2011).
- Xiao, Q., Hu, X., Wei, Z., Tam, K. Y. Cytoskeleton molecular motors: structures and their functions in neuron. International Journal of Biological Sciences. 12 (9), 1083-1092 (2016).
- Ajeti, V. et al. Wound healing coordinates actin architectures to regulate mechanical work. Nature Physics. 15 (7), 696-705 (2019).
- Jung, W. et al. Dynamic motions of molecular motors in the actin cytoskeleton. Cytoskeleton. 76 (11-12), 517-531 (2019).
- Pollard, T. D., O'Shaughnessy, B. Molecular mechanism of cytokinesis. Annual Review of Biochemistry. 88 (1), 661-689 (2019).
- Huber, F., Boire, A., López, M. P., Koenderink, G. H. Cytoskeletal crosstalk: when three different personalities team up. Current Opinion in Cell Biology. 32, 39-47 (2015).
- Rivero, F. et al. The role of the cortical cytoskeleton: F-actin crosslinking proteins protect against osmotic stress, ensure cell size, cell shape and motility, and contribute to phagocytosis and development. Journal of Cell Science. 109 (11), 2679-2691 (1996).
- Duclos, G. et al. Topological structure and dynamics of three-dimensional active nematics. Science. 367 (6482), 1120-1124 (2020).
- Baclayon, M. et al. Optical tweezers-based measurements of forces and dynamics at microtubule ends. Optical Tweezers. 1486, 411-435 (2017).
- Gurmessa, B., Fitzpatrick, R., Falzone, T. T., Robertson-Anderson, R. M. Entanglement density tunes microscale nonlinear response of entangled actin. Macromolecules. 49 (10), 3948-3955 (2016).
- Francis, M. L. et al. Non-monotonic dependence of stiffness on actin crosslinking in cytoskeleton composites. Soft Matter. 15 (44), 9056-9065 (2019).
- Ricketts, S. N. et al. Varying crosslinking motifs drive the mesoscale mechanics of actin-microtubule composites. Scientific Reports. 9 (1), 12831 (2019).
- Lee, G. et al. Active cytoskeletal composites display emergent tunable contractility and restructuring. Soft Matter. 17 (47), 10765-10776 (2021).
- Murrell, M. P., Gardel, M. L. F-actin buckling coordinates contractility and severing in a biomimetic actomyosin cortex. Proceedings of the National Academy of Sciences. 109 (51), 20820-20825 (2012).
- Soares e Silva, M. et al. Active multistage coarsening of actin networks driven by myosin motors. Proceedings of the National Academy of Sciences. 108 (23), 9408-9413 (2011).
- Sonn-Segev, A., Bernheim-Groswasser, A., Roichman, Y. Dynamics in steady state in vitro acto-myosin networks. Journal of Physics: Condensed Matter. 29 (16), 163002 (2017).
- Ideses, Y., Sonn-Segev, A., Roichman, Y., Bernheim-Groswasser, A. Myosin II does it all: assembly, remodeling, and disassembly of actin networks are governed by myosin II activity. Soft Matter. 9 (29), 7127 (2013).
- Fürthauer, S. et al. Self-straining of actively crosslinked microtubule networks. Nature Physics. 15 (12), 1295-1300 (2019).
- Lemma, L. M. et al. Multiscale microtubule dynamics in active nematics. Physical Review Letters. 127 (14), 148001 (2021).
- Fan, Y., Wu, K.-T., Aghvami, S. A., Fraden, S., Breuer, K. S. Effects of confinement on the dynamics and correlation scales in kinesin-microtubule active fluids. Physical Review E. 104 (3), 034601 (2021).
- Triclin, S. et al. Self-repair protects microtubules from destruction by molecular motors. Nature Materials. 20 (6), 883-891 (2021).
- Lee, G. et al. Myosin-driven actin-microtubule networks exhibit self-organized contractile dynamics. Science Advances. 7 (6), eabe4334 (2021).
- Ricketts, S. N., Ross, J. L., Robertson-Anderson, R. M. Co-entangled actin-microtubule composites exhibit tunable stiffness and power-law stress relaxation. Biophysical Journal. 115 (6), 1055-1067 (2018).
- Bendix, P. M. et al. A quantitative analysis of contractility in active cytoskeletal protein networks. Biophysical Journal. 94 (8), 3126-3136 (2008).
- Linsmeier, I. et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7 (1), 12615 (2016).
- Stam, S. et al. Filament rigidity and connectivity tune the deformation modes of active biopolymer networks. Proceedings of the National Academy of Sciences. 114 (47), E10037-E10045 (2017).
- Yadav, V. et al. Filament nucleation tunes mechanical memory in active polymer networks. Advanced Functional Materials. 29 (49), 1905243 (2019).
- Ennomani, H. et al. Architecture and connectivity govern actin network contractility. Current Biology. 26 (5), 616-626 (2016).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (9), 591-597 (2013).
- Alvarado, J., Cipelletti, L., Koenderink, G. H. Uncovering the dynamic precursors to motor-driven contraction of active gels. Soft Matter. 15 (42), 8552-8565 (2019).
- Jung, W., Murrell, M. P., Kim, T. F-actin cross-linking enhances the stability of force generation in disordered actomyosin networks. Computational Particle Mechanics. 2 (4), 317-327 (2015).
- Lenz, M., Thoresen, T., Gardel, M. L., Dinner, A. R. Contractile units in disordered actomyosin bundles arise from f-actin buckling. Physical Review Letters. 108 (23), 238107 (2012).
- Memarian, F.L. et al. Active nematic order and dynamic lane formation of microtubules driven by membrane-bound diffusing motors. Proceedings of the National Academy of Sciences. 118 (52), e2117107118 (2021).
- Needleman, D., Dogic, Z. Active matter at the interface between materials science and cell biology. Nature Reviews Materials. 2 (9), 17048 (2017).
- Foster, P. J., Fürthauer, S., Shelley, M. J., Needleman, D. J. Active contraction of microtubule networks. eLife. 4, e10837 (2015).
- Thijssen, K. et al. Submersed micropatterned structures control active nematic flow, topology, and concentration. Proceedings of the National Academy of Sciences. 118 (38), e2106038118 (2021).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Colen, J. et al. Machine learning active-nematic hydrodynamics. Proceedings of the National Academy of Sciences. 118 (10), e2016708118 (2021).
- Mitchell, K. A., Tan, A. J., Arteaga, J., Hirst, L. S. Fractal generation in a two-dimensional active-nematic fluid. Chaos: An Interdisciplinary Journal of Nonlinear Science. 31 (7), 073125 (2021).
- Pandolfi, R. J., Edwards, L., Johnston, D., Becich, P., Hirst, L. S. Designing highly tunable semiflexible filament networks. Physical Review E. 89 (6), 062602 (2014).
- Tan, A. J. et al. Topological chaos in active nematics. Nature Physics. 15 (10), 1033-1039 (2019).
- Roostalu, J., Rickman, J., Thomas, C., Nédélec, F., Surrey, T. Determinants of polar versus nematic organization in networks of dynamic microtubules and mitotic motors. Cell. 175 (3), 796-808.e14 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sheung, J. Y. et al. Motor-driven restructuring of cytoskeleton composites leads to tunable time-varying elasticity. ACS Macro Letters. 10 (9), 1151-1158 (2021).
- McGorty, R. PyDDM v0.2.0. Zenodo. (2022).
- Achiriloaie, D. H. et al. Kinesin and myosin motors compete to drive rich multi-phase dynamics in programmable cytoskeletal composites. arXiv. (2021).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), eaay5912 (2019).
- McGorty, R. Image-Correlation. at <https://github.com/rmcgorty/Image-Correlation>. (2020).
- Robertson, C. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- McGorty, R. Differential Dynamic Microscopy - Python. at <https://github.com/rmcgorty/Differential-Dynamic-Microscopy---Python>. (2021).
- Cerbino, R., Trappe, V. Differential dynamic microscopy: probing wave vector dependent dynamics with a microscope. Physical Review Letters. 100 (18), 188102 (2008).
- Robertson-Anderson, R. M. Optical tweezers microrheology: from the basics to advanced techniques and applications. ACS Macro Letters. 7 (8), 968-975 (2018).
- Pollard, T. D. Polymerization of ADP-actin. Journal of Cell Biology. 99 (3), 769-777 (1984).
- Coué, M., Brenner, S. L., Spector, I., Korn, E. D. Inhibition of actin polymerization by latrunculin A. FEBS Letters. 213 (2), 316-318 (1987).
- Pollard, T. D. Actin and actin-binding proteins. Cold Spring Harbor Perspectives in Biology. 8 (8), a018226 (2016).
- Kumar, N. Taxol-induced polymerization of purified tubulin. Mechanism of action. Journal of Biological Chemistry. 256 (20), 10435-10441 (1981).
- Käs, J. et al. F-actin, a model polymer for semiflexible chains in dilute, semidilute, and liquid crystalline solutions. Biophysical Journal. 70 (2), 609-625 (1996).
- Viamontes, J., Narayanan, S., Sandy, A. R., Tang, J. X. Orientational order parameter of the nematic liquid crystalline phase of F -actin. Physical Review E. 73 (6), 061901 (2006).
- Hitt, A. L., Cross, A. R., Williams, R. C. Microtubule solutions display nematic liquid crystalline structure. Journal of Biological Chemistry. 265 (3), 1639-1647 (1990).
- Andexer, J. N., Richter, M. Emerging enzymes for ATP regeneration in biocatalytic processes. ChemBioChem. 16 (3), 380-386 (2015).
- Farhadi, L. et al. Actin and microtubule crosslinkers tune mobility and control co-localization in a composite cytoskeletal network. Soft Matter. 16 (31), 7191-7201 (2020).
- Falzone, T. T., Lenz, M., Kovar, D. R., Gardel, M. L. Assembly kinetics determine the architecture of α-actinin crosslinked F-actin networks. Nature Communications. 3 (1), 861 (2012).
- Thoresen, T., Lenz, M., Gardel, M. L. Reconstitution of contractile actomyosin bundles. Biophysical Journal. 100 (11), 2698-2705 (2011).
- Sanghvi-Shah, R., Weber, G. F. Intermediate filaments at the junction of mechanotransduction, migration, and development. Frontiers in Cell and Developmental Biology. 5, 81 (2017).
- Shen, Y. et al. Effects of vimentin intermediate filaments on the structure and dynamics of in vitro multicomponent interpenetrating cytoskeletal networks. Physical Review Letters. 127 (10), 108101 (2021).
- Laan, L., Roth, S., Dogterom, M. End-on microtubule-dynein interactions and pulling-based positioning of microtubule organizing centers. Cell Cycle. 11 (20), 3750-3757 (2012).
Erratum
Erratum: Reconstituting and Characterizing Actin-Microtubule Composites with Tunable Motor-Driven Dynamics and MechanicsAn erratum was issued for: Reconstituting and Characterizing Actin-Microtubule Composites with Tunable Motor-Driven Dynamics and Mechanics. The Authors section was updated.
Mehrzad Sasanpour1
Daisy H. Achiriloaie1,2
Gloria Lee1
Gregor Leech1
Christopher Currie1
K. Alice Lindsay3
Jennifer L. Ross3
Ryan J. McGorty1
Rae M. Robertson-Anderson1
1Department of Physics and Biophysics, University of San Diego
2W. M. Keck Science Department, Scripps College, Pitzer College, and Claremont McKenna College
3Department of Physics, Syracuse University
to:
Mehrzad Sasanpour1
Daisy H. Achiriloaie1,2
Gloria Lee1
Gregor Leech1
Maya Hendija1
K. Alice Lindsay3
Jennifer L. Ross3
Ryan J. McGorty1
Rae M. Robertson-Anderson1
1Department of Physics and Biophysics, University of San Diego
2W. M. Keck Science Department, Scripps College, Pitzer College, and Claremont McKenna College
3Department of Physics, Syracuse University
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved