Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
असमर्थ मोटर-संचालित गतिशीलता और यांत्रिकी के साथ एक्टिन-माइक्रोट्यूबुल्स कंपोजिट का पुनर्गठन और विशेषता
ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …यह पेपर इंजीनियरिंग के लिए प्रोटोकॉल प्रस्तुत करता है और सह-उलझा हुआ एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं के असमर्थ त्रि-आयामी समग्र नेटवर्क को चिह्नित करता है। कंपोजिट सक्रिय पुनर्गठन और बैलिस्टिक गति से गुजरते हैं, जो मायोसिन II और किनेसिन मोटर्स द्वारा संचालित होते हैं, और एक्टिन, सूक्ष्मनलिकाएं, मोटर प्रोटीन और निष्क्रिय क्रॉसलिंकर की सापेक्ष सांद्रता से ट्यून किए जाते हैं।
मिश्रित साइटोस्केलेटन, जिसमें अर्ध-लचीले एक्टिन फिलामेंट्स और कठोर सूक्ष्मनलिकाएं के अंतःक्रियात्मक नेटवर्क शामिल हैं, माइग्रेशन, साइटोकिनेसिस, आसंजन और मेकेनोसेंसिंग जैसी प्रमुख प्रक्रियाओं को चलाने के लिए मायोसिन II और काइन्सिन जैसे मोटर प्रोटीन का उपयोग करके बलों का पुनर्गठन और उत्पन्न करते हैं। जबकि एक्टिन-सूक्ष्मनलिकाएं साइटोस्केलेटन की बहुमुखी प्रतिभा और अनुकूलनशीलता के लिए महत्वपूर्ण हैं, मायोसिन और काइन्सिन गतिविधि के साथ उनके अंतःक्रिया की समझ अभी भी नवजात है। यह काम वर्णन करता है कि सह-उलझे हुए एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं के असमर्थ त्रि-आयामी समग्र नेटवर्क को कैसे इंजीनियर किया जाए जो मायोसिन II और किन्सिन मोटर्स द्वारा संचालित सक्रिय पुनर्गठन और बैलिस्टिक गति से गुजरते हैं, और एक्टिन, सूक्ष्मनलिकाएं, मोटर प्रोटीन और निष्क्रिय क्रॉसलिंकर की सापेक्ष सांद्रता से ट्यून किए जाते हैं। मल्टी-स्पेक्ट्रल कॉन्फोकल इमेजिंग का उपयोग करके समग्र पुनर्गठन और गति को सबसे प्रभावी ढंग से कल्पना करने के लिए सूक्ष्मनलिकाएं और एक्टिन फिलामेंट्स के फ्लोरेसेंस लेबलिंग के लिए प्रोटोकॉल भी विस्तृत हैं। अंत में, डेटा विश्लेषण विधियों के परिणाम जो मात्रात्मक रूप से गैर-संतुलन संरचना, गतिशीलता और यांत्रिकी को चिह्नित करने के लिए उपयोग किए जा सकते हैं, प्रस्तुत किए जाते हैं। इस असमर्थ बायोमिमेटिक प्लेटफॉर्म को फिर से बनाना और जांच करना मूल्यवान अंतर्दृष्टि प्रदान करता है कि कैसे युग्मित मोटर गतिविधि, समग्र यांत्रिकी और फिलामेंट गतिशीलता माइटोसिस से ध्रुवीकरण से लेकर मेकेनो-सनसनी तक असंख्य सेलुलर प्रक्रियाओं को जन्म दे सकती है।
साइटोस्केलेटन इंटरैक्टिंग बायोपॉलिमर का एक गतिशील समग्र नेटवर्क है जो कोशिकाओं को संरचनात्मक और यांत्रिक सहायता प्रदान करता है। संबद्ध आणविक मोटर्स और बाध्यकारी प्रोटीन कोशिकाओं को बढ़ने, आकार बदलने, कठोर होने, स्थानांतरित करने और यहां तक कि आत्म-उपचार करने की अनुमति देने के लिए साइटोस्केलेटन को पुनर्गठित और अनुकूलित करते हैं, जिससे माइग्रेशन और डिवीजन से लेकर मेकेनोसेंसिंग 1,2 तक असंख्य सेलुलर प्रक्रियाएं सक्षम होती हैं। सेलुलर बायोफिज़िक्स में इसके महत्व से परे, साइटोस्केलेटन घाव भरने और दवा वितरण से लेकर निस्पंदन और नरम रोबोटिक्स 1,3,4,5,6,7,8,9 तक संभावित सामग्री अनुप्रयोगों के साथ सक्रिय पदार्थ का एक सर्वोत्कृष्ट उदाहरण भी है।
साइटोस्केलेटन को इसकी अनूठी संरचनात्मक और यांत्रिक विविधता और बहुक्रियाशीलता के साथ संपन्न करने वाली दो प्रमुख विशेषताएं हैं: 1) इसकी समग्र प्रकृति, जिसमें कई अंतःक्रियात्मक प्रोटीन फिलामेंट्स शामिल हैं, जैसे कि अर्ध-लचीला एक्टिन फिलामेंट्स और कठोर सूक्ष्मनलिकाएं, साथ ही साथ उनके संबंधित बंधन और क्रॉसलिंकिंग प्रोटीन 3,5,10; और 2) ऊर्जा-खपत मोटर्स, जैसे मायोसिन और किन्सिन के माध्यम से लगातार पुनर्गठन, स्थानांतरित, मोटा और काम करने की क्षमता, फिलामेंटस प्रोटीन 1,7,11,12,13 पर धक्का देना और खींचना। जबकि यह सुरुचिपूर्ण जटिलता साइटोस्केलेटन को सेल गतिशीलता, साइटोकिनेसिस और घाव भरने 3,6,7,11 के रूप में विविध प्रक्रियाओं को मध्यस्थ करने में सक्षम बनाती है, यह शोधकर्ताओं की क्षमता को पुनर्गठित इन विट्रो सिस्टम में साइटोस्केलेटन की विवो विशेषताओं में हस्ताक्षर को पुन: उत्पन्न करने की क्षमता में बाधा डालती है।
वर्तमान सीमांत पुनर्गठन प्रयास उलझे हुए और क्रॉसलिंक्ड एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं 3,10,14,15,16,17, बल-जनरेटिंग एक्टोमायोसिन नेटवर्क 2,8,18,19,20,21 और काइन्सिन-माइक्रोट्यूबुल्स द्वारा संचालित सक्रिय न्यूमैटिक्स के कंपोजिट पर ध्यान केंद्रित करते हैं इंटरैक्शन 22,23,24,25,26. स्थिर-राज्य एक्टिन-सूक्ष्मनलिका कंपोजिट को उभरते यांत्रिक गुणों को प्रदर्शित करने के लिए दिखाया गया है 15,16,27, जैसे कि बढ़ी हुई फिलामेंट गतिशीलता और एकल-घटक प्रणालियों की तुलना में कठोरता में वृद्धि। इन विट्रो एक्टोमायोसिन सिस्टम पर अध्ययन ने संरचनात्मक और गतिशील गुणों की एक विस्तृत श्रृंखला की सूचना दी है जो एक्टिन, मायोसिन और क्रॉसलिंकर 28,29,30,31 की सांद्रता पर निर्भर करते हैं। उदाहरण के लिए, पर्याप्त क्रॉसलिंकिंग के साथ, एक्टोमायोसिन नेटवर्क बड़े पैमाने पर संकुचन और मोटे 2,28,30,32,33,34,35,36 से गुजरते हैं, जबकि क्रॉसलिंकर के बिना, नेटवर्क तेजी से, अस्थिर प्रवाह प्रदर्शित करते हैं और 19,29 को तोड़ते हैं . पुनर्गठित सूक्ष्मनलिका-आधारित सक्रिय नेमैटिक्स जो सूक्ष्मनलिका बंडलों को क्रॉसलिंक करने और खींचने के लिए काइन्सिन मोटर्स के समूहों का उपयोग करते हैं, को लंबे समय तक चलने वाले अशांत प्रवाह, विस्तार, बकलिंग, फ्रैक्चरिंग और उपचार 12,22,23,24,25,37,38,39,40,41 का प्रदर्शन करने के लिए सूचित किया गया है। 42,43,44,45,46,47.
हाल ही में, मायोसिन II मिनी-फिलामेंट्स द्वारा संचालित एक्टिन-माइक्रोट्यूबुल्स कंपोजिट को अव्यवस्थित प्रवाह और नेटवर्क टूटने की तुलना में अधिक व्यवस्थित संकुचन और नेटवर्क अखंडता का कारण दिखाया गया है जो क्रॉसलिंकर के बिना एक्टोमायोसिन नेटवर्क 17,26,48 प्रदर्शित करता है। इसके अलावा, समग्र मजबूती और बल-उत्पादन का संयोजन अनुकूलित किया जाता है जब एक्टिन और सूक्ष्मनलिकाएं तुलनीय सांद्रता पर मौजूद होती हैं। सूत्रीकरण अंतरिक्ष के इस क्षेत्र में प्रमुख उभरती विशेषताओं में बढ़ी हुई यांत्रिक शक्ति26, एक्टिन और सूक्ष्मनलिकाएं26 की समन्वित गति, स्थिर निरंतर संकुचन और मेसोस्केल पुनर्गठन17 शामिल हैं।
यहां, प्रोटोकॉल को सूक्ष्मनलिकाएं और एक्टिन फिलामेंट्स के सह-उलझे हुए और क्रॉसलिंक्ड कंपोजिट को इंजीनियर करने और ट्यून करने के लिए वर्णित किया गया है, जिन्हें क्रमशः एक्टिन फिलामेंट्स और माइक्रोट्यूबुल्स पर काम करने वाले मायोसिन II मिनी-फिलामेंट्स और किनेसिन क्लस्टर द्वारा संतुलन से बाहर धकेल दिया जाता है (चित्रा 1)। कंपोजिट के इस वर्ग की गतिशीलता, संरचना और यांत्रिकी को तंतुओं, मोटर्स और क्रॉसलिंकर की सापेक्ष सांद्रता द्वारा ट्यून किया जा सकता है ताकि उत्तेजक और अशांत प्रवाह, आइसोट्रोपिक संकुचन, त्वरण, मंदी, डी-मिक्सिंग, कठोरता, विश्राम और टूटने के समृद्ध चरण स्थान का प्रदर्शन किया जा सके। इस काम का ध्यान सक्रिय साइटोस्केलेटल कंपोजिट के इस वर्ग को तैयार करने और ट्यून करने पर है। हालांकि, वर्णित सक्रिय कंपोजिट को बेंचमार्क करने और चिह्नित करने में शोधकर्ताओं की सहायता के लिए, बहु-वर्णक्रमीय कॉन्फोकल माइक्रोस्कोपी का उपयोग करके प्रभावी इमेजिंग विधियां भी विस्तृत हैं। अंत में, प्रमुख कम्प्यूटेशनल विश्लेषण विधियों के परिणाम जो कंपोजिट की गतिशीलता, संरचना और यांत्रिकी को मापने के लिए उपयोग किए जा सकते हैं, प्रस्तुत किए जाते हैं। शोधकर्ताओं को इन तरीकों को अपनाने के लिए प्रोत्साहित किया जाता है - जिसमें अंतर गतिशील माइक्रोस्कोपी (डीडीएम), स्थानिक छवि ऑटोकोरिलेशन (एसआईए), और कण छवि वेलोसिमेट्री (पीआईवी) शामिल हैं - क्योंकि उन्हें कंपोजिट 17,26,49 की जटिल गतिशीलता और संरचनात्मक विविधता को चिह्नित करने के लिए अनुकूलित किया गया है।
नीचे वर्णित चरण कंपोजिट तैयार करने और कॉन्फोकल माइक्रोस्कोपी का उपयोग करके उन्हें इमेजिंग करने पर ध्यान केंद्रित करते हैं। अधिग्रहण के बाद डेटा विश्लेषण और ऑप्टिकल ट्वीज़र्स माप का वर्णन करने वाले प्रोटोकॉल पिछले कार्यों 17,26,48,50 में पाए जा सकते हैं, और अनुरोध पर प्रदान किए जा सकते हैं। सभी सामग्री प्रदान की गई सामग्री की तालिका में सूचीबद्ध हैं।
1. कक्ष सतहों पर प्रोटीन के सोखने को रोकने के लिए सिलैनाइज्ड कवरलिप्स और माइक्रोस्कोप स्लाइड तैयार करें
नोट: यह एक 2-दिवसीय प्रक्रिया है। उपयोग से 1 महीने पहले तक सिलैनाइज्ड स्लाइड तैयार की जा सकती हैं।
- एक निर्दिष्ट रैक में नंबर 1 कवरलिप्स (24 मिमी x 24 मिमी) और माइक्रोस्कोप स्लाइड (एक्स 3 इंच में 1) रखें जो प्लाज्मा क्लीनर में फिट होंगे। रैक को प्लाज्मा क्लीनर में रखें और 20 मिनट तक चलाएं।
- कवरलिप और स्लाइड को केवल सिलेन के साथ उपयोग के लिए नामित एक नए रैक में स्थानांतरित करें और नीचे वर्णित चश्मे को साफ करने के लिए ग्लास कंटेनर में रैक रखें।
- 1 घंटे के लिए 100% एसीटोन में कवरलिप्स और स्लाइड्स को डुबोएं। 10 मिनट के लिए 100% इथेनॉल में कवरलिप और स्लाइड को डुबोएं।
- 5 मिनट के लिए विआयनीकृत पानी (डीआई) में कवरलिप और स्लाइड को डुबोएं। सफाई चरणों को दो बार दोहराएं।
- 15 मिनट के लिए ताजा तैयार 0.1 एम केओएच में कवरलिप और स्लाइड को डुबोएं। 5 मिनट के लिए ताजा डीआई में कवरलिप और स्लाइड ्स को डुबोएं। इस चरण को दो बार दोहराएं।
- 10 मिनट के लिए एयर ड्राई कवरलिप्स और स्लाइड्स। नीचे वर्णित हाइड्रोफोबिक सतहों का उत्पादन करने के लिए सिलेन के साथ साफ कवरलिप और स्लाइड का इलाज करें।
नोट: फ्यूम हुड में निम्नलिखित चरणों को पूरा करें।- सूखे कवरलिप और स्लाइड को 2% सिलेन (टोल्यूनि में घुलित) में 5 मिनट के लिए डुबोएं। पांच बार तक पुन: उपयोग करने के लिए अपनी निर्दिष्ट बोतल में सिलेन वापस डालने के लिए एक फ़नल का उपयोग करें।
- 5 मिनट के लिए 100% इथेनॉल में कवरलिप्स और स्लाइड्स को डुबोएं। इथेनॉल को ताजा इथेनॉल के साथ बदलें। 5 मिनट के लिए कवरलिप्स और स्लाइड्स को डुबोएं।
- 5 मिनट के लिए ताजा डीआई में कवरलिप और स्लाइड ्स को डुबोएं। हर बार ताजा इथेनॉल और डीआई का उपयोग करके इथेनॉल और डीआई वॉश स्टेप को दो बार दोहराएं। 10 मिनट के लिए एयर ड्राई कवरलिप्स और स्लाइड्स।
2. मायोसिन मिनी-फिलामेंट्स द्वारा संचालित सक्रिय एक्टिन-सूक्ष्मनलिकाएं समग्र तैयार करना
- एक्टिन फिलामेंट बाइंडिंग के माध्यम से निष्क्रिय मायोसिन को हटा दें और नीचे वर्णित अल्ट्रासेंट्रीफ्यूजेशन के माध्यम से पुल-डाउन करें।
- फिलामेंट्स में एक्टिन को पॉलीमराइज करें। एक सटीक माइक्रोपिपेट और बाँझ पाइप युक्तियों का उपयोग करके, एक माइक्रोसेंट्रीफ्यूज ट्यूब में मिलाएं: डीआई का 1.87 μL, 10x G-बफर का 1.3 μL, 10x F-बफर का 1.3 μL, 4 M KCl का 1.63 μL, 4.53 μL एक्टिन (47.6 μM), और 100 μM plloidin का 1.08 μM phalloidin।
नोट: पर्याप्त पोलीमराइजेशन सुनिश्चित करने के लिए, एक्टिन एकाग्रता और एक्टिन: फेलोइडिन मोलर अनुपात क्रमशः 18.4 μM और 2: 1 होना चाहिए। - मिश्रण करने के लिए घोल को धीरे-धीरे ऊपर और नीचे पाइप करें और फिर ≥1 घंटे के लिए अंधेरे में बर्फ पर सेट करें। 4 डिग्री सेल्सियस तक ठंडा अल्ट्रासेंट्रीफ्यूज। मायोसिन एलिकोट को -80 डिग्री सेल्सियस से हटा दें और बर्फ पर रखें।
नोट: इस बिंदु पर चरण 2.2 को पूरा करें जबकि एक्टिन बहुलक है। - ≥1 घंटे के एक्टिन पोलीमराइजेशन के बाद, पॉलीमराइज्ड एक्टिन में 10 एमएम एटीपी का 1.3 μL और 19 μM मायोसिन का 2 μL जोड़ें।
नोट: निष्क्रिय मायोसिन मोटर्स (यानी, मृत सिर) को पर्याप्त हटाने के लिए एक्टिन: मायोसिन मोलर अनुपात >5 होना चाहिए। - मिश्रण करने के लिए घोल को धीरे-धीरे ऊपर और नीचे पाइप करें। एक अल्ट्रासेंट्रीफ्यूज ग्रेड ट्यूब में स्थानांतरित करें।
सेंट्रीफ्यूज 4 डिग्री सेल्सियस और 30 मिनट के लिए 121,968 x g पर।
- फिलामेंट्स में एक्टिन को पॉलीमराइज करें। एक सटीक माइक्रोपिपेट और बाँझ पाइप युक्तियों का उपयोग करके, एक माइक्रोसेंट्रीफ्यूज ट्यूब में मिलाएं: डीआई का 1.87 μL, 10x G-बफर का 1.3 μL, 10x F-बफर का 1.3 μL, 4 M KCl का 1.63 μL, 4.53 μL एक्टिन (47.6 μM), और 100 μM plloidin का 1.08 μM phalloidin।
- नीचे वर्णित एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं का सह-उलझा हुआ समग्र नेटवर्क तैयार करें।
नोट: मायोसिन स्पिन-डाउन से 30 मिनट पहले शुरू करें (चरण 2.1.4)।- एक हीट ब्लॉक को 37 डिग्री सेल्सियस पर सेट करें। माइक्रोसेंट्रीफ्यूज ट्यूब में निम्नलिखित जोड़ने के लिए एक सटीक माइक्रोपिपेट और बाँझ पाइप युक्तियों का उपयोग करें: 100 mM GTP का 13.9 μL, 1% ट्वीन 20 का 3 μL, 47.6 का 1.55 μL, 34.8 का 0.36 μM R-actin, 5-488-ट्यूबुलिन का 0.3 μL, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM ATP, 0.87 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM ATP, 0.87 μL of 47.6 μM actin, 0.36 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM GTP, 0.87%010%, 0.3%300 mM ATP, 0.87 μL of 47.6 mM actin, 0.36 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM GTP, 0.3%3 और 200 μM Taxol का 0.75 μL, 23 μL की कुल मात्रा के लिए।
नोट: सूचीबद्ध एक्टिन और ट्यूबुलिन की सांद्रता 2.9 μM एक्टिन और 2.9 μM ट्यूबुलिन के साथ एक समग्र के लिए हैं। कुल प्रोटीन सांद्रता c = cA + cT = 5.8 μM है और मोलरएक्टिन अंश c A/(cA + cT) = त्रिभुजA = 0.5 है। इन मानों को समायोजित करने के लिए चरण 2.5 देखें। - धीरे से मिश्रण करने के लिए घोल को ऊपर और नीचे पाइप करें और 1 घंटे के लिए प्रकाश से संरक्षित 37 डिग्री सेल्सियस गर्मी ब्लॉक पर रखें।
- एक हीट ब्लॉक को 37 डिग्री सेल्सियस पर सेट करें। माइक्रोसेंट्रीफ्यूज ट्यूब में निम्नलिखित जोड़ने के लिए एक सटीक माइक्रोपिपेट और बाँझ पाइप युक्तियों का उपयोग करें: 100 mM GTP का 13.9 μL, 1% ट्वीन 20 का 3 μL, 47.6 का 1.55 μL, 34.8 का 0.36 μM R-actin, 5-488-ट्यूबुलिन का 0.3 μL, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM ATP, 0.87 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM ATP, 0.87 μL of 47.6 μM actin, 0.36 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM GTP, 0.87%010%, 0.3%300 mM ATP, 0.87 μL of 47.6 mM actin, 0.36 μL of 100 mM GTP, 0.3 μL of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM GTP, 0.87 μL of 100 mM GTP, 0.3%L of 100 mM GTP, 0.3%3 और 200 μM Taxol का 0.75 μL, 23 μL की कुल मात्रा के लिए।
- नीचे वर्णित के रूप में कॉन्फोकल इमेजिंग प्रयोगों के लिए नमूना कक्ष तैयार करें।
नोट: प्रतीक्षा अवधि के दौरान चरण 2.1.4 और 2.2.2 को पूरा करें।- एक गर्म प्लेट पर दो सिलनाइज्ड स्लाइड्स को साथ-साथ रखें (बंद कर दिया गया), स्लाइड्स में थर्मोप्लास्टिक सीलिंग फिल्म की दो स्ट्रिप्स ~ 3 मिमी अलग रखें, और नमूना कक्ष बनाने के लिए थर्मोप्लास्टिक सीलिंग फिल्म के ऊपर दो सिलनाइज्ड कवरलिप रखें।
- गर्म प्लेट को कम सेटिंग पर तब तक घुमाएं जब तक कि कवरलिप पिघले हुए थर्मोप्लास्टिक सीलिंग फिल्म (~ 1-2 मिनट) के साथ स्लाइड से मजबूती से बंध न जाएं। दोनों सतहों के बीच ~ 100 μm की दूरी बनाए रखते हुए संबंध सुनिश्चित करने के लिए दबाव के साथ भी दबाएं।
- कक्षों को हटा दें और गर्म प्लेट बंद कर दें। (+) और (-) के साथ कक्षों को लेबल करें। (+) कक्ष सक्रिय नमूने (मायोसिन के साथ) के लिए होगा और (-) कक्ष नियंत्रण (कोई मायोसिन नहीं) होगा। सुनिश्चित करें कि प्रत्येक कक्ष ≤10 μL तरल पदार्थ को समायोजित कर सकता है।
- नीचे वर्णित छवि के लिए नमूने तैयार करें।
नोट: चरण 2.1 और 2.2 पूरा होने के तुरंत बाद इस चरण को पूरा करना महत्वपूर्ण है।- अल्ट्रासेंट्रीफ्यूज (चरण 2.1.4) से मायोसिन-एक्टिन नमूने को सावधानीपूर्वक हटा दें और तुरंत सतह पर तैरने वाले के शीर्ष 7.5 μL को पाइप करें और एक नए माइक्रोसेंट्रीफ्यूज ट्यूब में स्थानांतरित करें।
- हीट ब्लॉक से एक्टिन-माइक्रोट्यूबुल्स नमूने को हटा दें और धीरे से 10x D-Glucose के 1.5 μL, 10x GOC के 1.5 μL और 1 mM blebbistatin के 1.5 μL में मिलाएं। समाधान को दो 13.7 μL एलिकोट में विभाजित करें और (+) और (-) के रूप में लेबल करें।
- चरण 2.4.1 से (+) एलिकोट तक सतह पर तैरने वाले के 1.28 μL में मिलाएं। डीआई के 1.28 μL में (-) एलिकोट में मिलाएं। धीरे-धीरे प्रत्येक समाधान को केशिका क्रिया के माध्यम से संबंधित कक्ष (चरण 2.3) में प्रवाहित करें। सावधान रहें कि चैनल में हवा के बुलबुले पेश न करें।
- तेजी से सूखने वाले एपॉक्सी या यूवी गोंद के साथ प्रत्येक चैनल के दो खुले सिरों को सील करें। सुनिश्चित करें कि चिपकने वाला माइक्रोस्कोप पर रखने से पहले पूरी तरह से सूखा है। छवि तुरंत चरण 3 में वर्णित है।
नोट: यूवी गोंद फायदेमंद है क्योंकि यह यूवी एक्सपोजर पर लगभग तुरंत ठीक हो जाता है। हालांकि, क्योंकि ब्लेबिस्टैटिन यूवी संवेदनशील है, इसलिए ब्लेबिस्टैटिन को निष्क्रिय करने से बचने के लिए एक छोटी यूवी छड़ी का उपयोग करके गोंद (नमूना कक्ष के किनारों पर) को केवल स्थानीय रूप से रोशन करना महत्वपूर्ण है।
- वैकल्पिक: कंपोजिट की गतिशीलता और संरचना को ट्यून करने के लिए प्रोटीन सांद्रता को अलग-अलग करें।
नोट: यदि वांछित हो तो एक्टिन, सूक्ष्मनलिकाएं और मायोसिन की सांद्रता को अलग करने के लिए निम्नलिखित चरणों में परिवर्तन का सुझाव दिया गया है।- चरण 2.2.1 और 2.4.3 में निम्नलिखित संशोधनों को छोड़कर ऊपर वर्णित चरणों का पालन करें।
- एक्टिन और सूक्ष्मनलिकाएं की सांद्रता को अलग-अलग करने के लिए, जिससे सी और ए ए को समायोजित किया जाता है, चरण 2.2.1 में उपयोग किए जाने वाले एक्टिन, आर-एक्टिन और 5-488-ट्यूबुलिन की मात्रा को बढ़ाता या घटाता है, जैसा कि वांछित26 है। एक्टिन एकाग्रता को बदलते समय, एक्टिन के साथ समान दाढ़ अनुपात बनाए रखने के लिए आनुपातिक रूप से आर-एक्टिन और फेलोइडिन दाढ़ सांद्रता को समायोजित करें। पीईएम की मात्रा को इस तरह समायोजित करें कि मिश्रण का अंतिम आयतन 23 μL रहे। अन्य सभी घटक वॉल्यूम और सांद्रता समान रहती है।
- मायोसिन एकाग्रता को अलग करने के लिए, चरण 2.4.3 में (+) एलिकोट में जोड़े गए मायोसिन की मात्रा को वांछित रूप से समायोजित करें। तदनुसार (-) एलिकोट में जोड़े गए डीआई वॉल्यूम को समायोजित करें। मायोसिन (+) और डीआई (-) वॉल्यूम में वृद्धि या कमी के लिए चरण 2.2.1 में पीईएम वॉल्यूम समायोजित करें, यह सुनिश्चित करते हुए कि प्रत्येक नमूने ((+) और (-)) का अंतिम वॉल्यूम 14.98 μL है।
3. कॉन्फोकल माइक्रोस्कोपी का उपयोग करके सक्रिय कंपोजिट की इमेजिंग और लक्षण वर्णन
- चरण 2 में तैयार एक्टोमायोसिन-माइक्रोट्यूबुल्स कंपोजिट की छवि बनाने के लिए, 60x 1.4 NA तेल-विसर्जन उद्देश्य के साथ लेजर स्कैनिंग कॉन्फोकल माइक्रोस्कोप (LSCM), या इसी तरह के माइक्रोस्कोप का उपयोग करें। एक साथ अलग-अलग फ्लोरेसेंस चैनलों में एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं की कल्पना करने के लिए, 565/591 एनएम उत्तेजना / उत्सर्जन फिल्टर के साथ 561 एनएम लेजर और 488/525 एनएम उत्तेजना / उत्सर्जन फिल्टर के साथ 488 एनएम लेजर का उपयोग करें।
- माइक्रोस्कोप पर नमूना कक्ष रखें ताकि नियंत्रण चैनल सीधे उद्देश्य पर तैनात हो। सुनिश्चित करें कि उद्देश्य और कवरस्लिप के बीच एक तेल इंटरफ़ेस है।
- नियंत्रण समग्र को फोकस में लाने के लिए चरण नियंत्रण का उपयोग करें, फिर नमूना कक्ष की दोनों सतहों को ढूंढें। जेड स्थिति को नमूना कक्ष के केंद्र में ले जाएं। चित्रा 2 में दिखाए गए अनुसार स्पष्ट फिलामेंटस नेटवर्क की उपस्थिति की जांच करें।
- अभी भी नियंत्रण कक्ष की कल्पना करते हुए, एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं के एक साथ विज़ुअलाइज़ेशन की अनुमति देने के लिए प्रत्येक लेजर की तीव्रता को समायोजित करें। फोटोब्लीचिंग (एक्टिन चैनल में अधिक प्रचलित) को रोकने के लिए सबसे कम लेजर तीव्रता बनाए रखें और खून बह रहा है (आमतौर पर सूक्ष्मनलिकाएं से एक्टिन चैनल में)।
- निष्क्रिय नियंत्रण नमूने को चिह्नित करने के लिए, कुल ≥1000 फ्रेम के लिए 2.65 एफपीएस पर 256 x 256 वर्ग पिक्सेल (213 μm x 213 μm) छवियों की तीन समय-श्रृंखला (वीडियो) एकत्र करें। प्रत्येक समय-श्रृंखला को नमूना कक्ष के एक अलग क्षेत्र में एकत्र करें जिसे ≥500 μm द्वारा अलग किया गया है। सुनिश्चित करें कि कम से कम पता लगाने योग्य गति है और कोई प्रवाह या पुनर्गठन नहीं है।
- 488 एनएम लेजर को बंद करें और (+) कक्ष में जाने के लिए मंच नियंत्रण का उपयोग करें।
- 568 एनएम लेजर का उपयोग करके, उचित नेटवर्क गठन (चित्रा 2) सुनिश्चित करने के लिए (+) चैनल में सूक्ष्मनलिकाएं की कल्पना करें और नमूना कक्ष के अक्षीय केंद्र की पहचान करें (जो नियंत्रण कक्ष के केंद्र जेड-स्थिति से अलग हो सकता है)।
- 488 एनएम लेजर चालू करें और निम्नलिखित संशोधनों के साथ ऊपर चरण 3.5 दोहराएं। 45 मिनट तक के लिए समय-श्रृंखला एकत्र करें, अधिग्रहण को रोकें जब नमूना या तो दृश्य के क्षेत्र से बाहर निकल जाता है, टूट जाता है, या फोटोब्लीच। 5-10 टाइम-सीरीज़ रिकॉर्ड करें और उस समय का ट्रैक रखें जिस पर प्रत्येक बार-श्रृंखला पहली बार-श्रृंखला की शुरुआत के सापेक्ष शुरू होती है।
- DDM, SIA, और PIV का उपयोग करके डेटा का विश्लेषण करें जैसा कि चित्रा 3, चित्रा 4, चित्रा 5, और पहले 17,48,50,51 में वर्णित है।
नोट: 488 एनएम लेजर स्थानीय रूप से ब्लेबिस्टैटिन को डी-एक्टिवेट करके मायोसिन एटीपीस गतिविधि को सक्रिय करता है, इसलिए इसे केवल डेटा अधिग्रहण की शुरुआत में चालू किया जाना चाहिए जैसे कि टी = 0 समय-श्रृंखला की शुरुआत में है। इन अधिग्रहण मापदंडों को विभेदक गतिशील माइक्रोस्कोपी (डीडीएम) विश्लेषण के लिए अनुकूलित किया गया है जैसा कि पहले कियागया था।
4. काइन्सिन मोटर्स द्वारा संचालित सक्रिय एक्टिन-सूक्ष्मनलिका कंपोजिट की तैयारी
नोट: निम्नलिखित चरण एक्टिन-सूक्ष्मनलिका कंपोजिट बनाते हैं जो किनेसिन मोटर्स या काइन्सिन और मायोसिन50 के संयोजन द्वारा संतुलन से बाहर संचालित होते हैं।
- नीचे वर्णित के रूप में काइन्सिन और मायोसिन मोटर्स तैयार करें।
- मायोसिन को शामिल करते समय, चरण 2.1 का पालन करें।
- सूक्ष्मनलिकाएं के जोड़े के बीच बलों को बांधने और बढ़ाने वाले किनेसिन मोटर क्लस्टर बनाने के लिए, एक बाँझ 1.5 एमएल माइक्रोसेंट्रीफ्यूज ट्यूब में निम्नलिखित जोड़ने के लिए एक माइक्रोपिपेट और बाँझ पिपेट युक्तियों का उपयोग करें: 1.16 μL PEM, 2.74 μL 8.87 μM kinesin dimers, 7.29 μL 83.3 μM Neutravidin, 0.81 μL 2mM DTT. घोल को ऊपर और नीचे करके धीरे-धीरे मिलाएं और प्रकाश से सुरक्षित (काले माइक्रोसेंट्रीफ्यूज ट्यूब का उपयोग करें या पन्नी में लपेटें) को 4 डिग्री सेल्सियस पर 30 मिनट के लिए इनक्यूबेट करें।
नोट: एनए के लिए काइन्सिन डिमर का दाढ़ अनुपात 1: 25 है।
- नमूना कक्ष तैयार करने और दो के बजाय तीन कक्ष बनाने के लिए चरण 2.3 का पालन करें। इस चरण को काइन्सिन इनक्यूबेशन (चरण 4.1.2) और मायोसिन अल्ट्रासेंट्रीफ्यूजेशन (चरण 4.1.1) के दौरान करें।
- एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं का सह-उलझा हुआ समग्र नेटवर्क तैयार करें।
- हीट ब्लॉक को 37 डिग्री सेल्सियस पर सेट करें। एक बाँझ 1.5 एमएल माइक्रोसेंट्रीफ्यूज ट्यूब में निम्नलिखित जोड़ने के लिए एक माइक्रोपिपेट और बाँझ पाइप युक्तियों का उपयोग करें: 3.21 μL PEM, 1% ट्वीन 20 का 4.5 μL, 47.6 μM actin का 2.18 μL, 5-R-ट्यूबुलिन का 3.46 μL, 4.5 mM TAXOL, और 100 mM ATP का 1.5 μL सुनिश्चित करें कि कुल मात्रा 25 μL है।
- धीरे से मिश्रण करने के लिए घोल को ऊपर और नीचे पाइप करें और 1 घंटे के लिए प्रकाश से संरक्षित 37 डिग्री सेल्सियस गर्मी ब्लॉक पर रखें। हीट ब्लॉक से ट्यूब को निकालें और 100 μM phalloidin के 0.84 μL में धीरे से मिश्रण करने के लिए एक माइक्रोपिपेट का उपयोग करें। कमरे के तापमान पर 5-10 मिनट के लिए इनक्यूबेट करें, प्रकाश से सुरक्षित।
नोट: चरण 4.3.1 के बजाय इस चरण में फेलोइडिन जोड़ने से एक्टिन फिलामेंट्स के फ्लोरेसेंस लेबलिंग में सुधार होता है, क्योंकि 488-फेलोइडिन को एक्टिन बाइंडिंग साइटों के लिए अनलेबल फेलोइडिन के साथ प्रतिस्पर्धा नहीं करनी पड़ती है।
- कॉन्फोकल इमेजिंग के लिए सक्रिय कंपोजिट तैयार करें।
- चरण 4.3.2 से घोल में 200 μM blebbistatin का 1.13 μL, 10x Glu का 1.35 μL और 10x GOC का 1.35 μL जोड़ें और ऊपर और नीचे पाइप करके धीरे-धीरे मिलाएं। समाधान को तीन 10 μL एलिकोट में विभाजित करें और लेबल (K), (K + M), और (-) के रूप में करें।
- चरण 2.1.4 से (K +M) एलिकोट तक मायोसिन के 2.54 μL में मिलाएं। 2.54 μL PEM से (K) और (-) एलिकोट में मिलाएं।
- चरण 4.1.2 से (K) और (K +M) एलिकोट तक 2.5 μL काइन्सिन क्लस्टर जोड़ने के लिए एक माइक्रोपिपेट और बाँझ पिपेट युक्तियों का उपयोग करें। मिश्रण करने के लिए ऊपर और नीचे पाइप करें। एक ही तकनीक का उपयोग करके (-) में 2.5 μL PEM में मिलाएं।
नोट: सूचीबद्ध एक्टिन और ट्यूबुलिन की सांद्रता 2.32 μM एक्टिन और 3.48 μM ट्यूबुलिन के साथ एक समग्र के लिए हैं। कुल प्रोटीन सांद्रता c = cA + cT = 5.8 μM है और मोलरएक्टिन अंश c A/(cA + cT) = त्रिभुजA = 0.4 है। किन्सिन और मायोसिन सांद्रता क्रमशः 0.35 μM और 0.47 μM हैं। cA, cT, c, और A को समायोजित करने के लिए सामान्य दिशानिर्देशों के लिए चरण 2.5देखें। - एक माइक्रोपिपेट का उपयोग करके, धीरे-धीरे प्रत्येक समाधान को केशिका कार्रवाई के माध्यम से तैयार नमूना कक्षों (चरण 4.2) के संबंधित चैनल में प्रवाहित करें। पाइप पर बहुत धीरे-धीरे और धीरे से धक्का दें ताकि चैनल में हवा के बुलबुले पेश न हों।
- तेजी से सूखने वाले एपॉक्सी या यूवी-इलाज योग्य गोंद के साथ प्रत्येक चैनल के दो खुले सिरों को सील करें। सुनिश्चित करें कि चिपकने वाला माइक्रोस्कोप पर रखने से पहले पूरी तरह से सूखा है।
नोट: यह महत्वपूर्ण है कि यह कदम उस समय को कम करने के लिए जल्दी से किया जाए जब काइन्सिन निगरानी के बिना कार्य कर रहा है। इस कारण से, एपॉक्सी जो 1 मिनट (5 या 10 मिनट के बजाय) में ठीक हो जाता है, की सिफारिश की जाती है। यूवी-इलाज योग्य गोंद इस संबंध में फायदेमंद है क्योंकि यह यूवी एक्सपोजर पर लगभग तुरंत ठीक हो जाता है।
- निम्नलिखित महत्वपूर्ण संशोधनों को छोड़कर, चरण 3 के बाद छवि ने तुरंत नमूने तैयार किए। क्योंकि किन्सिन प्रकाश-सक्रियण द्वारा नियंत्रित नहीं होता है, यह चरण 4.4.3 के तुरंत बाद काम करना शुरू कर देता है, इसलिए इस बार को टी = 0 के रूप में चिह्नित करें। समग्र को प्रारंभिक निष्क्रिय अवस्था (t = 0) के करीब जितना संभव हो उतना चित्रित करने के लिए, पहले (K) और (K + M) चैनलों को चित्रित करें और चरण 4.4.3 और डेटा अधिग्रहण की शुरुआत (चरण 3.8) के बीच बीत चुके समय को नोट करें। व्यवहार में, यह बीता हुआ समय ~ 5 मिनट है।
5. सक्रिय कंपोजिट में निष्क्रिय क्रॉसलिंकर को शामिल करना
नोट: ये चरण वर्णन करते हैं कि चरण 4 में वर्णित सक्रिय कंपोजिट में एक्टिन को एक्टिन (ए-ए) या सूक्ष्मनलिकाएं से सूक्ष्मनलिकाएं (एम-एम) में निष्क्रिय रूप से क्रॉसलिंक करने के लिए बायोटिनिलेटेड एक्टिन और ट्यूबुलिन सबयूनिट्स और न्यूट्राविडिन (एनए) का उपयोग कैसे किया जाए।
- बायोटिनिलेटेड प्रोटीन (बायोटिन-एक्टिन या बायोटिन-ट्यूबुलिन), एनए, और बायोटिन के साथ ए-ए या एम-एम क्रॉसलिंकर कॉम्प्लेक्स 2: 2: 1 बायोटिन-एक्टिन / ट्यूबुलिन: बायोटिन: एनए के अनुपात में तैयार करें। चरण 4 से पहले इस प्रक्रिया को शुरू करें।
- ए-ए क्रॉसलिंकर के लिए, माइक्रो-पेस्ट्रीफ्यूज ट्यूब में 11.6 μM बायोटिन-एक्टिन के 2 μL, 8.33 μM NA के 1.39 μL, 1.02 μM बायोटिन का 2.27 μL और 4.34 μL PEM जोड़ने के लिए एक माइक्रोपिपेट और बाँझ पिपेट युक्तियों का उपयोग करें। ऊपर और नीचे पाइप करके धीरे-धीरे मिलाएं।
- एम-एम क्रॉसलिंकर के लिए, माइक्रो-पेस्ट्रीफ्यूज ट्यूब में 4.55 μM बायोटिन-ट्यूबुलिन का 1.86 μL, 8.33 μM NA का 1.11 μL, 1.02 μM बायोटिन का 1.82 μL, और PEM का 5.21 μL PEM जोड़ने के लिए एक माइक्रोपिपेट और बाँझ पिपेट युक्तियों का उपयोग करें। ऊपर और नीचे पाइप करके धीरे-धीरे मिलाएं।
- पानी-तंग सील बनाने के लिए थर्मोप्लास्टिक सीलिंग फिल्म में चरण 5.1.1 और / या 5.1.2 से ट्यूब (ओं) को लपेटें। तापमान-नियंत्रित सोनिकेटर स्नान में 4 डिग्री सेल्सियस पर सेट एक प्लवनशीलता बेड़ा में रखें।
- 4 डिग्री सेल्सियस पर 90 मिनट के लिए सोनिकेट करें। व्यवहार में सोनिकेटर को ठंडे कमरे में रखना और कम तापमान बनाए रखने के लिए सोनिकेशन स्नान में आइस पैक जोड़ना सबसे अच्छा है।
- इमेजिंग के लिए नमूनों में क्रॉसलिंकर कॉम्प्लेक्स को शामिल करने के लिए, चरण 4.3 का पालन करें, चरण 4.3.1 को संशोधित करें जैसा कि ए-ए क्रॉसलिंकिंग (चरण 5.2.1) या एम-एम क्रॉसलिंकिंग (चरण 5.2.2) के लिए नीचे वर्णित है।
- A-A क्रॉसलिंकिंग के लिए, निम्नलिखित को एक माइक्रोसेंट्रीफ्यूज ट्यूब में संयोजित करें: PEM का 1.94 μL, 1% Tween20 का 4.50 μL, 47.6 μM actin का 2.18 μL, 45.5 μM 5-R-ट्यूबुलिन, 1.13 μL का A-A क्रॉसलिंकर (चरण 5.1.1) का 4.50 μL, 10 mM GTP का 1.13 μL और 20 μM 488-फैलोइडिन का 1.57 μL। सुनिश्चित करें कि कुल मात्रा 25 μL है।
- M-M क्रॉसलिंकिंग के लिए, निम्नलिखित को एक माइक्रोसेंट्रीफ्यूज ट्यूब में संयोजित करें: PEM का 1.97 μL, 1% Tween20 का 4.50 μL, 47.6 μM actin का 2.18 μL, 45.5 μM 5-R-ट्यूबुलिन, 10 mM GTP का 1.13 μL, M-M क्रॉसलिंकर का 1.13 μL, M-M क्रॉसलिंकर का 1.13 μL, M-M क्रॉसलिंकर का 1.4 μL, M-M क्रॉसलिंकर (चरण 5.1.1.2) का 2.18 μL का 47.5 μM ATIL, 4.5 mM ATP का 3.76 μL, 10 mM GTP का 1.13 μL, M-M क्रॉसलिंकर का 1.13 μL, M-M क्रॉसलिंकर का 1.13 μL, M-M क्रॉसलिंकर का 1.13 μL का 10 mM Taxol, 1.13 μL का M-M क्रॉसलिंकर (चरण 5.1.2) का 1.50% पतला होना, M-M क्रॉसलिंकरों का 1.13 μL का 1.4 μM Taxol, 1.13 μL का M-M क्रॉसलिंकर (चरण 5.1.1.2), 4.5 mM ATP का 3.76 μL, 10 mM GTP का 1.13 μL, M-M क्रॉसलिंकर का 1.13 μL का 1.4 μL Tween20, 4.13 μL का M-M क्रॉसलिंकर (चरण 5.1.2) का 4.50 mM ATP का 3.76 μL, 10 mM GTP का 1.13 μL, M-M क्रॉसलिंकर का 1.13 μL का 1.13 μL का M-M क्रॉसलिंकर (चरण 5.1.2) का 1.13 μ और 20 μM 488-फैलोइडिन का 1.57 μL। सुनिश्चित करें कि कुल मात्रा 25 μL है।
- एक क्रॉसलिंकर के लिए विशिष्ट सांद्रता के साथ चरण 4.3.2-4.5 का पालन करें: आरए का एक्टिन दाढ़ अनुपात = 0.02 और आरटी = 0.005 का क्रॉसलिंकर: ट्यूबुलिन मोलर अनुपात। इन आर ए और आरटी मानों के परिणामस्वरूपएक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं (डीए
 60 एनएम और डीएमटी
60 एनएम और डीएमटी 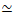 67 एनएम) के साथ क्रॉसलिंकर के बीच समान लंबाई होती है, जिसका अनुमान डीए = आईमोनोमर / 2 आरए का उपयोग करके लगाया जाता है, जहां आईमोनोमर एक एक्टिन मोनोमर की लंबाई है, और डीएमटी = आईरिंग / 26 आरटी, जहां आईरिंग 13 ट्यूबुलिन की अंगूठीकी लंबाई है। 17.
67 एनएम) के साथ क्रॉसलिंकर के बीच समान लंबाई होती है, जिसका अनुमान डीए = आईमोनोमर / 2 आरए का उपयोग करके लगाया जाता है, जहां आईमोनोमर एक एक्टिन मोनोमर की लंबाई है, और डीएमटी = आईरिंग / 26 आरटी, जहां आईरिंग 13 ट्यूबुलिन की अंगूठीकी लंबाई है। 17.
सक्रिय कंपोजिट (चित्रा 1) की सफल तैयारी को निर्धारित करने के लिए, और उनकी गतिशीलता और संरचना को चिह्नित करने के लिए, कम से कम दो प्रतिदीप्ति चैनलों के साथ एक लेजर स्कैनिंग फ्लोरेसेंस माइक्रोस्कोप का उपयोग एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं को एक साथ देखने के लिए किया जाता है (चित्रा 2 और चित्रा 6)। कंपोजिट में सभी एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं ट्रेसर उज्ज्वल फिलामेंट्स में डोपिंग के बजाय विरल रूप से लेबल की जाती हैं, जैसा कि अक्सर इन विट्रो अध्ययनों में किया जाता है। यह विधि सुनिश्चित करती है कि मापा गतिशीलता और संरचना ट्रैसर के बजाय समग्र का प्रतिनिधि है जो कंपोजिट की तुलना में विभिन्न परिस्थितियों में बनते हैं। इस कारण से, व्यक्तिगत एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं आमतौर पर हल नहीं की जा सकती हैं, बल्कि छवियां मेसोस्केल नेटवर्क संरचना (चित्रा 2 और चित्रा 6) को चित्रित करती हैं।
इस लेबलिंग दृष्टिकोण को स्थानिक छवि ऑटोकोरिलेशन (एसआईए) और अंतर गतिशील माइक्रोस्कोपी (डीडीएम) विश्लेषणों के लिए अनुकूलित किया गया था जो पारस्परिक फूरियर स्पेस (चित्रा 4, चित्रा 5, और चित्रा 8) 52,53,54,55 में गतिशीलता और संरचना की जांच करते हैं। कण-छवि वेलोसिमेट्री (पीआईवी) का उपयोग गतिशीलता और प्रवाह क्षेत्रों (चित्रा 3 और चित्रा 7) को चित्रित करने और चिह्नित करने के लिए भी किया जा सकता है, लेकिन घने, कम-सिग्नल छवियों में शोर से उत्पन्न होने वाले गलत वैक्टर को खत्म करने के लिए एसआईए और डीडीएम की तुलना में पिक्सेल-बिनिंग (कम स्थानिक रिज़ॉल्यूशन) और बड़े अंतराल-समय वृद्धि (कम अस्थायी रिज़ॉल्यूशन) की आवश्यकता होती है। फिर भी, प्रवाह क्षेत्रों की गुणात्मक जांच और डीडीएम परिणामों की पुष्टि के लिए पीआईवी की सिफारिश की जाती है (चित्रा 4 और चित्रा 8)26,50।
इन विश्लेषणों (यानी, डीडीएम, एसआईए, पीआईवी) का उपयोग करके वर्णित नेटवर्क का नमूना लक्षण वर्णन शोधकर्ताओं को बेंचमार्क करने और उनके नमूनों को चिह्नित करने के लिए समान विश्लेषण अपनाने में सहायता करने के लिए प्रदान किया जाता है। हालांकि, इन तकनीकों का विस्तृत विवरण इस काम के दायरे से बाहर है। उपयोगकर्ता के अनुकूल पायथन कोड सहित इन और अन्य समान प्रणालियों पर डीडीएम करने के तरीके के विस्तृत विवरण के लिए, पिछलेकार्यों 17,26,49,50 और उसके भीतर के संदर्भों को देखें। यहां वर्णित प्रणालियों पर एसआईए और पीआईवी करने के तरीके के बारे में विवरण के लिए, पाठक को पिछलेकार्यों 17,50 पर निर्देशित किया जाता है।
नीचे वर्णित कई नियंत्रण, यह सुनिश्चित करने के लिए किया जाना चाहिए कि कंपोजिट अपेक्षित रूप से काम कर रहे हैं। मायोसिन या किन्सिन के बिना एक समग्र न्यूनतम थर्मल उतार-चढ़ाव या बहाव के साथ अनिवार्य रूप से स्थिर दिखाई देना चाहिए। एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं सह-उलझी हुई और सजातीय रूप से वितरित दिखाई देनी चाहिए, जिसमें ~ 200 μm x 200 μm (चित्रा 2, दूर बाएं) 17 के दृश्य के क्षेत्र में एक्टिन और सूक्ष्मनलिकाएं के न्यूनतम बंडलिंग, एकत्रीकरण या चरण पृथक्करण के साथ दिखाई देना चाहिए। किसी को कंपोजिट के लिए एक समान परिणाम की उम्मीद करनी चाहिए जिसमें मायोसिन होता है लेकिन 488 एनएम प्रकाश के संपर्क में नहीं आता है (ब्लेबिस्टैटिन को निष्क्रिय करने के लिए)।
मायोसिन को शामिल करने और 488 एनएम प्रकाश के संपर्क में आने पर, कंपोजिट संकुचन से गुजरते हैं जो काफी हद तक आइसोट्रोपिक है और एक्टिन और सूक्ष्मनलिकाएं के लिए समान है, जैसा कि मायोसिन गतिविधि से पहले और बाद में ली गई माइक्रोस्कोप छवियों में देखा गया है (चित्रा 2), साथ ही गतिविधि के दौरान अलग-अलग समय के लिए संबंधित पीआईवी प्रवाह क्षेत्र (चित्रा 3)। यह निर्धारित करने के लिए कि क्या गति बैलिस्टिक, परमाणु, उप-आयाम, आदि है, डीडीएम से निर्धारित विशिष्ट डीकोरिलेशन समय (क्यू) का मूल्यांकन तरंग वेक्टर (यानी, पारस्परिक स्थान) के कार्य के रूप में किया जाता है। पहले 17,26,49 में विस्तार से वर्णित के रूप में देखें। चित्रा 4 यह भी दर्शाता है कि इन कंपोजिट को चिह्नित करने के लिए डीडीएम का उपयोग कैसे करें। β = 1 के साथ पावर-लॉ स्केलिंग ( q) ~ 1 / vqβ, गति v के साथ बैलिस्टिक गति को इंगित करता है। संदर्भ के लिए, β = 2 प्रसार गुणांक होने के साथ गतिशील गतिशीलता का प्रतिनिधित्व करता है। सभी सक्रिय कंपोजिट एक्टिन और मायोसिन (चित्रा 4 बी) की सांद्रता से ट्यून की गई गति के साथ बैलिस्टिक स्केलिंग (चित्रा 4 ए) प्रदर्शित करते हैं, और जो गतिविधि के दौरान समय में भिन्न हो सकते हैं, या तो तेज या कम हो सकते हैं (चित्रा 4 सी, डी)।
नेटवर्क पुनर्गठन और क्लस्टरिंग, चित्रा 2 में दिखाई देता है और उच्च एक्टिन और मायोसिन सांद्रता के लिए अधिक स्पष्ट है, एसआईए का उपयोग करके विशेषता दी जा सकती है, जैसा कि चित्र 5 में दर्शाया गया है, और पहले 17,48,50 वर्णित है। संक्षेप में, एक सहसंबंध लंबाई 3, जो एक छवि में सुविधाओं के विशिष्ट आकार का एक माप है, को पिक्सेल के बीच दूरी आर के घातीय कार्य के लिए प्रत्येक स्थानिक तीव्रता ऑटोकोरिलेशन वक्र जी (आर) को फिट करके निर्धारित किया जा सकता है। बड़ी जी (आर) चोटियां जो लंबी दूरी तक बनी रहती हैं, बड़ी संरचनात्मक विशेषताओं (यानी, बंडलिंग, व्यक्तिगत फिलामेंट्स के क्लस्टरिंग) का संकेत देती हैं। जैसा कि चित्र 5 में दिखाया गया है, उच्च एक्टिन अंशों और मायोसिन सांद्रता के लिए, महत्वपूर्ण पुनर्गठन और एकत्रीकरण समय के साथ ξ में वृद्धि में परिलक्षित होता है।
सक्रिय कंपोजिट के विस्कोस्टिक गुणों और गैर-रेखीय यांत्रिक प्रतिक्रिया को ऑप्टिकल ट्वीज़र्स माइक्रोरियोलॉजी (ओटीएम) का उपयोग करके भी मापा जा सकता है। हालांकि, इन प्रयोगों के लिए प्रोटोकॉल और प्रतिनिधि परिणाम इस काम के दायरे से बाहर हैं। इच्छुक पाठकों को पिछले कार्यों48,56 के लिए संदर्भित किया जाता है जो ओटीएम माप और अपेक्षित परिणामों को करने के तरीके का पूरी तरह से वर्णन करते हैं।
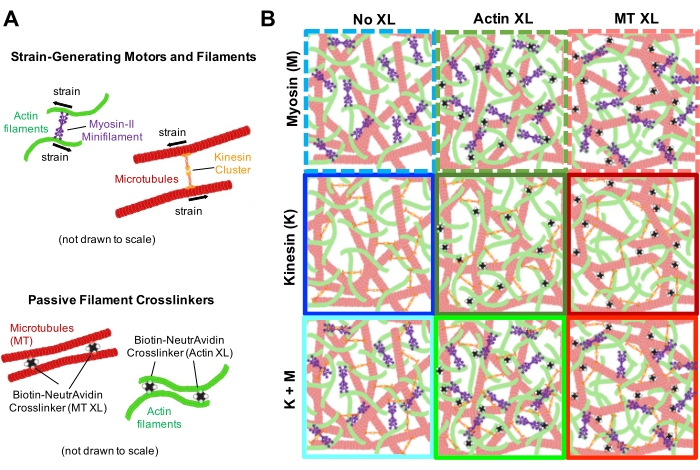
ऊपर वर्णित प्रयोगात्मक और विश्लेषण उपकरणों के एक ही कार्यक्रम का उपयोग करते हुए, निम्नलिखित खंड वर्णन करता है कि जब किन्सिन मोटर्स और बायोटिन-एनए क्रॉसलिंकर्स को कंपोजिट (चित्रा 6, चित्रा 7 और चित्रा 8) में शामिल किया जाता है तो गतिशीलता और संरचना कैसे बदलती है। चित्रा 6 एक्टिन फिलामेंट्स या सूक्ष्मनलिकाएं के निष्क्रिय क्रॉसलिंकिंग (एक्सएल) के साथ और बिना काइन्सिन-ओनली (के) या काइन्सिन और मायोसिन (के + एम) द्वारा संचालित कंपोजिट की प्रतिनिधि कॉन्फोकल छवियों को दर्शाता है।
कंपोजिट में काइन्सिन को शामिल करने से शुरू में मायोसिन-संचालित कंपोजिट के समान गतिशीलता और पुनर्गठन होता है जैसा कि चित्रा 7 (कक्षा 1) की शीर्ष पंक्ति में देखा गया है। हालांकि, गतिशीलता आमतौर पर बड़े पैमाने पर अनिसोट्रोपिक प्रवाह (चित्रा 7 मध्य पंक्ति, वर्ग 2), त्वरण और मंदी (चित्रा 7 नीचे पंक्ति, कक्षा 3) में संक्रमण करती है। ये विशेषताएं 5-30 मिनट (चित्रा 6 और चित्रा 8 बी) के बाद मेसोस्केल क्लस्टरिंग और एकत्रीकरण के साथ जुड़ती हैं। चित्र 7 में दिखाए गए पीआईवी-जनित प्रवाह क्षेत्र और अस्थायी रंग मानचित्र आइसोट्रोपिक पुनर्गठन (कक्षा 1, शीर्ष पैनल), निर्देशित प्रवाह (कक्षा 2, मध्य पैनल), और द्वि-दिशात्मक त्वरण (कक्षा 3, नीचे पैनल) के उदाहरणों को दर्शाते हैं।
गतिविधि के दौरान अलग-अलग समय बिंदुओं पर एक्टिन और सूक्ष्मनलिकाएं की गति, जो कि (क्यू) वक्रों के लिए फिट बैठती है, मंदी के बाद त्वरण को दर्शाती है (चित्रा 8), जो क्रॉसलिंकिंग पर निर्भर करता है। जैसा कि चित्रा 8 में भी दिखाया गया है, जब दोनों मोटर प्रोटीन शामिल होते हैं, तो गतिशीलता वास्तव में किनेसिन-केवल कंपोजिट की तुलना में धीमी होती है, और मेसोस्केल प्रवाह की देरी से शुरुआत होती है। मायोसिन गतिविधि की अवधि के दौरान एक्टिन और सूक्ष्मनलिका नेटवर्क के अधिक सजातीय अंतर्प्रवेश का भी समर्थन करता है, साथ ही साथ कम एकत्रीकरण और पुनर्गठन भी करता है। इन प्रभावों को चित्रा 6 में छवियों में देखा जा सकता है और एसआईए के माध्यम से गणना की गई समय-भिन्न सहसंबंध लंबाई द्वारा निर्धारित किया जाता है, जो आम तौर पर मायोसिन (चित्रा 8 बी) की उपस्थिति में छोटे होते हैं।
चित्र 1. "कई बल-उत्पादक मोटर्स और निष्क्रिय क्रॉसलिंकर के साथ सक्रिय एक्टिन-माइक्रोट्यूबुल्स कंपोजिट का डिजाइन और लक्षण वर्णन"। (ए) एक्टिन मोनोमर्स और ट्यूबुलिन डिमर को मोलर सांद्रता सीएऔर सीटीके 0.73-11.6 μM और एक्टिन A = c A / (cA + cT) = 0, 0.25, 0.5, 0.75, और 1 के दाढ़ अंशों पर सह-बहुलकीकृत किया जाता है, ताकि एक्टिन फिलामेंट्स (हरा) और सूक्ष्मनलिकाएं (लाल) के सह-उलझे नेटवर्क बनाए जा सकें। निष्क्रिय क्रॉसलिंकिंग को एनए का उपयोग करके क्रॉसलिंकर पर बायोटिनिलेटेड एक्टिन फिलामेंट्स (एक्टिन एक्सएल) या सूक्ष्मनलिकाएं (एमटी एक्सएल) को जोड़ने के लिए प्राप्त किया जाता है: आर ए = 0.01-0.08 और आरएमटी = 0.001-0.01 के प्रोटीन मोलर अनुपात क्रमशः एक्टिन और सूक्ष्मनलिकाएं के लिए। मायोसिन-II मिनी-फिलामेंट्स (बैंगनी) और काइन्सिन क्लस्टर (नारंगी), सीएम = 0.12 - 0.48 μM और cK = 0.2 - 0.7 μM की सांद्रता पर, कंपोजिट को स्थिर अवस्था से बाहर निकालने के लिए फिलामेंट्स पर धक्का देते हैं और खींचते हैं। (बी) फॉर्मूलेशन स्पेस का योजनाबद्ध। मायोसिन II मिनी-फिलामेंट्स (एम), किनेसिन क्लस्टर (के), या दोनों मोटर्स (के + एम) को बिना निष्क्रिय क्रॉसलिंकर (नो एक्सएल), एक्टिन-एक्टिन क्रॉसलिंक्स (एक्टिन एक्सएल), और माइक्रोट्यूबुल्स-माइक्रोट्यूबुल्स क्रॉसलिंक्स (एमटी एक्सएल) के साथ कंपोजिट में शामिल किया जाता है। सभी कार्टून स्केल पर नहीं खींचे गए हैं। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
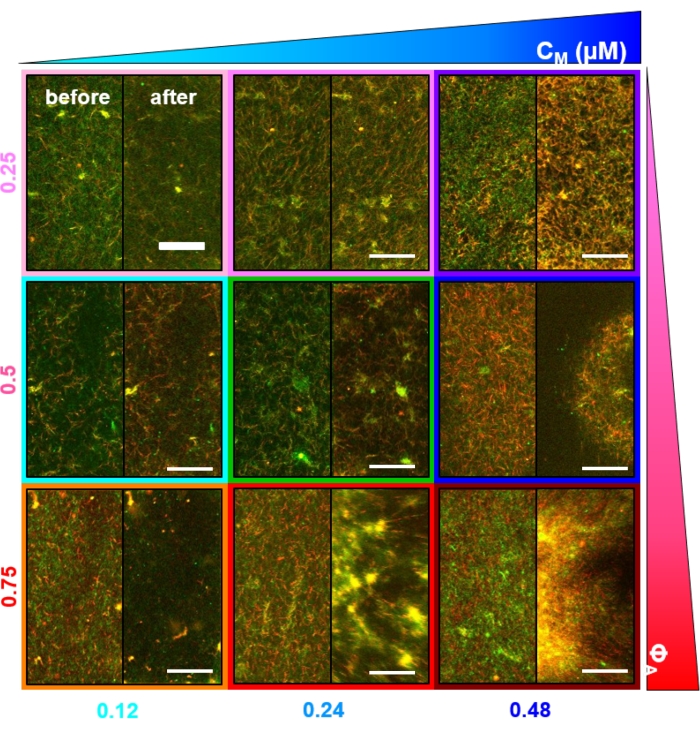
चित्र 2. मायोसिन संचालित साइटोस्केलेटन कंपोजिट की दो-रंग कंफोकल इमेजिंग जिसमें अलग-अलग मायोसिन सांद्रता सीएम और मोलर एक्टिन अंश ए है। (ए) 256 x 128 वर्ग-पिक्सेल (212 x 106 μm2) दो-रंग कॉन्फोकल माइक्रोस्कोपी छवियां दिखाती हैं कि मायोसिन मोटर गतिविधि के माध्यम से एक्टिन फिलामेंट्स (हरा) और सूक्ष्मनलिकाएं (लाल) के कंपोजिट को कैसे पुनर्व्यवस्थित किया जाता है। कोई किन्सिन मोटर्स या निष्क्रिय क्रॉसलिंकर मौजूद नहीं हैं। प्रत्येक पैनल में, 45 मिनट मायोसिन सक्रियण की शुरुआत (बाएं, पहले) और अंत (दाएं, बाद में) में ली गई छवियां दिखाई जाती हैं (ब्लेबिस्टाटिन को निष्क्रिय करने के लिए 488 एनएम प्रकाश के साथ रोशनी के माध्यम से)। पैनलों को मायोसिन (सीएम) की दाढ़ एकाग्रता को बढ़ाकर, बाएं से दाएं जाने और एक्टिन (ए ए) के दाढ़ अंश को बढ़ाकर, ऊपर से नीचे तक जाकर आदेश दिया जाता है। प्रत्येक पैनल को रेखांकित करने वाले रंग चित्रा 4 और चित्रा 5 में उपयोग किए गए रंग कोडिंग से मेल खाते हैं। स्केल बार 50 μM हैं। विश्लेषण के लिए गतिशीलता और संरचना को सर्वोत्तम रूप से पकड़ने के लिए, हम संकुचन और पुनर्व्यवस्था की दर के आधार पर 1-5 एफपीएस की फ्रेम दरों, 50-250 μm पक्षों के साथ ROIs और 5-45 मिनट की समय-श्रृंखला अवधि का उपयोग करते हैं। पैनल जिनमें पहले और बाद की छवियां समान दिखती हैं, न्यूनतम पुनर्गठन का संकेत देती हैं, जैसा कि गुलाबी, मैजेंटा और सियान पैनलों में देखा जाता है। छोटे पैमाने पर क्लस्टरिंग, बढ़ी हुई विषमता और उज्ज्वल पंक्टेट विशेषताओं की उपस्थिति से स्पष्ट है, नारंगी, हरे और लाल पैनलों में देखा जा सकता है। बड़े पैमाने पर संकुचन, जिसे समान रूप से सिकुड़ते नेटवर्क के रूप में देखा जाता है, नीले और बैंगनी पैनलों में स्पष्ट है। इस आंकड़े को संदर्भ17 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
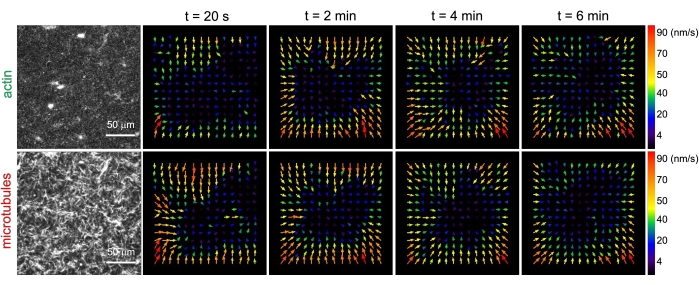
चित्र 3. कण छवि वेलोसिमेट्री (पीआईवी) से पता चलता है कि एक्टोमायोसिन गतिविधि सह-उलझे हुए कंपोजिट में एक्टिन और सूक्ष्मनलिकाएं की समन्वित सिकुड़ा हुआ गतिशीलता को ट्रिगर करती है। 6 मिनट की समय-श्रृंखला के दौरान बढ़ते समय पर मायोसिन-संचालित समग्र में एक्टिन (शीर्ष पंक्ति) और सूक्ष्मनलिकाएं (नीचे की पंक्ति) के लिए पीआईवी प्रवाह क्षेत्र। फ्लो फ़ील्ड 20 s और 2 पिक्सेल x 2 पिक्सेल बिनिंग के अंतराल-समय के साथ Fiji / ImageJ PIV प्लगइन का उपयोग करके उत्पन्न किए गए थे। एक्टिन और सूक्ष्मनलिकाएं दोनों फिल्म अवधि के दौरान फील्ड-ऑफ-व्यू के केंद्र क्षेत्र की ओर निर्देशित लगातार गति दिखाते हैं। सभी छवियों में स्केल बार 50 μm हैं। विभिन्न तीर रंग अलग-अलग गति के अनुरूप होते हैं जैसा कि वेक्टर फ़ील्ड के दाईं ओर रंग पैमाने में दर्शाया गया है। इस आंकड़े को संदर्भ26 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
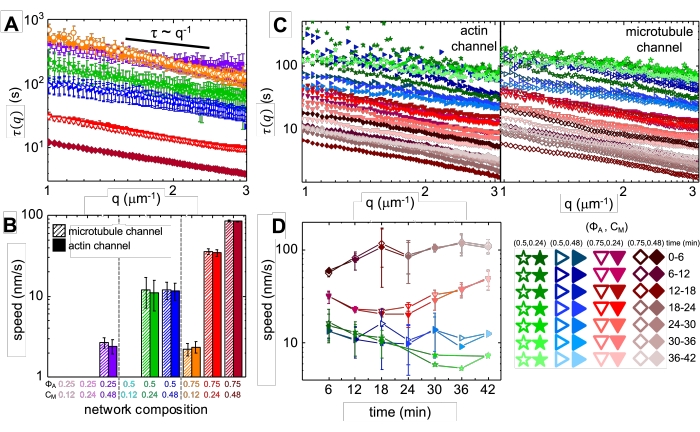
चित्र 4. समय-संकल्पित अंतर गतिशील माइक्रोस्कोपी (डीडीएम) सक्रिय कंपोजिट में एक्टिन और सूक्ष्मनलिकाएं की गति की दर और प्रकार को मापता है। (ए) डीडीएम को समय-श्रृंखला के सूक्ष्मनलिका (शीर्ष, खुले प्रतीकों) और एक्टिन (नीचे, भरे हुए प्रतीकों) चैनलों पर किया जाता है ताकि एक्टिन (भरे हुए प्रतीकों) और सूक्ष्मनलिकाएं (खुले प्रतीकों) दोनों के लिए विशिष्ट क्षय समय बनाम वेवनंबर क्यू निर्धारित किया जा सके जैसा कि पहलेवर्णित है। सभी वक्र ों में 3 ~ q-1 स्केलिंग का अनुसरण किया जाता है, जो बैलिस्टिक गति को दर्शाता है, जिसमें गति v होती है जो कि y(q) = (vq)-1 के लिए फिट के माध्यम से निर्धारित की जाती है। तेज गति किसी भी दिए गए q के लिए छोटे 3 (q) मानों के अनुरूप होती है। प्रतीक रंग और आकृतियाँ B में दिखाए गए (A, cM) संयोजनों के अनुरूप हैं। (B) संकुचन गति v को A में दिखाए गए τ (q) वक्रों के फिट के माध्यम से निर्धारित किया जाता है, जो प्रत्येक 45 मिनट की समय-श्रृंखला की अवधि के लिए सभी अंतराल-समय पर औसत होते हैं। (ग) समय-संकल्पित डीडीएम (trDDM) यह निर्धारित करता है कि 45 मिनट सक्रियण समय के दौरान लगातार 6 मिनट के अंतराल (एक ही रंग के विभिन्न रंगों द्वारा निरूपित) के लिए एक्टिन (भरे हुए प्रतीक, बाएं) और सूक्ष्मनलिकाएं (खुले प्रतीक, दाएं) के लिए (क्यू) का मूल्यांकन करके समय के साथ गतिशीलता कैसे बदलती है। trDDM प्रत्येक (A, cM) संयोजन (विभिन्न प्रतीकों और रंगों द्वारा निरूपित) के लिए किया जाता है जैसा कि निचले दाएं में किंवदंती में वर्णित है। C में दिखाए गए वक्र A के समान स्केलिंग और रुझानों का अनुसरण करते हैं, लेकिन कुछ (A, cM) रचनाओं के लिए समय-निर्भरता भी दिखाते हैं, विशेष रूप से A = 0.75 के लिए। (d) एक्टिन फिलामेंट्स (बंद प्रतीकों) और सूक्ष्मनलिकाएं (खुले प्रतीकों) के लिए संकुचन की गति संगत (q) वक्रों के लिए फिट से निर्धारित की जाती है। सभी प्लॉटों में त्रुटि पट्टियाँ तीन से पांच प्रतिकृतियों में मानों की मानक त्रुटि का प्रतिनिधित्व करती हैं. इस आंकड़े को संदर्भ17 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
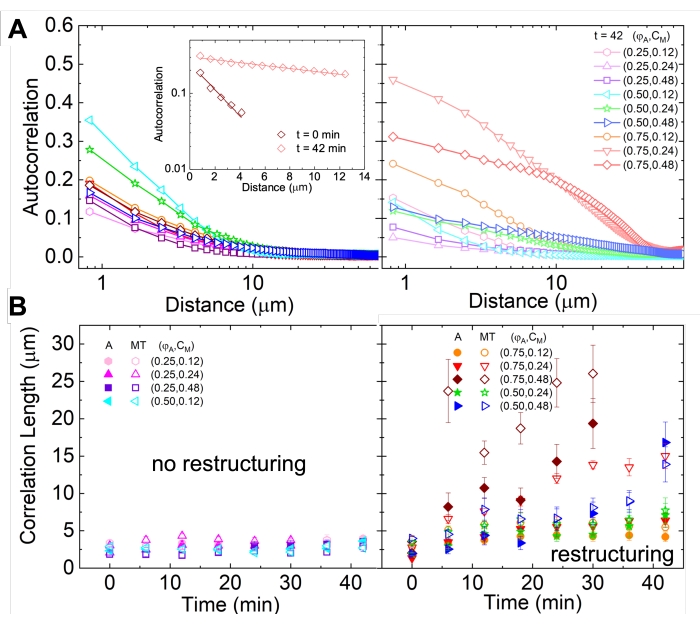
चित्र 5. स्थानिक छवि ऑटोकोरिलेशन (एसआईए) विश्लेषण सक्रिय साइटोस्केलेटल कंपोजिट के मोटर-संचालित पुनर्गठन को निर्धारित करता है। (ए) प्रयोग की शुरुआत (बाएं, टी = 0 मिनट, गहरे रंग) और अंत (दाएं, टी = 42 मिनट, हल्के रंग) में सूक्ष्मनलिकाएं के लिए ऑटोकोरिलेशन जी (आर) किंवदंती में सूचीबद्ध (ए, सीएम) योगों के लिए। इनसेट: उदाहरण प्रारंभिक और अंतिम समय में डेटा 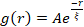 के लिए फिट बैठता है (ए, सीएम) = (0.75, 0.12)। (B) एक्टिन (बंद प्रतीकों) और सूक्ष्मनलिकाएं (खुले प्रतीकों) के लिए औसत सहसंबंध लंबाई प्रत्येक g(r) वक्र के घातांकीय फिट के माध्यम से निर्धारित की जाती है, जैसा कि A में इनसेट में दिखाया गया है। डेटा को उन लोगों में विभाजित किया गया है जो न्यूनतम (बाएं) बनाम पर्याप्त (दाएं) पुनर्गठन प्रदर्शित करते हैं। ए और बी में त्रुटि पट्टियाँ तीन से पांच प्रतिकृतियों में मानक त्रुटि का प्रतिनिधित्व करती हैं। इस आंकड़े को संदर्भ17 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
के लिए फिट बैठता है (ए, सीएम) = (0.75, 0.12)। (B) एक्टिन (बंद प्रतीकों) और सूक्ष्मनलिकाएं (खुले प्रतीकों) के लिए औसत सहसंबंध लंबाई प्रत्येक g(r) वक्र के घातांकीय फिट के माध्यम से निर्धारित की जाती है, जैसा कि A में इनसेट में दिखाया गया है। डेटा को उन लोगों में विभाजित किया गया है जो न्यूनतम (बाएं) बनाम पर्याप्त (दाएं) पुनर्गठन प्रदर्शित करते हैं। ए और बी में त्रुटि पट्टियाँ तीन से पांच प्रतिकृतियों में मानक त्रुटि का प्रतिनिधित्व करती हैं। इस आंकड़े को संदर्भ17 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
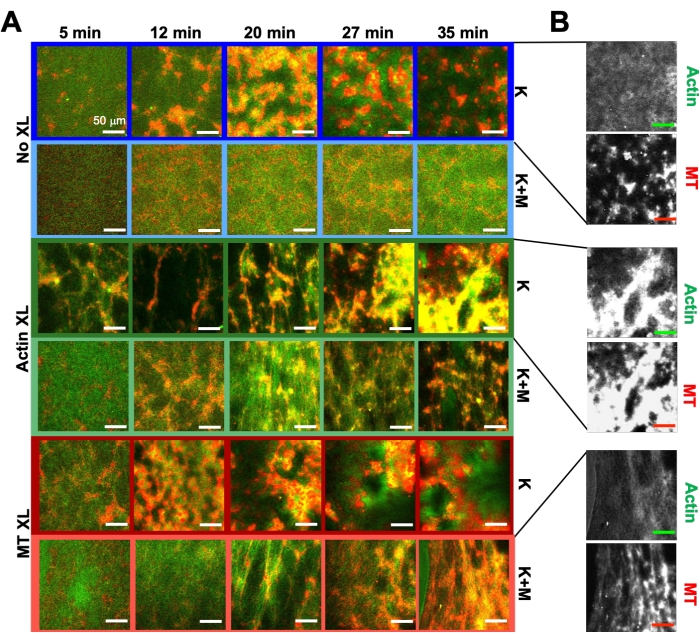
चित्र 6. प्रोग्रामेबिलिटी बढ़ाने और गतिशीलता और संरचना के चरण स्थान का विस्तार करने के लिए सक्रिय कंपोजिट में किनेसिन मोटर्स और निष्क्रिय क्रॉसलिंकर को शामिल करना। (ए) सक्रिय कंपोजिट में एक्टिन (हरा) और सूक्ष्मनलिकाएं (लाल) की दो-रंग कंफोकल छवियां समय के साथ जटिल सूत्रीकरण-निर्भर पुनर्गठन दिखाती हैं (मिनट में सूचीबद्ध)। प्रत्येक पंक्ति में पांच छवियां काइन्सिन (के, पंक्ति 1, 3, 5) या काइन्सिन और मायोसिन (के + एम, पंक्ति 2, 4, 6) द्वारा संचालित एक समग्र के लिए अधिग्रहित 2000 फ्रेम समय-श्रृंखला के पांच फ्रेम से मेल खाती हैं, और इसमें या तो कोई निष्क्रिय क्रॉसलिंकर (नो एक्सएल, पंक्तियां 1, 2), एक्टिन-एक्टिन क्रॉसलिंक (एक्टिन एक्सएल, पंक्तियां 3, 4), या सूक्ष्मनलिका-माइक्रोट्यूबुल्स क्रॉसलिंक (एमटी एक्सएल) शामिल हैं। पंक्तियाँ 5, 6)। स्केल बार सभी 50 μm हैं। चित्र 8 में रंग योजना से मेल खाने वाले रंगों की रूपरेखा। (बी) काइन्सिन-केवल कंपोजिट के लिए अलग-अलग एक्टिन और माइक्रोट्यूबुल्स फ्लोरेसेंस चैनल एक्टिन-एमटी सह-स्थानीयकरण और सूक्ष्म-चरण पृथक्करण दोनों के साथ विभिन्न संरचनाओं को दिखाते हैं। दिखाए गए चित्र cA = 2.32 μM, cT = 3.48 μM, cK = 0.35 μM, cM = 0.47 μM (पंक्ति 2, 4, 6), RA = 0.02 (पंक्तियाँ 3, 4), और RMT = 0.005 (पंक्तियाँ 5, 6) के कंपोजिट के लिए हैं। सभी कंपोजिट एक्टिन और सूक्ष्मनलिकाएं (कॉलम 1) के समान रूप से वितरित इंटरपेनिट्रेटिंग नेटवर्क से शुरू होते हैं। क्रॉसलिंकर (पंक्ति 1) के बिना किन्सिन-संचालित कंपोजिट शिथिल रूप से जुड़े अनाकार समूहों का निर्माण करते हैं जो एमटी-समृद्ध होते हैं। एक्टिन शुरू में इन समुच्चय के केंद्रों में सह-स्थानीयकरण करता है, लेकिन फिर एमटी-समृद्ध क्षेत्रों से निचोड़ा जाता है जो एक दूसरे से अनुबंध और डिस्कनेक्ट करना जारी रखते हैं। एक्टिन-एक्टिन क्रॉसलिंकिंग (पंक्ति 3) इस माइक्रोस्केल एक्टिन-एमटी पृथक्करण में बाधा डालता है, और इसके बजाय एमटी-समृद्ध समुच्चय एक्टिन के लंबे किस्में के माध्यम से जुड़े होते हैं। एक्टिन क्रॉसलिंकिंग एमटी समृद्ध क्षेत्रों में एक्टिन के धीमे उत्थान को भी सक्षम बनाता है, जैसे कि समग्र सह-स्थानीयकृत एक्टिन और एमटी क्लस्टर का एक जुड़ा हुआ नेटवर्क बन जाता है। माइक्रोट्यूबुल्स क्रॉसलिंकिंग (पंक्ति 5) एमटी के अनाकार क्लस्टरिंग की ओर जाता है जो समय के साथ एकजुट होता है, जिसके परिणामस्वरूप एक्टिन और एमटी का बड़े पैमाने पर चरण पृथक्करण होता है। मायोसिन (पंक्ति 2, 4, 6) जोड़ने से किन्सिन-संचालित डी-मिक्सिंग और पुनर्गठन कम हो जाता है। क्रॉसलिंकर्स (पंक्ति 2) के बिना, कंपोजिट घंटों के दौरान थोड़ा पुनर्व्यवस्था दिखाते हैं। क्रॉसलिंकिंग एक्टिन और सूक्ष्मनलिकाएं (पंक्तियों 4, 6) के पुनर्गठन और सह-स्थानीयकरण को बढ़ाता है। विशेष रूप से, जब सूक्ष्मनलिकाएं क्रॉसलिंक होती हैं (पंक्ति 6), फाइबर के वेब जैसे नेटवर्क में महत्वपूर्ण अंतर्प्रवेश और पुनर्गठन होता है। इस आंकड़े को संदर्भ50 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
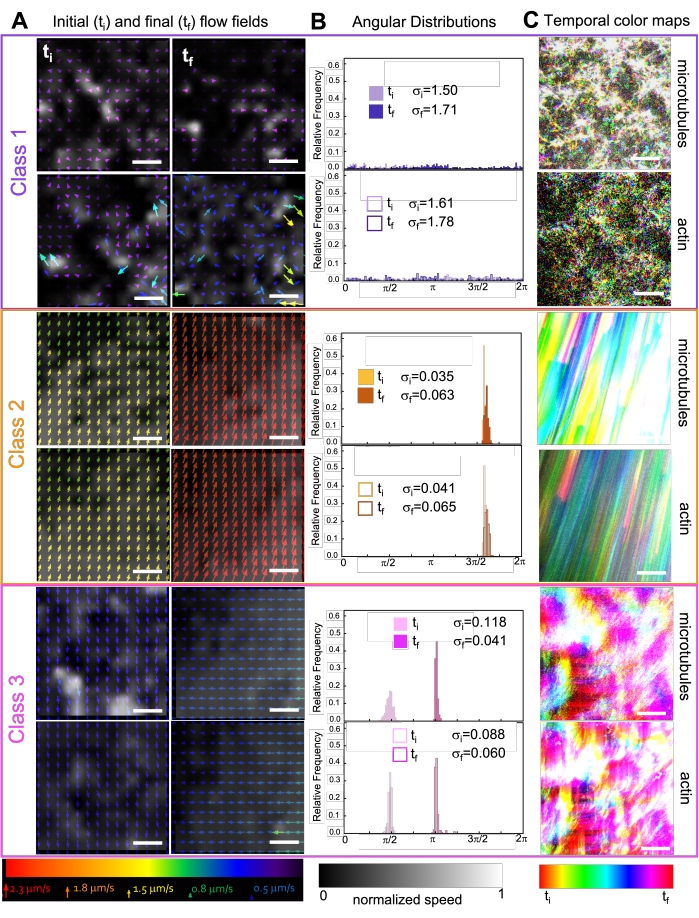
चित्र 7. पीआईवी से पता चलता है कि सक्रिय कंपोजिट स्थानिक रूप से अलग-अलग प्रवाह क्षेत्रों के तीन वर्गों का प्रदर्शन करते हैं। (ए) तीन प्रतिनिधि समय-श्रृंखला के पहले (टीआई) और अंतिम (टी एफ) फ्रेम के लिए पीआईवी प्रवाह क्षेत्र, विभिन्न गतिशील वर्गों को दर्शाते हैं जो चित्रा 6 में दिखाए गए कंपोजिट प्रदर्शित करते हैं। कक्षा 1 (ऊपर, बैंगनी), वर्ग 2 (मध्यम, नारंगी), और वर्ग 3 (नीचे, मैजेंटा) उदाहरण वीडियो के लिए सूक्ष्मनलिकाएं (ऊपर) और एक्टिन (नीचे) के लिए पीआईवी प्रवाह क्षेत्र, नीचे सार्वभौमिक गति पैमाने के अनुरूप तीर के रंगों के साथ, और ग्रेस्केल कलरमैप स्थानिक गति वितरण दिखाता है, जो नीचे दिखाए गए पैमाने के अनुसार प्रत्येक प्रवाह क्षेत्र के लिए अलग से सामान्यीकृत होता है। स्केल बार सभी 50 μM हैं। (बी) ए से वेग वैक्टर का कोणीय वितरण (रेडियन की इकाइयों में) जिसमें सूचीबद्ध प्रारंभिक और अंतिम मानक विचलन σ i और σf शामिल हैं। (सी) ए और बी में विश्लेषण किए गए वीडियो के लिए अस्थायी रंग मानचित्र प्रत्येक पिक्सेल की फ्रेम-टू-फ्रेम स्थिति को उसके शुरुआती बिंदु के सापेक्ष दिखाते हैं। कक्षा 1 के नक्शे छोटे पैमाने पर यादृच्छिक गति दिखाते हैं; कक्षा 2 के नक्शे न्यूनतम स्थानिक या अस्थायी भिन्नता के साथ तेज यूनिडायरेक्शनल गति को दर्शाते हैं; कक्षा 3 के नक्शे कक्षा 1 और 2 दोनों की विशेषताओं को प्रदर्शित करते हैं। इस आंकड़े को संदर्भ50 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
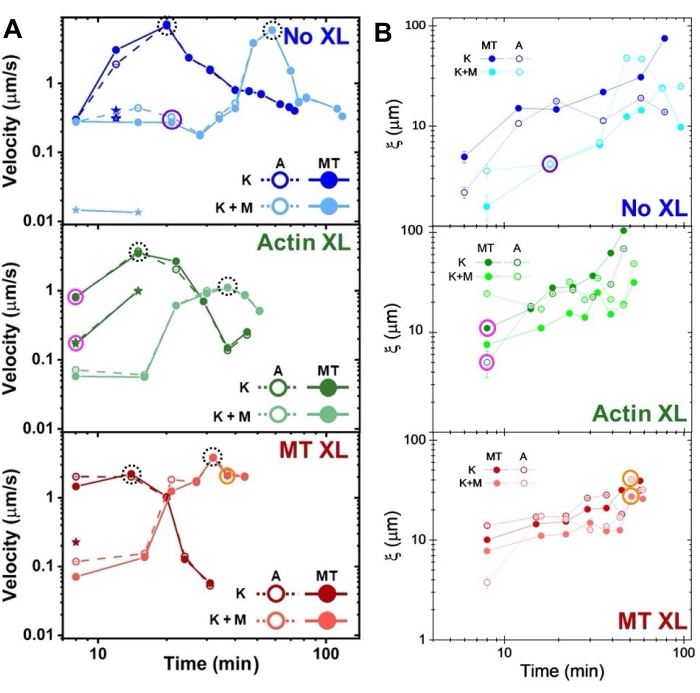
चित्र 8. डीडीएम और एसआईए दो-मोटर एक्टिन-सूक्ष्मनलिका कंपोजिट की समय-भिन्न गतिशीलता और संरचना को मापते हैं। (ए) डीडीएम के माध्यम से मापा गया चित्रा 6 और चित्रा 7 में वर्णित कंपोजिट के लिए गति, क्रॉसलिंकिंग और मायोसिन गतिविधि द्वारा प्रोग्राम किए गए कंपोजिट के त्वरण और मंदी को दर्शाती है। सूक्ष्मनलिकाएं (एमटी, बंद सर्कल) और एक्टिन (ए, ओपन सर्कल) की गति को कंपोजिट में गतिविधि समय के कार्य के रूप में प्लॉट किया जाता है जिसमें कोई क्रॉसलिंकिंग (शीर्ष, नीला), एक्टिन क्रॉसलिंकिंग (मध्य, हरा), सूक्ष्मनलिका क्रॉसलिंकिंग (नीचे, लाल), मायोसिन (के, गहरे रंग) के बिना, और मायोसिन (के + एम, हल्के रंग) होते हैं। कक्षा 3 के मामलों के लिए, जिनमें दो गति होती है, धीमी गति एक तारे द्वारा इंगित की जाती है। डैश्ड ब्लैक सर्कल द्वारा संलग्न डेटा पॉइंट प्रत्येक फॉर्मूलेशन के लिए अधिकतम गति vअधिकतमके अनुरूप होते हैं। त्रुटि पट्टियाँ (देखने के लिए बहुत छोटी) संबंधित (q) के पावर-लॉ फिट पर मानक त्रुटि हैं। (बी) संरचनात्मक सहसंबंध लंबाई, एसआईए के माध्यम से निर्धारित, बनाम गतिविधि समय, ए में मूल्यांकन किए गए समय-श्रृंखला के एक ही सेट के लिए। प्रत्येक डेटा बिंदु संबंधित समय-श्रृंखला के पहले और अंतिम फ्रेम के लिए निर्धारित सहसंबंध लंबाई का औसत है। सामान्य तौर पर, सभी कंपोजिट प्रणालियों में एक्टिन और सूक्ष्मनलिकाएं दोनों के लिए समय में वृद्धि होती है, और केवल काइन्सिन द्वारा संचालित कंपोजिट में उन लोगों की तुलना में अधिक सहसंबंध लंबाई होती है जिनमें मायोसिन भी मौजूद होता है। ए और बी में डेटा बिंदु जो चित्रा 7 में विश्लेषण किए गए तीन समय-श्रृंखला के अनुरूप हैं, उन्हें संबंधित वर्ग रंग (1 = बैंगनी, 2 = नारंगी, 3 = मैजेंटा) में सर्कल किया गया है। इस आंकड़े को संदर्भ50 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
ऊपर वर्णित पुनर्गठित प्रणाली की एक महत्वपूर्ण प्रगति इसकी मॉड्यूलरिटी और ट्यूनेबिलिटी है, इसलिए उपयोगकर्ताओं को अपने वांछित परिणामों के अनुरूप प्रोटीन, मोटर्स, क्रॉसलिंकर आदि की सांद्रता को संशोधित करने के लिए प्रोत्साहित किया जाता है, चाहे वह किसी विशेष सेलुलर प्रक्रिया का अनुकरण करना हो या विशिष्ट कार्यक्षमता या यांत्रिक गुणों के साथ सामग्री इंजीनियर करना हो। एक्टिन और ट्यूबुलिन की एकाग्रता सीमा पर सीमाएं एक्टिन (~ 0.2 μM)57,58,59 और ट्यूबुलिन (~ 3 - 4 μM)60 को पॉलीमराइज़ करने के लिए आवश्यक महत्वपूर्ण एकाग्रता द्वारा निचली सीमा पर निर्धारित की जाती हैं, और ऊपरी सीमा पर एक्टिन फिलामेंट्स (~ 90 μM)61,62 या सूक्ष्मनलिकाएं (~ 35 μM)63 के न्यूमेटिक संरेखण में संक्रमण द्वारा निर्धारित की जाती हैं। . एक्टिन मोनोमर्स और ट्यूबुलिन डिमर को पोलीमराइजेशन के बाद एक साथ मिश्रित करने के बजाय फिलामेंट्स में एक साथ पोलीमराइज्ड किया जाना चाहिए, ताकि यह सुनिश्चित किया जा सके कि वे समरूप रूप से इंटरपेनिट्रेटिंग परकोलेटेड नेटवर्क बनाते हैं जो सहक्रियात्मक रूप से एक-दूसरे का समर्थन करते हैं। कंपोजिट प्रदर्शित करने वाली उपन्यास गतिशीलता इस बातचीत पर निर्भर करती है। हालांकि दिखाए गए परिणामों को सफलतापूर्वक पुन: पेश करने के लिए प्रोटोकॉल में उल्लिखित सभी चरणों का पालन करना आम तौर पर महत्वपूर्ण है, कुछ चरण अधिक सटीक हैं, जबकि अन्य में विशिष्ट आवश्यकताओं और उपलब्ध संसाधनों को फिट करने के लिए संशोधित और समायोजित करने के लिए जगह है।
उदाहरण के लिए, प्रतिलिपि प्रस्तुत करने योग्य परिणामों को सुनिश्चित करने में एक महत्वपूर्ण कदम सामग्री की तालिका में प्रदान किए गए दिशानिर्देशों का पालन करते हुए अभिकर्मकों को ठीक से तैयार करना और संग्रहीत करना है। साइटोस्केलेटल प्रोटीन (एक्टिन, ट्यूबुलिन, मायोसिन, किन्सिन) लेबिल होते हैं और तरल नाइट्रोजन के साथ फ्लैश-जमे हुए होते हैं, और एकल-उपयोग वाले एलिकोट में -80 डिग्री सेल्सियस पर संग्रहीत किए जाने चाहिए। -80 डिग्री सेल्सियस से हटाने के बाद, एलिकोट को बर्फ पर रखा जाना चाहिए। साइटोस्केलेटल प्रोटीन अतिरिक्त फ्रीज-पिघलना चक्रों के बाद विश्वसनीय रूप से कार्य को बनाए नहीं रखते हैं।
सूक्ष्मनलिकाएं एक्टिन की तुलना में डीपोलीमराइजेशन और विकृत करने के प्रति अधिक संवेदनशील होती हैं। एक बार -80 डिग्री सेल्सियस से हटा दिए जाने के बाद, ट्यूबुलिन को पोलीमराइजेशन से पहले बर्फ पर रखा जाना चाहिए, और 12 घंटे के भीतर उपयोग किया जाना चाहिए। एक बार बहुलक होने के बाद, सूक्ष्मनलिकाएं कमरे के तापमान पर रखी जानी चाहिए। डिपोलीमराइजेशन को रोकने के लिए टैक्सोल के साथ सूक्ष्मनलिकाएं स्थिर करना भी महत्वपूर्ण है। एक्टिन फिलामेंट्स का फेलोइडिन-स्थिरीकरण एटीपी-खपत करने वाले एक्टिन ट्रेडमिलिंग को दबाने के लिए भी महत्वपूर्ण है जो मायोसिन और काइन्सिन गतिविधि के साथ प्रतिस्पर्धा करता है।
मायोसिन मोटर्स का अल्ट्रासेंट्रीफ्यूजेशन एक और महत्वपूर्ण कदम है, क्योंकि यह निष्क्रिय मायोसिन मृत सिर को हटा देता है। एंजाइमेटिक रूप से निष्क्रिय मोनोमर्स को नहीं हटाने से एक्टिन नेटवर्क का निष्क्रिय क्रॉसलिंकिंग और गतिविधि का नुकसान होता है। मोटर्स की एटीपीस गतिविधि को बढ़ाने के लिए, क्रिएटिन फॉस्फेट और क्रिएटिन फॉस्फोकाइनेज64 जैसे एटीपी पुनर्जनन प्रणाली को शामिल किया जा सकता है।
अंत में, समग्र गतिविधि को बनाए रखने के लिए नमूना कक्ष की दीवारों पर फिलामेंट्स और मोटर्स के सोखने को रोकने की आवश्यकता होती है, जिसे माइक्रोस्कोप कवरलिप्स और स्लाइड्स के निष्क्रिय होने से प्राप्त किया जा सकता है। मोटर प्रोटीन विशेष रूप से सोखना के लिए प्रवण होते हैं, जिसके परिणामस्वरूप समग्र को नमूना कक्ष की सतह पर खींचा जाता है, फील्ड-ऑफ-व्यू से बाहर निकल जाता है, 2 डी तक ढह जाता है, और अब गतिविधि से नहीं गुजरता है। कवरलिप्स और स्लाइड्स को सिलनाइज करना सतहों को पास करने और सोखना को रोकने का एक प्रभावी तरीका है (चरण 1 देखें)। इन विट्रो साइटोस्केलेटन प्रयोगों में प्रभावी ढंग से उपयोग की जाने वाली एक वैकल्पिक निष्क्रिय विधि कोशिका झिल्ली18 के समान लिपिड बाइलेयर के साथ सतह को कोटिंग कर रही है। यह विधि फायदेमंद है यदि कोई प्रोटीन को सतह पर जोड़ना चाहता है या अन्य विशिष्ट प्रोटीन-सतह इंटरैक्शन पेश करना चाहता है, क्योंकि बाइलेयर को कार्यात्मक बनाया जा सकता है। ऑप्टिकल ट्वीज़र्स प्रयोगों के लिए, माइक्रोसेफर्स का निष्क्रिय होना भी महत्वपूर्ण है, और कार्बोडिमाइड क्रॉसलिंकर रसायन विज्ञान48 के माध्यम से बीएसए या पीईजी के साथ कार्बोक्सिलेटेड माइक्रोसेफर्स को कोटिंग करके प्राप्त किया जा सकता है।
प्रस्तुत प्रोटोकॉल के कुछ पहलू हैं जिन्हें शोधकर्ता अपनी आवश्यकताओं के अनुरूप बदलने पर विचार कर सकते हैं। सबसे पहले, शोधकर्ता गैर-देशी बायोटिन-एनए क्रॉसलिंकर को जैविक क्रॉसलिंकर के साथ बदलने का विकल्प चुन सकते हैं, जैसे कि अल्फा-एक्टिनिन या एमएपी 65 जो क्रमशः एक्टिन और सूक्ष्मनलिकाएं क्रॉसलिंक करते हैं,क्रमशः 28,65,66। यहां वर्णित कंपोजिट में गैर-देशी क्रॉसलिंकर का उपयोग देशी क्रॉसलिंकर्स की तुलना में उनकी बढ़ी हुई प्रजनन क्षमता, स्थिरता और ट्यूनेबिलिटी से प्रेरित है। मजबूत बायोटिन-एनए बॉन्ड के कारण, क्रॉसलिंकर को अधिकांश देशी क्रॉसलिंकर्स के बजाय स्थायी माना जा सकता है जो क्षणिक रूप से व्यापक टर्नओवर दरों के साथ बंधते हैं। क्षणिक क्रॉसलिंकिंग की गतिशीलता क्रॉसलिंकर और मोटर्स से गतिशीलता में योगदान को जटिल बनाती है। इसके अलावा, बायोटिन-एनए लिंकर का उपयोग बहुमुखी रूप से एक्टिन और सूक्ष्मनलिकाएं दोनों को क्रॉसलिंक करने के लिए किया जा सकता है, साथ ही क्रॉसलिंक एक्टिन को सूक्ष्मनलिकाएं भी। इस तरह, क्रॉसलिंकिंग रूपांकनों के बीच एक स्पष्ट तुलना की जा सकती है, अन्य सभी चर (जैसे, क्रॉसलिंकर आकार, बाध्यकारी आत्मीयता, स्टोइकोमेट्री, आदि) को तय रखा जा सकता है। अंत में, बायोटिन-एनए लिंकर को शामिल करने के लिए आवश्यक अभिकर्मकों व्यापक रूप से व्यावसायिक रूप से उपलब्ध हैं, अच्छी तरह से विशेषता है, और आमतौर पर कई बायोफिज़िक्स प्रयोगशालाओं में उपयोग किए जाते हैं। हालांकि, यहां वर्णित इन विट्रो प्लेटफॉर्म की प्रमुख शक्तियों में से एक इसकी मॉड्यूलरिटी है, इसलिए शोधकर्ताओं को बायोटिन-एनए लिंकर को मूल लिंकर के साथ मूल रूप से बदलने में सक्षम होना चाहिए।
दूसरे, वर्तमान प्रोटोकॉल में, एक्टिन मोनोमर्स और ट्यूबुलिन डिमर को नमूना कक्ष में जोड़ने से पहले सेंट्रीफ्यूज ट्यूब में एक साथ फिलामेंट्स में पॉलीमराइज्ड किया जाता है। नमूना कक्ष में उलझे हुए फिलामेंटस प्रोटीन के घोल को प्रवाहित करने से प्रवाह संरेखण हो सकता है, विशेष रूप से सूक्ष्मनलिकाएं, जो कंपोजिट की वांछित आइसोट्रोपी और समरूपता को तोड़ती हैं। दरअसल, स्थिर-राज्य एक्टिन-सूक्ष्मनलिका कंपोजिट पर पूर्व कार्य में एक बड़ी प्रगति एक्टिन और सूक्ष्मनलिकाएं 15,16,27 के आइसोट्रोपिक इंटरपेनिट्रेटिंग नेटवर्क के गठन को सुनिश्चित करने के लिए सीटू (नमूना कक्ष में) में एक्टिन और सूक्ष्मनलिकाएं को-पॉलीमराइज करने की क्षमता थी। हालांकि, सक्रिय कंपोजिट के लिए इस दृष्टिकोण का विस्तार करने के लिए एक्टिन और ट्यूबुलिन पोलीमराइजेशन से पहले नमूने में मोटर्स को जोड़ने की आवश्यकता होगी और प्रयोगों से पहले पूरे नमूने को 37 डिग्री सेल्सियस पर एक साथ इनक्यूबेट करना होगा। प्रोटोकॉल में इस भिन्नता के परीक्षणों के परिणामस्वरूप एक्टिन पोलीमराइजेशन कम हो गया है और कोई स्पष्ट मोटर गतिविधि नहीं हुई है, संभवतः प्रतिस्पर्धी एटीपीस गतिविधि और मोटर्स के लंबे समय तक 37 डिग्री सेल्सियस इनक्यूबेशन के कारण। सौभाग्य से, वर्तमान प्रोटोकॉल का पालन करते समय कंपोजिट का कोई स्पष्ट प्रवाह संरेखण नहीं है, जैसा कि चित्रा 2, चित्रा 3 और चित्रा 6 में देखा जा सकता है। फिर भी, शोधकर्ताओं को प्रोटोकॉल डिजाइन करने के लिए प्रोत्साहित किया जाता है जो सक्रिय कंपोजिट के सीटू गठन की अनुमति देता है।
विचार का एक और बिंदु प्रतिदीप्ति लेबलिंग योजना है, जो नेटवर्क में सभी एक्टिन फिलामेंट्स और सूक्ष्मनलिकाएं को विरल रूप से लेबल करता है। इस लेबलिंग दृष्टिकोण को ट्रेसर फिलामेंट्स या माइक्रोसेफर्स के माध्यम से संरचना और गतिशीलता का अनुमान लगाने के बजाय नेटवर्क की संरचना को सीधे कल्पना करने के लिए अनुकूलित किया गया था। हालांकि, व्यापार यह है कि व्यक्तिगत फिलामेंट्स उज्ज्वल रूप से लेबल और हल करने योग्य नहीं हैं। एक दृष्टिकोण जो शोधकर्ता एकल फिलामेंट्स को हल करने के साथ-साथ नेटवर्क संरचना की कल्पना करने के लिए ले सकते हैं, वह है एक और फ्लोरोफोरे के साथ लेबल किए गए पूर्व-निर्मित फिलामेंट्स में डोप करना, ताकि आसपास के नेटवर्क और व्यक्तिगत फिलामेंट्स दोनों को एक साथ चित्रित किया जा सके। हालांकि, दो से अधिक फ्लोरोफोर और उत्तेजना / उत्सर्जन चैनलों का उपयोग करते समय, चैनलों के बीच रक्तस्राव को खत्म करना अक्सर कठिन होता है, इसलिए फ्लोरोफोरे, फिल्टर और लेजर तीव्रता चुनने में सावधानी बरतनी चाहिए।
एक संबंधित सीमा कंपोजिट में मायोसिन या किन्सिन मोटर्स की कल्पना करने में असमर्थता है। फ्लोरोसेंट-लेबल एक्टिन मोनोमर्स और ट्यूबुलिन डिमर व्यावसायिक रूप से उपलब्ध हैं, जबकि कंपोजिट में मायोसिन या काइन्सिन के विज़ुअलाइज़ेशन के लिए इन-हाउस लेबलिंग की आवश्यकता होती है। शोधकर्ताओं को मोटर्स को लेबल करने के लिए अगला कदम उठाने के लिए प्रोत्साहित किया जाता है, जैसा कि पहले18,67 किया गया था, ताकि मोटर गतिविधि को स्पष्ट रूप से लिंक किया जा सके और हमारे कंपोजिट प्रदर्शित होने वाली गतिशीलता और संरचनाओं को बांध सकें।
अंत में, यह ध्यान रखना महत्वपूर्ण है कि, वर्तमान प्रोटोकॉल में, किनेसिन गतिविधि की शुरुआत और अवधि को नियंत्रित नहीं किया जाता है। क्योंकि मायोसिन गतिविधि को ब्लेबिस्टैटिन के फोटो-डिएक्टिवेशन का उपयोग करके नियंत्रित किया जाता है, जैसा कि ऊपर वर्णित है, काइन्सिन के समान प्रकाश-सक्रियण में निर्माण करने के लिए, कोई प्रकाश-सक्रिय एटीपी को शामिल कर सकता है।
यहां वर्णित डिजाइनों की जटिलता का निर्माण करने के लिए, सेलुलर स्थितियों की बेहतर नकल करने और गतिशील-संरचना-फ़ंक्शन पैरामीटर स्थान को व्यापक बनाने के लिए, भविष्य का काम मध्यवर्ती फिलामेंट्स को शामिल करने पर ध्यान केंद्रित करेगा, जैसे कि विमेंटिन68,69, साथ ही अन्य मोटर्स जैसे डायनेन13,70। एक्टिन लंबाई14 को नियंत्रित करने के लिए विभिन्न सांद्रता में गेलसोलिन को भी शामिल किया जाएगा, साथ ही सूक्ष्मनलिका कठोरता को नियंत्रित करने के लिए ताऊ प्रोटीन भी शामिल किया जाएगा।
सारांश में, प्रस्तुत प्रोटोकॉल वर्णन करते हैं कि साइटोस्केलेटन-प्रेरित सक्रिय पदार्थ प्रणालियों की गतिशीलता, संरचना और यांत्रिकी को कैसे डिजाइन, बनाया और चिह्नित किया जाए, जिसमें दो अलग-अलग सक्रिय बल-उत्पन्न करने वाले घटक होते हैं जो एक ही प्रणाली में विभिन्न सब्सट्रेट्स पर कार्य करते हैं। यह असमर्थ और मॉड्यूलर प्लेटफ़ॉर्म पुनर्गठन प्रयासों को सेलुलर साइटोस्केलेटन की नकल करने के करीब एक महत्वपूर्ण कदम लाता है और स्वतंत्र रूप से शामिल करके, हटाकर और ट्यूनिंग करके एक विस्तृत चरण स्थान में अपने गुणों को प्रोग्राम करने की अनूठी क्षमता प्रदान करता है। इसके अलावा, इस बहुमुखी प्रणाली के सभी घटक व्यावसायिक रूप से उपलब्ध हैं (सामग्री की तालिका देखें), रॉस लैब में शुद्ध किए गए किन्सिन डिमर को छोड़कर, जैसा कि पहले50 में वर्णित है, और अनुरोध पर उपलब्ध है। अंत में, सभी विश्लेषण कोड GitHub49 के माध्यम से स्वतंत्र रूप से उपलब्ध है और मुफ्त प्रोग्रामिंग भाषाओं और सॉफ्टवेयर (पायथन और फिजी) पर आधारित है। इन प्रणालियों को डिजाइन करने के लिए प्रोटोकॉल का पारदर्शी प्रसार उम्मीद है कि इस मंच को विभिन्न विशेषज्ञता, पृष्ठभूमि, संस्थागत संबद्धता और अनुसंधान लक्ष्यों के साथ उपयोगकर्ताओं के विविध समूह के लिए अधिक सुलभ बना देगा।
लेखकों के पास खुलासा करने के लिए कुछ भी नहीं है
हम डेटा विश्लेषण के साथ सहायता के लिए माया हेंडिजा और डॉ जोनाथन मिशेल को और सहायक चर्चाओं और मार्गदर्शन के लिए डॉ जेनेट शेउंग, डॉ मौमिता दास और डॉ माइकल रस्ट को स्वीकार करते हैं। इस शोध को आरएमआरए और जेएलआर को दिए गए विलियम एम. केक फाउंडेशन रिसर्च ग्रांट और एनएसएफ डीएमआरईएफ अवार्ड (डीएमआर 2119663) और आरएमआर-ए और आरजेएम को दिए गए नेशनल इंस्टीट्यूट ऑफ हेल्थ आर 15 ग्रांट्स (आर15जीएम123420, 2आर15जीएम123420-02) द्वारा समर्थित किया गया था।
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin Abbreviation used in paper: blebbistatin | Sigma Aldrich | B0560 | Stock Concentration: 200 μM in DMSO Storage: dessicated, in DMSO, -20ºC Stock and Experiment Recipes: dissolve 1 mg of powder to 200 μM in DMSO Storage, Handling, Troubleshooting Notes: limited shelf-life, typically stops functioning reliably after 3-4 months. purchase and prepare new solution every 3 months. |
| 1:20 488-tubulin:tubulin mixture Abbreviation used in paper: 5-488-tubulin | NA | NA | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: mix tubulin and 488-tubulin at a 20:1 ratio, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| 1:20 R-tubulin:tubulin mixture Abbreviation used in paper: 5-R-tubulin | NA | NA | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: mix tubulin and rhodamine tubulin at a 20:1 ratio, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| actin (biotin): skeletal muscle Abbreviation used in paper: biotin-actin | Cytoskeleton | AB07 | Stock Concentration: 1 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: (1) immediately prior to use dilute to 0.5 mg/ml in PEM, (2) once removed from -80ºC, store aliquot on ice at 4ºC for up to 1 week |
| actin (rhodamine): rabbit skeletal muscle Abbreviation used in paper: R-actin | Cytoskeleton | AR05 | Stock Concentration: 1.5 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1.5 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: once removed from -80ºC, store aliquot on ice at 4ºC, can be used for up to 1 week |
| adenosine triphosphate Abbreviation used in paper: ATP | Thermo Fisher Scientific | A1048 | Stock Concentration: 100 mM Storage: in solution (pH 7), -20ºC Stock and Experiment Recipes: reconsitute in DI H20, bring pH to 7 with NaOH Storage, Handling, Troubleshooting Notes: routinely check pH and adjust as needed, hydrolyzes over time, replace every ~6-12 months |
| AlexaFluor488 Phalloidin Abbreviation used in paper: 488-phalloidin | Thermo Fisher Scientific | A12379 | Stock Concentration: 100 μM DMSO Storage: protected from light, dessicated, -20ºC Stock and Experiment Recipes: reconstitute to 100 μM with DMSO Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 20 μM in PEM (1 μL in 4 μL PEM) |
| AlexaFluor488–labeled actin Abbreviation used in paper: 488-actin | Thermo Fisher Scientific | A12373 | Stock Concentration: 1.5 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 1.5 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: this item has been discontinued |
| Basic Plasma Cleaner Abbreviation used in paper: plasma cleaner | Harrick Plasma | PDC-32G | |
| Bemis Parafilm M Laboratory Wrapping Film Abbreviation used in paper: transparent film | Thermo Fisher Scientific | 13-374-5 | |
| D-(+)-Glucose Abbreviation used in paper: | Thermo Fisher Scientific | A1682836 | Stock Concentration: 100x Storage: store at stock concentration (100x) or 10x concentration, dessicated, at -20ºC Stock and Experiment Recipes: reconstitute powder to 4.5 mg/ml in DI H20 Storage, Handling, Troubleshooting Notes: final concentration in solution should 45 μg/mL |
| D-Biotin Abbreviation used in paper: biotin | Fisher Scientific | BP232-1 | Stock Concentration: 1.02 mM in PEM Storage: dessicated, 4ºC |
| deionized nanopure water Abbreviation used in paper: DI | |||
| Dimethyldichlorosilane Abbreviation used in paper: silane | Thermo Fisher Scientific | D/3820/PB05 | Stock Concentration: 2% dissolved in Toulene |
| Dithiothreitol Abbreviation used in paper: DTT | Thermo Fisher Scientific | R0861 | Stock Concentration: 1 M in DMSO Storage: dessicated, -20ºC Stock and Experiment Recipes: dilute to 2 mM in PEM immediately before each experiment |
| DMSO Anhydrous Abbreviation used in paper: DMSO | Thermo Fisher Scientific | D12345 | |
| F-Buffer Abbreviation used in paper: F-buffer | NA | NA | Stock Concentration: 10x Storage: dessicated, -20ºC Stock and Experiment Recipes: 10 mM Imidazole (pH 7.0), 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 0.2 mM ATP |
| G-Buffer Abbreviation used in paper: G-buffer | NA | NA | Stock Concentration: 10x Storage: dessicated, -20ºC Stock and Experiment Recipes: 2.0 mM Tris (pH 8), 0.2 mM ATP, 0.5 mM DTT, 0.1 mM CaCl2. Store at -20°C. |
| glass microscope slide Abbreviation used in paper: slide | Thermo Fisher Scientific | 22-310397 | |
| Glucose oxidase + catalase + β-mercaptoethanol Abbreviation used in paper: GOC | Sigma Aldrich | G2133-250KU, C1345, 63689 | Stock Concentration: 100x Storage: store at stock concentration (100x) or 10x concentration, dessicated, at -20ºC Stock and Experiment Recipes: For 100x: 4.3 mg/ml glucose oxidase, 0.7 mg/ml catalase, 0.5% v/v β-mercaptoethanol in DI H20 Storage, Handling, Troubleshooting Notes: final concentration in solution should be: 0.005% β-mercaptoethanol, 43 μg/mL glucose oxidase, 7 μg/mL catalase |
| glu-GOC oxygen scavenging system Abbreviation used in paper: glu-GOC | NA | NA | Stock Concentration: 100x Storage: prepare fresh each time Stock and Experiment Recipes: mix equal parts Glu and GOC and add at 1/100 final sample volume immediately before imaging Storage, Handling, Troubleshooting Notes: prepare from Glu and GOC immediately before imaging |
| Guanosine triphosphate Abbreviation used in paper: GTP | Thermo Fisher Scientific | R0461 | Stock Concentration: 100 mM Storage: 100 μL aliquots at -20ºC |
| Instant Mix 1-minute epoxy Abbreviation used in paper: epoxy | Loctite | 1366072 | |
| Kinesin-1 401 BIO 6x HIS Abbreviation used in paper: kinesin | Prepared in JL Ross Lab at Syracuse University | NA | Stock Concentration: 8.87 μM in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Storage, Handling, Troubleshooting Notes: biotinylated dimers form kinesin clusters, each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| NeutrAvidin Abbreviation used in paper: NA | Thermo Fisher Scientific | 31000 | Stock Concentration: 5 mg/ml in PEM Storage: dessicated, -20ºC Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM |
| No 1. glass coverslips (24 mm x 24 mm) Abbreviation used in paper: coverslip | Thermo Fisher Scientific | 12-548-CP | |
| Paclitaxel Abbreviation used in paper: Taxol | Thermo Fisher Scientific | P3456 | Stock Concentration: 2 mM in DMSO Storage: protected from light, dessicated, -20ºC Stock and Experiment Recipes: reconstitute to 2 mM with DMSO Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 200 μM in DMSO (0.4 μL in 3.6 μL DMSO) |
| PEM-100 Abbreviation used in paper: PEM | NA | NA | Stock Concentration: 1x Storage: room temperature (RT) Stock and Experiment Recipes: 100 mM K-PIPES (pH 6.8), 2 mM EGTA, 2 mM MgCl2 Storage, Handling, Troubleshooting Notes: use KOH to adjust pH to 6.8, recheck pH often and adjust accordingly |
| phalloidin Abbreviation used in paper: phalloidin | Thermo Fisher Scientific | P3457 | Stock Concentration: 100 μM in DMSO Storage: protected from light, dessicated, -20ºC, adhere closely to storage/handling conditions Stock and Experiment Recipes: reconstitute to 100 μM with DMSO Storage, Handling, Troubleshooting Notes: susceptible to impurities in its preparation and denaturing, identifiable as large amorphous aggregates of actin in samples |
| porcine brain tubulin Abbreviation used in paper: tubulin | Cytoskeleton | T240 | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| Potassium Chloride Abbreviation used in paper: KCl | Thermo Fisher Scientific | AM9640G | Stock Concentration: 4 M Storage: RT |
| Rabbit skeletal actin Abbreviation used in paper: actin | Cytoskeleton | AKL99 | Stock Concentration: 2 mg/ml in G-buffer Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute to 2 mg/ml in G-buffer, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: once removed from -80ºC, store aliquot on ice at 4ºC, can be used for up to 1 week |
| Rabbit skeletal myosin II Abbreviation used in paper: myosin | Cytoskeleton | MY02 | Stock Concentration: 10 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 10 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: monomers form minifilaments at low KCl, each aliquot can be used for up to 12 hrs stored on ice at 4ºC |
| Tubulin (biotin): porcine brain Abbreviation used in paper: biotin-tubulin | Cytoskeleton | T333P | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: immediately prior to use dilute to 0.5 mg/ml in PEM |
| Tubulin (fluorescent HiLyte 488): porcine brain Abbreviation used in paper: 488-tubulin | Cytoskeleton | TL488M | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| tubulin (rhodamine): porcine brain Abbreviation used in paper: R-tubulin | Cytoskeleton | TL590M | Stock Concentration: 5 mg/ml in PEM Storage: single use aliquots, -80ºC, avoid freeze-thaw cycles Stock and Experiment Recipes: reconstitute powder to 5 mg/ml in PEM, flash freeze with LN2 Storage, Handling, Troubleshooting Notes: each aliquot can be used for up to 12 hrs stored on ice at 4ºC, protect from light |
| Tween 20 Abbreviation used in paper: Tween20 | Thermo Fisher Scientific | J20605.AP | Stock Concentration: 1% v/v in DI H20 Storage: RT |
| ultracentrifuge grade microtubes Abbreviation used in paper: Beckman-Coulter Optima Max XP | Beckman Coultier | 343776 | Storage, Handling, Troubleshooting Notes: 8x34 mm PC |
| UV light curing glue Abbreviation used in paper: UV glue | Pharda | SKG-2869 |
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463 (7280), 485-492 (2010).
- Koenderink, G. H., Paluch, E. K. Architecture shapes contractility in actomyosin networks. Current Opinion in Cell Biology. 50, 79-85 (2018).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Burla, F., Mulla, Y., Vos, B. E., Aufderhorst-Roberts, A., Koenderink, G. H. From mechanical resilience to active material properties in biopolymer networks. Nature Reviews Physics. 1 (4), 249-263 (2019).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State and Materials Science. 15 (5), 177-182 (2011).
- Xiao, Q., Hu, X., Wei, Z., Tam, K. Y. Cytoskeleton molecular motors: structures and their functions in neuron. International Journal of Biological Sciences. 12 (9), 1083-1092 (2016).
- Ajeti, V. et al. Wound healing coordinates actin architectures to regulate mechanical work. Nature Physics. 15 (7), 696-705 (2019).
- Jung, W. et al. Dynamic motions of molecular motors in the actin cytoskeleton. Cytoskeleton. 76 (11-12), 517-531 (2019).
- Pollard, T. D., O'Shaughnessy, B. Molecular mechanism of cytokinesis. Annual Review of Biochemistry. 88 (1), 661-689 (2019).
- Huber, F., Boire, A., López, M. P., Koenderink, G. H. Cytoskeletal crosstalk: when three different personalities team up. Current Opinion in Cell Biology. 32, 39-47 (2015).
- Rivero, F. et al. The role of the cortical cytoskeleton: F-actin crosslinking proteins protect against osmotic stress, ensure cell size, cell shape and motility, and contribute to phagocytosis and development. Journal of Cell Science. 109 (11), 2679-2691 (1996).
- Duclos, G. et al. Topological structure and dynamics of three-dimensional active nematics. Science. 367 (6482), 1120-1124 (2020).
- Baclayon, M. et al. Optical tweezers-based measurements of forces and dynamics at microtubule ends. Optical Tweezers. 1486, 411-435 (2017).
- Gurmessa, B., Fitzpatrick, R., Falzone, T. T., Robertson-Anderson, R. M. Entanglement density tunes microscale nonlinear response of entangled actin. Macromolecules. 49 (10), 3948-3955 (2016).
- Francis, M. L. et al. Non-monotonic dependence of stiffness on actin crosslinking in cytoskeleton composites. Soft Matter. 15 (44), 9056-9065 (2019).
- Ricketts, S. N. et al. Varying crosslinking motifs drive the mesoscale mechanics of actin-microtubule composites. Scientific Reports. 9 (1), 12831 (2019).
- Lee, G. et al. Active cytoskeletal composites display emergent tunable contractility and restructuring. Soft Matter. 17 (47), 10765-10776 (2021).
- Murrell, M. P., Gardel, M. L. F-actin buckling coordinates contractility and severing in a biomimetic actomyosin cortex. Proceedings of the National Academy of Sciences. 109 (51), 20820-20825 (2012).
- Soares e Silva, M. et al. Active multistage coarsening of actin networks driven by myosin motors. Proceedings of the National Academy of Sciences. 108 (23), 9408-9413 (2011).
- Sonn-Segev, A., Bernheim-Groswasser, A., Roichman, Y. Dynamics in steady state in vitro acto-myosin networks. Journal of Physics: Condensed Matter. 29 (16), 163002 (2017).
- Ideses, Y., Sonn-Segev, A., Roichman, Y., Bernheim-Groswasser, A. Myosin II does it all: assembly, remodeling, and disassembly of actin networks are governed by myosin II activity. Soft Matter. 9 (29), 7127 (2013).
- Fürthauer, S. et al. Self-straining of actively crosslinked microtubule networks. Nature Physics. 15 (12), 1295-1300 (2019).
- Lemma, L. M. et al. Multiscale microtubule dynamics in active nematics. Physical Review Letters. 127 (14), 148001 (2021).
- Fan, Y., Wu, K.-T., Aghvami, S. A., Fraden, S., Breuer, K. S. Effects of confinement on the dynamics and correlation scales in kinesin-microtubule active fluids. Physical Review E. 104 (3), 034601 (2021).
- Triclin, S. et al. Self-repair protects microtubules from destruction by molecular motors. Nature Materials. 20 (6), 883-891 (2021).
- Lee, G. et al. Myosin-driven actin-microtubule networks exhibit self-organized contractile dynamics. Science Advances. 7 (6), eabe4334 (2021).
- Ricketts, S. N., Ross, J. L., Robertson-Anderson, R. M. Co-entangled actin-microtubule composites exhibit tunable stiffness and power-law stress relaxation. Biophysical Journal. 115 (6), 1055-1067 (2018).
- Bendix, P. M. et al. A quantitative analysis of contractility in active cytoskeletal protein networks. Biophysical Journal. 94 (8), 3126-3136 (2008).
- Linsmeier, I. et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7 (1), 12615 (2016).
- Stam, S. et al. Filament rigidity and connectivity tune the deformation modes of active biopolymer networks. Proceedings of the National Academy of Sciences. 114 (47), E10037-E10045 (2017).
- Yadav, V. et al. Filament nucleation tunes mechanical memory in active polymer networks. Advanced Functional Materials. 29 (49), 1905243 (2019).
- Ennomani, H. et al. Architecture and connectivity govern actin network contractility. Current Biology. 26 (5), 616-626 (2016).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (9), 591-597 (2013).
- Alvarado, J., Cipelletti, L., Koenderink, G. H. Uncovering the dynamic precursors to motor-driven contraction of active gels. Soft Matter. 15 (42), 8552-8565 (2019).
- Jung, W., Murrell, M. P., Kim, T. F-actin cross-linking enhances the stability of force generation in disordered actomyosin networks. Computational Particle Mechanics. 2 (4), 317-327 (2015).
- Lenz, M., Thoresen, T., Gardel, M. L., Dinner, A. R. Contractile units in disordered actomyosin bundles arise from f-actin buckling. Physical Review Letters. 108 (23), 238107 (2012).
- Memarian, F.L. et al. Active nematic order and dynamic lane formation of microtubules driven by membrane-bound diffusing motors. Proceedings of the National Academy of Sciences. 118 (52), e2117107118 (2021).
- Needleman, D., Dogic, Z. Active matter at the interface between materials science and cell biology. Nature Reviews Materials. 2 (9), 17048 (2017).
- Foster, P. J., Fürthauer, S., Shelley, M. J., Needleman, D. J. Active contraction of microtubule networks. eLife. 4, e10837 (2015).
- Thijssen, K. et al. Submersed micropatterned structures control active nematic flow, topology, and concentration. Proceedings of the National Academy of Sciences. 118 (38), e2106038118 (2021).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Colen, J. et al. Machine learning active-nematic hydrodynamics. Proceedings of the National Academy of Sciences. 118 (10), e2016708118 (2021).
- Mitchell, K. A., Tan, A. J., Arteaga, J., Hirst, L. S. Fractal generation in a two-dimensional active-nematic fluid. Chaos: An Interdisciplinary Journal of Nonlinear Science. 31 (7), 073125 (2021).
- Pandolfi, R. J., Edwards, L., Johnston, D., Becich, P., Hirst, L. S. Designing highly tunable semiflexible filament networks. Physical Review E. 89 (6), 062602 (2014).
- Tan, A. J. et al. Topological chaos in active nematics. Nature Physics. 15 (10), 1033-1039 (2019).
- Roostalu, J., Rickman, J., Thomas, C., Nédélec, F., Surrey, T. Determinants of polar versus nematic organization in networks of dynamic microtubules and mitotic motors. Cell. 175 (3), 796-808.e14 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sheung, J. Y. et al. Motor-driven restructuring of cytoskeleton composites leads to tunable time-varying elasticity. ACS Macro Letters. 10 (9), 1151-1158 (2021).
- McGorty, R. PyDDM v0.2.0. Zenodo. (2022).
- Achiriloaie, D. H. et al. Kinesin and myosin motors compete to drive rich multi-phase dynamics in programmable cytoskeletal composites. arXiv. (2021).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), eaay5912 (2019).
- McGorty, R. Image-Correlation. at <https://github.com/rmcgorty/Image-Correlation>. (2020).
- Robertson, C. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- McGorty, R. Differential Dynamic Microscopy - Python. at <https://github.com/rmcgorty/Differential-Dynamic-Microscopy---Python>. (2021).
- Cerbino, R., Trappe, V. Differential dynamic microscopy: probing wave vector dependent dynamics with a microscope. Physical Review Letters. 100 (18), 188102 (2008).
- Robertson-Anderson, R. M. Optical tweezers microrheology: from the basics to advanced techniques and applications. ACS Macro Letters. 7 (8), 968-975 (2018).
- Pollard, T. D. Polymerization of ADP-actin. Journal of Cell Biology. 99 (3), 769-777 (1984).
- Coué, M., Brenner, S. L., Spector, I., Korn, E. D. Inhibition of actin polymerization by latrunculin A. FEBS Letters. 213 (2), 316-318 (1987).
- Pollard, T. D. Actin and actin-binding proteins. Cold Spring Harbor Perspectives in Biology. 8 (8), a018226 (2016).
- Kumar, N. Taxol-induced polymerization of purified tubulin. Mechanism of action. Journal of Biological Chemistry. 256 (20), 10435-10441 (1981).
- Käs, J. et al. F-actin, a model polymer for semiflexible chains in dilute, semidilute, and liquid crystalline solutions. Biophysical Journal. 70 (2), 609-625 (1996).
- Viamontes, J., Narayanan, S., Sandy, A. R., Tang, J. X. Orientational order parameter of the nematic liquid crystalline phase of F -actin. Physical Review E. 73 (6), 061901 (2006).
- Hitt, A. L., Cross, A. R., Williams, R. C. Microtubule solutions display nematic liquid crystalline structure. Journal of Biological Chemistry. 265 (3), 1639-1647 (1990).
- Andexer, J. N., Richter, M. Emerging enzymes for ATP regeneration in biocatalytic processes. ChemBioChem. 16 (3), 380-386 (2015).
- Farhadi, L. et al. Actin and microtubule crosslinkers tune mobility and control co-localization in a composite cytoskeletal network. Soft Matter. 16 (31), 7191-7201 (2020).
- Falzone, T. T., Lenz, M., Kovar, D. R., Gardel, M. L. Assembly kinetics determine the architecture of α-actinin crosslinked F-actin networks. Nature Communications. 3 (1), 861 (2012).
- Thoresen, T., Lenz, M., Gardel, M. L. Reconstitution of contractile actomyosin bundles. Biophysical Journal. 100 (11), 2698-2705 (2011).
- Sanghvi-Shah, R., Weber, G. F. Intermediate filaments at the junction of mechanotransduction, migration, and development. Frontiers in Cell and Developmental Biology. 5, 81 (2017).
- Shen, Y. et al. Effects of vimentin intermediate filaments on the structure and dynamics of in vitro multicomponent interpenetrating cytoskeletal networks. Physical Review Letters. 127 (10), 108101 (2021).
- Laan, L., Roth, S., Dogterom, M. End-on microtubule-dynein interactions and pulling-based positioning of microtubule organizing centers. Cell Cycle. 11 (20), 3750-3757 (2012).
Erratum
Erratum: Reconstituting and Characterizing Actin-Microtubule Composites with Tunable Motor-Driven Dynamics and MechanicsAn erratum was issued for: Reconstituting and Characterizing Actin-Microtubule Composites with Tunable Motor-Driven Dynamics and Mechanics. The Authors section was updated.
Mehrzad Sasanpour1
Daisy H. Achiriloaie1,2
Gloria Lee1
Gregor Leech1
Christopher Currie1
K. Alice Lindsay3
Jennifer L. Ross3
Ryan J. McGorty1
Rae M. Robertson-Anderson1
1Department of Physics and Biophysics, University of San Diego
2W. M. Keck Science Department, Scripps College, Pitzer College, and Claremont McKenna College
3Department of Physics, Syracuse University
to:
Mehrzad Sasanpour1
Daisy H. Achiriloaie1,2
Gloria Lee1
Gregor Leech1
Maya Hendija1
K. Alice Lindsay3
Jennifer L. Ross3
Ryan J. McGorty1
Rae M. Robertson-Anderson1
1Department of Physics and Biophysics, University of San Diego
2W. M. Keck Science Department, Scripps College, Pitzer College, and Claremont McKenna College
3Department of Physics, Syracuse University
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved