Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Cancer Research
High-Content-Screening-Assay zur Identifizierung von Antikörper-abhängigen zellulären Zytotoxizitäts-modifizierenden Verbindungen
Dieses Protokoll stellt eine automatisierte, bildbasierte Hochdurchsatztechnik vor, um Verbindungen zu identifizieren, die die natürliche Killerzell-vermittelte Abtötung von Brustkrebszellen in Gegenwart eines therapeutischen Anti-HER2-Antikörpers modulieren.
Die Immuntherapie mit antigenspezifischen Antikörpern oder Immun-Checkpoint-Inhibitoren hat die Therapie von Brustkrebs revolutioniert. Brustkrebszellen, die den epidermalen Wachstumsfaktorrezeptor HER2 exprimieren, können mit dem Anti-HER2-Antikörper Trastuzumab angegriffen werden. Die Antikörper-abhängige zelluläre Zytotoxizität (ADCC) ist ein wichtiger Mechanismus, der an der Antitumorwirkung von HER2 beteiligt ist. Trastuzumab, das an Krebszellen gebunden ist, kann von den Fc-Rezeptoren von ADCC-Effektorzellen (z. B. natürlichen Killerzellen, Makrophagen und Granulozyten) erkannt werden, wodurch die zytotoxische Aktivität dieser Immunzellen ausgelöst wird, die zum Tod von Krebszellen führt. Wir haben uns zum Ziel gesetzt, einen bildbasierten Assay für die Quantifizierung von ADCC zu entwickeln, um neuartige ADCC-Modulatorverbindungen durch High-Content-Screening zu identifizieren. In dem Assay werden HER2-überexprimierende JIMT-1-Brustkrebszellen mit NK-92-Zellen in Gegenwart von Trastuzumab kokultiviert, und der Zielzelltod wird durch automatisierte Mikroskopie und quantitative Bildanalyse quantifiziert. Zielzellen werden anhand ihrer EGFP-Fluoreszenz von Effektorzellen unterschieden. Wir zeigen, wie Substanzbibliotheken im Assay getestet werden können, um ADCC-Modulatoren zu identifizieren. Zu diesem Zweck wurde eine Compound-Library-Testplatte mit zufällig ausgewählten Feinchemikalien aus dem Laborregal aufgebaut. Drei Mikrotubuli-destabilisierende Verbindungen (Colchicin, Vincristin, Podophyllotoxin), von denen angenommen wird, dass sie die Migration und Degranulation von NK-Zellen stören, wurden ebenfalls in die Testbibliothek aufgenommen. Das Testscreening identifizierte alle drei Positivkontrollverbindungen als Treffer, was die Eignung der Methode zur Identifizierung von ADCC-modifizierenden Medikamenten in einer chemischen Bibliothek belegt. Mit diesem Assay können Substanzbibliotheks-Screenings durchgeführt werden, um ADCC-verstärkende Verbindungen zu identifizieren, die als adjuvante Therapeutika für die Behandlung von Patienten verwendet werden könnten, die Krebsimmuntherapien erhalten. Darüber hinaus können mit der Methode auch unerwünschte ADCC-hemmende Nebenwirkungen von Therapeutika identifiziert werden, die von Krebspatienten für verschiedene Indikationen eingenommen werden.
Die Immuntherapie mit Antikrebsantikörpern, Immun-Checkpoint-Inhibitoren oder chimären Antigenrezeptor-exprimierenden T (CAR-T)-Zellen stellt einen wirksamen Ansatz zur Krebsbehandlung dar 1,2,3. Trastuzumab ist ein humanisierter monoklonaler Anti-HER2-Antikörper (humaner epidermaler Wachstumsfaktor-Rezeptor 2), der zur Behandlung von HER2-positivem Brustkrebs im Frühstadium oder metastasierendem Brustkrebs sowie HER2-positivem metastasierendem Magenkrebs eingesetzt wird 4,5,6. Es wi....
HINWEIS: Die wichtigsten Schritte des Assay-Workflows sind in Abbildung 2 dargestellt.
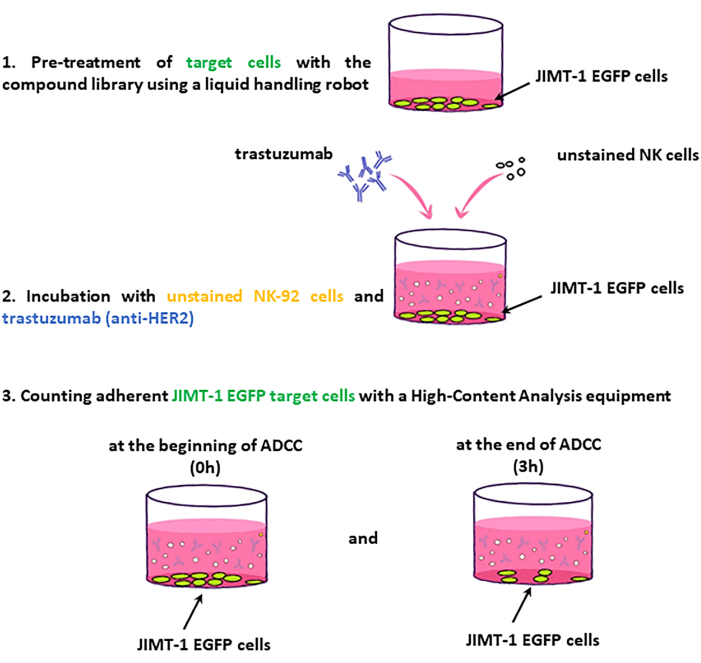
Abbildung 2: Workflow des ADCC-Bildschirms. JIMT-1-EGFP-Zielzellen, die in 96 Well-HCS-Platten ausgesät wurden, werden mit Medikamenten aus der Substanzbibliothek behandelt. Im Gegenzug werden ungefärbte .......
Um zu demonstrieren, wie der Assay in der Praxis funktioniert, haben wir eine Testbibliothek mit 16 Verbindungen erstellt, die nach dem Zufallsprinzip aus den Laborregalen ausgewählt wurden (Abbildung 3). Darüber hinaus wurde DMSO als Negativkontrolle und drei Mikrotubuli-Polymerisationshemmerverbindungen (Colchicin, Vincristin und Podophyllotoxin) als Positivkontrollen eingeschlossen. Letztere sollten ADCC hemmen, indem sie die Migration von NK-Zellen zu den Krebszellen und die Degranulat.......
Die ADCC-Reaktion wurde schon vor relativ langer Zeit beschrieben. Wichtige molekulare Ereignisse des Prozesses wurden ebenfalls beschrieben19. Die Methoden zur Messung der ADCC reichen vom Goldstandard für den Assay zur Freisetzung von radioaktivem Chrom über zytoplasmatische Enzymfreisetzungsassays bis hin zu verschiedenen fluoreszenzbasierten Durchflusszytometrie- oder Mikrotiterplatten-Assays20. Eine häufige Einschränkung dieser Assays besteht jedoch darin, dass sie.......
LV erhielt Mittel aus den Zuschüssen des Nationalen Forschungs-, Entwicklungs- und Innovationsamtes GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE und OTKA K132193, K147482. CD16.176V.NK-92-Zellen wurden von Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, im Auftrag von Brink Biologics, lnc. San Diego, CA), sind weltweit durch Patente geschützt und wurden von Nantkwest, lnc, lizenziert. Die Autoren danken György Vereb und Árpád Szöőr für ihre Hilfe bei der Verwendung der NK-92-Zelllinie und für die technische Beratung.
....| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved