Summary
Abstract
Introduction
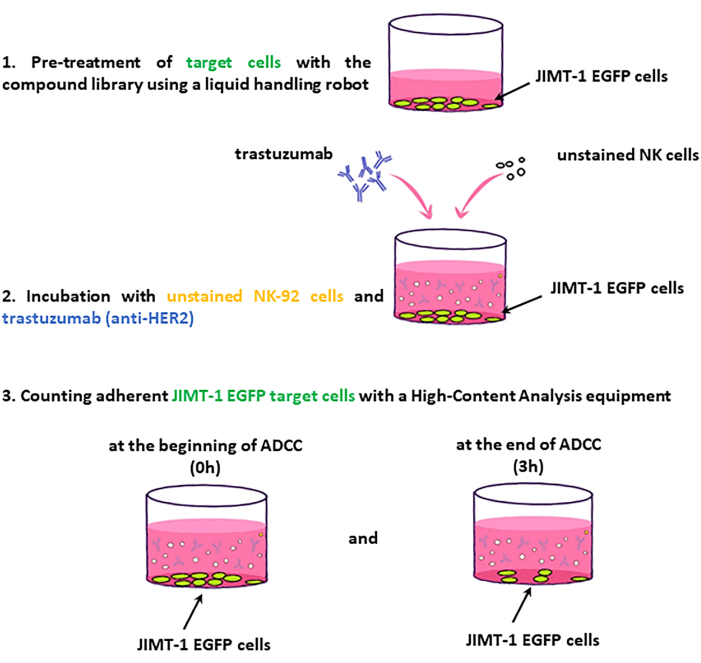
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Cancer Research
抗体依存性細胞傷害修飾化合物の同定のためのハイコンテントスクリーニングアッセイ(英語)
このプロトコルは、治療用抗HER-2抗体の存在下でナチュラルキラー細胞媒介性乳がん細胞死滅を調節する化合物を同定するための自動化された画像ベースのハイスループット技術を提示します。
抗原特異的抗体または免疫チェックポイント阻害剤による免疫療法は、乳がんの治療に革命をもたらしました。上皮成長因子受容体HER2を発現する乳癌細胞は、抗HER-2抗体トラスツズマブによって標的とすることができる。抗体依存性細胞傷害(ADCC)は、HER-2の抗腫瘍作用に関与する重要なメカニズムです。がん細胞に結合したトラスツズマブは、ADCCエフェクター細胞(ナチュラルキラー(NK)細胞、マクロファージ、顆粒球など)のFc受容体によって認識され、これらの免疫細胞の細胞傷害活性を引き起こし、がん細胞死につながります。私たちは、ハイコンテントスクリーニングによって新規ADCCモジュレーター化合物を同定するために、ADCCを定量するための画像ベースのアッセイの開発に着手しました。本アッセイでは、HER2過剰発現JIMT-1乳癌細胞をトラスツズマブ存在下でNK-92細胞と共培養し、自動顕微鏡および定量画像解析により標的細胞死を定量します。標的細胞は、EGFP蛍光に基づいてエフェクター細胞と区別されます。ADCCモジュレーター薬を同定するために、アッセイで化合物ライブラリをテストする方法を示します。この目的のために、ラボの棚からランダムに選択されたファインケミカルを使用して、化合物ライブラリのテストプレートをセットアップしました。NK細胞の移動と脱顆粒を妨げると予想される3つの微小管不安定化化合物(コルヒチン、ビンクリスチン、ポドフィロトキシン)もテストライブラリに含まれていました。テストスクリーニングでは、3つのポジティブコントロール化合物すべてがヒットとして識別され、化学ライブラリ内のADCC修飾薬を同定するための方法の適合性が証明されました。このアッセイでは、化合物ライブラリースクリーニングを実施して、抗がん免疫療法を受けている患者の治療のための補助治療薬として使用できるADCC増強化合物を同定することができます。さらに、この方法は、異なる適応症のために癌患者によって服用された治療薬の望ましくないADCC阻害副作用を特定するためにも使用することができる。
抗がん抗体、免疫チェックポイント阻害剤、またはキメラ抗原受容体発現T(CAR-T)細胞による免疫療法は、がん治療への強力なアプローチです1,2,3。トラスツズマブは、HER-2陽性の早期または転移性乳がん、ならびにHER-2陽性の転移性胃がんの治療に使用されるヒト化モノクローナル抗HER-2(ヒト上皮成長因子受容体2)抗体である4,5,6。主に上皮成長因子4の増殖刺激作用を阻害することにより作用する。しかし、トラスツズマブは、がん細胞がHER-2刺激に対する反応性を失っても、効率的にがん細胞死を引き起こすことが報告されています7。抗体のこの逆説的な効果は、抗体依存性細胞媒介性細胞傷害(ADCC)7によるものです。ADCCは、ADCCのエフェクター細胞と総称されるナチュラルキラー(NK)細胞、顆粒球、およびマクロファージによって媒介され得る8,9
LVは、国立研究開発イノベーションオフィスの助成金GINOP-2.3.2-15-2016-00010 TUMORDNS」、GINOP-2.3.2-15-2016-00048-STAYALIVEおよびOTKA K132193、K147482から資金提供を受けました。CD16.176V.NK-92細胞は、Dr. Kerry S. Campbell(Fox Chase Center, Philapedlphia, Pen, Brink Biologics, lnc.カリフォルニア州サンディエゴ)は、世界中の特許によって保護されており、nantkwest、lncによってライセンスされています。著者らは、NK-92細胞株の使用と技術的助言を提供してくれたGyörgy VerebとÁrpád Szöőrに感謝しています。
....| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved