Summary
Abstract
Introduction
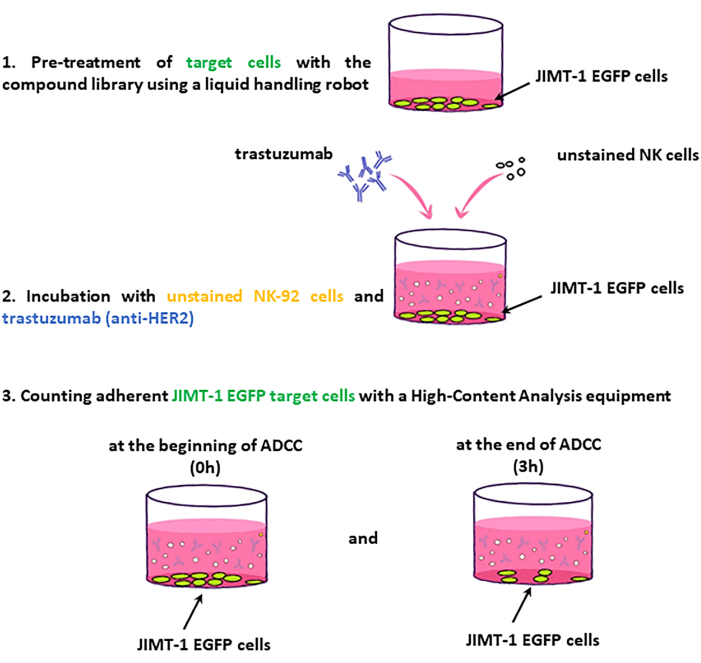
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Cancer Research
Скрининговый анализ с высоким содержанием для идентификации антителозависимых соединений, модифицирующих клеточную цитотоксичность
Этот протокол представляет собой автоматизированный высокопроизводительный метод на основе изображений для идентификации соединений, модулирующих естественное уничтожение клеток рака молочной железы, опосредованное естественными клетками-киллерами, в присутствии терапевтического антитела против HER-2.
Иммунотерапия антиген-специфическими антителами или ингибиторами иммунных контрольных точек произвела революцию в терапии рака молочной железы. Клетки рака молочной железы, экспрессирующие рецептор эпидермального фактора роста HER2, могут быть нацелены на антитело против HER-2 трастузумаб. Антителозависимая клеточная цитотоксичность (ADCC) является важным механизмом, участвующим в противоопухолевом действии HER-2. Трастузумаб, связанный с раковыми клетками, может быть распознан Fc-рецепторами эффекторных клеток ADCC (например, естественных клеток-киллеров (NK), макрофагов и гранулоцитов), запуская цитотоксическую активность этих иммунных клеток, приводящую к гибели раковых клеток. Мы решили разработать анализ на основе изображений для количественного определения ADCC для идентификации новых соединений модулятора ADCC с помощью скрининга с высоким содержанием. В анализе сверхэкспрессирующие клетки рака молочной железы HER2 JIMT-1 культивируются совместно с клетками NK-92 в присутствии трастузумаба, а гибель клеток-мишеней количественно определяется с помощью автоматической микроскопии и количественного анализа изображений. Клетки-мишени отличаются от эффекторных клеток на основе их флуоресценции EGFP. Мы показываем, как библиотеки соединений могут быть протестированы в анализе для идентификации препаратов-модуляторов ADCC. Для этой цели была установлена тестовая пластина для библиотеки соединений с использованием случайно выбранных тонких химикатов с лабораторной полки. В библиотеку тестов также были включены три дестабилизирующих соединения микротрубочек (колхицин, винкристин, подофиллотоксин), которые, как ожидается, будут препятствовать миграции и дегрануляции NK-клеток. Тестовый экран идентифицировал все три положительных контрольных соединения как попадания, доказывающие пригодность метода для идентификации ADCC-модифицирующих лекарств в химической библиотеке. С помощью этого анализа можно проводить скрининг библиотеки соединений для идентификации соединений, усиливающих ADCC, которые могут быть использованы в качестве адъювантных терапевтических агентов для лечения пациентов, получающих противоопухолевую иммунотерапию. Кроме того, метод также может быть использован для выявления любых нежелательных побочных эффектов, ингибирующих ADCC терапевтических препаратов, принимаемых онкологическими больными по различным показаниям.
Иммунотерапия противоопухолевыми антителами, ингибиторами иммунных контрольных точек или Т-клетками, экспрессирующими химерные антигенные рецепторы (CAR-T), представляет собой мощный подход к лечению рака 1,2,3. Трастузумаб представляет собой гуманизированное моноклональное антитело против HER-2 (рецептор 2 эпидермального фактора роста человека), используемое для лечения HER-2-положительного рака молочной железы на ранней стадии или метастатического рака молочной железы, а также HER-2-положительного метастатического рака желудка
Чтобы продемонстрировать, как анализ работает в реальной жизни, мы создали тестовую библиотеку из 16 соединений, выбранных случайным образом с лабораторных полок (рис. 3). Кроме того, ДМСО также был включен в качестве отрицательного контроля и три соединения-ингибитора по.......
Реакция ADCC была описана относительно давно. Также были описаны ключевые молекулярные события процесса19. Методы измерения ADCC варьируются от золотого стандарта анализа высвобождения радиоактивного хрома, анализов высвобождения цитоплазматических ферментов до нескольких.......
LV получила финансирование от грантов Национального управления исследований, разработок и инноваций GINOP-2.3.2-15-2016-00010 TUMORDNS», GINOP-2.3.2-15-2016-00048-STAYALIVE и OTKA K132193, K147482. Клетки CD16.176V.NK-92 были получены от доктора Керри С. Кэмпбелла (Fox Chase Center, Philapedlphia, PA, от имени Brink Biologics, lnc. Сан-Диего, Калифорния), защищены патентами по всему миру и были лицензированы Nantkwest, lnc. Авторы благодарят Дьёрдя Вереба и Арпада Сёёра за помощь в использовании клеточной линии NK-92 и за технические консультации.
....| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved