Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
Subcellulaire fractionering voor de isolatie van synaptische componenten uit het muizenbrein
Dit protocol presenteert een robuuste, gedetailleerde methode om zeer zuivere synaptosomen, synaptische blaasjes en andere synaptische fracties uit het muizenbrein te verkrijgen. Deze methode maakt de evaluatie van synaptische processen mogelijk, inclusief de biochemische analyse van eiwitlokalisatie en -functie met compartimentale resolutie.
Synaptische terminals zijn de primaire plaatsen van neuronale communicatie. Synaptische disfunctie is een kenmerk van veel neuropsychiatrische en neurologische aandoeningen. De karakterisering van synaptische subcompartimenten door biochemische isolatie is daarom een krachtige methode om de moleculaire bases van synaptische processen op te helderen, zowel in gezondheid als ziekte. Dit protocol beschrijft de isolatie van synaptische terminals en synaptische subcompartimenten uit muizenhersenen door subcellulaire fractionering. Ten eerste worden verzegelde synaptische terminale structuren, bekend als synaptosomen, geïsoleerd na homogenisatie van hersenweefsel. Synaposomen zijn neuronale pre- en post-synaptische compartimenten met afgeknepen en afgedichte membranen. Deze structuren behouden een metabolisch actieve toestand en zijn waardevol voor het bestuderen van synaptische structuur en functie. De synaposomen worden vervolgens onderworpen aan hypotone lysis en ultracentrifugatie om synaptische subcompartimenten te verkrijgen die zijn verrijkt voor synaptische blaasjes, synaptisch cytosol en synaptisch plasmamembraan. Fractiezuiverheid wordt bevestigd door elektronenmicroscopie en biochemische verrijkingsanalyse voor eiwitten die specifiek zijn voor sub-synaptische compartimenten. De gepresenteerde methode is een eenvoudig en waardevol hulpmiddel voor het bestuderen van de structurele en functionele kenmerken van de synaps en de moleculaire etiologie van verschillende hersenaandoeningen.
Synapsen zijn de elementaire computationele eenheden van de hersenen waardoor neuronen communiceren en diverse en buitengewoon complexe functies uitoefenen. Synapsen zijn dus fundamenteel voor de gezondheid van de hersenen1; synaptische disfunctie is betrokken als een bron of gevolg van vele aandoeningen2. Synapsen worden gevormd door pre- en post-synaptische terminals, uitbreidingen van twee verschillende neuronen die nauw worden aangesteld en gescheiden door een synaptische spleet doorkruist door synaptische adhesiemoleculen. Informatie stroomt van het pre- naar post-synaptische compartiment in de vorm van chemische boodschappers genaamd neurotransmitters1. De moleculaire processen die betrokken zijn bij neurotransmissie zijn actieve onderzoeksgebieden 3,4,5. Het begrijpen van de pathogene processen binnen synaptische terminals en de reactie van synapsen op pathologie in andere neuronale subcompartimenten zijn cruciale stappen om hersenaandoeningen aan te pakken 1,2. Verschillende methodologische ontwikkelingen, voornamelijk toegepast op muizenmodellen, hebben dit streven bevorderd6. De isolatie van synaptische fracties door differentiële centrifugatie is zo'n paradigma-verschuivende methode die de gedetailleerde evaluatie van synaptische processen in gezondheid en ziekte mogelijk heeft gemaakt.
Het volwassen menselijk brein bestaat uit 80-90 miljard neuronen 7,8. Onder muizensoorten bevat het rattenbrein ongeveer ~ 200 miljoen neuronen, terwijl muizen ~ 70 miljoen 9,10 hebben. Elk neuron vormt duizenden specifieke synaptische verbindingen met een netwerk van sterk gepolariseerde neuronen vermengd met gliacellen en dichte vasculatuur. In zulk complex en heterogeen weefsel was het ooit ondenkbaar om synapsen als een onafhankelijk systeem te isoleren en te bestuderen. In de jaren 1960 maakten Victor Whittaker, Catherine Hebb en anderen dit mogelijk door intacte synaptische terminals te isoleren met behulp van subcellulaire fractionering 11,12,13,14. In een poging om synaptische blaasjes (SV's) te isoleren, homogeniseerden ze de hersenen door middel van vloeibare schuifkracht in iso-osmotische (0,32 M) sucrose gevolgd door ultracentrifugatie. Ze verkregen afgeknepen, plasmamembraan-ingesloten, intacte zenuwterminals of spataderen, die ze zenuwuiteinddeeltjes (NEPs) noemden 11,13. Omdat de structurele en functionele kenmerken van de synaps in deze structuren bewaard bleven, werden NAP's later "synaptosomen" genoemd voor congruentie met andere subcellulaire organellen13,15. Het is vermeldenswaard dat het werk van Eduardo de Robertis en collega's, die de term "synaptisch blaasje" bedachten, overlapte met dat van Whittaker en collega's en bijdroeg aan de validatie van "synaptosoom" isolatie en karakterisering 16,17,18.
Synaptosomen zijn fysiologisch actieve structuren die alle cellulaire en moleculaire eigenschappen bevatten die nodig zijn voor de opslag, afgifte en heropname van neurotransmitters 13,18. Het behoud van belangrijke synaptische kenmerken in vitro en de vrijheid van niet-synaptische componenten dragen ook bij aan het nut van deze isolatiemethode. Synaptosomen hebben enorm bijgedragen aan het begrip van de chemische en fysiologische eigenschappen van neurotransmissie en worden nu gebruikt om synaptische moleculaire processen en hun veranderingen in ziekte te bestuderen 19,20,21,22,23. Synaposomen zijn ook het initiële bronmateriaal voor het isoleren van synaptische componenten zoals SV's, clathrine-gecoate blaasjes (CCV's), synaptisch cytosol, synaptisch plasmamembraan, synaptische mitochondriën, synaptische adhesiemoleculen en andere componenten van belang, die het begrip van de moleculaire mechanismen van synaptische functie kunnen vergemakkelijken 18,19,20,24,25,26, 27,28. Deze sub-synaptische componenten kunnen worden verkregen door de osmotische lysis van synaposomen en sucrosedichtheidsgradiënt ultracentrifugatie15,29. Hoewel bekend is dat de oorspronkelijke subcellulaire fractioneringsmethode van whittaker's onderzoeksgroep efficiënt is in het isoleren van kwaliteitssynadosomen en SV's13,30, verbeteren recente optimalisaties de zuiverheid van de subcellulaire fracties 22,23,31,32. Dit artikel biedt een zeer gedetailleerde en toegankelijke versie van een klassiek protocol voor de subcellulaire fractionering van muizenhersenweefsel om synaptosomen, SV's en andere sub-synaptische componenten te isoleren.
Alle experimenten met muizen werden goedgekeurd door de Institutional Animal Care and Use Committee (IACUC) aan de Yale University (Protocol 2021-11117) en uitgevoerd in een faciliteit die is geaccrediteerd door de Association for the Assessment and Accreditation of Laboratory Animal Care International (AAALAC). Dierenverzorging en huisvesting voldeden aan de Guide for the Care and Use of Laboratory Animals33 en werden verstrekt door het Yale Animal Resource Center (YARC). Dieren werden gehouden in een 12 uur licht/donker cyclus met ad libitum toegang tot voedsel en water. Vijf tot acht muizen of twee tot vier ratten per genotype of aandoening zijn vereist voor het volgende protocol. Er zijn minder ratten nodig vanwege hun grotere hersenvolumes. Evenzo kan de leeftijd van de proefdieren van invloed zijn op de fractieopbrengst; extra muizen kunnen nodig zijn voor leeftijden jonger dan 2 maanden. Anders zijn de geschetste procedures van toepassing op zowel muizensoorten als gezonde volwassen dieren van elke leeftijd. De representatieve gegevens die in deze studie werden gepresenteerd, maakten gebruik van wildtype (C57BL / 6J) muizen (leeftijd = 2 maanden; vier mannetjes en vier vrouwtjes per replicaat) verkregen uit een commerciële bron (zie materiaaltabel).
1. Experimentele voorbereiding
OPMERKING: Dit protocol vereist ~ 11 uur voor een enkele onderzoeker om te voltooien. Het wordt ten zeerste aanbevolen om de benchtop-opstelling (figuur 1), buffervoorbereiding (tabel 1), het voorkoelen van centrifuges en rotors tot 4 °C en het verzamelen en etiketteren van benodigde materialen en apparatuur (zie materiaaltabel) de dag voorafgaand aan de uitvoering van het protocol, indien van toepassing, te voltooien.
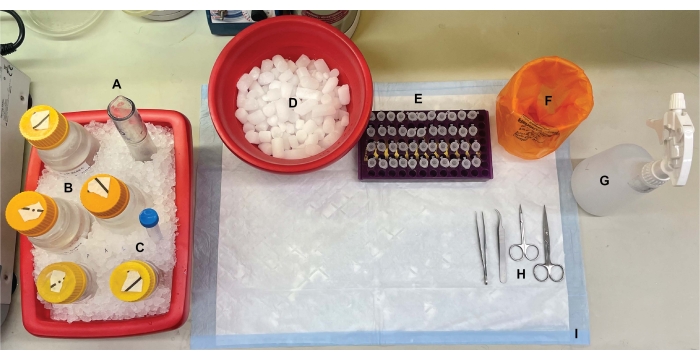
Figuur 1: Benchtop setup. Voorafgaand aan hersendissecties werden (A) Dounce-glashomogenisatoren en (B) alle buffers gekoeld op ijs. (C) Proteaseremmers werden op ijs ontdooid. Een tweede container met nat ijs voor centrifugebuizen, een Dewar van vloeibare stikstof (niet afgebeeld) en (D) een container met droogijs voor kortetermijnopslag van de monsters die in vloeibare stikstof zijn bevroren, werden verkregen. (E) Microcentrifugebuizen werden voor alle monsters vooraf gelabeld, aangezien tijdens deze procedure vier aliquots van elk subcellulair fractiemonster per genotype of toestand werden verzameld (tijdbesparende tip: label alle buizen grondig de dag voordat het experiment wordt uitgevoerd). (F) Een geschikte biohazard afvalcontainer, (G) 70% ethanol, (H) chirurgische hulpmiddelen en (I) een absorberend oppervlak pad. De benodigde centrifugebuizen en disposables werden gereserveerd voor efficiënte toegang tijdens de implementatie van het protocol (niet getoond). Klik hier om een grotere versie van deze figuur te bekijken.
- Bereid de benchtop voor op een operatie en verzamel de schaar en tang die nodig zijn voor hersenexcisie (zie materiaaltabel). Pre-label 1,5 ml microcentrifugebuizen voor muizenstaartbiopten en vier buizen per verzamelde fractie, zoals aangegeven in figuur 2.
- Verkrijg twee containers nat ijs, een container met droogijs en een benchtop vloeibare stikstof Dewar-kolf.
- Ontdooi fenylmethylsulfonylfluoride (PMSF), pepstatine A, aprotinine en leupeptine stockoplossingen op ijs (zie Materiaaltabel). Bereid de nodige buffers voor (tabel 1).
OPMERKING: Sucrose-oplossingen kunnen van tevoren worden bereid en bij 4 °C worden bewaard. Proteaseremmers (ontdooide voorraden en tabletten) moeten echter aan het begin van het experiment vers aan alle buffers worden toegevoegd vanwege de instabiliteit van deze reagentia in waterige oplossingen. Verder moeten alle buffers worden bereid met wasmiddelvrij glaswerk en wasmiddelvrij water om intacte synaptokosomen te kunnen verzamelen. - Koel alle buffers en glazen Dounce homogenisatoren (zie Materiaaltabel) op ijs. Zet de centrifuges op 4 °C en koel de rotoren tot 4 °C.
- Voeg 14 ml buffer A (tabel 1) toe aan een douncehomogenisator op ijs.
Tabel 1: Samenstelling van de subcellulaire fractioneringsbuffers. Klik hier om deze tabel te downloaden.
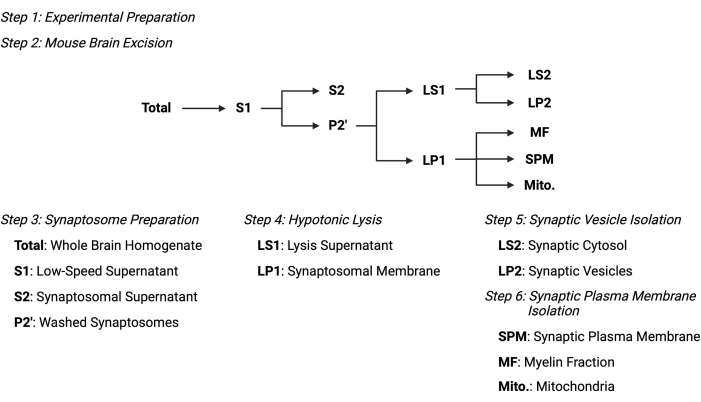
Figuur 2: Overzicht van het subcellulaire fractioneringsprotocol. Samenvatting schema van de subcellulaire fractioneringsstappen en verzamelde monsters. Klik hier om een grotere versie van deze figuur te bekijken.
2. Hersenexcisie van muizen
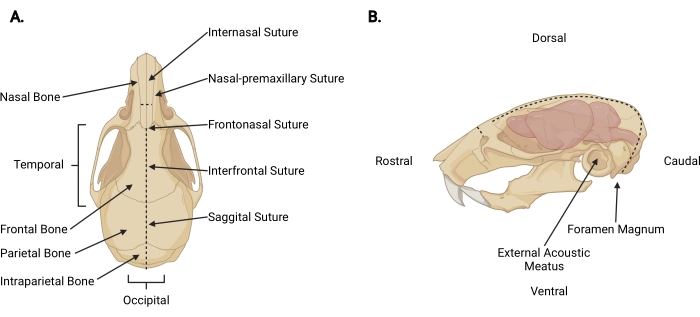
Figuur 3: Craniofaciale anatomie. (A) Dorsale weergave van een muizenschedel met relevante schedelstructuren aangegeven. (B) Linker zijwaartse weergave van een muizenschedel en hersenen met relevante schedelstructuren en anatomische richtingen aangegeven. De stippellijnen vertegenwoordigen de locaties waar incisies moeten worden gemaakt. Klik hier om een grotere versie van deze figuur te bekijken.
- Verdoof elke muis diep met 100% isofluoraan in een anesthesiekamer in een zuurkast of bioveiligheidskast met behulp van een open druppelmethode34. Offer elke muis op door cervicale wervelkolomdislocatie, snel gevolgd door onthoofding. Wissel af tussen genotypen of experimentele groepen voor elk offer en dissectie12. Verkrijg staartbiopten na euthanasie door 2 mm van de distale staartpunt met een fijne schaar uit te stoten. Bewaar het weefsel voor genotypering.
- Spray de onthoofde kop met 70% ethanol om te voorkomen dat het haar zich tijdens de dissectie aan het weefsel en chirurgische instrumenten hecht.
- Breng een fijne schaar onder de huid in bij de onthoofdingsincisie tot een pericraniale diepte en maak een midsagittale incisie tot aan de interne hechting (figuur 3A) om de hoofdhuid van de schedel terug te trekken.
- Werk vanuit het occipitale gebied naar elk temporeel aspect en trim de fascia en spier om het externe oppervlak van de schedel bloot te leggen voorbij elke externe akoestische meatus (figuur 3B).
- Beveilig de hoofdhuid en het rostrale aspect van de schedel met de niet-dominante hand. Plaats met de andere een fijne schaar 2 mm in de caudale kant van het foramen magnum, waar het ruggenmerg zichtbaar is. Maak een middellijnincisie totdat de schaar het interne oppervlak van het intrapariëtale bot bereikt (figuur 3; stippellijnen).
OPMERKING: Tijdens de eerste incisie moet de schaar parallel zijn aan het ruggenmerg met druk op het interne oppervlak van de schedel om schade aan de hersenstam en het cerebellum te voorkomen. - Verander de hoek van de schaar zodat de messen parallel lopen met het dorsale oppervlak van de schedel. Ga door met het rostrale bevorderen van de midsagittale incisie door de pariëtale en frontale botten, met behulp van de sagittale en interfrontale hechtingen als leidraad. Gebruik constante opwaartse druk om schade aan de cortex te voorkomen. Beëindig de incisie net voorbij de interne hechting (figuur 3A).
- Maak een kleine loodrechte incisie (~ 3 mm) op het neusbeen, rostral op de internasale hechting, door de schaar loodrecht op de schedel te plaatsen met elk mes op een nasale-premaxillaire hechting en maak er een gelijkmatige snede (figuur 3; stippellijnen).
OPMERKING: Deze stap verhoogt het gemak van het intrekken van de schedel en is van cruciaal belang voor het verzamelen van de olfactorische bol als dit gebied van belang is. - Gebruik tijdens het beveiligen van het rostrale aspect één kant van een paar getextureerde tangen om de schedel voorzichtig uit de hersenen op te tillen, vervolgens lateraal en ventraal. Herhaal dit langs de middellijn als dat nodig is, dan voor de andere hemisfeer totdat het hele hersenoppervlak is blootgesteld.
- Gebruik een gebogen tang of een fijne spatel om de rostrale kant van de hersenen voorzichtig op te tillen. Snijd de oog- en hersenzenuwen door om de excisie uit de schedel te voltooien.
- Verzamel voor elke aandoening vijf tot acht muizenhersenen samen in de gekoelde glazen Dounce-homogenisator met 14 ml buffer A (tabel 1).
3. Synasptosoompreparaat
OPMERKING: De schema's van deze procedure zijn weergegeven in figuur 4.
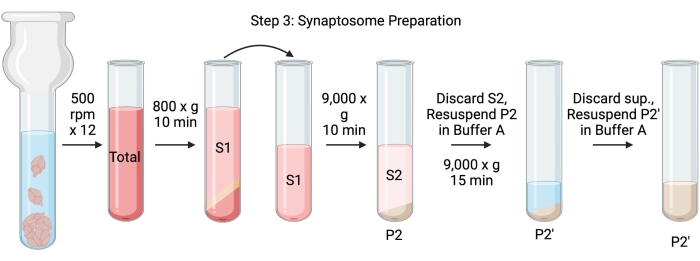
Figuur 4: Synasptosoompreparaat. Schema van stap 3, het genereren van synaptokosomen (P2'). Klik hier om een grotere versie van deze figuur te bekijken.
- Homogeniseer de hersenen met behulp van een glazen Dounce-homogenisator in 12 up-down passes bij 500 tpm (totaal). Pauzeer kort bij elke downstroke om een grondige homogenisatie van het weefsel te garanderen. Homogeniseer bij voorkeur in een ijsbad om opwarming en eiwitdenaturatie te voorkomen. Neem 5 μL aliquots voor de bepaling van de eiwitconcentratie door de bicinchonininezuurtest (BCA, zie materiaaltabel). Neem 100 μL hele hersenen lysaat aliquots voor western blot (WB). Neem voor deze en alle volgende monsters (figuur 2) twee aliquots voor BCA en twee aliquots voor WB. Bevries alle verzamelde aliquots in vloeibare stikstof en bewaar ze bij −80 °C.
- Draai het totale hersenhomogenaat in een snelle ronde bodemcentrifugebuis (14 ml) (zie materiaaltabel) op 800 x g gedurende 10 minuten bij 4 °C om het supernatant (S1) te verkrijgen. Breng S1 over naar een nieuwe centrifugebuis en laat de pellet achter (P1), die intacte cellen en kernen bevat. Vermijd het pipetteren van de donzige, witte, losse, oppervlakkige pellet. Neem 2 x 5 μL S1 voor BCA en 2 x 100 μL S1 voor WB.
- Draai S1 bij 9.000 x g gedurende 15 minuten bij 4 °C om het synaptosomale supernatant (S2) en de ruwe synaptosoompellet (P2) te verkrijgen. Neem 2 x 10 μL S2 voor BCA en 2 x 500 μL S2 voor WB. Gooi het supernatant weg na het verkrijgen van aliquots en ga verder met de volgende stap met de pellet.
- Resuspensie P2 in 3 ml ijskoude buffer A met proteaseremmers en centrifugeer bij 9.000 x g gedurende 15 minuten bij 4 °C om het supernatant (S2') en gewassen synaptosomen (P2') te verkrijgen. Gooi het supernatant weg en bewaar de pellet.
- Resuspendeer P2' in 3 ml buffer A. Vermijd resuspendatie van het donkerrode gedeelte op de bodem van de pellet, dat voornamelijk mitochondriën bevat. Neem 2 x 20 μL P2' voor BCA en 2 x 100 μL P2' voor WB.
OPMERKING: Dit kan worden bereikt door de randen en het oppervlak van de pellet voorzichtig te pipet-mengen om de witgekalkte synaftosomen te resuspenderen terwijl de pipetpunt wegleidt van het rode midden van de pellet.
4. Hypotone lysis
OPMERKING: De schema's van deze procedure zijn weergegeven in figuur 5.
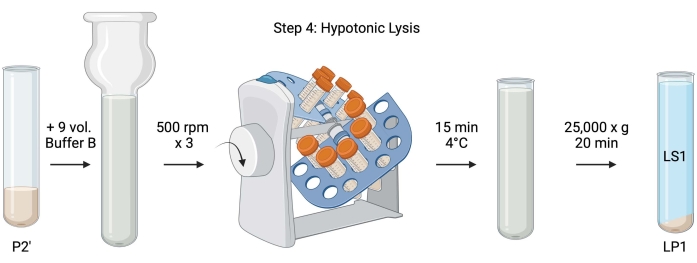
Figuur 5: Hypotone lysis. Schematische van stap 4, de hypotone lysis van synaptosomen om het lysis-supernatant (LS1) en synaptosomale membraanfracties (LP1) te genereren. Klik hier om een grotere versie van deze figuur te bekijken.
- Voeg voor de hypotone lysis van gewassen synaposomen 9 volumes gekoelde buffer B (tabel 1) toe aan geresuspendeerde P2' (~27 ml). Homogeniseer de synaptokosomen in een glazen Dounce-homogenisator (drie up-down passages bij 500 tpm).
- Breng de monsters over in conische centrifugebuizen met 50 ml. Draai ze op een buis revolver in een 4 °C koude ruimte gedurende 15 min.
- Centrifugeer P2' bij 25.000 x g gedurende 20 minuten bij 4 °C om het lysissupernatant (LS1) en de lysispellet met synaptosomale membranen (LP1) te verkrijgen. Neem 2 x 50 μL LS1 voor BCA en 2 x 400 μL LS1 voor WB. Breng LS1 over in een afgedekte centrifugebuis voor ultracentrifugatie (zie Materiaaltabel).
5. Synaptische vesikel isolatie
OPMERKING: De schema's van deze procedure zijn weergegeven in figuur 6.
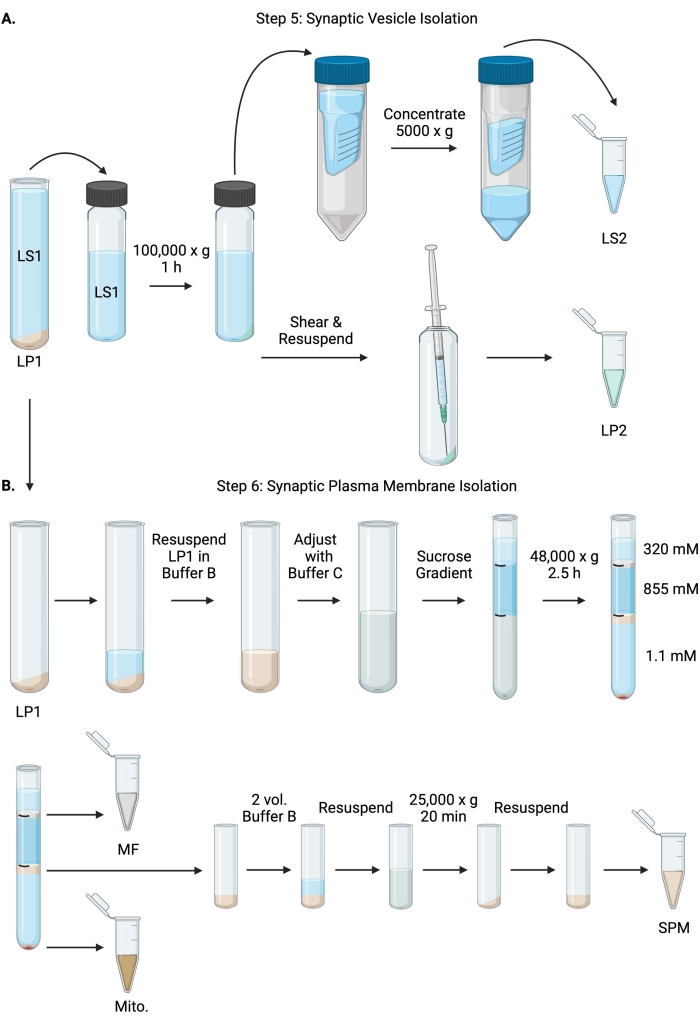
Figuur 6: Synaptische vesikelisolatie en synaptische plasmamembraanisolatie. (A) Schematische van stap 5, de isolatie van synaptische cytosol (LS2) en synaptische blaasjes (LP2) fracties, en (B) stap 6, de generatie van myeline (MF), synaptisch plasmamembraan (SPM) en mitochondriale (Mito.) fracties na de ultracentrifugatie van sucrosegradiënten. Klik hier om een grotere versie van deze figuur te bekijken.
- Centrifugeer LS1 in een ultracentrifugerotor met vaste hoek (zie materiaaltabel) bij 100.000 x g gedurende 60 minuten bij 4 °C om synaptisch cytosolsupernatant (LS2) en synaptische blaasjespellet (LP2) te verkrijgen. LP2 is klein, doorschijnend en sterk gehecht aan de zijkant van de centrifugebuis.
- Resuspend LP2 in 500 μL buffer A. Met behulp van een naald van 23 G en een spuit van 1 ml schuift u LP2 af met zachte trituratie. Neem 2 x 10 μL LP2 voor BCA en 2 x 250 μL LP2 voor WB.
- Breng LS2 (~30 ml) over op centrifugale filtereenheden met een afsnijding van 10 kDa (zie materiaaltabel).
OPMERKING: Als eiwitten kleiner dan 10 kDa van belang zijn, zijn 4 kDa cutoff centrifugaalfiltereenheden beschikbaar, maar dit zal resulteren in langere spintijden. - Concentraat LS2 tot ongeveer 0,5 ml door te draaien bij 5000 x g gedurende maximaal 1 uur bij 4 °C. Neem 2 x 10 μL geconcentreerd ls2 voor BCA en 2 x 250 μl geconcentreerd ls2 voor wb. Nadat u de spin hebt gestart, gaat u direct verder met stap 6.1.
6. Synaptische plasmamembraanisolatie
- Resuspendeer LP1 (stap 4.3) in 1 ml buffer B (tabel 1). Neem 2 x 10 μL LP1 voor BCA en 2 x 50 μL LP1 voor WB. Stel de resterende LP1 in op een eindvolume van 7,5 ml en een uiteindelijke sucroseconcentratie van 1,1 M met buffer B en buffer C (tabel 1).
- Breng 7,5 ml geresuspendeerde LP1 over in een ultracentrifugebuis van 14 ml (zie materiaaltabel). Leg LP1 voorzichtig overlay met 3,75 ml buffer D (tabel 1) en leg vervolgens over met 1,25 ml buffer A (of een groter volume om net onder de bovenkant van de centrifugebuis te vullen). Vermijd pipetteren langs de zijkant van de buis, die de sucrose gradiënt interfaces zal verstoren. Nadat u elke sucrosefractie hebt bedekt, markeert u de bovenkant van de oplossing met een pen. Balanceer de buizen voor ultracentrifugatie op gewicht, niet volume, met de druppelsgewijze toevoeging van buffer A tot binnen 10 mg. Centrifugeer bij 48.000 x g gedurende 2,5 uur bij 4 °C in een ultracentrifugerotor met zwenkbare emmer (zie Materiaaltabel).
- Verkrijg afbeeldingen van de intacte gradiënten na ultracentrifugatie om de onderscheidendheid van elke sucrose-interface en het succes van fractionering te documenteren.
- Verwijder voorzichtig de oppervlakkige laag van 320 mM sucrose (Buffer A). Herstel de myelinefractie (MF) op de sucrose-interface van 320 mM/855 mM in een volume van 800 μL. Herstel de synaptische plasmamembraanfractie (SPM) op de sucrose-interface van 855 mM/1,1 M in een volume van 1.000 μL. Pipetteer elke fractie op een cirkelvormige manier uit de wand van de buis om ervoor te zorgen dat de volledige fractie wordt verzameld. Zuig de resterende sucrose voorzichtig af en win de mitochondriale pellet (Mito.) terug door 200 μL buffer B te resuspenderen. Neem 2 x 100 μL MF voor BCA en 2 x 10 μL Mito. voor BCA; verdeel de rest van MF en Mito. monsters in tweeën voor WB.
- Verdun de SPM-fractie met 2 volumes buffer B (~ 2 ml) en centrifugeer vervolgens in een rotor met vaste hoek in een centrifugebuis van 3,5 ml (zie materiaaltabel) bij 25.000 x g gedurende 20 minuten bij 4 °C. Gooi het supernatant weg en resuspendeer de SPM-pellet in buffer A voor een eindvolume van 250 μL. Neem 2 x 5 μL SPM voor BCA en verdeel de resterende SPM in tweeën voor WB.
- Voer een BCA uit om de eiwitconcentratie van elk monster te bepalen, rekening houdend met variabel aliquotvolume.
OPMERKING: Voor WB-analyse is de voorgestelde werkeiwitconcentratie voor alle subcellulaire fracties 2 μg / μL (of zo hoog als haalbaar voor LS1 en MF).
De gepresenteerde methode resulteert in 11 subcellulaire fracties van de hersenen die kunnen worden onderworpen aan verdere zuivering en verschillende vormen van downstream-analyse35,36. De gouden standaardmethode om de kwaliteit van synaptokosomen, SV's23 en andere componenten te beoordelen, is elektronenmicroscopie (EM) (figuur 7). Kwantitatieve immunoblotting voor eiwitten die aanwezig zijn in specifieke subcellulaire fracties kan ook worden uitgevoerd om markers van fractiezuiverheid te beoordelen (figuur 8). Immunoblotanalyse van fracties onthult bijvoorbeeld de verrijking van N-cadherine (CDH2, UniProt-naam) in de synaptische plasmamembraanfractie (SPM), α-synucleïne (SYUA) in het synaptische cytosol (LS2), synaptophysine (SYPH) in de synaptische blaasjesfractie (LP2) en myelinebasiseiwit (MBP) in de myelinefractie (MF) in vergelijking met eiwitniveaus in het initiële homogenaat van de hele hersenen (totaal) (figuur 8) ). Zodra de fractiezuiverheid is vastgesteld (let bijvoorbeeld op de afwezigheid van CDH2 in de LS2-fractie of de veelvoudige toename van SYPH in de LP2-fractie), kan kwantitatieve immunoblotting worden gebruikt om de lokalisatie van interessante eiwitten te bepalen of verschillen in eiwitverdeling tussen genotypen of behandelingen te onderzoeken. Inzicht in de subcellulaire lokalisatie van synaptische eiwitten kan de dissectie van voorheen onbeschreven eiwitfuncties mogelijk maken. Verder kan deze methode traffickingdefecten of synaptische disfunctie in ziektetoestanden ophelderen, vooral in combinatie met functionele assays. Ons team heeft deze methode bijvoorbeeld gebruikt om een pool van enzymatisch actief palmitoyleiwit thioesterase 1 te identificeren dat is verrijkt in het synaptische cytosol19.
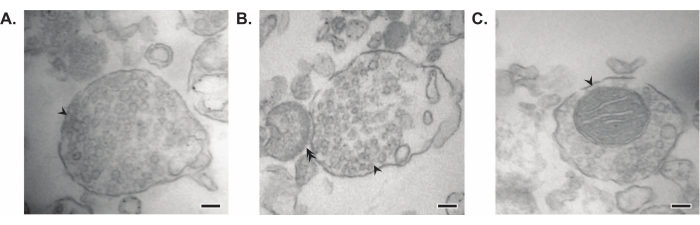
Figuur 7: Elektronenmicroscopie (EM) van synaptosomen. (A) Representatieve EM-afbeelding van een synaptosoom dat synaptische blaasjes bevat (pijl). (B) Representatief EM-beeld van een synaptosoom met zowel pre- (pijl) als post-synaptische componenten (dubbele pijl). (C) Representatief EM-beeld van een synaptosoom dat synaptische blaasjes bevat en een mitochondrion (pijl) (schaalstaven = 100 nm). Klik hier om een grotere versie van deze figuur te bekijken.
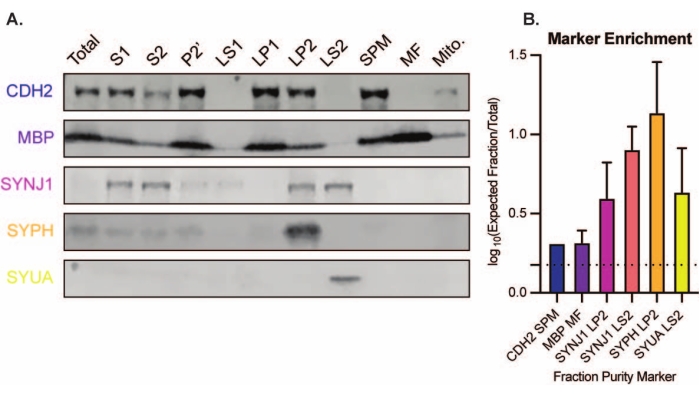
Figuur 8: Immunoblotanalyse van subcellulaire fracties. (A) Markers van subcellulaire fractiezuiverheid (aangegeven met UniProt-nomenclatuur) zijn passend gelokaliseerd in vergelijking met het gehele hersenhomogenaat (totaal): N-cadherine (CDH2) in de synaptische plasmamembraanfractie (SPM), synaptophysine 1 (SYPH) en synaptojanine 1 (SYNJ1) in de synaptische blaasjesverrijkte fractie (LP2), α-synucleïne (SYUA) in het synaptische cytosol (LS2), en myeline basiseiwit (MBP) in de myelinefractie (MF). (B) Immunoblot-kwantificeringsanalyse onthult de verrijking (vouwverandering ten opzichte van totaal) van fractiezuiverheidsmarkers. Gegevens worden weergegeven als gemiddelde ± standaarddeviatie op een log10-schaal. De stippellijn geeft een 1,5-voudige verandering aan (y = 0,176) (n = 3 replicatie-experimenten met 8 wildtype muizen; leeftijd = 2 maanden; n = 4-5 vlekken voor SYPH, SYUA, MBP, met n = 3 uitgezette waarden eerder gepubliceerd door Gorenberg et al.19; n = 5 voor SYNJ1; n = 1 voor CDH2). Klik hier om een grotere versie van deze figuur te bekijken.
In hun baanbrekende studies gebruikten Whittaker en collega's vier morfologische criteria om synaptokosomen te identificeren: (1) de structuren hebben een verzegeld plasmamembraan; (2) de structuren bevatten SV's die qua grootte en aantal lijken op die in zenuwklemmen en spataderen in situ; (3) de structuren bezitten een of meer kleine mitochondriën; en (4) het presynaptische membraan wordt vaak gehecht aan een post-synaptische component 11,12,13. Hoewel de eerste twee criteria over het algemeen van toepassing zijn op elke isolatiemethode, zullen in de meest recente protocollen die in dit artikel worden beschreven, niet alle resulterende synaptosomen mitochondriën en bevestigde post-synaptische terminals hebben. Ongeveer 60% van de synaptosomen zal mitochondriën hebben en slechts tot 15% heeft naar schatting post-synaptische terminals bevestigd37. Als post-synaptische componenten van bijzonder belang zijn, is bekend dat het gebruik van een isotone Krebs-achtige homogenisatiebuffer en drukfiltratie voor verrijking hoge concentraties synaptosomen met post-synaptische terminals (ook wel synaptoneurosomen genoemd)22,38 oplevert.
De methode om het dier op te offeren kan de kwaliteit van synaposomen en synaptische subfractions beïnvloeden. Volwassen dieren die worden geofferd met behulp van een euthanasiemethode die geen anesthesie vereist, zullen resulteren in de beste fractiekwaliteit. Verder moeten de hersenen vers worden ontleed, niet bevroren en gehomogeniseerd met behulp van een 1:10 verhouding van homogenisatiebuffer (gewicht / volume) voor de meest levensvatbare synaptische fracties22. De hersenen hebben een heterogene populatie van synapsen die kunnen worden onderscheiden door het type neurotransmitters dat ze dragen. Synaptosoomvorming wordt over het algemeen niet beïnvloed door synapstype of neurotransmittergehalte13. Een uitzondering zijn bemoste vezels in het cerebellum, waarvan bekend is dat ze in optimale omstandigheden worden verstoord voor het verkrijgen van synaptosomen uit de rest van de hersenen39,40. Verwijdering van het cerebellum voorafgaand aan hersenhomogenisatie wordt dus aanbevolen als de uitsluiting van dit gebied het experimentele doel niet beïnvloedt. Als u geïnteresseerd bent in het isoleren van synaptosomen van een bepaald neurotransmitterkarakter, kunnen gebieden van de hersenen die zijn verrijkt voor neuronen die de neurotransmitter van belang bevatten, eerst worden geïsoleerd. Deze aanpak zal echter beperkingen opleggen aan de uiteindelijke fractieopbrengst, afhankelijk van de grootte van het gebied van belang (de leeftijd van dieren is daarom ook een overweging). Er zijn immunochemische methoden voor de isolatie van neurotransmitterspecifieke synaptosomen, maar de levensvatbaarheid en opbrengst zullen aanzienlijk in gevaar komen22. Als het beoordelen van de metabole levensvatbaarheid van synaptosomen belangrijk is, kan de meting van neurotransmitterafgifte 41,42 of bepaalde enzymatische assays43 worden gebruikt.
Veel voorkomende verontreinigingen in synasptosoompreparaten zijn microsomen, vrije mitochondriën, SV's en neuronale en gliamembranen. Verontreiniging kan worden verminderd door het aantal wasbeurten bij de P1- en P2-fracties22 te verhogen en resuspensie van de rode mitochondriale pellet in volgende stappen te voorkomen. In experimenten waar metabole levensvatbaarheid en tijd cruciaal zijn, zal het verminderen van het aantal wasbeurten en het gebruik van Ficoll- of Percoll-gradiënten over sucrosegradiënten nuttig zijn 44,45,46. Deze methoden verminderen ook de vervuiling aanzienlijk. Het oorspronkelijke protocol van Whittaker leverde hoogwaardige SV's op. Verdere optimalisatie door Nagy et al.23, opgenomen in deze methode, produceert SV's met opmerkelijke homogeniteit en zuiverheid zonder significant in te leveren op opbrengst36. Als specifieke SV-subtypen van belang zijn, zoals glutamaterge (VGLUT-1-bevattende) of GABAerge (VGAT-1-bevattende) SV's, kan immuno-isolatatie met behulp van specifieke antilichamen worden uitgevoerd47,48. Er zijn ook alternatieve methoden beschikbaar voor het isoleren van CCV's van synaptokosomen, die vanwege de differentiële dichtheid mogelijk niet op hetzelfde grensvlak aanwezig zijn als SV's die met deze methode worden verkregen 20,49,50.
Over het algemeen kan het huidige protocol om synaptische componenten te isoleren verder worden geoptimaliseerd om fracties te verkrijgen met verbeterde homogeniteit en levensvatbaarheid op basis van de kwaliteit en kwantiteit van het bronhersenweefsel en de experimentele doelen. Voor verdere details over het oplossen van problemen, moet men verwijzen naar boekhoofdstukken van Dunkley en Robinson22 en Ganzella et al.36.
De auteurs hebben niets te onthullen.
We willen P. Colosi bedanken voor em-beeldvoorbereiding. Dit werk werd ondersteund door de National Institutes of Health (R01 NS064963, SSC; R01 NS110354, SSC; R01 NS083846, SSC; R21 NS094971, SSC; T32 NS007224, SMT; T32 NS041228, SMT), het Amerikaanse ministerie van Defensie (W81XWH-17-1-0564, SSC; W81XWH-19-1-0264, VDJ), Aligning Science Across Parkinson's (ASAP) Collaborative Research Network (SSC) en het Michael J. Fox Foundation Target Advancement Program (MJFF-020160, SSC &VDJ). We hebben grafische illustraties gemaakt met behulp van BioRender.com.
| Name | Company | Catalog Number | Comments |
| 1 mL TB Syringe | BD | 309649 | |
| 1.5 mL Eppendorf Tubes | USA Scientific | 1415-2500 | |
| 14 mL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter | 344060 | Compatible with SW 40 Ti |
| 23 Gauge Precision Glide Hypodermic Needle | BD | 305145 | |
| 26.3 mL, Polycarbonate Bottle with Cap Assembly | Beckman Coulter | 355618 | Compatible with Ti70 |
| 3.5 mL, Open-Top Thickwall Polypropylene Tube | Beckman Coulter | 349623 | Compatible with TLA-100.3 |
| 50 mL Falcon Tubes | Fisher Scientific | 14-432-22 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901024 | |
| Aprotinin | Sigma-Aldrich | A6279 | 1 mg/mL in diH2O |
| Avanti J-26 XP Centrifuge | Beckman Coulter | B22984 | <26,000 rpm |
| Benchtop HDPE Dewar Flask | Thermo Scientific | 5028U19 | |
| C57BL/6J Mice | The Jackson Labs | 000664 | |
| Centrifuge 5810R | Eppendorf | EP022628168 | <14,000 rpm |
| complete, Mini, EDTA-free Protease Inhibitor Cocktail Tablets | Roche | 11873580001 | Add 1 tablet per 50 mL of solution |
| Curved Forceps | Fine Science Tools | 11273-20 | |
| Fine Surgical Scissors | Fine Science Tools | 8r | |
| Glas-Col Tissue Homogenizing System | Cole-Parmer | UX-04369-15 | |
| Graefe Forceps | Fine Science Tools | 11650-10 | |
| High-Speed Polycarbonate Round Bottom Centrifuge Tubes | ThermoFisher | 3117-0500 | Compatible with JA20 |
| Isofluorane | Henry Schein Animal Health | NDC 11695-6776-2 | |
| JA-20 Rotor | Beckman Coulter | 334831 | |
| Leupeptin | American Bio | AB01108 | 1 mg/mL in diH2O |
| N-[2-Hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid] (HEPES) | American Bio | AB00892 | |
| Optima L-80 XP Ultracentrifuge | Beckman Coulter | <100,000 rpm | |
| Optima TLX Ultracentrifuge | Beckman Coulter | <120,000 rpm | |
| Pepstatin A | Thermo Scientific | 78436 | 1 mg/mL in DMSO |
| Phenylmethylsulfonyl fluoride (PMSF) | American Bio | AB01620 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23335 | For determination of protein concentration |
| Pipette Tips | |||
| Serological Pipettes | |||
| Sucrose | Sigma-Aldrich | S0389 | |
| Surgical Scissors | Fine Science Tools | 14002-12 | |
| SW 40 Ti Swinging-Bucket Rotor | Beckman Coulter | 331301 | |
| Teflon-Coated Pestle and Mortar Tissue Grinder | Thomas Scientific | 3431D94 | |
| Ti70 Rotor | Beckman Coulter | 337922 | |
| TLA-100.3 Rotor | Beckman Coulter | 349490 | |
| Tube Revolver | Dot Scientific | DTR-02VS |
- Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J., Education, A. J. Synaptic Transmission. Principles of Neural Science, Fifth Edition. , (2014).
- Lepeta, K., et al. Synaptopathies: synaptic dysfunction in neurological disorders - A review from students to students. Journal of Neurochemistry. 138 (6), 785-805 (2016).
- Südhof, T. C., Malenka, R. C. Understanding synapses: Past, present, and future. Neuron. 60 (3), 469-476 (2008).
- Südhof, T. C. The molecular machinery of neurotransmitter release (Nobel lecture). Angewandte Chemie International Edition. 53 (47), 12696-12717 (2014).
- Jahn, R., Boyken, J., Pfaff, D. W. Molecular Regulation of Synaptic Release. Neuroscience in the 21st Century: From Basic to Clinical. , 351-401 (2013).
- Xiong, H., Gendelman, H. E. . Current Laboratory Methods in Neuroscience Research. , (2014).
- Azevedo, F. A., et al. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology. 513 (5), 532-541 (2009).
- Herculano-Houzel, S. The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost. Proceedings of the National Academy of Sciences of the United States of America. 109, 10661-10668 (2012).
- Herculano-Houzel, S., Lent, R. Isotropic fractionator: A simple, rapid method for the quantification of total cell and neuron numbers in the brain. Journal of Neuroscience. 25 (10), 2518-2521 (2005).
- Herculano-Houzel, S., Mota, B., Lent, R. Cellular scaling rules for rodent brains. Proceedings of the National Academy of Sciences of the United States of America. 103 (32), 12138-12143 (2006).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron-microscopic study of cell fragments derived by homogenization and centrifugation. Journal of Anatomy. 96, 79-88 (1962).
- Gray, E. G., Whittaker, V. P. The isolation of synaptic vesicles from the central nervous system. Journal of Physiology. 153, 35-37 (1960).
- Whittaker, V. P. Thirty years of synaptosome research. Journal of Neurocytology. 22 (9), 735-742 (1993).
- Jahn, R., Fasshauer, D. Molecular machines governing exocytosis of synaptic vesicles. Nature. 490, 201-207 (2012).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from nerve-ending particles ('synaptosomes). Biochemical Journal. 90 (2), 293-303 (1964).
- De Robertis, E., Rodriguez De Lores Arnaiz, G., Pellegrino De Iraldi, A. Isolation of synaptic vesicles from nerve endings of the rat brain. Nature. 194, 794-795 (1962).
- De Robertis, E., Pellegrino De Iraldi, A., Rodriguez, G., Gomez, C. J. On the isolation of nerve endings and synaptic vesicles. The Journal of Biophysical and Biochemical Cytology. 9 (1), 229-235 (1961).
- Zimmermann, H., Whittaker, V. P., Murphy, K. M. The Discovery of the Synaptosome and Its Implications. Synaptosomes. , 9-26 (2018).
- Gorenberg, E. L., et al. Identification of substrates of palmitoyl protein thioesterase 1 highlights roles of depalmitoylation in disulfide bond formation and synaptic function. PLoS Biology. 20 (3), 3001590 (2022).
- Vidyadhara, D. J., et al. Dopamine transporter and synaptic vesicle sorting defects initiate auxilin-linked Parkinson's disease. bioRxiv. , (2022).
- Schrimpf, S. P., et al. Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry. Proteomics. 5 (10), 2531-2541 (2005).
- Dunkley, P. R., Robinson, P. J., Murphy, K. M. Synaptosome Preparations: Which Procedure Should I Use. Synaptosomes. , 27-53 (2018).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Research. 109 (2), 285-309 (1976).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127 (4), 831-846 (2006).
- Wagner, J. A., Kelly, R. B. Topological organization of proteins in an intracellular secretory organelle: the synaptic vesicle. Proceedings of the National Academy of Sciences of the United States of America. 76 (8), 4126-4130 (1979).
- Jahn, R., Schiebler, W., Ouimet, C., Greengard, P. A 38,000-dalton membrane protein (p38) present in synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 82 (12), 4137-4141 (1985).
- Binotti, B., Jahn, R., Pérez-Lara, &. #. 1. 9. 3. ;. An overview of the synaptic vesicle lipid composition. Archives of Biochemistry and Biophysics. 709, 108966 (2021).
- Siegel, D. P., Ware, B. R. Electrokinetic properties of synaptic vesicles and synaptosomal membranes. Biophysical Journal. 30 (1), 159-172 (1980).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from disrupted nervending particles. Biochemical Pharmacology. 12 (3), 300-302 (1963).
- Clementi, F., Whittaker, V. P., Sheridan, M. N. The yield of synaptosomes from the cerebral cortex of guinea pigs estimated by a polystyrene bead "tagging" procedure. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 72, 126-138 (1966).
- Carlson, S. S., Wagner, J. A., Kelly, R. B. Purification of synaptic vesicles from elasmobranch electric organ and the use of biophysical criteria to demonstrate purity. Biochemistry. 17 (7), 1188-1199 (1978).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. Journal of Cell Biology. 96 (5), 1374-1388 (1983).
- Hawkins, P., et al. A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Laboratory Animals. 45 (1), 1-13 (2011).
- Risling, T. E., Caulkett, N. A., Florence, D. Open-drop anesthesia for small laboratory animals. Canadian Veterinary Journal. 53 (3), 299-302 (2012).
- Deutsch, C., Drown, C., Rafalowska, U., Silver, I. A. Synaptosomes from rat brain: Morphology, compartmentation, and transmembrane pH and electrical gradients. Journal of Neurochemistry. 36 (6), 2063-2072 (1981).
- Ganzella, M., Ninov, M., Riedel, D., Jahn, R. Isolation of synaptic vesicles from mammalian brain. Methods in Molecular Biology. 2417, 131-145 (2022).
- Dunkley, P. R., et al. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: homogeneity and morphology of subcellular fractions. Brain Research. 441 (1-2), 59-71 (1988).
- Schwartz, R. D., Skolnick, P., Hollingsworth, E. B., Paul, S. M. Barbiturate and picrotoxin-sensitive chloride efflux in rat cerebral cortical synaptoneurosomes. FEBS Letters. 175 (1), 193-196 (1984).
- Pittaluga, A., Thellung, S., Maura, G., Raiteri, M. Characterization of two central AMPA-preferring receptors having distinct location, function and pharmacology. Naunyn-Schmiedeberg's Archives of Pharmacology. 349 (6), 555-558 (1994).
- Israël, M., Whittaker, V. P. The isolation of mossy fibre endings from the granular layer of the cerebellar cortex. Experientia. 21 (6), 325-326 (1965).
- Khvotchev, M., Lonart, G., Südhof, T. C. Role of calcium in neurotransmitter release evoked by alpha-latrotoxin or hypertonic sucrose. Neuroscience. 101 (3), 793-802 (2000).
- Lonart, G., Janz, R., Johnson, K. M., Südhof, T. C. Mechanism of action of rab3A in mossy fiber LTP. Neuron. 21 (5), 1141-1150 (1998).
- Nicholls, D. G., Sihra, T. S. Synaptosomes possess an exocytotic pool of glutamate. Nature. 321 (6072), 772-773 (1986).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nature Protocols. 3 (11), 1718-1728 (2008).
- Cotman, C. W., Matthews, D. A. Synaptic plasma membranes from rat brain synaptosomes: Isolation and partial characterization. Biochimica et Biophysica Acta. 249 (2), 380-394 (1971).
- Booth, R. F., Clark, J. B. A rapid method for the preparation of relatively pure metabolically competent synaptosomes from rat brain. Biochemical Journal. 176 (2), 365-370 (1978).
- Takamori, S., Riedel, D., Jahn, R. Immunoisolation of GABA-specific synaptic vesicles defines a functionally distinct subset of synaptic vesicles. Journal of Neuroscience. 20 (3), 4904-4911 (2000).
- Burger, P. M., et al. Synaptic vesicles immunoisolated from rat cerebral cortex contain high levels of glutamate. Neuron. 3 (6), 715-720 (1989).
- Blondeau, F., et al. Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling. Proceedings of the National Academy of Sciences of the United States of America. 101 (11), 3833-3838 (2004).
- Maycox, P. R., Link, E., Reetz, A., Morris, S. A., Jahn, R. Clathrin-coated vesicles in nervous tissue are involved primarily in synaptic vesicle recycling. Journal of Cell Biology. 118 (6), 1379-1388 (1992).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved