Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
मुराइन मस्तिष्क से सिनैप्टिक घटकों के अलगाव के लिए उपकोशिकीय विभाजन
यह प्रोटोकॉल माउस मस्तिष्क से अत्यधिक शुद्ध सिनैप्टोसोम, सिनैप्टिक पुटिकाओं और अन्य सिनैप्टिक अंशों को प्राप्त करने के लिए एक मजबूत, विस्तृत विधि प्रस्तुत करता है। यह विधि सिनैप्टिक प्रक्रियाओं के मूल्यांकन को सक्षम बनाती है, जिसमें प्रोटीन स्थानीयकरण के जैव रासायनिक विश्लेषण और कंपार्टमेंटल रिज़ॉल्यूशन के साथ कार्य शामिल है।
सिनैप्टिक टर्मिनल न्यूरोनल संचार की प्राथमिक साइटें हैं। सिनैप्टिक डिसफंक्शन कई न्यूरोसाइकियाट्रिक और न्यूरोलॉजिकल विकारों की एक पहचान है। जैव रासायनिक अलगाव द्वारा सिनैप्टिक उप-डिब्बों का लक्षण वर्णन, इसलिए, स्वास्थ्य और रोग दोनों में सिनैप्टिक प्रक्रियाओं के आणविक आधारों को स्पष्ट करने के लिए एक शक्तिशाली तरीका है। यह प्रोटोकॉल उपकोशिकीय विभाजन द्वारा माउस दिमाग से सिनैप्टिक टर्मिनलों और सिनैप्टिक उप-डिब्बों के अलगाव का वर्णन करता है। सबसे पहले, सील सिनैप्टिक टर्मिनल संरचनाएं, जिन्हें सिनैप्टोसोम के रूप में जाना जाता है, मस्तिष्क के ऊतक होमोजेनाइजेशन के बाद अलग होते हैं। सिनैप्टोसोम न्यूरोनल प्री-और पोस्ट-सिनैप्टिक डिब्बे होते हैं जिनमें पिन-ऑफ और सील झिल्ली होती है। ये संरचनाएं चयापचय रूप से सक्रिय स्थिति बनाए रखती हैं और सिनैप्टिक संरचना और कार्य का अध्ययन करने के लिए मूल्यवान हैं। सिनैप्टोसोम को तब सिनैप्टिक पुटिकाओं, सिनैप्टिक साइटोसोल और सिनैप्टिक प्लाज्मा झिल्ली के लिए समृद्ध सिनैप्टिक उप-डिब्बों को प्राप्त करने के लिए हाइपोटोनिक लाइसिस और अल्ट्रासेंट्रीफ्यूजेशन के अधीन किया जाता है। उप-सिनैप्टिक डिब्बों के लिए विशिष्ट प्रोटीन के लिए इलेक्ट्रॉन माइक्रोस्कोपी और जैव रासायनिक संवर्धन विश्लेषण द्वारा अंश शुद्धता की पुष्टि की जाती है। प्रस्तुत विधि सिनैप्स की संरचनात्मक और कार्यात्मक विशेषताओं और विभिन्न मस्तिष्क विकारों के आणविक एटियलजि का अध्ययन करने के लिए एक सीधा और मूल्यवान उपकरण है।
सिनैप्स मस्तिष्क की बुनियादी कम्प्यूटेशनल इकाइयाँ हैं जिनके माध्यम से न्यूरॉन्स संचार करते हैं और विविध और उत्तम रूप से जटिल कार्य करते हैं। इस प्रकार, सिनैप्स मस्तिष्क के स्वास्थ्य के लिए मौलिक हैं1; सिनैप्टिक डिसफंक्शन को कई विकारों के स्रोत या परिणाम के रूप में फंसायाजाता है। सिनैप्स का गठन पूर्व और पोस्ट-सिनैप्टिक टर्मिनलों द्वारा किया जाता है, जो दो अलग-अलग न्यूरॉन्स के विस्तार होते हैं जो सिनैप्टिक आसंजन अणुओं द्वारा पार किए गए सिनैप्टिक फांक द्वारा बारीकी से जुड़े और अलग होते हैं। सूचना न्यूरोट्रांसमीटर1 नामक रासायनिक संदेशवाहकों के रूप में पूर्व से पोस्ट-सिनैप्टिक डिब्बे तक बहती है। न्यूरोट्रांसमिशन में शामिल आणविक प्रक्रियाएं अनुसंधान के सक्रिय क्षेत्र हैं 3,4,5. सिनैप्टिक टर्मिनलों के भीतर रोगजनक प्रक्रियाओं को समझना और अन्य न्यूरोनल उप-डिब्बों में पैथोलॉजी के लिए सिनैप्स की प्रतिक्रिया मस्तिष्क के विकारों को संबोधित करने के लिए महत्वपूर्ण कदम हैं। कई पद्धतिगत प्रगति, मुख्य रूप से मुराइन मॉडल पर लागू, ने इस खोजको उन्नत किया है। अंतर सेंट्रीफ्यूजेशन द्वारा सिनैप्टिक अंशों का अलगाव एक ऐसी प्रतिमान-स्थानांतरण विधि है जिसने स्वास्थ्य और बीमारी में सिनैप्टिक प्रक्रियाओं के विस्तृत मूल्यांकन को सक्षम किया है।
वयस्क मानव मस्तिष्क में 80-90 बिलियन न्यूरॉन्स 7,8 होते हैं। मुराइन प्रजातियों में, चूहे के मस्तिष्क में लगभग ~ 200 मिलियन न्यूरॉन्स होते हैं, जबकि चूहों में ~ 70 मिलियन 9,10 होते हैं। प्रत्येक न्यूरॉन ग्लियल कोशिकाओं और घने वाहिका के साथ जुड़े अत्यधिक ध्रुवीकृत न्यूरॉन्स के नेटवर्क के साथ हजारों विशिष्ट सिनैप्टिक कनेक्शन बनाता है। इस तरह के जटिल और विषम ऊतक में, एक स्वतंत्र प्रणाली के रूप में सिनैप्स को अलग करना और अध्ययन करना एक बार अकल्पनीय था। 1960 के दशक में, विक्टर व्हिटकर, कैथरीन हेब और अन्य ने उपकोशिकीय विभाजन 11,12,13,14 का उपयोग करके बरकरार सिनैप्टिक टर्मिनलों को अलग करके इसे संभव बनाया। सिनैप्टिक पुटिकाओं (एसवी) को अलग करने के प्रयास में, उन्होंने आइसो-आसमाटिक (0.32 एम) सुक्रोज में तरल कतरनी बल के माध्यम से मस्तिष्क को समरूप किया, जिसके बाद अल्ट्रासेंट्रीफ्यूजेशन हुआ। उन्होंने पिन-ऑफ, प्लाज्मा झिल्ली-संलग्न, बरकरार तंत्रिका टर्मिनल या वैरिकोसिटी प्राप्त की, जिसे उन्होंने तंत्रिका-अंत कण (एनईपी) 11,13 कहा। चूंकि इन संरचनाओं में सिनैप्स की संरचनात्मक और कार्यात्मक विशेषताओं को संरक्षित किया गया था, एनईपी को बाद में अन्य उपकोशिकीय जीवोंके अनुरूपता के लिए "सिनैप्टोसोम" कहा गया था। यह ध्यान देने योग्य है कि एडुआर्डो डी रॉबर्टिस और सहयोगियों का काम, जिन्होंने "सिनैप्टिक पुटिका" शब्द गढ़ा, व्हिटटेकर और सहयोगियों के साथ अतिव्यापी हो गया और "सिनैप्टोसोम" अलगाव और लक्षण वर्णन 16,17,18 के सत्यापन में योगदान दिया।
सिनैप्टोसोम शारीरिक रूप से सक्रिय संरचनाएं हैं जिनमें न्यूरोट्रांसमीटर13,18 के भंडारण, रिलीज और पुन: उत्थान के लिए आवश्यक सभी सेलुलर और आणविक गुण होते हैं। विट्रो में प्रमुख सिनैप्टिक विशेषताओं का संरक्षण और गैर-सिनैप्टिक घटकों से स्वतंत्रता भी इस अलगाव विधि की उपयोगिता में योगदान करती है। सिनैप्टोसोम ने न्यूरोट्रांसमिशन के रासायनिक और शारीरिक गुणों की समझ में बेहद योगदान दिया है और अब इसका उपयोग सिनैप्टिक आणविक प्रक्रियाओं और बीमारी19,20,21,22,23 में उनके परिवर्तनों का अध्ययन करने के लिए किया जा रहा है। सिनैप्टोसोम भी एसवी, क्लैथ्रिन-लेपित पुटिकाओं (सीसीवी), सिनैप्टिक साइटोसोल, सिनैप्टिक प्लाज्मा झिल्ली, सिनैप्टिक माइटोकॉन्ड्रिया, सिनैप्टिक आसंजन अणुओं और रुचि के अन्य घटकों जैसे सिनैप्टिक घटकों को अलग करने के लिए प्रारंभिक स्रोत सामग्री हैं, जो सिनैप्टिक फ़ंक्शन 18,19,20,24,25,26 के आणविक तंत्र की समझ की सुविधा प्रदान कर सकते हैं। 27,28. इन उप-सिनैप्टिक घटकों को सिनैप्टोसोम के आसमाटिक लाइसिस और सुक्रोज घनत्व ढाल अल्ट्रासेंट्रीफ्यूजेशन15,29 द्वारा प्राप्त किया जा सकता है। यद्यपि व्हिटकर के शोध समूह द्वारा मूल उपकोशिकीय विभाजन विधि को गुणवत्ता सिनैप्टोसोम और एसवी13,30 को अलग करने में कुशल माना जाता है, हाल के अनुकूलन उपकोशिकीय अंशोंकी शुद्धता को बढ़ाते हैं 22,23,31,32। यह लेख सिनैप्टोसोम, एसवी और अन्य उप-सिनैप्टिक घटकों को अलग करने के लिए मुराइन मस्तिष्क ऊतक के उपकोशिकीय विभाजन के लिए एक क्लासिक प्रोटोकॉल का एक अत्यधिक विस्तृत और सुलभ संस्करण प्रदान करता है।
चूहों के साथ सभी प्रयोगों को येल विश्वविद्यालय (प्रोटोकॉल 2021-11117) में संस्थागत पशु देखभाल और उपयोग समिति (आईएसीयूसी) द्वारा अनुमोदित किया गया था और एसोसिएशन फॉर द असेसमेंट एंड एक्रेडिटेशन ऑफ लेबोरेटरी एनिमल केयर इंटरनेशनल (एएएएलएसी) द्वारा मान्यता प्राप्त सुविधा में प्रदर्शन किया गया था। पशु देखभाल और आवास प्रयोगशाला जानवरों की देखभाल और उपयोग के लिए गाइड33 का अनुपालन करते हैं और येल पशु संसाधन केंद्र (वाईएआरसी) द्वारा प्रदान किए गए थे। जानवरों को भोजन और पानी तक पहुंच के साथ 12 घंटे के प्रकाश / अंधेरे चक्र में बनाए रखा गया था। निम्नलिखित प्रोटोकॉल के लिए प्रति जीनोटाइप या स्थिति में पांच से आठ चूहे या दो से चार चूहे आवश्यक हैं। उनके बड़े मस्तिष्क की मात्रा के कारण कम चूहे आवश्यक हैं। इसी तरह, प्रयोगात्मक जानवरों की उम्र अंश उपज को प्रभावित कर सकती है; 2 महीने से कम उम्र के लिए अतिरिक्त चूहों की आवश्यकता हो सकती है। अन्यथा, उल्लिखित प्रक्रियाएं मुराइन प्रजातियों और किसी भी उम्र के स्वस्थ वयस्क जानवरों दोनों पर लागू होती हैं। इस अध्ययन में प्रस्तुत प्रतिनिधि डेटा ने एक वाणिज्यिक स्रोत से प्राप्त जंगली प्रकार (C57BL / 6J) चूहों (आयु = 2 महीने; प्रति प्रतिकृति चार पुरुष और चार मादा) का उपयोग किया ( सामग्री की तालिका देखें)।
1. प्रयोगात्मक तैयारी
नोट: इस प्रोटोकॉल को पूरा करने के लिए एक एकल शोधकर्ता के लिए ~ 11 घंटे की आवश्यकता होती है। बेंचटॉप सेटअप (चित्रा 1), बफर तैयारी (तालिका 1), सेंट्रीफ्यूज और रोटर को 4 डिग्री सेल्सियस तक प्रीकूलिंग, और प्रोटोकॉल निष्पादन से एक दिन पहले आवश्यक सामग्री और उपकरणों के संग्रह और लेबलिंग ( सामग्री की तालिका देखें) को पूरा करने की अत्यधिक अनुशंसा की जाती है।
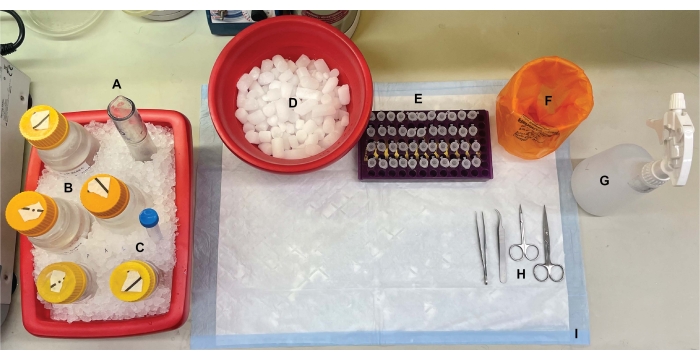
चित्र 1: बेंचटॉप सेटअप। मस्तिष्क विच्छेदन से पहले, (ए) डौंस ग्लास होमोजेनाइज़र और (बी) सभी बफर बर्फ पर ठंडा थे। (सी) प्रोटीज अवरोधक स्टॉक समाधान बर्फ पर पिघल गए थे। सेंट्रीफ्यूज ट्यूबों के लिए गीली बर्फ का एक दूसरा कंटेनर, तरल नाइट्रोजन का एक देवर (नहीं दिखाया गया), और (डी) तरल नाइट्रोजन में फ्लैश-जमे हुए नमूनों के अल्पकालिक भंडारण के लिए सूखी बर्फ का एक कंटेनर प्राप्त किया गया। (ई) माइक्रोसेंट्रीफ्यूज ट्यूबों को सभी नमूनों के लिए पूर्व-लेबल किया गया था, क्योंकि इस प्रक्रिया के दौरान प्रति जीनोटाइप या स्थिति में प्रत्येक उपकोशिकीय अंश नमूने के चार एलिकोट एकत्र किए गए थे (समय-बचत टिप: प्रयोग किए जाने से एक दिन पहले सभी ट्यूबों को अच्छी तरह से लेबल करें)। (एफ) एक उपयुक्त बायोहैजार्ड अपशिष्ट कंटेनर, (जी) 70% इथेनॉल, (एच) सर्जिकल उपकरण, और (आई) एक शोषक सतह पैड। प्रोटोकॉल कार्यान्वयन के दौरान कुशल पहुंच के लिए आवश्यक सेंट्रीफ्यूज ट्यूब और डिस्पोजेबल अलग रखे गए थे (नहीं दिखाया गया)। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
- सर्जरी के लिए बेंचटॉप तैयार करें और मस्तिष्क छांटने के लिए आवश्यक कैंची और बल एकत्र करें ( सामग्री की तालिका देखें)। माउस पूंछ बायोप्सी के लिए प्री-लेबल 1.5 एमएल माइक्रोसेंट्रीफ्यूज ट्यूब और प्रति एकत्र अंश चार ट्यूब, जैसा कि चित्र 2 में उल्लिखित है।
- गीली बर्फ के दो कंटेनर, सूखी बर्फ का एक कंटेनर, और एक बेंचटॉप तरल नाइट्रोजन देवर फ्लास्क प्राप्त करें।
- बर्फ पर फेनिलमेथिलसल्फोनिल फ्लोराइड (पीएमएसएफ), पेपस्टैटिन ए, एप्रोटिनिन और ल्यूपेप्टिन स्टॉक समाधान ( सामग्री की तालिका देखें)। आवश्यक बफर तैयार करें (तालिका 1)।
नोट: सुक्रोज समाधान पहले से तैयार किया जा सकता है और 4 डिग्री सेल्सियस पर संग्रहीत किया जा सकता है। हालांकि, जलीय घोलों में इन अभिकर्मकों की अस्थिरता के कारण प्रयोग की शुरुआत में प्रोटीज इनहिबिटर (पिघले हुए स्टॉक और टैबलेट) को सभी बफर में ताजा जोड़ा जाना चाहिए। इसके अलावा, बरकरार सिनैप्टोसोम के संग्रह को सक्षम करने के लिए सभी बफर को डिटर्जेंट-मुक्त ग्लासवेयर और डिटर्जेंट-मुक्त पानी के साथ तैयार किया जाना चाहिए। - बर्फ पर सभी बफर और ग्लास डौंस होमोजेनाइज़र ( सामग्री की तालिका देखें) को ठंडा करें। सेंट्रीफ्यूज को 4 डिग्री सेल्सियस पर सेट करें और रोटर को 4 डिग्री सेल्सियस पर ठंडा करें।
- बर्फ पर एक डौंस होमोजेनाइज़र में 14 एमएल बफर ए (तालिका 1) जोड़ें।
तालिका 1: उपकोशिकीय विभाजन बफर की संरचना। कृपया इस तालिका को डाउनलोड करने के लिए यहाँ क्लिक करें.
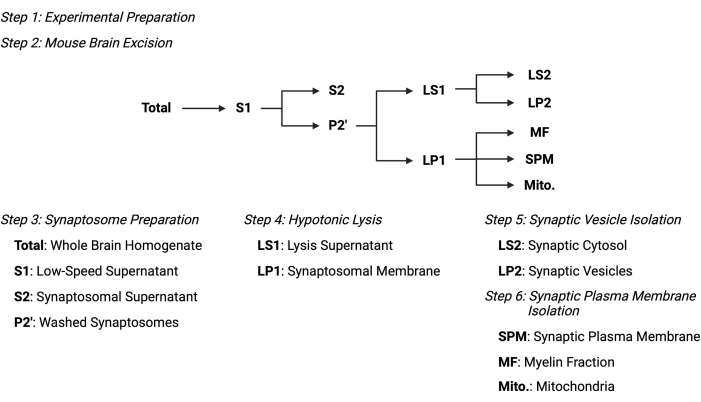
चित्रा 2: उपकोशिकीय विभाजन प्रोटोकॉल का अवलोकन। उपकोशिकीय विभाजन चरणों और एकत्र किए गए नमूनों का सारांश योजनाबद्ध। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
2. माउस मस्तिष्क छांटना
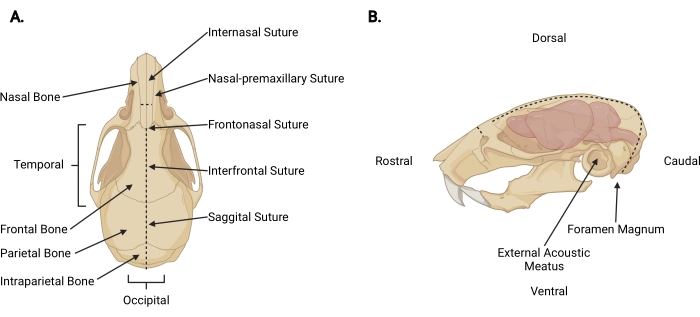
चित्र 3: क्रानियोफेशियल एनाटॉमी( ए) प्रासंगिक कपाल संरचनाओं के साथ एक माउस खोपड़ी का पृष्ठीय दृश्य इंगित किया गया है। (बी) प्रासंगिक कपाल संरचनाओं और शारीरिक दिशाओं के साथ एक माउस खोपड़ी और मस्तिष्क का बाएं पार्श्व दृश्य। धराशायी रेखाएं उन स्थानों का प्रतिनिधित्व करती हैं जहां चीरे लगाए जाने चाहिए। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
- एक ओपन ड्रॉप विधि34 का उपयोग करके फ्यूम हुड या बायोसेफ्टी कैबिनेट में स्थित एनेस्थीसिया कक्ष में 100% आइसोफ्लोरेन के साथ प्रत्येक माउस को गहराई से एनेस्थेटाइज करें। गर्भाशय ग्रीवा रीढ़ की अव्यवस्था द्वारा प्रत्येक माउस का बलिदान करें और उसके बाद तेजी से सिर काट दें। प्रत्येक बलिदान और विच्छेदन के लिए जीनोटाइप या प्रयोगात्मक समूहों के बीच वैकल्पिक12. इच्छामृत्यु के बाद 2 मिमी डिस्टल टेल टिप को बारीक कैंची से निकालकर पूंछ बायोप्सी प्राप्त करें। जीनोटाइपिंग के लिए ऊतक को स्टोर करें।
- विच्छेदन के दौरान बालों को ऊतक और शल्य चिकित्सा उपकरणों का पालन करने से रोकने के लिए 70% इथेनॉल के साथ कटे हुए सिर को स्प्रे करें।
- सिर काटने के समय त्वचा के नीचे बारीक कैंची डालें और खोपड़ी से खोपड़ी को वापस लेने के लिए इंटरनेसल सीवन (चित्रा 3 ए) तक एक मध्य चीरा लगाएं।
- प्रत्येक अस्थायी पहलू की ओर ओसीसीपटल क्षेत्र से काम करते हुए, प्रत्येक बाहरी ध्वनिक मांस से परे खोपड़ी की बाहरी सतह को उजागर करने के लिए प्रावरणी और मांसपेशियों को ट्रिम करें (चित्रा 3 बी)।
- गैर-प्रमुख हाथ के साथ खोपड़ी और खोपड़ी के रोस्ट्रल पहलू को सुरक्षित करें। दूसरे के साथ, फोरमेन मैग्नम के पुच्छल पक्ष में 2 मिमी की बारीक कैंची डालें, जहां रीढ़ की हड्डी बाहर निकलती दिखाई दे रही है। जब तक कैंची इंट्रापेराइटल हड्डी की आंतरिक सतह तक नहीं पहुंच जाती तब तक एक मध्य रेखा चीरा लगाएं (चित्रा 3; डैश्ड लाइनें)।
नोट: प्रारंभिक चीरा के दौरान, कैंची रीढ़ की हड्डी के समानांतर होनी चाहिए, जिसमें मस्तिष्क और सेरिबैलम को नुकसान को रोकने के लिए खोपड़ी की आंतरिक सतह की ओर दबाव लगाया जाना चाहिए। - कैंची के कोण को बदलें ताकि ब्लेड खोपड़ी की पृष्ठीय सतह के समानांतर चलें। एक गाइड के रूप में धनु और इंटरफ्रंटल सीवन का उपयोग करके, पार्श्विका और ललाट हड्डियों के माध्यम से मध्य चीरा रोस्टरैली को आगे बढ़ाना जारी रखें। कॉर्टेक्स को नुकसान से बचने के लिए लगातार ऊपर की ओर दबाव का उपयोग करें। अंतर्नेजल सीवन (चित्रा 3 ए) से परे चीरा को समाप्त करें।
- नाक की हड्डी पर एक छोटा लंबवत चीरा (~ 3 मिमी) बनाएं, जो कि खोपड़ी के लंबवत कैंची को नाक-प्रीमैक्सिलरी सीवन पर स्थित करके खोपड़ी के लंबवत रखता है और एक को भी काटता है (चित्र 3; डैश लाइनें)।
नोट: यह कदम खोपड़ी को वापस लेने में आसानी को बढ़ाएगा और घ्राण बल्ब को इकट्ठा करने के लिए महत्वपूर्ण होगा यदि यह क्षेत्र रुचि का है। - रोस्ट्रल पहलू को सुरक्षित करते समय, खोपड़ी को धीरे से मस्तिष्क से ऊपर उठाने के लिए बनावट बल की एक जोड़ी के एक तरफ का उपयोग करें, फिर पार्श्व और उदर रूप से। आवश्यकतानुसार मध्य रेखा के साथ दोहराएं, फिर दूसरे गोलार्ध के लिए जब तक कि पूरे मस्तिष्क की सतह उजागर न हो जाए।
- घुमावदार बल या एक महीन स्पैटुला का उपयोग करके, धीरे से मस्तिष्क के रोस्ट्रल पक्ष को उठाएं। खोपड़ी से छांटने को पूरा करने के लिए ऑप्टिक और कपाल नसों को काटें।
- प्रत्येक स्थिति के लिए, पांच से आठ माउस दिमागों को एक साथ ठंडा ग्लास डौंस होमोजेनाइज़र में इकट्ठा करें जिसमें 14 एमएल बफर ए (तालिका 1) होता है।
3. सिनैप्टोसोम तैयारी
नोट: इस प्रक्रिया के योजनाबद्ध चित्र 4 में दिखाए गए हैं।
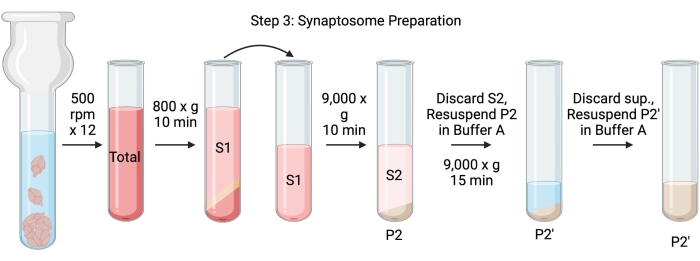
चित्रा 4: सिनैप्टोसोम तैयारी। चरण 3 का योजनाबद्ध, सिनैप्टोसोम की पीढ़ी (पी 2')। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
- 500 आरपीएम (कुल) पर 12 अप-डाउन पास में ग्लास डौंस होमोजेनाइज़र का उपयोग करके दिमाग को समरूप करें। ऊतक के संपूर्ण समरूपीकरण को सुनिश्चित करने के लिए प्रत्येक डाउनस्ट्रोक पर थोड़ी देर के लिए रुकें। वार्मिंग और प्रोटीन विकृतीकरण से बचने के लिए बर्फ स्नान में अधिमानतः समरूप करें। बिसिनकोनिनिक एसिड परख (बीसीए, सामग्री की तालिका देखें) द्वारा प्रोटीन एकाग्रता निर्धारण के लिए 5 μL एलिकोट लें। पश्चिमी धब्बा (डब्ल्यूबी) के लिए पूरे मस्तिष्क लाइसेट एलिकोट के 100 μL लें। इसके लिए और बाद के सभी नमूने (चित्रा 2), बीसीए के लिए दो एलिकोट और डब्ल्यूबी के लिए दो एलिकोट लें। फ्लैश-सभी एकत्रित एलिकोट को तरल नाइट्रोजन में फ्रीज करें और उन्हें -80 डिग्री सेल्सियस पर स्टोर करें।
- सुपरनैटेंट (एस 1) प्राप्त करने के लिए 4 डिग्री सेल्सियस पर 10 मिनट के लिए 800 x g पर एक उच्च गति गोल तल सेंट्रीफ्यूज ट्यूब (14 एमएल) (सामग्री की तालिका देखें) में कुल मस्तिष्क होमोजेनेट को घुमाएं। एस 1 को एक नई सेंट्रीफ्यूज ट्यूब में स्थानांतरित करें, गोली को पीछे छोड़ दें (पी 1), जिसमें बरकरार कोशिकाएं और नाभिक होते हैं। फूली हुई, सफेद, ढीली, सतही गोली को ऊपर उठाने से बचें। BCA के लिए S1 का 2 x 5 μL और WB के लिए S1 का 2 x 100 μL लें।
- सिनैप्टोसोमल सुपरनैटेंट (एस 2) और क्रूड सिनैप्टोसोम गोली (पी 2) प्राप्त करने के लिए 4 डिग्री सेल्सियस पर 15 मिनट के लिए 9,000 x g पर एस 1 को स्पिन करें। BCA के लिए S2 का 2 x 10 μL और WB के लिए S2 का 2 x 500 μL लें। एलिकोट प्राप्त करने के बाद सुपरनैटेंट को छोड़ दें और गोली के साथ अगले चरण पर आगे बढ़ें।
- सतह पर तैरनेवाला (एस 2') और धोए गए सिनैप्टोसोम (पी 2') प्राप्त करने के लिए 15 मिनट के लिए 9,000 x g पर प्रोटीज इनहिबिटर और सेंट्रीफ्यूज के साथ 3 एमएल बर्फ-ठंडे बफर ए में पी 2 को फिर से निलंबित करें। सतह पर तैरने वाले को त्याग दें और गोली रखें।
- 3 एमएल बफर ए में पी 2 को पुन: निलंबित करें। गोली के तल पर गहरे लाल भाग को फिर से चार्ज करने से बचें, जिसमें मुख्य रूप से माइटोकॉन्ड्रिया होता है। BCA के लिए P2 का 2 x 20 μL और WB के लिए P2 का 2 x 100 μL लें।
नोट: यह गोली के लाल केंद्र से पिपेट टिप को दूर निर्देशित करते हुए सफेद धोए गए सिनैप्टोसोम को फिर से निलंबित करने के लिए गोली के किनारों और सतह को धीरे से मिलाकर प्राप्त किया जा सकता है।
4. हाइपोटोनिक लाइसिस
नोट: इस प्रक्रिया के योजनाबद्ध चित्र 5 में दिखाए गए हैं।
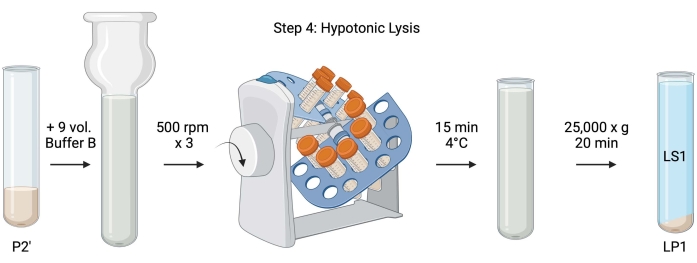
चित्रा 5: हाइपोटोनिक लाइसिस। चरण 4 का योजनाबद्ध, लाइसिस सुपरनैटेंट (एलएस 1) और सिनैप्टोसोमल झिल्ली अंश (एलपी 1) उत्पन्न करने के लिए सिनैप्टोसोम का हाइपोटोनिक लाइसिस। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
- धोए गए सिनैप्टोसोम के हाइपोटोनिक लाइसिस के लिए, फिर से निलंबित पी 2 '(~ 27 एमएल) में ठंडा बफर बी (तालिका 1) के 9 वॉल्यूम जोड़ें। सिनैप्टोसोम को एक ग्लास डौंस होमोजेनाइज़र (500 आरपीएम पर तीन अप-डाउन पास) में समरूप करें।
- नमूने को 50 एमएल कैप्ड शंक्वाकार सेंट्रीफ्यूज ट्यूबों में स्थानांतरित करें। उन्हें 15 मिनट के लिए 4 डिग्री सेल्सियस ठंडे कमरे में ट्यूब रिवॉल्वर पर घुमाएं।
- सेंट्रीफ्यूज ने 25,000 x g पर 25,000 x g पर 4 डिग्री सेल्सियस पर लाइसिस सुपरनैटेंट (एलएस 1) और लाइसिस पेलेट युक्त सिनैप्टोसोमल झिल्ली (एलपी 1) प्राप्त करने के लिए 20 मिनट के लिए 'लाइस्ड पी 2' किया। BCA के लिए LS1 का 2 x 50 μL और WB के लिए LS1 का 2 x 400 μL लें। अल्ट्रासेंट्रीफ्यूजेशन के लिए एलएस 1 को एक कैप्ड सेंट्रीफ्यूज ट्यूब में स्थानांतरित करें ( सामग्री की तालिका देखें)।
5. सिनैप्टिक पुटिका अलगाव
नोट: इस प्रक्रिया के योजनाबद्ध चित्र 6 में दिखाए गए हैं।
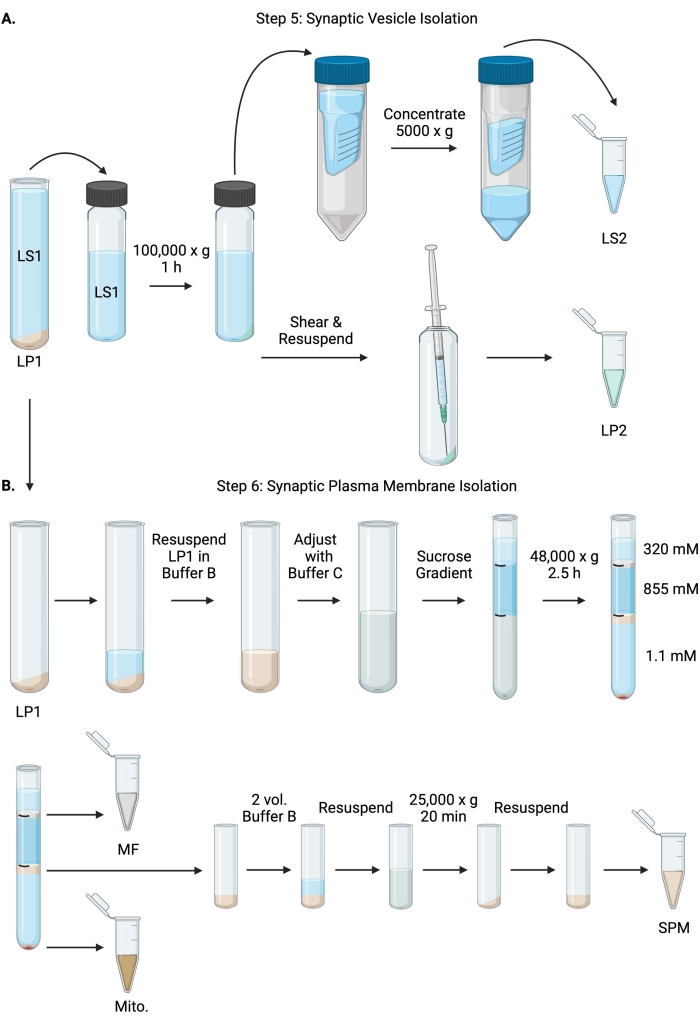
(ए) चरण 5 का योजनाबद्ध, सिनैप्टिक साइटोसोल (एलएस 2) और सिनैप्टिक पुटिका (एलपी 2) अंशों का अलगाव, और (बी) चरण 6, माइलिन (एमएफ), सिनैप्टिक प्लाज्मा झिल्ली (एसपीएम), और माइटोकॉन्ड्रियल (माइटो) अंशों की पीढ़ी सुक्रोज ग्रेडिएंट के अल्ट्रासेंट्रीफ्यूजेशन के बाद। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
- सिनैप्टिक साइटोसोल सुपरनैटेंट (एलएस 2) और सिनैप्टिक पुटिका गोली (एलपी 2) प्राप्त करने के लिए 4 डिग्री सेल्सियस पर 60 मिनट के लिए 100,000 एक्स जी पर एक निश्चित कोण अल्ट्रासेंट्रीफ्यूज रोटर (सामग्री की तालिका देखें) में सेंट्रीफ्यूज एलएस 1। एलपी 2 छोटा, पारभासी होगा, और सेंट्रीफ्यूज ट्यूब के किनारे दृढ़ता से पालन किया जाएगा।
- 23 ग्राम सुई और 1 एमएल सिरिंज, कतरनी एलपी 2 का उपयोग करके 500 μL बफर A में पुन: निलंबित करें। बीसीए के लिए एलपी 2 का 2 x 10 μL और WB के लिए LP2 का 2 x 250 μL लें।
- एलएस 2 (~ 30 एमएल) को 10 केडीए कटऑफ के साथ केन्द्रापसारक फ़िल्टर इकाइयों में स्थानांतरित करें ( सामग्री की तालिका देखें)।
नोट: यदि 10 केडीए से छोटे प्रोटीन रुचि के हैं, तो 4 केडीए कटऑफ केन्द्रापसारक फिल्टर इकाइयां उपलब्ध हैं, लेकिन इसके परिणामस्वरूप लंबे स्पिन समय होंगे। - 4 डिग्री सेल्सियस पर 1 घंटे तक 5000 x g पर घूमकर LS2 को लगभग 0.5 mL पर केंद्रित करें। बीसीए के लिए केंद्रित एलएस 2 का 2 x 10 μL और WB के लिए केंद्रित LS2 का 2 x 250 μL लें। स्पिन शुरू करने के बाद, सीधे चरण 6.1 पर आगे बढ़ें।
6. सिनैप्टिक प्लाज्मा झिल्ली अलगाव
- बफर बी के 1 एमएल में एलपी 1 (चरण 4.3) को पुन: निलंबित करें (तालिका 1)। बीसीए के लिए एलपी 1 का 2 x 10 μL और WB के लिए LP1 का 2 x 50 μL लें। शेष एलपी 1 को 7.5 एमएल की अंतिम मात्रा और बफर बी और बफर सी के साथ 1.1 एम की अंतिम सुक्रोज एकाग्रता में समायोजित करें (तालिका 1)।
- 7.5 एमएल पुन: निलंबित एलपी 1 को 14 एमएल अल्ट्रासेंट्रीफ्यूज ट्यूब में स्थानांतरित करें ( सामग्री की तालिका देखें)। एलपी 1 को 3.75 एमएल बफर डी (तालिका 1) के साथ सावधानीपूर्वक ओवरले करें, और फिर 1.25 एमएल बफर ए (या सेंट्रीफ्यूज ट्यूब के शीर्ष के ठीक नीचे भरने के लिए एक बड़ी मात्रा) के साथ ओवरले करें। ट्यूब के किनारे पाइपिंग से बचें, जो सुक्रोज ग्रेडिएंट इंटरफेस को बाधित करेगा। प्रत्येक सुक्रोज अंश को ओवरलाइज करने के बाद, एक पेन के साथ घोल के शीर्ष को चिह्नित करें। अल्ट्रासेंट्रीफ्यूजेशन के लिए ट्यूबों को वजन से संतुलित करें, न कि मात्रा के आधार पर, बफर ए को 10 मिलीग्राम के भीतर छोड़ने के साथ। एक स्विंगिंग बाल्टी अल्ट्रासेंट्रीफ्यूज रोटर में 4 डिग्री सेल्सियस पर 2.5 घंटे के लिए 48,000 x g पर सेंट्रीफ्यूज ( सामग्री की तालिका देखें)।
- प्रत्येक सुक्रोज इंटरफ़ेस की विशिष्टता और विभाजन की सफलता का दस्तावेजीकरण करने के लिए अल्ट्रासेंट्रीफ्यूजेशन के बाद बरकरार ग्रेडिएंट की छवियां प्राप्त करें।
- सावधानी से 320 एमएम सुक्रोज (बफर ए) की सतही परत को हटा दें। माइलिन अंश (एमएफ) को 320 mM/ 855 mM सुक्रोज इंटरफ़ेस पर 800 μL वॉल्यूम में पुनर्प्राप्त करें। 1,000 μL मात्रा में 855 mM / 1.1 M सुक्रोज इंटरफ़ेस पर सिनैप्टिक प्लाज्मा झिल्ली (एसपीएम) अंश को पुनर्प्राप्त करें। ट्यूब की दीवार से प्रत्येक अंश को गोलाकार तरीके से ऊपर उठाएं ताकि यह सुनिश्चित हो सके कि पूरा अंश एकत्र किया गया है। शेष सुक्रोज को सावधानीपूर्वक हटा दें और बफर बी के 200 μL में पुन: निलंबन करके माइटोकॉन्ड्रियल गोली (माइटो) को पुनर्प्राप्त करें। BCA के लिए MF का 2 x 100 μL और Mito का 2 x 10 μL लें। बीसीए के लिए; एमएफ और मिटो के शेष भाग को विभाजित करें। डब्ल्यूबी के लिए आधे में नमूने।
- एसपीएम अंश को बफर बी (~ 2 एमएल) के 2 खंडों के साथ पतला करें, और फिर 4 डिग्री सेल्सियस पर 20 मिनट के लिए 25,000 x g पर 3.5 एमएल सेंट्रीफ्यूज ट्यूब (सामग्री की तालिका देखें) में एक निश्चित कोण रोटर में सेंट्रीफ्यूज करें। सतह पर तैरने वाले को त्याग दें और 250 μL की अंतिम मात्रा के लिए बफर ए में एसपीएम गोली को फिर से निलंबित करें। BCA के लिए SPM का 2 x 5 μL लें और शेष SPM को WB के लिए आधे में विभाजित करें।
- प्रत्येक नमूने की प्रोटीन एकाग्रता निर्धारित करने के लिए एक बीसीए करें, जो चर एलिकोट मात्रा के लिए लेखांकन है।
नोट: डब्ल्यूबी विश्लेषण के लिए, सभी उपकोशिकीय अंशों के लिए सुझाए गए कार्यशील प्रोटीन एकाग्रता 2 μg / μL (या LS1 और MF के लिए प्राप्त करने योग्य के रूप में उच्च) है।
प्रस्तुत विधि के परिणामस्वरूप 11 मस्तिष्क उपकोशिकीय अंश होते हैं जिन्हें आगे शुद्धिकरण और डाउनस्ट्रीम विश्लेषण के विभिन्न रूपों के अधीन किया जा सकता है। सिनैप्टोसोम, एसवी23 और अन्य घटकों की गुणवत्ता का आकलन करने के लिए स्वर्ण मानक विधि इलेक्ट्रॉन माइक्रोस्कोपी (ईएम) (चित्रा 7) है। प्रोटीन के लिए मात्रात्मक इम्यूनोब्लोटिंग जो विशिष्ट उपकोशिकीय अंशों में मौजूद हैं, अंश शुद्धता के मार्करों का आकलन करने के लिए भी किया जा सकता है (चित्रा 8)। उदाहरण के लिए, अंशों के इम्यूनोब्लोट विश्लेषण से सिनैप्टिक प्लाज्मा झिल्ली अंश (एसपीएम) में एन-कैडरिन (सीडीएच 2, यूनिप्रोट नाम), सिनैप्टिक साइटोसोल (एलएस 2) में α-सिन्यूक्लिन (एसवाईयूए), सिनैप्टिक पुटिका अंश (एलपी 2) में सिनैप्टोफिसिन (एसवाईपीएच) और माइलिन अंश (एमएफ) में माइलिन बेसिक प्रोटीन (एमबीपी) के संवर्धन का पता चलता है। ). एक बार अंश शुद्धता स्थापित हो जाने के बाद (उदाहरण के लिए, एलएस 2 अंश में सीडीएच 2 की अनुपस्थिति या एलपी 2 अंश में एसवाईपीएच में कई गुना वृद्धि पर ध्यान दें), मात्रात्मक इम्यूनोब्लोटिंग का उपयोग जीनोटाइप या उपचार के बीच प्रोटीन वितरण में रुचि या क्वेरी अंतर के प्रोटीन के स्थानीयकरण को निर्धारित करने के लिए किया जा सकता है। सिनैप्टिक प्रोटीन के उपकोशिकीय स्थानीयकरण को समझना पहले से अवर्णित प्रोटीन कार्यों के विच्छेदन को सक्षम कर सकता है। इसके अलावा, यह विधि रोग की स्थिति में तस्करी दोष या सिनैप्टिक डिसफंक्शन को स्पष्ट कर सकती है, खासकर जब कार्यात्मक परख के साथ जोड़ा जाता है। उदाहरण के लिए, हमारी टीम ने एंजाइमेटिक रूप से सक्रिय पामिटोयल प्रोटीन थियोस्टेरेज़ 1 के पूल की पहचान करने के लिए इस विधि का उपयोग किया है जो सिनैप्टिक साइटोसोल19 में समृद्ध है।
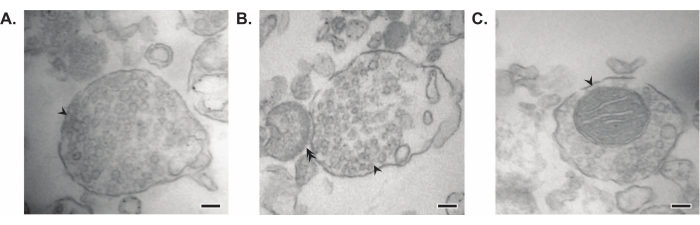
चित्रा 7: सिनैप्टोसोम की इलेक्ट्रॉन माइक्रोस्कोपी (ईएम) (ए) सिनैप्टिक पुटिकाओं (तीर) युक्त सिनैप्टोसोम की प्रतिनिधि ईएम छवि। (बी) प्री-(तीर) और पोस्ट-सिनैप्टिक घटकों (डबल तीर) दोनों के साथ सिनैप्टोसोम की प्रतिनिधि ईएम छवि। (सी) सिनैप्टिक पुटिकाओं और एक माइटोकॉन्ड्रियन (तीर) (स्केल बार = 100 एनएम) युक्त सिनैप्टोसोम की प्रतिनिधि ईएम छवि। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
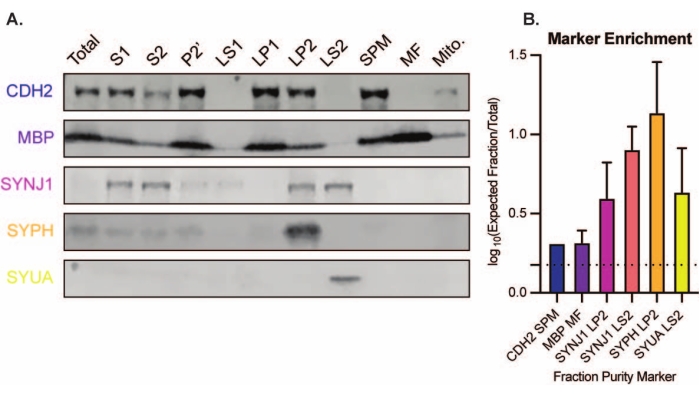
(ए) उपकोशिकीय अंश शुद्धता के मार्कर (यूनिप्रोट नामकरण के साथ इंगित) पूरे मस्तिष्क होमोजेनेट (कुल) की तुलना में उचित रूप से स्थानीयकृत होते हैं: सिनैप्टिक प्लाज्मा झिल्ली अंश (एसपीएम) में एन-कैडरिन (सीडीएच 2), सिनैप्टोफिसिन 1 (एसवाईपीएच) और सिनैप्टिक पुटिका समृद्ध अंश (एलपी 2), α-सिन्यूक्लिन (एसवाईयूए) में सिनैप्टिक साइटोसोल (एलएस 2) में सिनैप्टिक पुटिका समृद्ध अंश (एलपी 2), α-सिन्यूक्लिन (एसवाईयूए) और माइलिन अंश (एमएफ) में माइलिन बेसिक प्रोटीन (एमबीपी)। (बी) इम्यूनोब्लॉट परिमाणीकरण विश्लेषण से अंश शुद्धता मार्करों के संवर्धन (कुल से गुना परिवर्तन) का पता चलता है। डेटा को लॉग 10 पैमाने पर औसत ± मानक विचलन के रूप में दर्शाया जाता है। बिंदीदार रेखा 1.5 गुना परिवर्तन (y = 0.176) (n = 3 8 जंगली प्रकार के चूहों के साथ प्रयोगों की नकल; आयु = 2 महीने; N = SYPH, SYUA, MBP के लिए 4-5 धब्बे, n = 3 प्लॉटेड मानों के साथ पहले गोरेनबर्ग एट अल.19 द्वारा प्रकाशित; n = 5 SYNJ1 के लिए; n = 1 CDH2 के लिए)। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
अपने मौलिक अध्ययनों में, व्हिटकर और सहयोगियों ने सिनैप्टोसोम की पहचान करने के लिए चार रूपात्मक मानदंडों का उपयोग किया: (1) संरचनाओं में एक सील प्लाज्मा झिल्ली होती है; (2) संरचनाओं में तंत्रिका टर्मिनलों के समान एसवी होते हैं और आकार और संख्या में सीटू में वैरिकासिटी होते हैं; (3) संरचनाओं में एक या अधिक छोटे माइटोकॉन्ड्रिया होते हैं; और (4) प्रीसिनेप्टिक झिल्ली को अक्सर पोस्ट-सिनैप्टिक घटक 11,12,13 का पालन किया जाता है। हालांकि पहले दो मानदंड आम तौर पर हर अलगाव विधि पर लागू होते हैं, इस लेख में वर्णित सबसे हालिया प्रोटोकॉल में, सभी परिणामी सिनैप्टोसोम में माइटोकॉन्ड्रिया और संलग्न पोस्ट-सिनैप्टिक टर्मिनल नहीं होंगे। लगभग 60% सिनैप्टोसोम में माइटोकॉन्ड्रिया होंगे, और केवल 15% तक पोस्ट-सिनैप्टिक टर्मिनल37 से जुड़े होने का अनुमान है। यदि पोस्ट-सिनैप्टिक घटक विशेष रुचि रखते हैं, तो संवर्धन के लिए आइसोटोनिक क्रेब्स जैसे होमोजेनाइजेशन बफर और दबाव निस्पंदन का उपयोग पोस्ट-सिनैप्टिक टर्मिनलों (जिसे सिनैप्टोन्यूरोसोम भी कहा जाता है) के साथ सिनैप्टोसोम की उच्च सांद्रता उत्पन्न करने के लिए जाना जाता है।
जानवर की बलि देने की विधि सिनैप्टोसोम और सिनैप्टिक सबफ्रैक्शन की गुणवत्ता को प्रभावित कर सकती है। इच्छामृत्यु विधि का उपयोग करके बलिदान किए गए वयस्क जानवरों को संज्ञाहरण की आवश्यकता नहीं होती है, जिसके परिणामस्वरूप सर्वोत्तम अंश गुणवत्ता होगी। इसके अलावा, दिमाग को ताजा विच्छेदित किया जाना चाहिए, जमे हुए नहीं, और सबसे व्यवहार्य सिनैप्टिक अंशों के लिए होमोजेनाइजेशन बफर (वजन / मात्रा) के 1: 10 अनुपात का उपयोग करके समरूपकिया जाना चाहिए। मस्तिष्क में सिनैप्स की एक विषम आबादी होती है जिसे उनके द्वारा ले जाने वाले न्यूरोट्रांसमीटर के प्रकार से विभेदित किया जा सकता है। सिनैप्टोसोम गठन आम तौर पर सिनैप्स प्रकार या न्यूरोट्रांसमीटर सामग्री13 से अप्रभावित होता है। एक अपवाद सेरिबैलम में काई फाइबर है, जो मस्तिष्क के बाकी हिस्सों से सिनैप्टोसोम प्राप्त करने के लिए इष्टतम परिस्थितियों में बाधित होने के लिए जाना जाता है39,40। इस प्रकार, मस्तिष्क समरूपीकरण से पहले सेरिबैलम को हटाने की सिफारिश की जाती है यदि इस क्षेत्र का बहिष्करण प्रयोगात्मक लक्ष्य को प्रभावित नहीं करता है। यदि किसी विशेष न्यूरोट्रांसमीटर चरित्र के सिनैप्टोसोम को अलग करने में रुचि रखते हैं, तो मस्तिष्क के क्षेत्र जो रुचि के न्यूरोट्रांसमीटर वाले न्यूरॉन्स के लिए समृद्ध होते हैं, उन्हें पहले अलग किया जा सकता है। हालांकि, यह दृष्टिकोण अंतिम अंश उपज पर सीमाएं लगाएगा, जो रुचि के क्षेत्र के आकार पर निर्भर करता है (जानवरों की उम्र भी एक विचार है)। न्यूरोट्रांसमीटर-विशिष्ट सिनैप्टोसोम के अलगाव के लिए इम्यूनोकेमिकल तरीके हैं, लेकिन व्यवहार्यता और उपज से काफीसमझौता किया जाएगा। यदि सिनैप्टोसोम चयापचय व्यवहार्यता का आकलन करना महत्वपूर्ण है, तो न्यूरोट्रांसमीटर रिलीज41,42 या कुछ एंजाइमेटिक परख 43 का माप नियोजित किया जा सकता है।
सिनैप्टोसोम तैयारी में आम संदूषकों में माइक्रोसोम, मुक्त माइटोकॉन्ड्रिया, एसवी और न्यूरोनल और ग्लियल झिल्ली शामिल हैं। पी 1 और पी 2 अंश 22 पर धोने की संख्या में वृद्धि करके और बाद केचरणों में लाल माइटोकॉन्ड्रियल गोली के पुन: निलंबन से बचने से संदूषण को कम किया जा सकता है। उन प्रयोगों में जहां चयापचय व्यवहार्यता और समय महत्वपूर्ण हैं, धोने की संख्या को कम करना और सुक्रोज ग्रेडिएंट पर फिकोल या परकोल ग्रेडिएंट का उपयोगकरना 44,45,46 सहायक होगा। ये विधियां संदूषण को भी काफी कम करती हैं। व्हिटकर के मूल प्रोटोकॉल ने उच्च गुणवत्ता वाले एसवी का उत्पादन किया। इस विधि में शामिल नागी एट अल.23 द्वारा आगे अनुकूलन, उपज36 पर महत्वपूर्ण रूप से समझौता किए बिना उल्लेखनीय समरूपता और शुद्धता के साथ एसवी का उत्पादन करता है। यदि विशिष्ट एसवी उपप्रकार रुचि के हैं, जैसे कि ग्लूटामेटर्जिक (वीजीएलयूटी -1-युक्त) या जीबीएर्जिक (वीजीएटी -1-युक्त) एसवी, विशिष्ट एंटीबॉडी का उपयोग करके इम्यूनोआइसोलेशन47,48 किया जा सकता है। सिनैप्टोसोम से सीसीवी को अलग करने के लिए वैकल्पिक तरीके भी उपलब्ध हैं, जो अंतर घनत्व के कारण, इस विधि 20,49,50 के साथ प्राप्त एसवी के समान इंटरफ़ेस पर मौजूद नहीं हो सकते हैं।
कुल मिलाकर, सिनैप्टिक घटकों को अलग करने के लिए वर्तमान प्रोटोकॉल को स्रोत मस्तिष्क ऊतक और प्रयोगात्मक लक्ष्यों की गुणवत्ता और मात्रा के आधार पर बेहतर एकरूपता और व्यवहार्यता के साथ अंश प्राप्त करने के लिए और अनुकूलित किया जा सकता है। आगे के समस्या निवारण विवरण के लिए, डंकले और रॉबिन्सन22 और गैंजेला एट अल.36 द्वारा पुस्तक अध्यायों का उल्लेख करना चाहिए।
लेखकों के पास खुलासा करने के लिए कुछ भी नहीं है।
हम ईएम छवि तैयारी के लिए पी कोलोसी को धन्यवाद देना चाहते हैं। इस काम को राष्ट्रीय स्वास्थ्य संस्थान (आर 01 एनएस 064963, एसएससी) द्वारा समर्थित किया गया था; आर01 एनएस110354, एसएससी; आर01 एनएस083846, एसएससी; आर 21 एनएस 094971, एसएससी; टी 32 एनएस 007224, एसएमटी; टी 32 एनएस 041228, एसएमटी), संयुक्त राज्य अमेरिका के रक्षा विभाग (डब्ल्यू 81 एक्सडब्ल्यूएच-17-1-0564, एसएससी; W81XWH-19-1-0264, VDJ, पार्किंसंस (ASAP) सहयोगी अनुसंधान नेटवर्क (SSC) और माइकल J. Fox Foundation Target Advancement Program (MJFF-020160, SSC और VDJ) के पार विज्ञान को संरेखित करना। हमने BioRender.com का उपयोग करके ग्राफिकल चित्र बनाए।
| Name | Company | Catalog Number | Comments |
| 1 mL TB Syringe | BD | 309649 | |
| 1.5 mL Eppendorf Tubes | USA Scientific | 1415-2500 | |
| 14 mL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter | 344060 | Compatible with SW 40 Ti |
| 23 Gauge Precision Glide Hypodermic Needle | BD | 305145 | |
| 26.3 mL, Polycarbonate Bottle with Cap Assembly | Beckman Coulter | 355618 | Compatible with Ti70 |
| 3.5 mL, Open-Top Thickwall Polypropylene Tube | Beckman Coulter | 349623 | Compatible with TLA-100.3 |
| 50 mL Falcon Tubes | Fisher Scientific | 14-432-22 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901024 | |
| Aprotinin | Sigma-Aldrich | A6279 | 1 mg/mL in diH2O |
| Avanti J-26 XP Centrifuge | Beckman Coulter | B22984 | <26,000 rpm |
| Benchtop HDPE Dewar Flask | Thermo Scientific | 5028U19 | |
| C57BL/6J Mice | The Jackson Labs | 000664 | |
| Centrifuge 5810R | Eppendorf | EP022628168 | <14,000 rpm |
| complete, Mini, EDTA-free Protease Inhibitor Cocktail Tablets | Roche | 11873580001 | Add 1 tablet per 50 mL of solution |
| Curved Forceps | Fine Science Tools | 11273-20 | |
| Fine Surgical Scissors | Fine Science Tools | 8r | |
| Glas-Col Tissue Homogenizing System | Cole-Parmer | UX-04369-15 | |
| Graefe Forceps | Fine Science Tools | 11650-10 | |
| High-Speed Polycarbonate Round Bottom Centrifuge Tubes | ThermoFisher | 3117-0500 | Compatible with JA20 |
| Isofluorane | Henry Schein Animal Health | NDC 11695-6776-2 | |
| JA-20 Rotor | Beckman Coulter | 334831 | |
| Leupeptin | American Bio | AB01108 | 1 mg/mL in diH2O |
| N-[2-Hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid] (HEPES) | American Bio | AB00892 | |
| Optima L-80 XP Ultracentrifuge | Beckman Coulter | <100,000 rpm | |
| Optima TLX Ultracentrifuge | Beckman Coulter | <120,000 rpm | |
| Pepstatin A | Thermo Scientific | 78436 | 1 mg/mL in DMSO |
| Phenylmethylsulfonyl fluoride (PMSF) | American Bio | AB01620 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23335 | For determination of protein concentration |
| Pipette Tips | |||
| Serological Pipettes | |||
| Sucrose | Sigma-Aldrich | S0389 | |
| Surgical Scissors | Fine Science Tools | 14002-12 | |
| SW 40 Ti Swinging-Bucket Rotor | Beckman Coulter | 331301 | |
| Teflon-Coated Pestle and Mortar Tissue Grinder | Thomas Scientific | 3431D94 | |
| Ti70 Rotor | Beckman Coulter | 337922 | |
| TLA-100.3 Rotor | Beckman Coulter | 349490 | |
| Tube Revolver | Dot Scientific | DTR-02VS |
- Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J., Education, A. J. Synaptic Transmission. Principles of Neural Science, Fifth Edition. , (2014).
- Lepeta, K., et al. Synaptopathies: synaptic dysfunction in neurological disorders - A review from students to students. Journal of Neurochemistry. 138 (6), 785-805 (2016).
- Südhof, T. C., Malenka, R. C. Understanding synapses: Past, present, and future. Neuron. 60 (3), 469-476 (2008).
- Südhof, T. C. The molecular machinery of neurotransmitter release (Nobel lecture). Angewandte Chemie International Edition. 53 (47), 12696-12717 (2014).
- Jahn, R., Boyken, J., Pfaff, D. W. Molecular Regulation of Synaptic Release. Neuroscience in the 21st Century: From Basic to Clinical. , 351-401 (2013).
- Xiong, H., Gendelman, H. E. . Current Laboratory Methods in Neuroscience Research. , (2014).
- Azevedo, F. A., et al. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology. 513 (5), 532-541 (2009).
- Herculano-Houzel, S. The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost. Proceedings of the National Academy of Sciences of the United States of America. 109, 10661-10668 (2012).
- Herculano-Houzel, S., Lent, R. Isotropic fractionator: A simple, rapid method for the quantification of total cell and neuron numbers in the brain. Journal of Neuroscience. 25 (10), 2518-2521 (2005).
- Herculano-Houzel, S., Mota, B., Lent, R. Cellular scaling rules for rodent brains. Proceedings of the National Academy of Sciences of the United States of America. 103 (32), 12138-12143 (2006).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron-microscopic study of cell fragments derived by homogenization and centrifugation. Journal of Anatomy. 96, 79-88 (1962).
- Gray, E. G., Whittaker, V. P. The isolation of synaptic vesicles from the central nervous system. Journal of Physiology. 153, 35-37 (1960).
- Whittaker, V. P. Thirty years of synaptosome research. Journal of Neurocytology. 22 (9), 735-742 (1993).
- Jahn, R., Fasshauer, D. Molecular machines governing exocytosis of synaptic vesicles. Nature. 490, 201-207 (2012).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from nerve-ending particles ('synaptosomes). Biochemical Journal. 90 (2), 293-303 (1964).
- De Robertis, E., Rodriguez De Lores Arnaiz, G., Pellegrino De Iraldi, A. Isolation of synaptic vesicles from nerve endings of the rat brain. Nature. 194, 794-795 (1962).
- De Robertis, E., Pellegrino De Iraldi, A., Rodriguez, G., Gomez, C. J. On the isolation of nerve endings and synaptic vesicles. The Journal of Biophysical and Biochemical Cytology. 9 (1), 229-235 (1961).
- Zimmermann, H., Whittaker, V. P., Murphy, K. M. The Discovery of the Synaptosome and Its Implications. Synaptosomes. , 9-26 (2018).
- Gorenberg, E. L., et al. Identification of substrates of palmitoyl protein thioesterase 1 highlights roles of depalmitoylation in disulfide bond formation and synaptic function. PLoS Biology. 20 (3), 3001590 (2022).
- Vidyadhara, D. J., et al. Dopamine transporter and synaptic vesicle sorting defects initiate auxilin-linked Parkinson's disease. bioRxiv. , (2022).
- Schrimpf, S. P., et al. Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry. Proteomics. 5 (10), 2531-2541 (2005).
- Dunkley, P. R., Robinson, P. J., Murphy, K. M. Synaptosome Preparations: Which Procedure Should I Use. Synaptosomes. , 27-53 (2018).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Research. 109 (2), 285-309 (1976).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127 (4), 831-846 (2006).
- Wagner, J. A., Kelly, R. B. Topological organization of proteins in an intracellular secretory organelle: the synaptic vesicle. Proceedings of the National Academy of Sciences of the United States of America. 76 (8), 4126-4130 (1979).
- Jahn, R., Schiebler, W., Ouimet, C., Greengard, P. A 38,000-dalton membrane protein (p38) present in synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 82 (12), 4137-4141 (1985).
- Binotti, B., Jahn, R., Pérez-Lara, &. #. 1. 9. 3. ;. An overview of the synaptic vesicle lipid composition. Archives of Biochemistry and Biophysics. 709, 108966 (2021).
- Siegel, D. P., Ware, B. R. Electrokinetic properties of synaptic vesicles and synaptosomal membranes. Biophysical Journal. 30 (1), 159-172 (1980).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from disrupted nervending particles. Biochemical Pharmacology. 12 (3), 300-302 (1963).
- Clementi, F., Whittaker, V. P., Sheridan, M. N. The yield of synaptosomes from the cerebral cortex of guinea pigs estimated by a polystyrene bead "tagging" procedure. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 72, 126-138 (1966).
- Carlson, S. S., Wagner, J. A., Kelly, R. B. Purification of synaptic vesicles from elasmobranch electric organ and the use of biophysical criteria to demonstrate purity. Biochemistry. 17 (7), 1188-1199 (1978).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. Journal of Cell Biology. 96 (5), 1374-1388 (1983).
- Hawkins, P., et al. A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Laboratory Animals. 45 (1), 1-13 (2011).
- Risling, T. E., Caulkett, N. A., Florence, D. Open-drop anesthesia for small laboratory animals. Canadian Veterinary Journal. 53 (3), 299-302 (2012).
- Deutsch, C., Drown, C., Rafalowska, U., Silver, I. A. Synaptosomes from rat brain: Morphology, compartmentation, and transmembrane pH and electrical gradients. Journal of Neurochemistry. 36 (6), 2063-2072 (1981).
- Ganzella, M., Ninov, M., Riedel, D., Jahn, R. Isolation of synaptic vesicles from mammalian brain. Methods in Molecular Biology. 2417, 131-145 (2022).
- Dunkley, P. R., et al. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: homogeneity and morphology of subcellular fractions. Brain Research. 441 (1-2), 59-71 (1988).
- Schwartz, R. D., Skolnick, P., Hollingsworth, E. B., Paul, S. M. Barbiturate and picrotoxin-sensitive chloride efflux in rat cerebral cortical synaptoneurosomes. FEBS Letters. 175 (1), 193-196 (1984).
- Pittaluga, A., Thellung, S., Maura, G., Raiteri, M. Characterization of two central AMPA-preferring receptors having distinct location, function and pharmacology. Naunyn-Schmiedeberg's Archives of Pharmacology. 349 (6), 555-558 (1994).
- Israël, M., Whittaker, V. P. The isolation of mossy fibre endings from the granular layer of the cerebellar cortex. Experientia. 21 (6), 325-326 (1965).
- Khvotchev, M., Lonart, G., Südhof, T. C. Role of calcium in neurotransmitter release evoked by alpha-latrotoxin or hypertonic sucrose. Neuroscience. 101 (3), 793-802 (2000).
- Lonart, G., Janz, R., Johnson, K. M., Südhof, T. C. Mechanism of action of rab3A in mossy fiber LTP. Neuron. 21 (5), 1141-1150 (1998).
- Nicholls, D. G., Sihra, T. S. Synaptosomes possess an exocytotic pool of glutamate. Nature. 321 (6072), 772-773 (1986).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nature Protocols. 3 (11), 1718-1728 (2008).
- Cotman, C. W., Matthews, D. A. Synaptic plasma membranes from rat brain synaptosomes: Isolation and partial characterization. Biochimica et Biophysica Acta. 249 (2), 380-394 (1971).
- Booth, R. F., Clark, J. B. A rapid method for the preparation of relatively pure metabolically competent synaptosomes from rat brain. Biochemical Journal. 176 (2), 365-370 (1978).
- Takamori, S., Riedel, D., Jahn, R. Immunoisolation of GABA-specific synaptic vesicles defines a functionally distinct subset of synaptic vesicles. Journal of Neuroscience. 20 (3), 4904-4911 (2000).
- Burger, P. M., et al. Synaptic vesicles immunoisolated from rat cerebral cortex contain high levels of glutamate. Neuron. 3 (6), 715-720 (1989).
- Blondeau, F., et al. Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling. Proceedings of the National Academy of Sciences of the United States of America. 101 (11), 3833-3838 (2004).
- Maycox, P. R., Link, E., Reetz, A., Morris, S. A., Jahn, R. Clathrin-coated vesicles in nervous tissue are involved primarily in synaptic vesicle recycling. Journal of Cell Biology. 118 (6), 1379-1388 (1992).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved