Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
쥐의 뇌로부터 시냅스 성분의 분리를 위한 세포하 분획
이 프로토콜은 마우스 뇌에서 고순도 시냅토솜, 시냅스 소포 및 기타 시냅스 분획을 얻는 강력하고 상세한 방법을 제시합니다. 이 방법은 단백질 국소화의 생화학적 분석을 포함한 시냅스 과정의 평가 및 구획 분해능을 통한 기능을 가능하게 합니다.
시냅스 말단은 신경 통신의 주요 부위입니다. 시냅스 기능 장애는 많은 신경 정신병 및 신경 장애의 특징입니다. 따라서 생화학 적 분리에 의한 시냅스 하위 구획의 특성화는 건강과 질병 모두에서 시냅스 과정의 분자 염기를 설명하는 강력한 방법입니다. 이 프로토콜은 세포 내 분획에 의해 마우스 뇌로부터 시냅스 말단 및 시냅스 하위 구획의 분리를 설명합니다. 첫째, 시냅토솜으로 알려진 밀봉된 시냅스 말단 구조는 뇌 조직 균질화 후 분리됩니다. 시냅토솜은 꼬집어지고 밀봉된 막이 있는 시냅스 전후 뉴런 구획입니다. 이러한 구조는 대사 활성 상태를 유지하며 시냅스 구조와 기능을 연구하는 데 유용합니다. 그런 다음 시냅토솜을 저장성 용해 및 초원심분리하여 시냅스 소포, 시냅스 세포질 및 시냅스 원형질막에 대해 풍부한 시냅스 하위 구획을 얻습니다. 분획 순도는 시냅스 구획에 특이적인 단백질에 대한 전자 현미경 및 생화학적 농축 분석에 의해 확인됩니다. 제시된 방법은 시냅스의 구조적 및 기능적 특성과 다양한 뇌 질환의 분자 병인을 연구하기위한 간단하고 가치있는 도구입니다.
시냅스는 뉴런이 통신하고 다양하고 정교하게 복잡한 기능을 발휘하는 뇌의 기본 계산 단위입니다. 따라서 시냅스는 뇌 건강의 기본입니다1; 시냅스 기능 장애는 많은 장애의 원인 또는 결과로 연루됩니다2. 시냅스는 시냅스 접착 분자에 의해 횡단되는 시냅스 틈새에 의해 밀접하게 부착되고 분리되는 두 개의 다른 뉴런의 확장인 시냅스 전후 말단으로 구성됩니다. 정보는 신경 전달 물질1이라고하는 화학 메신저의 형태로 시냅스 전후 구획에서 시냅스 후로 흐릅니다. 신경 전달과 관련된 분자 과정은 활발한 연구 분야입니다 3,4,5. 시냅스 말단 내의 병원성 과정과 다른 신경 하위 구획의 병리에 대한 시냅스의 반응을 이해하는 것은 뇌 장애를 해결하는 중요한 단계입니다 1,2. 주로 쥐 모델에 적용되는 몇 가지 방법 론적 발전은이 추구를 발전 시켰습니다6. 차등 원심분리에 의한 시냅스 분획의 분리는 건강과 질병의 시냅스 과정을 자세히 평가할 수 있게 한 패러다임 전환 방법 중 하나입니다.
성인 인간의 뇌는 80-900억 개의 뉴런으로 구성되어있습니다(7,8). 쥐 종 중에서 쥐의 뇌에는 약 ~2억 개의 뉴런이 있는 반면 쥐는 ~7천만 개의 9,10을 가지고 있습니다. 각 뉴런은 신경교 세포 및 조밀 한 혈관 구조와 혼합 된 고도로 편광 된 뉴런 네트워크와 수천 개의 특정 시냅스 연결을 형성합니다. 이러한 복잡하고 이질적인 조직에서 시냅스를 독립적 인 시스템으로 분리하고 연구하는 것은 한때 생각할 수 없었습니다. 1960년대에 Victor Whittaker, Catherine Hebb 및 다른 사람들은 세포하 분획 11,12,13,14를 사용하여 손상되지 않은 시냅스 말단을 분리함으로써 이를 가능하게 했습니다. 시냅스 소포 (SV)를 분리하려는 시도에서, 그들은 등삼 투 (0.32 M) 자당에서 액체 전단력을 통해 뇌를 균질화하고 초 원심 분리를 통해 뇌를 균질화했다. 그들은 꼬집어 진 원형질막으로 둘러싸인 손상되지 않은 신경 말단 또는 정맥류를 얻었으며,이를 신경 종말 입자 (NEP)라고 불렀습니다 11,13. 시냅스의 구조적 및 기능적 특성이 이러한 구조에서 보존됨에 따라 NEP는 나중에 다른 세포 내 세포 기관과의 일치를 위해 "시냅토솜"이라고 불렸습니다13,15. "시냅스 소포"라는 용어를 만든 Eduardo de Robertis와 동료들의 연구가 Whittaker와 동료들의 연구와 겹쳐서 "시냅스 토솜"분리 및 특성화16,17,18의 검증에 기여했다는 점은 주목할 가치가 있습니다.
시냅토솜은 신경 전달 물질13,18의 저장, 방출 및 재흡수에 필요한 모든 세포 및 분자 특성을 포함하는 생리학적 활성 구조입니다. 시험관 내에서 주요 시냅스 특성을 보존하고 비 시냅스 구성 요소가없는 것도 이러한 분리 방법의 유용성에 기여합니다. 시냅토솜은 신경 전달의 화학적 및 생리적 특성에 대한 이해에 크게 기여했으며 현재 시냅스 분자 과정과 질병 19,20,21,22,23에서의 변화를 연구하는 데 사용되고 있습니다. 시냅토솜은 또한 SV, 클라 트린 코팅 소포 (CCV), 시냅스 세포질, 시냅스 원형질막, 시냅스 미토콘드리아, 시냅스 접착 분자 및 기타 관심 성분과 같은 시냅스 구성 요소를 분리하기위한 초기 소스 물질이며, 이는 시냅스 기능의 분자 메커니즘의 이해를 용이하게 할 수 있습니다 18,19,20,24,25,26, 27,28. 이들 시냅스 하부 성분은 시냅토좀의 삼투압 용해 및 슈크로스 밀도 구배 초원심분리15,29에 의해 수득될 수 있다. Whittaker의 연구 그룹에 의한 원래의 세포 내 분획 방법은 양질의 시냅토솜 및 SV 13,30을 분리하는 데 효율적인 것으로 알려져 있지만, 최근의 최적화는 세포 내 분획 22,23,31,32의 순도를 향상시킵니다. 이 기사는 시냅토솜, SV 및 기타 시냅스 이하 구성 요소를 분리하기 위해 쥐 뇌 조직의 세포하 분획에 대한 고전적인 프로토콜의 매우 상세하고 접근 가능한 버전을 제공합니다.
마우스를 대상으로 한 모든 실험은 예일 대학교의 기관 동물 관리 및 사용 위원회(IACUC)(프로토콜 2021-11117)의 승인을 받았으며 국제 실험실 동물 관리 평가 및 인증 협회(AAALAC)의 인증을 받은 시설에서 수행되었습니다. 동물 관리 및 주거는 실험실 동물 관리 및 사용 가이드33 을 준수했으며 예일 동물 자원 센터 (YARC)에서 제공했습니다. 동물들은 음식과 물에 자유롭게 접근할 수 있는 12시간의 명암주기로 유지되었습니다. 유전자형 또는 조건 당 5 내지 8마리의 마우스 또는 2 내지 4마리의 래트가 하기 프로토콜에 대해 요구된다. 더 적은 수의 쥐가 뇌의 부피로 인해 필요합니다. 유사하게, 실험 동물의 나이는 분획 수율에 영향을 미칠 수 있고; 2 개월 미만의 나이에 추가 마우스가 필요할 수 있습니다. 그렇지 않으면, 설명 된 절차는 쥐 종과 모든 연령의 건강한 성인 동물 모두에게 적용됩니다. 이 연구에서 제시된 대표적인 데이터는 상업적 출처에서 얻은 야생형 (C57BL / 6J) 마우스 (생후 = 2 개월, 복제 당 수컷 4 명과 암컷 4 명)를 활용했습니다 ( 재료 표 참조).
1. 실험 준비
참고: 이 프로토콜은 단일 연구원이 완료하는 데 ~11시간이 필요합니다. 해당되는 경우 프로토콜 실행 전날 벤치탑 설정(그림 1), 버퍼 준비(표 1), 원심분리기 및 로터를 4°C로 사전 냉각, 필요한 재료 및 장비의 수집 및 라벨링( 재료 표 참조)을 완료하는 것이 좋습니다.
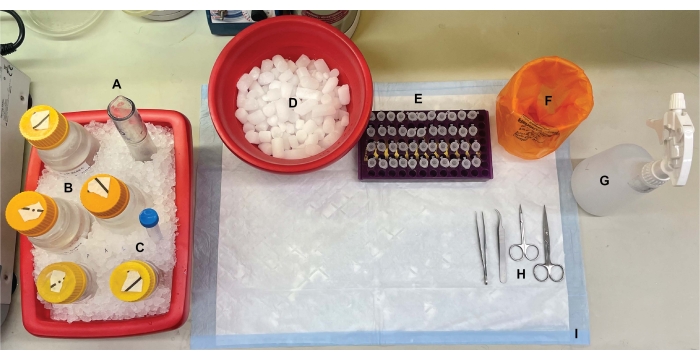
그림 1: 벤치탑 설정. 뇌 해부 전에, (A) Dounce 유리 균질화기 및 (B) 모든 완충액을 얼음 위에서 냉각시켰다. (c) 프로테아제 억제제 스톡 용액을 얼음 상에서 해동시켰다. 원심분리 튜브용 습식 얼음의 제2 용기, 액체 질소의 듀어(도시되지 않음), 및 (D) 액체 질소에서 급속 냉동된 샘플의 단기 저장을 위한 드라이아이스 용기가 수득되었다. (E) 이 절차 동안 유전자형 또는 조건당 각 세포내 분획 샘플의 4개의 분취량이 수집되었기 때문에 모든 샘플에 대해 미세 원심분리 튜브가 사전 라벨링되었습니다(시간 절약 팁: 실험 수행 전날 모든 튜브에 철저히 라벨링). (F) 적절한 생물학적 위험 폐기물 용기, (G) 70 % 에탄올, (H) 수술 도구 및 (I) 흡수성 표면 패드. 필요한 원심분리기 튜브와 일회용품은 프로토콜 구현 중에 효율적인 접근을 위해 따로 보관되었습니다(표시되지 않음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 수술을 위해 벤치 탑을 준비하고 뇌 절제에 필요한 가위와 집게를 수집하십시오 ( 재료 표 참조). 마우스 꼬리 생검을 위한 사전 라벨링 1.5mL 마이크로 원심분리 튜브와 수집된 분획당 4개의 튜브( 그림 2에 설명된 대로).
- 습식 얼음 용기 2 개, 드라이 아이스 용기 1 개, 벤치 탑 액체 질소 듀어 플라스크를 얻습니다.
- 얼음 위의 페닐메틸설포닐플루오라이드(PMSF), 펩스타틴 A, 아프로티닌 및 류펩틴 스톡 용액 해동( 재료 표 참조). 필요한 버퍼를 준비합니다(표 1).
참고: 자당 용액은 미리 준비하여 4°C에서 보관할 수 있습니다. 그러나 프로테아제 억제제 (해동 된 스톡 및 정제)는 수용액에서 이러한 시약의 불안정성으로 인해 실험 시작시 모든 완충액에 신선하게 첨가해야합니다. 또한, 모든 완충액은 온전한 시냅토좀의 수집을 가능하게 하기 위해 무세제 유리 제품과 무세제 물로 준비되어야 합니다. - 얼음 위에서 모든 완충액과 유리 Dounce 균질화기( 재료 표 참조)를 식힙니다. 원심분리기를 4°C로 설정하고 로터를 4°C로 냉각합니다.
- 14mL의 완충액 A(표 1)를 얼음 위의 Dounce 균질화기에 추가합니다.
표 1: 세포내 분획화 완충액의 조성. 이 표를 다운로드하려면 여기를 클릭하십시오.
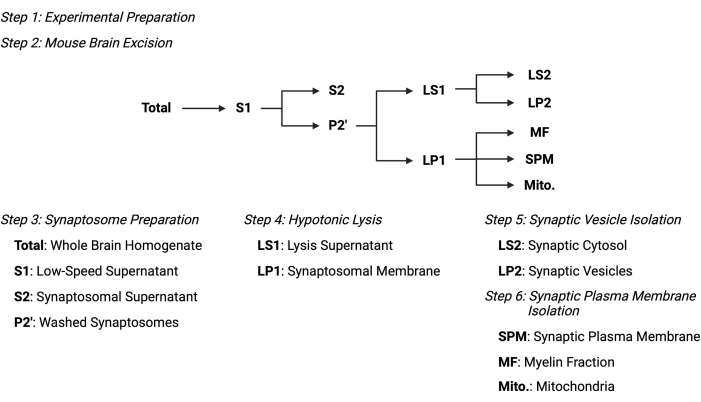
그림 2: 세포하 분획 프로토콜의 개요. 세포하 분획화 단계 및 수집된 샘플의 요약 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 마우스 뇌 절제
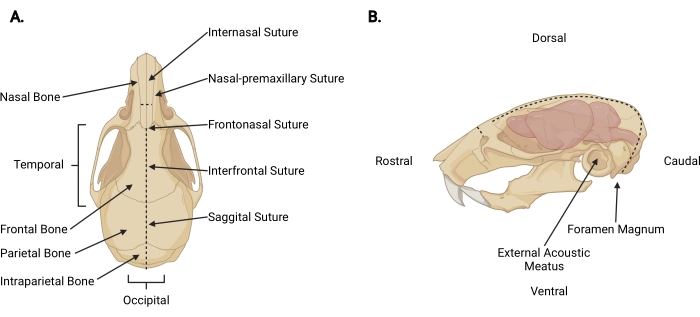
그림 3: 두개안면 해부학. (A) 관련 두개골 구조가 표시된 마우스 두개골의 등쪽 보기. (B) 관련 두개골 구조와 해부학적 방향이 표시된 마우스 두개골과 뇌의 왼쪽 측면도. 점선은 절개해야 할 위치를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 오픈 드롭 방법34를 사용하여 흄 후드 또는 생물안전 캐비닛에 위치한 마취 챔버에서 각 마우스를 100% 이소플루오란으로 깊이 마취시킨다. 경추 탈구로 각 마우스를 희생 한 다음 신속하게 참수하십시오. 각 희생 및 해부에 대한 유전자형 또는 실험 그룹 간 교대12. 안락사 후 꼬리 끝의 2mm를 가위로 절제하여 꼬리 생검을 받으십시오. 유전형 분석을 위해 조직을 보관하십시오.
- 해부 중에 머리카락이 조직과 수술 도구에 달라 붙지 않도록 목이 잘린 머리에 70 % 에탄올을 뿌립니다.
- 참수 절개 부위에서 피부 아래에 미세한 가위를 두개 깊이까지 삽입하고 비강 간 봉합사까지 중간 시상 절개 (그림 3A)를 수행하여 두개골에서 두피를 수축시킵니다.
- 후두 영역에서 각 측두적 측면을 향해 작업하면서 근막과 근육을 다듬어 각 외부 음향 고기 너머로 두개골의 외부 표면을 노출시킵니다(그림 3B).
- 지배적이지 않은 손으로 두피와 두개골의 측면을 고정하십시오. 다른 하나는 척수가 나가는 것을 볼 수있는 구멍 매그넘의 꼬리쪽에 2mm의 가위를 삽입합니다. 가위가 정수리 뼈의 내부 표면에 도달 할 때까지 정중선 절개를하십시오 (그림 3, 점선).
알림: 초기 절개 중에 가위는 뇌간과 소뇌의 손상을 방지하기 위해 두개골의 내부 표면쪽으로 압력을 가하여 척수와 평행해야합니다. - 칼날이 두개골의 등쪽 표면과 평행을 이루도록 가위의 각도를 변경하십시오. 시상과 전두엽 봉합사를 가이드로 사용하여 정수리 및 전두골을 통해 주둥이로 중간 시상 절개를 계속 전진시킵니다. 피질의 손상을 피하기 위해 일정한 상향 압력을 사용하십시오. 비강 봉합사 바로 너머의 절개를 종료합니다 (그림 3A).
- 각 날이 비강-상악 전 봉합사에 위치하도록 가위를 두개골에 수직으로 놓고 고르게 절단하여 비강 뼈에 작은 수직 절개 (~ 3mm)를, 주둥이를 비강 간 봉합사에 만듭니다 (그림 3, 점선).
알림: 이 단계는 두개골을 쉽게 수축시킬 수 있으며 이 영역에 관심이 있는 경우 후각 구를 수집하는 데 중요합니다. - 측면을 고정하면서 한 쌍의 질감이있는 집게의 한쪽을 사용하여 두개골을 뇌에서 부드럽게 들어 올린 다음 측면 및 복부로 들어 올립니다. 필요에 따라 정중선을 따라 반복 한 다음 전체 뇌 표면이 노출 될 때까지 다른 반구에 대해 반복합니다.
- 구부러진 집게 또는 가는 주걱을 사용하여 뇌의 쪽을 부드럽게 들어 올립니다. 시신경과 뇌신경을 절단하여 두개골에서 절제를 완료하십시오.
- 각 조건에 대해 5-8 개의 마우스 뇌를 14mL의 완충액 A를 포함하는 냉각 유리 Dounce 균질 기에 함께 수집합니다 (표 1).
3. 시냅토솜 제제
주: 이 절차의 회로도는 그림 4에 나와 있습니다.
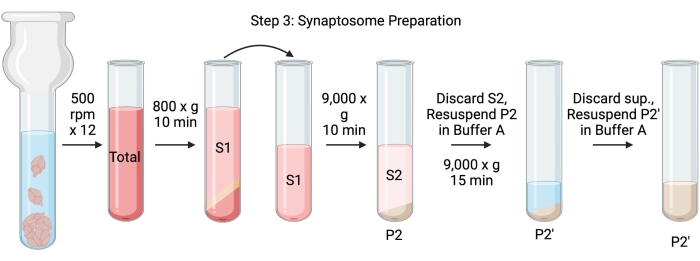
그림 4: 시냅토솜 준비. 3단계의 도식, 시냅토좀의 생성(P2'). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 유리 Dounce 균질화기를 사용하여 500 rpm (총)에서 12 개의 상하 통과로 뇌를 균질화합니다. 조직의 철저한 균질화를 보장하기 위해 각 다운스트로크에서 잠시 멈춥니다. 온난화와 단백질 변성을 피하기 위해 얼음 욕조에서 우선적으로 균질화하십시오. 비신코닌산 분석법(BCA, 재료 표 참조)에 의한 단백질 농도 측정을 위해 5μL 분취량을 취합니다. 웨스턴 블롯 (WB)을 위해 100 μL의 전체 뇌 용해물 분취량을 취하십시오. 이 샘플과 모든 후속 샘플(그림 2)의 경우 BCA에 대해 2개의 분취량을 취하고 WB에 대해 2개의 분취량을 취합니다. 수집된 모든 분취량을 액체 질소에 급속 냉동하고 -80°C에서 보관하십시오.
- 전체 뇌 균질액을 고속 둥근바닥 원심분리 튜브(14 mL)( 재료 표 참조)에서 800 x g 에서 4°C에서 10분 동안 스핀시켜 상층액을 얻었다(S1). S1을 새로운 원심분리 튜브로 옮기고 손상되지 않은 세포와 핵을 포함하는 펠릿 (P1)을 남겨 둡니다. 푹신하고 흰색이며 느슨하고 표면적인 펠릿을 피펫팅하지 마십시오. BCA의 경우 2 x 5 μL의 S1을, WB의 경우 2 x 100 μL의 S1을 섭취하십시오.
- S1을 9,000 x g 에서 4°C에서 15분 동안 스핀시켜 시냅토솜 상층액(S2)과 미정제 시냅토솜 펠렛(P2)을 얻었다. BCA의 경우 2 x 10 μL의 S2를, WB의 경우 2 x 500 μL의 S2를 섭취하십시오. 분취량을 얻은 후 상청액을 버리고 펠릿으로 다음 단계로 진행하십시오.
- P2를 프로테아제 억제제와 함께 얼음처럼 차가운 완충액 A 3mL에 재현탁하고 4°C에서 15분 동안 9,000 x g 에서 원심분리하여 상청액(S2') 및 세척된 시냅토좀(P2')을 얻습니다. 상청액을 버리고 펠릿을 보관하십시오.
- 3mL의 완충액 A에 P2'를 재현탁하십시오. 주로 미토콘드리아를 포함하는 펠릿 바닥의 진한 빨간색 부분을 재현탁하지 마십시오. BCA의 경우 2 x 20 μL의 P2'를, WB의 경우 2 x 100 μL의 P2'를 섭취하십시오.
알림: 이것은 펠릿의 가장자리와 표면을 부드럽게 피펫 혼합하여 흰색으로 세척된 시냅토좀을 다시 부유시키면서 피펫 팁을 펠릿의 빨간색 중심에서 멀어지게 하여 달성할 수 있습니다.
4. 최전 용해
참고: 이 절차의 회로도는 그림 5에 나와 있습니다.
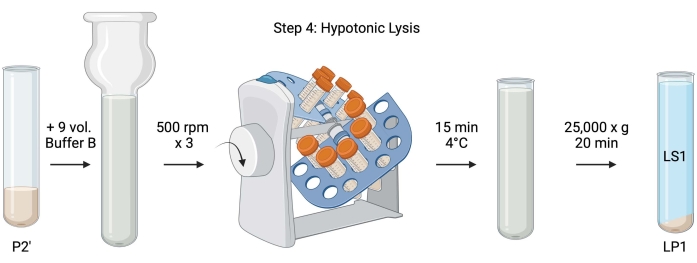
그림 5: 염기성 용해. 단계 4의 도식은, 시냅토좀의 저장성 용해를 통해 용해 상층액(LS1)과 시냅토솜 막 분획(LP1)을 생성한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 세척된 시냅토좀의 저장성 용해를 위해 9부피의 냉각된 완충액 B(표 1)를 재현탁 P2'(~27mL)에 추가합니다. 시냅토좀을 유리 Dounce 균질화기에서 균질화한다(500 rpm에서 3개의 상하 통과).
- 샘플을 50mL 캡이 있는 원뿔형 원심분리 튜브로 옮깁니다. 4°C 냉장실의 튜브 리볼버에서 15분 동안 회전시킵니다.
- P2'를 25,000 x g 에서 4°C에서 20분 동안 원심분리하여 용해 상층액(LS1) 및 시냅토솜막(LP1)을 포함하는 용해 펠렛을 얻었다. BCA의 경우 LS1 2 x 50 μL, WB의 경우 LS1 2 x 400 μL를 복용하십시오. 초원심분리를 위해 LS1을 캡이 있는 원심분리기 튜브로 옮깁니다( 재료 표 참조).
5. 시냅스 소포 분리
주: 이 절차의 회로도는 그림 6에 나와 있습니다.
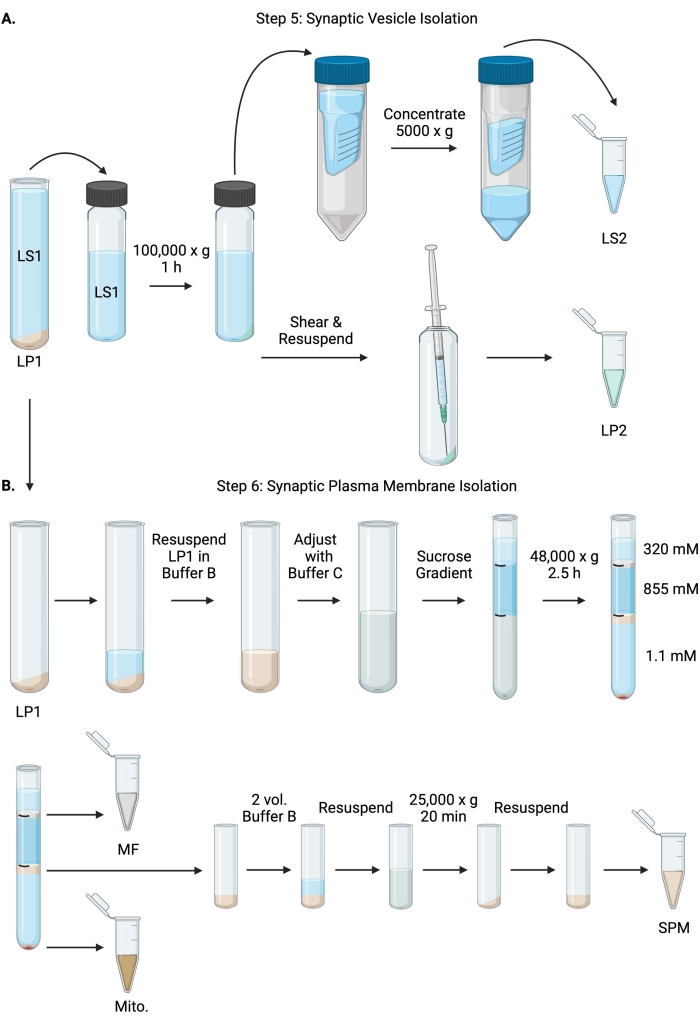
그림 6: 시냅스 소포 분리 및 시냅스 원형질막 분리. (a) 단계 5, 시냅스 세포질 (LS2) 및 시냅스 소포 (LP2) 분획의 분리, 및 (B) 단계 6, 수크로스 구배의 초원심분리에 따른 미엘린(MF), 시냅스 원형질막(SPM) 및 미토콘드리아(Mito.) 분획의 생성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 고정각 초원심분리 로터( 재료 표 참조)에서 LS1을 100,000 x g 에서 4°C에서 60분 동안 원심분리하여 시냅스 시토졸 상청액(LS2) 및 시냅스 소포 펠릿(LP2)을 얻습니다. LP2는 작고 반투명하며 원심 분리기 튜브의 측면에 강하게 부착됩니다.
- LP2를 500μL의 완충액 A에 재현탁합니다. 23G 바늘과 1mL 주사기를 사용하여 부드러운 분쇄로 LP2를 전단합니다. BCA의 경우 2 x 10 μL의 LP2를, WB의 경우 2 x 250 μL의 LP2를 섭취하십시오.
- LS2(~30mL)를 10kDa 컷오프가 있는 원심 필터 장치로 옮깁니다( 재료 표 참조).
참고: 10kDa보다 작은 단백질에 관심이 있는 경우 4kDa 차단 원심 필터 장치를 사용할 수 있지만 스핀 시간이 더 길어집니다. - LS2를 4°C에서 최대 1시간 동안 5000 x g 에서 방사하여 약 0.5mL로 농축합니다. BCA의 경우 농축 LS2 2 x 10 μL, WB용 농축 LS2 2 x 250 μL를 섭취합니다. 스핀을 시작한 후 6.1 단계로 바로 진행하십시오.
6. 시냅스 원형질막 분리
- 1mL의 버퍼 B에 LP1(단계 4.3)을 재현탁합니다(표 1). BCA의 경우 2 x 10 μL의 LP1을, WB의 경우 2 x 50 μL의 LP1을 섭취하십시오. 나머지 LP1을 완충액 B 및 완충액 C를 사용하여 최종 부피 7.5mL 및 최종 자당 농도 1.1M으로 조정합니다(표 1).
- 재현탁된 LP1 7.5mL를 14mL 초원심분리 튜브에 옮깁니다( 재료 표 참조). LP1을 3.75mL의 버퍼 D(표 1)로 조심스럽게 오버레이한 다음 1.25mL의 버퍼 A(또는 원심분리 튜브 상단 바로 아래에 채울 더 큰 부피)로 오버레이합니다. 자당 그래디언트 인터페이스를 방해할 수 있는 튜브 측면 아래로 피펫팅을 피하십시오. 각 자당 분획을 오버레이 한 후 용액의 상단을 펜으로 표시하십시오. 초원심분리를 위한 튜브의 균형을 부피가 아닌 무게로 맞추고 버퍼 A를 10mg 이내로 적가합니다. 스윙 버킷 초원심분리기 로터에서 4°C에서 2.5시간 동안 48,000 x g 로 원심분리합니다( 재료 표 참조).
- 초원심분리 후 손상되지 않은 그래디언트의 이미지를 획득하여 각 자당 계면의 구별성과 분획의 성공을 문서화합니다.
- 320 mM 수크로오스(완충액 A)의 표재성 층을 조심스럽게 제거한다. 800 μL 부피의 320 mM/855 mM 자당 계면에서 미엘린 분획(MF)을 회수합니다. 1,000 μL 부피의 855 mM/1.1 M 자당 계면에서 시냅스 원형질막(SPM) 분획을 회수합니다. 튜브 벽에서 각 분획을 원형으로 피펫팅하여 완전한 분획이 수집되도록 합니다. 남은 슈크로스를 조심스럽게 흡인하고 200μL의 완충액 B에 재현탁하여 미토콘드리아 펠릿(Mito.)을 회수합니다. BCA의 경우 MF 2 x 100 μL와 미토 2 x 10 μL를 섭취하십시오. BCA의 경우; MF와 미토의 나머지를 나눕니다. WB의 경우 절반으로 샘플을 채취합니다.
- SPM 분획을 2부피의 버퍼 B(~2mL)로 희석한 다음 3.5mL 원심분리 튜브( 재료 표 참조)의 고정각 로터에서 25,000 x g 로 4°C에서 20분 동안 원심분리합니다. 상청액을 버리고 SPM 펠릿을 완충액 A에 재현탁하여 최종 부피 250μL로 만듭니다. BCA의 경우 2 x 5 μL의 SPM을 취하고 나머지 SPM을 WB의 경우 반으로 나눕니다.
- BCA를 수행하여 가변 분취량 부피를 고려하여 각 샘플의 단백질 농도를 결정합니다.
참고: WB 분석의 경우 모든 세포하 분획에 대해 권장되는 작동 단백질 농도는 2μg/μL(또는 LS1 및 MF에 대해 달성할 수 있는 수준)입니다.
제시된 방법은 추가 정제 및 다양한 형태의 하류 분석(35,36)을받을 수있는 11 개의 뇌 세포 내 분획을 생성한다. 시냅토솜, SVs23 및 기타 구성 요소의 품질을 평가하는 황금 표준 방법은 전자 현미경(EM)입니다(그림 7). 특정 세포하 분획에 존재하는 단백질에 대한 정량적 면역블로팅을 수행하여 분획 순도의 마커를 평가할 수도 있습니다(그림 8). 예를 들어, 분획의 면역블롯 분석은 시냅스 세포막 분획(SPM)에서 N-카드헤린(CDH2, UniProt 이름), 시냅스 세포질(LS2)에서 α-시누클레인(SYUA), 시냅스 소포 분획(LP2)에서 시냅토피신(SYPH), 초기 전뇌 균질액(Total)의 단백질 수준과 비교할 때 미엘린 분획(MF)의 미엘린 염기성 단백질(MBP)의 농축을 보여줍니다(그림 8 ). 일단 분획 순도가 확립되면(예를 들어, LS2 분획에 CDH2가 없거나 LP2 분획에서 SYPH가 몇 배 증가한 것에 주목), 정량적 면역블로팅을 사용하여 관심 단백질의 국소화를 결정하거나 유전자형 또는 치료 간 단백질 분포의 차이를 질의할 수 있다. 시냅스 단백질의 세포 내 국소화를 이해하면 이전에 설명되지 않은 단백질 기능의 해부가 가능할 수 있습니다. 또한, 이 방법은 특히 기능적 분석과 쌍을 이룰 때 질병 상태에서의 트래피킹 결함 또는 시냅스 기능 장애를 해명할 수 있다. 예를 들어, 우리 팀은 이 방법을 사용하여 시냅스 세포질19가 풍부한 효소 활성 팔미토일 단백질 티오에스테라제 1 풀을 확인했습니다.
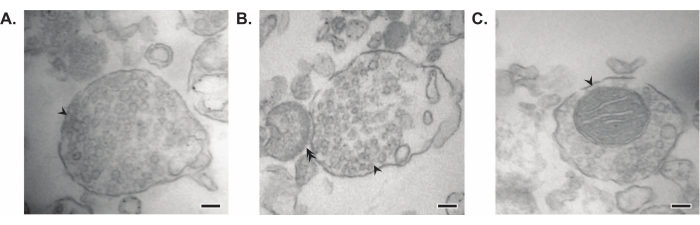
그림 7: 시냅토좀의 전자 현미경(EM). (A) 시냅스 소포를 포함하는 시냅토좀의 대표적인 EM 이미지(화살표). (B) 사전 (화살표) 및 시냅스 후 구성 요소 (이중 화살표)가있는 시냅 토좀의 대표적인 EM 이미지. (c) 시냅스 소포 및 미토콘드리아를 포함하는 시냅토좀의 대표적인 EM 이미지(화살표)(scale bar = 100 nm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
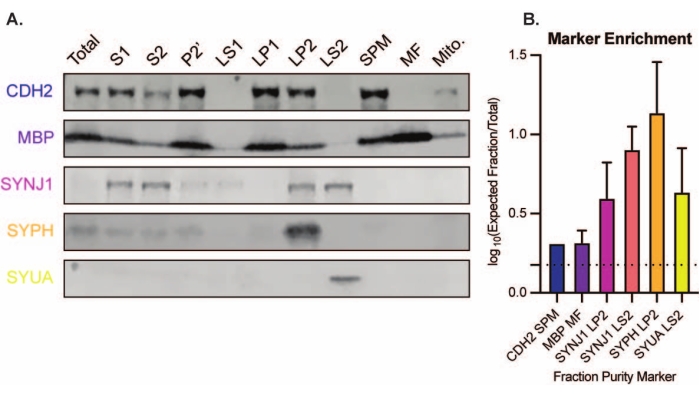
그림 8: 세포하 분획의 면역블롯 분석. (A) 세포 내 분획 순도의 마커 (UniProt 명명법으로 표시됨)는 전체 뇌 균질 액 (총계)에 비해 적절하게 국소화됩니다 : 시냅스 원형질막 분획 (SPM)의 N- 카드 헤린 (CDH2), 시냅스 소포 농축 분획 (LP2)의 시냅스 피신 1 (SYPH) 및 시냅토 자닌 1 (SYNJ1), 시냅스 세포질 (LS2)의 α- 시누 클레인 (SYUA), 및 미엘린 분획 (MF)의 미엘린 염기성 단백질 (MBP). (b) 면역블롯 정량화 분석은 분획 순도 마커의 농축(전체로부터의 폴드-변화)을 나타낸다. 데이터는 log10 척도에서 평균 ± 표준 편차로 표시됩니다. 점선은 1.5배 변화(y=0.176)를 나타낸다(8마리의 야생형 마우스를 대상으로 한 n=3회 반복 실험; 연령=2개월; SYPH, SYUA, MBP에 대한 n = 4-5 블롯, Gorenberg et al.19에 의해 이전에 발표된 n=3개의 플롯된 값; SYNJ1의 경우 n=5; CDH2의 경우 n=1). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그들의 정액 연구에서 Whittaker와 동료들은 시냅 토솜을 확인하기 위해 네 가지 형태 학적 기준을 사용했습니다 : (1) 구조는 밀폐 된 원형질막을 가지고 있습니다. (2) 구조는 크기와 수면에서 신경 말단 및 정맥류와 유사한 SV를 포함합니다. (3) 구조가 하나 이상의 작은 미토콘드리아를 소유하고; (4) 시냅스 전 막은 시냅스 후 성분11,12,13에 자주 부착됩니다. 처음 두 가지 기준은 일반적으로 모든 분리 방법에 적용되지만이 기사에서 설명한 가장 최근의 프로토콜에서 모든 결과 시냅토솜이 미토콘드리아와 연결된 시냅스 후 말단을 갖는 것은 아닙니다. 시냅토솜의 약 60 %는 미토콘드리아를 가질 것이며, 최대 15 %만이 시냅스 후 말단37을 부착 한 것으로 추정된다. 시냅스 후 구성 요소가 특히 관심이있는 경우, 등장 성 Krebs와 같은 균질화 완충액과 농축을위한 압력 여과를 사용하면 시냅스 후 말단 (시냅토 뉴로솜이라고도 함)을 가진 고농도의 시냅토솜을 생성하는 것으로 알려져 있습니다 22,38.
동물을 희생시키는 방법은 시냅 토솜과 시냅스 하위 분획의 품질에 영향을 줄 수 있습니다. 마취를 필요로하지 않는 안락사 방법을 사용하여 희생 된 성인 동물은 최상의 분획 품질을 얻을 것입니다. 또한, 뇌는 동결되지 않고 신선하게 해부되어야하며, 가장 생존 가능한 시냅스 분획22에 대해 균질화 완충액 (무게 / 부피)의 1:10 비율을 사용하여 균질화되어야합니다. 뇌에는 운반하는 신경 전달 물질의 유형에 따라 구별 될 수있는 이질적인 시냅스 집단이 있습니다. 시냅토솜 형성은 일반적으로 시냅스 유형 또는 신경전달물질 함량13에 의해 영향을 받지 않는다. 예외는 소뇌의 이끼 섬유이며, 이는 뇌의 나머지 부분에서 시냅토좀을 얻기위한 최적의 조건에서 파괴되는 것으로 알려져 있습니다39,40. 따라서이 영역의 배제가 실험 목표에 영향을 미치지 않는 경우 뇌 균질화 전에 소뇌를 제거하는 것이 좋습니다. 특정 신경 전달 물질 특성의 시냅 토솜을 분리하는 데 관심이있는 경우 관심있는 신경 전달 물질을 포함하는 뉴런에 대해 풍부한 뇌 영역을 먼저 분리 할 수 있습니다. 그러나이 접근법은 관심 영역의 크기에 따라 최종 분획 수율에 제한을 부과합니다 (따라서 동물의 나이도 고려 사항입니다). 신경 전달 물질 특이 적 시냅토좀을 분리하기위한 면역 화학적 방법이 있지만 생존력과 수율이 크게 손상 될 것입니다22. 시냅토솜 대사 생존능을 평가하는 것이 중요한 경우, 신경전달물질 방출(41,42) 또는 특정 효소 분석(43)의 측정이 사용될 수 있다.
시냅토솜 제제의 일반적인 오염 물질에는 마이크로솜, 유리 미토콘드리아, SV, 신경 및 신경교막이 포함됩니다. 오염은 P1 및 P2 분획22에서 세척 횟수를 증가시키고 후속 단계에서 적색 미토콘드리아 펠릿의 재현탁을 피함으로써 감소될 수 있다. 대사 생존력과 시간이 중요한 실험에서는 세척 횟수를 줄이고 자당 구배에 대해 Ficoll 또는 Percoll 구배를 사용하는 것이 도움이 될 것입니다44,45,46. 이러한 방법은 또한 오염을 크게 줄입니다. Whittaker의 원래 프로토콜은 고품질 SV를 산출했습니다. 이 방법에 포함된 Nagy et al.23에 의한 추가 최적화는 수율36을 크게 손상시키지 않으면서 놀라운 균질성과 순도를 가진 SV를 생성합니다. 글루타메이트성(VGLUT-1 함유) 또는 GABAergic (VGAT-1 함유) SV와 같은 특정 SV 아형이 관심의 대상인 경우, 특정 항체를 사용한 면역단리를 수행할 수 있다(47,48). 시냅토좀으로부터 CCV를 단리하기 위한 대안적인 방법이 또한 이용가능하며, 이는 차등 밀도로 인해, 이 방법(20,49,50)으로 수득된 SV와 동일한 계면에 존재하지 않을 수 있다.
전반적으로, 시냅스 성분을 단리하는 본 프로토콜은 공급원 뇌 조직의 질 및 양 및 실험 목표에 기초하여 개선된 균질성 및 생존성을 갖는 분획을 수득하도록 추가로 최적화될 수 있다. 자세한 문제 해결에 대해서는 Dunkley and Robinson22 및 Ganzella et al.36의 책 장을 참조해야 합니다.
저자는 공개 할 것이 없습니다.
EM 이미지 준비에 대해 P. Colosi에게 감사드립니다. 이 작업은 국립 보건원 (R01 NS064963, SSC; R01 NS110354, SSC; R01 NS083846, SSC; R21 NS094971, SSC; T32 NS007224, 스마트 미디어 토큰; T32 NS041228, SMT), 미국 국방부(W81XWH-17-1-0564, SSC; W81XWH-19-1-0264, VDJ), 파킨슨병(ASAP) Collaborative Research Network(SSC) 및 Michael J. Fox Foundation Target Advancement Program(MJFF-020160, SSC & VDJ)에 걸쳐 과학 조정. 우리는 BioRender.com 사용하여 그래픽 일러스트레이션을 만들었습니다.
| Name | Company | Catalog Number | Comments |
| 1 mL TB Syringe | BD | 309649 | |
| 1.5 mL Eppendorf Tubes | USA Scientific | 1415-2500 | |
| 14 mL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter | 344060 | Compatible with SW 40 Ti |
| 23 Gauge Precision Glide Hypodermic Needle | BD | 305145 | |
| 26.3 mL, Polycarbonate Bottle with Cap Assembly | Beckman Coulter | 355618 | Compatible with Ti70 |
| 3.5 mL, Open-Top Thickwall Polypropylene Tube | Beckman Coulter | 349623 | Compatible with TLA-100.3 |
| 50 mL Falcon Tubes | Fisher Scientific | 14-432-22 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901024 | |
| Aprotinin | Sigma-Aldrich | A6279 | 1 mg/mL in diH2O |
| Avanti J-26 XP Centrifuge | Beckman Coulter | B22984 | <26,000 rpm |
| Benchtop HDPE Dewar Flask | Thermo Scientific | 5028U19 | |
| C57BL/6J Mice | The Jackson Labs | 000664 | |
| Centrifuge 5810R | Eppendorf | EP022628168 | <14,000 rpm |
| complete, Mini, EDTA-free Protease Inhibitor Cocktail Tablets | Roche | 11873580001 | Add 1 tablet per 50 mL of solution |
| Curved Forceps | Fine Science Tools | 11273-20 | |
| Fine Surgical Scissors | Fine Science Tools | 8r | |
| Glas-Col Tissue Homogenizing System | Cole-Parmer | UX-04369-15 | |
| Graefe Forceps | Fine Science Tools | 11650-10 | |
| High-Speed Polycarbonate Round Bottom Centrifuge Tubes | ThermoFisher | 3117-0500 | Compatible with JA20 |
| Isofluorane | Henry Schein Animal Health | NDC 11695-6776-2 | |
| JA-20 Rotor | Beckman Coulter | 334831 | |
| Leupeptin | American Bio | AB01108 | 1 mg/mL in diH2O |
| N-[2-Hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid] (HEPES) | American Bio | AB00892 | |
| Optima L-80 XP Ultracentrifuge | Beckman Coulter | <100,000 rpm | |
| Optima TLX Ultracentrifuge | Beckman Coulter | <120,000 rpm | |
| Pepstatin A | Thermo Scientific | 78436 | 1 mg/mL in DMSO |
| Phenylmethylsulfonyl fluoride (PMSF) | American Bio | AB01620 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23335 | For determination of protein concentration |
| Pipette Tips | |||
| Serological Pipettes | |||
| Sucrose | Sigma-Aldrich | S0389 | |
| Surgical Scissors | Fine Science Tools | 14002-12 | |
| SW 40 Ti Swinging-Bucket Rotor | Beckman Coulter | 331301 | |
| Teflon-Coated Pestle and Mortar Tissue Grinder | Thomas Scientific | 3431D94 | |
| Ti70 Rotor | Beckman Coulter | 337922 | |
| TLA-100.3 Rotor | Beckman Coulter | 349490 | |
| Tube Revolver | Dot Scientific | DTR-02VS |
- Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J., Education, A. J. Synaptic Transmission. Principles of Neural Science, Fifth Edition. , (2014).
- Lepeta, K., et al. Synaptopathies: synaptic dysfunction in neurological disorders - A review from students to students. Journal of Neurochemistry. 138 (6), 785-805 (2016).
- Südhof, T. C., Malenka, R. C. Understanding synapses: Past, present, and future. Neuron. 60 (3), 469-476 (2008).
- Südhof, T. C. The molecular machinery of neurotransmitter release (Nobel lecture). Angewandte Chemie International Edition. 53 (47), 12696-12717 (2014).
- Jahn, R., Boyken, J., Pfaff, D. W. Molecular Regulation of Synaptic Release. Neuroscience in the 21st Century: From Basic to Clinical. , 351-401 (2013).
- Xiong, H., Gendelman, H. E. . Current Laboratory Methods in Neuroscience Research. , (2014).
- Azevedo, F. A., et al. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology. 513 (5), 532-541 (2009).
- Herculano-Houzel, S. The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost. Proceedings of the National Academy of Sciences of the United States of America. 109, 10661-10668 (2012).
- Herculano-Houzel, S., Lent, R. Isotropic fractionator: A simple, rapid method for the quantification of total cell and neuron numbers in the brain. Journal of Neuroscience. 25 (10), 2518-2521 (2005).
- Herculano-Houzel, S., Mota, B., Lent, R. Cellular scaling rules for rodent brains. Proceedings of the National Academy of Sciences of the United States of America. 103 (32), 12138-12143 (2006).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron-microscopic study of cell fragments derived by homogenization and centrifugation. Journal of Anatomy. 96, 79-88 (1962).
- Gray, E. G., Whittaker, V. P. The isolation of synaptic vesicles from the central nervous system. Journal of Physiology. 153, 35-37 (1960).
- Whittaker, V. P. Thirty years of synaptosome research. Journal of Neurocytology. 22 (9), 735-742 (1993).
- Jahn, R., Fasshauer, D. Molecular machines governing exocytosis of synaptic vesicles. Nature. 490, 201-207 (2012).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from nerve-ending particles ('synaptosomes). Biochemical Journal. 90 (2), 293-303 (1964).
- De Robertis, E., Rodriguez De Lores Arnaiz, G., Pellegrino De Iraldi, A. Isolation of synaptic vesicles from nerve endings of the rat brain. Nature. 194, 794-795 (1962).
- De Robertis, E., Pellegrino De Iraldi, A., Rodriguez, G., Gomez, C. J. On the isolation of nerve endings and synaptic vesicles. The Journal of Biophysical and Biochemical Cytology. 9 (1), 229-235 (1961).
- Zimmermann, H., Whittaker, V. P., Murphy, K. M. The Discovery of the Synaptosome and Its Implications. Synaptosomes. , 9-26 (2018).
- Gorenberg, E. L., et al. Identification of substrates of palmitoyl protein thioesterase 1 highlights roles of depalmitoylation in disulfide bond formation and synaptic function. PLoS Biology. 20 (3), 3001590 (2022).
- Vidyadhara, D. J., et al. Dopamine transporter and synaptic vesicle sorting defects initiate auxilin-linked Parkinson's disease. bioRxiv. , (2022).
- Schrimpf, S. P., et al. Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry. Proteomics. 5 (10), 2531-2541 (2005).
- Dunkley, P. R., Robinson, P. J., Murphy, K. M. Synaptosome Preparations: Which Procedure Should I Use. Synaptosomes. , 27-53 (2018).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Research. 109 (2), 285-309 (1976).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127 (4), 831-846 (2006).
- Wagner, J. A., Kelly, R. B. Topological organization of proteins in an intracellular secretory organelle: the synaptic vesicle. Proceedings of the National Academy of Sciences of the United States of America. 76 (8), 4126-4130 (1979).
- Jahn, R., Schiebler, W., Ouimet, C., Greengard, P. A 38,000-dalton membrane protein (p38) present in synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 82 (12), 4137-4141 (1985).
- Binotti, B., Jahn, R., Pérez-Lara, &. #. 1. 9. 3. ;. An overview of the synaptic vesicle lipid composition. Archives of Biochemistry and Biophysics. 709, 108966 (2021).
- Siegel, D. P., Ware, B. R. Electrokinetic properties of synaptic vesicles and synaptosomal membranes. Biophysical Journal. 30 (1), 159-172 (1980).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from disrupted nervending particles. Biochemical Pharmacology. 12 (3), 300-302 (1963).
- Clementi, F., Whittaker, V. P., Sheridan, M. N. The yield of synaptosomes from the cerebral cortex of guinea pigs estimated by a polystyrene bead "tagging" procedure. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 72, 126-138 (1966).
- Carlson, S. S., Wagner, J. A., Kelly, R. B. Purification of synaptic vesicles from elasmobranch electric organ and the use of biophysical criteria to demonstrate purity. Biochemistry. 17 (7), 1188-1199 (1978).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. Journal of Cell Biology. 96 (5), 1374-1388 (1983).
- Hawkins, P., et al. A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Laboratory Animals. 45 (1), 1-13 (2011).
- Risling, T. E., Caulkett, N. A., Florence, D. Open-drop anesthesia for small laboratory animals. Canadian Veterinary Journal. 53 (3), 299-302 (2012).
- Deutsch, C., Drown, C., Rafalowska, U., Silver, I. A. Synaptosomes from rat brain: Morphology, compartmentation, and transmembrane pH and electrical gradients. Journal of Neurochemistry. 36 (6), 2063-2072 (1981).
- Ganzella, M., Ninov, M., Riedel, D., Jahn, R. Isolation of synaptic vesicles from mammalian brain. Methods in Molecular Biology. 2417, 131-145 (2022).
- Dunkley, P. R., et al. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: homogeneity and morphology of subcellular fractions. Brain Research. 441 (1-2), 59-71 (1988).
- Schwartz, R. D., Skolnick, P., Hollingsworth, E. B., Paul, S. M. Barbiturate and picrotoxin-sensitive chloride efflux in rat cerebral cortical synaptoneurosomes. FEBS Letters. 175 (1), 193-196 (1984).
- Pittaluga, A., Thellung, S., Maura, G., Raiteri, M. Characterization of two central AMPA-preferring receptors having distinct location, function and pharmacology. Naunyn-Schmiedeberg's Archives of Pharmacology. 349 (6), 555-558 (1994).
- Israël, M., Whittaker, V. P. The isolation of mossy fibre endings from the granular layer of the cerebellar cortex. Experientia. 21 (6), 325-326 (1965).
- Khvotchev, M., Lonart, G., Südhof, T. C. Role of calcium in neurotransmitter release evoked by alpha-latrotoxin or hypertonic sucrose. Neuroscience. 101 (3), 793-802 (2000).
- Lonart, G., Janz, R., Johnson, K. M., Südhof, T. C. Mechanism of action of rab3A in mossy fiber LTP. Neuron. 21 (5), 1141-1150 (1998).
- Nicholls, D. G., Sihra, T. S. Synaptosomes possess an exocytotic pool of glutamate. Nature. 321 (6072), 772-773 (1986).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nature Protocols. 3 (11), 1718-1728 (2008).
- Cotman, C. W., Matthews, D. A. Synaptic plasma membranes from rat brain synaptosomes: Isolation and partial characterization. Biochimica et Biophysica Acta. 249 (2), 380-394 (1971).
- Booth, R. F., Clark, J. B. A rapid method for the preparation of relatively pure metabolically competent synaptosomes from rat brain. Biochemical Journal. 176 (2), 365-370 (1978).
- Takamori, S., Riedel, D., Jahn, R. Immunoisolation of GABA-specific synaptic vesicles defines a functionally distinct subset of synaptic vesicles. Journal of Neuroscience. 20 (3), 4904-4911 (2000).
- Burger, P. M., et al. Synaptic vesicles immunoisolated from rat cerebral cortex contain high levels of glutamate. Neuron. 3 (6), 715-720 (1989).
- Blondeau, F., et al. Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling. Proceedings of the National Academy of Sciences of the United States of America. 101 (11), 3833-3838 (2004).
- Maycox, P. R., Link, E., Reetz, A., Morris, S. A., Jahn, R. Clathrin-coated vesicles in nervous tissue are involved primarily in synaptic vesicle recycling. Journal of Cell Biology. 118 (6), 1379-1388 (1992).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved