Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
Subcellulär fraktionering för isolering av synaptiska komponenter från murin hjärnan
Detta protokoll presenterar en robust, detaljerad metod för att erhålla mycket rena synaptosomer, synaptiska vesiklar och andra synaptiska fraktioner från mushjärnan. Denna metod möjliggör utvärdering av synaptiska processer, inklusive biokemisk analys av proteinlokalisering och funktion med fackupplösning.
Synaptiska terminaler är de primära platserna för neuronal kommunikation. Synaptisk dysfunktion är ett kännetecken för många neuropsykiatriska och neurologiska störningar. Karakteriseringen av synaptiska delfack genom biokemisk isolering är därför en kraftfull metod för att belysa de molekylära baserna för synaptiska processer, både i hälsa och sjukdom. Detta protokoll beskriver isoleringen av synaptiska terminaler och synaptiska underfack från mushjärnor genom subcellulär fraktionering. Först isoleras förseglade synaptiska terminalstrukturer, kända som synaptosomer, efter hjärnvävnadshomogenisering. Synaptosomer är neuronala pre- och postsynaptiska fack med klämda och förseglade membran. Dessa strukturer behåller ett metaboliskt aktivt tillstånd och är värdefulla för att studera synaptisk struktur och funktion. Synaptosomerna utsätts sedan för hypotonisk lys och ultracentrifugering för att erhålla synaptiska underfack berikade för synaptiska vesiklar, synaptisk cytosol och synaptiskt plasmamembran. Fraktionsrenhet bekräftas genom elektronmikroskopi och biokemisk anrikningsanalys för proteiner som är specifika för subsynaptiska fack. Den presenterade metoden är ett enkelt och värdefullt verktyg för att studera synapsens strukturella och funktionella egenskaper och molekylär etiologi hos olika hjärnsjukdomar.
Synapser är de grundläggande beräkningsenheterna i hjärnan genom vilka neuroner kommunicerar och utövar olika och utsökt komplexa funktioner. Synapser är således grundläggande för hjärnans hälsa1; Synaptisk dysfunktion är inblandad som en källa eller ett resultat av många störningar2. Synapser utgörs av pre- och postsynaptiska terminaler, förlängningar av två olika neuroner som är nära apposed och separerade av en synaptisk klyfta som passeras av synaptiska vidhäftningsmolekyler. Information flödar från det pre- till postsynaptiska facket i form av kemiska budbärare som kallas neurotransmittorer1. De molekylära processer som är involverade i neurotransmission är aktiva forskningsområden 3,4,5. Att förstå de patogena processerna inom synaptiska terminaler och synapsernas svar på patologi i andra neuronala underfack är avgörande steg för att ta itu med störningar i hjärnan 1,2. Flera metodologiska framsteg, främst tillämpade på murina modeller, har avancerat denna strävan6. Isoleringen av synaptiska fraktioner genom differentiell centrifugering är en sådan paradigmskiftande metod som har möjliggjort detaljerad utvärdering av synaptiska processer inom hälsa och sjukdom.
Den vuxna mänskliga hjärnan består av 80-90 miljarder neuroner 7,8. Bland murina arter innehåller råtthjärnan cirka ~ 200 miljoner neuroner, medan möss har ~ 70 miljoner 9,10. Varje neuron bildar tusentals specifika synaptiska förbindelser med ett nätverk av mycket polariserade neuroner blandade med gliaceller och tät vaskulatur. I sådan komplex och heterogen vävnad var det en gång otänkbart att isolera och studera synapser som ett oberoende system. På 1960-talet gjorde Victor Whittaker, Catherine Hebb och andra detta möjligt genom att isolera intakta synaptiska terminaler med subcellulär fraktionering11,12,13,14. I ett försök att isolera synaptiska vesiklar (SVs) homogeniserade de hjärnor genom flytande skjuvkraft i iso-osmotisk (0,32 M) sackaros följt av ultracentrifugering. De erhöll avklämda, plasmamembranslutna, intakta nervterminaler eller varicositeter, som de kallade nervändande partiklar (NEPs)11,13. Eftersom synapsens strukturella och funktionella egenskaper bevarades i dessa strukturer kallades NEP senare "synaptosomer" för kongruens med andra subcellulära organeller13,15. Det är värt att notera att arbetet med Eduardo de Robertis och kollegor, som myntade termen "synaptisk vesikel", överlappade med Whittakers och kollegors och bidrog till valideringen av "synaptosom" isolering och karakterisering16,17,18.
Synaptosomer är fysiologiskt aktiva strukturer som innehåller alla cellulära och molekylära egenskaper som krävs för lagring, frisättning och återupptag av neurotransmittorer13,18. Bevarandet av viktiga synaptiska egenskaper in vitro och frihet från icke-synaptiska komponenter bidrar också till nyttan av denna isoleringsmetod. Synaptosomer har bidragit oerhört till förståelsen av de kemiska och fysiologiska egenskaperna hos neurotransmission och används nu för att studera synaptiska molekylära processer och deras förändringar i sjukdom 19,20,21,22,23. Synaptosomer är också det ursprungliga källmaterialet för isolering av synaptiska komponenter såsom SVs, clathrinbelagda vesiklar (CCV), synaptisk cytosol, synaptiskt plasmamembran, synaptiska mitokondrier, synaptiska vidhäftningsmolekyler och andra komponenter av intresse, vilket kan underlätta förståelsen av de molekylära mekanismerna för synaptisk funktion 18,19,20,24,25,26, 27,28. Dessa subsynaptiska komponenter kan erhållas genom osmotisk lys av synaptosomer och sackarosdensitetsgradient ultracentrifugering15,29. Även om den ursprungliga subcellulära fraktioneringsmetoden av Whittakers forskargrupp är känd för att vara effektiv för att isolera kvalitetssynaptosomer och SVs 13,30, förbättrar de senaste optimeringarna renheten hos de subcellulära fraktionerna 22,23,31,32. Den här artikeln innehåller en mycket detaljerad och tillgänglig version av ett klassiskt protokoll för subcellulär fraktionering av murin hjärnvävnad för att isolera synaptosomer, SVs och andra subsynaptiska komponenter.
Alla experiment med möss godkändes av Institutional Animal Care and Use Committee (IACUC) vid Yale University (Protocol 2021-11117) och utfördes i en anläggning ackrediterad av Association for the Assessment and Accreditation of Laboratory Animal Care International (AAALAC). Djurvård och boende följde guiden för vård och användning av laboratoriedjur33 och tillhandahölls av Yale Animal Resource Center (YARC). Djuren hölls i en 12 timmars ljus/mörk cykel med ad libitum tillgång till mat och vatten. Fem till åtta möss eller två till fyra råttor per genotyp eller tillstånd krävs för följande protokoll. Färre råttor är nödvändiga på grund av deras större hjärnvolymer. På samma sätt kan försöksdjurens ålder påverka fraktionsavkastningen. Ytterligare möss kan krävas för åldrar mindre än 2 månader. I annat fall gäller de skisserade förfarandena för både murina arter och friska vuxna djur i alla åldrar. De representativa data som presenterades i denna studie använde vildtypsmöss (C57BL/6J) (ålder = 2 månader; fyra hanar och fyra honor per replikat) erhållna från en kommersiell källa (se materialförteckning).
1. Experimentell förberedelse
OBS: Detta protokoll kräver ~ 11 timmar för att en enda forskare ska kunna slutföra. Det rekommenderas starkt att slutföra bänkinstallationen (figur 1), buffertförberedelse (tabell 1), förkylning av centrifuger och rotorer till 4 °C och insamling och märkning av nödvändiga material och utrustning (se materialförteckning) dagen före protokollutförande, där så är tillämpligt.
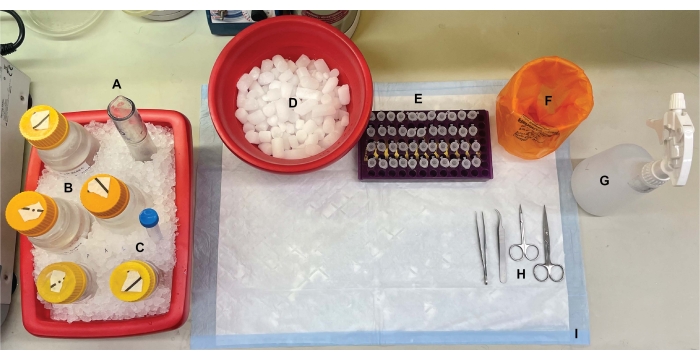
Bild 1: Bänkskivans inställning. Före hjärndissektioner kyldes (A) Dounce glashomogenisatorer och (B) alla buffertar på is. (C) Proteasehämmare stamlösningar tinades på is. En andra behållare med våt is för centrifugrör, en Dewar av flytande kväve (visas inte) och (D) en behållare med torris för kortvarig lagring av proverna flashfrysta i flytande kväve erhölls. (E) Mikrocentrifugrör förmärktes för alla prover, eftersom fyra alikvoter av varje subcellulärt fraktionsprov per genotyp eller tillstånd samlades in under denna procedur (tidsbesparande tips: märk noggrant alla rör dagen innan experimentet utförs). (F) En lämplig behållare för biologiskt riskavfall, (G) 70% etanol, (H) kirurgiska verktyg och (I) en absorberande ytplatta. De nödvändiga centrifugrören och engångsartiklarna avsattes för effektiv åtkomst under protokollimplementering (visas inte). Klicka här för att se en större version av denna siffra.
- Förbered bänkskivan för operation och samla saxen och pincetten som krävs för hjärnexcision (se materialförteckning). Förmärk 1,5 ml mikrocentrifugrör för biopsier med mussvans och fyra rör per uppsamlad fraktion, enligt figur 2.
- Skaffa två behållare med våtis, en behållare med torris och en bänkskiva flytande kväve Dewar-kolv.
- Tina fenylmetylsulfonylfluorid (PMSF), pepstatin A, aprotinin och leupeptin stamlösningar på is (se materialförteckning). Förbered nödvändiga buffertar (tabell 1).
OBS: Sackaroslösningar kan beredas i förväg och förvaras vid 4 °C. Proteashämmare (tinade stamberedningar och tabletter) måste dock tillsättas färska till alla buffertar i början av experimentet på grund av instabiliteten hos dessa reagenser i vattenlösningar. Vidare måste alla buffertar beredas med tvättmedelsfria glasvaror och tvättmedelsfritt vatten för att möjliggöra uppsamling av intakta synaptosomer. - Kyl alla buffertar och glas Dounce homogenisatorer (se Materialförteckning) på is. Ställ in centrifugerna på 4 °C och kyl rotorerna till 4 °C.
- Tillsätt 14 ml buffert A (tabell 1) till en Dounce-homogenisator på is.
Tabell 1: Sammansättning av de subcellulära fraktioneringsbuffertarna. Klicka här för att ladda ner den här tabellen.
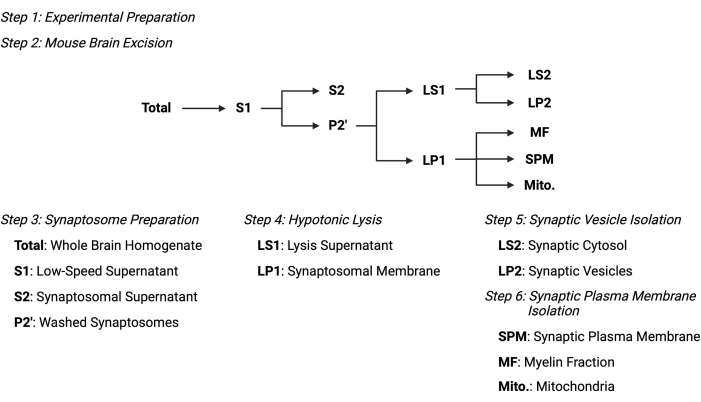
Bild 2: Översikt över det subcellulära fraktioneringsprotokollet. Sammanfattande schematisk över de subcellulära fraktioneringsstegen och insamlade prover. Klicka här för att se en större version av denna siffra.
2. Mushjärna excision
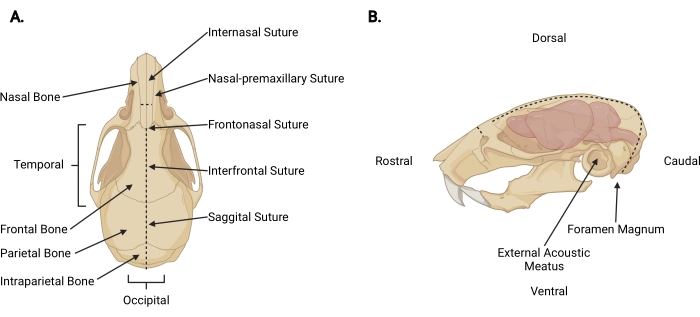
Figur 3: Kraniofacial anatomi . (A) Dorsalvy av en musskalle med relevanta kranialstrukturer angivna. (B) Vänster sidovy av en musskalle och hjärna med relevanta kranialstrukturer och anatomiska riktningar angivna. De streckade linjerna representerar de platser där snitt ska göras. Klicka här för att se en större version av denna siffra.
- Bedöva varje mus djupt med 100% isofluoran i en anestesikammare i en dragskåp eller biosäkerhetsskåp med en öppen droppmetod34. Offra varje mus genom cervikal ryggradsförskjutning följt snabbt av halshuggning. Växla mellan genotyper eller experimentgrupper för varje offer och dissektion12. Få svansbiopsier efter eutanasi genom att excitera 2 mm av den distala svansspetsen med fin sax. Förvara vävnaden för genotypning.
- Spraya det halshuggna huvudet med 70% etanol för att förhindra att håret fäster vid vävnaden och kirurgiska instrument under dissektion.
- Sätt in en fin sax under huden vid halshuggningssnittet till ett perikraniellt djup och gör ett midsagittalt snitt upp till den internasala suturen (figur 3A) för att dra tillbaka hårbotten från skallen.
- Arbeta från det occipitala området mot varje tidsmässig aspekt, trimma fascian och muskeln för att exponera den yttre ytan av skallen bortom varje yttre akustisk meatus (figur 3B).
- Säkra hårbotten och rostral aspekt av skallen med den icke-dominerande handen. Med den andra, sätt in fin sax 2 mm i den kaudala sidan av foramen magnum, där ryggmärgen är synlig utgång. Gör ett snitt i mittlinjen tills saxen når den inre ytan av det intraparietala benet (figur 3; streckade linjer).
OBS: Under det första snittet måste saxen vara parallell med ryggmärgen med tryck applicerat mot den inre ytan av skallen för att förhindra skador på hjärnstammen och lillhjärnan. - Ändra saxens vinkel så att bladen löper parallellt med skallens dorsala yta. Fortsätt att avancera det midsagittala snittet rostralt genom parietal- och frontbenen, med sagittal och interfrontal suturer som vägledning. Använd konstant uppåttryck för att undvika skador på cortex. Avsluta snittet strax bortom den internasala suturen (figur 3A).
- Gör ett litet vinkelrätt snitt (~ 3 mm) mot näsbenet, rostralt mot den internasala suturen, genom att placera saxen vinkelrätt mot skallen med varje blad placerat vid en nasal-premaxillär sutur och göra ett jämnt snitt (figur 3; streckade linjer).
OBS: Detta steg kommer att öka lättheten att dra tillbaka skallen och kommer att vara avgörande för att samla luktlampan om detta område är av intresse. - När du säkrar rostralaspekten, använd ena sidan av ett par texturerade tångar för att försiktigt lyfta upp skallen från hjärnan, sedan i sidled och ventralt. Upprepa längs mittlinjen efter behov, sedan för den andra halvklotet tills hela hjärnytan är exponerad.
- Använd böjda pincett eller en fin spatel och lyft försiktigt hjärnans rostrala sida. Skär de optiska och kraniala nerverna för att slutföra excisionen från skallen.
- För varje tillstånd, samla fem till åtta mushjärnor tillsammans i det kylda glaset Dounce-homogenisator som innehåller 14 ml buffert A (tabell 1).
3. Synaptosomberedning
OBS: Scheman för denna procedur visas i figur 4.
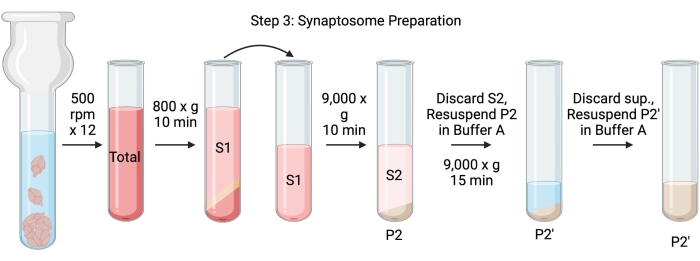
Figur 4: Synaptosomberedning. Schematisk för steg 3, generering av synaptosomer (P2'). Klicka här för att se en större version av denna siffra.
- Homogenisera hjärnorna med ett glas Dounce-homogenisator i 12 upp-ner-pass vid 500 rpm (totalt). Pausa kort vid varje nedslag för att säkerställa grundlig homogenisering av vävnaden. Homogenisera företrädesvis i ett isbad för att undvika uppvärmning och proteindenaturering. Ta 5 μL alikvoter för bestämning av proteinkoncentrationen med bicinchoninsyraanalysen (BCA, se materialförteckning). Ta 100 μl av hela hjärnans lysatalikvoter för western blot (WB). För detta och alla efterföljande prover (figur 2), ta två alikvoter för BCA och två alikvoter för WB. Blixtfrys alla uppsamlade alikvoter i flytande kväve och förvara dem vid −80 °C.
- Snurra det totala hjärnhomogenatet i ett höghastighetscentrifugrör med rund botten (14 ml) (se materialtabell) vid 800 x g i 10 minuter vid 4 °C för att erhålla supernatanten (S1). Överför S1 till ett nytt centrifugrör och lämna pelleten bakom (P1), som innehåller intakta celler och kärnor. Undvik att pipettera upp den fluffiga, vita, lösa, ytliga pelleten. Ta 2 x 5 μL S1 för BCA och 2 x 100 μL S1 för WB.
- Snurra S1 vid 9 000 x g i 15 minuter vid 4 °C för att erhålla synaptosomal supernatant (S2) och rå synaptosompellet (P2). Ta 2 x 10 μL S2 för BCA och 2 x 500 μL S2 för WB. Kassera supernatanten efter att ha fått alikvoter och fortsätt till nästa steg med pelleten.
- Återsuspendera P2 i 3 ml iskall buffert A med proteashämmare och centrifugera vid 9 000 x g i 15 minuter vid 4 °C för att erhålla supernatanten (S2') och tvättade synaptosomer (P2'). Kassera supernatanten och behåll pelleten.
- Återsuspendera P2' i 3 ml buffert A. Undvik att återsuspendera den mörkröda delen i botten av pelleten, som huvudsakligen innehåller mitokondrier. Ta 2 x 20 μL P2' för BCA och 2 x 100 μL P2' för WB.
OBS: Detta kan uppnås genom att försiktigt pipettblanda kanterna och ytan på pelleten för att återsuspendera de vittvättade synaptosomerna medan pipettspetsen riktas bort från pelletens röda mitt.
4. Hypotonisk lys
OBS: Scheman för denna procedur visas i figur 5.
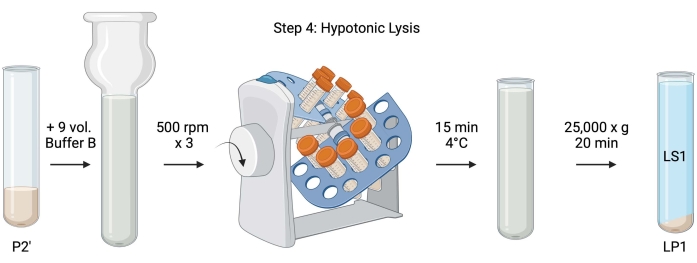
Figur 5: Hypotonisk lys. Schematisk för steg 4, den hypotoniska lysen av synaptosomer för att generera lysis supernatant (LS1) och synaptosomala membranfraktioner (LP1). Klicka här för att se en större version av denna siffra.
- För hypotonisk lys av tvättade synaptosomer, tillsätt 9 volymer kyld buffert B (tabell 1) till återsuspenderad P2 '(~ 27 ml). Homogenisera synaptosomerna i ett glas Dounce-homogenisator (tre upp-ner-pass vid 500 rpm).
- Överför proverna till 50 ml täckta koniska centrifugrör. Rotera dem på en rörrevolver i ett 4 °C kylrum i 15 minuter.
- Centrifuglyserad P2' vid 25 000 x g i 20 minuter vid 4 °C för att erhålla lyssupernatanten (LS1) och lyspelleten innehållande synaptosomala membran (LP1). Ta 2 x 50 μL LS1 för BCA och 2 x 400 μL LS1 för WB. Överför LS1 till ett centrifugrör med tak för ultracentrifugering (se materialförteckning).
5. Synaptisk vesikelisolering
OBS: Scheman för denna procedur visas i figur 6.
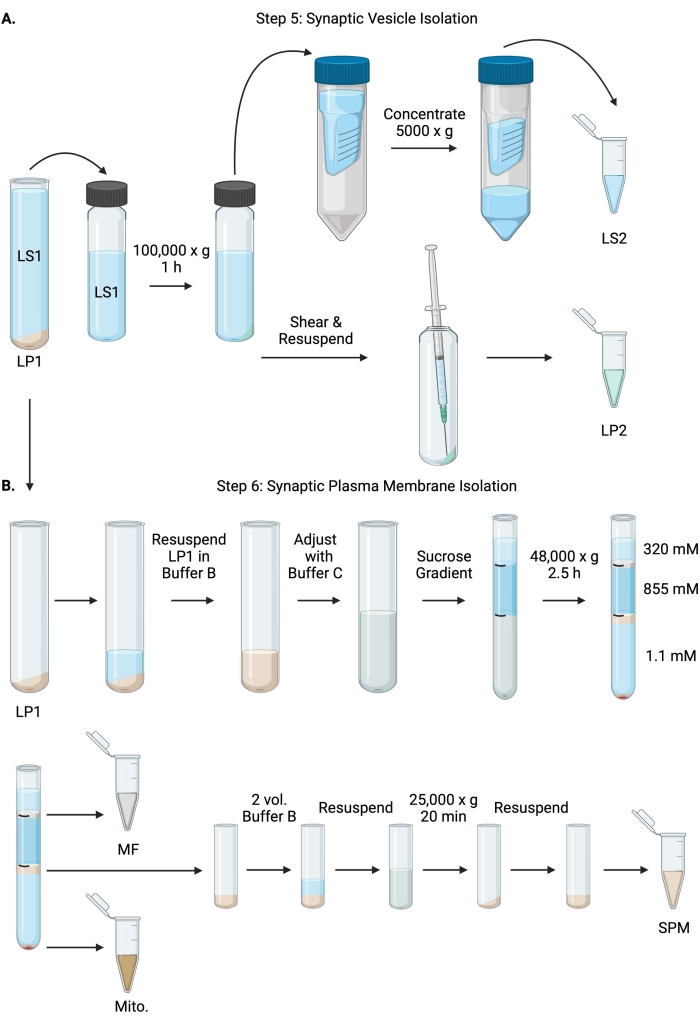
Figur 6: Synaptisk vesikelisolering och synaptisk plasmamembranisolering. (A) Schematisk för steg 5, isolering av synaptiska cytosolfraktioner (LS2) och synaptisk vesikel (LP2) och (B) steg 6, generering av myelin (MF), synaptiskt plasmamembran (SPM) och mitokondriella (Mito.) fraktioner efter ultracentrifugering av sackarosgradienter. Klicka här för att se en större version av denna siffra.
- Centrifugera LS1 i en ultracentrifugrotor med fast vinkel (se materialtabell) vid 100 000 x g i 60 minuter vid 4 °C för att erhålla synaptisk cytosolsupernatant (LS2) och synaptisk vesikelpellet (LP2). LP2 kommer att vara liten, genomskinlig och starkt vidhäftad på sidan av centrifugröret.
- Återsuspendera LP2 i 500 μl buffert A. Skär LP2 med en 23 G nål och en 1 ml spruta med försiktig trituration. Ta 2 x 10 μL LP2 för BCA och 2 x 250 μL LP2 för WB.
- Överför LS2 (~ 30 ml) till centrifugalfilterenheter med en 10 kDa cutoff (se materialtabell).
OBS: Om proteiner mindre än 10 kDa är av intresse finns 4 kDa cutoff centrifugalfilterenheter tillgängliga men kommer att resultera i längre centrifugeringstider. - Koncentrera LS2 till cirka 0,5 ml genom att snurra vid 5000 x g i upp till 1 timme vid 4 °C. Ta 2 x 10 μl koncentrerad LS2 för BCA och 2 x 250 μl koncentrerad LS2 för WB. När du har startat snurret, fortsätt direkt till steg 6.1.
6. Synaptisk plasmamembranisolering
- Återsuspendera LP1 (steg 4.3) i 1 ml buffert B (tabell 1). Ta 2 x 10 μL LP1 för BCA och 2 x 50 μL LP1 för WB. Justera den återstående LP1 till en slutlig volym på 7,5 ml och en slutlig sackaroskoncentration på 1,1 M med buffert B och buffert C (tabell 1).
- Överför 7,5 ml återsuspenderad LP1 till ett 14 ml ultracentrifugrör (se materialförteckning). Överlägg försiktigt LP1 med 3,75 ml buffert D (tabell 1) och lägg sedan över med 1,25 ml buffert A (eller en större volym för att fylla strax under toppen av centrifugröret). Undvik att pipettera ner på sidan av röret, vilket kommer att störa sackarosgradientgränssnitten. Efter överlagring av varje sackarosfraktion, markera toppen av lösningen med en penna. Balansera rören för ultracentrifugering efter vikt, inte volym, med droppvis tillsats av buffert A med en noggrannhet av 10 mg. Centrifugera vid 48 000 x g i 2,5 timmar vid 4 °C i en svängande skopa ultracentrifugrotor (se Materialförteckning).
- Skaffa bilder av de intakta gradienterna efter ultracentrifugering för att dokumentera distinktionen hos varje sackarosgränssnitt och framgången med fraktionering.
- Ta försiktigt bort det ytliga skiktet på 320 mM sackaros (buffert A). Återvinn myelinfraktionen (MF) vid sackarosgränssnittet 320 mM/855 mM i en volym på 800 μl. Återvinn den synaptiska plasmamembranfraktionen (SPM) vid sackarosgränssnittet på 855 mM/1,1 M i en volym på 1 000 μl. Pipettera upp varje fraktion från rörets vägg på ett cirkulärt sätt för att säkerställa att hela fraktionen samlas upp. Sug försiktigt bort den återstående sackarosen och återvinn mitokondriell pellet (Mito.) genom att återsuspendera i 200 μL buffert B. Ta 2 x 100 μL MF för BCA och 2 x 10 μL Mito. för BCA; dela resten av MF och Mito. prover i hälften för WB.
- Späd SPM-fraktionen med 2 volymer buffert B (~2 ml) och centrifugera sedan i en rotor med fast vinkel i ett 3,5 ml centrifugrör (se materialtabell) vid 25 000 x g i 20 minuter vid 4 °C. Kassera supernatanten och återsuspendera SPM-pelleten i buffert A för en slutlig volym på 250 μl. Ta 2 x 5 μL SPM för BCA och dela den återstående SPM i hälften för WB.
- Utför en BCA för att bestämma proteinkoncentrationen för varje prov, med hänsyn till variabel alikvotvolym.
OBS: För WB-analys är den föreslagna arbetsproteinkoncentrationen för alla subcellulära fraktioner 2 μg / μL (eller så hög som möjligt för LS1 och MF).
Den presenterade metoden resulterar i 11 subcellulära fraktioner i hjärnan som kan utsättas för ytterligare rening och olika former av nedströmsanalys35,36. Guldstandardmetoden för att bedöma kvaliteten på synaptosomer, SVs23 och andra komponenter är elektronmikroskopi (EM) (Figur 7). Kvantitativ immunoblotting för proteiner som finns i specifika subcellulära fraktioner kan också utföras för att bedöma markörer för fraktionsrenhet (figur 8). Till exempel avslöjar immunoblotanalys av fraktioner anrikningen av N-kadherin (CDH2, UniProt-namn) i den synaptiska plasmamembranfraktionen (SPM), α-synuklein (SYUA) i den synaptiska cytosolen (LS2), synaptofysin (SYPH) i den synaptiska vesikelfraktionen (LP2) och myelinbasiskt protein (MBP) i myelinfraktionen (MF) jämfört med proteinnivåer i det ursprungliga hela hjärnhomogenatet (totalt) (Figur 8 ). När fraktionsrenhet har fastställts (notera till exempel frånvaron av CDH2 i LS2-fraktionen eller den flerfaldiga ökningen av SYPH i LP2-fraktionen) kan kvantitativ immunoblotting användas för att bestämma lokaliseringen av proteiner av intresse eller frågeskillnader i proteinfördelning mellan genotyper eller behandlingar. Att förstå den subcellulära lokaliseringen av synaptiska proteiner kan möjliggöra dissektion av tidigare obeskrivna proteinfunktioner. Vidare kan denna metod belysa handelsfel eller synaptisk dysfunktion i sjukdomstillstånd, särskilt när den paras ihop med funktionella analyser. Till exempel har vårt team använt denna metod för att identifiera en pool av enzymatiskt aktivt palmitoylproteintioesteras 1 som är berikat i den synaptiska cytosolen19.
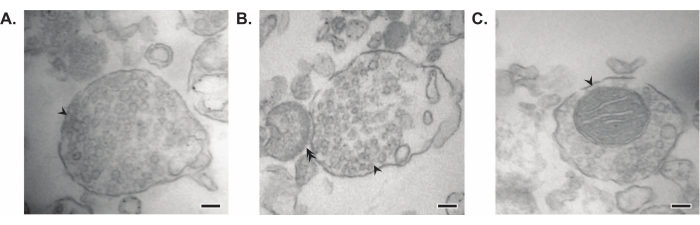
Figur 7: Elektronmikroskopi (EM) av synaptosomer. (A) Representativ EM-bild av en synaptosom som innehåller synaptiska vesiklar (pil). (B) Representativ EM-bild av en synaptosom med både pre- (pil) och postsynaptiska komponenter (dubbelpil). (C) Representativ EM-bild av en synaptosom som innehåller synaptiska vesiklar och en mitokondrion (pil) (skalstänger = 100 nm). Klicka här för att se en större version av denna siffra.
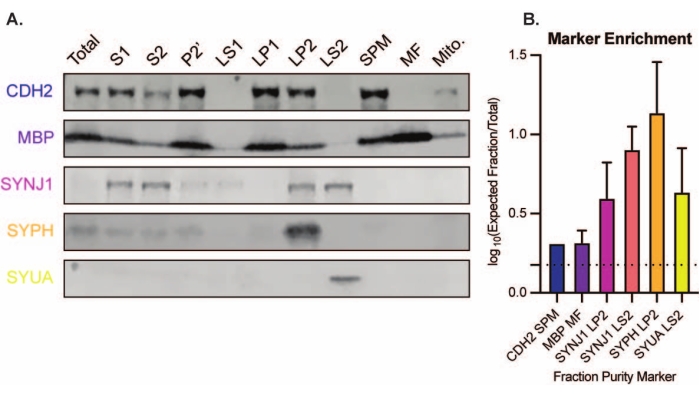
Figur 8: Immunoblotanalys av subcellulära fraktioner. (A) Markörer för subcellulär fraktionsrenhet (indikerad med UniProt-nomenklatur) är lämpligt lokaliserade jämfört med hela hjärnhomogenatet (totalt): N-kadherin (CDH2) i den synaptiska plasmamembranfraktionen (SPM), synaptofysin 1 (SYPH) och synaptojanin 1 (SYNJ1) i den synaptiska vesikelberikade fraktionen (LP2), α-synuklein (SYUA) i den synaptiska cytosolen (LS2), och myelinbasiskt protein (MBP) i myelinfraktionen (MF). (B) Immunoblotkvantifieringsanalys visar anrikningen (vikförändring från total) av fraktionsrenhetsmarkörer. Data representeras som medelvärde ± standardavvikelse på en log10-skala. Den streckade linjen indikerar en 1,5-faldig förändring (y = 0,176) (n = 3 replikera experiment med 8 vildtypsmöss; ålder = 2 månader; n = 4-5 blottar för SYPH, SYUA, MBP, med n = 3 plottade värden som tidigare publicerats av Gorenberg et al.19; n = 5 för SYNJ1; n = 1 för CDH2). Klicka här för att se en större version av denna siffra.
I sina banbrytande studier använde Whittaker och kollegor fyra morfologiska kriterier för att identifiera synaptosomer: (1) strukturerna har ett förseglat plasmamembran; (2) strukturerna innehåller SVs som liknar dem i nervterminaler och varicosities in situ i storlek och antal; (3) strukturerna har en eller flera små mitokondrier; och (4) det presynaptiska membranet ofta fästs vid en postsynaptisk komponent11,12,13. Även om de två första kriterierna i allmänhet gäller för varje isoleringsmetod, i de senaste protokollen som beskrivs i den här artikeln, kommer inte alla resulterande synaptosomer att ha mitokondrier och bifogade postsynaptiska terminaler. Cirka 60% av synaptosomerna kommer att ha mitokondrier, och endast upp till 15% beräknas ha bifogade postsynaptiska terminaler37. Om postsynaptiska komponenter är av särskilt intresse är användningen av en isotonisk Krebs-liknande homogeniseringsbuffert och tryckfiltrering för anrikning kända för att ge höga koncentrationer av synaptosomer med postsynaptiska terminaler (även kallade synaptoneurosomer)22,38.
Metoden att offra djuret kan påverka kvaliteten på synaptosomer och synaptiska delfraktioner. Vuxna djur som offras med en eutanasimetod som inte kräver anestesi kommer att resultera i bästa fraktionskvalitet. Vidare bör hjärnorna nyligen dissekeras, inte frysas och homogeniseras med hjälp av ett homogeniseringsbuffert på 1:10 (vikt / volym) för de mest livskraftiga synaptiska fraktionerna22. Hjärnan har en heterogen population av synapser som kan differentieras av vilken typ av neurotransmittorer de bär. Synaptosombildning påverkas i allmänhet inte av synapstyp eller neurotransmittorinnehåll13. Ett undantag är mossiga fibrer i lillhjärnan, som är kända för att störas under optimala förhållanden för att erhålla synaptosomer från resten av hjärnan39,40. Således rekommenderas avlägsnande av cerebellum före hjärnhomogenisering om uteslutningen av denna region inte påverkar det experimentella målet. Om du är intresserad av att isolera synaptosomer av en viss neurotransmittorkaraktär, kan områden i hjärnan som är berikade för neuroner som innehåller neurotransmittorn av intresse först isoleras. Detta tillvägagångssätt kommer emellertid att medföra begränsningar för det slutliga fraktionsutbytet, beroende på storleken på intresseområdet (djurens ålder är därför också en övervägande). Det finns immunokemiska metoder för isolering av neurotransmittorspecifika synaptosomer, men livskraften och utbytet kommer att äventyras avsevärt22. Om det är viktigt att bedöma synaptosomens metaboliska livskraft kan mätningen av neurotransmittorfrisättning 41,42 eller vissa enzymatiska analyser43 användas.
Vanliga föroreningar i synaptosompreparat inkluderar mikrosomer, fria mitokondrier, SVs och neuronala och glialmembran. Kontaminering kan minskas genom att öka antalet tvättar vid P1- och P2-fraktionerna22 och undvika återsuspension av den röda mitokondriella pelleten i efterföljande steg. I experiment där metabolisk livskraft och tid är avgörande kommer det att vara till hjälpatt minska antalet tvättar och använda Ficoll- eller Percoll-gradienter över sackarosgradienter 44,45,46. Dessa metoder minskar också kontamineringen avsevärt. Whittakers ursprungliga protokoll gav högkvalitativa SVs. Ytterligare optimering av Nagy et al.23, som ingår i denna metod, producerar SVs med anmärkningsvärd homogenitet och renhet utan att kompromissa avsevärt med avkastning36. Om specifika SV-subtyper är av intresse, såsom glutamaterga (VGLUT-1-innehållande) eller GABAerga (VGAT-1-innehållande) SVs, kan immunisolering med specifika antikroppar utföras47,48. Alternativa metoder finns också tillgängliga för att isolera CCV från synaptosomer, som på grund av differentiell densitet kanske inte finns i samma gränssnitt som SV erhållna med denna metod20,49,50.
Sammantaget kan det nuvarande protokollet för att isolera synaptiska komponenter optimeras ytterligare för att erhålla fraktioner med förbättrad homogenitet och livskraft baserat på kvaliteten och kvantiteten av källhjärnvävnaden och de experimentella målen. För ytterligare felsökningsdetaljer bör man hänvisa till bokkapitel av Dunkley och Robinson22 och Ganzella et al.36.
Författarna har inget att avslöja.
Vi vill tacka P. Colosi för EM-bildförberedelser. Detta arbete stöddes av National Institutes of Health (R01 NS064963, SSC; R01 NS110354, SSC; R01 NS083846, SSC; R21 NS094971, SSC; T32 NS007224, SMT; T32 NS041228, SMT), Förenta staternas försvarsdepartement (W81XWH-17-1-0564, SSC; W81XWH-19-1-0264, VDJ), Aligning Science Across Parkinson's (ASAP) Collaborative Research Network (SSC) och Michael J. Fox Foundation Target Advancement Program (MJFF-020160, SSC & VDJ). Vi skapade grafiska illustrationer med BioRender.com.
| Name | Company | Catalog Number | Comments |
| 1 mL TB Syringe | BD | 309649 | |
| 1.5 mL Eppendorf Tubes | USA Scientific | 1415-2500 | |
| 14 mL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter | 344060 | Compatible with SW 40 Ti |
| 23 Gauge Precision Glide Hypodermic Needle | BD | 305145 | |
| 26.3 mL, Polycarbonate Bottle with Cap Assembly | Beckman Coulter | 355618 | Compatible with Ti70 |
| 3.5 mL, Open-Top Thickwall Polypropylene Tube | Beckman Coulter | 349623 | Compatible with TLA-100.3 |
| 50 mL Falcon Tubes | Fisher Scientific | 14-432-22 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901024 | |
| Aprotinin | Sigma-Aldrich | A6279 | 1 mg/mL in diH2O |
| Avanti J-26 XP Centrifuge | Beckman Coulter | B22984 | <26,000 rpm |
| Benchtop HDPE Dewar Flask | Thermo Scientific | 5028U19 | |
| C57BL/6J Mice | The Jackson Labs | 000664 | |
| Centrifuge 5810R | Eppendorf | EP022628168 | <14,000 rpm |
| complete, Mini, EDTA-free Protease Inhibitor Cocktail Tablets | Roche | 11873580001 | Add 1 tablet per 50 mL of solution |
| Curved Forceps | Fine Science Tools | 11273-20 | |
| Fine Surgical Scissors | Fine Science Tools | 8r | |
| Glas-Col Tissue Homogenizing System | Cole-Parmer | UX-04369-15 | |
| Graefe Forceps | Fine Science Tools | 11650-10 | |
| High-Speed Polycarbonate Round Bottom Centrifuge Tubes | ThermoFisher | 3117-0500 | Compatible with JA20 |
| Isofluorane | Henry Schein Animal Health | NDC 11695-6776-2 | |
| JA-20 Rotor | Beckman Coulter | 334831 | |
| Leupeptin | American Bio | AB01108 | 1 mg/mL in diH2O |
| N-[2-Hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid] (HEPES) | American Bio | AB00892 | |
| Optima L-80 XP Ultracentrifuge | Beckman Coulter | <100,000 rpm | |
| Optima TLX Ultracentrifuge | Beckman Coulter | <120,000 rpm | |
| Pepstatin A | Thermo Scientific | 78436 | 1 mg/mL in DMSO |
| Phenylmethylsulfonyl fluoride (PMSF) | American Bio | AB01620 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23335 | For determination of protein concentration |
| Pipette Tips | |||
| Serological Pipettes | |||
| Sucrose | Sigma-Aldrich | S0389 | |
| Surgical Scissors | Fine Science Tools | 14002-12 | |
| SW 40 Ti Swinging-Bucket Rotor | Beckman Coulter | 331301 | |
| Teflon-Coated Pestle and Mortar Tissue Grinder | Thomas Scientific | 3431D94 | |
| Ti70 Rotor | Beckman Coulter | 337922 | |
| TLA-100.3 Rotor | Beckman Coulter | 349490 | |
| Tube Revolver | Dot Scientific | DTR-02VS |
- Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J., Education, A. J. Synaptic Transmission. Principles of Neural Science, Fifth Edition. , (2014).
- Lepeta, K., et al. Synaptopathies: synaptic dysfunction in neurological disorders - A review from students to students. Journal of Neurochemistry. 138 (6), 785-805 (2016).
- Südhof, T. C., Malenka, R. C. Understanding synapses: Past, present, and future. Neuron. 60 (3), 469-476 (2008).
- Südhof, T. C. The molecular machinery of neurotransmitter release (Nobel lecture). Angewandte Chemie International Edition. 53 (47), 12696-12717 (2014).
- Jahn, R., Boyken, J., Pfaff, D. W. Molecular Regulation of Synaptic Release. Neuroscience in the 21st Century: From Basic to Clinical. , 351-401 (2013).
- Xiong, H., Gendelman, H. E. . Current Laboratory Methods in Neuroscience Research. , (2014).
- Azevedo, F. A., et al. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology. 513 (5), 532-541 (2009).
- Herculano-Houzel, S. The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost. Proceedings of the National Academy of Sciences of the United States of America. 109, 10661-10668 (2012).
- Herculano-Houzel, S., Lent, R. Isotropic fractionator: A simple, rapid method for the quantification of total cell and neuron numbers in the brain. Journal of Neuroscience. 25 (10), 2518-2521 (2005).
- Herculano-Houzel, S., Mota, B., Lent, R. Cellular scaling rules for rodent brains. Proceedings of the National Academy of Sciences of the United States of America. 103 (32), 12138-12143 (2006).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron-microscopic study of cell fragments derived by homogenization and centrifugation. Journal of Anatomy. 96, 79-88 (1962).
- Gray, E. G., Whittaker, V. P. The isolation of synaptic vesicles from the central nervous system. Journal of Physiology. 153, 35-37 (1960).
- Whittaker, V. P. Thirty years of synaptosome research. Journal of Neurocytology. 22 (9), 735-742 (1993).
- Jahn, R., Fasshauer, D. Molecular machines governing exocytosis of synaptic vesicles. Nature. 490, 201-207 (2012).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from nerve-ending particles ('synaptosomes). Biochemical Journal. 90 (2), 293-303 (1964).
- De Robertis, E., Rodriguez De Lores Arnaiz, G., Pellegrino De Iraldi, A. Isolation of synaptic vesicles from nerve endings of the rat brain. Nature. 194, 794-795 (1962).
- De Robertis, E., Pellegrino De Iraldi, A., Rodriguez, G., Gomez, C. J. On the isolation of nerve endings and synaptic vesicles. The Journal of Biophysical and Biochemical Cytology. 9 (1), 229-235 (1961).
- Zimmermann, H., Whittaker, V. P., Murphy, K. M. The Discovery of the Synaptosome and Its Implications. Synaptosomes. , 9-26 (2018).
- Gorenberg, E. L., et al. Identification of substrates of palmitoyl protein thioesterase 1 highlights roles of depalmitoylation in disulfide bond formation and synaptic function. PLoS Biology. 20 (3), 3001590 (2022).
- Vidyadhara, D. J., et al. Dopamine transporter and synaptic vesicle sorting defects initiate auxilin-linked Parkinson's disease. bioRxiv. , (2022).
- Schrimpf, S. P., et al. Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry. Proteomics. 5 (10), 2531-2541 (2005).
- Dunkley, P. R., Robinson, P. J., Murphy, K. M. Synaptosome Preparations: Which Procedure Should I Use. Synaptosomes. , 27-53 (2018).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Research. 109 (2), 285-309 (1976).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127 (4), 831-846 (2006).
- Wagner, J. A., Kelly, R. B. Topological organization of proteins in an intracellular secretory organelle: the synaptic vesicle. Proceedings of the National Academy of Sciences of the United States of America. 76 (8), 4126-4130 (1979).
- Jahn, R., Schiebler, W., Ouimet, C., Greengard, P. A 38,000-dalton membrane protein (p38) present in synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 82 (12), 4137-4141 (1985).
- Binotti, B., Jahn, R., Pérez-Lara, &. #. 1. 9. 3. ;. An overview of the synaptic vesicle lipid composition. Archives of Biochemistry and Biophysics. 709, 108966 (2021).
- Siegel, D. P., Ware, B. R. Electrokinetic properties of synaptic vesicles and synaptosomal membranes. Biophysical Journal. 30 (1), 159-172 (1980).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from disrupted nervending particles. Biochemical Pharmacology. 12 (3), 300-302 (1963).
- Clementi, F., Whittaker, V. P., Sheridan, M. N. The yield of synaptosomes from the cerebral cortex of guinea pigs estimated by a polystyrene bead "tagging" procedure. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 72, 126-138 (1966).
- Carlson, S. S., Wagner, J. A., Kelly, R. B. Purification of synaptic vesicles from elasmobranch electric organ and the use of biophysical criteria to demonstrate purity. Biochemistry. 17 (7), 1188-1199 (1978).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. Journal of Cell Biology. 96 (5), 1374-1388 (1983).
- Hawkins, P., et al. A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Laboratory Animals. 45 (1), 1-13 (2011).
- Risling, T. E., Caulkett, N. A., Florence, D. Open-drop anesthesia for small laboratory animals. Canadian Veterinary Journal. 53 (3), 299-302 (2012).
- Deutsch, C., Drown, C., Rafalowska, U., Silver, I. A. Synaptosomes from rat brain: Morphology, compartmentation, and transmembrane pH and electrical gradients. Journal of Neurochemistry. 36 (6), 2063-2072 (1981).
- Ganzella, M., Ninov, M., Riedel, D., Jahn, R. Isolation of synaptic vesicles from mammalian brain. Methods in Molecular Biology. 2417, 131-145 (2022).
- Dunkley, P. R., et al. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: homogeneity and morphology of subcellular fractions. Brain Research. 441 (1-2), 59-71 (1988).
- Schwartz, R. D., Skolnick, P., Hollingsworth, E. B., Paul, S. M. Barbiturate and picrotoxin-sensitive chloride efflux in rat cerebral cortical synaptoneurosomes. FEBS Letters. 175 (1), 193-196 (1984).
- Pittaluga, A., Thellung, S., Maura, G., Raiteri, M. Characterization of two central AMPA-preferring receptors having distinct location, function and pharmacology. Naunyn-Schmiedeberg's Archives of Pharmacology. 349 (6), 555-558 (1994).
- Israël, M., Whittaker, V. P. The isolation of mossy fibre endings from the granular layer of the cerebellar cortex. Experientia. 21 (6), 325-326 (1965).
- Khvotchev, M., Lonart, G., Südhof, T. C. Role of calcium in neurotransmitter release evoked by alpha-latrotoxin or hypertonic sucrose. Neuroscience. 101 (3), 793-802 (2000).
- Lonart, G., Janz, R., Johnson, K. M., Südhof, T. C. Mechanism of action of rab3A in mossy fiber LTP. Neuron. 21 (5), 1141-1150 (1998).
- Nicholls, D. G., Sihra, T. S. Synaptosomes possess an exocytotic pool of glutamate. Nature. 321 (6072), 772-773 (1986).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nature Protocols. 3 (11), 1718-1728 (2008).
- Cotman, C. W., Matthews, D. A. Synaptic plasma membranes from rat brain synaptosomes: Isolation and partial characterization. Biochimica et Biophysica Acta. 249 (2), 380-394 (1971).
- Booth, R. F., Clark, J. B. A rapid method for the preparation of relatively pure metabolically competent synaptosomes from rat brain. Biochemical Journal. 176 (2), 365-370 (1978).
- Takamori, S., Riedel, D., Jahn, R. Immunoisolation of GABA-specific synaptic vesicles defines a functionally distinct subset of synaptic vesicles. Journal of Neuroscience. 20 (3), 4904-4911 (2000).
- Burger, P. M., et al. Synaptic vesicles immunoisolated from rat cerebral cortex contain high levels of glutamate. Neuron. 3 (6), 715-720 (1989).
- Blondeau, F., et al. Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling. Proceedings of the National Academy of Sciences of the United States of America. 101 (11), 3833-3838 (2004).
- Maycox, P. R., Link, E., Reetz, A., Morris, S. A., Jahn, R. Clathrin-coated vesicles in nervous tissue are involved primarily in synaptic vesicle recycling. Journal of Cell Biology. 118 (6), 1379-1388 (1992).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved