Summary
Abstract
Introduction
Protocol
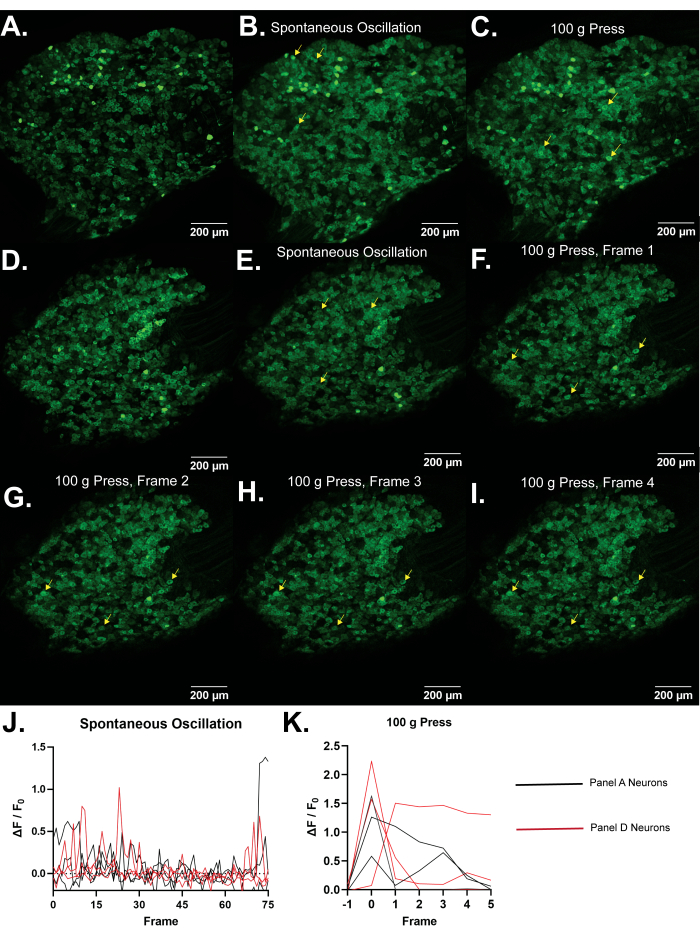
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
ב Vivo הדמיית סידן של הרכבים עצביים ברשתות של נוירונים חושיים ראשוניים בגרעיני שורש גבי שלמים
פרוטוקול זה מתאר את החשיפה הכירורגית של גנגליון השורש הגבי (DRG) ואחריו GCaMP3 (אינדיקטור Ca2+ מקודד גנטית; חלבון פלואורסצנטי ירוק-קלמודולין-M13 חלבון 3) Ca2+ הדמיה של הרכבים עצביים באמצעות עכברי Pirt-GCaMP3 תוך הפעלת מגוון גירויים על הכף האחורית ipsilateral.
הדמיית Ca 2+ יכולה לשמש כפרוקסי לפעילות תאית, כולל פוטנציאלי פעולה ומנגנוני איתות שונים הכוללים כניסה של Ca 2+ לציטופלסמה או שחרור מאגרי Ca 2+ תוך תאיים. הדמיית Ca2+ מבוססת Pirt-GCaMP3 של נוירונים חושיים ראשוניים של גנגליון השורש הגבי (DRG) בעכברים מציעה את היתרון של מדידה בו זמנית של מספר רב של תאים. ניתן לנטר עד 1,800 תאי עצב, מה שמאפשר לרשתות עצביות ולתהליכים סומטוסנסוריים להיחקר כמכלול בהקשר הפיזיולוגי הרגיל שלהם ברמת האוכלוסייה in vivo. המספר הגדול של תאי עצב המנוטרים מאפשר זיהוי של דפוסי פעילות שיהיה מאתגר לזהות באמצעות שיטות אחרות. גירויים יכולים להיות מיושמים על כף העכבר האחורית, המאפשר את ההשפעות הישירות של גירויים על הרכב נוירונים DRG להילמד. מספר תאי העצב המייצרים Ca 2+ transients כמו גם המשרעת של Ca2+ transients מצביע על רגישות לאופני חוש ספציפיים. קוטר תאי העצב מספק עדות לסוגי סיבים פעילים (מכנו לא מזיק לעומת סיבי כאב מזיקים, סיבי Aβ, Aδ ו-C). נוירונים המבטאים קולטנים ספציפיים יכולים להיות מסומנים גנטית עם td-Tomato ורקומבינזות Cre ספציפיות יחד עם Pirt-GCaMP. לכן, הדמיית Pirt-GCaMP3 Ca2+ של DRG מספקת כלי רב עוצמה ומודל לניתוח של אופני חישה ספציפיים ותת-סוגים של נוירונים הפועלים כאנסמבל ברמת האוכלוסייה לחקר כאב, גירוד, מגע ואותות סומטוסנסורים אחרים.
נוירונים חושיים ראשוניים מעצבבים ישירות את העור ונושאים מידע סומטוסנסורי חזרה למערכת העצבים המרכזית 1,2. גרעיני שורש דורסלי (DRGs) הם צבירי גוף תאים של 10,000-15,000 נוירונים חושיים ראשוניים 3,4. נוירוני DRG מציגים גדלים שונים, רמות מיאלינציה ודפוסי ביטוי גנים וקולטנים. נוירונים בקוטר קטן יותר כוללים נוירונים קולטי כאב ותאי עצב בקוטר גדול יותר מגיבים בדרך כלל לגירויים מכניים לא כואבים 5,6. הפרעות בנוירונים החושיים הראשוניים כגון פציעה, דלקת כרונית ונוירופתיות היקפיות יכולות לגרום לרגישות נוירונ....
כל ההליכים המתוארים כאן בוצעו בהתאם לפרוטוקול שאושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של המרכז למדעי הבריאות של אוניברסיטת טקסס בסן אנטוניו.
הערה: לאחר תחילת הניתוח, יש להשלים ניתוח בעלי חיים (שלב 1) והדמיה (שלב 2) באופן רציף. ניתוח נתונים (שלב 3) עשוי להתבצע מאוחר ?.......
כאב מתמשך קיים במגוון רחב של הפרעות, מתיש ו / או מוריד את איכות החיים של כ -8% מהאנשים29. נוירונים חושיים ראשוניים מזהים גירויים מזיקים על העור, והפלסטיות שלהם תורמת לכאב מתמשך8. בעוד שניתן לחקור תאי עצב בתרביות תאים ובצמחים, פעולה זו מוציאה אותם מההקשר הפיזיולוגי הרג.......
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233 (2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083 (2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651 (2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990 (2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846 (2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450 (2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171 (2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225 (2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810 (2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351 (2017).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved