Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
In vivo Kalsiumavbildning av nevronale ensembler i nettverk av primære sensoriske nevroner i intakte dorsale rotganglier
Denne protokollen beskriver kirurgisk eksponering av dorsalrotganglion (DRG) etterfulgt av GCaMP3 (genetisk kodet Ca2+ indikator; Grønt fluorescerende protein-Calmodulin-M13 Protein 3) Ca2+ avbildning av nevronensemblene ved bruk av Pirt-GCaMP3-mus mens du bruker en rekke stimuli til den ipsilaterale bakpoten.
Ca 2+-avbildning kan brukes som proxy for cellulær aktivitet, inkludert aksjonspotensialer og forskjellige signalmekanismer som involverer Ca 2+ inngang i cytoplasma eller frigjøring av intracellulære Ca 2+ lagre. Pirt-GCaMP3-basert Ca2+-avbildning av primære sensoriske nevroner i dorsalrotganglion (DRG) hos mus gir fordelen av samtidig måling av et stort antall celler. Opptil 1,800 nevroner kan overvåkes, slik at nevrale nettverk og somatosensoriske prosesser kan studeres som et ensemble i sin normale fysiologiske kontekst på populasjonsnivå in vivo. Det store antallet nevroner som overvåkes, gjør det mulig å oppdage aktivitetsmønstre som ville være utfordrende å oppdage ved hjelp av andre metoder. Stimuli kan brukes på musens bakpote, slik at de direkte effektene av stimuli på DRG-nevronensemblet kan studeres. Antall nevroner som produserer Ca 2+ transienter samt amplituden til Ca2+ transienter indikerer følsomhet for spesifikke sensoriske modaliteter. Diameteren av nevroner gir bevis på aktiverte fibertyper (ikke-skadelig mekano vs. skadelige smertefibre, Aβ, Aδ og C-fibre). Nevroner som uttrykker spesifikke reseptorer kan genetisk merkes med td-tomat og spesifikke Cre-rekombinaser sammen med Pirt-GCaMP. Derfor gir Pirt-GCaMP3 Ca2+ avbildning av DRG et kraftig verktøy og modell for analyse av spesifikke sensoriske modaliteter og nevronsubtyper som fungerer som et ensemble på populasjonsnivå for å studere smerte, kløe, berøring og andre somatosensoriske signaler.
Primære sensoriske nevroner innerverer huden direkte og bærer somatosensorisk informasjon tilbake til sentralnervesystemet 1,2. Dorsal rotganglier (DRG) er cellekroppsklynger av 10.000-15.000 primære sensoriske nevroner 3,4. DRG-nevroner presenterer forskjellig størrelse, myeliniseringsnivåer og gen- og reseptoruttrykksmønstre. Nevroner med mindre diameter inkluderer smertefølende nevroner og nevroner med større diameter reagerer vanligvis på ikke-smertefulle mekaniske stimuli 5,6. Forstyrrelse....
Alle prosedyrer beskrevet her ble utført i samsvar med en protokoll godkjent av Institutional Animal Care and Use Committee ved University of Texas Health Science Center i San Antonio.
MERK: Ved oppstart må dyrekirurgi (trinn 1) og bildediagnostikk (trinn 2) fullføres fortløpende. Dataanalyse (trinn 3) kan utføres senere.
1. Kirurgi og sikring av dyret for høyre side L5 DRG-avbildning
MERK: Både mannlige og kvinnelig.......
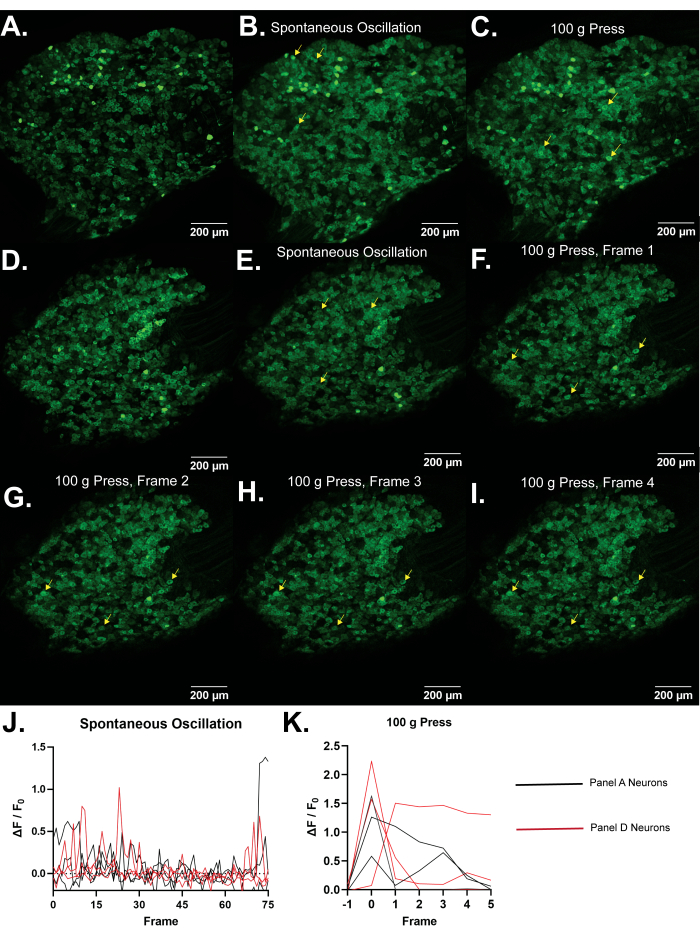
Figur 4: Representative bilder av L5 dorsalrotganglier av Pirt-GCaMP3-mus. (A,D) Enkeltramme høyoppløselige skanninger av L5 dorsale rotganglier av Pirt-GCaMP3-mus er vist. (B,E) . Gjennomsnittlig intensitetsprojeksjoner av 15 bilder Pirt-GCaMP3 L5 DRG ganglier fra henholdsvis panel A og panel D, .......
Vedvarende smerte er tilstede i et bredt spekter av lidelser, svekkende og / eller reduserer livskvaliteten for ca 8% av mennesker29. Primære sensoriske nevroner oppdager skadelige stimuli på huden, og deres plastisitet bidrar til vedvarende smerte8. Mens nevroner kan studeres i cellekultur og eksplanter, fjerner det dem fra sin normale fysiologiske kontekst. Kirurgisk eksponering av DRG, etterfulgt av Pirt-GCaMP3 Ca2+ avbildning, tillater studiet av primære s.......
| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233 (2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083 (2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651 (2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990 (2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846 (2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450 (2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171 (2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225 (2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810 (2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351 (2017).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved