Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Neuroscience
In vivo Imagem com cálcio de conjuntos neuronais em redes de neurônios sensoriais primários em gânglios intactos da raiz dorsal
Este protocolo descreve a exposição cirúrgica do gânglio da raiz dorsal (DRG) seguida de GCaMP3 (indicador Ca2+ codificado geneticamente; Green Fluorescent Protein-Calmodulin-M13 Protein 3) Imagem de Ca2+ dos conjuntos neuronais usando camundongos Pirt-GCaMP3 enquanto se aplica uma variedade de estímulos na pata traseira ipsilateral.
A imagem por Ca 2+ pode ser usada como proxy da atividade celular, incluindo potenciais de ação e vários mecanismos de sinalização envolvendo a entrada de Ca 2+ no citoplasma ou a liberação de depósitos intracelulares de Ca2+. A imagem de Ca2+ baseada em Pirt-GCaMP3 de neurônios sensoriais primários do gânglio da raiz dorsal (DRG) em camundongos oferece a vantagem da medição simultânea de um grande número de células. Até 1.800 neurônios podem ser monitorados, permitindo que redes neuronais e processos somatossensoriais sejam estudados como um conjunto em seu contexto fisiológico normal em nível populacional in vivo. O grande número de neurônios monitorados permite a detecção de padrões de atividade que seriam difíceis de detectar usando outros métodos. Os estímulos podem ser aplicados na pata traseira do camundongo, permitindo que os efeitos diretos dos estímulos no conjunto de neurônios DRG sejam estudados. O número de neurônios produzindo transientes de Ca 2+, bem como a amplitude de transientes de Ca2+, indica sensibilidade a modalidades sensoriais específicas. O diâmetro dos neurônios fornece evidências de tipos de fibras ativadas (fibras mecanas não nocivas vs. fibras dolorosas nocivas, fibras Aβ, Aδ e C). Neurônios que expressam receptores específicos podem ser geneticamente marcados com td-Tomato e recombinases específicas de Cre juntamente com Pirt-GCaMP. Portanto, a imagem Pirt-GCaMP3 Ca2+ de DRG fornece uma poderosa ferramenta e modelo para a análise de modalidades sensoriais específicas e subtipos de neurônios atuando como um conjunto em nível populacional para estudar dor, coceira, toque e outros sinais somatossensoriais.
Os neurônios sensoriais primários inervam diretamente a pele e transportam informações somatossensoriais de volta ao sistema nervoso central 1,2. Gânglios da raiz dorsal (DRGs) são aglomerados de corpos celulares de 10.000-15.000 neurônios sensoriais primários 3,4. Os neurônios DRG apresentam diversos tamanhos, níveis de mielinização e padrões de expressão gênica e receptora. Neurônios de menor diâmetro incluem neurônios sensíveis à dor e neurônios de maior diâmetro tipicamente respondem a estímulos mecânicos não dolorosos ....
Todos os procedimentos aqui descritos foram realizados de acordo com um protocolo aprovado pelo Comitê Institucional de Cuidados e Uso de Animais do Centro de Ciências da Saúde da Universidade do Texas em San Antonio.
NOTA: Uma vez iniciadas, a cirurgia dos animais (etapa 1) e os exames de imagem (etapa 2) devem ser concluídos de forma contínua. A análise dos dados (etapa 3) poderá ser realizada posteriormente.
1. Cirurgia e fixação do animal para ima.......
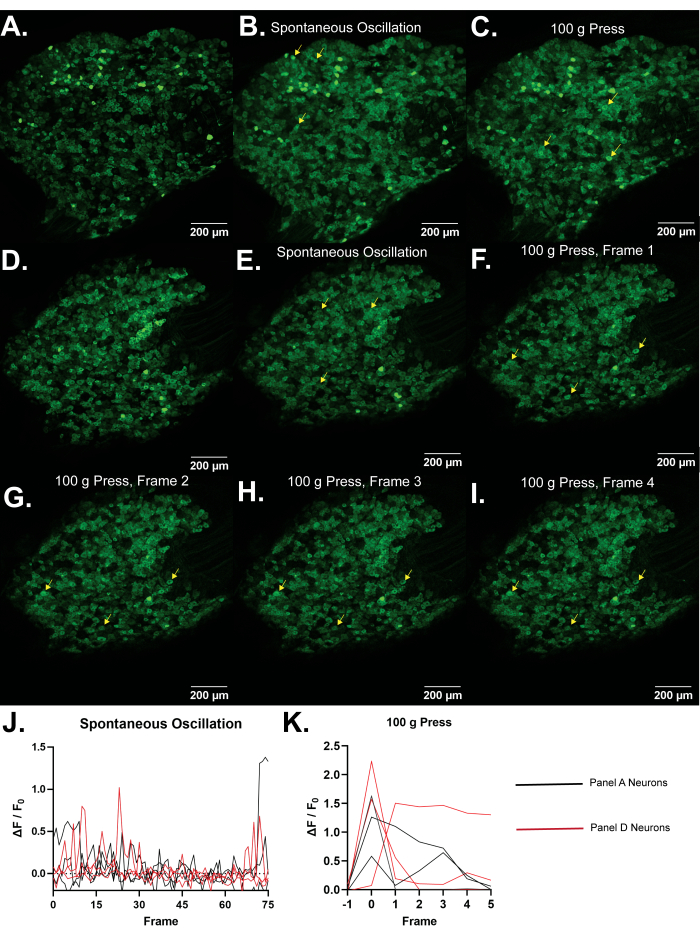
Figura 4: Imagens representativas dos gânglios da raiz dorsal L5 de camundongos Pirt-GCaMP3. (A,D) Imagens de alta resolução de quadro único de gânglios da raiz dorsal L5 de camundongos Pirt-GCaMP3 são mostrados. (B,E) . Projeções de intensidade média de 15 quadros dos gânglios do Pirt-GCa.......
A dor persistente está presente em uma ampla gama de distúrbios, debilitando e/ou reduzindo a qualidade de vida de cerca de 8% das pessoas29. Os neurônios sensoriais primários detectam estímulos nocivos na pele, e sua plasticidade contribui para a dor persistente8. Enquanto os neurônios podem ser estudados em cultura celular e explantes, fazê-lo os remove de seu contexto fisiológico normal. A exposição cirúrgica do DRG, seguida de Pirt-GCaMP3 Ca2+, per.......
Este trabalho foi apoiado pelos National Institutes of Health Grants R01DE026677 e R01DE031477 (para Y.S.K.), UTHSCSA startup fund (Y.S.K.) e um Rising STAR Award da University of Texas system (Y.S.K.).
....| Name | Company | Catalog Number | Comments |
| Anased Injection (Xylazine) | Covetrus, Akorn | 33197 | |
| C Epiplan-Apochromat 10x/0.4 DIC | Cal Zeiss | 422642-9900-000 | |
| Cotton Tipped Applicators | McKesson | 24-106-1S | |
| Curved Hemostat | Fine Science Tools | 13007-12 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Dumont Ceramic Coated Forceps | Fine Science Tools | 11252-50 | |
| FHC DC Temperature Controller | FHC | 40-90-8D | |
| Fluriso (Isoflurane) | MWI Animal Health, Piramal Group | 501017 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16221-14 | |
| GelFoam | Pfizer | 09-0353-01 | |
| Ketaset (Ketamine) | Zoetis | KET-00002R2 | |
| Luminescent Green Stage Tape | JSITON/ Amazon | B803YW8ZWL | |
| Matrx VIP 3000 Isoflurane Vaporizer | Midmark | 91305430 | |
| Micro dissecting scissors | Roboz | RS-5882 | |
| Micro dissecting spring scissors | Fine Science Tools | 15023-10 | |
| Micro dissecting spring scissors | Roboz | RS-5677 | |
| Mini Rectal Thermistor Probe | FHC | 40-90-5D-02 | |
| Operating scissors | Roboz | RS-6812 | |
| Pirt-GCaMP3 C57BL/6J mice | Johns Hopkins University | N/A | Either sex can be imaged equally well. Mice should be at least 8 weeks old due to weak or intermittent Pirt promoter expression in younger mice. |
| SMALGO small animal algometer | Bioseb In vivo Research Instruments | BIO-SMALGO | |
| Stereotaxic frame | Kopf Model 923-B | 923-B | |
| td-Tomato C57BL/6J mice | Jackson Laboratory | 7909 | |
| Top Plate, 6 in x 10 in | Newport | 290-TP | |
| TrpV1-Cre C57BL/6J mice | Jackson Laboratory | 17769 | |
| Zeiss LSM 800 confocal microscope | Cal Zeiss | LSM800 | |
| Zeiss Zen 2.6 Blue Edition Software | Cal Zeiss | Zen (Blue Edition) 2.6 |
- Rivero-Melián, C., Grant, G. Distribution of lumbar dorsal root fibers in the lower thoracic and lumbosacral spinal cord of the rat studied with choleragenoid horseradish peroxidase conjugate. The Journal of Comparative Neurology. 299 (4), 470-481 (1990).
- Wessels, W. J., Marani, E. A rostrocaudal somatotopic organization in the brachial dorsal root ganglia of neonatal rats. Clinical Neurology and Neurosurgery. 95, 3-11 (1993).
- Schmalbruch, H. The number of neurons in dorsal root ganglia L4-L6 of the rat. The Anatomical Record. 219 (3), 315-322 (1987).
- Sørensen, B., Tandrup, T., Koltzenburg, M., Jakobsen, J. No further loss of dorsal root ganglion cells after axotomy in p75 neurotrophin receptor knockout mice. The Journal of Comparative Neurology. 459 (3), 242-250 (2003).
- Basbaum, A. I., Woolf, C. J. Pain. Current Biology. 9 (12), 429-431 (1999).
- Liu, Y., Ma, Q. Generation of somatic sensory neuron diversity and implications on sensory coding. Current Opinion in Neurobiology. 21 (1), 52-60 (2011).
- Basbaum, A. I., Bautista, D. M., Scherrer, G., Julius, D. Cellular and molecular mechanisms of pain. Cell. 139 (2), 267-284 (2009).
- Stucky, C. L., Mikesell, A. R. Cutaneous pain in disorders affecting peripheral nerves. Neuroscience Letters. 765, 136233 (2021).
- Iseppon, F., Linley, J. E., Wood, J. N. Calcium imaging for analgesic drug discovery. Neurobiology of Pain. 11, 100083 (2022).
- Chen, Z., et al. Adjacent intact nociceptive neurons drive the acute outburst of pain following peripheral axotomy. Scientific Reports. 9 (1), 7651 (2019).
- Chisholm, K. I., Khovanov, N., Lopes, D. M., La Russa, F., McMahon, S. B. Large scale in vivo recording of sensory neuron activity with GCaMP6. eNeuro. 5 (1), (2018).
- Emery, E. C., et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Science Advances. 2 (11), 1600990 (2016).
- Ishida, H., et al. In vivo calcium imaging visualizes incision-induced primary afferent sensitization and its amelioration by capsaicin pretreatment. The Journal of Neuroscience. 41 (41), 8494-8507 (2021).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- MacDonald, D. I., et al. Silent cold-sensing neurons contribute to cold allodynia in neuropathic pain. Brain. 144 (6), 1711-1726 (2021).
- Wang, F., et al. Sensory afferents use different coding strategies for heat and cold. Cell Reports. 23 (7), 2001-2013 (2018).
- Kucharczyk, M. W., et al. The impact of bone cancer on the peripheral encoding of mechanical pressure stimuli. Pain. 161 (8), 1894-1905 (2020).
- Kim, A. Y., et al. a phosphoinositide-binding protein, functions as a regulatory subunit of TRPV1. Cell. 133 (3), 475-485 (2008).
- Kim, Y. S., et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron. 81 (4), 873-887 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Mahadevan, A. S., et al. cytoNet: Spatiotemporal network analysis of cell communities. PLoS Computational Biology. 18 (6), 1009846 (2022).
- Barretto, R. P., et al. The neural representation of taste quality at the periphery. Nature. 517 (7534), 373-376 (2015).
- Leijon, S. C. M., et al. Oral thermosensing by murine trigeminal neurons: modulation by capsaicin, menthol and mustard oil. The Journal of Physiology. 597 (7), 2045-2061 (2019).
- Sekiguchi, K. J., et al. Imaging large-scale cellular activity in spinal cord of freely behaving mice. Nature Communications. 7, 11450 (2016).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171 (2015).
- Ran, C., Hoon, M. A., Chen, X. The coding of cutaneous temperature in the spinal cord. Nature Neuroscience. 19 (9), 1201-1209 (2016).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. The Journal of Pain. 7 (4), 281-289 (2006).
- Shannonhouse, J., et al. Meclizine and metabotropic glutamate receptor agonists attenuate severe pain and Ca(2+) activity of primary sensory neurons in chemotherapy-induced peripheral neuropathy. The Journal of Neuroscience. 42 (31), 6020-6037 (2022).
- Luiz, A. P., et al. Cold sensing by Na(V)1.8-positive and Na(V)1.8-negative sensory neurons. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3811-3816 (2019).
- Hartung, J. E., Gold, M. S. GCaMP as an indirect measure of electrical activity in rat trigeminal ganglion neurons. Cell Calcium. 89, 102225 (2020).
- Chung, M. K., Wang, S., Oh, S. L., Kim, Y. S. Acute and chronic pain from facial skin and oral mucosa: Unique neurobiology and challenging treatment. International Journal of Molecular Sciences. 22 (11), 5810 (2021).
- Chan, S. L., Mayne, M., Holden, C. P., Geiger, J. D., Mattson, M. P. Presenilin-1 mutations increase levels of ryanodine receptors and calcium release in PC12 cells and cortical neurons. The Journal of Biological Chemistry. 275 (24), 18195-18200 (2000).
- Sierra, D. A., Popov, S., Wilkie, T. M. Regulators of G-protein signaling in receptor complexes. Trends in Cardiovascular Medicine. 10 (6), 263-268 (2000).
- Yoshihara, K., et al. Astrocytic Ca(2+) responses in the spinal dorsal horn by noxious stimuli to the skin. Journal of Pharmacological Sciences. 137 (1), 101-104 (2018).
- Tan, C. H., McNaughton, P. A. The TRPM2 ion channel is required for sensitivity to warmth. Nature. 536 (7617), 460-463 (2016).
- Akemann, W., Mutoh, H., Perron, A., Rossier, J., Knöpfel, T. Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins. Nature Methods. 7 (8), 643-649 (2010).
- Gong, Y., et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 350 (6266), 1361-1366 (2015).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 7 (5), 399-405 (2010).
- Harada, K., et al. Red fluorescent protein-based cAMP indicator applicable to optogenetics and in vivo imaging. Scientific Reports. 7 (1), 7351 (2017).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved